Gulsah ALBAYRAK1, Ece KONAC1, Umit Akin DERE2, Hakan EMMEZ2
1 Université Gazi, Faculté de médecine, Département de biologie médicale et de génétique, Ankara, Turquie
2 Université Gazi, Faculté de médecine, Département de neurochirurgie, Ankara, Turquie
Correspondance : Ece KONAC ; Courriel : [email protected]
Reçu : 16 janvier 2020
Accepté : 3 juillet 2020
Publié : 29 décembre 2020
Résumé
OBJECTIF : Étudier les effets de la metformine, du dichloroacétate (DCA) et de la mémantine sur les cellules humaines de glioblastome (GBM) T98G et U87-MG afin de cibler le métabolisme des cellules tumorales de manière multidirectionnelle.
MATÉRIEL et MÉTHODES : Les niveaux IC50 de la metformine, du DCA, de la metformine+DCA et de la mémantine ont été déterminés par le test MTT sur les cellules T98G et U87-MG in vitro. Les expressions des protéines Casp3, Bcl-2, Bax, c-Myc et GSK-3B ont été étudiées après les traitements. Quinze tissus tumoraux GBM+ ont été évalués pour les profils d’expression des protéines apoptotiques Casp-3, Bcl-2, Bad, Bax.
RÉSULTATS : Les médicaments ciblant le métabolisme des cellules cancéreuses, la metformine, le DCA, la metformine+DCA et la mémantine, ont induit une cytotoxicité de manière dose-dépendante dans les cellules T98G et U87-MG. L’IC50 de la mémantine est de 0,5 mM (p<0,01), soit une concentration près de 10 fois inférieure à celle de la metformine. Quinze tissus tumoraux GBM+ présentaient des expressions différentielles de protéines apoptotiques.
CONCLUSION : La mémantine a exercé un mécanisme d’action anticancéreux sur les cellules T98G et U87-MG, mais ce mécanisme nécessite une étude plus approfondie pour le traitement des GBM.
Mots clés : Glioblastome, Cellule cancéreuse, Métabolisme, Metformine, Dichloroacetate, Memantine
DOI: 10.5137/1019-5149.JTN.29176-20.3
INTRODUCTION
Le glioblastome (GBM) est l’une des tumeurs les plus agressives du système nerveux central et représente environ 50 % de tous les types de tumeurs gliales [12,27]. Le taux de survie médian des patients atteints de GBM ne change pas signicantly en utilisant les traitements standard actuels, qui impliquent une résection de la tumeur suivie d’une radiothérapie et d’un traitement au Temozolomide. La survie médiane est d’environ 12-14 mois malgré l’utilisation combinée de la chirurgie, de la radiothérapie et de la chimiothérapie [7,23].
Les tumeurs GBM présentent un large éventail de variations génétiques conduisant à dierent réponses thérapeutiques [5,9,21]. L’hétérogénéité intratumorale pourrait être la clé pour identifier la cause de l’échec du traitement [22]. Les médicaments de chimiothérapie tels que le Temozolamide augmentent la charge mutationnelle dans le génome du cancer par rapport aux cellules GBM non traitées [17]. Il est donc urgent de trouver des approches thérapeutiques alternatives pour le traitement des GBM.
La metformine est un médicament antidiabétique couramment utilisé dans le traitement du diabète de type 2 [18]. Le traitement à la metformine est associé à un risque plus faible de plusieurs cancers, mais ses effets sur le GBM n’ont pas été bien caractérisés [4,24]. Le traitement à la metformine diminue la résistance au témozolomide dans les cellules de GBM [26]. Cependant, la metformine pose des problèmes de sécurité en milieu clinique, car la plupart des travaux précliniques ont utilisé des doses supraphysiologiques de metformine [25]. Dans cette étude, nous avons voulu surmonter ce problème en étudiant l’effet de la metformine en l’associant au dichloroacétate (DCA) qui cible le métabolisme des cellules cancéreuses via l’inhibition de la pyruvate déshydrogénase kinase [11]. Le fait de cibler le métabolisme des cellules cancéreuses pourrait avoir des implications dans le traitement des GBM agressifs. En outre, nous avons cherché à étudier les profils d’expression des protéines apoptotiques afin de mieux comprendre le GBM au niveau moléculaire. Nous avons également cherché à interférer avec le métabolisme des cellules cancéreuses en utilisant la metformine, le DCA et la mémantine dans les lignées cellulaires de GBM T98G et U87-MG.
Matériel et méthodes
Culture cellulaire et produits chimiques
Les lignées cellulaires de glioblastome humainT98Get U87-MG ont été fournies par l’ATCC. Les cellules T98G et U87-MG ont été cultivées dans un milieu DMEM/F12 complété par 10% de sérum bovin fœtal (FBS) (Sigma-Aldrich, St Louis, MO, USA). Les cellules ont été cultivées dans un incubateur à 5% deCO2 à 37° C. La metformine, le dichloroacétate et la mémantine ont été fournis par Sigma-Aldrich, St Louis, MO, USA. Les cellules ont été traitées avec ces agents pendant 48h. afin de déterminer les niveaux IC50. Tous les agents ont été dissous dans de l’eau distillée stérile.
Essai de cytotoxicité cellulaire
3X103cellules T98G et U87-MG ont été ensemencées dans une plaque à 96 puits et cultivées pendant la nuit. Différentes concentrations de metformine, de DCA et de mémantine ont été utilisées dans le test MTT. Une solution de MTT (5 mg/ml dans du PBS) a été ajoutée et les cellules ont été incubées pendant 4 heures à 37°C. Du DMSO a été ajouté pour solubiliser les cristaux. Le rapport d’absorbance a été mesuré à l’aide de SpectraMax M3 (Molecular Devices, USA)
Échantillons de patients atteints de GBM et isolement de protéines à partir detissustumoraux
Un total de 17 échantillons de tissus tumoraux de GBM a été collecté à l’Université de Gazi, département de neurochirurgie, sur la période avril 2015-avril 2016 avec l’approbation du comité d’éthique de la recherche clinique de l’Université de Gazi. Les échantillons tumoraux ont été fraîchement congelés à -80°C. Deux des tissus tumoraux ont été exclus de l’étude car leurs rapports de pathologie ont été trouvés comme GBM (-). 0.un gramme d’échantillon de tissu tumoral a été homogénéisé dans un tampon de lyse RIPA. Le lysat a été centrifugé pendant 15 minutes à 14 000 rpm et le surnageant a été recueilli pour effectuer le test de quantification des protéines BCA. Les échantillons ont été conservés à -80 °C pour un traitement ultérieur.
Western Blotting
Les cellulesT98Get U87-MG ont été lavées avec du PBS et grattées dans un tampon de lyse RIPA contenant 1mM de PMSF, suivi d’une sonication. Les échantillons ont été centrifugés pendant 15 minutes à 13500 rpm à 4°C et le surnageant a été recueilli. Les protéines ont été quantifiées à l’aide du kit de dosage BCA (Thermo Pierce, Rockford, IL, USA). Les lysats de protéines (20 μg) ont été chauffés pendant 5 minutes à 95°C dans le tampon d’échantillon non réducteur LDS (Pierce, Rockford, IL, USA) puis chargés sur des gels Tris-glycine à 10 %, transférés sur une membrane PVDF (Pierce, Rockford, IL, USA). Les membranes ont été bloquées pendant 1 heure à température ambiante et incubées pendant une nuit à 4°C avec les anticorps primaires pour Casp3, Bcl2, Bad, Bax, GSK-3B, C-Myc et β-actine (Thermo Pierce, Rockford, IL, USA). Les taches ont été visualisées par le substrat Western HRP Luminata Forte (Merck Millipore, Darmtadt, Allemagne). Les signaux chimioluminescents des immunoblots ont été documentés à l’aide de Gel Logic 2200 Pro (Carestream Health ; Rochester, NY, USA).
Analyse statistique
Les expériences ont été réalisées en triplicatas. Les niveaux IC50 de la metformine, du dichloroacétate et de la mémantine pour les lignées cellulaires T98G et U87-MG ont été calculés à l’aide de Graph-Pad Prism7. Les résultats ont été exprimés sous forme de moyenne±écart-type. p<0,05 a été considéré comme statistiquement significatif.
Résultats
Effets de la metformine, du DCA, de la metformine+DCA et de la mémantine sur la cytotoxicité des cellules GBM T98G et U87-MG
La metformine a diminué la viabilité cellulaire des cellules cancéreuses GBM humaines T98G et U87- MG de manière dose-dépendante comme le montre la Figure 1A, le traitement avec 45mM et 25mM de metformine a réduit la viabilité cellulaire pendant 48 heures (p<0,01). Nous avons étudié l’effet du DCA sur les cellules T98G et U87-MG pendant 48 heures, une gamme de concentration de 10-60 mM de DCA a été testée sur les cellules. Le DCA a réduit la viabilité cellulaire à une concentration de 45 mM, comme le montre la figure 1B (p<0,01). Différentes concentrations de metformine+DCA ont également été testées sur des cellules de GBM afin de diminuer les doses IC50. La combinaison metformine+DCA a diminué la viabilité cellulaire à des doses plus faibles, la dose IC50 pour le traitement combiné a été trouvée comme 20mM DCA et 20mM metformine pour les cellules T98G et U87MG pendant 48 heures comme le montre la Figure 1C (p<0,01). En outre, la mémantine a affecté la toxicité cellulaire de manière dose-dépendante, comme le montre la figure 1D. 0.la concentration de 125-5 mM de mémantine a été testée sur les cellules T98G et U87MG pendant 48 heures, et, la valeur IC50 a été déterminée comme étant de 0,5 mM pour les cellules T98G et U87MG (p<0,01).
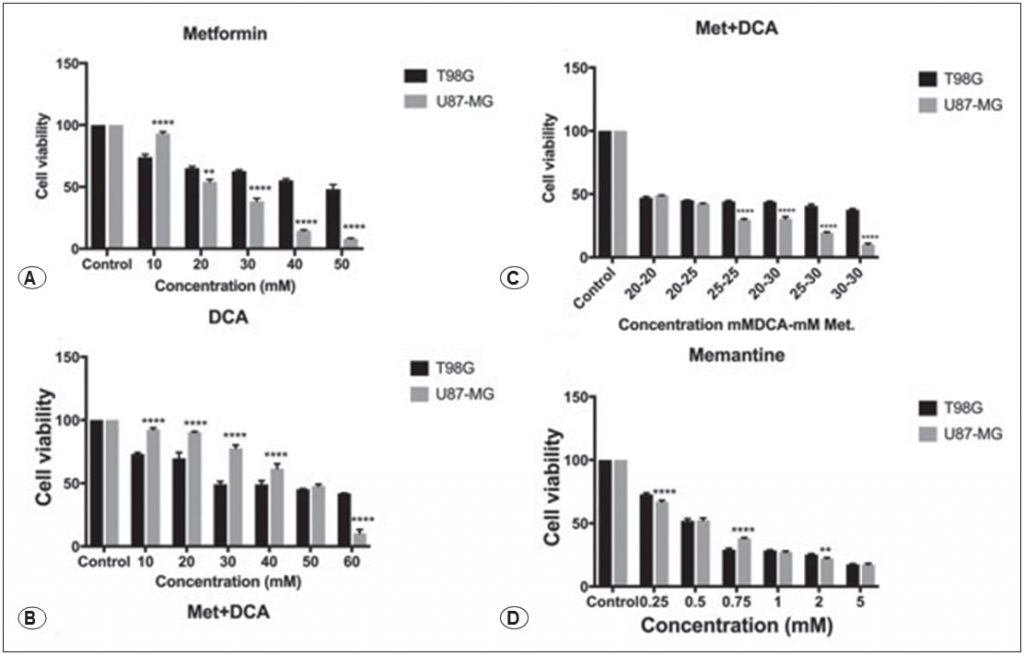
Effets de la metformine, du DCA, de la metformine+DCA et de la mémantine sur les niveaux d’expression des protéines Casp3, Bcl2, Bax, c-Myc, GSK3B
Les cellulesT98Gont été traitées avec 45mM de metformine, 45mM de DCA, 20mM de metformine en combinaison avec 20mM de DCA et 0,5mM de mémantine pendant 48 heures. Les cellules U87-MG ont été traitées avec 25 mM de metformine, 45 mM de DCA, 20 mM de metformine en combinaison avec 20 mM de DCA et 0,5 mM de mémantine pendant 48 heures. Les expressions des protéines liées à l’apoptose et à la progression du cycle cellulaire, à savoir Casp3, Bcl2, Bax, c-Myc et GSK3B, ont été évaluées par western blot. La metformine et l’association metformine-DCA ont diminué l’expression de la protéine Casp-3 dans les cellules T98G (Figure 2), alors que l’expression de la protéine Casp-3 était augmentée dans tous les traitements (metformine, DCA, metformine+DCA, mémantine) dans les cellules U87-MG (Figure 3). On a constaté que l’expression de la protéine Bcl-2 augmentait avec le traitement au DCA, à la metformine+DCA et à la mémantine, tandis que l’expression de la protéine Bax diminuait dans tous les traitements pour les cellules T98G. L’expression de la protéine c-Myc était diminuée par les traitements susmentionnés (metformine, DCA, metformine+DCA, mémantine) dans les cellules T98G. Le traitement par la mémantine a inhibé l’expression de la protéine GSK3B dans les cellules T98G (Figure 2).

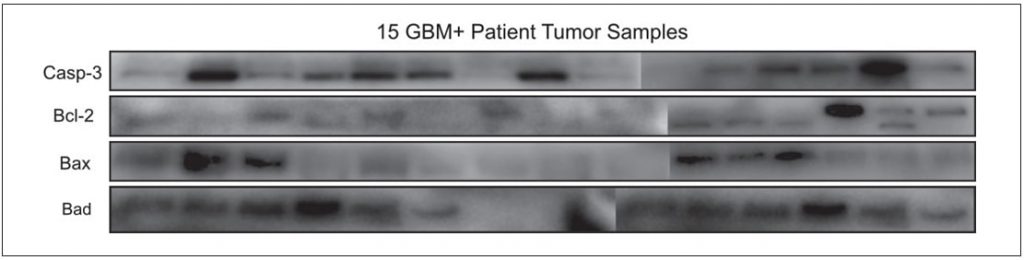
Profils d’expression protéique différentielle destissustumoraux positifs au GBM
Les échantillons de tissus tumoraux positifs au GBM ont été caractérisés en termes d’apoptose, car cela pourrait être un indicateur de la progression de la maladie. Quinze échantillons de tissu tumoral GBM+ ont été étudiés pour les profils d’expression des protéines Casp-3, Bcl-2, Bad, Bax. Les protéines apoptotiques étudiées se sont avérées être exprimées de manière différentielle chez chaque patient (Figure 4).
Discussion
L’approbation du médicament anti-angiogénique bevacizumab dans le traitement du GBM a montré une amélioration du taux de survie global des patients ; cependant, cette découverte reste controversée [6]. À l’heure de la médecine personnalisée, il est nécessaire de trouver d’autres schémas thérapeutiques pour une tumeur aussi agressive que le GBM.
La dépendance des cellules cancéreuses au glucose et à la glutamine est connue comme la marque distinctive des cancers [16]. Le métabolisme aberrant du glucose est défini comme le moteur de l’agressivité et de la chimiorésistance des GBM. Le ciblage du métabolisme tumoral dans le traitement du cancer a maintenant élargi l’intérêt au-delà du métabolisme du glucose à d’autres molécules telles que la glutamine. Il est donc crucial de mieux comprendre le métabolisme de la glutamine dans les cellules cancéreuses [2]. L’objectif de la présente étude est donc de cibler le métabolisme du glucose et de la glutamine en utilisant la metformine, le DCA et la mémantine.
Le mécanisme d’action de la metformine, médicament contre le diabète, sur les cellules cancéreuses est connu pour sa sélectivité à cibler les cellules souches cancéreuses. Ce mécanisme pourrait dépendre du métabolisme de la glutamine [8]. Le DCA est un inhibiteur de la pyruvate déshydrogénase kinase qui inverse l’effet Warburg [20]. La sensibilisation des cellules tumorales à l’inhibition de la glycolyse pourrait être obtenue par un double ciblage via la metformine et le DCA. En outre, la mémantine, un médicament contre la maladie d’Alzheimer, présente des doses IC50 beaucoup plus faibles que celles de la metformine. La dose IC50 relativement plus faible de la mémantine (0,5mM) pourrait donc permettre de surmonter les problèmes liés à la dose supra-physiologique de la metformine en milieu clinique. Les dérivés de la mémantine nouvellement synthétisés ont également démontré une activité antitumorale sur la lignée cellulaire U87-MG GBM [3]. L’utilisation de la mémantine pour cibler les voies de signalisation associées aux récepteurs NMDA pourrait améliorer le traitement des gliomes et des GBM [1,14]. La mise en lumière du mécanisme anticancéreux de la mémantine sur les cellules de GBM est donc prometteuse en tant que nouveau médicament repurposé.
Les profils d’expression protéique différentielle de 15 tissus tumoraux GBM+ pour les gènes apoptotiques Casp-3, Bcl-2, Bad, Bax confirment également la nature hétérogène de la maladie. L’expression positive de Bax a été associée de manière significative à un meilleur taux de survie dans une grande série de tumeurs [19]. Le profil d’expression de la protéine Bax pourrait donc avoir une valeur pronostique dans la réponse au traitement des GBM. L’activation de la Caspase-3 est un facteur prédictif de la survie sans progression chez les patients atteints de GBM [13].
La stratification moléculaire des patients est indispensable pour cibler les groupes de patients les plus susceptibles de bénéficier du protocole de traitement choisi.
Dans une étude récente qui passe en phase II, les chercheurs ont étudié les doses maximales tolérées de mémantine, de méfloquine et de metformine en association avec le Temozolomide. Maraka et al. ont conclu que ces médicaments pouvaient être associés en toute sécurité au témozolomide dans les cas de GBM récemment diagnostiqués [10]. Cependant, certains effets secondaires ont été signalés dans les schémas thérapeutiques combinés et l’approche a été examinée de près, ce qui a suscité des confusions quant à savoir si la mémantine ou la méfloquine était à l’origine des effets secondaires observés [15]. Il reste crucial de comprendre les interactions médicamenteuses et/ou pharmacocinétiques lors de l’utilisation d’associations de médicaments.
CONCLUSION
Nos résultats in vitro fournissent la preuve de concept que la mémantine, un médicament de la maladie d’Alzheimer, pourrait être utilisée dans le traitement des GBM à des doses plus faibles que la metformine. Les propriétés de pénétration de la mémantine dans la barrière hémato-encéphalique sont également prometteuses pour le traitement de la maladie de Basedow. Il est également intéressant de noter que la mémantine pourrait constituer une thérapie néoadjuvante alternative, en particulier pour les patients âgés atteints de cancer. Cette affirmation nécessite une étude plus approfondie à l’aide d’essais contrôlés randomisés.
REMERCIEMENTS
Cette étude a été soutenue par une subvention scientifique du Conseil de la Recherche Scientifique et Technologique de Turquie, TUBITAK (Projet No : SBAG- 214S578).
RÉFÉRENCES
1 Altinoz MA, Elmaci I : Targeting nitric oxide and NMDA receptor-associated pathways in treatment of high grade glial tumors. Hypothèses pour la nitro-mémantine et les nitrones. Oxyde nitrique 79:68-83, 20182 Altman BJ, Stine ZE, Dang CV : De Krebs à la clinique : Le métabolisme de la glutamine à la thérapie du cancer. Nat Rev Cancer 16(10):619- 634, 2016
3 Cacciatore I, Fornasari E, Marinelli L, Eusepi P, Ciulla M, Ozdemir O, Tatar A, Turkez H, Di Stefano A : Les médicaments dérivés de la mémoire comme agents antitumoraux potentiels pour le traitement du glioblastome. Eur J Pharm Sci 109:402-411, 2017
4 Ferla R, Haspinger E, Surmacz E : La metformine inhibe la croissance et la migration des cellules de glioblastome induites par la leptine. Oncology Letters 4(5):1077-1081, 2012
5 Inda MD, Bonavia R, Seoane J : Glioblastoma multiforme : Un regard sur sa nature hétérogène. Cancers 6(1):226-239, 2014
6 Johnson DR, Omuro AM, Ravelo A, Sommer N, Guerin A, Ionescu-Ittu R, Shi S, Macalalad A, Uhm JH : survie globale des patients atteints de glioblastome avant et après l’approbation du bevacizumab. Recherche et opinion médicales actuelles 34(5):813- 820, 2018
7 Khosla D : Thérapie simultanée pour améliorer les résultats radiothérapeutiques dans le glioblastome. Ann Transl Med 4(3):54, 2016
8 Kim JH, Lee KJ, Seo Y, Kwon JH, Yoon JP, Kang JY, Lee HJ, Park SJ, Hong SP, Cheon JH, Kim WH : Les effets de la metformine sur les cellules souches du cancer colorectal dépendent des altérations du métabolisme de la glutamine. Scientific Reports 8(1):409, 2018
9 Liu Y, Xu X, Yin L, Zhang X, Li L, Lu H : Relation entre l’hétérogénéité du glioblastome et la durée de survie : Une analyse de la texture de l’imagerie par résonance magnétique. Am J Neuroradiol 38(9):1695-1701, 2017
10 Maraka S, Groves MD, Mammoser AG, Melguizo-Gavilanes I, Conrad CA, Tremont-Lukats IW, Loghin ME, O’Brien BJ, Puduvalli VK, Sulman EP, Hess KR : Phase 1 lead-in à une étude factorielle de phase 2 de temozolomide plus memantine, mefloquine, et metformine comme thérapie adjuvante postradiation pour les glioblastomes nouvellement diagnostiqués. Cancer 125(3):424-433, 2019
11 Michelakis ED, Webster L, Mackey JR : Le dichloroacétate (DCA) comme thérapie potentielle de ciblage métabolique pour le cancer. Br J Cancer 99(7):989-994, 2008
12 Mrugala MM : Advances and challenges in the treatment of glioblastoma : A clinician’s perspective. Discov Med 15(83):221-230, 2013
13 Murphy ÁC, Weyhenmeyer B, Schmid J, Kilbride SM, Rehm M, Huber HJ, Senft C, Weissenberger J, Seifert V, Dunst M, Mittelbronn M : Activation of executioner caspases is a predictor of progression-free survival in glioblastoma patients : A systems medicine approach. Cell Death Dis 4(5):e629, 2013
14 Müller-Längle A, Lutz H, Hehlgans S, Rödel F, Rau K, Laube B : Les voies de signalisation médiées par les récepteurs NMDA améliorent la résistance aux rayonnements, la survie et la migration des cellules de glioblastome – une cible potentielle pour la radiothérapie adjuvante. Cancers (4):503, 2019
15 Nevin RL : Taux anormalement bas d’effets indésirables neuropsychiatriques associés à la méfloquine repurposée pour le traitement du glioblastome. Cancer 125(8):1384-1385, 2019
16 Panchanathan RS, Sittur MG, Aoun RJ, Pines AR, Swanson KR, Bendok BR : War on glioblastoma multiforme : 2-pronged siege on glutamine. World Neurosurgery 91:254-256, 2016
17 Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, Olivi A, McLendon R, Rasheed BA, Keir S, Nikolskaya T, Nikolsky Y, Busam DA, Tekleab H, Diaz Jr LA, Hartigan J, Smith DR, Strausberg RL, Nagahashi Marie SK, Oba Shinjo SM, Yan H, Riggins GJ, Bigner DD, Karchin R, Papadopoulos N, Parmigiani G, Vogelstein B, Velculescu VE, Kinzler KW : Une analyse génomique intégrée du glioblastome multiforme humain. Science 321(5897):1807-1812, 2008
18 Rojas LBA, Gomes MB : Metformin : An old but still the best treatment for type 2 diabetes. Diabetol Metab Syndr 5(1):6, 2013
19 Ruano Y, Mollejo M, Camacho FI, de Lope AR, Fiaño C, Ribalta T, Martinez P, Hernández Moneo JL, Meléndez B : Identification des gènes liés à la survie de la voie de signalisation phosphatidylinositol 3′ kinase dans le glioblastome multiforme. Cancer 112(7):1575-1584, 2008
20 Shen H, Decollogne S, Dilda PJ, Hau E, Chung SA, Luk PP, Hogg PJ, McDonald KL : Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 34(1):14, 2015
21 Soeda A, Hara A, Kunisada T, Yoshimura SI, Iwama T, Park DM : The evidence of glioblastoma heterogeneity. Scientific Reports 5:7979, 2015
22 Sottoriva A, Spiteri I, Piccirillo SG, Touloumis A, Collins VP, Marioni JC, Curtis C, Watts C, Tavaré S : Intratumor heterogeneity in human glioblastoma reflects cancer evolutionary dynamics. Proc Natl Acad Sci U S A 110(10):4009- 4014, 2013
23 Stupp R, Mason WP, Van Den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO, European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups ; National Cancer Institute of Canada Clinical Trials Group : Radiothérapie plus témozolomide concomitante et adjuvante pour le glioblastome. N Engl J Med 352(10):987-996, 2005
24 Quinn BJ, Kitagawa H, Memmott RM, Gills JJ, Dennis PA : Repositionnement de la metformine pour la prévention et le traitement du cancer. Tendances en endocrinologie et métabolisme 24(9):469-480, 2013
25 Whitburn J, Edwards CM, Sooriakumaran P : La metformine et le cancer de la prostate : Un nouveau rôle pour un vieux médicament. Rapports d’urologie actuels 18(6):46, 2017
26 Yang SH, Li S, Lu G, Xue H, Kim DH, Zhu JJ, Liu Y : Le traitement par la metformine réduit la résistance au temozolomide des cellules de glioblastome. Oncotarget 7(48):78787-78803, 2016
27 Zhang X, Zhang W, Cao WD, Cheng G, Zhang YQ : Glioblastome multiforme : Caractérisation moléculaire et stratégie de traitement actuelle. Exp Ther Med 3(1):9-14, 2012
Contenu connexe :