Gulsah ALBAYRAK1 , Ece KONAC1 , Umit Akin DERE2 , Hakan EMMEZ2
1 Gazi Universität, Medizinische Fakultät, Abteilung für Medizinische Biologie und Genetik, Ankara, Türkei
2 Gazi Universität, Medizinische Fakultät, Abteilung für Neurochirurgie, Ankara, Türkei
Korrespondenz: Ece KONAC; E-Mail: [email protected]
Empfangen: 16 January 2020Accepted
: 3 July 2020Published
: 29 December 2020
Zusammenfassung
ZIEL: Es sollten die Wirkungen von Metformin, Dichloracetat (DCA) und Memantin auf T98G- und U87-MG-Zellen des menschlichen Glioblastoms (GBM) untersucht werden, um den Stoffwechsel der Tumorzellen auf multidirektionale Weise zu beeinflussen.
MATERIAL und METHODEN: Die IC50-Werte für Metformin, DCA, Metformin+DCA und Memantin wurden mittels MTT-Assay in T98G- und U87-MG-Zellen in vitro bestimmt. Die Expression der Proteine Casp3, Bcl-2, Bax, c-Myc und GSK-3B wurde nach der Behandlung untersucht. Fünfzehn GBM+-Tumorgewebe wurden auf Casp-3, Bcl-2, Bad, Bax und apoptotische Proteinexpressionsmuster untersucht.
ERGEBNISSE: Die Krebszellen-Stoffwechselmedikamente Metformin, DCA, Metformin+DCA und Memantin induzierten Zytotoxizität in T98G- und U87-MG-Zellen in dosisabhängiger Weise. Die IC50 für Memantin liegt bei 0,5 mM (p<0,01) und damit fast zehnmal niedriger als die Konzentration von Metformin. Fünfzehn GBM+-Tumorgewebe wiesen unterschiedliche apoptotische Proteinexpressionen auf.
SCHLUSSFOLGERUNG: Memantin hat in T98G- und U87-MG-Zellen einen krebshemmenden Wirkmechanismus, der jedoch für die GBM-Behandlung noch genauer untersucht werden muss.
Keywords: Glioblastom, Krebszelle, Metabolismus, Metformin, Dichloracetat, MemantineDOI
: 10.5137/1019-5149.JTN.29176-20.3
EINLEITUNG
Das Glioblastom (GBM) ist einer der aggressivsten Tumore des zentralen Nervensystems und macht etwa 50 % aller glialen Tumorarten aus [12,27]. Die mediane Überlebensrate für GBM-Patienten ändert sich nicht wesentlich, wenn man die derzeitigen Standardbehandlungen anwendet, die eine Tumorresektion mit anschließender Strahlentherapie und Temozolomid-Behandlung umfassen. Die mediane Überlebenszeit beträgt trotz des kombinierten Einsatzes von Operation, Strahlen- und Chemotherapie ca. 12-14 Monate [7,23].
GBM-Tumoren weisen ein breites Spektrum genetischer Variationen auf, die zu unterschiedlichen therapeutischen Reaktionen führen [5,9,21]. Die Intratumor-Heterogenität könnte der Schlüssel zur Identifizierung der Ursache für ein Therapieversagen sein [22]. Chemotherapeutische Medikamente wie Temozolamid erhöhen die Mutationslast im Krebsgenom im Vergleich zu unbehandelten GBM-Zellen [17]. Alternative Therapieansätze sind daher in der GBM-Behandlung dringend erforderlich.
Metformin ist ein gängiges Antidiabetikum, das bei der Behandlung von Typ-2-Diabetes eingesetzt wird [18]. Die Behandlung mit Metformin wird mit einem geringeren Risiko für verschiedene Krebsarten in Verbindung gebracht, seine Auswirkungen auf das GBM sind jedoch noch nicht ausreichend untersucht worden [4,24]. Die Behandlung mit Metformin verringert die Temozolomid-Resistenz in GBM-Zellen [26]. Metformin ist jedoch im klinischen Umfeld mit Sicherheitsbedenken behaftet, da in den meisten präklinischen Arbeiten supraphysiologische Dosen von Metformin verwendet wurden [25]. In dieser Studie wollten wir dieses Problem lösen, indem wir die Wirkung von Metformin in Kombination mit Dichloracetat (DCA) untersuchten, das über die Hemmung der Pyruvat-Dehydrogenase-Kinase auf den Stoffwechsel von Krebszellen abzielt [11]. Ein gezielter Eingriff in den Stoffwechsel von Krebszellen könnte Auswirkungen auf die Behandlung des aggressiven GBM haben. Außerdem wollten wir die Expressionsprofile apoptotischer Proteine untersuchen, um GBM auf molekularer Ebene besser zu verstehen. Außerdem wollten wir mit Metformin, DCA und Memantin in den GBM-Zelllinien T98G und U87-MG in den Stoffwechsel der Krebszellen eingreifen.
Materialien und Methoden
Zellkultur und Chemikalien
Die menschlichen Glioblastom-ZelllinienT98Gund U87-MG wurden von ATCC zur Verfügung gestellt. T98G- und U87-MG-Zellen wurden in DMEM/F12-Medium gezüchtet, das mit 10 % fötalem Rinderserum (FBS) (Sigma-Aldrich, St Louis, MO, USA) ergänzt wurde. Die Zellen wurden in einem 5%igenCO2-Inkubator bei 37° C gezüchtet. Metformin, Dichloracetat und Memantin wurden von Sigma-Aldrich, St Louis, MO, USA, zur Verfügung gestellt. Die Zellen wurden 48 Stunden lang mit diesen Wirkstoffen behandelt, um die IC50-Werte zu bestimmen. Alle Wirkstoffe wurden in sterilem destilliertem Wasser aufgelöst.
Zellzytotoxizitätstest
3X103T98G- und U87-MG-Zellen wurden in einer 96-Well-Platte ausgesät und über Nacht kultiviert. Für den MTT-Assay wurden verschiedene Konzentrationen von Metformin, DCA und Memantin verwendet. MTT-Lösung (5 mg/ml in PBS) wurde zugegeben und die Zellen wurden 4 Stunden lang bei 37 °C inkubiert. Zum Lösen der Kristalle wurde DMSO zugegeben. Das Absorptionsverhältnis wurde mit SpectraMax M3 (Molecular Devices, USA) gemessen
GBM-Patientenproben und Proteinisolierung aus Tumorgewebe
Insgesamt 17 GBM-Tumorgewebeproben wurden im Zeitraum von April 2015 bis April 2016 mit Genehmigung der Ethikkommission für klinische Forschung der Gazi-Universität in der Abteilung für Neurochirurgie entnommen. Die Tumorproben wurden bei -80°C frisch eingefroren. Zwei der Tumorgewebe wurden aus der Studie ausgeschlossen, da ihre Pathologieberichte GBM (-) anzeigten. 0.1 Gramm der Tumorgewebeprobe wurde in RIPA-Lysepuffer homogenisiert. Das Lysat wurde 15 Minuten lang bei 14.000 Umdrehungen pro Minute zentrifugiert, und der Überstand wurde zur Durchführung des BCA-Proteinquantifizierungstests aufgefangen. Die Proben wurden für die weitere Verarbeitung bei -80 °C gelagert.
Western Blotting
T98G-und U87-MG-Zellen wurden mit PBS gewaschen und in RIPA-Lysepuffer, der 1 mM PMSF enthielt, geschabt und anschließend beschallt. Die Proben wurden 15 Minuten lang bei 13500 Umdrehungen pro Minute bei 4 °C zentrifugiert, und der Überstand wurde gesammelt. Die Proteine wurden mit dem BCA-Assay-Kit (Thermo Pierce, Rockford, IL, USA) quantifiziert. Proteinlysate (20 μg) wurden 5 Minuten lang bei 95 °C in nicht reduzierendem LDS-Probenpuffer (Pierce, Rockford, IL, USA) erhitzt, dann auf 10%ige Tris-Glycin-Gele geladen und auf eine PVDF-Membran (Pierce, Rockford, IL, USA) übertragen. Die Membranen wurden 1 Stunde lang bei Raumtemperatur blockiert und über Nacht bei 4°C mit den primären Antikörpern für Casp3, Bcl2, Bad, Bax, GSK-3B, C-Myc und β-Actin (Thermo Pierce, Rockford, IL, USA) inkubiert. Die Blots wurden mit Luminata Forte Western HRP Substrate (Merck Millipore, Darmstadt, Deutschland) visualisiert. Die Chemilumineszenzsignale der Immunoblots wurden mit Gel Logic 2200 Pro (Carestream Health; Rochester, NY, USA) dokumentiert.
Statistische Analyse
Die Experimente wurden in dreifacher Ausführung durchgeführt. Die IC50-Werte von Metformin, Dichloracetat und Memantin für die Zelllinien T98G und U87-MG wurden mithilfe von Graph-Pad Prism7 berechnet. Die Ergebnisse wurden als Mittelwert±Standardabweichung angegeben. p<0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Auswirkungen von Metformin, DCA, Metformin+DCA und Memantin auf die Zytotoxizität von T98G- und U87-MG-GBM-Zellen
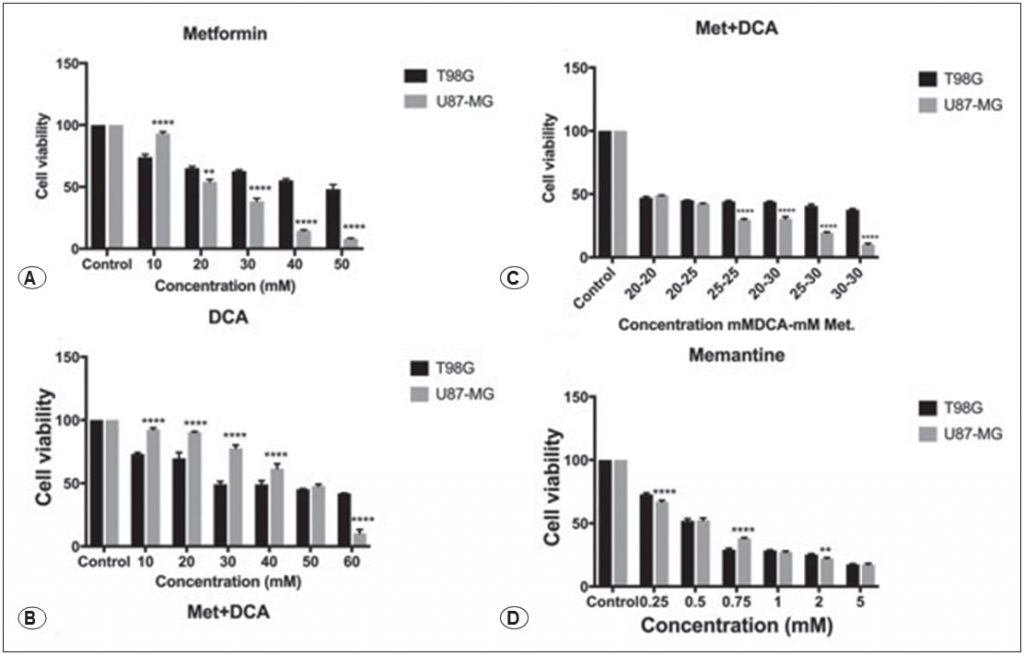
Metformin verringerte die zelluläre Lebensfähigkeit von T98G- und U87-MG-GBM-Krebszellen in einer dosisabhängigen Weise, wie in Abbildung 1A gezeigt wird. Die Behandlung mit 45mM und 25mM Metformin verringerte die Zelllebensfähigkeit für 48 Stunden (p<0,01). Wir untersuchten die Wirkung von DCA auf T98G- und U87-MG-Zellen über 48 Stunden, wobei ein Konzentrationsbereich von 10-60 mM DCA auf Zellen getestet wurde. DCA reduzierte die Lebensfähigkeit der Zellen bei einer Konzentration von 45 mM, wie in Abbildung 1B gezeigt (p<0,01). Es wurden auch verschiedene Konzentrationen von Metformin+DCA an GBM-Zellen getestet, um die IC50-Dosen zu verringern. Die Kombination aus Metformin und DCA verringerte die Lebensfähigkeit der Zellen auf niedrigere Dosen. Die IC50-Dosis für die Kombinationsbehandlung wurde für T98G- und U87MG-Zellen mit 20 mM DCA und 20 mM Metformin für 48 Stunden ermittelt (Abbildung 1C, p<0,01). Darüber hinaus wirkte sich Memantin dosisabhängig auf die zelluläre Toxizität aus, wie in Abbildung 1D dargestellt. 0.die Memantin-Konzentration von 125-5 mM wurde an T98G- und U87MG-Zellen 48 Stunden lang getestet, und der IC50-Wert wurde mit 0,5 mM für T98G- und U87MG-Zellen bestimmt (p<0,01).
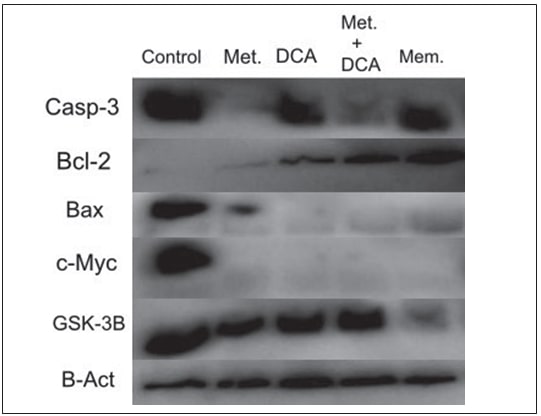
Auswirkungen von Metformin, DCA, Metformin+DCA und Memantin auf die Casp3-, Bcl2-, Bax-, c-Myc- und GSK3B-Proteinexpression
T98G-Zellenwurden 48 Stunden lang mit 45mM Metformin, 45mM DCA, 20mM Metformin in Kombination mit 20mM DCA und 0,5mM Memantin behandelt. U87-MG-Zellen wurden 48 Stunden lang mit 25mM Metformin, 45mM DCA, 20mM Metformin in Kombination mit 20mM DCA und 0,5mM Memantin behandelt. Die Expression von Proteinen, die mit Apoptose und Zellzyklusprogression zusammenhängen, d.h. Casp3, Bcl2, Bax, c-Myc und GSK3B, wurde mittels Western Blot untersucht. Metformin und die Metformin-DCA-Kombination verringerten die Casp-3-Proteinexpression in T98G-Zellen (Abbildung 2), wohingegen die Casp-3-Proteinexpression bei allen Behandlungen (Metformin, DCA, Metformin+DCA, Memantin) in U87-MG-Zellen erhöht war (Abbildung 3). Die Bcl-2-Proteinexpression stieg bei DCA-, Metformin+DCA- und Memantin-Behandlung an, während die Bax-Proteinexpression bei allen Behandlungen von T98G-Zellen abnahm. Die c-Myc-Proteinexpression wurde durch die oben genannten Behandlungen (Metformin, DCA, Metformin+DCA, Memantin) in T98G-Zellen verringert. Die Memantin-Behandlung hemmte die GSK3B-Proteinexpression in T98G-Zellen (Abbildung 2).

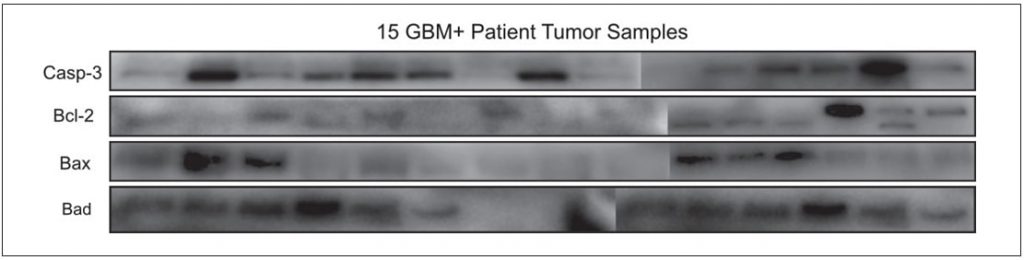
Differentielle Proteinexpressionsprofile von GBM-positivem
Tumorgewebe GBM-positive Tumorgewebeproben wurden im Hinblick auf Apoptose charakterisiert, da dies ein Indikator für das Fortschreiten der Krankheit sein könnte. Fünfzehn GBM+-Tumorgewebeproben wurden auf die Expressionsprofile der Proteine Casp-3, Bcl-2, Bad und Bax untersucht. Es wurde festgestellt, dass die untersuchten apoptotischen Proteine bei jedem Patienten unterschiedlich exprimiert werden (Abbildung 4).
Diskussion
Die Zulassung des antiangiogenen Medikaments Bevacizumab bei GBM zeigte eine Verbesserung der Gesamtüberlebensrate der Patienten; diese Erkenntnis bleibt jedoch umstritten [6]. Im Zeitalter der personalisierten Medizin besteht ein Bedarf an alternativen Behandlungsmethoden für einen so aggressiven GBM-Tumor.
Die Glukose- und Glutaminsucht von Krebszellen ist bekanntlich das Markenzeichen von Krebserkrankungen [16]. Ein gestörter Glukosestoffwechsel gilt als treibende Kraft für die Aggressivität und Chemoresistenz von GBM. Das Interesse an einer gezielten Beeinflussung des Tumorstoffwechsels bei der Krebsbehandlung hat sich inzwischen über den Glukosestoffwechsel hinaus auf andere Moleküle wie Glutamin ausgeweitet. Es ist daher von entscheidender Bedeutung, mehr Erkenntnisse über den Glutamin-Stoffwechsel in Krebszellen zu gewinnen [2]. Ziel der aktuellen Studie ist es daher, den Glukose- und Glutaminstoffwechsel mit Hilfe von Metformin, DCA und Memantin zu beeinflussen.
Der Wirkmechanismus des Diabetesmedikaments Metformin auf Krebszellen ist bekannt als seine Selektivität bei der Bekämpfung von Krebsstammzellen. Dieser Mechanismus könnte vom Glutamin-Stoffwechsel abhängig sein [8]. DCA ist ein Pyruvat-Dehydrogenase-Kinase-Inhibitor, der den Warburg-Effekt umkehrt [20]. Die Sensibilisierung von Tumorzellen für die Hemmung der Glykolyse könnte durch ein duales Targeting über Metformin und DCA erreicht werden. Darüber hinaus hat das Alzheimer-Medikament Memantin im Vergleich zu Metformin eine viel niedrigere IC50-Dosis. Die relativ niedrigere IC50-Dosis von Memantin (0,5 mM) könnte daher die Bedenken bezüglich der supra-physiologischen Dosis von Metformin im klinischen Umfeld ausräumen. Neu synthetisierte Memantin-Derivate haben auch eine Anti-Tumor-Aktivität in der U87-MG GBM-Zelllinie gezeigt [3]. Die gezielte Beeinflussung von NMDA-Rezeptor-assoziierten Signalwegen durch Memantin könnte die Behandlung von Gliomen und GBM verbessern [1,14]. Die Aufklärung des Anti-Krebs-Mechanismus von Memantin bei GBM-Zellen ist daher ein vielversprechendes neues Medikament.
Unterschiedliche Proteinexpressionsprofile von 15 GBM+-Tumorgeweben für die apoptotischen Gene Casp-3, Bcl-2, Bad und Bax bestätigen ebenfalls den heterogenen Charakter der Krankheit. Eine positive Expression von Bax wurde in einer großen Serie von Tumoren signifikant mit einer besseren Überlebensrate in Verbindung gebracht [19]. Das Bax-Proteinexpressionsprofil könnte daher eine prognostische Bedeutung für das Ansprechen auf die GBM-Behandlung haben. Die Caspase-3-Aktivierung hat sich als Prädiktor für das progressionsfreie Überleben bei GBM-Patienten erwiesen [13].
Die molekulare Stratifizierung von Patienten ist unerlässlich, um die Patientengruppen zu identifizieren, die am ehesten von dem gewählten Behandlungsprotokoll profitieren werden.
In einer kürzlich durchgeführten Studie, die in eine Phase-II-Studie überging, untersuchten Forscher die maximal verträglichen Dosen von Memantin, Mefloquin und Metformin in Kombination mit Temozolomid. Maraka et al. kamen zu dem Schluss, dass diese Medikamente bei neu diagnostiziertem GBM sicher mit Temozolomid kombiniert werden können [10]. Allerdings wurden bei den kombinierten Therapieschemata einige Nebenwirkungen gemeldet, so dass der Ansatz hinterfragt wurde und die Frage aufgeworfen wurde, ob Memantin oder Mefloquin die beobachteten Nebenwirkungen verursachte [15]. Bei der Verwendung von Arzneimittelkombinationen ist es nach wie vor von entscheidender Bedeutung, die Wechselwirkungen zwischen den Arzneimitteln und/oder die pharmakokinetischen Wechselwirkungen zu verstehen.
SCHLUSSFOLGERUNG
Unsere In-vitro-Ergebnisse belegen, dass das Alzheimer-Medikament Memantin bei der GBM-Behandlung in niedrigeren Dosen als Metformin eingesetzt werden könnte. Die Eigenschaften von Memantin, die Hirnblutschranke zu durchdringen, sind ebenfalls vielversprechend für die GBM-Behandlung. Interessant ist auch, dass Memantin eine alternative neoadjuvante Therapie insbesondere für ältere Krebspatienten darstellen könnte. Diese Behauptung muss in randomisierten kontrollierten Studien weiter untersucht werden.
DANKSAGUNG
Diese Studie wurde durch ein wissenschaftliches Stipendium des Wissenschaftlichen und Technologischen Forschungsrates der Türkei, TUBITAK (Projekt Nr.: SBAG- 214S578), unterstützt.
REFERENZEN
1 Altinoz MA, Elmaci I: Nitric Oxide and NMDA receptor-associated pathways in treatment of high grade glial tumors. Hypotheses for nitro-memantine and nitrones. Nitric Oxide 79:68-83, 20182 Altman BJ, Stine ZE, Dang CV: From Krebs to clinic: Der Glutaminstoffwechsel in der Krebstherapie. Nat Rev Cancer 16(10):619- 634, 2016
3 Cacciatore I, Fornasari E, Marinelli L, Eusepi P, Ciulla M, Ozdemir O, Tatar A, Turkez H, Di Stefano A: Memantinederived drugs as potential antitumor agents for the treatment of glioblastoma. Eur J Pharm Sci 109:402-411, 2017
4 Ferla R, Haspinger E, Surmacz E: Metformin hemmt Leptin-induziertes Wachstum und Migration von Glioblastomzellen. Oncology Letters 4(5):1077-1081, 2012
5 Inda MD, Bonavia R, Seoane J: Glioblastoma multiforme: A look inside its heterogeneous nature. Cancers 6(1):226-239, 2014
6 Johnson DR, Omuro AM, Ravelo A, Sommer N, Guerin A, Ionescu-Ittu R, Shi S, Macalalad A, Uhm JH: Overall survival in patients with glioblastoma before and after bevacizumab approval. Current Medical Research and Opinion 34(5):813- 820, 2018
7 Khosla D: Concurrent therapy to enhance radiotherapeutic outcomes in glioblastoma. Ann Transl Med 4(3):54, 2016
8 Kim JH, Lee KJ, Seo Y, Kwon JH, Yoon JP, Kang JY, Lee HJ, Park SJ, Hong SP, Cheon JH, Kim WH: Effects of metformin on colorectal cancer stem cells depend on alterations in glutamine metabolism. Scientific Reports 8(1):409, 2018
9 Liu Y, Xu X, Yin L, Zhang X, Li L, Lu H: Relationship between glioblastoma heterogeneity and survival time: An MR imaging texture analysis. Am J Neuroradiol 38(9):1695-1701, 2017
10 Maraka S, Groves MD, Mammoser AG, Melguizo-Gavilanes I, Conrad CA, Tremont-Lukats IW, Loghin ME, O’Brien BJ, Puduvalli VK, Sulman EP, Hess KR: Phase 1 lead-in to a phase 2 factorial study of temozolomide plus memantine, mefloquine, and metformin as postradiation adjuvant therapy for newly diagnosed glioblastoma. Cancer 125(3):424-433, 2019
11 Michelakis ED, Webster L, Mackey JR: Dichloracetat (DCA) als potenzielle metabolische zielgerichtete Therapie für Krebs. Br J Cancer 99(7):989-994, 2008
12 Mrugala MM: Fortschritte und Herausforderungen bei der Behandlung des Glioblastoms: Die Sicht eines Klinikers. Discov Med 15(83):221-230, 2013
13 Murphy ÁC, Weyhenmeyer B, Schmid J, Kilbride SM, Rehm M, Huber HJ, Senft C, Weissenberger J, Seifert V, Dunst M, Mittelbronn M: Activation of executioner caspases is a predictor of progression-free survival in glioblastoma patients: Ein systemmedizinischer Ansatz. Cell Death Dis 4(5):e629, 2013
14 Müller-Längle A, Lutz H, Hehlgans S, Rödel F, Rau K, Laube B: NMDA receptor-mediated signaling pathways enhance radiation resistance, survival and migration in glioblastoma cells – a potential target for adjuvant radiotherapy. Cancers (4):503, 2019
15 Nevin RL: Unerwartet niedrige Raten neuropsychiatrischer Nebenwirkungen im Zusammenhang mit Mefloquin, das für die Behandlung von Glioblastomen neu eingesetzt wird. Cancer 125(8):1384-1385, 2019
16 Panchanathan RS, Sittur MG, Aoun RJ, Pines AR, Swanson KR, Bendok BR: War on glioblastoma multiforme: 2-pronged siege on glutamine. World Neurosurgery 91:254-256, 2016
17 Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, Olivi A, McLendon R, Rasheed BA, Keir S, Nikolskaya T, Nikolsky Y, Busam DA, Tekleab H, Diaz Jr LA, Hartigan J, Smith DR, Strausberg RL, Nagahashi Marie SK, Oba Shinjo SM, Yan H, Riggins GJ, Bigner DD, Karchin R, Papadopoulos N, Parmigiani G, Vogelstein B, Velculescu VE, Kinzler KW: Eine integrierte genomische Analyse des menschlichen Glioblastoma multiforme. Wissenschaft 321(5897):1807-1812, 2008
18 Rojas LBA, Gomes MB: Metformin: Eine alte, aber immer noch die beste Behandlung für Typ-2-Diabetes. Diabetol Metab Syndr 5(1):6, 2013
19 Ruano Y, Mollejo M, Camacho FI, de Lope AR, Fiaño C, Ribalta T, Martinez P, Hernández Moneo JL, Meléndez B: Identification of survival related genes of the phosphatidylinositol 3′ kinase signaling pathway in glioblastoma multiforme. Cancer 112(7):1575-1584, 2008
20 Shen H, Decollogne S, Dilda PJ, Hau E, Chung SA, Luk PP, Hogg PJ, McDonald KL: Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 34(1):14, 2015
21 Soeda A, Hara A, Kunisada T, Yoshimura SI, Iwama T, Park DM: The evidence of glioblastoma heterogeneity. Scientific Reports 5:7979, 2015
22 Sottoriva A, Spiteri I, Piccirillo SG, Touloumis A, Collins VP, Marioni JC, Curtis C, Watts C, Tavaré S: Intratumor-Heterogenität im menschlichen Glioblastom spiegelt die evolutionäre Dynamik von Krebs wider. Proc Natl Acad Sci U S A 110(10):4009- 4014, 2013
23 Stupp R, Mason WP, Van Den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO, European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group: Strahlentherapie plus begleitendes und adjuvantes Temozolomid bei Glioblastom. N Engl J Med 352(10):987-996, 2005
24 Quinn BJ, Kitagawa H, Memmott RM, Gills JJ, Dennis PA: Neupositionierung von Metformin für die Krebsprävention und -behandlung. Trends in Endocrinology & Metabolism 24(9):469-480, 2013
25 Whitburn J, Edwards CM, Sooriakumaran P: Metformin und Prostatakrebs: A new role for an old drug. Current Urology Reports 18(6):46, 2017
26 Yang SH, Li S, Lu G, Xue H, Kim DH, Zhu JJ, Liu Y: Metformin treatment reduces temozolomide resistance of glioblastoma cells. Oncotarget 7(48):78787-78803, 2016
27 Zhang X, Zhang W, Cao WD, Cheng G, Zhang YQ: Glioblastoma multiforme: Molekulare Charakterisierung und aktuelle Behandlungsstrategie. Exp Ther Med 3(1):9-14, 2012
Verwandte Inhalte: