D.L. Kolesnik*, O.N. Pyaskovskaya, O.V. Yurchenko, G.I. Solyanik
R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, NAS of Ukraine, Kyiv 03022, Ukraine
Ingediend: 06 mei 2019.
*Correspondentie: E-mail: [email protected] Gebruikte afkortingen: DCA – natriumdichlooracetaat; MTF – metformine; Δψm – mitochondriaal membraanpotentiaal; IC50 – halfmaximale remmende concentratie
Abstract
Het is bekend dat het arsenaal aan chemotherapeutische middelen voor de behandeling van kwaadaardige hersentumoren vrij beperkt is, waardoor onderzoek gericht op het vinden van nieuwe effectieve antitumorregimes, waaronder het gebruik van energiestofwisselingsmodificatoren, van groot belang is. Doel: Onderzoeken van de anti-glioma activiteit van natriumdichlooracetaat (DCA) en metformine (MTF) in combinatie in vitro en in vivo. Materialen en methoden: Celoverleving, celcyclus, apoptose, mitochondriaal membraanpotentieel (Δψm), ATP-niveau, het glucoseverbruik en de lactaatproductiesnelheid werden in vitro bepaald in gekweekte glioma C6-cellen. De antitumorwerking van de agentia in vivo werd routinematig geëvalueerd door de verlenging van de levensduur van ratten met getransplanteerd intracerebraal glioom C6 en werd bevestigd door histologisch onderzoek van tumorweefsel. Resultaten: De halfmaximale remmende concentratie (IC50) voor DCA en MTF afzonderlijk gebruikt was respectievelijk 79,2 ± 2,1 mM en 78,4 ± 4,0 mM, terwijl de IC50 voor DCA gebruikt in combinatie met 7,8 mM MTF 3,3 maal lager was (24,0 ± 1,2 mM, p < 0,05). De eendaagse incubatie van cellen met DCA in een concentratie dicht bij IC50 (25 mM), in combinatie met MTF in een concentratie die orde lager is dan IC50 (7,8 mM), resulteerde in tegenstelling tot het afzonderlijke gebruik ervan, in een afname van het aantal levensvatbare cellen met 40% (p < 0.05); herverdeling van de cellen over de celcyclusfasen in de richting van een verminderd aandeel cellen in de S-fase met 46% (p < 0,05) en een verhoogd percentage cellen in de G0/G1-fase met 24% (p < 0,05) in vergelijking met soortgelijke indexen in de controle. De hoge proapoptotische activiteit van DCA in combinatie met MTF werd ondersteund door een significant hoger percentage apoptotische cellen in vitro dan in de controle (18,9 ± 4,4% vs 5,7 ± 1,3%, p < 0,05) en een hoog aantal tumorcellen met tekenen van apoptose die bij het histologisch onderzoek van de tumorpathomorfose aan het licht kwamen. Het gecombineerde effect van DCA en MTF resulteerde in een bijna 4-voudige daling van het glucoseverbruik door glioma C6 cellen (0,23 ± 0,05 μmol/106 cellen/h vs 0,91 ± 0,12 μmol/106 cellen/h, p<0.05) in vergelijking met de overeenkomstige parameters in de controle, en een 2-voudig verhoogde snelheid van lactaatproductie (1,06 ± 0,03 μmol/106 cellen/h vs 0,53 ± 0,03 μmol/106 cellen/h, p <0,05). Tegelijkertijd verschilden zowel Δψm als het niveau van intracellulair ATP in de met DCA en MTF behandelde glioma C6-cellen, zowel afzonderlijk als in combinatie, niet significant van die indices in de controle. In in vivo studies was de gemiddelde levensduur van ratten met intracranieel getransplanteerd glioom C6, behandeld met DCA in combinatie met MTF in een totale dosis van respectievelijk 1,1 en 2,6 g/kg lichaamsgewicht, 50% hoger (p < 0,001) dan in de controlegroep. In het geval van alleen gebruik (in een dosis van 2,6 g/kg) daarentegen, verhoogde MTF de levensduur van de tumordragende dieren slechts met 19% (p < 0,01), terwijl DCA alleen (in een dosis van 1,1 g/kg) de overlevingstijd van de ratten niet significant veranderde. Conclusies: De verkregen gegevens wijzen op synergisme van de anti-gliomenwerking van DCA en MTF bij gecombineerd gebruik, zowel in vitro als in vivo, en kunnen worden beschouwd als een beginpunt voor de ontwikkeling van effectieve behandelingsregimes voor kwaadaardige hersentumoren op basis van gecombineerd gebruik van DCA en MTF.
Trefwoorden: glioom C6, natriumdichlooracetaat, metformine.
Kwaadaardige gliomen staan bekend als de meest agressieve menselijke tumoren met meestal een ongunstige prognose, zelfs met de huidige vooruitgang in de antitumortherapie, waaronder anti-angiogene therapie, gerichte moleculaire therapie en immunotherapie. De invoering van nieuwe methoden van multimodale anti-glioma therapie leidt tot enige toename van de gemiddelde levensverwachting van patiënten, maar helaas wint een patiënt meestal niet meer dan 3-6 maanden leven [1-4]. Rekening houdend met de onmiskenbare renaissance op het gebied van studies met betrekking tot glucosemetabolisme in tumorcellen [5, 6] enerzijds, en de grote afhankelijkheid van hersencellen van glucose [7] anderzijds, lijkt het veelbelovend te proberen de effectiviteit van antitumortherapie te vergroten door metabole routes van glucosegebruik in tumorcellen te wijzigen.
In experimentele studies is gebleken dat metformine (MTF), een remmer van de mitochondriale ademhalingsketen (complex I), die op grote schaal wordt gebruikt bij de behandeling van diabetes type 2 als hypoglycemisch middel, de proliferatie en migratie van glioblastoomcellen kan remmen [8], de groei van glioom U87 en LN18 xenograften bij dieren kan remmen [9] enz. De resultaten van een epidemiologische studie met behulp van een grote gevalideerde database toonden aan dat het langdurig gebruik van MTF weliswaar niet in verband wordt gebracht met een vermindering van het risico van de ontwikkeling van glioma’s, maar wel bijdraagt tot een betere overleving van patiënten met kwaadaardig glioom [10].
De antitumoractiviteit van natriumdichlooracetaat (DCA), een niet-kankermedicijn die al 30 jaar wordt gebruikt als middel voor de behandeling van stofwisselingsstoornissen, met name melkverzuring, is in vitro en in vivo bevestigd, met name tegen glioomcellen [11-13].
Het doel van dit werk was de antiglioma-activiteit van DCA en MTF bij gecombineerd gebruik in vitro en in vivo te onderzoeken.
MATERIALEN EN METHODEN
Proefdieren en tumorcellijnen. Het onderzoek werd uitgevoerd op ingeteelde vrouwelijke ratten van 2,5-3 maanden oud met een gewicht van 100-130 g uit het vivarium van het R.E. Kavetsky Instituut voor Experimentele Pathologie, Oncologie en Radiobiologie (IEPOR) van de Nationale Academie van Wetenschappen van Oekraïne (NASU), Kiev, Oekraïne. Het onderzoek op dieren werd uitgevoerd in overeenstemming met de bepalingen van de Algemene Ethische Principes van Dierproeven, aangenomen door het Eerste Congres over Bio-ethiek (Kiev, 2001) en internationale eisen overeenkomstig de Europese Overeenkomst voor de bescherming van gewervelde dieren die voor experimentele en andere doeleinden worden gebruikt (Straatsburg, 1986).
Als experimenteel tumormodel werd de glioom C6-cellijn gebruikt, die was verkregen van de National Bank of Cell Lines and Tumor Strains van IEPOR NASU.
De glioma C6 cellen werden in vitro gehouden in DMEM met 10% foetaal kalfsserum (Sigma, VS) en 40 mg/ml gentamicine bij 37°С in een vochtige atmosfeer met 5% СО2.
Voor in vivo experimenten werden de cellen in vitro gekweekt onder standaard omstandigheden en getransplanteerd bij ratten onder algemene verdoving door intracerebrale inoculatie van 0,6-106 cellen in 0,05 ml fysiologische zoutoplossing in de linker pariëtale regio van de hersenen.
Middelen, doses en toedieningswijze. DCA (Sigma, VS) en MTF (Sigma, VS) werden gebruikt als onderzochte verbindingen.
Om de antitumoractiviteit van DCA, MTF en hun combinatie bij ratten na inoculatie van tumorcellen te evalueren, werden de dieren gerandomiseerd naar gewicht en verdeeld in 4 groepen: 1)ratten die alleen DCA kregen toegediend in een totale dosis van 1..1 g/kg (n = 12); 2) ratten die alleen MTF kregen toegediend in een totale dosis van 2,6 g/kg (n = 12); 3) ratten die DCA kregen toegediend in combinatie met MTF (n = 13) in bovengenoemde doses; en 4) ratten die water kregen toegediend (controle, n = 12).
In alle gevallen werden de middelen opgelost in water en oraal toegediend met een sonde, eenmaal per dag, vanaf de eerste dag na de inoculatie van de tumorcellen. In het geval van gecombineerd gebruik van DCA en MTF werd deze laatste 3-4 uur na de toediening van DCA toegediend.
Alle middelen werden ex tempore bereid.
De cytotoxische/cytostatische effecten van DCA en MTF alleen en in combinatie werden beoordeeld aan de hand van de halfmaximale remmende concentratie (IC50) – de concentratie van het agens die door zijn cytotoxische en/of cytostatische werking het aantal levensvatbare cellen met 50% vermindert ten opzichte van de controle.
Glioma C6-cellen werden in een 35 mm petrischaal gezaaid bij een dichtheid van 0,5-106 cellen/ml. Na de preïncubatieperiode (16-18 uur) werd het medium vervangen door een vers medium met toevoeging van de onderzoeksmiddelen, en werd de incubatie gedurende 1 dag voortgezet.
In alle gevallen dienden de cellen die onder analoge omstandigheden waren geïncubeerd, maar zonder toevoeging van de agentia, als controle.
Elke agentconcentratie en combinatie van deze agentia werd geëvalueerd in 3 herhalingen (voor de bepaling van de IC50 ) of 5 herhalingen (voor de bepaling van de effecten van 25 mM DCA, 7,8 mM MTF en de combinatie daarvan).
Het aantal levensvatbare cellen aan het begin van de incubatie (N0) en na 1 dag (N24) werd geëvalueerd door directe telling in een hemocytometer met behulp van trypanblauw.
De verdeling van de cellen over de celcyclusfasen en het apoptoseniveau werden beoordeeld door middel van flowcytometrie met propidiumjodide en RNAase A [14]. Het aantal apoptotische cellen werd beoordeeld aan de hand van de sub-G0/G1 piek.
De snelheid van het glucoseverbruik en de snelheid van de lactaatproductie door de tumorcellen werd geschat op basis van het gehalte aan substraten in het incubatiemedium en het aantal levensvatbare cellen aan het begin van de incubatieperiode en na 1 dag.
Het gehalte aan glucose en lactaat werd bepaald in gedeproteïneerde monsters van de supernatanten met behulp van een biochemisch analyseapparaat en commerciële kits voor de bepaling daarvan.
Het interne mitochondriummembraanpotentiaal (Δψm) van de tumorcellen werd bepaald met behulp van flowcytometrie en de kationische kleurstof JC-10 (Sigma, VS) door de verhouding van de fluorescentie-intensiteit in de rode (FL2) en groene (FL1) gebieden.
De doeltreffendheid van de antitumorwerking van de onderzochte stoffen werd beoordeeld aan de hand van de verlenging van de levensduur (LSP) van dieren in de experimentele groepen in vergelijking met de levensduur van dieren in de controlegroep, die werd berekend met de formule:
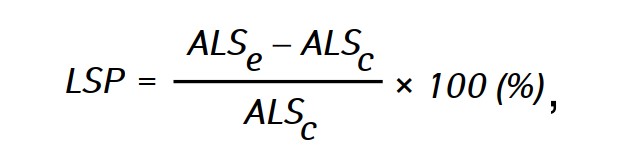
waarbij ALSe en ALSc-de gemiddelde levensduur van ratten in respectievelijk de experimentele en de controlegroep.
Voor histologisch onderzoek werden tumorweefselmonsters van de ratten met glioom C6 gedurende 24 uur gefixeerd in 10% neutraal gebufferde formalineoplossing, gedehydrateerd in alcoholen van oplopende concentraties en ingebed in paraffine. Histologische secties werden gekleurd met hematoxyline-eosine en geanalyseerd met de AxioStarPlusZeiss microscoop.
Statistische analyse van de gegevens werd uitgevoerd met behulp van beschrijvende statistieken, Student’s t-test en Mann- Whitney u-test, niet-lineaire regressieanalyse met behulp van Microsoft Excel en Microcal Origin software. De gegevens worden weergegeven als M ± m, waarbij M de gemiddelde waarde is; m is de standaardafwijking van de gemiddelde waarde.
RESULTATEN EN DISCUSSIE
Wij hebben aangetoond dat MTF de cytotoxische en/of cytostatische activiteit van DCA tegen glioma C6-cellen in vitro aanzienlijk versterkte. In het bijzonder bedroeg de IC50 van DCA bij afzonderlijk gebruik 79,2 ± 2,1 mM, terwijl deze index voor DCA gebruikt in combinatie met MTF zelfs in lage niet-cytotoxische concentratie meer dan driemaal afnam (p < 0,05) (tabel 1, fig. 1). Bovendien, als de necrotische celdood door de werking van DCA en MTF afzonderlijk gebruikt vrij laag was in een breed concentratiebereik van beide middelen en zelfs bij de maximale onderzochte concentraties niet meer dan 15% bedroeg, resulteerde het gebruik van DCA in combinatie met 7,8 mM MTF in een sterke concentratie-afhankelijke toename van het aantal dode cellen, vooral in het bereik van concentraties DCA hoger dan IC50 (Fig. 1, c).
| Agent | DCA | MTF | IC50, mM |
| DCA | 10-100 | – | 79.2 ± 2.1 |
| MTF | – | 7.8-80 | 78.4 ± 4.0 |
| DCA + MTF | 10-40 | 7.8 | 24.0 ± 1.2* |
Opmerking: *p < 0,05 in vergelijking met de overeenkomstige waarde in het geval van eenmalig gebruik.
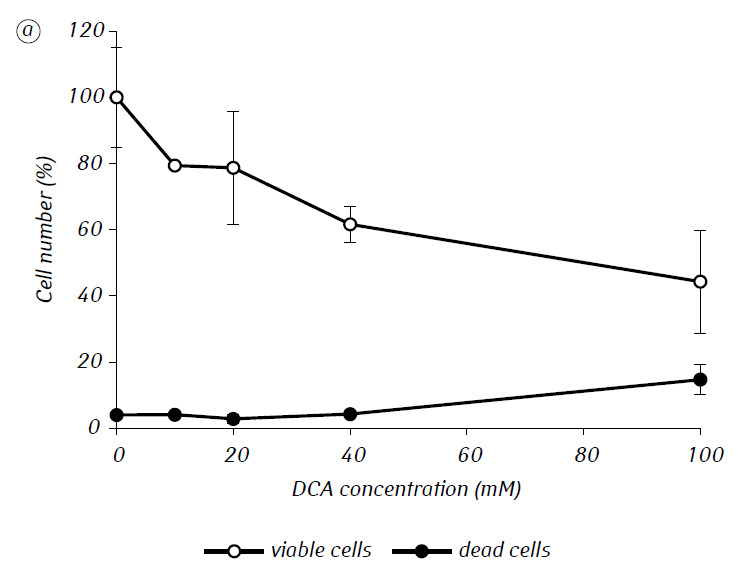
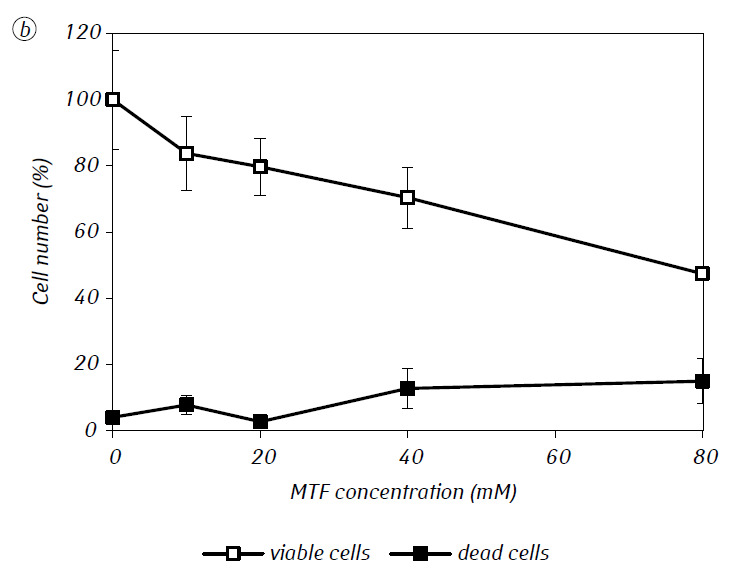
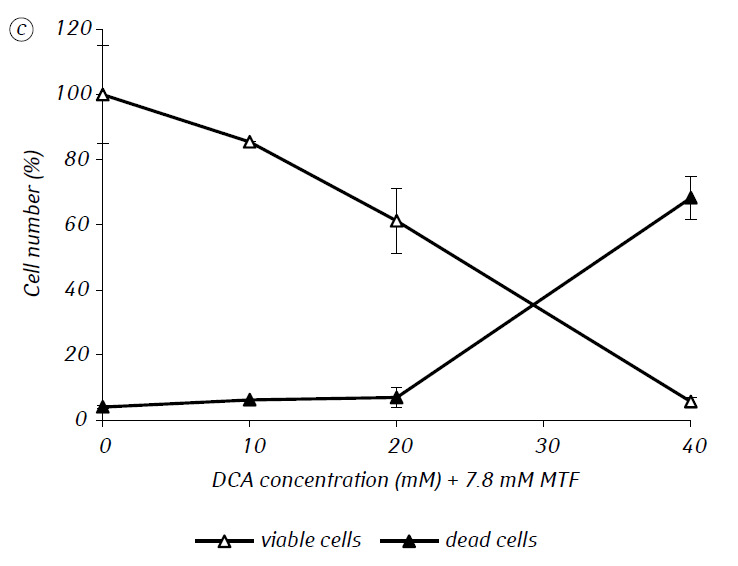
Voor een meer gedetailleerde beoordeling van de synergetische werking van de twee agentia werden de glioma C6-cellen gedurende 1 dag geïncubeerd met 25 mM DCA (concentratie dicht bij IC50) en 7,8 mM MTF (concentratie lager dan IC50), in combinatie en afzonderlijk. De verkregen gegevens over hun invloed op de groeikenmerken van glioma C6-cellen, alsmede de kenmerken die verband houden met hun energiemetabolisme, zijn weergegeven in tabel 2.
| Index | Controle | 25 mM DCA | 7.8 mM MTF | 25 mM DCA+ 7,8 mM MTF |
| Aantal levensvatbare cellen, % | 100.0 ± 5.3 | 91.5 ± 2.3 | 85.3 ± 6.7 | 60.2 ± 2.0 |
| N24/N0 | 1.9 ± 0.1 | 1.8 ± 0.04 | 1.7 ± 0.1 | 1.2 ± 0.04* |
| Necrose, % | 2.6 ± 0.6 | 2.9 ± 0.8 | 5.5 ± 1.6 | 6.9 ± 2.6 |
| Apoptose, % | 5.7 ± 1.3 | 30.2 ± 4.1* | 5.6 ± 2.5 | 18.9 ± 4.4* |
| G0/G1, % | 49.0 ± 2.3 | 49.6 ± 2.2 | 46.2 ± 3.3 | 60.8 ± 1.3* |
| G2/M, % | 30.7 ± 4.3 | 27.5 ± 1.7 | 29.7 ± 2.8 | 28.2 ± 3.07 |
| S, % | 20.3 ± 2.7 | 22.9 ± 1.0 | 21.1 ± 3.3 | 11.0 ± 1.8* |
| Δψm (FL2/FL1) | 0.85 ± 0.15 | 0.97 ± 0.01 | 0.81 ± 0.04 | 0.96 ± 0.01 |
| Het glucoseverbruik, µmol/106 cellen-h | 0.91 ± 0.12 | 0.16 ± 0.02* | 0.46 ± 0.07* | 0.23 ± 0.05* |
| De lactaatproductiesnelheid, µmol/106 cellen-h | 0.53 ± 0.03 | 0.42 ± 0.01* | 1.1 ± 0.02* | 1.06 ± 0.03* |
| ATP-niveau, pmol/106 cellen | 9835 ± 357 | 9819 ± 292 | – | 9379 ± 191 |
Opmerking: *p < 0,05 in vergelijking met de overeenkomstige index in de controle.
Zoals blijkt uit tabel 2, werd de synergetische werking van DCA in combinatie met MTF tegen glioma C6-cellen bevestigd door een scherpe daling van het aantal levensvatbare cellen met bijna 40% (p < 0,05) in vergelijking met de overeenkomstige index in de controle, terwijl bij onafhankelijk gebruik het aantal levensvatbare cellen niet significant werd beïnvloed. Tegelijkertijd was het aantal dode cellen in alle gevallen laag en verschilde het praktisch niet van dat in de controle.
Ook werd geen significant effect van DCA in combinatie met MTF op de inductie van apoptose in glioma C6-cellen vastgesteld. De sterke toename van meer dan driemaal (p < 0,05) van het aantal apoptotische cellen bij gecombineerd gebruik van DCA en MTF trad alleen op door de werking van DCA zelf. Dit laatste werd bevestigd door het hoge niveau van door DCA geïnduceerde apoptose, dat bij afzonderlijk gebruik 5,3 maal (p < 0,05) hoger lag dan de overeenkomstige waarde in de controle (tabel 2).
In tegenstelling tot DCA verhoogde 7,8 mM MTF bij afzonderlijk gebruik de apoptose in deze cellen niet en verminderde het zelfs de gevoeligheid van de cellen voor de proapoptotische werking van DCA bij gecombineerd gebruik. Met name het aantal apoptotische cellen geïnduceerd door de combinatie van DCA en MTF was bijna 1,5 maal lager (p < 0,05) dan door DCA geïnduceerde cellen.
Het synergetisch anti-glioma effect van DCA en MTF werd ook bevestigd door een toename van bijna 24% (p <0,05) van het percentage cellen in de G0/G1-fase en een significante afname van hun fractie (met bijna 46%, p <0,05) in de S-fase, terwijl DCA en MTF afzonderlijk gebruikt geen significant effect hadden op de verdeling van de celcyclusfasen (tabel 2).
De aandacht wordt gevestigd op het feit dat de toevoeging van DCA en MTF, zowel afzonderlijk als in combinatie, de snelheid van het glucoseverbruik significant verminderde. Daarentegen werd de snelheid van de lactaatproductie in de met DCA behandelde cellen sterk verminderd, terwijl deze index in de met MTF behandelde cellen, alleen of in de combinatie, aanzienlijk toenam.
Met name in de met DCA behandelde cellen werd een sterke daling van het glucoseverbruik met 82% (p < 0,05) waargenomen, samen met 21% (p < 0,05) daling van de lactaatproductie in vergelijking met soortgelijke controleparameters. In tegenstelling tot DCA verhoogde MTF de productie van lactaat door tumorcellen aanzienlijk, zowel bij afzonderlijk gebruik als in combinatie met DCA. De snelheid van de lactaatproductie steeg met bijna 108% (p < 0,05) en met 100% (p < 0,05) in cellen die met MTF alleen en in combinatie met DCA werden behandeld, vergeleken met die in de controle. Interessant is dat ondanks het significante effect van DCA en MTF op het metabolisme van tumorcellen, zij het niveau van ATP in tumorcellen praktisch niet verminderden. Zoals blijkt uit tabel 2 verschilde het gehalte aan intracellulair ATP in cellen die alleen of in combinatie met DCA en MTF werden behandeld, niet significant van dat in de controle.
In in vivo experimenten versterkte MTF het antitumoreffect van DCA aanzienlijk, wat resulteerde in de synergie van hun werking. De overlevingscurven van de proefdieren zijn weergegeven in fig. 2. De gemiddelde levensduur van ratten met intracranieel getransplanteerd glioom C6 die alleen met DCA werden behandeld, verschilde praktisch niet van die van de controle, terwijl de toediening van MTF alleen de levensduur van ratten met tumoren aanzienlijk verlengde met bijna 20% (p < 0,01). Gecombineerd gebruik van DCA en MTF resulteerde in een significante toename van hun anti-glioma-effecten, hetgeen werd bevestigd door een significante verlenging van de levensduur van de dieren met 50% (p < 0,001) en met meer dan 26% (p < 0,05) in vergelijking met deze index in de controlegroep en in de groep ratten die alleen MTF toegediend kregen.
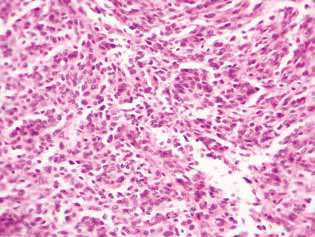
Histologisch onderzoek van het tumorweefsel van ratten met glioom C6 bracht enkele veranderingen in de structuur ervan aan het licht, die correleerden met de hoge efficiëntie van de antigliomawerking van de onderzochte middelen. Bij controledieren ontwikkelde de tumor zich meestal in de moleculaire of lagere lagen van de hersenschors. Morfologisch werd de neoplasiezone vertegenwoordigd door de accumulatie van grote cellen en kernen van uiteenlopende vorm, hyperchroom of met een matig chromatinegehalte. In de bestudeerde monsters waren cellulaire polymorfie en de aanwezigheid van multi-nucleus grote cellen typisch. Tumorcellen hebben in de regel een langwerpige vorm met cytoplasma, met vezelachtige structuren, en goed geexprimeerde kernen. Sommige cellen waren kleiner, afgerond, met dichte hyperchrome kernen (fig. 3).
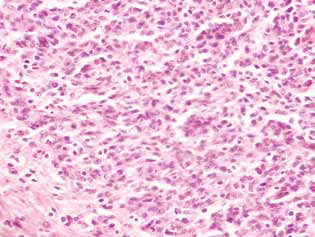
Bij ratten behandeld met DCA en MTF alleen of in combinatie, werd in het tumorweefsel een accumulatie van apoptotische cellen of cellen met hyperchrome ringvormige structuren in de kernperiferie waargenomen als bewijs van activering van apoptose. Opgemerkt zij dat deze verschijnselen veel meer tot uiting kwamen bij gecombineerd gebruik van de middelen (fig. 4).
Een duidelijke manifestatie van de anti-glioma werking van DCA in combinatie met MTF was een significante afname van satellietgebieden in het hersenweefsel (Fig. 5). In de controlegroep dieren bevonden de satellietstructuren zich in de buurt van de hoofdknoop van de tumor en kwamen ze vrij veel voor. Rond de verschillende kwaadaardige cellen die uit het hoofdtumorweefsel migreerden, werd duidelijk het proces van neoplastische angiogenese op gang gebracht, dat leidde tot de vorming van een bloedvat en de vorming van een meerlagige rand van de kwaadaardige cellen eromheen, die vervolgens gepaard ging met het samensmelten van dergelijke structuren met de hoofdlaesie en een toename van de tumorgrootte (Fig. 5, a).
Bij dieren die DCA in combinatie met MTF kregen, werd daarentegen een sterke afname van de vorming van satelliettumorlaesies waargenomen, wat te wijten kan zijn aan de onderdrukking van neoangiogenese en het onvermogen om nieuwe plaatsen van neoplastische groei te vormen (fig. 5, b). Bovendien kwam de tumorpathomorfose bij dieren die DCA in combinatie met MTF kregen tot uiting in de aanwezigheid van duidelijk verwoeste tumorlaesies (fig. 6) en een voldoende groot aantal vernietigde en verwoeste bloedvaten in het tumorweefsel (fig. 7).
Bijgevolg was de significante remming van de glioma C6-celproliferatie in vitro door het gecombineerde gebruik van 25 mM DCA en 7,8 mM MTF, in tegenstelling tot de geringe celdood, voornamelijk te wijten aan hun cytostatische werking. De cytostatische component in het synergetische effect van DCA en MTF met betrekking tot glioma C6-cellen werd ook bevestigd door de significante accumulatie van cellen in de G0/G1-fase en de afname van hun fractie in de S-fase.
Blijkbaar werd de versterking van de anti-glioma werking van DCA en MTF door hun combinatie veroorzaakt door hun multidirectionele effecten op het energiemetabolisme van de tumorcellen. Met name de lactaatproductie in glioma C6-cellen zonder toevoeging van enig middel (controle) was bijna tweemaal zo laag als de glucoseconsumptie. Een dergelijke correlatie tussen deze indexen wees erop dat in deze cellen niet alleen de glycolytische omzetting van glucose in lactaat plaatsvindt, maar ook een vrij hoge activiteit van oxidatieve fosforylering en anabole processen van synthese van biomoleculen.
In met DCA behandelde cellen wees een scherpe daling van het glucoseverbruik samen met een gelijktijdige daling van de lactaatproductie erop dat DCA bij een concentratie van 25 mM in staat was zijn potentieel als kinase-pyruvaatdehydrogenaseremmer waar te maken en de intensiteit van de mitochondriale ademhaling te verhogen en indirect de glycolyse in deze cellen te onderdrukken.
Een sterke afname van het glucoseverbruik in glioomcellen door de werking van DCA werd in verband gebracht met de uitgesproken apoptose-inducerende activiteit. Ondanks het aanzienlijke pro-apoptotische effect van DCA en de verschuiving van het cellulaire metabolisme naar mitochondriale ademhaling, werden geen duidelijke veranderingen in de membraanpotentiaal van het interne membraan van de mitochondriën in glioma C6-cellen vastgesteld.
In tegenstelling tot DCA werd in tumorcellen die met MTF werden behandeld een aanzienlijke toename van de lactaatproductie geconstateerd, zowel bij afzonderlijk gebruik als in combinatie met DCA. Uiteraard gebeurde dit door remming van complex I van de elektronentransportketen van mitochondriën door MTF [15], zelfs in lage niet-giftige concentraties. Rekening houdend met het feit dat activering van de glycolyse gewoonlijk de verwerving van resistentie van tumorcellen tegen pro-apoptotische prikkels bevordert [16], kan de meer dan 1,5 maal zo grote daling van de door DCA veroorzaakte apoptose bij gecombineerd gebruik van de middelen althans gedeeltelijk worden toegeschreven aan de door MTF veroorzaakte activering van de aërobe glycolyse in glioma C6-cellen.
In het geval van de combinatie van DCA en MTF werd de door MTF veroorzaakte wijziging van het energiemetabolisme in grotere mate doorgevoerd. Gezien de hoge lactaatproductie door cellen die met MTF alleen of in combinatie met DCA werden behandeld, kan worden geconcludeerd dat in het laatste geval de door MTF geïnduceerde glycolyse de overhand had op het door DCA geïnduceerde mitochondriale metabolisme in de tumorcellen.
Opgemerkt zij dat ondanks het significante effect op het tumormetabolisme van DCA en MTF, afzonderlijk of in combinatie gebruikt, zij het ATP-niveau in tumorcellen vrijwel niet verminderden. Het ontbreken van veranderingen in het ATP-niveau in tumorcellen als gevolg van het effect van DCA en MTF alleen en in combinatie wijst op de uitvoering van compensatoire reacties in de cellen om de energievoorziening van de cel op peil te houden en op een voldoende hoge metabole plasticiteit van deze cellen.
Eerder hebben wij aangetoond dat het antitumoreffect van energiestofwisselingsmodificatoren, met name MTF, sterk afhangt van de micro-omgeving van de tumorcellen en radicaal kan verschillen van de in vitro effecten [17]. In deze studies werd het synergisme van de anti-glioma activiteit van DCA in combinatie met MTF niet alleen in vitro maar ook in vivo vastgesteld.
In vivo resulteerde de hoge anti-tumorwerking van de combinatie van DCA en MTF in een aanzienlijke verlenging van de gemiddelde levensduur van ratten met tumoren. Volgens het histologisch onderzoek van tumorweefsel van ratten met glioom C6 is een belangrijke bijdrage aan de anti-gliomawerking van DCA en MTF geleverd door hun vermogen om bij gecombineerd gebruik apoptose te induceren. Hoewel in vitro geen toename van de pro-apoptotische werking van de combinatie van DCA en MTF werd waargenomen (hetgeen kennelijk verband hield met een vrij lage onderzochte concentratie van laatstgenoemde), wezen histologische gegevens op hun vermogen om synergetisch apoptose in de tumoren te induceren. In het werk [18] werd het synergisme van de pro-apoptotische werking van deze twee middelen ook aangetoond met betrekking tot ovariumtumorcellen.
Naast de pro-apoptotische werking werd de hoge efficiëntie van het anti-glioma effect van DCA in combinatie met MTF in verband gebracht met een afname van de mate van tumorinvasie en de vernietiging van de bloedvaten in de tumor. Dit laatste kan leiden tot een tekort aan voedingsstoffen, met name glucose, in de tumormicro-omgeving, wat resulteert in de onderdrukking van de tumorgroei.
De hogere antitumorwerking van de combinatie van DCA en MTF kan ook het gevolg zijn van de betrokkenheid van aanvullende werkingsmechanismen van de agentia, waaronder hun werking op normale lichaamscellen, die de niveaus van voedingssubstraten in de tumormicro-omgeving, met name in het bloed, aanzienlijk kunnen wijzigen. Dit geldt voor MTF, dat via de activering van AMP-geactiveerd proteïnekinase in staat is het glucose- en lipidenmetabolisme van hepatocyten en skeletspieren te beïnvloeden [19], en voor DCA, dat algemeen bekend staat als doeltreffend in het verlagen van het lactaatgehalte [20]. In het bijzonder hebben wij eerder aangetoond dat DCA in combinatie met MTF de niveaus van lactaat en glucose in het bloed van ratten verlaagt, hetgeen correleert met hun antitumoractiviteit [ 21]. Het is ook mogelijk dat een zekere bijdrage aan het anti-glioma effect van de combinatie van DCA en MTF is dat zij in staat zijn bloedarmoede en trombocytopenie die zich ontwikkelen tegen de achtergrond van de groei van glioom C6 bij ratten te corrigeren [21].
De gepresenteerde gegevens wezen dus op het synergisme van de anti-gliomawerking van DCA en MTF bij gecombineerd gebruik, zowel in vitro als in vivo, en kunnen worden beschouwd als een uitgangspunt voor de ontwikkeling van effectieve behandelingsschema’s voor kwaadaardige hersentumoren op basis van gecombineerd gebruik van DCA en MTF.
REFERENTIES
1 1. Taal W, Bromberg JE, van den Bent MJ. Chemotherapie bij glioom. CNS Oncol 2015; 4: 179-92.
2 Chowdhary MM, Ene CI, Silbergeld DL. Behandeling van gliomen: hoe zijn we hier gekomen? Surg Neurol Int 2015; 6: S85-8.
3 Wang Y, Xing D, Zhao M, et al. The role of a single angiogenesis inhibitor in the treatment of recurrent glioblastoma multiforme: a meta-analysis and systematic review. PLoS One 2016; 11: e0152170.
4 Ameratunga M, Pavlakis N, Wheeler H, et al. Antiangiogene therapie voor hooggradig glioom. Cochrane Database Syst Rev 2018; 11: CD008218.
5 Agnihotri S, Zadeh G. Metabolic reprogramming in glioblastoma: the influence of cancer metabolism on epigenetics and unanswered questions. Neuro-Oncol 2016; 18: 160-72.
6 Weber GF. Tijd en omstandigheden: kankercelmetabolisme in verschillende stadia van ziekteprogressie. Front Oncol 2016; 6: 257.
7 Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer. Br J Cancer 2003; 89: 1375-82.
8 Seliger C, Meyer A-L, Renner K, et al. Metformine remt proliferatie en migratie van glioblastoomcellen onafhankelijk van TGF-β2. Cell Cycle 2016; 15: 1755-66.
9 Sesen J, Dahan P, Scotland SJ, et al.Metformine remt de groei van menselijke glioblastoomcellen en verbetert de therapeutische respons. PLoS One 2015; 10: e0123721.
10 Seliger C, Renner K. P08.52 Metformine als adjuvante therapie voor glioom. Neuro-Oncology 2017; 19: iii65.
11 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010; 2: 31ra34.
12 Duan Y, Zhao X, Ren W, et al. Antitumor activity of dichloroacetate on C6 glioma cell: in vitro and in vivo evaluation. Onco Targets Ther 2013; 6: 189-98.
13 Fedorchuk AG, Pyaskovskaya ON, Gorbik GV, et al. Effectiviteit van natriumdichlooracetaat tegen glioom C6 is afhankelijk van toedieningsschema en dosering. Exp Oncol 2016; 38: 80-3.
14 Nicoletti I, Migliorati G, Pagliacci MC, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods 1991; 139: 271-80.
15 Wheaton WW, Weinberg SE, Hamanaka RB, et al. Metformine remt mitochondriaal complex I van kankercellen om tumorigenese te verminderen. eLife 2014; 3: e02242.
16 Michelakis ЕD, Websterl L, Mackey JR. Dichlooracetaat (DCA) als een potentiële metabool-gerichte therapie voor kanker. Br J Cancer 2008; 99: 989-94.
17 Pyaskovskaya ON, Kolesnik DL, Fedorchuk AG, et al. Cytotoxische activiteit van metformine in vitro correleert niet met zijn antitumorwerking in vivo. Exp Oncol 2017; 39: 264-8.
18 Bo Li, Xinzhe Li, Zhenhong Ni, et al. Dichlooracetaat en metformine onderdrukken synergetisch de groei van eierstokkankercellen. Oncotarget 2016; 7: 59458-90.
19 Zhou G,Myers R, Li Y, et al. Rol van AMP-activated protein kinase in mechanisme van metformine werking. J Clin Invest 2001; 108: 1167-74.
20 Abdelmalak M, Lew A, Ramezani R, et al. Langdurige veiligheid van dichlooracetaat bij congenitale melkziekte. Mol Genet Metab 2013; 109: 139-43.
21 Prokhorova IV, Pyaskovskaya ON, Kolesnik DL, Solyanik GI. Invloed van metformine, natriumdichlooracetaat en hun combinatie op de hematologische en biochemische bloedparameters van ratten met glioom C6. Exp Oncol 2018; 40: 205-10.