Dana F. Flavin1, 2
1Klinikim Alpenpark, Defreggerweg 2-6, Ringsee, 83707 Tegernsee, Alemania
2 Foundation for Collaborative Medicine and Research, 24 Midwood Drive, Greenwich, CT 06830, EE.UU
La correspondencia debe dirigirse a Dana F. Flavin, [email protected]
Recibido: 4 de junio de 2010
Aceptado: 23 de julio de 2010
Editor académico: Michael A. Carducci
Copyright © 2010 Dana F. Flavin. Este es un artículo de acceso abierto distribuido bajo la Licencia de Atribución Creative Commons, que permite el uso, distribución y reproducción sin restricciones en cualquier medio, siempre que se cite adecuadamente el trabajo original.
En junio de 2007, un paciente de 48 años de edad, de sexo masculino, con diagnóstico de estadio 4 de linfoma folicular no Hodgkin (LNH), fue tratado durante 3 meses con quimioterapia convencional que resulta en una remisión completa. Casi un año después, los tumores reaparecieron en la nasofaringe y los ganglios linfáticos del cuello. Rechazando todas las quimioterapias sugeridas, el paciente comenzó a autoadministrarse dicloroacetato (DCA) 900 mg al día, con una PET que mostraba una remisión completa cuatro meses después. Desde su último escáner PET, en mayo de 2009, sigue libre de tumores gracias al uso continuado de DCA.
INTRODUCCIÓN
El linfoma no Hodgkin (LNH), un cáncer del sistema linfático que puede originarse en cualquier parte del cuerpo, afecta a más de 400.000 personas en Estados Unidos, con 66.000 nuevos casos en 2009 [1]. El LNH suele presentarse como fiebre baja con sudoración, inflamación de los ganglios linfáticos, malestar general y fatiga. Aunque responde bien a los tratamientos establecidos, como la quimioterapia y la radioterapia [2], se están desarrollando nuevos tratamientos más agresivos, como la quimioterapia con radiación a todo el cuerpo seguida de trasplantes de células madre [3]. Si bien estos tratamientos han logrado la remisión completa en algunos pacientes [4], otros, conscientes de los riesgos para la calidad de vida que conllevan las terapias agresivas [3], buscan vías alternativas de tratamiento con profesionales o por su cuenta, muchas de ellas no convencionales o en fase experimental. Una de estas terapias es el dicloroacetato (DCA) [5].
El DCA es un subproducto de la cloración del agua [6, 7 ] que inhibe la glucólisis aeróbica. Se ha utilizado en medicina durante más de 30 años [ 8] como fármaco en investigación para tratar trastornos metabólicos graves como la diabetes y la hipercolesterolemia [5, 9 ], así como para el tratamiento de la acidosis láctica congénita en niños norteamericanos [10]. La biodisponibilidad [11 ] y la farmacocinética [12 ] del DCA se han investigado a fondo durante varias décadas en adultos [6], niños [13, 14] y animales [15]. Como medicamento, el DCA suele tolerarse bien a partir de dosis de entre 10 mg/Kg y 50 mg/Kg, aunque la exposición prolongada se asocia a neuropatía periférica [16]. Su activación de la enzima piruvato deshidrogenasa (PDH) de la mitocondria disminuye la glucólisis y reactiva la oxidación de la glucosa, un enfoque favorable para mejorar la acidosis láctica [9].
Las células cancerosas utilizan predominantemente un sistema de glucólisis para obtener energía en lugar de la oxidación de la glucosa utilizada por las células sanas. El cáncer parece ser una forma de acidosis láctica intracelular causada por un bloqueo en la oxidación de la glucosa a nivel de la PDH (piruvato deshidrogenasa). El metabolismo glucolítico de la glucosa aumenta el ácido láctico de las células cancerosas y reduce el pH intracelular [7] , lo que provoca cambios importantes en la bioquímica intracelular. La glucólisis aeróbica, conocida como «efecto Warburg» [17], inactiva la respiración mitocondrial, lo que permite el crecimiento de las células cancerosas [18]. El DCA invierte esta glucólisis causando varios cambios perjudiciales importantes en las células tumorales cancerosas.
En primer lugar, el DCA inhibe la piruvato deshidrogenasa quinasa (PDK). La PDK bloquea la piruvato deshidrogenasa (PDH) a través de su actividad de fosforilación. Cuando esta quinasa es inhibida por el DCA, la PDH se reactiva causando que la mitocondria ya no esté hiperpolarizada, en su lugar la membrana y la mitocondria se despolarizan, reactivando los canales de K+ mitocondriales que entonces disminuyen el K+ citosólico. Cuando la PDH es inhibida en las células cancerosas por la PDK, se produce un exceso de K+ citosólico que inactiva las caspasas 3 y 9, factores importantes en la apoptosis. El DCA reactiva estas caspasas junto con un aumento del H2O2 intracelular, lo que permite la liberación del citocromo c de las mitocondrias. La liberación de citocromo c es un importante paso activador de la apoptosis celular, ya que desencadena la cascada de caspasas [19]. Los resultados del DCA en los cánceres se observan tanto in vitro como in vivo. Estos efectos no se observan en las células normales.
Otro efecto importante del dicloroacetato en las células cancerosas es la liberación de calcio mitocondrial (Ca++). El aumento de Ca++ en las células cancerosas está asociado al aumento y proliferación de los factores de transcripción. El calcio también activa la ornitina descarboxilasa, la enzima limitante de la velocidad de síntesis del ADN [20], y el factor antiapoptosis NFAT (factor nuclear de los linfocitos T activados) [21]. Cuando el calcio disminuye con la introducción del DCA, la célula se dirige aún más hacia la apoptosis y hacia una disminución de la replicación celular. Además de que el DCA provoca un cambio importante en las mitocondrias, el citoplasma y la membrana celular [19], el efecto final del DCA es una detención del ciclo celular en la fase Gap 1 (G1), lo que también aumenta la apoptosis [22].
Materiales y método
Tras ser tratado con éxito con seis tratamientos de Rituxan más el régimen CHOP (ciclofosfamida, clorhidrato de doxorrubicina, vincristina y prednisolona) durante un periodo de tres meses en 2007, una tomografía por emisión de positrones (PET) mostró una remisión completa del LNH. Sin más tratamientos en agosto de 2008, la PET mostró la reaparición de sus tumores en la nasofaringe y los ganglios linfáticos del cuello, que presentó con fiebre baja de 99,8, sudoración y fatiga.
El paciente con linfoma no Hodgkin rechazó la terapia convencional, en su lugar obtuvo personalmente dicloroacetato (DCA) que comenzó a autoadministrarse 900 mg diarios a 10 mg/kg en agosto de 2008, añadiendo 750 mg diarios de tiamina para proteger sus nervios de la toxicidad [15, 23]. Cuatro meses después, un escáner PET mostró una remisión completa (véase la Figura 2). Ha permanecido libre de tumores con el régimen continuado de DCA y tiamina desde su última PET en mayo de 2009. Los análisis de sangre mensuales muestran que todos sus parámetros son normales.
Resultados
En agosto de 2008, un paciente de LNH, que había estado en remisión durante casi un año tras la quimioterapia, se quejó de dolor y sensibilidad en la zona del cuello, donde se apreciaban protuberancias al examinarle. Se le realizó una PET para investigar la naturaleza del problema y la extensión de la afectación linfática.
La figura 1 muestra varios focos hipermetabólicos nuevos dentro de la cabeza y el cuello compatibles con linfoma recurrente; hipermetabolismo nuevo en la cara postlateral derecha de la nasofaringe, que mide 3,2 × 2,2 cm; adenopatía hipermetabólica nueva dentro del cuello derecho que afecta a la región yugulodigástrica derecha, la cadena yugular derecha y el triángulo posterior derecho que se extiende hasta la base del cuello; el ganglio más grande mide aproximadamente 1.9 × 1,9 cm; varios ganglios linfáticos hipermetabólicos más pequeños en el triángulo posterior extendiéndose hasta la base del cuello; una única zona focal de hipermetabolismo dentro del triángulo posterior izquierdo correspondiente a un pequeño ganglio linfático que medía 1,0 × 0,5 cm.
Cuatro meses después de la automedicación diaria de la paciente con 750 mg de DCA, un escáner PET no mostró signos visibles de linfoma. Los síntomas desaparecieron al cabo de varias semanas y los resultados de la PET 4 meses más tarde en la figura 2 muestran que los focos de actividad anormal observados anteriormente en la nasofaringe y el cuello se habían resuelto; no se observaron focos anormales de actividad metabólica; no hay indicios de enfermedad recurrente.

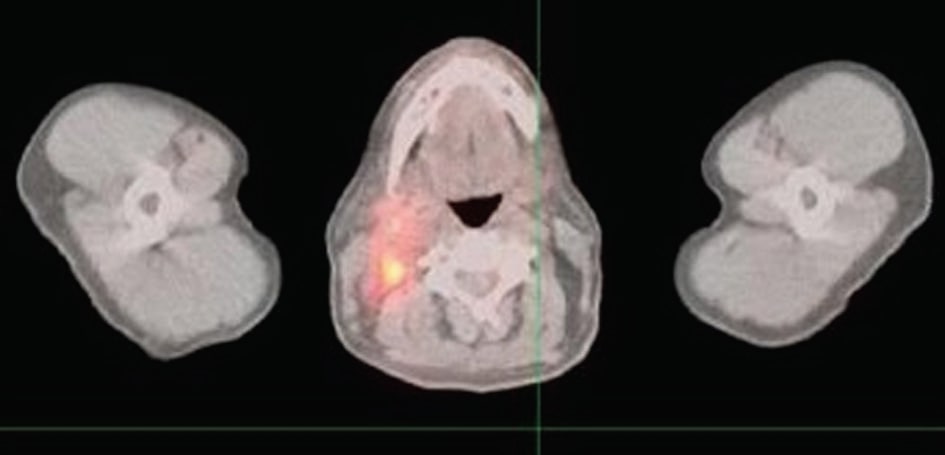
Discusión
La comunidad médica está viendo cada vez más pacientes que buscan formas de terapia por su cuenta con resultados variables; algunos son deletéreos y ponen en peligro mientras que otros pueden prolongar su vida, pero aun así deben hacerse bajo supervisión médica. Es comprensible que los médicos a menudo no puedan aconsejar o administrar éticamente el uso de las preferencias de los pacientes, dejándoles a su suerte. Aunque este caso, y otros anecdóticos, tuvieron un resultado satisfactorio que podría explicarse por la amplia investigación existente sobre la farmacología y toxicología del tratamiento con dicoloroacetato que eligió el paciente, la aplicación del compuesto en pacientes con cáncer sigue siendo objeto de investigación. Actualmente estamos estudiando muestras tumorales in vitro para comprobar la sensibilidad al DCA. También estamos buscando parámetros de laboratorio para una posible correlación de laboratorio en respondedores a niveles específicos de enzimas ya que los cánceres de algunos pacientes responden positivamente o se resuelven, el DCA no parece no ser específico del tipo de tumor.
Las células tumorales utilizan preferentemente la glucólisis para generar trifosfato de adenosina (ATP) incluso en presencia de oxígeno, un fenómeno conocido como glucólisis aeróbica o el «Efecto Warburg» [17]. La piruvato deshidrogenasa (PDH), una enzima que mantiene la puerta de entrada del piruvato en el ciclo mitocondrial del ácido tricarboxílico (TCA) [24], es inhibida en las células cancerosas por la fosforilación de la enzima piruvato deshidrogenasa cinasa (PDK) [18]. Esta inhibición de la PDH por la PDK provoca un cambio de la oxidación de la glucosa a la glucólisis, lo que favorece el crecimiento tumoral [19]. Se ha demostrado que el DCA bloquea esta fosforilación por PDK a nivel de la membrana mitocondrial y disminuye la glucólisis a favor de la oxidación de la glucosa. Este retorno a un metabolismo normal de la glucosa permite cambios importantes incluyendo una disminución del Ca++ intracelular, y la estabilización de las mitocondrias permitiendo una reactivación de las caspasas en las células cancerosas que conduce a la apoptosis [19].
Los efectos del DCA, causados por la reactivación de la respiración mitocondrial, no están exentos de complicaciones, aunque inexplicablemente parecen limitarse predominantemente a las células cancerosas, mientras que la mayoría de las células normales no se ven afectadas [24]. Un daño nervioso mínimo y reversible puede reducirse considerablemente mediante una ingesta diaria de tiamina de varios cientos de miligramos en humanos [23] y animales [15]. La cantidad de tiamina varía de 50 mg/día a 100 mg/día dependiendo de si se administra por vía oral o se inyecta intramuscularmente [23].
Corregir la disfunción mitocondrial puede ser uno de los principales objetivos farmacológicos futuros para tratar muchas enfermedades, ya que la disfunción mitocondrial de muchas enfermedades parece ser un denominador patológico común. La acidosis láctica también se observa como complicación en la malaria [25], lo que indica una implicación mitocondrial, y más recientemente en el Síndrome de Fatiga Crónica [26]. También se ha demostrado que el DCA ayuda considerablemente en la diabetes [27 ] y la hipercolesterolemia familiar [28].
Conclusión
Un paciente con linfoma no Hodgkin que tomaba por su cuenta 10 mg/kg [750 mg] de dicloroacetato al día, tuvo una remisión completa de su cáncer de linfoma no Hodgkin al cabo de cuatro meses que ha continuado hasta la fecha manteniendo su dosis de DCA además de tomar 750 mg de tiamina para protegerse del ligero hormigueo y entumecimiento de los nervios de los dedos de manos y pies, sin comprometer su calidad de vida ni afectar a la eficacia del tratamiento. Haciendo caso omiso del consejo médico de no automedicarse, ha continuado con su régimen de DCA/tiamina, manifestando su preocupación de que la interrupción del DCA pueda permitir una recurrencia de la enfermedad.
Hay muy pocos datos para sacar conclusiones absolutas sobre el uso del DCA para el cáncer. Es necesario realizar investigaciones controladas para validar y confirmar la eficacia del DCA y sus niveles de mantenimiento en el espectro de terapias contra el cáncer.
Conflicto de intereses
El autor no declara ningún conflicto de intereses. El autor es el único responsable del contenido y la redacción del artículo.
Agradecimientos
Se agradece la ayuda de Jimmy Xu de la Universidad Carnegie Mellon. Este trabajo ha contado con el apoyo de la Fundación Valerie Beth Schwartz.
REFERENCIAS
1 Linfoma no Hodgkin, Instituto Nacional del Cáncer, Institutos Nacionales de Salud de EE. UU., Rockville, Md, EE. UU., mayo de 2009, http://www.cancer.gov/cancertopics/types/non-hodgkin.
2 J. O. Armitage y D. L. Longo, «Malignancies of lymphoid cells», en Harrisons’s Principles of Internal Medicine, D. L. Kasper, E. Braunwald y A. S. Fauci, Eds., págs. 642-655, McGraw Hill, Nueva York, NY, EE. UU., 16.ª edición, 2005.
3 E. Kimby, L. Brandt, P. Nygren y B. Glimelius, «A systematic overview of chemotherapy effects in aggressive non-Hodgkin’s lymphoma», Acta Oncologica, vol. 40, nº 2-3, pp. 198-212, 2001.
4 N. G. Mikhaeel, «Use of FDG-PET to monitor response to chemotherapy and radiotherapy in patients with lymphomas», European Journal of Nuclear Medicine and Molecular Imaging, vol. 33, nº 13, suplemento 1, pp. 22-26, 2006.
5 J. M. Donohue, H. Galal-Gorchev, W. Brattin, J. J. Liccione y K. B. Altshuler, Toxicological Review of Dichloroacetic Acid, Integrated Risk Information System, U.S. EPA, Washington, DC, EE.UU., agosto de 2003.
6 I. R. Schultz y R. E. Shangraw, «Effect of short-term drinking water exposure to dichloroacetate on its pharmacokinetics nd oral bioavailability in human volunteers: a stable isotope study», Toxicological Sciences, vol. 92, nº 1, pp. 42-50, 2006.
7 P. W. Stacpoole, G. N. Henderson, Z. Yan y M. O. James, «Clinical pharmacology and toxicology of dichloroacetate», Environmental Health Perspectives, vol. 106, suplemento 4, pp. 989-994, 1998.
8 P. W. Stacpoole, A. C. Lorenz, R. G. Thomas y E. M. Harman, «Dichloroacetate in the treatment of lactic acidosis», Annals of Internal Medicine, vol. 108, nº 1, pp. 58-63, 1988.
9 P. W. Stacpoole, «The pharmacology of dichloroacetate,» Metabolism, vol. 38, nº 11, pp. 1124-1144, 1989.
10 P. W. Stacpoole, L. R. Gilbert, R. E. Neiberger et al., «Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate,» Pediatrics, vol. 121, no. 5, pp. e1223-e1228, 2008.
11 S. H. Curry, A. Lorenz, P.-I. Chu, M. Limacher, y P. W. Stacpoole, «(DCA) and oxalate following oral DCA doses,» Biopharmaceutics and Drug Disposition, vol. 12, no. 5, pp. 375- 390, 1991.
12 M. Jia, B. Coats, M. Chadha et al., «Human kinetics of orally and intravenously administered low-dose 1,2-(13)Cdichloroacetate,» Journal of Clinical Pharmacology, vol. 46, nº 12, pp. 1449-1459, 2006.
13 K. Berendzen, D. W. Theriaque, J. Shuster, y P. W. Stacpoole, «Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency,» Mitochondrion, vol. 6, no. 3, pp. 126-135, 2006.
14 P. W. Stacpoole, D. S. Kerr, C. Barnes et al., «Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children,» Pediatrics, vol. 117, no. 5, pp. 1519- 1531, 2006.
15 P. W. Stacpoole, H. J. Harwood Jr., D. F. Cameron et al., «Chronic toxicity of dichloroacetate: possible relation to thiamine deficiency in rats,» Fundamental and Applied Toxicology, vol. 14, nº 2, pp. 327-337, 1990.
16 P. W. Stacpoole, T. L. Kurtz, Z. Han y T. Langaee, «Role of dichloroacetate in the treatment of genetic mitochondrial diseases», Advanced Drug Delivery Reviews, vol. 60, nº 13-14, pp. 1478-1487, 2008.
17 O. Warburg, F. Wind y E. Negelein, «Uber den Sto ¨ ffwechsel von Tumoren im Korper», ¨ Journal of Molecular Medicine, vol. 5, nº 19, pp. 829-832, 1926.
18 E. D. Michelakis, L. Webster y J. R. Mackey, «Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer», British Journal of Cancer, vol. 99, nº 7, pp. 989-994, 2008.
19 S. Bonnet, S. L. Archer, J. Allalunis-Turner y otros, «A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth», Cancer Cell, vol. 11, nº 1, pp. 37-51, 2007.
20 R. K. Boutwell, «Biochemical mechanism of tumor promotion,» in Carcinogensis Mechanisms of Tumor Promotion and Cocarcinogenesis, T. J. Slaga, A. Sivak, and R. K. Boutwell, Eds., pp. 29-58, Raven press, New York, NY, USA, 1978.
21 J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C. Munshi e I. De Vivo, «Dichloroacetate induces apoptosis in endometrial cancer cells», Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
22 W. Cao, S. Yacoub, K. T. Shiverick et al., «Dichloroacetate (DCA) sensitizes both wild-type and over expressing bcl-2 prostate cancer cells in vitro to radiation,» Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
23 L. Spruijt, R. K. Naviaux, K. A. McGowan y otros, «Nerve conduction changes in patients with mitochondrial diseases treated with dichloroacetate,» Muscle and Nerve, vol. 24, nº 7, pp. 916-924, 2001.
24 J. G. Pan y T. W. Mak, «Metabolic targeting as an anticancer strategy: dawn of a new era?» STKE de Science, vol. 2007, no. 381, p. pe14, 2007.
25 S. Krishna, T. Agbenyega, B. J. Angus et al., «Pharmacokinetics and pharmacodynamics of dichloroacetate in children with lactic acidosis due to severe malaria,» QJM, vol. 88, no. 5, pp. 341-349, 1995.
26 S. Myhill, N. E. Booth y J. McLaren-Howard, «Chronic fatigue syndrome and mitochondrial dysfunction», International Journal of Clinical and Experimental Medicine, vol. 2, n.º 1, pp. 1-16, 2009.
27 P. W. Stacpoole, G. W. Moore y D. M. Kornhauser, «Metabolic e ffects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia», New England Journal of Medicine, vol. 298, nº 10, pp. 526-530, 1978.
28 G. W. Moore, L. L. Swift, and D. Rabinowitz, «Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate,» Atherosclerosis, vol. 33, no. 3, pp. 285-293, 1979.