Jingtao Tong, Ganfeng Xie, Jinxia He, Jianjun Li, Feng Pan, and Houjie Liang
Отделение онкологии, Юго-западный госпиталь, Третий военно-медицинский университет, улица Гаотаньян, 29, Чунцин 400038, Китай
Корреспонденцию следует направлять Хоуцзе Лян, [email protected] Получено 27 мая 2010 г.; пересмотрено 29 декабря 2010 г.; принято 13 января 2011 г
Академический редактор: Мигель А. Андраде
Copyright © 2011 Jingtao Tong et al. Это статья с открытым доступом, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение в любой среде при условии надлежащего цитирования оригинальной работы.
Дихлорацетат (DCA), ингибитор киназы пируватдегидрогеназы (PDK), недавно был продемонстрирован как перспективный нетоксичный антинеопластический агент, способствующий апоптозу раковых клеток. В данном исследовании мы стремились изучить противоопухолевый эффект DCA в сочетании с 5-фторурацилом (5-ФУ) на клетки колоректального рака (КРР). Четыре клеточные линии CRC человека обрабатывали DCA, 5-FU или комбинацией DCA и 5-FU. Жизнеспособность клеток определяли методом 3-(4,5-диметилтиазол-2-ил)- 2,5-дифенилтетразолия бромида. Взаимодействие между DCA и 5-FU оценивали по принципу медианного эффекта. Иммуноцитохимия с бромдезоксиуридином (BrdU) проводилась для определения пролиферации клеток CRC. Клеточный цикл и апоптоз измеряли с помощью проточной цитометрии, а экспрессию молекул, связанных с апоптозом, оценивали с помощью вестерн-блота. Наши результаты показали, что DCA подавлял жизнеспособность клеток CRC и обладал синергетическим антипролиферативным действием в комбинации с 5-FU. Более того, по сравнению с 5-ФУ, апоптоз клеток CRC, обработанных DCA и 5-ФУ, был усилен и продемонстрирован изменениями белков Bcl-2, Bax и каспазы-3. Наши результаты свидетельствуют о том, что DCA оказывает синергическое противоопухолевое действие с 5-ФУ на клеточные линии CRC in vitro.
1. Введение
Колоректальный рак является одним из наиболее распространенных злокачественных новообразований во всем мире [1]. Помимо хирургического вмешательства, лечение пациентов с КРР в основном основывается на химиотерапии, особенно пациентов с распространенным КРР. Среди химиотерапевтических препаратов для лечения РПК, 5-фторурацил (5-ФУ), который является классическим химиотерапевтическим препаратом, был первой линией лечения РПК в течение нескольких десятилетий [2, 3]. Однако сам по себе 5-ФУ обладает низкой избирательностью в отношении опухоли, а также высокой токсичностью для костного мозга, желудочно-кишечного тракта и кожи при использовании в терапевтической дозе [4].
Метаболические нарушения являются одним из важнейших признаков рака [5]. Еще в 1920-х годах Отто Варбург заметил, что раковые клетки обычно используют для получения энергии гликолиз, а не окислительное фосфорилирование [6]. Таким образом, метаболический переход на анаэробное дыхание посредством гликолиза из пирувата, а не преобразование пирувата в ацетил-КоА под действием пируватдегидрогеназы (ПДГ) при аэробном метаболизме глюкозы, становится преимущественным фенотипом прогрессирования рака. PDH может быть инактивирована киназой пируватдегидрогеназы (PDK) во многих гликолитических фенотипах, включая рак, а ингибирование PDK переключает метаболизм на аэробное окисление, что, как доказано, неблагоприятно для роста опухоли [7].
Дихлорацетат (ДХА) является типичным ингибитором митохондриальной PDK. Блокируя фермент, ДХА снижает выработку лактата путем смещения метаболизма пирувата с гликолиза на окисление в митохондриях. Это свойство привело к испытаниям DCA для лечения заболеваний, связанных с накоплением молочной кислоты [8]. Недавно исследования показали, что DCA подавляет рост опухолей через ингибирование PDK [9-11]. Микелакис и его коллеги обнаружили, что DCA восстанавливает функцию митохондрий, тем самым восстанавливая апоптоз, убивая раковые клетки in vitro и уменьшая опухоли у крыс [12].
Широко используется комбинированная химиотерапия. 5-ФУ обычно сочетают с другими противоопухолевыми препаратами и облучением для усиления противоопухолевого эффекта. Клиническая недостаточность, по-видимому, вызвана резистентностью 5-ФУ и тяжелыми побочными эффектами. Сильная и избирательная индукция апоптоза предполагает, что ингибитор PDK DCA может усиливать ингибирующий эффект противораковых препаратов, тем самым превышая эффективность текущего лечения. В данном случае мы поставили перед собой цель изучить комбинированное противоопухолевое действие DCA и 5-ФУ на клетки CRC в надежде оценить относительно эффективный и безопасный режим, потенцированный для лечения CRC.
2. Материал и методы
2.1. Клетки и реактивы. Клеточные линии рака толстой кишки человека LS174T, LoVo, SW620 и HT29 были приобретены у American Type Culture Collection (Manassas, VA, USA). Реагенты для клеточных культур были приобретены у Gibco-Invitrogen (Карлсбад, Калифорния, США). Клеточные линии поддерживали в среде Дульбекко (Dulbecco’s Modified Eagle’s medium) или среде Лейбовица L-15, содержащей 10% фетальной бычьей сыворотки (FBS), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина в увлажненном инкубаторе 37◦C, 5% CO2. 5-FU и DCA были приобретены у компании Sigma-Aldrich Co. Ltd. (Сент-Луис, МО, США), растворяли в деионизированной воде для получения 1 моль/л рабочего раствора, стерилизовали на фильтре и затем разводили в ростовой среде для обработки.
2.2. Анализ жизнеспособности клеток. Жизнеспособность клеток определяли с помощью 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ) (Sigma-Aldrich). Клетки высевали в 96-луночные планшеты (5 × 104 клеток на лунку) и инкубировали в стандартных условиях роста в течение ночи с 60% до 70% конфлюэнции. Затем клетки обрабатывали только DCA (конечная концентрация 0-90 мМ) или DCA в сочетании с 5-ФУ (5-200 мкМ). После 48-часовой обработки клетки инкубировали при 37◦Cеще 4 часа с МТТ (20 мклна лунку) и измеряли поглощение при 490 нм на планшетном ридере BioRad Model 550 (Hercules, CA, USA).
2.3. Анализ взаимодействия препаратов. Взаимодействие между DCA и 5-ФУ анализировали с помощью принципа медианного эффекта, описанного Chou и Talalay [13, 14]. Программа позволяет рассчитать индексы сочетания (ИКС), которые, если меньше 1, равны 1 или больше 1, указывают на синергизм, аддитивность или антагонизм, соответственно, между двумя препаратами. CI рассчитывались по формуле, где (Dx)1 и (Dx)2 — концентрации только DCA или только 5-FU, дающие х% ингибирования роста, а (D)1 и (D)2 — концентрации препаратов в комбинации, ингибирующие рост клеток также на х%.
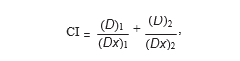
(Dx)1 и (Dx)2 были рассчитаны по уравнению медианы-эффекта:
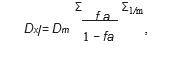
где Dm — медиана-эффект дозы, fa — доля афекта, а m — наклон графика медиана-эффект.
2.4. Анализы клеточной пролиферации. Иммуноцитохимию проводили с бромдезоксиуридином (BrdU) (BD Bioscience, Сан-Хосе, Калифорния, США) in vitro. Клетки размножали на покровных стеклах в 12-луночных планшетах в стандартных условиях роста. Через 24 часа добавляли различные концентрации DCA, 5-ФУ или комбинацию двух препаратов. Клетки подвергали сывороточному голоданию в течение 12 часов в ростовой среде, содержащей 0,5% FBS, чтобы сбросить клеточный цикл до фазы G0, а затем клетки импульсировали в течение 2 часов 10 мкмоль/лBrdU в ростовой среде. Затем клетки фиксировали, промывали и окрашивали в соответствии с инструкцией производителя.
Анализ клеточного цикла определяли косвенно с помощью окрашивания пропидий йодидом (PI, BD Bioscience) методом проточной цитометрии (FACScan, Becton Dickinson, San Jose, CA, USA). Клетки высевали в 6-луночные планшеты и культивировали с или без 10 мМ DCA или 20 мкМ5-FU. После инкубации в течение 48 часов клетки собирали с помощью 0,25% Трипсин-ЭДТА (Invitrogen, Карлсбад, Калифорния, США). Затем клетки фиксировали 70% спиртом в течение 24 часов при 4◦Cи дважды промывали фосфатным буферным солевым раствором (PBS). Добавляли РНКазу (100 мкл; 1 мг/мл) (BD Bioscience), и клетки инкубировали на водяной бане при 37◦Cв течение 30 минут. После окрашивания 200 мклPI (50 мкг/мл) клетки выдерживали при 4◦Cв течение 30 минут. Наконец, клетки анализировали методом проточной цитометрии.
2.5. Анализ апоптоза. Апоптоз определяли методом проточной цитометрии с использованием аннексина-V-FITC (BD Bioscience) и PI. Клетки высевали в 6-луночные планшеты. После 48-часовой инкубации с препаратами или без них, клетки промывали и ресуспендировали в 0,5 мл PBS buffer. После окрашивания аннексином-V-FITC и PI клетки анализировали методом проточной цитометрии в трех независимых экспериментах.
.6. Вестерн-блоттинг. Клетки собирали и общий белок экстрагировали с помощью RIPA-реактива, содержащего ингибиторы протеаз. Общий белок (50 мкг) подвергали 10% или 12% SDS/PAGE, и растворенные белки переносили электрофоретически на PVDF мембраны (Millipore, Bedford, MA, USA). Мембраны блокировали на 2 часа 5% обезжиренным молоком в TBS buffer, содержащим 0,05% Tween- 20 (TBST) при 4◦C. Затем мембраны инкубировали с антителами к Bax, Bcl-2, каспазе-3 и GADPH в течение ночи при 4◦C. После промывки в TBST мембраны инкубировали с соответствующими вторичными антителами в течение 1 часа.
Затем мембраны инкубировали с субстратом максимальной чувствительности SuperSignal West Femto (Pierce, Rockford, IL, USA) в течение 1 минуты и визуализировали с помощью системы Gel Doc XR (Bio-Rad). Все антитела были приобретены у компании Santa Cruz Biotechnology (Santa Cruz, CA, США).
2.7. Статистика. Все данные выражены как среднее значение и стандартное отклонение (SD). Статистический анализ проводили с помощью программы SPSS 13.0 (SPSS, Chicago, IL, USA). Различия между двумя группами определяли с помощью парного t-теста или независимого t-теста(с двумя хвостами), как указано. Различия между группами анализировали с помощью одностороннего дисперсионного анализа (ANOVA). P < .05 считалось статистически значимым.
3. Результаты
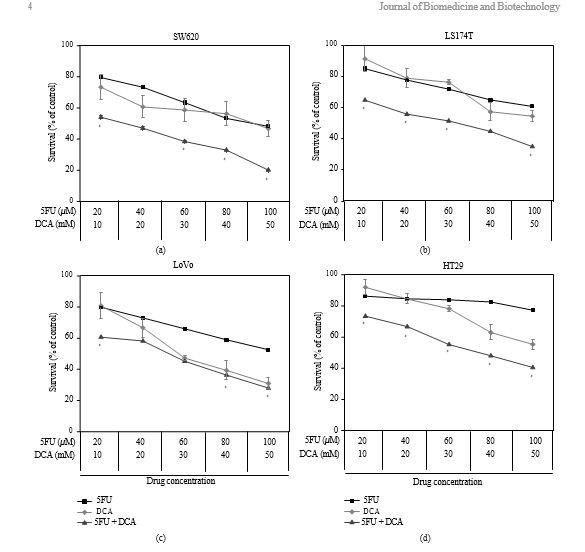
3.1. Жизнеспособность клеток CRC, обработанных DCA отдельно или в комбинации с 5-ФУ. Для определения эффекта DCA на клетки CRC, клетки подвергались воздействию DCA (0-90 мМ) в течение 48 часов. Результат показал, что ингибирующий эффект был дозозависимым. Как показано на рисунке 1, ингибирование жизнеспособности линий раковых клеток, обработанных 50 мМ DCA, составило
следующим образом: SW620 (46,73% ± 5,21%), LoVo (30,94% ± 3,57%), LS174t (54,59% ± 3,93%) и HT29 (55,31% ± 3,35%). Мы обработали клетки 5-ФУ (20-100 мкМ) и обнаружили, что жизнеспособность SW620, LoVo, LS174t была значительно подавлена, за исключением HT29, у которой ингибирование жизнеспособности не было очевидным при 80 мкМ5-ФУ. При одновременной обработке этими двумя препаратами жизнеспособность вышеупомянутых клеток CRC значительно снижалась по сравнению с DCA или 5-ФУ (значения IC50 приведены в таблице 1).
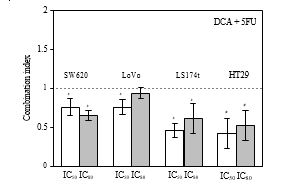
3.2. Синергетический эффект DCA в сочетании с 5-ФУ в клеточных линиях CRC. Жизнеспособность клеток CRC снижалась в присутствии 5-FU и DCA. DCA усиливал ингибирующее действие 5-FU на клетки CRC, а влияние DCA на действие 5-FU зависело от дозы (рис. 1). Взаимодействие между 5-ФУ и DCA было проанализировано методом медианных эффектов. Комбинация DCA и 5-ФУ давала синергетический или аддитивный эффект в зависимости от диапазона уровня клеточной гибели (Fa). Все четыре линии клеток CRC показали синергетический эффект от 5-ФУ и DCA. Синергизм был статистически значимым в LS174t при уровнях ингибирования 50% и 80%, достигая значений CI от 0,46-0,61, и в клеточной линии HT-29 при уровнях ингибирования 50 и 80%, со значениями CI в диапазоне от 0,42 до 0,52. В клетках SW620 и LoVo значения КИ при уровнях ингибирования 50% и 80% составили 0,64-0,75 и 0,75-0,94, соответственно (рис. 2).
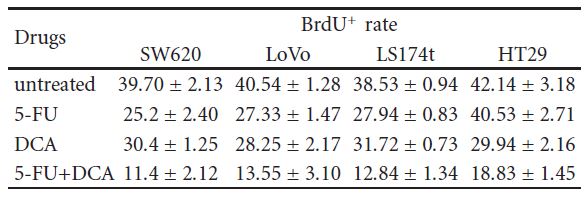
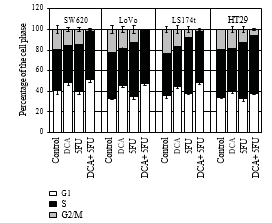
3.3. DCA увеличивал антипролиферативный эффект 5-FU. Для подтверждения того, что снижение жизнеспособности клеток связано со снижением пролиферации, использовали иммуноцитохимию и проточную цитометрию. Клетки обрабатывали 10 мМ DCA в сочетании с 20 мкМ 5-ФУ. Как и ожидалось, клетки, обработанные DCA, продемонстрировали снижение пролиферации по сравнению с необработанными клетками. Количество BrdU-позитивных клеток на четырех клеточных линиях CRC после обработки 5-FU и DCA составило 11,4 ± 2,12, 13,55 ± 3,10, 12,84 ± 1,34 и 18,83 ± 1,45, соответственно, что было ниже, чем при обработке только 5-FU или DCA (P < .01, см. таблицу 2). Кроме того, лечение DCA усиливало остановку клеточного цикла в фазе G1. При лечении DCA и 5-FU клетки, заблокированные в фазе G1/S, были больше, чем при лечении только DCA или 5-FU (рис. 3).
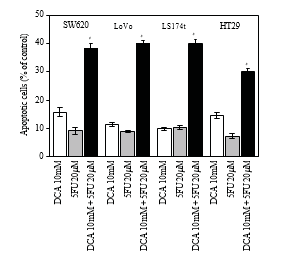
3.4. Повышенный апоптоз, индуцированный DCA в сочетании с 5-FU в клетках CRC. Для дальнейшего изучения снижения жизнеспособности клеток CRC, обработанных комбинированным режимом, апоптоз определяли с помощью проточной цитометрии. Как показано на рисунке 4, только DCA увеличивал долю апоптозных CRC-клеток. При обработке 10 мМ DCA уровень апоптоза четырех клеточных линий CRC составил 15,72 ± 1,63%, 11,32 ± 0,74%, 9,77 ± 0,53% и 14,52 ± 1,00%, соответственно, тогда как уровень апоптоза Таблица 1: Значения IC50 (концентрации, необходимые для снижения жизнеспособности клеток на 50% по сравнению с контрольными клетками) были рассчитаны с помощью линейной или нелинейной регрессии (трехпараметрическая функция Хилла) (R2> 0,9). Они представлены как среднее ± SD по результатам не менее трех независимых экспериментов. Значения IC50 исследуемых препаратов для ингибирования роста различных клеточных линий (клетки инкубировали с препаратами в течение 48 часов).
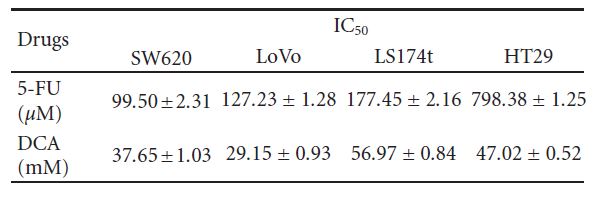
Таблица 2: Клетки SW620, LoVo, LS174t, HT29 и нераковые контрольные 293T обрабатывали 10 мМ DCA и 20 мкМ 5-FU по отдельности или в комбинации в течение 48 часов, а затем вводили BrdU. Затем клетки собирали и окрашивали, а количество BrdU+ клеток подсчитывали как среднее число положительных клеток в восьми различных полях зрения на одном изображении (увеличение 400X). Этот расчет повторяли три раза. ∗P< .05, по сравнению с контролем. BrdU+ клетки в разных вариантах лечения препаратами (%, среднее ± SD).
были 9,14 ± 119%, 8,82 ± 0,41%, 10,31 ± 0,71% и 7,27 ± 0,96% с 5-ФУ. Когда применялась комбинация DCA и 5-FU, скорость апоптоза была намного выше, чем 5-FU или только DCA (P < .05), что указывает на увеличение апоптотического эффекта под воздействием комбинации DCA и 5-FU (рис. 4).
3.5. Изменения апоптоз-ассоциированных молекул, стимулированных DCA и 5-FU. Для подтверждения того, что усиление апоптоза, вызванное комбинированной терапией, связано с изменением экспрессии апоптоз-ассоциированных молекул, был проведен вестерн-блот анализ. На рисунке 5 показано, что 5-FU или DCA снижали экспрессию Bcl-2 в четырех клеточных линиях CRC по сравнению с контролем PBS, а комбинация DCA и 5-FU значительно снижала экспрессию Bcl-2 по сравнению с DCA или 5-FU. Напротив, экспрессия Bax и каспазы-3 значительно увеличилась в четырех клеточных линиях CRC, обработанных комбинацией DCA и 5-FU, по сравнению с их одиночным использованием. Наиболее очевидное увеличение экспрессии Bax было обнаружено в клетках LS174t, в то время как в LoVo, как оказалось, больше всего увеличилась экспрессия каспазы-3 (Рисунок 5).
4. Обсуждение
В настоящем исследовании мы продемонстрировали, что DCA не только снижает жизнеспособность и пролиферацию клеток, но и обладает синергетической противоопухолевой эффективностью с химиотерапевтическим агентом 5-FU in vitro в клетках CRC.
Между тем, DCA не оказывает существенного воздействия на нераковые клетки. Кроме того, мы показали, что ДКА-индуцированный апоптоз способствует его синергическому противоопухолевому эффекту. По сравнению с DCA или 5-фторурацилом, комбинированное применение этих двух препаратов способствует апоптозу клеток CRC. 5-ФУ — химиотерапевтический препарат, используемый для лечения нескольких видов рака, включая колоректальный, молочной железы, пищевода и желудка [15]. Однако токсичность, связанная с 5-ФУ, является серьезной и распространенной проблемой для многих онкологических больных, причем наиболее часто наблюдаемыми побочными эффектами являются миелосупрессия и желудочно-кишечная токсичность [16]. Клиническая активность 5-ФУ в стандартных дозах скромна, и в целом дозировка ограничивается профилем безопасности. В результате мы обычно остаемся перед дилеммой принятия решения о терапевтической дозе 5-ФУ. Для повышения клинической активности 5-ФУ были разработаны различные стратегии, такие как биохимическая модуляция [17], изменение графика введения [18] и использование комбинированной терапии [19-22]. DCA — это небольшая молекула без запаха и цвета, недорогая, относительно нетоксичная. Он используется в клинической практике с 1969 года для лечения молочнокислого ацидоза путем повышения способности митохондрий вырабатывать энергию и снижения накопления молочной кислоты [23].
DCA рассматривается как потенциальный метод лечения рака с тех пор, как канадская группа обнаружила, что он вызывает регрессию в нескольких видах рака, включая опухоли легких, молочной железы и мозга [24, 25]. При введении препарата в раковые клетки, клетки переключались с гликолиза на митохондриальное производство энергии. Более того, функциональные митохондрии помогают клеткам распознавать функциональные аномалии и вызывать гибель клеток благодаря торможению роста опухоли и индукции апоптоза при некоторых видах рака. В настоящем исследовании мы обнаружили такой же ингибирующий жизнеспособность эффект в CRCs, который был дозозависимым и различным при разных степенях дифференцировки опухоли.
Результаты также показали, что низкая доза DCA оказывает синергетический эффект с химиотерапевтическим агентом 5-ФУ в остановке роста клеток CRC, который был количественно проанализирован по методу Чоу-Талалая.
Результаты пролиферации клеток также показали, что DCA усиливает антипролиферативный эффект 5-ФУ. Количество BrdU-позитивных клеток уменьшилось при лечении 5-ФУ или DCA, а количество клеток, окрашенных BrdU, значительно снизилось при лечении комбинацией 5-ФУ и DCA по сравнению с их отдельным использованием. Между тем, ингибирование роста клеток CRC сопровождалось арестом клеточного цикла. Комбинация DCA и 5-ФУ вызывала арест клеточного цикла в фазе G1/S в клеточных линиях CRC, в то время как арест в фазе G1, вызванный 5-ФУ, был неочевиден. Индукция остановки клеточного цикла может быть результатом ингибирования способности синтезировать или восстанавливать ДНК, что может привести к апоптозу клеток.
Оказалось, что DCA оказывает биохимические эффекты, соответствующие обращению эффекта Варбурга и уничтожению раковых клеток. Мы обнаружили, что DCA индуцировал апоптоз клеток CRC, что согласуется с предыдущими исследованиями DCA. Важно отметить, что комбинация DCA с 5-FU увеличивала количество апоптотических клеток по сравнению с 5-FU, демонстрируя, что DCA подавляет рост клеток через апоптоз.
Многие факторы, опосредующие апоптоз, сходятся в активации критического вектора — каспазы-3, которая считается ключевой протеазой семейства каспаз в апоптозе клеток млекопитающих [26]. Она всегда существует в цитоплазме в виде 23 кД неактивного предшественника, который активируется во время апоптоза и принимает участие в апоптозе, индуцированном множеством факторов. Каспаза-зависимый путь апоптоза в основном включает путь митохондрий, путь рецепторов смерти и путь эндоплазматического ретикулума [27].
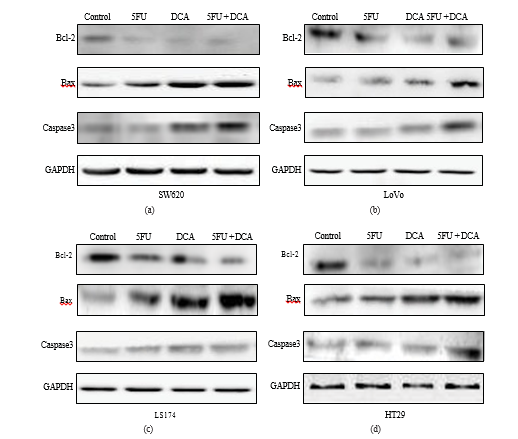
И путь митохондрий контролируется и регулируется семейством белков Bcl-2 [28, 29], которые делятся на две части, антиапоптотические члены (Bcl-2) и проапоптотические члены (Bax) [30]. Недавние исследования показывают, что Bcl-2 ингибирует апоптоз через подавление удаления Bax на внешнюю мембрану митохондрий [31]. Мы исследовали экспрессию каспазы-3, Bcl-2 и Bax на белковом уровне, и результат вестерн-блота показал, что экспрессия каспазы-3 и Bax увеличилась, а экспрессия Bcl-2 уменьшилась в комбинации DCA с 5-FU, по сравнению с одиночным лечением. Эти результаты позволили предположить, что апоптоз, индуцированный комбинацией DCA и 5-ФУ, может быть связан с каспазозависимым путем в митохондриях. Предыдущие исследования предположили, что индукция апоптоза под действием DCA является результатом возвращения дисфункции митохондрий и пути NFAT-Kv1.5 [9, 12], которые были посвящены тому же вопросу, что и настоящее исследование — апоптозу, опосредованному митохондриями.
Благодарность
Эта работа была поддержана Национальным фондом естественных наук Китая (NSFC, № 30873015). Ж. Тонг и Г. Се внесли равный вклад в эту работу.
Ссылки
[1] A. Jemal, R. Siegel, E. Ward, Y. Hao, J. Xu, and M. J. Thun, «Cancer statistics, 2009,» CA Cancer Journal for Clinicians, vol. 59, no. 4, pp. 225-249, 2009.[2] J. A. Meyerhardt and R. J. Mayer, «Drug therapy: systemic therapy for colorectal cancer,» The New England Journal of Medicine, vol. 352, no. 5, pp. 476-487, 2005.
[3] Н. К. Теббутт, Э. Кэттелл, Р. Мидгли, Д. Каннингем и Д. Керр, «Системное лечение колоректального рака», European Journal of Cancer, vol. 38, no. 7, pp. 1000-1015, 2002.
[4] M. Gusella, A. C. Frigo, C. Bolzonella и др., «Предикторы выживаемости и токсичности у пациентов, получающих адъювантную терапию 5-фторурацилом при колоректальном раке», British Journal of Cancer, vol. 100, no. 10, pp. 1549-1557, 2009.
[5] Д. Ханахан и Р. А. Вайнберг, «Основные признаки рака», Cell, том 100, № 1, стр. 57-70, 2000.
[6] Z. Chen, W. Lu, C. Garcia-Prieto, and P.Huang, «TheWarburg effect and its cancer therapeutic implications,» Journal of Bioenergetics and Biomembranes, vol. 39, no. 3, pp. 267-274, 2007.
[7] Y. Chen, R. Cairns, I. Papandreou, A. Koong, andN. C. Denko, «Oxygen consumption can regulate the growth of tumors, a new perspective on theWarburg effect,» PLoS ONE, vol. 4, no. 9, Article ID e7033, 2009.
[8] A. Aynsley Green, A. M. Weindling, G. Soltesz, and P. A. Jenkins, «Transient lactic acidosis and hyperalaninaemia associated with neonatal hyperinsulinaemic hypoglycaemia: the effects of dichloroacetate (DCA),» European Journal of Pediatrics, vol. 141, no. 2, pp. 114-117, 1983.
[9] J. Y. Y. Wong, G. S. Huggins, M. Debidda, N. C.Munshi, and I. De Vivo, «Dichloroacetate induces apoptosis in endometrial cancer cells,» Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
[10] W. Cao, S. Yacoub, K. T. Shiverick et al., «Dichloroacetate (DCA) sensitizes both wild-type and over expressing bcl-2 prostate cancer cells in vitro to radiation,» Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
[11] E. D. Michelakis, L. Webster, and J. R. Mackey, «Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer,» British Journal of Cancer, vol. 99, no. 7, pp. 989-994, 2008.
[12] S. Bonnet, S. L. Archer, J. Allalunis-Turner et al., «A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth,» Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
[13] T. C. Chou и P. Talalay, «Анализ комбинированного действия лекарств: новый взгляд на очень старую проблему», Trends in Pharmacological Sciences, vol. 4, pp. 450-454, 1983.
[14] T. C. Chou и P. Talalay, «Количественный анализ зависимости доза-эффект: комбинированное действие нескольких лекарств или ингибиторов ферментов», Advances in Enzyme Regulation, vol. 22, pp. 27-55, 1984.
[15] D. B. Longley, D. P. Harkin, and P. G. Johnston, «5- Fluorouracil: mechanisms of action and clinical strategies,» Nature Reviews Cancer, vol. 3, no. 5, pp. 330-338, 2003.
[16] M. W. Saif, A. Choma, S. J. Salamone, and E. Chu, «Pharmacokinetically guided dose adjustment of 5-fluorouracil: a rational approach to improve therapeutic outcomes,» Journal of the National Cancer Institute, vol. 101, no. 22, pp. 1543-1552, 2009.
[17] C.G. Leichman, K. Chansky, J. S. Macdonaldet al., «Biochemical modulation of 5-fluorouacil through dihydropyrimidine dehydrogenase inhibition: a Southwest OncologyGroup phase II trial of eniluracil and 5-fluorouracil in advanced resistant colorectal cancer,» Investigational New Drugs, vol. 20, no. 4, pp. 419-424, 2002.
[18] F. A. Levi, R. Zidani, J. M. Vannetzel et al., «Хрономодулированная по сравнению с фиксированной скоростью инфузии доставка амбулаторной химиотерапии с оксалиплатином, флуороурацилом и фолиновой кислотой (лейковорином) у пациентов с метастазами колоректального рака: рандомизированное мультиинституциональное исследование», Journal of the National Cancer Institute, vol. 86, no. 21, pp. 1608-1617, 1994.
[19] G. Melen-Mucha, E. Balcerczak, S. Mucha, M. Panczyk, S. Lipa, and M. Mirowski, «Expression of p65 gene in experimental colon cancer under the influence of 5-fluorouracil given alone and in combination with hormonal modulation,» Neoplasma, vol. 51, no. 4, pp. 319-324, 2004.
[20] F. Richards II, L. D. Case, and D. R. White, «Combination chemotherapy (5-fluorouracil, methyl-CCNU, mitomycin C) versus 5-fluorouracil alone for advanced previously untreated colorectal carcinoma. Исследование III фазы Пьемонтской онкологической ассоциации», Journal of Clinical Oncology, vol. 4, no. 4, pp. 565-570, 1986.
[21] A. Aquino, S. P. Prete, J. W. Greiner et al., «Effect of the combined treatment with 5-fluorouracil, γ-interferon or folinic acid on carcinoembryonic antigen expression in colon cancer cells,» Clinical Cancer Research, vol. 4, no. 10, pp. 2473- 2481, 1998.
[22] S. Obi, H. Yoshida, R. Toune et al., «Комбинированная терапия внутриартериального 5-фторурацила и системного интерферона-альфа при распространенной гепатоцеллюлярной карциноме с инвазией в портальную вену», Cancer, vol. 106, no. 9, pp. 1990-1997, 2006.
[23] P. W. Stacpoole, «Review of the pharmacologic and therapeutic effects of diisopropylammonium dichloroacetate (DIPA),» The Journal of Clinical Pharmacology, vol. 9, no. 5, pp. 282- 291, 1969.
[24] S. Bonnet, S. L. Archer, J. Allalunis-Turner et al., «A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth,» Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
[25] E. D.Michelakis, G. Sutendra, P.Dromparis et al., «Metabolic modulation of glioblastoma with dichloroacetate,» Science Translational Medicine, vol. 2, no. 31, pp. 31-ra34, 2010.
[26] T. Fernandes-Alnemri, G. Litwack, and E. S. Alnemri, «CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1β-converting enzyme,» The Journal of Biological Chemistry, vol. 269, no. 49, pp. 30761-30764, 1994.
[27] H. Mehmet, «Caspases find a new place to hide,» Nature, vol. 403, no. 6765, pp. 29-30, 2000.
[28] Э. Янг и С. Дж. Корсмайер, «Молекулярный танатопсис: рассуждения о семействе BCL2 и клеточной смерти», Blood, vol. 88, no. 2, pp. 386-401, 1996.
[29] D. R. Green and J. C. Reed, «Mitochondria and apoptosis,» Science, vol. 281, no. 5381, pp. 1309-1312, 1998.
[30] J. C. Reed, «Double identity for proteins of the Bcl-2 family,» Nature, vol. 387, no. 6635, pp. 773-776, 1997.
[31] B. Antonsson, S. Montessuit, B. Sanchez, and J. C. Martinou, «Bax присутствует в виде высокомолекулярного олигомера/комплекса в митохондриальной мембране апоптотических клеток», Журнал биологической химии, том 276, № 15, стр. 11615- 11623, 2001.