Jingtao Tong, Ganfeng Xie, Jinxia He, Jianjun Li, Feng Pan, et Houjie Liang
Département d’oncologie, Hôpital du Sud-Ouest, Troisième université médicale militaire, 29 Gaotanyan Street, Chongqing 400038, Chine
Toute correspondance doit être adressée à Houjie Liang, [email protected]. Reçu le 27 mai 2010 ; révisé le 29 décembre 2010 ; accepté le 13 janvier 2011
Rédacteur académique : Miguel A. Andrade
Copyright © 2011 Jingtao Tong et al. Il s’agit d’un article en accès libre distribué sous la licence Creative Commons Attribution, qui autorise l’utilisation, la distribution et la reproduction sans restriction sur tout support, à condition que l’œuvre originale soit correctement citée.
Le dichloroacétate (DCA), un inhibiteur de la pyruvate déshydrogénase kinase (PDK), a été récemment démontré comme un agent antinéoplasique non toxique prometteur qui favorise l’apoptose des cellules cancéreuses. Dans la présente étude, nous avons cherché à étudier l’effect antitumoral du DCA combiné au 5-Fluorouracil (5-FU) sur des cellules de cancer colorectal (CRC). Quatre lignées cellulaires humaines de CRC ont été traitées avec du DCA ou du 5-FU, ou une combinaison de DCA et de 5-FU. La viabilité cellulaire a été déterminée par le test au bromure de 3-(4,5-diméthylthiazol-2-yl)- 2,5-diphényltétrazolium. L’interaction entre le DCA et le 5-FU a été évaluée par le principe de l’effect médian. Une immunocytochimie à la bromodésoxyuridine (BrdU) a été réalisée pour déterminer la prolifération des cellules du CCR. Le cycle cellulaire et l’apoptose ont été mesurés par cytométrie de flux, et l’expression des molécules liées à l’apoptose a été évaluée par western blot. Nos résultats ont démontré que le DCA inhibe la viabilité des cellules du CCR et présente une antiprolifération synergique en combinaison avec le 5-FU. De plus, par rapport au 5-FU seul, l’apoptose des cellules du cancer colorectal traitées avec du DCA et du 5-FU a été augmentée et démontrée par les changements des protéines Bcl-2, Bax et caspase-3. Nos résultats suggèrent que le DCA a un effect antitumoral synergique avec le 5-FU sur les lignées cellulaires du CRC in vitro.
1. Introduction
Le cancer colorectal est l’une des tumeurs malignes les plus fréquentes dans le monde [1]. En dehors de la chirurgie, le traitement des patients atteints de CCR repose principalement sur la chimiothérapie, en particulier pour les patients atteints de CCR avancé. Parmi les agents chimiothérapeutiques pour le CCR, le 5-Fluorouracil (5-FU), qui est un agent chimiothérapeutique classique, est le traitement de première ligne du CCR depuis plusieurs décennies [2, 3]. Cependant, le 5-FU seul est peu sélectif vis-à-vis de la tumeur et hautement toxique pour la moelle osseuse, le tractus gastro-intestinal et la peau lorsqu’il est utilisé à la dose thérapeutique [4].
L’anomalie métabolique est l’une des caractéristiques essentielles du cancer [5]. Dès les années 1920, Otto Warburg a observé que les cellules cancéreuses utilisent généralement la glycolyse plutôt que la phosphorylation oxydative pour produire de l’énergie [6]. Ainsi, le passage métabolique à la respiration anaérobie par glycolyse à partir du pyruvate, plutôt que la conversion du pyruvate en acétyl-CoA par l’action de la pyruvate déshydrogénase (PDH) dans le métabolisme aérobie du glucose, devient un phénotype préférentiel de la progression du cancer. La PDH peut être inactivée par la pyruvate déshydrogénase kinase (PDK) dans de nombreux phénotypes glycolytiques, y compris le cancer, tandis que l’inhibition de la PDK fait basculer le métabolisme vers l’oxydation aérobie, ce qui s’avère désavantageux pour la croissance tumorale [7].
Le dichloroacétate (DCA) est un inhibiteur prototypique de la PDK mitochondriale. En bloquant cette enzyme, le DCA diminue la production de lactate en déplaçant le métabolisme du pyruvate de la glycolyse vers l’oxydation dans la mitochondrie. Cette propriété a conduit à des essais du DCA pour le traitement des troubles de l’accumulation d’acide lactique [8]. Récemment, des études ont démontré que le DCA supprime la croissance tumorale par l’inhibition de la PDK [9-11]. Michelakis et ses collègues ont découvert que le DCA restaurait la fonction mitochondriale, rétablissant ainsi l’apoptose, tuant les cellules cancéreuses in vitro et réduisant les tumeurs chez les rats [12].
La chimiothérapie combinée a été largement utilisée. le 5-FU est généralement associé à d’autres agents antinéoplasiques et à des radiations pour renforcer son effect antitumoral. L’insufficiance clinique semble être causée par la résistance du 5-FU et des effects secondaires sévères. L’induction forte et sélective de l’apoptose suggère que l’inhibiteur PDK DCA pourrait potentialiser l’effect inhibiteur des médicaments anticancéreux, dépassant ainsi l’efficacité du traitement actuel. Ici, nous avons voulu examiner les effets antitumoraux combinés du DCA avec le 5-FU sur les cellules du CCR, dans l’espoir d’évaluer un régime relativement effectif et sûr potentialisé pour le traitement du CCR.
2. Matériel et méthodes
2.1. Cellules et régents. Les lignées cellulaires humaines de cancer du côlon LS174T, LoVo, SW620 et HT29 ont été achetées auprès de l’American Type Culture Collection (Manassas, VA, USA). Les réactifs de culture cellulaire ont été achetés auprès de Gibco-Invitrogen (Carlsbad, CA, USA). Les lignées cellulaires ont été maintenues dans un milieu d’Eagle modifié de Dulbecco ou un milieu Leibovitz L-15 contenant 10 % de sérum fœtal bovin (FBS), 100 U/mL de pénicilline et 100 μg/mL de streptomycine dans un incubateur humidifié à 37◦C, 5 % de CO2. le 5-FU et le DCA ont été achetés auprès de Sigma-Aldrich Co. Ltd. (St. Louis, MO, USA), dissous dans de l’eau désionisée pour obtenir une solution de travail de 1 mol/L, stérilisés par filtration, puis dilués dans le milieu de croissance pour le traitement.
2.2. Test de viabilité cellulaire. La viabilité cellulaire a été déterminée à l’aide du test au bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium (MTT) (Sigma-Aldrich). Les cellules ont été ensemencées dans des plaques à 96 puits (5 × 104 cellules par puits) et incubées dans des conditions de croissance standard pendant la nuit pour atteindre une confluence de 60 à 70 %. Les cellules ont ensuite été traitées avec du DCA seul (concentration finale 0-90 mM) ou avec du DCA associé à du 5-FU (5-200 μM). Après un traitement de 48 heures, les cellules ont été incubées à 37◦Cpendant 4 heures supplémentaires avec du MTT (20 μLpar puits) et l’absorbance à 490 nm a été mesurée dans un lecteur de plaques BioRad Model 550 (Hercules, CA, USA).
2.3. Analyse de l’interaction médicamenteuse. L’interaction entre le DCA et le 5-FU a été analysée en utilisant le principe de l’effect médian décrit par Chou et Talalay [13, 14]. Ce programme permet de calculer les indices de combinaison (IC) qui, lorsqu’ils sont inférieurs à 1, égaux à 1 ou supérieurs à 1, indiquent respectivement une synergie, une additivité ou un antagonisme entre deux médicaments. Les IC ont été calculés de la manière suivante : (Dx)1 et (Dx)2 sont les concentrations de DCA seul ou de 5-FU seul, donnant x% d’inhibition de la croissance, et (D)1 et (D)2 sont les concentrations de médicaments en combinaison inhibant également x% de la croissance cellulaire.
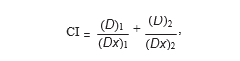
(Dx)1 et (Dx)2 ont été calculés par l’équation médiane-effect :
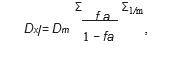
où Dm est la dose médiane-effect, fa est la fraction affectée, et m représente la pente du tracé médiane-effect.
2.4. Essais de prolifération cellulaire. L’immunocytochimie a été réalisée avec de la bromodésoxyuridine (BrdU) (BD Bioscience, San Jose, CA, USA) in vitro. Les cellules ont été propagées sur des lamelles couvre-objet dans des plaques à 12 puits dans des conditions de croissance standard. Après 24 heures, diverses concentrations de DCA, de 5-FU ou une combinaison de deux médicaments ont été ajoutées. Les cellules ont été privées de sérum pendant 12 heures dans un milieu de croissance contenant 0,5 % de FBS pour réinitialiser le cycle cellulaire à la phase G0, puis les cellules ont été pulsées pendant 2 heures avec 10 μmol/Lde BrdU dans le milieu de croissance. Ensuite, les cellules ont été fixées, lavées et colorées selon les instructions du fabricant.
L’analyse du cycle cellulaire a été déterminée indirectement en utilisant la coloration à l’iodure de propidium (PI, BD Bioscience) par cytométrie en flux (FACScan, Becton Dickinson, San Jose, CA, USA). Les cellules ont été ensemencées dans des plaques à 6 puits et cultivées avec ou sans 10 mM de DCA ou 20 μMde 5-FU. Après une incubation de 48 heures, les cellules ont été récoltées avec de la trypsine-EDTA à 0,25 % (Invitrogen, Carlsbad, CA, États-Unis). Ensuite, les cellules ont été fixées avec de l’alcool à 70 % pendant 24 heures à 4◦Cet lavées deux fois avec du phosphate buffer saline (PBS). De l’ARNase (100 μL; 1 mg/mL) (BD Bioscience) a été ajoutée, et les cellules ont été incubées dans un bain-marie à 37◦Cpendant 30 minutes. Après la coloration avec 200 μLde PI (50 μg/mL), les cellules ont été maintenues à 4◦Cpendant 30 minutes. Enfin, les cellules ont été analysées par cytométrie en flux.
2.5. Test d’apoptose. L’apoptose a été détectée par cytométrie en flux avec l’annexin-V-FITC (BD Bioscience) et le PI. Les cellules ont été ensemencées dans des plaques à 6 puits. Après une incubation de 48 heures avec ou sans médicaments, les cellules ont été lavées et remises en suspension dans 0,5 ml de PBS buffer. Après coloration à l’annexin-V-FITC et au PI, les cellules ont été analysées par cytométrie en flux dans trois expériences indépendantes.
2.6. Western Blot. Les cellules ont été récoltées et les protéines totales ont été extraites avec du buffer RIPA contenant des inhibiteurs de protéase. Les protéines totales (50 μg) ont été soumises à une SDS/PAGE à 10% ou 12%, et les protéines résolues ont été transférées par électrophorèse sur des membranes PVDF (Millipore, Bedford, MA, USA). Les membranes ont été bloquées pendant 2 heures avec du lait écrémé à 5 % dans du TBS buffer contenant 0,05 % de Tween- 20 (TBST) à 4◦C. Les membranes ont ensuite été incubées avec les anticorps contre Bax, Bcl-2, Caspase-3 et GADPH pendant la nuit à 4◦C. Après lavage dans du TBST, les membranes ont été incubées avec leurs anticorps secondaires respectifs pendant 1 heure.
Les membranes ont ensuite été incubées avec le substrat SuperSignal West Femto à sensibilité maximale (Pierce, Rockford, IL, USA) pendant 1 minute et imagées à l’aide d’un système Gel Doc XR (Bio-Rad). Tous les anticorps ont été achetés auprès de Santa Cruz Biotechnology (Santa Cruz, CA, USA).
2.7. Statistiques. Toutes les données sont exprimées sous forme de moyennes de l’écart type (ET). L’analyse statistique a été réalisée à l’aide du logiciel SPSS 13.0 (SPSS, Chicago, IL, USA). Les differences entre les deux groupes ont été déterminées par un test t d’ échantillons appariés ou un test t d’échantillons indépendants (bilatéral), comme indiqué. Les differences entre les groupes ont été analysées par une analyse de variance à sens unique (ANOVA). P < 0,05 a été considéré comme statistiquement significatif.
3. Résultats
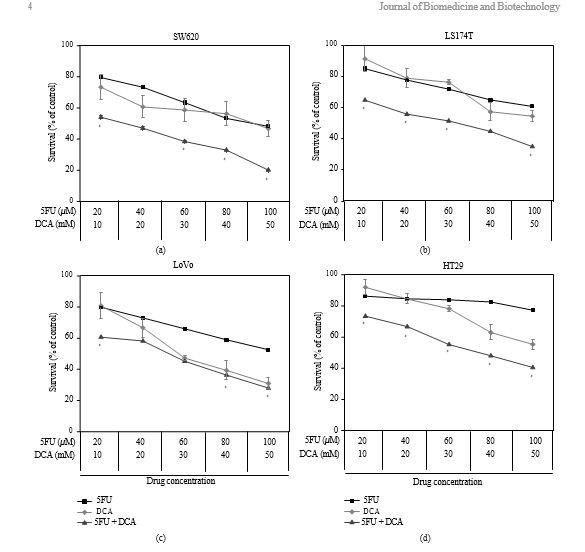
3.1. Viabilité des cellules du CCR traitées par le DCA seul ou en combinaison avec le 5-FU. Pour déterminer l’effect du DCA sur les cellules du CRC, les cellules ont été exposées au DCA (0-90 mM) pendant 48 heures. Le résultat a montré que l’effect inhibiteur était dose-dépendant. Comme le montre la figure 1, l’inhibition de la viabilité des lignées de cellules cancéreuses traitées avec 50 mM de DCA était
comme suit : SW620 (46,73 % ± 5 ,21 %), LoVo (30,94 % ± 3,57 %), LS174t (54,59 % ± 3 ,93 %) et HT29 (55,31 % ± 3,35 %). Nous avons traité les cellules avec du 5-FU (20-100 μM) et avons constaté que la viabilité de SW620, LoVo, LS174t était inhibée de manière significative, à l’exception de HT29, dont l’inhibition de la viabilité n’était pas évidente sous 80 μMde 5-FU. Lorsqu’elles ont été traitées avec ces deux médicaments simultanément, la viabilité des cellules CRC susmentionnées a été significativement diminuée par rapport au DCA ou au 5- FU seul (les valeurs IC50 sont indiquées dans le tableau 1).
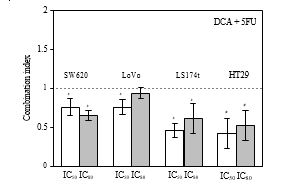
3.2. Effects synergiques du DCA combiné au 5-FU dans les lignées cellulaires du CCR. La viabilité des cellules du CCR a diminué en présence de 5-FU et de DCA. Le DCA a potentialisé les effets inhibiteurs du 5-FU sur les cellules de CRC, et l’influence du DCA sur les effets du 5-FU était dose dépendante (Figure 1). L’interaction entre le 5-FU et le DCA a été analysée par la méthode des effects médians. L’association du DCA et du 5-FU a produit des effects synergiques ou additifs en fonction de la plage du niveau de destruction des cellules (Fa). Les quatre lignées cellulaires de CRC ont toutes indiqué un effect synergique avec le 5-FU et le DCA. Le synergisme était statistiquement significatif dans la lignée LS174t à des niveaux d’inhibition de 50 % et 80 %, atteignant des valeurs d’IC comprises entre 0,46 et 0,61, et dans la lignée cellulaire HT-29 à des niveaux d’inhibition de 50 et 80 %, avec des valeurs d’IC comprises entre 0,42 et 0,52. Dans les cellules SW620 et LoVo, les valeurs de l’IC aux niveaux d’inhibition de 50 et 80 % étaient respectivement de 0,64 à 0,75 et de 0,75 à 0,94 (figure 2).
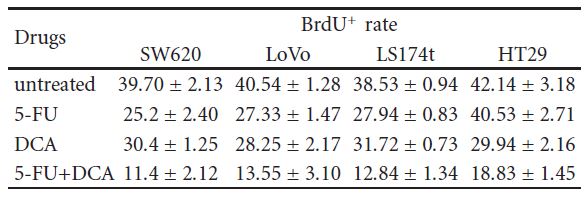
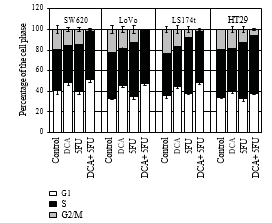
3.3. Le DCA a augmenté l’Efficience de l’Effect antiprolifératif du 5-FU. Pour confirmer que la diminution de la viabilité cellulaire était due à une réduction de la prolifération, on a utilisé l’immunocytochimie et la cytométrie de flux. Les cellules ont été traitées avec 10 mM de DCA combiné à 20 μM de 5-FU. Comme prévu, les cellules traitées au DCA ont présenté une prolifération réduite par rapport aux cellules non traitées. Le nombre de cellules positives BrdU sur quatre lignées cellulaires de CCR après traitement par 5-FU et DCA était de 11,4 ± 2,12, 13,55 ± 3,10, 12,84 ± 1,34 et 18,83 ± 1,45, respectivement, ce qui était inférieur à celui des cellules traitées par 5-FU ou DCA seul (P < 0,01, voir tableau 2). En outre, le traitement au DCA a potentialisé l’arrêt du cycle cellulaire en phase G1. Lorsqu’elles ont été traitées avec du DCA et du 5-FU, les cellules bloquées dans la phase G1/S étaient plus nombreuses que celles incorporées avec du DCA ou du 5-FU seul (figure 3).
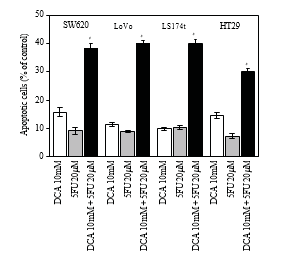
3.4. Augmentation de l’apoptose induite par le DCA combiné au 5-FU dans les cellules du CCR. Pour approfondir l’étude de la diminution de la viabilité des cellules du CCR traitées par un régime combiné, l’apoptose a été déterminée par cytométrie de flux. Comme le montre la figure 4, le DCA seul a augmenté la proportion de cellules CRC en apoptose. Lorsqu’elles ont été traitées avec 10 mM de DCA, les taux d’apoptose de quatre lignées cellulaires du CCR étaient respectivement de 15,72 ± 1 ,63 %, 11,32 ± 0 ,74 %, 9,77 ± 0 ,53 % et 14,52 ± 1 ,00 %, tandis que les taux d’apoptose Tableau 1 : Les valeurs de CI50 (concentrations requises pour réduire la viabilité des cellules de 50 % par rapport aux cellules témoins) ont été calculées à l’aide d’une régression linéaire ou non linéaire (fonction de Hill à trois paramètres) (R2> 0 ,9). Elles sont présentées en tant que moyenne ± SD d’au moins trois expériences indépendantes. Valeurs IC50 des médicaments étudiés pour l’inhibition de la croissance de diverses lignées cellulaires (les cellules ont été incubées avec les médicaments pendant 48 heures).
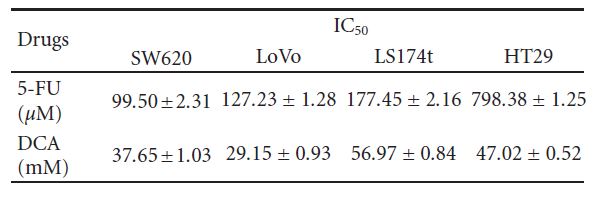
Tableau 2 : Les cellules SW620, LoVo, LS174t, HT29 et les témoins non cancéreux 293T ont été traités avec 10 mM de DCA et 20 μM de 5-FU seuls ou en combinaison pendant 48 heures, puis pulsés avec BrdU. Les cellules ont ensuite été récoltées et colorées, et le nombre de cellules BrdU+ a été calculé comme le nombre moyen de cellules positives dans huit champs differents d’une image (grossissement, 400X). Ce calcul a été répété trois fois. ∗P< 0,05, par rapport au contrôle. Cellules BrdU+ dans les traitements médicamenteux differents (%, moyenne ± SD).
étaient de 9,14 ± 119 %, 8,82 ± 0 ,41 %, 10,31 ± 0 ,71 % et 7,27 ±0 ,96 % avec le 5-FU. Lorsque la combinaison du DCA et du 5-FU a été appliquée, le taux d’apoptose était beaucoup plus élevé que celui du 5-FU ou du DCA seul (P < 0,05), ce qui indique que l’effect apoptotique a été augmenté par la combinaison du DCA et du 5-FU (Figure 4).
3.5. Changements sur les molécules associées à l’apoptose stimulées par le DCA et le 5-FU. Pour confirmer que l’augmentation de l’apoptose induite par la thérapie combinée était due à une modification de l’expression des molécules associées à l’apoptose, un test Western Blot a été appliqué. Dans la figure 5, les résultats ont indiqué que le 5-FU ou le DCA diminuait l’expression de Bcl-2 dans quatre lignées cellulaires de CRC par rapport aux contrôles PBS, et que l’association de DCA et de 5-FU diminuait significativement l’expression de Bcl-2 par rapport au DCA ou au 5-FU seul. À l’inverse, les expressions de Bax et de la caspase-3 ont augmenté de manière significative dans les quatre lignées cellulaires de CRC traitées par l’association de DCA et de 5-FU par rapport à leur usage unique. L’augmentation la plus évidente de l’expression de Bax a été détectée dans les cellules LS174t, tandis que dans LoVo il est apparu que l’expression de la caspase-3 a augmenté le plus (Figure 5).
4. Discussion
Dans la présente étude, nous démontrons que le DCA a non seulement réduit la viabilité et la prolifération des cellules, mais qu’il a également une efficience antitumorale synergique avec l’agent chimiothérapeutique 5-FU in vitro dans les cellules de CRC.
Parallèlement, le DCA n’a pas d’effects significatifs sur les cellules non cancéreuses. De plus, nous avons montré que l’apoptose induite par le DCA contribue à son effect antitumoral synergique. Par rapport au DCA ou au 5-FU seul, l’utilisation combinée de ces deux médicaments favorise l’apoptose des cellules du CCR. le 5-FU est un médicament de chimiothérapie utilisé pour traiter plusieurs types de cancer, notamment le cancer colorectal, du sein, de l’œsophage et de l’estomac [15]. Cependant, la toxicité liée au 5-FU est un problème grave et courant pour de nombreux patients atteints de cancer, la myélosuppression et la toxicité gastro-intestinale étant les effects secondaires les plus fréquemment observés [16]. L’activité clinique du 5-FU est modeste aux doses standard et, en général, la posologie est limitée par le profil de sécurité. Par conséquent, nous sommes généralement confrontés au dilemme de la prise de décision concernant la dose thérapeutique de 5-FU. Diverses stratégies ont été développées pour améliorer l’activité clinique du 5-FU, telles que la modulation biochimique [17], la modification du calendrier d’administration [18] et l’utilisation d’une thérapie combinée [19-22]. Le DCA est une petite molécule inodore, incolore, peu coûteuse et relativement non toxique. Il est utilisé en clinique depuis 1969 pour le traitement de l’acidose lactique en augmentant la capacité des mitochondries à produire de l’énergie et en réduisant l’accumulation d’acide lactique [23].
Le DCA a été considéré comme un régime potentiel de thérapie du cancer depuis qu’un groupe canadien a constaté qu’il provoquait la régression de plusieurs cancers, notamment des tumeurs du poumon, du sein et du cerveau [24, 25]. Lorsqu’il est administré aux cellules cancéreuses, celles-ci passent de la glycolyse à la production d’énergie par les mitochondries. Qui plus est, les mitochondries fonctionnelles aident les cellules à reconnaître les anomalies fonctionnelles et à déclencher la mort cellulaire grâce à l’inhibition de la croissance tumorale et à l’induction de l’apoptose dans certains cancers. Dans la présente étude, nous avons constaté le même effect inhibiteur de viabilité dans les CRC, qui était dose-dépendant et divers avec different degrés de differentiation tumorale.
Les résultats ont également indiqué que le DCA à faible dose exerce un effect synergique avec l’agent chimiothérapeutique 5- FU dans l’arrêt de la croissance des cellules du CCR, qui a été analysé quantitativement selon la méthode Chou-Talalay.
Les résultats de la prolifération cellulaire ont également démontré que le DCA renforçait les effets antiproliférationnels du 5-FU. Le nombre de cellules positives au BrdU a diminué lors du traitement avec le 5-FU ou le DCA, tandis que les cellules colorées au BrdU ont diminué de manière significative lors du traitement avec la combinaison de 5-FU et de DCA par rapport à leur utilisation unique. L’inhibition de la croissance des cellules du cancer colorectal s’est accompagnée d’un arrêt du cycle cellulaire. La combinaison du DCA et du 5-FU a induit un arrêt du cycle cellulaire en phase G1/S dans les lignées cellulaires du CRC, alors que l’arrêt induit par le 5-FU en phase G1 n’était pas évident. L’induction de l’arrêt du cycle cellulaire peut résulter de l’inhibition de la capacité à synthétiser ou à réparer l’ADN, ce qui peut conduire à l’apoptose des cellules.
Le DCA semble exercer des effets biochimiques compatibles avec l’inversion de l’effect de Warburg et la mort des cellules cancéreuses. Nous avons constaté que le DCA induisait l’apoptose des cellules du CCR, ce qui est orchestré avec les études précédentes sur le DCA. Il est important de noter que la combinaison du DCA avec le 5-FU a augmenté le nombre de cellules apoptotiques par rapport au 5-FU seul, ce qui démontre que le DCA a inhibé la croissance cellulaire via l’apoptose.
De nombreux facteurs médiant l’apoptose convergent pour activer l’effector critique la caspase-3, qui est considérée comme la protéase clé de la famille des caspases dans l’apoptose des cellules de mammifères [26]. Elle existe toujours sous la forme d’un précurseur inactif de 23 kD dans le cytoplasme, qui est activé pendant l’apoptose et participe à l’apoptose induite par de multiples facteurs. La voie de l’apoptose dépendante des caspases comprend principalement la voie des mitochondries, la voie des récepteurs de la mort et la voie du réticulum endoplasmique [27].
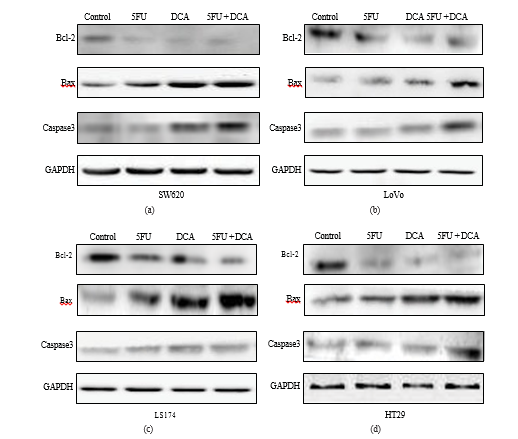
Et la voie des mitochondries est contrôlée et régulée par les protéines de la famille Bcl-2 [28, 29], qui sont divisées en deux parties, les membres antiapoptotiques (Bcl-2) et les membres proapoptotiques (Bax) [30]. Une étude récente indique que les Bcl-2 inhibent l’apoptose en empêchant Bax de se fixer sur la membrane externe des mitochondries [31]. Nous avons étudié l’expression de la caspase-3, de Bcl-2 et de Bax au niveau des protéines et le résultat du western blot a montré que les expressions de la caspase-3 et de Bax étaient augmentées, tandis que l’expression de Bcl-2 était diminuée dans le traitement combiné de DCA et de 5-FU, par rapport aux traitements individuels. Ces résultats suggèrent que l’apoptose induite par la combinaison du DCA et du 5-FU pourrait être liée à la voie mitochondriale dépendante des caspases. Des études antérieures ont suggéré que l’induction de l’apoptose par le DCA résultait du retour du dysfonctionnement des mitochondries et de la voie NFAT-Kv1.5 [9, 12], qui se concentrait sur le même point que la présente étude, à savoir l’apoptose médiée par les mitochondries.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (NSFC, n° 30873015). J. Tong et G. Xie ont contribué à parts égales à ce travail.
Références
[1 ] A. Jemal, R. Siegel, E. Ward, Y. Hao, J. Xu et M. J. Thun, » Cancer statistics, 2009 « , CA Cancer Journal for Clinicians, vol. 59, no. 4, pp. 225-249, 2009.[2] J. A. Meyerhardt et R. J. Mayer, « Drug therapy : systemic therapy for colorectal cancer, » The New England Journal of Medicine, vol. 352, no. 5, pp. 476-487, 2005.
[3 ] N. C. Tebbutt, E. Cattell, R. Midgley, D. Cunningham et D. Kerr, » Systemic treatment of colorectal cancer « , European Journal of Cancer, vol. 38, no 7, p. 1000-1015, 2002.
[4 ] M. Gusella, A. C. Frigo, C. Bolzonella et al, « Predictors of survival and toxicity in patients on adjuvant therapy with 5- fluorouracil for colorectal cancer, » British Journal of Cancer, vol. 100, no. 10, pp. 1549-1557, 2009.
[5] D. Hanahan et R. A. Weinberg, » The hallmarks of cancer « , Cell, vol. 100, no 1, p. 57-70, 2000.
[6 ] Z. Chen, W. Lu, C. Garcia-Prieto, et P.Huang, « TheWarburg effect and its cancer therapeutic implications, » Journal of Bioenergetics and Biomembranes, vol. 39, no. 3, pp. 267-274, 2007.
[7] Y. Chen, R. Cairns, I. Papandreou, A. Koong, etN. C. Denko, « Oxygen consumption can regulate the growth of tumors, a new perspective on theWarburg effect », PLoS ONE, vol. 4, no. 9, Article ID e7033, 2009.
[8 ] A. Aynsley Green, A. M. Weindling, G. Soltesz et P. A. Jenkins, » Transient lactic acidosis and hyperalaninaemia associated with neonatal hyperinsulinaemic hypoglycaemia : the effects of dichloroacetate (DCA) « , European Journal of Pediatrics, vol. 141, no 2, p. 114-117, 1983.
[9] J. Y. Y. Wong,G. S. Huggins,M. Debidda, N. C.Munshi, et I. De Vivo, « Dichloroacetate induces apoptosis in endometrial cancer cells, » Gynecologic Oncology, vol. 109, no. 3, pp. 394- 402, 2008.
[10 ] W. Cao, S. Yacoub, K. T. Shiverick et al, « Dichloroacetate (DCA) sensitizes both wild-type and over expressing bcl-2 prostate cancer cells in vitro to radiation, » Prostate, vol. 68, no. 11, pp. 1223-1231, 2008.
[11] E. D. Michelakis, L. Webster et J. R. Mackey, « Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer », British Journal of Cancer, vol. 99, no. 7, pp. 989-994, 2008.
[12 ] S. Bonnet, S. L. Archer, J. Allalunis-Turner et al, « A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth, » Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
[13] T. C. Chou et P. Talalay, « Analysis of combined drug effects : a new look at a very old problem », Trends in Pharmacological Sciences, vol. 4, pp. 450-454, 1983.
[14] T. C. Chou et P. Talalay, « Quantitative analysis of doseeffect relationships : the combined effects of multiple drugs or enzyme inhibitors », Advances in Enzyme Regulation, vol. 22, pp. 27-55, 1984.
[15] D. B. Longley, D. P. Harkin et P. G. Johnston, « 5- Fluorouracil : mechanisms of action and clinical strategies, » Nature Reviews Cancer, vol. 3, no. 5, pp. 330-338, 2003.
[16 ] M. W. Saif, A. Choma, S. J. Salamone et E. Chu, » Pharmacokinetically guided dose adjustment of 5-fluorouracil : a rational approach to improving therapeutic outcomes « , Journal of the National Cancer Institute, vol. 101, no 22, p. 1543-1552, 2009.
[17] C.G. Leichman, K. Chansky, J. S. Macdonald et al, « Biochemical modulation of 5-fluorouacil through dihydropyrimidine dehydrogenase inhibition : a Southwest OncologyGroup phase II trial of eniluracil and 5-fluorouracil in advanced resistant colorectal cancer, » Investigational New Drugs, vol. 20, no. 4, pp. 419-424, 2002.
[18 ] F. A. Levi, R. Zidani, J. M. Vannetzel et al, « Chronomodulated versus fixed-infusion-rate delivery of ambulatory chemotherapy with oxaliplatin, fluorouracil, and folinic acid (leucovorin) in patients with colorectal cancer metastases : a randomized multi-institutional trial, » Journal of the National Cancer Institute, vol. 86, no. 21, pp. 1608-1617, 1994.
[19] G. Melen-Mucha, E. Balcerczak, S. Mucha, M. Panczyk, S. Lipa et M. Mirowski, « Expression of p65 gene in experimental colon cancer under the influence of 5-fluorouracil given alone and in combination with hormonal modulation », Neoplasma, vol. 51, no. 4, pp. 319-324, 2004.
[20] F. Richards II, L. D. Case et D. R. White, » Combination chemotherapy (5-fluorouracil, methyl-CCNU, mitomycin C) versus 5-fluorouracil alone for advanced previously untreated colorectal carcinoma. A phase III study of the piedmont oncology association », Journal of Clinical Oncology, vol. 4, no. 4, pp. 565-570, 1986.
[21 ] A. Aquino, S. P. Prete, J. W. Greiner et al. « Effect of the combined treatment with 5-fluorouracil, γ-interferon or folinic acid on carcinoembryonic antigen expression in colon cancer cells », Clinical Cancer Research, vol. 4, no. 10, pp. 2473- 2481, 1998.
[22 ] S. Obi, H. Yoshida, R. Toune et al. « Combination therapy of intraarterial 5-fluorouracil and systemic interferon-alpha for advanced hepatocellular carcinoma with portal venous invasion », Cancer, vol. 106, no. 9, pp. 1990-1997, 2006.
[23] P. W. Stacpoole, « Review of the pharmacologic and therapeutic effects of diisopropylammonium dichloroacetate (DIPA), » The Journal of Clinical Pharmacology, vol. 9, no. 5, pp. 282- 291, 1969.
[24 ] S. Bonnet, S. L. Archer, J. Allalunis-Turner et al. « A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth », Cancer Cell, vol. 11, no. 1, pp. 37-51, 2007.
[25] E. D.Michelakis, G. Sutendra, P.Dromparis et al, « Metabolic modulation of glioblastoma with dichloroacetate, » Science Translational Medicine, vol. 2, no. 31, pp. 31-ra34, 2010.
[26] T. Fernandes-Alnemri, G. Litwack et E. S. Alnemri, » CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1β-converting enzyme « , The Journal of Biological Chemistry, vol. 269, no. 49, pp. 30761-302, 2010. 49, pp. 30761-30764, 1994.
[27] H. Mehmet, » Caspases find a new place to hide « , Nature, vol. 403, no 6765, p. 29-30, 2000.
[28 ] E. Yang et S. J. Korsmeyer, « Molecular thanatopsis : a discourse on the BCL2 family and cell death », Blood, vol. 88, no. 2, pp. 386-401, 1996.
[29] D. R. Green et J. C. Reed, « Mitochondria and apoptosis, » Science, vol. 281, no. 5381, pp. 1309-1312, 1998.
[30] J. C. Reed, « Double identity for proteins of the Bcl-2 family », Nature, vol. 387, no. 6635, pp. 773-776, 1997.
[31 ] B. Antonsson, S. Montessuit, B. Sanchez, et J. C. Martinou, « Bax is present as a high molecular weight oligomer/complex in the mitochondrial membrane of apoptotic cells, » The Journal of Biological Chemistry, vol. 276, no. 15, pp. 11615- 11623, 2001.