A.G. Fedorchuk, O.N. Pyaskovskaya, G.V. Gorbik, I.V. Prokhorova, D.L. Kolesnik, G.I. Solyanik
1R.E. Kavetsky Instituto de Patología Experimental, Oncología y Radiobiología, NAS de Ucrania, Kyiv 03022, Ucrania.
Correspondencia: [email protected]
Enviado: 17 de mayo de 2016
Resumen
Antecedentes: La acción anticancerígena del dicloroacetato de sodio (DCA) podría estar relacionada con su capacidad para activar la fosforilación oxidativa, lo que conduce a una mayor generación de especies reactivas de oxígeno y a la inducción de la apoptosis. Por otro lado, la activación de la fosforilación oxidativa podría promover la supervivencia de las células tumorales, en particular, a través del aumento de la síntesis de ATP. Estos efectos ambiguos del DCA podrían influir en su eficacia anticancerígena, dependiendo de las propiedades biológicas de un tumor, el calendario de administración del DCA y su dosificación. El objetivo del estudio fue analizar el efecto anticancerígeno del DCA contra el glioma С6 en ratas en condiciones de diferentes horarios de su administración y varias dosis.
Materiales y métodos: El estudio se llevó a cabo en ratas Wistar con células de glioma С6 transplantadas intracerebralmente. La terapia con DCA se realizó de la siguiente manera: diariamente durante 6 días a partir del segundo día después del trasplante de células tumorales (esquema І) o 7(º) día (esquema ІІ) a una dosis de 1,0 g/kg, o diariamente durante 13 días a partir del segundo día a dosis de 1,0; 1,5 o 4,5 g/kg (esquema ІІІ). Se estudió la influencia de la hipoxia en el efecto anticancerígeno del DCA utilizando cámaras hipóxicas en las que el contenido de oxígeno se mantuvo a un nivel del 12,5-13% durante 3 h después de la administración de DCA a ratas portadoras de glioma С6. El estado de los componentes de la cadena mitocondrial de transporte de electrones en las células tumorales se estudió mediante resonancia paramagnética electrónica.
Resultados: Se ha demostrado que la terapia con DCA utilizando el esquema I resultó en una disminución del 15% de la vida útil de los animales (LS; < 0,05), mientras que el uso del esquema II no tuvo ningún efecto sobre este índice. La administración prolongada de DCA (esquema ІІІ) produjo un efecto antitumoral significativo y aumentó la LS de las ratas en un 25,5% (p < 0,05). En condiciones de hipoxia, el tratamiento con DCA produjo un aumento significativo del LS de los animales en un 15-22%. La dosis de DCA tuvo un efecto moderado de su acción anticancerígena. El efecto máximo, un aumento del LS en un 34,5% (p < 0,05) se detectó a una dosis de 1,5 g/kg. Se ha demostrado que la actividad anticancerígena del DCA en todas las condiciones estudiadas no está relacionada con su influencia en el estado funcional de las mitocondrias de las células tumorales.
Conclusiones: El efecto anticancerígeno del DCA depende significativamente del horario de su administración; siendo administrado a igual dosis total, pero dependiendo del horario el DCA podría causar efectos ambiguos que varían desde la estimulación del crecimiento tumoral hasta una actividad anticancerígena significativa. En condiciones de hipoxia, la eficacia anticancerígena del DCA contra el glioma С6 es significativamente mayor.
Palabras clave: dicloroacetato sódico, glioma С6, cadena de transporte de electrones mitocondrial.
Abreviaturas utilizadas: DCA: dicloroacetato sódico; EPR: resonancia paramagnética electrónica; LS: esperanza de vida; MtETC: cadena mitocondrial de transporte de electrones; PDH: piruvato deshidrogenasa cinasa; ROS: especies reactivas del oxígeno.
INTRODUCCIÓN
Según las estadísticas de la Organización Mundial de la Salud, la tasa media de incidencia de tumores cerebrales es de 10,9-12,8 por 100 000 habitantes [1]. Casi el 60% de todos los tumores del sistema nervioso central son neoplasias malignas, entre las cuales los gliomas representan hasta el 50-55%. Según los datos estadísticos, los gliomas representan sólo el 1,4% de todos los tumores diagnosticados clínicamente, pero el pronóstico de los pacientes con glioma es el más desfavorable. El tiempo medio de supervivencia de los pacientes con glioma maligno tras su diagnóstico primario es de aproximadamente 8 meses en Ucrania y 14 meses en EE.UU. [2]. Por eso la terapia de los pacientes con gliomas de diferente grado de malignidad es uno de los problemas más importantes de la oncología clínica moderna.
A pesar del desarrollo de numerosos medios anticancerosos novedosos, en la actualidad el enfoque principal para la terapia de pacientes con glioma sigue siendo una «terapia de desesperación», es decir, la cirugía, pero su eficacia es insuficientemente baja [3, 4]. Se supone que la ineficacia de la extirpación radical de los gliomas se debe en gran medida a la invasión tumoral en los tejidos normales circundantes, con la formación de márgenes indiscretos que se reducen significativamente.
Los protocolos modernos de radioterapia del glioma maligno recomiendan una irradiación fraccionada con dosis diarias bajas (> 2 Gy), con una dosis total de 60-90 Gy [5]. Sin embargo, ni siquiera los métodos modernos de irradiación podrían ayudar a superar una eficacia extremadamente baja de la terapia, debido a la alta radioresistencia del glioma causada por el desarrollo de hipoxia local [6].
Los quimioterápicos (incluidos los agentes diana) son poco eficaces en el caso de los gliomas debido a su escasa biodisponibilidad [7-10]. Por ejemplo, en la mayoría de los casos, el análisis de la biopsia del glioma maligno evidencia la presencia de una barrera hematoencefálica defectuosa pero funcional que impide el paso de muchos preparados diana (especialmente anticuerpos contra factores de crecimiento y receptores). Para el tratamiento del glioma maligno sólo se utiliza un preparado citostático alquilante, la temozolomida. Hay que tener en cuenta que la respuesta a la terapia con temozolomida sólo se observa en el 5-8% de los pacientes en monoterapia, y en aproximadamente el 20% de los pacientes en terapia adyuvante con temozolomida combinada con radioterapia o tratamiento quirúrgico [11, 12].
Se sabe que en una gran parte de los tumores malignos el ATP se genera a través de la glucólisis incluso en presencia de oxígeno (efecto Warburg). La glucólisis aeróbica es una forma poco eficaz de generación de ATP, pero favorece el alto potencial proliferativo de las células tumorales y promueve su supervivencia disminuyendo el riesgo de formación de estímulos apoptóticos [13, 14
]. Por lo tanto, en los últimos años el metabolismo tumoral, que proporciona estos beneficios para el crecimiento, se considera una nueva diana para la terapia anticancerosa, y los compuestos capaces de inhibir la glucólisis en las células tumorales se estudian como agentes anticancerosos potencialmente eficaces [15-17
]. Entre los agentes antimetabólicos activos contra muchos tipos de células cancerosas se puede mencionar el dicloroacetato sódico (DCA) [18-20].
El DCA inhibe la piruvato deshidrogenasa cinasa (PDH), lo que provoca una activación indirecta de las enzimas del complejo PDH y, en consecuencia, un desplazamiento del metabolismo celular desde la glucólisis hacia la fosforilación oxidativa. En un caso de activación de la fosforilación oxidativa y disminución de la intensidad de la glucólisis tras la acción del DCA, cabría esperar una inhibición de la proliferación de células tumorales causada, en particular, por una disminución significativa del contenido de metabolitos de derivación de pentosa-fosfato y piruvato importantes para la síntesis de proteínas y ácidos nucleicos. La activación del metabolismo mitocondrial inducida por el DCA puede conducir al bloqueo de la proliferación de las células tumorales y al aumento de la generación de especies reactivas del oxígeno (ROS) y la inducción de la apoptosis. Sin embargo, a pesar de la aparencia teórica de la acción anticancerígena del DCA, su eficacia no está garantizada. Como se ha demostrado [21], en un amplio rango de concentraciones el DCA ejerce una acción citostática pero no citotóxica, lo que es apoyado por los datos sobre la ausencia de su efecto sobre el nivel intracelular de ROS, la tasa de producción de lactato y la tasa de apoptosis en células de glioma С6.
Además, es necesario tener en cuenta que la activación de la fosforilación oxidativa inducida por el DCA puede resultar no sólo en un efecto anticancerígeno, sino que también puede promover la supervivencia de las células tumorales a través del aumento de la síntesis de ATP. Esta influencia ambivalente sobre la supervivencia de las células tumorales predispone a una variabilidad de la actividad del DCA [22, 23]. Las propiedades biológicas de un tumor, los horarios de administración del DCA y sus dosis podrían afectar significativamente a su eficacia anticancerígena.
El objetivo del estudio fue analizar la eficacia anticancerígena del DCA contra el glioma С6 en ratas en condiciones de diferentes horarios de su administración y dosificación.
MATERIALES Y METODOS
El estudio se llevó a cabo en ratas hembra Wistar de 2,5-3 meses de edad con un peso de 90-150 g, criadas en el animalario del Instituto R.E. Kavetsky de Patología Experimental, Oncología y Radiobiología de la Academia Nacional de Ciencias de Ucrania (IEPOR). El uso y cuidado de los animales de experimentación se ha realizado de acuerdo con las normas internacionales estándar de ética biológica y fue aprobado por el Comité Institucional de Cuidado y Uso de Animales. La línea celular de glioma С6 se obtuvo del Banco Nacional de Líneas Celulares y Cepas Tumorales del IEPOR.
Las células de glioma С6 se cultivaron in vitro en medio de cultivo DMEM suplementado con 10% de FBS (Sigma, EE.UU.), 2 mM de L-glutamina y 40 mg/ml de gentamicina a 37 °С en atmósfera humidificada con 5% de СО2. El trasplante de células de glioma С6 se realizó bajo anestesia total mediante inoculación intracerebral de 0,6-106 células en 0,05 ml de solución fisiológica en una zona parietal izquierda (asta anterior del ventrículo lateral izquierdo).
La solución acuosa de DCA (Sigma-Aldrich, EE.UU.) se administró diariamente per os a través de un tubo en un volumen de 3 ml por animal. La terapia con DCA se llevó a cabo con diferentes horarios y a diferentes dosis, como sigue:
- esquema І – el DCA se administró diariamente durante 6 días a partir del segundo día después del trasplante de células tumorales a una dosis total de 1,0 g/kg;
- esquema ІІ – DCA se administró diariamente durante 6 días a partir delséptimo día después del trasplante de células tumorales a una dosis total de 1,0 g/kg;
- esquema ІІІ – DCA se administró diariamente durante 13 días a partir del segundo día a dosis totales de 1,0; 1,5 o 4,5 g/kg.
Todos los animales de los grupos de control correspondientes recibieron 3,0 ml de agua para inyecciones según los horarios de administración del DCA. Había 13-15 ratas por cada grupo.
El día 14 después de la inoculación de las células tumorales se sacrificaron 4-5 ratas de cada grupo bajo narcosis con éter, se recogió sangre y se tomó tejido cerebral para su posterior examen.
Los cambios en el tiempo de supervivencia (TST) de los animales restantes sirvieron como índice del efecto anticanceroso del tratamiento calculado mediante una fórmula:
CST (%) = 100 (ST – STC)/STC,
donde ST y STСsonel tiempo de supervivencia de las ratas de los grupos experimental y de control, respectivamente.
Se estudió la influencia de la hipoxia (inhibidor de la fosforilación oxidativa) sobre el efecto anticancerígeno del DCA utilizando cámaras hipóxicas en las que el contenido de oxígeno se mantuvo a un nivel del 12,5-13% durante 3 h tras la administración de DCA a ratas portadoras de glioma С6. El contenido de oxígeno en las cámaras hipóxicas se controló con el oxímetro ISO2 (World Precision Instruments, EE.UU.). Los efectos anticancerígenos del tratamiento se evaluaron mediante la prolongación del tiempo de supervivencia de los animales con glioma С6.
Los cambios del estado de los componentes de la cadena mitocondrial de transporte de electrones (MtETC) en las células tumorales se analizaron mediante el método de resonancia paramagnética de electrones. Electron paramagnetic resonance (EPR)-análisis de las muestras se realizó en 77 К utilizando espectrofotómetro Е-109 Varian (USA). Mediante los datos de la espectroscopia EPR, se determinaron los niveles de centros reducidos de hierro-azufre (Fe-S) no hemo (g = 1,94) de las proteínas MtETC, complejos nitrosilo (NO) de hierro hemo (gсер= 2,01) y complejos nitrosilo Fe-S (gсер= 2,03).
El análisis estadístico de los datos se realizó mediante métodos descriptivos, análisis de correlación, análisis de regresión no lineal, prueba t de Student y prueba U de Mann – Whitney, con el uso de Microsoft Excel, Microcal Origin y Statistica. Los datos se presentan como M ± m.
RESULTADOS Y DISCUSIÓN
Los resultados del estudio han demostrado que la eficacia del DCA contra el glioma С6 depende de la pauta de administración y aumenta significativamente si los animales se mantienen en condiciones de hipoxia durante 3 h después de la administración de este agente.
Como se puede ver (Tabla 1), la terapia con DCA por el esquema I resultó en una disminución del 15% de la vida útil de los animales (LS; р < 0,05). Tras la aplicación del esquema II, que difiere del esquema I por el inicio más tardío del tratamiento, no se observó ningún efecto sobre la esperanza de vida de los animales de experimentación. La administración prolongada de DCA (esquema ІІІ) produjo un efecto antitumoral significativo y aumentó la EV de las ratas en un 25,5% (p < 0,05).
Habitualmente, en los ensayos preclínicos, la eficacia de los agentes anticancerígenos cuya administración comienza en el fondo de un tumor ya desarrollado (días 7-10 tras la inoculación de células tumorales), es menor en comparación con la que se obtiene si dichos agentes se administran en términos más tempranos (día 2 tras la inoculación de células tumorales). Sin embargo, nuestros datos han demostrado lo contrario: la eficacia del DCA es mayor contra un tumor desarrollado. Se sabe que un tumor desarrollado se caracteriza por el desarrollo de hipoxia intratumoral. Un aumento de LS de ratas con glioma С6 después de la administración prolongada de DCA en el fondo de un tumor desarrollado podría estar relacionado con el desarrollo de la hipoxia intratumoral en cuanto a la activación inducida por DCA de la fosforilación oxidativa en condiciones de deficiencia de oxígeno disminuye significativamente la síntesis de ATP y, en consecuencia, puede resultar en la muerte de las células tumorales. Esta suposición está de acuerdo con los resultados del estudio que analizó la influencia de la hipoxia en la eficacia de la acción citotóxica/citostática del DCA contra las células de glioma С6 in vitro. Como se ha demostrado [21], el aumento significativo de la acción citotóxica del DCA contra las células de glioma С6 en condiciones de hipoxia (disminución triple de la IC50 del DCA frente a la que se produce en condiciones de normoxia de cultivo) se determinó por la necrosis de alto nivel inducida por el DCA de las células.
La administración de DCA en condiciones hipóxicas produjo un aumento significativo de su efecto anticancerígeno. En particular, en el caso del esquema I la administración del DCA en condiciones de hipoxia no tuvo ningún efecto sobre el LS de los animales de experimentación, mientras que en ausencia de hipoxia dicha terapia estimuló el proceso tumoral y causó una reducción del 15% del LS. Al ser administrado por el esquema II en condiciones de hipoxia, el DCA prolongó significativamente la LS de las ratas en un 22% en comparación con los animales tratados con DCA en condiciones de normoxia (Tabla 1). Sin embargo, es necesario tener en cuenta que se observó una variabilidad significativa de la acción antiglioma del DCA según los diferentes esquemas de administración en condiciones de hipoxia y normoxia.
| Tipo de terapia | Pauta de administración del DCA | Esquema de administración de DCA | Programa de administración de DCA | Cambio de LS, en % |
| Número | Inicio (día) | Duración del tratamiento (días) | ||
| DCA | І | 2º | 6 | -15.0 |
| DCA | ІІ | 7 | 6 | 0 |
| DCA | ІІІ | 2º | 13 | 25.5 |
| DCA + hipoxia | І | 2º | 6 | 0 |
| DCA + hipoxia | ІІ | 7 | 6 | 22 |
Entre los posibles mecanismos de accion anticancerosa de los inhibidores del metabolismo energetico de las celulas tumorales, incluido el DCA, se puede mencionar la capacidad de estos agentes de ejercer un efecto nocivo sobre el estado funcional del MtETC en las celulas tumorales a traves de la activacion de la fosforilacion oxidativa, la hipoxia y la posible deficiencia del sistema mitocondrial. Por ello, hemos estudiado la influencia del DCA en el estado funcional de MtETC mediante espectroscopia EPR.
La alta invasividad del glioma complica una separación precisa del tumor y los tejidos normales. Por eso para la preparación de las muestras de EPR hemos utilizado el tejido del hemisferio cerebral con el tumor, y para una comparación – el tejido del hemisferio cerebral sin tumor.
Como índices del estado funcional del MtETC hemos utilizado los niveles de complejos NO del hierro hemo mitocondrial (que refleja una acción dañina de ROS y nitrógeno hacia el ETC), y el contenido de centros Fe-S, que reflejan directamente un estado funcional de este sistema energético.
Un análisis de los efectos del DCA en condiciones de normoxia e hipoxia sobre el estado funcional del MtETC en células de glioma С6 reveló una ausencia de correlación entre la funcionalidad del MtETC y la LS de los animales experimentales (Tabla 2).
Como se muestra en la Tabla 2, la administración de DCA por todos los esquemas en condiciones de normoxia e hipoxia no tuvo ningún efecto sobre los niveles de los centros Fe-S en el hemisferio cerebral con glioma С6, incluso en el fondo de un aumento significativo (más del 46,7%) del nivel de nitrosilación de las proteínas hem registradas después de la administración de DCA en condiciones de normoxia. Se supone que una disminución del contenido de los centros Fe-S en el tejido tumoral caracteriza un mal funcionamiento de MtETC que resulta en la muerte de las células tumorales. La ausencia de cambios en el contenido de los centros Fe-S indica que la acción anticancerígena del DCA no está relacionada con su influencia sobre el estado funcional de las mitocondrias en las células С6 del glioma.
| Grupo de animales | Hemisferio cerebral con glioma | ||
| Esquema І | Programa ІІ | Programa ІІІ | |
| Intensidad de la señal EPR para los complejos NO-heme (g = 2,01; u.a.) | |||
| Control | 100.0 ± 2.9 | 100.0 ± 6.5 | 100.0 ± 1.4 |
| DCA | 153.1 ± 21.7* | 146.7 ± 13.0* | 152.4 ± 20.8* |
| DCA + hipoxia | 87.4 ± 14.3 | 148.4 ± 9.8* | 103.6 ± 10.7 |
| Intensidad de la señal EPR para los centros Fe-S (g=1,94; a.u.) | |||
| Control | 100.0 ± 40.4 | 100.0 ± 19.1 | 100.0 ± 28.9 |
| DCA | 97.5 ± 17.4 | 112.4 ± 23.0 | 83.3 ± 19.2 |
| DCA + hipoxia | 100.6 ± 37.3 | 115.1 ± 40.0 | 108.3 ± 16.0 |
Nota: *p < 0,05, las diferencias son significativas en comparación con el valor del control.
Al contrario que en las muestras de tejido cerebral con glioma, el contenido de complejos NO-heme en el tejido cerebral normal tras la administración de DCA mediante esquemas І y ІІІ disminuyó significativamente en más de un 17% en condiciones de normoxia e hipoxia (Tabla 3). Sin embargo, el nivel de centros Fe-S en el tejido cerebral normal permaneció inalterado.
| Grupo de animales | Hemisferio cerebral sin glioma | ||
| Programa І | Programa ІІ | Programa ІІІ | |
| Intensidad de la señal EPR para los complejos NO-heme (g = 2,01; u.a.) | |||
| Control | 100.0 ± 3.4 | 100.0 ± 4.3 | 100.0 ± 2.7 |
| DCA | 82.8 ± 3.4* | 119.6 ± 2.9* | 82.9 ± 3.6* |
| DCA + hipoxia | 72.1 ± 9.9* | 123.0 ± 9.1 | 56.8 ± 20.4* |
| Intensidad de la señal EPR para los centros Fe-S (g = 1,94; a.u.) | |||
| Control | 100.0 ± 34.0 | 100.0 ± 5.3 | 100.0 ± 20.0 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + hipoxia | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Nota: *p < 0,05, las diferencias son significativas en comparación con el valor del control.
El estudio de los efectos de la dosificación de DCA en el LS de las ratas se realizó mediante el esquema con mayor eficacia anticancerígena. Se ha demostrado que la dosis de DCA afectaba moderadamente a la eficacia de su acción antiglioma (Figura, Tabla 4). El efecto máximo se registró si el DCA se administraba a una dosis de 1,5 g/kg: El LS de los animales experimentales aumentó en un 34,5% (p < 0,05). Un aumento de la dosis de DCA hasta 4,5 g/kg no condujo a un mayor aumento de su eficacia: el LS de las ratas fue significativamente mayor que el de los animales de control no tratados con DCA, pero no difirió del de los animales tratados con una dosis de 1,0 g/kg.
Un análisis de los efectos del DCA tras su administración prolongada a diferentes dosis no reveló cambios significativos en los niveles de nitrosilación de las proteínas hemo y el contenido de los centros Fe-S en las células del hemisferio cerebral con glioma (Tabla 5), y el tejido cerebral normal (Tabla 6).
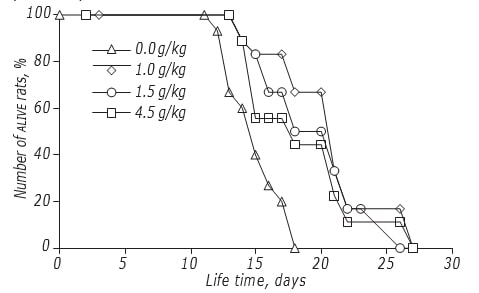
| Dosis total, g/kg | Calendario de administración | Inicio (día) | Duración de la terapia (días) | Variación del LS, % |
|---|---|---|---|---|
| 1.0 | III | iI | 13 | +25.5 |
| 1.5 | III | 2ª | 13 | +34.5 |
.
| Grupo de animales | Hemisferio cerebral con glioma | ||
| DІ | D2 | D3 | |
| Intensidad de la señal EPR para los complejos NO-heme (g = 2,01; u.a.) | |||
| Control | 100.0 ± 1.4 | 100.0 ± 3.5 | 100.0 ± 3.5 |
| DCA | 152.4 ± 20.8* | 93.1 ± 13.0 | 103.0 ± 3.1 |
| Intensidad de la señal EPR para los centros Fe-S (g=1,94; a.u.) | |||
| Control | 100.0 ± 28.9 | 100.0 ± 5.5 | 100.0 ± 5.5 |
| DCA | 83.3 ± 19.2 | 88.1 ± 12.1 | 101.2 ± 10.6 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + hipoxia | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Nota: *p < 0,05, las diferencias son significativas en comparación con el valor del control.
.
| Grupo de animales | Hemisferio cerebral sin glioma | ||
| DІ | D2 | D3 | |
| Intensidad de la señal EPR para los complejos NO-heme (g = 2,01; u.a.) | |||
| Control | 100.0 ± 2.7 | 100.0 ± 13.0 | 100.0 ± 13.0 |
| DCA | 82.9 ± 3.6* | 94.2 ± 2.7 | 79.4 ± 5.4 |
| Intensidad de la señal EPR para los centros Fe-S (g = 1,94; a.u.) | |||
| Control | 100.0 ± 20.0 | 100.0 ± 15.5 | 100.0 ± 15.5 |
| DCA | 101.3 ± 28.1 | 118.6 ± 3.6 | 102.4 ± 6.9 |
Nota: *p < 0,05, las diferencias son significativas en comparación con el valor del control.
.
La ausencia de tales cambios junto con una alta eficacia anticancerígena del DCA (especialmente a una dosis de 1,5 g/kg) demostró una vez más que los efectos del DCA contra el glioma С6 no tienen relación con un estado funcional de las mitocondrias de las células tumorales.
En conclusión, los resultados de nuestro estudio han demostrado que la eficacia anticancerígena del DCA depende significativamente del horario de su administración, con lo cual varía desde una disminución significativa del LS en correlación directa con la estimulación del crecimiento tumoral, hasta un efecto anticancerígeno significativo y un aumento del LS de las ratas en un 25,5%. La administración metronómica prolongada de DCA proporciona una mejor eficacia anticancerígena con una baja variabilidad entre las dosis. Asimismo, se ha demostrado que las condiciones de hipoxia de los animales elevan significativamente la eficacia antiglioma del DCA. Además, la actividad anticancerígena de este agente no está relacionada con sus efectos sobre el estado funcional de las mitocondrias de las células tumorales.
REFERENCIAS
1 Weller M, Wick W, Aldape K, et al. Glioma. Nat Rev Dis Primers 2015; 1: 15017. doi: 10.1038/nrdp.2015.17.2 Zozulya YuA, Vasil’ev IG, Glavacky AYa, et al. Gliomas cerebrales. Estado actual del problema y tendencias de futuras investigaciones. Zozulya YuA, ed. Kiev: ExOb, 2007. 631 p. (en ruso).
3 Aghi MK, Nahed BV, Sloan AE, et al. The role of surgery in the management of patients with diffuse low grade glioma: Una revisión sistemática y guía de práctica clínica basada en la evidencia. J Neurooncol 2015; 125: 503-30.
4 Hervey-Jumper SL, Berger MS. Matices técnicos de la cirugía despierta de tumores cerebrales y el papel de la resección máxima segura. J Neurosurg Sci 2015; 59: 351-60.
5 Laperriere N, Zuraw L, Cairncross G. Radioterapia para el glioma maligno recién diagnosticado en adultos: una revisión sistemática. Radiother Oncol 2002; 64: 259-73.
6 Ryken TC, Parney I, Buatti J, et al. The role of radiotherapy in the management of patients with diffuse low grade glioma: Una revisión sistemática y guía de práctica clínica basada en la evidencia. J Neurooncol 2015; 125: 551-83.
7 Norden AD, Drappatz J, Wen PY. Nuevas terapias antiangiogénicas para gliomas malignos. Lancet Neurol 2008; 7: 1152-60.
8 Huang TT, Sarkaria SM, Cloughesy TF, Mischel PS. Targeted therapy for malignant glioma patients: lessons learned and the road ahead. J Neurother 2009; 6: 500-12.
9 Staedtke V, Bai RY, Laterra J. Nuevos fármacos en investigación para el cáncer cerebral. Expert Opin Investig Drugs 2016; 17: 1-20.
10 Kang JH, Adamson C. Nuevos quimioterápicos y otras terapias para el tratamiento del glioma de alto grado. Expert Opin Investig Drugs 2015; 24: 1361-79.
11 Baritchii A, Jurj A, Soritau O, et al. Fármacos sensibilizadores para el tratamiento del glioblastoma resistente a la temozolomida. J BUON 2016; 21: 199-207.
12 Mallick S, Gandhi AK, Rath GK. Enfoque terapéutico más allá de la temozolomida convencional para el glioblastoma recién diagnosticado: Revisión de la evidencia actual y dirección futura. Indian J Med Paediatr Oncol 2015; 36: 229-37.
13 Gatenby RA, Gillies RJ. Por qué los cánceres tienen alta glucólisis aeróbica? Nat Rev Cancer 2004; 4: 891-9.
14 Kim JW, Dang CV. Multifaceted roles of glycolytic enzymes. Trends Biochem Sci 2005; 30: 142-50.
15 Jin S, DiPaola RS, Mathew R, White E. Metabolic catastrophe as a means to cancer cell death. J Cell Sci 2007; 3: 379-83.
16 Seyfried TN, Kiebish MA, Marsh J. Metabolic management of brain cancer. Biochim Biophys Acta 2011; 6: 577-94.
17 Decollogne S, Dilda PJ, Hau E, et al. Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 2015; 34: 14.
18 Kankotia S, Stacpoole PW. Dicloroacetato y cáncer: ¿nuevo hogar para un medicamento huérfano? Biochim Biophys Acta 2014; 1846: 617-29.
19 Stacpoole PW. El dilema del dicloroacetato: peligro ambiental versus mina de oro terapéutica, ¿ambos o ninguno? Environ Health Perspect 2011; 119: 155-8.
20 Michelakis ED, Webster L, Mackey JR. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 2008; 99: 989-94.
21 Kolesnik DL, Pyaskovskaya ON, Boichuk IV, Solyanik GI. Hypoxia enhances antitumor activity of dichloroacetate. Exp Oncol 2014; 36: 231-5.
22 James MO, Stacpoole PW. Consideraciones farmacogenéticas con la dosificación de dicloroacetato. Farmacogenómica 2016; doi:10.2217/pgs-2015-0012.
23 Dunbar EM, Coats BS, Shroads AL, et al. Ensayo de fase 1 de dicloroacetato (DCA) en adultos con tumores cerebrales malignos recurrentes. Invest New Drugs 2014; 32: 452-64.