A.G. Fedorchuk, O.N. Pyaskovskaya, G.V. Gorbik, I.V. Prokhorova, D.L. Kolesnik, G.I. Solyanik
1R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, NAS of Ukraine, Kyiv 03022, Ukraine.
Correspondance : [email protected]
Soumis : 17 mai 2016
Résumé
Contexte : L’action anticancéreuse du dichloroacétate (DCA) de sodium pourrait être liée à sa capacité à activer la phosphorylation oxydative conduisant à une génération accrue d’espèces réactives de l’oxygène et à l’induction de l’apoptose. D’autre part, l’activation de la phosphorylation oxydative pourrait favoriser la survie des cellules tumorales, notamment par une synthèse accrue d’ATP. Ces effets ambigus du DCA pourraient influencer son efficacité anticancéreuse, en fonction des propriétés biologiques d’une tumeur, du calendrier d’administration du DCA et de son dosage. L’objectif de l’étude était d’analyser l’effet anticancéreux du DCA contre le gliome С6 chez les rats dans des conditions de différents schémas d’administration et de divers dosages.
Matériaux et méthodes : L’étude a été réalisée chez des rats Wistar avec des cellules de gliome С6 transplantées par voie intracérébrale. Le traitement par DCA a été réalisé comme suit : quotidiennement pendant 6 jours à partir du deuxième jour après la transplantation des cellules tumorales (schéma І) ou du 7(ème) jour (schéma ІІ) à une dose de 1,0 g/kg, ou quotidiennement pendant 13 jours à partir du deuxième jour à des doses de 1,0 ; 1,5 ou 4,5 g/kg (schéma ІІІ). L’influence de l’hypoxie sur l’effet anticancéreux du DCA a été étudiée à l’aide de chambres hypoxiques où la teneur en oxygène était maintenue à un niveau de 12,5-13 % pendant 3 h après l’administration de DCA à des rats porteurs de gliomes С6. L’état des composants de la chaîne de transport d’électrons mitochondriale dans les cellules tumorales a été étudié par résonance paramagnétique électronique.
Résultats : Il a été montré que le traitement au DCA selon le schéma I a entraîné une diminution de 15 % de la durée de vie des animaux (LS ; < 0,05), tandis que l’utilisation du schéma II n’a eu aucun effet sur cet indice. L’administration prolongée de DCA (schéma ІІІ) a eu un effet antitumoral significatif et a augmenté la durée de vie des rats de 25,5 % (p < 0,05). Dans des conditions d’hypoxie, le traitement par le DCA a entraîné une augmentation significative de la LS des animaux de 15 à 22 %. La dose de DCA a eu un effet modéré de son action anticancéreuse. L’effet maximal, une augmentation du LS de 34,5 % (p < 0,05) a été détecté à une dose de 1,5 g/kg. Il a été démontré que l’activité anticancéreuse du DCA dans toutes les conditions étudiées n’est pas liée à son influence sur l’état fonctionnel des mitochondries des cellules tumorales.
Conclusion : L’effet anticancéreux du DCA dépend de manière significative de son schéma d’administration ; administré à une dose totale égale, mais dépendant du schéma, le DCA pourrait provoquer des effets ambigus allant de la stimulation de la croissance tumorale à une activité anticancéreuse significative. Dans des conditions hypoxiques, l’efficacité anticancéreuse du DCA contre le gliome С6 est considérablement accrue.
Mots clés : dichloroacétate de sodium, gliome С6, chaîne de transport d’électrons mitochondriale.
Abréviations utilisées : DCA – dichloroacétate de sodium ; RPE – résonance paramagnétique électronique ; LS – durée de vie ; MtETC – chaîne de transport d’électrons mitochondriale ; PDH – pyruvate déshydrogénase kinase ; ROS – espèces réactives de l’oxygène.
INTRODUCTION
Selon les statistiques de l’Organisation mondiale de la santé, l’incidence moyenne des tumeurs cérébrales est de 10,9-12,8 pour 100 000 habitants [1]. Près de 60 % de toutes les tumeurs du système nerveux central sont des néoplasmes malins, parmi lesquels les gliomes représentent 50 à 55 %. D’après les statistiques, les gliomes ne représentent que 1,4 % de toutes les tumeurs diagnostiquées cliniquement, mais le pronostic des patients atteints de gliomes est le plus défavorable. La durée moyenne de survie des patients atteints de gliome malin après le diagnostic primaire est d’environ 8 mois en Ukraine et de 14 mois aux Etats-Unis [2]. C’est pourquoi la thérapie des patients atteints de gliomes de différents grades de malignité fait partie des problèmes les plus importants de l’oncologie clinique moderne.
Malgré le développement de nombreux nouveaux moyens anticancéreux, à l’heure actuelle, la principale approche thérapeutique des patients atteints de gliomes reste la « thérapie du désespoir », c’est-à-dire la chirurgie, mais son efficacité est insuffisamment faible [3, 4]. On suppose que l’inefficacité de l’ablation radicale des gliomes est en grande partie due à l’invasion de la tumeur dans les tissus normaux environnants, la formation de marges indiscrètes réduisant considérablement cette invasion.
Les protocoles modernes de radiothérapie des gliomes malins recommandent une irradiation fractionnée avec de faibles doses quotidiennes (> 2 Gy), avec une dose totale de 60-90 Gy [5]. Cependant, même les méthodes modernes d’irradiation n’ont pas pu aider à surmonter l’efficacité extrêmement faible de la thérapie, due à la radiorésistance élevée du gliome causée par le développement d’une hypoxie locale [6].
Les chimiothérapies (y compris les agents cibles) sont peu efficaces dans le cas des gliomes en raison de leur faible biodisponibilité [7-10]. Par exemple, dans la majorité des cas, l’analyse de la biopsie d’un gliome malin met en évidence la présence d’une barrière hémato-encéphalique défectueuse mais fonctionnelle qui empêche le passage de nombreuses préparations cibles (notamment les anticorps contre les facteurs de croissance et les récepteurs). Pour le traitement du gliome malin, une seule préparation cytostatique alkylante, le temozolomide, est utilisée. Il convient de noter qu’une réponse au traitement par le témozolomide ne peut être observée que chez 5 à 8 % des patients en cas de monothérapie, et chez environ 20 % des patients en cas de traitement adjuvant par le témozolomide associé à une radiothérapie ou à un traitement chirurgical [11, 12].
On sait que dans une grande partie des tumeurs malignes, l’ATP est généré par la glycolyse, même en présence d’oxygène (effet Warburg). La glycolyse aérobie est un moyen peu efficace de générer de l’ATP, mais elle soutient le potentiel prolifératif élevé des cellules tumorales et favorise leur survie en diminuant le risque de formation de stimuli apoptotiques [13, 14]. Par conséquent, ces dernières années, le métabolisme tumoral, qui fournit ces avantages en termes de croissance, est considéré comme une nouvelle cible pour la thérapie anticancéreuse, et les composés capables d’inhiber la glycolyse dans les cellules tumorales sont étudiés comme des agents anticancéreux potentiellement efficaces [15-17]. Parmi les agents antimétaboliques actifs contre de nombreux types de cellules cancéreuses, on peut citer le dichloroacétate de sodium (DCA) [18-20].
Le DCA inhibe la pyruvate déshydrogénase kinase (PDH), ce qui entraîne une activation indirecte des enzymes du complexe PDH et, par conséquent, un déplacement du métabolisme cellulaire de la glycolyse vers la phosphorylation oxydative. Dans le cas d’une activation de la phosphorylation oxydative et d’une diminution de l’intensité de la glycolyse lors de l’action du DCA, on pourrait s’attendre à une inhibition de la prolifération des cellules tumorales causée, en particulier, par une diminution significative du contenu des métabolites de la dérivation du pentose-phosphate et du pyruvate importants pour la synthèse des protéines et des acides nucléiques. L’activation du métabolisme mitochondrial induite par le DCA peut conduire au blocage de la prolifération des cellules tumorales et à l’augmentation de la génération d’espèces réactives de l’oxygène (ROS) et à l’induction de l’apoptose. Cependant, malgré l’apparence théorique de l’action anticancéreuse du DCA, son efficacité n’est pas garantie. Comme il a été démontré [21], à une large gamme de concentrations, le DCA exerce une action cytostatique mais pas cytotoxique, ce qui est soutenu par les données sur l’absence de son effet sur le niveau intracellulaire de ROS, le taux de production de lactate et le taux d’apoptose dans les cellules de gliome С6.
En outre, il est nécessaire de noter que l’activation de la phosphorylation oxydative induite par le DCA peut non seulement avoir un effet anticancéreux, mais aussi favoriser la survie des cellules tumorales par une synthèse accrue d’ATP. Cette influence ambivalente sur la survie des cellules tumorales prédispose à une variabilité de l’activité du DCA [22, 23]. Les propriétés biologiques d’une tumeur, les horaires d’administration du DCA et ses doses peuvent affecter de manière significative son efficacité anticancéreuse.
L’objectif de l’étude était d’analyser l’efficacité anticancéreuse du DCA contre le gliome С6 chez les rats dans des conditions de différents schémas d’administration et de dosage.
MATÉRIEL ET MÉTHODES
L’étude a été réalisée sur des rats Wistar femelles âgés de 2,5 à 3 mois et pesant de 90 à 150 g, élevés dans l’animalerie de l’Institut R.E. Kavetsky de pathologie expérimentale, d’oncologie et de radiobiologie de l’Académie nationale des sciences d’Ukraine (IEPOR). L’utilisation et les soins des animaux expérimentaux ont été réalisés conformément aux règles internationales standard d’éthique biologique et ont été approuvés par le comité institutionnel de soins et d’utilisation des animaux. La lignée cellulaire de gliome С6 a été obtenue auprès de la Banque nationale de lignées cellulaires et de souches tumorales de l’IEPOR.
Les cellules de gliome С6 ont été cultivées in vitro dans un milieu de culture DMEM complété par 10% de FBS (Sigma, USA), 2 mM L-glutamine et 40 mg/ml de gentamycine à 37 °С en atmosphère humidifiée avec 5% de СО2. La transplantation de cellules de gliome С6 a été réalisée sous anesthésie totale par inoculation intracérébrale de 0,6-106 cellules dans 0,05 ml de solution physiologique dans une zone pariétale gauche (corne antérieure du ventricule latéral gauche).
Une solution aqueuse de DCA (Sigma-Aldrich, USA) a été administrée quotidiennement per os à travers un tube dans un volume de 3 ml par animal. Le traitement au DCA a été effectué selon différents horaires et à différentes doses, comme suit :
- schéma І – Le DCA a été administré quotidiennement pendant 6 jours à partir du deuxième jour après la transplantation des cellules tumorales à une dose totale de 1,0 g/kg ;
- schéma ІІ – Le DCA a été administré quotidiennement pendant 6 jours à partir du7e jour après la transplantation des cellules tumorales à une dose totale de 1,0 g/kg ;
- schéma ІІІ – Le DCA a été administré quotidiennement pendant 13 jours à partir du deuxième jour à des doses totales de 1,0 ; 1,5 ou 4,5 g/kg.
Tous les animaux des groupes témoins correspondants ont reçu 3,0 ml d’eau pour les injections selon les horaires d’administration du DCA. Il y avait 13 à 15 rats par groupe.
Au 14e jour après l’inoculation des cellules tumorales, 4 à 5 rats de chaque groupe ont été sacrifiés sous narcose à l’éther, le sang a été prélevé ; le tissu cérébral a été prélevé pour des examens complémentaires.
Les changements dans le temps de survie (CST) des animaux restants ont servi d’indice de l’effet anticancéreux du traitement calculé par une formule :
CST (%) = 100 (ST – STC)/STC,
où ST et STСsont le temps de survie des rats des groupes expérimental et témoin, respectivement.
L’influence de l’hypoxie (inhibiteur de la phosphorylation oxydative) sur l’effet anticancéreux du DCA a été étudiée à l’aide de chambres hypoxiques où la teneur en oxygène a été maintenue à un niveau de 12,5-13 % pendant 3 h après l’administration de DCA à des rats porteurs de gliomes С6. La teneur en oxygène dans les chambres hypoxiques a été contrôlée à l’aide de l’oxymètre ISO2 (World Precision Instruments, USA). Les effets anticancéreux du traitement ont été évalués par la prolongation du temps de survie des animaux porteurs de gliome С6.
Les changements d’état des composants de la chaîne de transport d’électrons mitochondriale (MtETC) dans les cellules tumorales ont été analysés par la méthode de résonance paramagnétique électronique. L’analyse par résonance paramagnétique électronique (RPE) des échantillons a été réalisée à 77 К à l’aide du spectrophotomètre Е-109 Varian (USA). Les données de la spectroscopie RPE ont permis de déterminer les niveaux des centres fer-soufre (Fe-S) non hémique réduits (g = 1,94) des protéines MtETC, des complexes nitrosyle (NO) du fer hémique (gсер= 2,01) et des complexes nitrosyle Fe-S (gсер= 2,03).
L’analyse statistique des données a été effectuée par des méthodes descriptives, une analyse de corrélation, une analyse de régression non linéaire, un test t de Student et un test U de Mann – Whitney, à l’aide de Microsoft Excel, Microcal Origin et Statistica. Les données sont présentées en M ± m.
RÉSULTATS ET DISCUSSION
Les résultats de l’étude ont montré qu’une efficacité du DCA contre le gliome С6 dépend du schéma d’administration et est significativement augmentée si les animaux sont maintenus dans des conditions hypoxiques pendant 3 h après l’administration de cet agent.
Comme on peut le voir (tableau 1), le traitement au DCA selon le schéma I a entraîné une diminution de 15 % de la durée de vie des animaux (LS ; р < 0,05). Lors de l’application du schéma II, qui diffère du schéma I par un début de traitement plus tardif, aucun effet sur la durée de vie des animaux expérimentaux n’a été observé. L’administration prolongée de DCA (schéma ІІІ) a eu un effet antitumoral significatif et a augmenté la durée de vie des rats de 25,5 % (p < 0,05).
Habituellement, dans les essais précliniques, l’efficacité des agents anticancéreux dont l’administration commence à l’arrière-plan d’une tumeur déjà développée (jours 7-10 après l’inoculation des cellules tumorales), est plus faible que si ces agents sont administrés plus tôt (jour 2 après l’inoculation des cellules tumorales). Cependant, nos données ont démontré une image opposée : l’efficacité du DCA est plus élevée contre une tumeur développée. Il est connu qu’une tumeur développée est caractérisée par le développement d’une hypoxie intratumorale. Une augmentation de la LS des rats atteints de gliome С6 après une administration prolongée de DCA dans le contexte d’une tumeur développée pourrait être liée au développement d’une hypoxie intratumorale dans la mesure où l’activation de la phosphorylation oxydative induite par le DCA dans des conditions de manque d’oxygène diminue significativement la synthèse d’ATP et, par conséquent, peut entraîner la mort des cellules tumorales. Cette hypothèse est en accord avec les résultats de l’étude qui a analysé l’influence de l’hypoxie sur l’efficacité de l’action cytotoxique/cytostatique du DCA contre les cellules du gliome С6 in vitro. Comme il a été démontré [21], l’augmentation significative de l’action cytotoxique du DCA contre les cellules de gliome С6 dans des conditions hypoxiques (triple diminution de la CI50 du DCA par rapport à celle dans des conditions normoxiques de culture) a été déterminée par la nécrose élevée des cellules induite par le DCA.
L’administration de DCA dans des conditions hypoxiques a entraîné une augmentation significative de son effet anticancéreux. En particulier, dans le cas du schéma I, l’administration de DCA dans des conditions hypoxiques n’a eu aucun effet sur le LS des animaux expérimentaux, alors qu’en l’absence d’hypoxie, cette thérapie a stimulé le processus tumoral et provoqué une réduction de 15 % du LS. Administré selon le schéma II dans des conditions hypoxiques, le DCA a prolongé de manière significative la LS des rats de 22 % par rapport aux animaux traités par le DCA dans des conditions de normoxie (tableau 1). Cependant, il est nécessaire de noter que la variabilité significative de l’action antigliomatique du DCA selon les différents schémas d’administration a été observée dans des conditions d’hypoxie et de normoxie.
| Type de thérapie | Schéma d’administration du DCA | Schéma d’administration du DCA | Calendrier d’administration du DCA | Changement de la LS, en % |
| Nombre | Début du traitement (jour) | Durée du traitement (jours) | ||
| DCA | І | 2e | 6 | -15.0 |
| DCA | ІІ | 7ème | 6 | 0 |
| DCA | ІІІ | 2ème | 13 | 25.5 |
| DCA + hypoxie | І | 2e | 6 | 0 |
| DCA + hypoxie | ІІ | 7ème | 6 | 22 |
Parmi les mécanismes possibles de l’action anticancéreuse des inhibiteurs du métabolisme énergétique des cellules tumorales, y compris le DCA, on peut mentionner la capacité de ces agents à exercer un effet néfaste sur l’état fonctionnel du MtETC dans les cellules tumorales par l’activation de la phosphorylation oxydative, l’hypoxie et une éventuelle déficience du système mitochondrial. C’est pourquoi nous avons étudié l’influence du DCA sur l’état fonctionnel du MtETC en utilisant la spectroscopie RPE.
La forte invasivité du gliome complique la séparation précise de la tumeur et des tissus normaux. C’est pourquoi, pour la préparation des échantillons RPE, nous avons utilisé le tissu de l’hémisphère cérébral avec la tumeur, et pour une comparaison – le tissu de l’hémisphère cérébral sans tumeur.
Comme indices de l’état fonctionnel du MtETC, nous avons utilisé les niveaux des complexes NO du fer hémique mitochondrial (qui reflètent une action dommageable des ROS et de l’azote envers l’ETC), et le contenu des centres Fe-S, reflétant directement un état fonctionnel de ce système énergétique.
Une analyse des effets du DCA dans des conditions de normoxie et d’hypoxie sur l’état fonctionnel du MtETC dans les cellules de gliome С6 a révélé l’absence de corrélation entre la fonctionnalité du MtETC et le LS des animaux expérimentaux (tableau 2).
Comme le montre le tableau 2, l’administration de DCA selon tous les schémas dans des conditions de normoxie et d’hypoxie n’a eu aucun effet sur les niveaux des centres Fe-S dans l’hémisphère cérébral du gliome С6, même dans le contexte d’une augmentation significative (plus de 46,7 %) du niveau de nitrosylation des protéines hémiques enregistrée après l’administration de DCA dans des conditions normoxiques. On suppose qu’une diminution du contenu des centres Fe-S dans le tissu tumoral caractérise un dysfonctionnement du MtETC entraînant la mort des cellules tumorales. Le contenu inchangé des centres Fe-S indique que l’action anticancéreuse du DCA n’est pas liée à son influence sur l’état fonctionnel des mitochondries dans les cellules de gliome С6.
| Groupe d’animaux | Hémisphère cérébral avec gliome | ||
| Programme І | Programme ІІ | Programme ІІІ | |
| Intensité du signal RPE pour les complexes NO-hème (g = 2,01 ; a.u.) | |||
| Contrôle | 100.0 ± 2.9 | 100.0 ± 6.5 | 100.0 ± 1.4 |
| DCA | 153.1 ± 21.7* | 146.7 ± 13.0* | 152.4 ± 20.8* |
| DCA + hypoxie | 87.4 ± 14.3 | 148.4 ± 9.8* | 103.6 ± 10.7 |
| Intensité du signal RPE pour les centres Fe-S (g=1,94 ; a.u.) | |||
| Contrôle | 100.0 ± 40.4 | 100.0 ± 19.1 | 100.0 ± 28.9 |
| DCA | 97.5 ± 17.4 | 112.4 ± 23.0 | 83.3 ± 19.2 |
| DCA + hypoxie | 100.6 ± 37.3 | 115.1 ± 40.0 | 108.3 ± 16.0 |
Remarque : *p < 0,05, les différences sont significatives par rapport à la valeur du contrôle.
Contrairement aux échantillons de tissu cérébral avec gliome, le contenu des complexes NO-hème dans le tissu cérébral normal après administration de DCA par les programmes І et ІІІ a significativement diminué de plus de 17% dans des conditions de normoxie et d’hypoxie (Tableau 3). Cependant, le niveau des centres Fe-S dans le tissu cérébral normal est resté inchangé.
| Groupe d’animaux | Hémisphère cérébral sans gliome | ||
| Programme І | Programme ІІ | Programme ІІІ | |
| Intensité du signal RPE pour les complexes NO-hème (g = 2,01 ; a.u.) | |||
| Contrôle | 100.0 ± 3.4 | 100.0 ± 4.3 | 100.0 ± 2.7 |
| DCA | 82.8 ± 3.4* | 119.6 ± 2.9* | 82.9 ± 3.6* |
| DCA + hypoxie | 72.1 ± 9.9* | 123.0 ± 9.1 | 56.8 ± 20.4* |
| Intensité du signal RPE pour les centres Fe-S (g = 1,94 ; a.u.) | |||
| Contrôle | 100.0 ± 34.0 | 100.0 ± 5.3 | 100.0 ± 20.0 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + hypoxie | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Remarque : *p < 0,05, les différences sont significatives par rapport à la valeur du contrôle.
L’étude des effets de la dose de DCA sur le LS des rats a été réalisée selon le schéma ayant la plus grande efficacité anticancéreuse. Il a été montré que la dose de DCA affectait modérément l’efficacité de son action antigliome (Figure, Tableau 4). L’effet maximal a été enregistré si le DCA a été administré à une dose de 1,5 g/kg : La LS des animaux expérimentaux a augmenté de 34,5 % (p < 0,05). Une augmentation de la dose de DCA jusqu’à 4,5 g/kg n’a pas entraîné une augmentation supplémentaire de son efficacité : le LS des rats était significativement plus élevé que celui des animaux témoins non traités avec du DCA, mais ne différait pas de celui des animaux traités avec une dose de 1,0 g/kg.
Une analyse des effets du DCA lors de son administration prolongée à différentes doses n’a pas révélé de changements significatifs dans les niveaux de nitrosylation des protéines de l’hème et dans le contenu des centres Fe-S dans les cellules de l’hémisphère cérébral présentant un gliome (tableau 5) et dans le tissu cérébral normal (tableau 6).
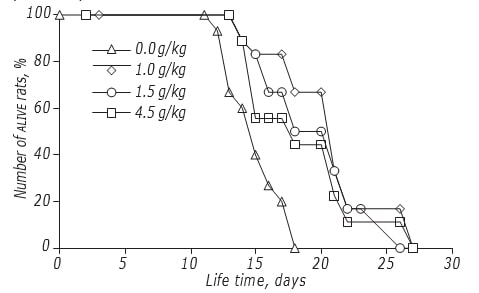
| Dose totale, g/kg | Schéma d’administration | Début du traitement (jour) | Durée du traitement (jours) | Modification de la LS, en pourcentage |
|---|---|---|---|---|
| 1.0 | III | 2ème | 13 | +25.5 |
| 1.5 | III | 2e | 13 | +34.5 |
.
| Groupe d’animaux | Hémisphère cérébral avec gliome | ||
| DІ | D2 | D3 | |
| Intensité du signal RPE pour les complexes NO-hème (g = 2,01 ; a.u.) | |||
| Contrôle | 100.0 ± 1.4 | 100.0 ± 3.5 | 100.0 ± 3.5 |
| DCA | 152.4 ± 20.8* | 93.1 ± 13.0 | 103.0 ± 3.1 |
| Intensité du signal RPE pour les centres Fe-S (g=1,94 ; a.u.) | |||
| Contrôle | 100.0 ± 28.9 | 100.0 ± 5.5 | 100.0 ± 5.5 |
| DCA | 83.3 ± 19.2 | 88.1 ± 12.1 | 101.2 ± 10.6 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + hypoxie | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Note : *p < 0,05, les différences sont significatives par rapport à la valeur du contrôle.
.
| Groupe d’animaux | Hémisphère cérébral sans gliome | ||
| DІ | D2 | D3 | |
| Intensité du signal RPE pour les complexes NO-hème (g = 2,01 ; a.u.) | |||
| Contrôle | 100.0 ± 2.7 | 100.0 ± 13.0 | 100.0 ± 13.0 |
| DCA | 82.9 ± 3.6* | 94.2 ± 2.7 | 79.4 ± 5.4 |
| Intensité du signal RPE pour les centres Fe-S (g = 1,94 ; a.u.) | |||
| Contrôle | 100.0 ± 20.0 | 100.0 ± 15.5 | 100.0 ± 15.5 |
| DCA | 101.3 ± 28.1 | 118.6 ± 3.6 | 102.4 ± 6.9 |
Note : *p < 0,05, les différences sont significatives par rapport à la valeur du contrôle.
.
L’absence de tels changements ainsi que l’efficacité anticancéreuse élevée du DCA (surtout à la dose de 1,5 g/kg) ont démontré une fois de plus que les effets du DCA contre le gliome С6 n’ont aucun rapport avec un état fonctionnel des mitochondries des cellules tumorales.
En conclusion, les résultats de notre étude ont montré que l’efficacité anticancéreuse du DCA dépend de manière significative du calendrier de son administration, où elle varie d’une diminution significative du LS directement corrélée à la stimulation de la croissance tumorale, à un effet anticancéreux significatif et une augmentation du LS des rats de 25,5 %. L’administration métronomique prolongée de DCA offre une meilleure efficacité anticancéreuse avec une faible variabilité entre les doses. Il a également été démontré que les conditions hypoxiques de l’élevage augmentent de manière significative l’efficacité antigliome du DCA. En outre, l’activité anticancéreuse de cet agent n’est pas liée à ses effets sur l’état fonctionnel des mitochondries des cellules tumorales.
RÉFÉRENCES
1 Weller M, Wick W, Aldape K, et al. Glioma. Nat Rev Dis Primers 2015 ; 1 : 15017. doi : 10.1038/nrdp.2015.17.2 Zozulya YuA, Vasil’ev IG, Glavacky AYa, et al. Brain gliomas. État actuel du problème et tendances des recherches futures. Zozulya YuA, ed. Kyiv : ExOb, 2007. 631 p. (en russe).
3 Aghi MK, Nahed BV, Sloan AE, et al. The role of surgery in the management of patients with diffuse low grade glioma : Une revue systématique et un guide de pratique clinique fondé sur des preuves. J Neurooncol 2015 ; 125 : 503-30.
4 Hervey-Jumper SL, Berger MS. Les nuances techniques de la chirurgie éveillée des tumeurs cérébrales et le rôle de la résection maximale sûre. J Neurosurg Sci 2015 ; 59 : 351-60.
5 Laperrière N, Zuraw L, Cairncross G. Radiothérapie pour les gliomes malins nouvellement diagnostiqués chez les adultes : une revue systématique. Radiother Oncol 2002 ; 64 : 259-73.
6 Ryken TC, Parney I, Buatti J, et al. The role of radiotherapy in the management of patients with diffuse low grade glioma : Une revue systématique et un guide de pratique clinique fondé sur des preuves. J Neurooncol 2015 ; 125 : 551-83.
7 Norden AD, Drappatz J, Wen PY. Nouvelles thérapies anti-angiogéniques pour les gliomes malins. Lancet Neurol 2008 ; 7 : 1152-60.
8 Huang TT, Sarkaria SM, Cloughesy TF, Mischel PS. Thérapie ciblée pour les gliomes malins : leçons apprises et chemin à parcourir. J Neurother 2009 ; 6 : 500-12.
9 Staedtke V, Bai RY, Laterra J. Nouveaux médicaments expérimentaux pour le cancer du cerveau. Expert Opin Investig Drugs 2016 ; 17 : 1-20.
10 Kang JH, Adamson C. Nouvelles chimiothérapies et autres thérapies pour le traitement des gliomes de haut grade. Expert Opin Investig Drugs 2015 ; 24 : 1361-79.
11 Baritchii A, Jurj A, Soritau O, et al. Des médicaments sensibilisateurs pour le traitement du glioblastome résistant au témozolomide. J BUON 2016 ; 21 : 199-207.
12 Mallick S, Gandhi AK, Rath GK. Approche thérapeutique au-delà du témozolomide conventionnel pour les glioblastomes nouvellement diagnostiqués : Examen des preuves actuelles et orientation future. Indian J Med Paediatr Oncol 2015 ; 36 : 229-37.
13 Gatenby RA, Gillies RJ. Pourquoi les cancers ont-ils une glycolyse aérobie élevée ? Nat Rev Cancer 2004 ; 4 : 891-9.
14 Kim JW, Dang CV. Multifaceted roles of glycolytic enzymes. Trends Biochem Sci 2005 ; 30 : 142-50.
15 Jin S, DiPaola RS, Mathew R, White E. Metabolic catastrophe as a means to cancer cell death. J Cell Sci 2007 ; 3 : 379-83.
16 Seyfried TN, Kiebish MA, Marsh J. Metabolic management of brain cancer. Biochim Biophys Acta 2011 ; 6 : 577-94.
17 Decollogne S, Dilda PJ, Hau E, et al. Double ciblage du métabolisme aberrant du glucose dans le glioblastome. J Exp Clin Cancer Res 2015 ; 34 : 14.
18 Kankotia S, Stacpoole PW. Dichloroacétate et cancer : nouvelle maison pour un médicament orphelin ? Biochim Biophys Acta 2014 ; 1846 : 617-29.
19 Stacpoole PW. Le dilemme du dichloroacétate : danger environnemental ou mine d’or thérapeutique – les deux ou aucun ? Environ Health Perspect 2011 ; 119 : 155-8.
20 Michelakis ED, Webster L, Mackey JR. Le dichloroacétate (DCA) comme thérapie potentielle de ciblage métabolique pour le cancer. Br J Cancer 2008 ; 99 : 989-94.
21 Kolesnik DL, Pyaskovskaya ON, Boichuk IV, Solyanik GI. L’hypoxie renforce l’activité antitumorale du dichloroacétate. Exp Oncol 2014 ; 36 : 231-5.
22 James MO, Stacpoole PW. Considérations pharmacogénétiques sur le dosage du dichloroacétate. Pharmacogénomique 2016 ; doi:10.2217/pgs-2015-0012.
23 Dunbar EM, Coats BS, Shroads AL, et al. Essai de phase 1 du dichloroacétate (DCA) chez les adultes atteints de tumeurs cérébrales malignes récurrentes. Invest New Drugs 2014 ; 32 : 452-64.