A.G. Fedorchuk, O.N. Pyaskovskaya, G.V. Gorbik, I.V. Prokhorova, D.L. Kolesnik, G.I. Solyanik
1R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology, NAS of Ukraine, Kyiv 03022, Ucraina.
Corrispondenza: [email protected]
Inviato: 17 maggio 2016
Abstract
Background: L’azione antitumorale del dicloroacetato di sodio (DCA) potrebbe essere legata alla sua capacità di attivare la fosforilazione ossidativa che porta a una maggiore generazione di specie reattive dell’ossigeno e all’induzione dell’apoptosi. D’altra parte, l’attivazione della fosforilazione ossidativa potrebbe promuovere la sopravvivenza delle cellule tumorali, in particolare attraverso un aumento della sintesi di ATP. Questi effetti ambigui del DCA potrebbero influenzare la sua efficacia antitumorale, a seconda delle proprietà biologiche del tumore, del programma di somministrazione del DCA e del suo dosaggio. Lo scopo dello studio è stato quello di analizzare l’effetto antitumorale del DCA contro il glioma С6 nei ratti in condizioni di diversi orari di somministrazione e vari dosaggi.
Materiali e metodi: Lo studio è stato condotto su ratti Wistar con cellule di glioma С6 trapiantate per via intracerebrale. La terapia con DCA è stata eseguita come segue: tutti i giorni per 6 giorni a partire dal secondo giorno dopo il trapianto di cellule tumorali (schema І) o dal 7° giorno (schema ІІ) alla dose di 1,0 g/kg, oppure tutti i giorni per 13 giorni a partire dal secondo giorno alle dosi di 1,0; 1,5 o 4,5 g/kg (schema ІІІ). L’influenza dell’ipossia sull’effetto antitumorale del DCA è stata studiata utilizzando camere ipossiche in cui il contenuto di ossigeno è stato mantenuto a un livello del 12,5-13% per 3 ore dopo la somministrazione di DCA a ratti portatori di glioma С6. Lo stato dei componenti della catena di trasporto degli elettroni mitocondriali nelle cellule tumorali è stato studiato mediante risonanza paramagnetica elettronica.
Risultati: È stato dimostrato che la terapia con DCA secondo lo schema I ha comportato una riduzione del 15% della durata di vita degli animali (LS; < 0,05), mentre l’uso dello schema II non ha avuto alcun effetto su questo indice. La somministrazione prolungata di DCA (schedula ІІІ) ha avuto un effetto antitumorale significativo e ha aumentato la LS dei ratti del 25,5% (p < 0,05). In condizioni di ipossia, il trattamento con DCA ha determinato un aumento significativo della LS degli animali del 15-22%. Il dosaggio del DCA ha avuto un effetto moderato sulla sua azione antitumorale. L’effetto massimo, un aumento della LS del 34,5% (p < 0,05) è stato rilevato alla dose di 1,5 g/kg. È stato dimostrato che l’attività antitumorale del DCA in tutte le condizioni studiate non è legata alla sua influenza sullo stato funzionale dei mitocondri delle cellule tumorali.
Conclusioni: L’effetto antitumorale del DCA dipende in modo significativo dal programma di somministrazione; essendo somministrato a una dose totale uguale, ma dipendente dal programma, il DCA potrebbe causare effetti ambigui che variano dalla stimolazione della crescita tumorale a una significativa attività antitumorale. In condizioni di ipossia, l’efficacia antitumorale del DCA contro il glioma С6 è significativamente aumentata.
Parole chiave: dicloroacetato di sodio, glioma С6, catena di trasporto degli elettroni mitocondriali.
Abbreviazioni utilizzate: DCA – dicloroacetato di sodio; EPR – risonanza paramagnetica degli elettroni; LS – durata della vita; MtETC – catena mitocondriale di trasporto degli elettroni; PDH – piruvato deidrogenasi chinasi; ROS – specie reattive dell’ossigeno.
INTRODUZIONE
Secondo le statistiche dell’Organizzazione Mondiale della Sanità, il tasso medio di incidenza dei tumori cerebrali è di 10,9-12,8 per 100.000 abitanti [1]. Quasi il 60% di tutti i tumori del sistema nervoso centrale sono neoplasie maligne, tra cui i gliomi rappresentano il 50-55%. Secondo i dati statistici, i gliomi rappresentano solo l’1,4% di tutti i tumori diagnosticati clinicamente, ma la prognosi dei pazienti affetti da glioma è la più sfavorevole. Il tempo medio di sopravvivenza dei pazienti con glioma maligno dopo la diagnosi primaria è di circa 8 mesi in Ucraina e 14 mesi negli Stati Uniti [2]. Per questo motivo la terapia dei pazienti con gliomi di diverso grado di malignità è uno dei problemi più importanti della moderna oncologia clinica.
Nonostante lo sviluppo di numerosi nuovi mezzi antitumorali, attualmente l’approccio principale per la terapia dei pazienti affetti da glioma è ancora una “terapia della disperazione”, cioè la chirurgia, la cui efficacia è però insufficiente [3, 4]. Si suppone che l’inefficacia dell’asportazione radicale dei gliomi sia in gran parte causata dall’invasione del tumore nei tessuti normali circostanti, con la formazione di margini indiscreti che si riducono notevolmente.
I moderni protocolli per la radioterapia del glioma maligno raccomandano un’irradiazione frazionata con basse dosi giornaliere (> 2 Gy), con una dose totale di 60-90 Gy [5]. Tuttavia, anche i moderni metodi di irradiazione non possono aiutare a superare un’efficacia estremamente bassa della terapia, dovuta all’elevata radioresistenza del glioma causata dallo sviluppo di ipossia locale [6].
I chemioterapici (compresi gli agenti target) sono poco efficaci nel caso dei gliomi a causa della loro scarsa biodisponibilità [7-10]. Ad esempio, nella maggior parte dei casi l’analisi della biopsia del glioma maligno evidenzia la presenza di una barriera ematoencefalica difettosa ma funzionale, che impedisce il passaggio di molti preparati target (soprattutto anticorpi contro i fattori di crescita e i recettori). Per il trattamento del glioma maligno viene utilizzato un solo preparato citostatico alchilante, la temozolomide. Va notato che una risposta alla terapia con temozolomide può essere osservata solo nel 5-8% dei pazienti in caso di monoterapia e in circa il 20% dei pazienti in caso di terapia adiuvante con temozolomide combinata con radioterapia o trattamento chirurgico [11, 12].
È noto che in gran parte dei tumori maligni l’ATP viene generato attraverso la glicolisi anche in presenza di ossigeno (effetto Warburg). La glicolisi aerobica è una via poco efficace per la generazione di ATP, ma sostiene l’elevato potenziale proliferativo delle cellule tumorali e ne promuove la sopravvivenza diminuendo il rischio di formazione di stimoli apoptotici [13, 14]. Pertanto, negli ultimi anni il metabolismo tumorale, che fornisce questi vantaggi alla crescita, è considerato un nuovo bersaglio per la terapia antitumorale e i composti in grado di inibire la glicolisi nelle cellule tumorali sono studiati come agenti antitumorali potenzialmente efficaci [15-17]. Tra gli agenti antimetabolici attivi contro molti tipi di cellule tumorali si può citare il dicloroacetato di sodio (DCA) [18-20].
Il DCA inibisce la piruvato deidrogenasi chinasi (PDH), con conseguente attivazione indiretta degli enzimi del complesso PDH e conseguente spostamento del metabolismo cellulare dalla glicolisi alla fosforilazione ossidativa. In caso di attivazione della fosforilazione ossidativa e di diminuzione dell’intensità della glicolisi in seguito all’azione del DCA, ci si potrebbe aspettare un’inibizione della proliferazione delle cellule tumorali causata, in particolare, da una significativa diminuzione del contenuto di metaboliti del pentoso-fosfato e del piruvato, importanti per la sintesi di proteine e acidi nucleici. L’attivazione del metabolismo mitocondriale indotta dal DCA può portare al blocco della proliferazione delle cellule tumorali e all’aumento della generazione di specie reattive dell’ossigeno (ROS) e all’induzione dell’apoptosi. Tuttavia, nonostante l’apparente teoricità dell’azione antitumorale del DCA, la sua efficacia non è garantita. Come è stato dimostrato [21], in un ampio intervallo di concentrazioni il DCA esercita un’azione citostatica ma non citotossica, come dimostrano i dati sull’assenza di effetti sul livello intracellulare di ROS, sul tasso di produzione di lattato e sul tasso di apoptosi nelle cellule di glioma С6.
Inoltre, è necessario notare che l’attivazione della fosforilazione ossidativa indotta dal DCA può avere non solo un effetto antitumorale, ma anche promuovere la sopravvivenza delle cellule tumorali attraverso l’aumento della sintesi di ATP. Questa influenza ambivalente sulla sopravvivenza delle cellule tumorali predispone una variabilità dell’attività del DCA [22, 23]. Le proprietà biologiche di un tumore, gli orari di somministrazione del DCA e le sue dosi possono influenzare significativamente la sua efficacia antitumorale.
Lo scopo dello studio è stato quello di analizzare l’efficacia antitumorale del DCA contro il glioma С6 nei ratti in condizioni di diversi programmi di somministrazione e dosaggio.
MATERIALI E METODI
Lo studio è stato condotto su femmine di ratto Wistar di 2,5-3 mesi di età, del peso di 90-150 g, allevate presso la struttura animale dell’Istituto di Patologia Sperimentale, Oncologia e Radiobiologia dell’Accademia Nazionale delle Scienze dell’Ucraina (IEPOR) di R.E. Kavetsky. L’uso e la cura degli animali da esperimento sono stati eseguiti in conformità alle norme internazionali standard di etica biologica e sono stati approvati dal Comitato istituzionale per la cura e l’uso degli animali. La linea cellulare di glioma С6 è stata ottenuta dalla Banca Nazionale di Linee Cellulari e Ceppi Tumorali dell’IEPOR.
Le cellule di glioma С6 sono state coltivate in vitro in terreno di coltura DMEM integrato con 10% FBS (Sigma, USA), 2 mM di L-glutammina e 40 mg/ml di gentamicina a 37 °С in atmosfera umidificata con il 5% di СО2. Il trapianto di cellule di glioma С6 è stato eseguito in anestesia totale mediante inoculazione intracerebrale di 0,6-106 cellule in 0,05 ml di soluzione fisiologica in un’area parietale sinistra (corno anteriore del ventricolo laterale sinistro).
La soluzione acquosa di DCA (Sigma-Aldrich, USA) è stata somministrata quotidianamente per os attraverso un tubo in un volume di 3 ml per animale. La terapia con DCA è stata eseguita con diversi orari e a diverse dosi, come segue:
- schema І – il DCA è stato somministrato quotidianamente per 6 giorni a partire dal secondo giorno dopo il trapianto di cellule tumorali a una dose totale di 1,0 g/kg;
- schema ІІ – il DCA è stato somministrato quotidianamente per 6 giorni a partire dal7° giorno dopo il trapianto di cellule tumorali a una dose totale di 1,0 g/kg;
- schema ІІІ – il DCA è stato somministrato quotidianamente per 13 giorni a partire dal secondo giorno a dosi totali di 1,0, 1,5 o 4,5 g/kg.
Tutti gli animali dei corrispondenti gruppi di controllo hanno ricevuto 3,0 ml di acqua per le iniezioni secondo gli orari di somministrazione del DCA. Per ogni gruppo erano presenti 13-15 ratti.
Al 14° giorno dopo l’inoculazione delle cellule tumorali, 4-5 ratti di ciascun gruppo sono stati sacrificati sotto narcosi di etere, il sangue è stato raccolto e il tessuto cerebrale è stato prelevato per ulteriori esami.
Le variazioni del tempo di sopravvivenza (CST) degli animali rimanenti sono servite come indice dell’effetto antitumorale del trattamento, calcolato con una formula:
CST (%) = 100 (ST – STC)/STC,
dove ST e STС sono i tempi di sopravvivenza dei ratti dei gruppi sperimentale e di controllo, rispettivamente.
L’influenza dell’ipossia (inibitore della fosforilazione ossidativa) sull’effetto antitumorale del DCA è stata studiata utilizzando camere ipossiche in cui il contenuto di ossigeno è stato mantenuto a un livello del 12,5-13% per 3 ore dopo la somministrazione di DCA a ratti portatori di glioma С6. Il contenuto di ossigeno nelle camere ipossiche è stato controllato con l’ossimetro ISO2 (World Precision Instruments, USA). Gli effetti antitumorali del trattamento sono stati valutati in base al prolungamento del tempo di sopravvivenza degli animali con glioma С6.
I cambiamenti dello stato dei componenti della catena di trasporto degli elettroni mitocondriali (MtETC) nelle cellule tumorali sono stati analizzati con il metodo della risonanza paramagnetica elettronica. L’analisi della risonanza paramagnetica elettronica (EPR) dei campioni è stata eseguita a 77 К con uno spettrofotometro Е-109 Varian (USA). In base ai dati della spettroscopia EPR, sono stati determinati i livelli di riduzione dei centri ferro-zolfo (Fe-S) non eme (g = 1,94) delle proteine MtETC, dei complessi nitrosilici (NO) del ferro eme (gсер= 2,01) e dei complessi nitrosilici Fe-S (gсер= 2,03).
L’analisi statistica dei dati è stata eseguita con metodi descrittivi, analisi di correlazione, analisi di regressione non lineare, test t di Student e test U di Mann – Whitney, con l’uso di Microsoft Excel, Microcal Origin e Statistica. I dati sono presentati come M ± m.
RISULTATI E DISCUSSIONE
I risultati dello studio hanno dimostrato che l’efficacia del DCA contro il glioma С6 dipende dal programma di somministrazione e aumenta significativamente se gli animali vengono tenuti in condizioni di ipossia per 3 ore dopo la somministrazione di questo agente.
Come si può vedere (Tabella 1), la terapia con DCA secondo lo schema I ha comportato una riduzione del 15% della durata della vita degli animali (LS; р < 0,05). Con l’applicazione dello schema II, che si differenzia dallo schema I per i termini più tardivi di inizio del trattamento, non è stato osservato alcun effetto sulla LS degli animali da esperimento. La somministrazione prolungata di DCA (schema ІІІ) ha prodotto un effetto antitumorale significativo e ha aumentato la LS dei ratti del 25,5% (p < 0,05).
Di solito negli studi preclinici l’efficacia di agenti antitumorali la cui somministrazione inizia a ridosso di un tumore già sviluppato (giorni 7-10 dopo l’inoculazione delle cellule tumorali) è inferiore rispetto a quella di agenti somministrati in tempi più precoci (giorno 2 dopo l’inoculazione delle cellule tumorali). Tuttavia, i nostri dati hanno dimostrato un quadro opposto: l’efficacia del DCA è maggiore contro un tumore sviluppato. È noto che un tumore sviluppato è caratterizzato dallo sviluppo di ipossia intratumorale. Un aumento della LS dei ratti con glioma С6 dopo la somministrazione prolungata di DCA in presenza di un tumore sviluppato potrebbe essere correlato allo sviluppo di ipossia intratumorale, in quanto l’attivazione della fosforilazione ossidativa indotta dal DCA in condizioni di carenza di ossigeno riduce significativamente la sintesi di ATP e, di conseguenza, può portare alla morte delle cellule tumorali. Questa ipotesi è in accordo con i risultati dello studio che ha analizzato l’influenza dell’ipossia sull’efficacia dell’azione citotossica/citostatica del DCA contro le cellule di glioma С6 in vitro. Come è stato dimostrato [21], il significativo potenziamento dell’azione citotossica del DCA contro le cellule di glioma С6 in condizioni di ipossia (diminuzione tripla dell’IC50 del DCA rispetto a quella in condizioni di coltura normossica) è stato determinato da un alto livello di necrosi delle cellule indotta dal DCA.
La somministrazione di DCA in condizioni di ipossia ha determinato un aumento significativo del suo effetto antitumorale. In particolare, nel caso dello schema I la somministrazione di DCA in condizioni di ipossia non ha avuto alcun effetto sulla LS degli animali da esperimento, mentre in assenza di ipossia tale terapia ha stimolato il processo tumorale e ha causato una riduzione del 15% della LS. Somministrato secondo lo schema II in condizioni di ipossia, il DCA ha prolungato significativamente la LS dei ratti del 22% rispetto agli animali trattati con DCA in condizioni di normossia (Tabella 1). Tuttavia, è necessario notare che è stata osservata una significativa variabilità dell’azione antiglioma del DCA in base a diversi schemi di somministrazione, sia in condizioni di ipossia che di normossia.
| Tipo di terapia | Programma di somministrazione del DCA | Programma di somministrazione del DCA | Programma di somministrazione di DCA | Variazione di LS, % |
| Numero | Inizio (giorno) | Durata del trattamento (giorni) | ||
| DCA | І | 2a | 6 | -15.0 |
| DCA | ІІ | 7° | 6 | 0 |
| DCA | ІІІ | 2a | 13 | 25.5 |
| DCA + ipossia | І | 2a | 6 | 0 |
| DCA + ipossia | ІІ | 7 | 6 | 22 |
Tra i possibili meccanismi di azione antitumorale degli inibitori del metabolismo energetico delle cellule tumorali, tra cui il DCA, si potrebbe citare la capacità di questi agenti di esercitare un effetto dannoso sullo stato funzionale del MtETC nelle cellule tumorali attraverso l’attivazione della fosforilazione ossidativa, l’ipossia e la possibile deficienza del sistema mitocondriale. Per questo motivo abbiamo studiato l’influenza del DCA sullo stato funzionale del MtETC utilizzando la spettroscopia EPR.
L’elevata invasività del glioma complica un’accurata separazione dei tessuti tumorali da quelli normali. Per questo motivo, per la preparazione dei campioni EPR abbiamo utilizzato il tessuto dell’emisfero cerebrale con il tumore e, per un confronto, il tessuto dell’emisfero cerebrale senza tumore.
Come indici dello stato funzionale del MtETC abbiamo utilizzato i livelli dei complessi NO del ferro eme mitocondriale (che riflette l’azione dannosa dei ROS e dell’azoto nei confronti dell’ETC) e il contenuto dei centri Fe-S, che riflettono direttamente lo stato funzionale di questo sistema energetico.
L’analisi degli effetti del DCA in condizioni di normossia e ipossia sullo stato funzionale del MtETC nelle cellule di glioma С6 ha rivelato l’assenza di correlazione tra la funzionalità del MtETC e la LS degli animali da esperimento (Tabella 2).
Come mostrato nella Tabella 2, la somministrazione di DCA in tutte le schedule in condizioni di normossia e ipossia non ha avuto alcun effetto sui livelli dei centri Fe-S nell’emisfero cerebrale con glioma С6 anche a fronte di un aumento significativo (oltre il 46,7%) del livello di nitrosilazione delle proteine eme registrato dopo la somministrazione di DCA in condizioni di normossia. Si suppone che una diminuzione del contenuto di centri Fe-S nel tessuto tumorale caratterizzi un malfunzionamento del MtETC con conseguente morte delle cellule tumorali. Il contenuto invariato di centri Fe-S indica che l’azione antitumorale del DCA non è legata alla sua influenza sullo stato funzionale dei mitocondri nelle cellule di glioma С6.
| Gruppo di animali | Emisfero cerebrale con glioma | ||
| Programma І | Programma ІІ | Schedule ІІІ | |
| Intensità del segnale EPR per i complessi NO-eme (g = 2,01; a.u.) | |||
| Controllo | 100.0 ± 2.9 | 100.0 ± 6.5 | 100.0 ± 1.4 |
| DCA | 153.1 ± 21.7* | 146.7 ± 13.0* | 152.4 ± 20.8* |
| DCA + ipossia | 87.4 ± 14.3 | 148.4 ± 9.8* | 103.6 ± 10.7 |
| Intensità del segnale EPR per i centri Fe-S (g=1,94; a.u.) | |||
| Controllo | 100.0 ± 40.4 | 100.0 ± 19.1 | 100.0 ± 28.9 |
| DCA | 97.5 ± 17.4 | 112.4 ± 23.0 | 83.3 ± 19.2 |
| DCA + ipossia | 100.6 ± 37.3 | 115.1 ± 40.0 | 108.3 ± 16.0 |
Nota: *p < 0,05, le differenze sono significative rispetto al valore del controllo.
A differenza dei campioni di tessuto cerebrale con glioma, il contenuto di complessi NO-eme nel tessuto cerebrale normale dopo la somministrazione di DCA da parte dei programmi І e ІІІ è diminuito significativamente di oltre il 17% in condizioni di normossia e ipossia (Tabella 3). Tuttavia, il livello dei centri Fe-S nel tessuto cerebrale normale è rimasto inalterato.
| Gruppo di animali | Emisfero cerebrale senza glioma | ||
| Programma І | Programma ІІ | Schedule ІІІ | |
| Intensità del segnale EPR per i complessi NO-eme (g = 2,01; a.u.) | |||
| Controllo | 100.0 ± 3.4 | 100.0 ± 4.3 | 100.0 ± 2.7 |
| DCA | 82.8 ± 3.4* | 119.6 ± 2.9* | 82.9 ± 3.6* |
| DCA + ipossia | 72.1 ± 9.9* | 123.0 ± 9.1 | 56.8 ± 20.4* |
| Intensità del segnale EPR per i centri Fe-S (g = 1,94; a.u.) | |||
| Controllo | 100.0 ± 34.0 | 100.0 ± 5.3 | 100.0 ± 20.0 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + ipossia | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Nota: *p < 0,05, le differenze sono significative rispetto al valore del controllo.
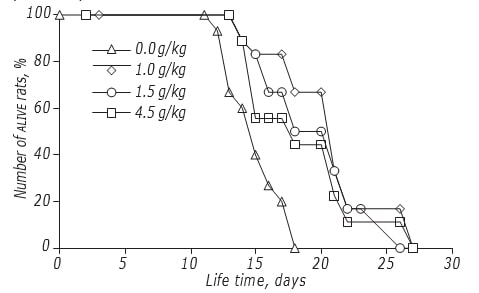
Lo studio degli effetti del dosaggio di DCA sulla LS dei ratti è stato effettuato secondo lo schema con la massima efficacia antitumorale. È stato dimostrato che la dose di DCA influenzava moderatamente l’efficacia della sua azione antiglioma (Figura, Tabella 4). L’effetto massimo è stato registrato se il DCA è stato somministrato a una dose di 1,5 g/kg: La LS degli animali sperimentali è aumentata del 34,5% (p < 0,05). L’aumento della dose di DCA fino a 4,5 g/kg non ha portato a un ulteriore aumento della sua efficacia: la LS dei ratti era significativamente superiore a quella degli animali di controllo non trattati con DCA, ma non differiva da quella degli animali trattati con una dose di 1,0 g/kg.
L’analisi degli effetti del DCA in seguito alla sua somministrazione prolungata a diverse dosi non ha rivelato cambiamenti significativi nei livelli di nitrosilazione delle proteine eme e nel contenuto di centri Fe-S nelle cellule dell’emisfero cerebrale con glioma (Tabella 5) e nel tessuto cerebrale normale (Tabella 6).
| Dose totale, g/kg | Schema di somministrazione | Inizio (giorno) | Durata della terapia (giorni) | Variazione di LS, % |
|---|---|---|---|---|
| 1.0 | III | iI | 13 | +25.5 |
| 1.5 | III | 2a | 13 | +34.5 |
.
| Gruppo di animali | Emisfero cerebrale con glioma | ||
| DІ | D2 | D3 | |
| Intensità del segnale EPR per i complessi NO-eme (g = 2,01; a.u.) | |||
| Controllo | 100.0 ± 1.4 | 100.0 ± 3.5 | 100.0 ± 3.5 |
| DCA | 152.4 ± 20.8* | 93.1 ± 13.0 | 103.0 ± 3.1 |
| Intensità del segnale EPR per i centri Fe-S (g=1,94; a.u.) | |||
| Controllo | 100.0 ± 28.9 | 100.0 ± 5.5 | 100.0 ± 5.5 |
| DCA | 83.3 ± 19.2 | 88.1 ± 12.1 | 101.2 ± 10.6 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + ipossia | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Nota: *p < 0,05, le differenze sono significative rispetto al valore del controllo.
.
| Gruppo di animali | Emisfero cerebrale senza glioma | ||
| DІ | D2 | D3 | |
| Intensità del segnale EPR per i complessi NO-eme (g = 2,01; a.u.) | |||
| Controllo | 100.0 ± 2.7 | 100.0 ± 13.0 | 100.0 ± 13.0 |
| DCA | 82.9 ± 3.6* | 94.2 ± 2.7 | 79.4 ± 5.4 |
| Intensità del segnale EPR per i centri Fe-S (g = 1,94; a.u.) | |||
| Controllo | 100.0 ± 20.0 | 100.0 ± 15.5 | 100.0 ± 15.5 |
| DCA | 101.3 ± 28.1 | 118.6 ± 3.6 | 102.4 ± 6.9 |
Nota: *p < 0,05, le differenze sono significative rispetto al valore del controllo.
.
L’assenza di tali cambiamenti e l’elevata efficacia antitumorale del DCA (soprattutto alla dose di 1,5 g/kg) hanno dimostrato ancora una volta che gli effetti del DCA contro il glioma С6 non hanno alcuna relazione con lo stato funzionale dei mitocondri delle cellule tumorali.
In conclusione, i risultati del nostro studio hanno dimostrato che l’efficacia antitumorale del DCA dipende in modo significativo dal programma di somministrazione, che varia da una diminuzione significativa della LS direttamente correlata alla stimolazione della crescita tumorale, a un effetto antitumorale significativo e a un aumento della LS dei ratti del 25,5%. La somministrazione metronomica prolungata di DCA fornisce una migliore efficacia antitumorale con una bassa variabilità tra le dosi. Inoltre, è stato dimostrato che le condizioni di ipossia negli animali aumentano significativamente l’efficacia antiglioma del DCA. Inoltre, l’attività antitumorale di questo agente non è legata ai suoi effetti sullo stato funzionale dei mitocondri delle cellule tumorali.
RIFERIMENTI
1 Weller M, Wick W, Aldape K, et al. Glioma. Nat Rev Dis Primers 2015; 1: 15017. doi: 10.1038/nrdp.2015.17.2 Zozulya YuA, Vasil’ev IG, Glavacky AYa, et al. Gliomi cerebrali. Stato attuale del problema e tendenze di ulteriori ricerche. Zozulya YuA, ed. Kiev: ExOb, 2007. 631 p. (in russo).
3 Aghi MK, Nahed BV, Sloan AE, et al. Il ruolo della chirurgia nella gestione dei pazienti con glioma diffuso di basso grado: Una revisione sistematica e una linea guida di pratica clinica basata sull’evidenza. J Neurooncol 2015; 125: 503-30.
4 Hervey-Jumper SL, Berger MS. Sfumature tecniche della chirurgia sveglia dei tumori cerebrali e ruolo della resezione massima sicura. J Neurosurg Sci 2015; 59: 351-60.
5 Laperriere N, Zuraw L, Cairncross G. Radiotherapy for newly diagnosed malignant glioma in adults: a systematic review. Radiother Oncol 2002; 64: 259-73.
6 Ryken TC, Parney I, Buatti J, et al. Il ruolo della radioterapia nella gestione dei pazienti con glioma diffuso di basso grado: Una revisione sistematica e una linea guida di pratica clinica basata sull’evidenza. J Neurooncol 2015; 125: 551-83.
7 Norden AD, Drappatz J, Wen PY. Nuove terapie anti-angiogeniche per i gliomi maligni. Lancet Neurol 2008; 7: 1152-60.
8 Huang TT, Sarkaria SM, Cloughesy TF, Mischel PS. Terapia mirata per i pazienti affetti da glioma maligno: lezioni apprese e strada da percorrere. J Neurother 2009; 6: 500-12.
9 Staedtke V, Bai RY, Laterra J. Investigational new drugs for brain cancer. Expert Opin Investig Drugs 2016; 17: 1-20.
10 Kang JH, Adamson C. Nuovi chemioterapici e altre terapie per il trattamento del glioma di alto grado. Expert Opin Investig Drugs 2015; 24: 1361-79.
11 Baritchii A, Jurj A, Soritau O, et al. Farmaci sensibilizzatori per il trattamento del glioblastoma resistente al temozolomide. J BUON 2016; 21: 199-207.
12 Mallick S, Gandhi AK, Rath GK. Approccio terapeutico oltre la temozolomide convenzionale per il glioblastoma di nuova diagnosi: Revisione delle evidenze attuali e direzione futura. Indian J Med Paediatr Oncol 2015; 36: 229-37.
13 Gatenby RA, Gillies RJ. Perché i tumori hanno un’elevata glicolisi aerobica? Nat Rev Cancer 2004; 4: 891-9.
14 Kim JW, Dang CV. I molteplici ruoli degli enzimi glicolitici. Trends Biochem Sci 2005; 30: 142-50.
15 Jin S, DiPaola RS, Mathew R, White E. Metabolic catastrophe as a means to cancer cell death. J Cell Sci 2007; 3: 379-83.
16 Seyfried TN, Kiebish MA, Marsh J. Metabolic management of brain cancer. Biochim Biophys Acta 2011; 6: 577-94.
17 Decollogne S, Dilda PJ, Hau E, et al. Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 2015; 34: 14.
18 Kankotia S, Stacpoole PW. Dicloroacetato e cancro: nuova casa per un farmaco orfano? Biochim Biophys Acta 2014; 1846: 617-29.
19 Stacpoole PW. Il dilemma del dicloroacetato: pericolo ambientale o miniera d’oro terapeutica – entrambi o nessuno? Environ Health Perspect 2011; 119: 155-8.
20 Michelakis ED, Webster L, Mackey JR. Il dicloroacetato (DCA) come potenziale terapia a bersaglio metabolico per il cancro. Br J Cancer 2008; 99: 989-94.
21 Kolesnik DL, Pyaskovskaya ON, Boichuk IV, Solyanik GI. L’ipossia aumenta l’attività antitumorale del dicloroacetato. Exp Oncol 2014; 36: 231-5.
22 James MO, Stacpoole PW. Considerazioni farmacogenetiche sul dosaggio del dicloroacetato. Pharmacogenomics 2016; doi:10.2217/pgs-2015-0012.
23 Dunbar EM, Coats BS, Shroads AL, et al. Studio di fase 1 sul dicloroacetato (DCA) in adulti con tumori cerebrali maligni ricorrenti. Invest New Drugs 2014; 32: 452-64.