Акбар Хан, Даг Эндрюс, Аннеке К Блэкберн
Акбар Хан, Дуглас Эндрюс, Medicor Cancer Centres Inc., Торонто, ON M2N 6N4, Канада
Аннеке С Блэкберн, Школа медицинских исследований Джона Куртина, Австралийский национальный университет, Канберра, ACT 2601, Австралия
Вклад авторов: Хан А лечил пациента и написал большую часть отчета о случае; Эндрюс Д лечил пациента, разработал протоколы естественной терапии и стал соавтором отчета о случае; Блэкберн АС выполнила работы in vitro и in vivo, демонстрирующие действие DCA как цитостатического агента, и написала части отчета о случае, касающиеся исследований in vitro и in vivo DCA.
Заявление совета по институциональному надзору: Не применимо.
Заявление об информированном согласии: Пациентка, описанная в данной рукописи, дала согласие на анонимную публикацию своего случая.
Заявление о конфликте интересов: Один из авторов (Хан) проводит терапию дихлорацетатом для онкологических больных через онкологические центры Medicor за плату и без прибыли. Клиника принадлежит члену семьи этого автора. Остальным авторам нечего раскрывать.
Открытый доступ: Эта статья является статьей с открытым доступом, которая была отобрана штатным редактором и полностью проверена внешними рецензентами. Она распространяется в соответствии с лицензией Creative Commons Attribution Non Commercial (CC BY-NC 4.0), которая разрешает другим распространять, ремиксовать, адаптировать, строить на основе этой работы некоммерческие произведения и лицензировать их производные работы на других условиях, при условии, что оригинальная работа должным образом цитируется и использование является некоммерческим. См.: http://creativecommons.org/licenses/by-nc/4.0/
Источник рукописи: Приглашенная рукопись
Переписка с: Акбар Хан, доктор медицины, медицинский директор,
Medicor Cancer Centres Inc, 4576 Yonge St, Suite 301, Торонто,
ON M2N 6N4, Канада. [email protected]
Телефон: +1-416-2270037
Факс: +1-416-2271915
Получено: 30 апреля 2016 г.
Peer-review started: 3 мая 2016 г.
Первое решение: 17 июня 2016 г.
Пересмотрено: 23 июля 2016
Принята: 6 августа 2016
Статья в печати: 8 августа 2016
Опубликовано онлайн: 16 октября 2016 г
Аннотация
Пероральный дихлорацетат натрия (ДХА) рассматривается в качестве новой метаболической терапии различных видов рака с 2007 года на основании данных Bonnet et al. о том, что ДХА может вызывать апоптоз клеток рака легких, молочной железы и мозга человека. Ответ на терапию в исследованиях на людях оценивается по стандартным критериям оценки ответа при солидных опухолях, которые определяют «ответ» по степени уменьшения опухоли или ее исчезновения при визуализации.
Однако Blackburn et al. продемонстрировали, что DCA также может действовать как цитостатический агент in vitro и in vivo, не вызывая апоптоза (запрограммированной клеточной смерти). Представлен случай, когда пероральная терапия DCA привела к стабилизации рака толстой кишки 4 стадии у 57-летней женщины в течение почти 4 лет, без серьезных токсических последствий. Поскольку естественная история рака толстой кишки 4 стадии состоит из неуклонного прогрессирования, приводящего к инвалидности и смерти, этот случай подчеркивает новое применение DCA в качестве цитостатического агента с потенциалом поддержания долгосрочной стабильности рака поздней стадии.
Ключевые слова: Дихлорацетат; рак; толстая кишка; колоректальный рак; цитостатик; стабилизация; ингибирование роста; внутривенное введение
© Автор(ы) 2016. Опубликовано Baishideng Publishing Group Inc. Все права защищены.
Основная идея: Пероральный дихлорацетат натрия (ДХА) исследовался в качестве новой метаболической терапии различных видов рака. Ответ на терапию в исследованиях на людях оценивается по стандартным критериям оценки ответа при солидных опухолях, которые определяют «ответ» по степени уменьшения опухоли или исчезновения опухоли при визуализации.
Однако DCA может также действовать как цитостатический агент, не вызывая апоптоза (запрограммированной гибели клеток). Представлен случай, когда пероральная терапия DCA привела к стабилизации опухоли при раке толстой кишки 4 стадии у женщины 57 лет в течение почти 4 лет, без серьезных токсических последствий.
Khan A, Andrews D, Blackburn AC. Долгосрочная стабилизация рака толстой кишки 4 стадии с помощью терапии дихлорацетатом натрия. World J Clin Cases 2016; 4(10): 336-343
Доступно из: URL: http://www.wjgnet.com/2307-8960/full/v4/i10/336.htm
DOI: http://dx.doi.org/10.12998/wjcc.v4.i10.336
ВВЕДЕНИЕ
Препарат дихлорацетат натрия (ДХА) изучается в качестве новой метаболической терапии различных видов рака с 2007 года, когда Bonnet et al[1] опубликовали комбинированное исследование in vitro/in vivo на крысах, продемонстрировавшее эффективность ДХА в лечении рака легких, груди и мозга человека путем ингибирования митохондриальной киназы пируватдегидрогеназы. Stacpoole et al[2-4] ранее опубликовали многочисленные исследования с применением DCA для лечения врожденного молочнокислого ацидоза, который представляет собой совокупность наследственных митохондриальных заболеваний[5].
Эти исследования установили профиль безопасности перорального DCA у людей. Было установлено, что DCA является безопасным препаратом, не вызывающим сердечной, легочной, почечной или костномозговой токсичности[4]. Наиболее серьезным общим побочным эффектом является периферическая нейропатия, которая является обратимой[6]. Сообщалось о делирии, который обратим после прекращения приема DCA[7]. У небольшого процента пациентов отмечалось бессимптомное и обратимое повышение уровня печеночных ферментов[3].
Предшествующая работа по лечению врожденного молочнокислого ацидоза позволила быстро внедрить ДКА в онкологическую клинику. В настоящее время опубликовано четыре отчета о клинических исследованиях рака с использованием DCA, что свидетельствует о растущем признании потенциальной пользы DCA[8-11]. Однако эти испытания, в которых лечили пациентов на поздних стадиях, позволили получить информацию о лечении только в течение относительно коротких периодов времени.
В первой работе 2007 года, опубликованной Bonnet et al.[1], сообщалось, что DCA снижает мембранный потенциал митохондрий, что приводит к селективному апоптозу раковых клеток. Выявленный механизм заключался в ингибировании аэробного гликолиза (эффект Варбурга) и активации митохондриальных калиевых ионных каналов[1].
Дальнейшие исследования DCA подтвердили противораковую активность в отношении нескольких видов рака, включая рак толстой кишки[12], простаты[13], яичников[14], нейробластомы[15], карциноида легкого[16], шейки матки[17], эндометрия[18], холангиокарциномы[19], саркомы[20] и Т-клеточной лимфомы[21].
Предполагаются и другие антинеопластические действия DCA. Они включают блокаду ангиогенеза[22], изменение экспрессии HIF1-α[23], изменение регуляторов рН V-АТФазы и MCT1, а также других регуляторов выживания клеток, таких как PUMA, GLUT1, Bcl2 и p53[24].
Однако в поисках цитотоксической активности во многих исследованиях in vitro использовались концентрации DCA, которые вряд ли могут быть достигнуты в клинических условиях[25]. В некоторых исследованиях использовались ограниченные концентрации и было установлено, что DCA является цитостатическим, а не цитотоксическим препаратом, но способен усиливать апоптоз при использовании других агентов[26-28].
В отчете об успешном лечении рака молочной железы in vivo с помощью DCA, Sun et al[26] обнаружили, что DCA является цитостатиком, подавляющим пролиферацию без усиления апоптоза. DCA смог значительно уменьшить метастатическое бремя в легких крыс в высокометастатической модели рака молочной железы in vivo. Это позволяет предположить новую роль DCA в качестве стабилизирующего рак агента, аналогичного антиангиогенной терапии.
Однако, насколько известно авторам, до сих пор не было опубликовано данных о применении DCA для длительного поддержания стабильного заболевания у людей. В результате новаторской публикации Бонне о DCA, в начале 2007 года Хан начал клиническое применение DCA для лечения онкологических больных с плохим прогнозом или не ответивших на одобренные методы лечения рака.
В сотрудничестве с врачом-натуропатом (Эндрюс) был разработан протокол приема натуральных препаратов для устранения неврологической токсичности, ограничивающей дозу. Разработанная схема перорального приема DCA включала три натуральных препарата — ацетил L-карнитин[29-31], R-альфа-липоевую кислоту[32-34] и бенфотиамин[35-37]— с основной целью профилактики нейропатии.
Наблюдательные данные, собранные у более чем 300 онкологических пациентов с прогрессирующим заболеванием, выявили ощутимую пользу от терапии DCA в 60%-70% случаев. Риск развития нейропатии при включении естественных нейропротекторных агентов составил примерно 20% при дозировке 20-25 мг/кг в день по схеме 2 недели в день/1 неделя в неделю. Обратимое повышение уровня печеночных ферментов было отмечено примерно у 2% в этой группе пациентов (данные клинического наблюдения опубликованы онлайн на сайте www.medicorcancer.com).
Представлен случай пациента, иллюстрирующий цитостатический эффект перорального лечения DCA, поддерживаемого в течение нескольких лет. У этого пациента был плохой прогноз (медиана выживаемости 9-12 месяцев при колоректальном раке 4 стадии с использованием агрессивной традиционной паллиативной химиотерапии)[38]. Лечение пациента проводилось Ханом в сотрудничестве с врачом-натуропатом Эндрюсом, который разработал протокол, состоящий из натуральных нейропротекторных средств.
ОТЧЕТ О СЛУЧАЕ
Женщина 57 лет обратилась в клинику автора (Хан) в марте 2012 года в поисках лечения метастатического колоректального рака. Первоначально у пациентки был диагностирован рак прямой кишки в середине 2010 года, когда она обратилась к врачу по поводу новых запоров и болей в пояснице. Была предпринята попытка проведения колоноскопии, но колоноскоп не удалось продвинуть из-за наличия частично обтурирующей опухоли прямой кишки. Биопсия подтвердила умеренно дифференцированную аденокарциному толстой кишки.
Компьютерная томография (КТ) в то время показала заболевание 4 стадии с множественными метастазами в печени до 3 см в диаметре, возможными крошечными метастазами в легких и кольцевидной карциномой прямой кишки, которую было нелегко измерить (края рака было трудно отличить от окружающих тканей на КТ).
Пациенту была выполнена петлевая илеостомия для обхода непроходимости, а опухоль прямой кишки не была иссечена. За операцией последовала химиотерапия, состоящая из 5-фторурацила, иринотекана, лейковорина и бевацизумаба (FOLFIRI + бевацизумаб). Вначале пациент ответил на химиотерапию уменьшением метастазов в печени, уменьшением первичного поражения прямой кишки и снижением уровня карциноэмбрионального антигена (CEA) в крови с 260,9 нг/мл до начала химиотерапии до 3,5 нг/мл непосредственно перед началом терапии DCA. Затем реакция на химиотерапию стала плато. К тому времени, когда пациентка обратилась в клинику автора, химиотерапия приводила к минимальному уменьшению заболевания и, по сути, просто поддерживала стабильность.
Пациентка была ранее здорова, имела 20-летний стаж курения. Она иногда употребляла алкоголь. В семейном анамнезе был рак толстой кишки и рак желудка. Лекарства включали химиотерапию, как описано выше, клизмы с перекисью водорода, пероральный витамин С, иногда пероральный витамин D, гидроморфон 32 мг с временным высвобождением дважды в день и гидроморфон короткого действия 2-4 мг перорально по мере необходимости при «прорывной» боли. Аллергии не было.
Функциональный опрос выявил легкие язвы во рту, связанные с продолжающейся химиотерапией, легкую диарею (ожидаемую при илеостомии) и легкое периодическое ректальное кровотечение. Наблюдалась ноющая/жгучая боль в пояснице и крестце интенсивностью до 6 баллов из 10, а также легкая боль в правом плече, усиливающаяся после химиотерапии (считалось, что это отсылающая боль, связанная с метастазами в печени).
Поскольку химиотерапия была все еще эффективной, и пациент не испытывал серьезных побочных эффектов, первоначальный подход заключался в поддержке существующей терапии, а не в ее замене. В сотрудничестве с врачом-натуропатом (Эндрюс) был составлен интегративный план.
План состоял из добавления высокой дозы перорального витамина D в количестве 10 000 международных единиц в день, замены перорального витамина С на витамин С 50 г внутривенно (внутривенно) еженедельно, и добавления дихлорацетата натрия (ДХА) 3000 мг внутривенно (49 мг/кг) еженедельно (производитель: Tokyo Chemical Industry, США). Для снижения риска побочных эффектов DCA были назначены 3 натуральные добавки: Альфа-липоевая кислота (рацемическая) 500 мг внутривенно с каждой дозой DCA, пероральная R-альфа-липоевая кислота 150 мг 3 раза в день, пероральный ацетил L-карнитин 500 мг 3 раза в день и пероральный бенфотиамин 80 мг дважды в день.
Инфузии были запланированы вокруг инфузий химиотерапии (отделены не менее чем на 2 дня от химиотерапии), чтобы избежать любых потенциальных помех или лекарственных взаимодействий. Липоевая кислота не принималась в дни химиотерапии, а также в течение 1 дня до или после химиотерапии, поскольку она является мощным антиоксидантом и может снизить эффективность химиотерапии. Интегративная терапия началась в марте 2012 года. Побочных эффектов не отмечалось, поэтому доза DCA была увеличена до 4000 мг внутривенно (66 мг/кг) еженедельно. Единственным побочным эффектом, отмеченным при увеличении дозы DCA, была легкая седация после инфузии.
Таблица 1 Анализ крови до начала терапии дихлорацетатом натрия
| Анализ крови | Значение | Единицы | Нормальный диапазон |
|---|---|---|---|
| Гемоглобин | 131 | г/л | 115-155 |
| Количество лейкоцитов | 6.5 | ×109/L | 4.0-11.0 |
| Тромбоциты | 202 | ×109/L | 145-400 |
| Глюкоза | 5.9 | ммоль/л | 2.6-7.0 |
| Мочевина | 6.5 | ммоль/л | 2.5-8.1 |
| Креатинин | 64 | мкмоль/л | 50-100 |
| Кальций | 2.38 | ммоль/л | 2.20-2.65 |
| Альбумин | 43 | г/л | 35-52 |
| Билирубин | 15 | мкмоль/л | < 23 |
| Натрий | 140 | ммоль/л | 136-146 |
| Калий | 4.2 | ммоль/л | 3.7-5.4 |
| Хлорид | 102 | ммоль/л | 95-108 |
| Щелочная фосфатаза | 1861 | ЕД/Л | 35-122 |
| ЛДГ | 167 | U/L | 110-215 |
| ГГТ | 3641 | U/L | < 36 |
| АСТ | 331 | U/L | < 31 |
| АЛТ | 31 | U/L | < 36 |
Для повышения чувствительности рака к химиотерапии был добавлен пероральный метформин, начиная с 500 мг перорально один раз в день с титрованием до 500 мг 3 раза в день[39]. Для купирования невропатической крестцовой боли был добавлен прегабалин (начало приема 50 мг в день, титрование до 50 мг 3 раза в день). Побочные эффекты химиотерапии включали тошноту и рвоту (до начала приема метформина), и метформин пропускали в те дни, когда пациент чувствовал себя плохо, чтобы предотвратить возможную токсичность, если пациент будет обезвожен.
Были получены обычные базовые анализы крови, включая полный подсчет клеток, стандартную метаболическую панель, печеночные ферменты и билирубин (Таблица 1). Была доступна исходная компьютерная томография, которая была выполнена за 2 месяца до начала интегративной терапии с ДКА.
После 4 месяцев интегративной терапии, как описано выше, была проведена новая компьютерная томография (рис. 1), о которой сообщили как о «стабильной и неизменной», но никаких измерений не привели. Была отмечена случайная находка желчного камня (также стабильная по сравнению с предыдущим сканированием). Пациент расстроился из-за того, что не было отмечено никаких улучшений, а в заключении КТ не было указано никаких подробных измерений. Была предпринята попытка получить результаты позитронно-эмиссионной томографии для уточнения живых и некротических опухолей, но государственное финансирование получить не удалось, а пациент отказался платить за томографию частным образом.
После некоторого обсуждения пациентка решила продолжить терапию и в дальнейшем проводить КТ в другой больнице. К сентябрю 2012 года было отмечено усиление побочных эффектов химиотерапии, включая усталость, тошноту и рвоту. Новая компьютерная томография показала, что все поражения печени «либо уменьшились, либо больше не определялись». Однако наибольшее уменьшение опухоли составило всего 2 мм (2,5 см поражения в сегменте 4a печени уменьшилось до 2,3 см). Новых поражений выявлено не было.
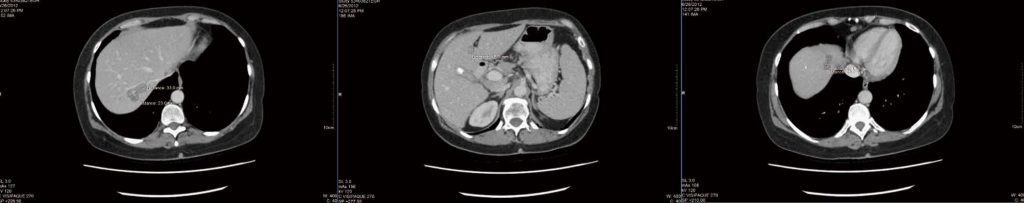
.
Таблица 2 Анализ крови во время терапии дихлорацетатом натрия, январь 2013 г
| Анализ крови | Значение | Единицы | Нормальный диапазон |
|---|---|---|---|
| Гемоглобин | 134 | г/л | 115-155 |
| Количество лейкоцитов | 5.1 | ×109/L | 4.0-11.0 |
| Тромбоциты | 1421 | ×109/L | 145-400 |
| Глюкоза | 5.5 | ммоль/л | 2.6-7.0 |
| Мочевина | 4.1 | ммоль/л | 2.5-8.1 |
| Креатинин | 57 | мкмоль/л | 50-100 |
| Кальций | 2.24 | ммоль/л | 2.20-2.65 |
| Альбумин | 39 | г/л | 35-52 |
| Билирубин | 11 | мкмоль/л | < 23 |
| Натрий | 140 | ммоль/л | 136-146 |
| Калий | 4.2 | ммоль/л | 3.7-5.4 |
| Хлорид | 106 | ммоль/л | 95-108 |
| Щелочная фосфатаза | 2671 | ЕД/Л | 35-122 |
| ЛДГ | 183 | U/L | 110-215 |
| ГГТ | 8371 | U/L | < 36 |
| АСТ | 1041 | U/L | < 31 |
| АЛТ | 100 | U/L | < 36 |
После изучения результатов КТ пациентка решила прекратить всю химиотерапию, а также бевацизумаб и метформин. Было продолжено введение DCA внутривенно, а доза была увеличена до 4500 мг внутривенно еженедельно. Тошнота и рвота прошли. Боль оставалась под контролем.
Через 3 месяца была проведена новая компьютерная томография, которая показала остаточную опухоль прямой кишки со стриктурой и проксимальной каловой нагрузкой (без изменений), а также «метастазы в печени, без существенных изменений». Пациент сообщил о легком онемении пальцев рук и ног. Наблюдалось дальнейшее увеличение бессимптомного повышения печеночных ферментов (табл. 2). Оба эти явления были диагностированы как побочные эффекты ДКА. Во время терапии до этого момента СЕА демонстрировал слабые колебания, но в целом считался стабильным (рис. 2).
терапия ДКА была прервана на 3 месяца для разрешения побочных эффектов ДКА
В течение этого времени проводилась только натуральная терапия (назначенная Эндрюсом). Ацетил L-карнитин, бенфотиамин и альфа-липоевая кислота были продолжены для ускорения восстановления нейропатии, вызванной ДКА. Пероральный куркумин[40] и хонокиол (экстракт дерева магнолии) были добавлены в попытке поддержать контроль над раком[41]. В период прекращения приема ДКА уровень СЕА повысился с 4,1 до 5,1 нг/мл (рис. 2). Легкая невропатия, вызванная ДКА, разрешилась, а показатели печеночных ферментов начали улучшаться.
К марту 2013 года, в связи с опасениями по поводу стоимости инфузионной терапии, было решено начать пероральную терапию ДКА. Новая базовая компьютерная томография показала увеличение на 1 мм маркерного поражения 7 сегмента печени и увеличение на 1 мм маркерного аортокавального лимфатического узла, но было сообщено о «стабильном внешнем виде толстой кишки» и «стабильных метастазах в печени».
Был начат пероральный прием DCA в дозе 500 мг (8,2 мг/кг) дважды в день, а также продолжался прием нейропротекторных добавок, состоящих из перорального ацетил L-карнитина, бенфотиамина и R-альфа-липоевой кислоты. Добавки принимались непрерывно, а DCA вводился по циклу 2 недели в день/1 неделя в день.
В декабре 2013 года для упрощения, улучшения контроля боли и экономии средств был осуществлен переход с гидроморфона на метадон 10 мг 3 раза в день.
Пациент продолжал придерживаться этой схемы лечения с регулярным проведением компьютерной томографии каждые 3-6 месяцев. Из-за напряженного графика работы пациентка стала менее комплаентной к регулярным анализам крови. Она оставалась высокофункциональной (уровень ECOG 1) с легкой хронической нейропатией ДКА, которая контролировалась и не влияла на ее повседневные функции.
Была предпринята попытка увеличить дозу DCA до 500 мг 3 раза в день, но это привело к значительному бессимптомному повышению печеночных ферментов и усилению нейропатии. В результате после небольшого перерыва в терапии была возобновлена доза ДКА в 500 мг два раза в день.
Текущие КТ-сканирования продолжали выявлять стабильное заболевание (рис. 3), новых очагов поражения не появлялось. Общий уровень CEA существенно не изменился с начала терапии DCA (CEA 3,5 в начале терапии DCA, CEA 3,7 после почти 4 лет терапии). Общий анализ крови также был благоприятным на отметке 3 года (Таблица 3) и после 4 лет (Таблица 4).
Таким образом, после получения обычной химиотерапии в течение 18 месяцев пациентка получала внутривенную терапию DCA с одновременной химиотерапией в течение 6 месяцев, затем внутривенную и пероральную терапию DCA без одновременной обычной противораковой терапии в течение почти 4 лет. Во время лечения пероральным DCA у пациентки наблюдалась стабильность заболевания по результатам компьютерной томографии и стабильность заболевания по результатам измерения опухолевого маркера CEA. Она также была клинически стабильна, не увеличивая дозу метадона, сохраняя функцию ECOG уровня 1, стабильную легкую невропатию DCA, и могла успешно вести свой бизнес.
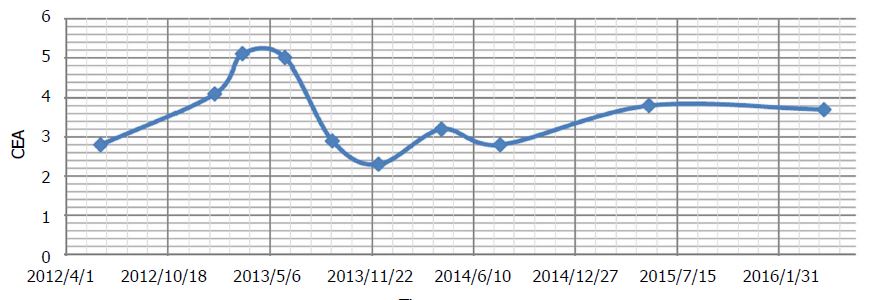
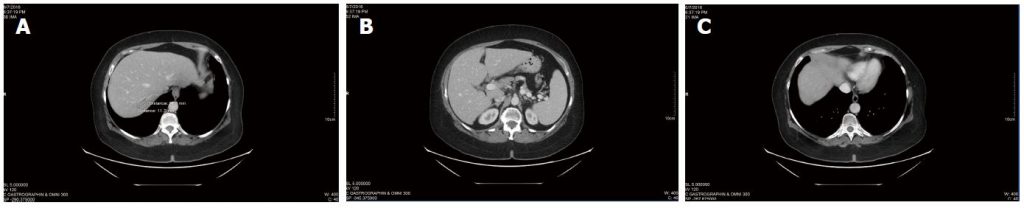
Таблица 3 Анализ крови во время терапии дихлорацетатом натрия, май 2015 г
| Анализ крови | Значение | Единицы | Нормальный диапазон |
|---|---|---|---|
| Гемоглобин | 134 | г/л | 115-155 |
| Количество лейкоцитов | 7.7 | ×109/L | 4.0-11.0 |
| Тромбоциты | 173 | ×109/L | 145-400 |
| Глюкоза | 5.3 | ммоль/л | 2.6-7.0 |
| Мочевина | 5.1 | ммоль/л | 2.5-8.1 |
| Креатинин | 70 | мкмоль/л | 50-100 |
| Кальций | 2.37 | ммоль/л | 2.20-2.65 |
| Альбумин | — | г/л | 35-52 |
| Билирубин | 8 | мкмоль/л | < 23 |
| Натрий | 144 | ммоль/л | 136-146 |
| Калий | 4.1 | ммоль/л | 3.7-5.4 |
| Хлорид | 104 | ммоль/л | 95-108 |
| Щелочная фосфатаза | — | ЕД/Л | 35-122 |
| ЛДГ | 174 | U/L | 110-215 |
| ГГТ | 1561 | U/L | < 36 |
| АСТ | 30 | U/L | < 31 |
| АЛТ | 25 | U/L | < 36 |
Таблица 4 Анализ крови во время терапии дихлорацетатом натрия, апрель 2016 г
| Анализ крови | Значение | Единицы | Нормальный диапазон |
|---|---|---|---|
| Гемоглобин | 133 | г/л | 115-155 |
| Количество лейкоцитов | 5.2 | ×109/L | 4.0-11.0 |
| Тромбоциты | 155 | ×109/L | 145-400 |
| Глюкоза | — | ммоль/л | 2.6-7.0 |
| Мочевина | 4.9 | ммоль/л | 2.5-8.1 |
| Креатинин | — | мкмоль/л | 50-100 |
| Кальций | 2.39 | ммоль/л | 2.20-2.65 |
| Альбумин | 42 | г/л | 35-52 |
| Билирубин | 9 | мкмоль/л | < 23 |
| Натрий | 142 | ммоль/л | 136-146 |
| Калий | 4 | ммоль/л | 3.7-5.4 |
| Хлорид | 102 | ммоль/л | 95-108 |
| Щелочная фосфатаза | 101 | ЕД/Л | 35-122 |
| ЛДГ | 156 | U/L | 110-215 |
| ГГТ | 1491 | U/L | < 36 |
| АСТ | 30 | U/L | < 31 |
| АЛТ | 28 | U/L | < 36 |
ДИСКУССИЯ
Данный случай терапии DCA у пациента с раком толстой кишки 4 стадии демонстрирует длительную стабильную болезнь согласно клиническим, биохимическим и радиологическим критериям.
Длительность стабильности при приеме DCA без другой активной химиотерапии в настоящее время составляет 46 месяцев (почти 4 года), а время выживания с момента первоначального диагноза рака толстой кишки 4 стадии — 6 лет.
По данным статистического обзора раковой статистики SEER Национального института рака за 1975-2011 годы, 5-летняя относительная выживаемость для женщин с диагнозом рака толстой/прямой кишки IV стадии составила 14,4% (http://seer.cancer.gov/csr/1975_2013/). Хотя нельзя сделать однозначный вывод об эффективности DCA, выживание в течение такого длительного периода времени в отсутствие постоянной химиотерапии было бы относительно маловероятным.
Сообщалось о цитостатическом, а не цитотоксическом действии DCA на колоректальные и другие раковые клетки, что подтверждает данный клинический вывод[23,27,42-44]. На сегодняшний день клиническое состояние пациентки остается хорошим, и она продолжает терапию ДКА.
В дополнение к поддержанию стабильного заболевания, этот случай демонстрирует переносимость перорального DCA у пациентов с раком в течение гораздо более длительных периодов времени, чем те, о которых в настоящее время сообщается в опубликованных клинических исследованиях у пациентов с раком. Chu et al.[11] сообщили о 24 пациентах, получавших лечение в течение 2 месяцев в дозе 6,25 или 12,5 мг/кг в сутки, постоянно принимавших пероральный ДКА без нейропротекторных добавок.
Они пришли к выводу, что рекомендуемая доза 2-й фазы составляет 6,25 мг/кг в сутки (12,5 мг/кг в день), при этом необходим тщательный мониторинг нейропатии. Данбар и др.[9] рекомендовали 5 мг/кг в сутки в качестве начальной дозы для большинства пациентов, а в их исследовании постоянно применялись 4, 8 или 12,5 мг/кг в сутки (среднее время приема ДКА 34 дня), также без нейропротекторных добавок.
Пациент в этом отчете принимал 500 мг BID, что эквивалентно 8,2 мг/кг BID, 2 недели включительно/1 неделя перерыва, но не смог переносить эту дозу три раза в день (всего 25 мг/кг в день). Данбар и др.[9] предлагают при определении начальной дозы для пациентов учитывать генотипирование полиморфизмов GSTZ1, фермента, метаболизирующего ДКА в печени, который инактивируется при постоянном применении ДКА[45].
Однако для сбора убедительного количества генотипов и данных о переносимости дозы необходима дальнейшая работа. В настоящее время проводится клиническое исследование DCA у пациентов с множественной миеломой, которое пополнит этот фонд данных (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr.org.au).
Необходимы дальнейшие исследования для определения оптимального режима дозирования для максимально переносимого острого или хронического лечения ДКА, а также для определения дозы, необходимой для эффективности.
Представленный случай показывает, что DCA имеет большие перспективы в качестве терапии рака. Пациентка получила значительный эффект от терапии, при этом побочные эффекты были слабо выражены, гематологическая, сердечная, легочная или почечная токсичность отсутствовала. Наблюдалась некоторая печеночная токсичность (табл. 2), которая легко устранялась прерыванием терапии DCA с последующей корректировкой дозы.
Сообщалось о легкой обратимой периферической нейротоксичности. Натуральные препараты, которые сочетались с DCA (ацетил L-карнитин, альфа-липоевая кислота и бенфотиамин), помогли пациенту уменьшить побочные эффекты, но не являются противораковыми средствами.
На момент написания этой статьи не существует активных клинических исследований, изучающих использование DCA в качестве цитостатического агента. В связи с тем, что DCA не имеет патента, привлечение достаточных средств для проведения крупномасштабных испытаний на людях является серьезной проблемой. Мы надеемся, что этот случай, демонстрирующий преимущества перорального DCA, послужит стимулом для дальнейших клинических исследований.
Основываясь на нашем клиническом опыте, в сочетании с существующими публикациями, можно сказать, что терапия с использованием ДКА является одним из вариантов для пациентов с ограниченными возможностями традиционного лечения, если они понимают и принимают риски и преимущества терапии.
Данный случай показывает, что даже на поздних стадиях заболевания DCA имеет потенциал для продления жизни без снижения качества жизни пациента, в отличие от химиотерапии с ее частыми изнурительными побочными эффектами или нарушением физиологических функций. Учитывая разумную стоимость и умеренную токсичность, DCA заслуживает дальнейшего изучения.
БЛАГОДАРНОСТИ
Авторы выражают благодарность доктору Хумайре Хан за помощь, а также пациентке за поддержку и согласие на публикацию ее случая.
КОММЕНТАРИИ
Характеристика случая
Пациентка 57 лет обратилась с запором и болью в пояснице.
Клинический диагноз
У пациента был диагностирован частично обтурирующий рак прямой кишки
Лабораторный диагноз
Повышенное соде
опухолевого маркера карциноэмбрионального антигена.
Визуализационный диагноз
Образование
при колоноскопии толстой кишки.
Патологический диагноз
Умеренно дифференцированная аденокарцинома толстой кишки
Лечение
Петлевая илеостомия с последующей химиотерапией, состоящей из 5-фторурацила, иринотекана, лейковорина и бевацизумаба, затем добавление дихлорацетата натрия (ДХА), затем ДХА без химиотерапии в течение почти 4 лет.
Похожие отчеты
Отчеты о компьютерной томографии демонстрируют уменьшение рака при комбинированной химиотерапии + DCA, затем стабильную болезнь в течение почти 4 лет при использовании DCA и без химиотерапии.
Объяснение термина
DCA: дихлорацетат натрия; RECIST: Критерии оценки ответа при солидных опухолях; ECOG: Восточная кооперативная онкологическая группа; SEER: Наблюдение, эпидемиология и конечные результаты.
Опыт и уроки
DCA является не только проапоптотическим препаратом, но и может действовать как цитостатический агент, и таким образом можно добиться долгосрочной стабилизации прогрессирующего рака без серьезных побочных эффектов, как показано на примере этого случая рака прямой кишки
Peer-review
DCA, натриевая соль дихлорацетата, является дешевым химическим соединением, показавшим несомненный потенциал в качестве альтернативного лечения рака, которое использовалось в ряде испытаний с людьми, страдающими от рака мозга, или глиобластомы. Это хорошо написанный отчет о случае, когда пероральная терапия DCA привела к стабилизации опухоли рака толстой кишки 4 стадии у 57-летней женщины в течение более 3 лет, без серьезной токсичности. Этот отчет соответствует тому, что он обещает.
Авторы проделали большую работу по объяснению основ терапии DCA и ее роли при различных типах опухолей. Наряду с добавлением механизмов действия против раковых клеток и терапевтического потенциала DCA, авторы предоставляют хороший ресурс для читателей, которые более незнакомы с терапией DCA, но в то же время предоставляют подробную информацию.
ССЫЛКИ
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. Ось митохондрий-K+ каналов подавляется при раке, и ее нормализация способствует апоптозу и подавляет рост рака. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/j.ccr.2006.10.020]2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Оценка долгосрочного лечения детей с врожденным молочнокислым ацидозом дихлорацетатом. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Терапевтический потенциал дихлорацетата при дефиците комплекса пируватдегидрогеназы. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Дихлорацетат вызывает токсическую нейропатию при MELAS: рандомизированное, контролируемое клиническое исследование. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Метаболическая модуляция глиобластомы с помощью дихлорацетата. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Фаза 1 испытания дихлорацетата (DCA) у взрослых с рецидивирующими злокачественными опухолями головного мозга. Invest New Drugs 2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Дихлорацетат следует рассматривать вместе с химиотерапией на основе платины в гипоксических опухолях, а не как отдельный агент при распространенном немелкоклеточном раке легкого. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/ s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Фаза I открытого меченого, однорукого, однорангового, дозо-эскалационного исследования дихлорацетата (DCA) у пациентов с прогрессирующими солидными опухолями. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Дихлорацетат индуцирует апоптоз и остановку клеточного цикла в клетках колоректального рака. Br J Cancer 2010; 102: 1746-1752 [PMID: 20485289 DOI: 10.1038/sj.bjc.6605701]
13 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Дихлорацетат (DCA) сенсибилизирует клетки рака простаты как дикого типа, так и экспрессирующие Bcl-2 in vitro к радиации. Prostate 2008; 68: 1223-1231 [PMID: 18465755 DOI: 10.1002/pros.20788]
14 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Дихлорацетат индуцирует апоптоз эпителиальных клеток рака яичников через механизм, включающий модуляцию окислительного стресса. Reprod Sci 2011; 18: 1253-1261 [PMID: 21701041 DOI: 10.1177/1 933719111411731]
15 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Dichloroacetate inhibits neuroblastoma growth by specifically acting against malignant undifferentiated cells. Int J Cancer 2012; 130: 1484-1493 [PMID: 21557214 DOI: 10.1002/ijc.26173]
16 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines. Clin Transl Oncol 2011; 13: 43-49 [PMID: 21239354 DOI: 10.1007/s12094-011-0615-z]
17 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Некроз карциномы шейки матки под действием дихлорацетата, высвобожденного из электросплетенных полилактидных матов. Biomaterials 2012; 33: 4362-4369 [PMID: 22425553 DOI: 10.1016/j.biomaterials.2012.02.062]
18 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 2008; 109: 394-402 [PMID: 18423823 DOI: 10.1016/j.ygyno.2008.01.038]
19 Ishiguro T, Ishiguro R, Ishiguro M, Iwai S. Совместное лечение дихлорацетатом, омепразолом и тамоксифеном оказывает синергическое антипролиферативное действие на злокачественные опухоли: эксперименты in vivo и история болезни. Hepatogastroenterology 2012; 59: 994-996 [PMID: 22580646 DOI: 10.5754/hge10507]
20 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. Влияние дихлорацетата натрия на окислительные процессы в саркоме 37. Exp Oncol 2011; 33: 216-221 [PMID: 22217710]
21 Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma: Влияние измененного метаболизма глюкозы, гомеостаза рН и регуляции выживания клеток. Chem Biol Interact 2012; 199: 29-37 [PMID: 22705712 DOI: 10.1016/j.cbi.2012.06.005]
22 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Активация митохондрий путем ингибирования PDKII подавляет сигнализацию HIF1a и ангиогенез при раке. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
23 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Дихлорацетат натрия (DCA) снижает апоптоз при гипоксии колоректальных опухолей. Cancer Lett 2010; 297: 75-83 [PMID: 20537792 DOI: 10.1016/j.canlet.2010.04.027]
24 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro эффекты дихлорацетата и CO2 на гипоксические клетки HeLa. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
25 Kankotia S, Stacpoole PW. Дихлорацетат и рак: новый дом для сиротского препарата? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
26 Sun RC, Board PG, Blackburn AC. Таргетинг метаболизма с помощью триоксида мышьяка и дихлорацетата в клетках рака молочной железы. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
27 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Дихлорацетат натрия избирательно нацелен на клетки с дефектами митохондриального ЭТЦ. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
28 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Таргетинг двух аспектов метаболизма в лечении рака молочной железы. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
29 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy- induced peripheral neuropathy: a short review. CNS Drugs 2007; 21 Suppl 1: 39-43; discussion 45-46 [PMID: 17696592]
30 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxel- and cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
31 Evans JD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
32 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alpha lipoic Acid for symptomatic peripheral neuropathy in patients with diabetes: a meta-analysis of randomized controlled trials. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
33 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. Лечебный эффект альфа-липоевой кислоты на периферическую нейропатию при диабете 2 типа: клиническое исследование. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
34 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Лечение симптоматической диабетической периферической нейропатии антиоксидантом альфа-липоевой кислотой. 3-недельное многоцентровое рандомизированное контролируемое исследование (исследование ALADIN). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
35 Winkler G, Kempler P. Pathomechanism of diabetic neuropathy: background of the pathogenesis-oriented therapy. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
36 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Витамин B для лечения периферической нейропатии. Cochrane Database Syst Rev 2008: CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573.pub3]
37 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosage regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
38 Loupakis F, Cremolini C, Masi G, Lonardi S, Zagonel V, Salvatore L, Cortesi E, Tomasello G, Ronzoni M, Spadi R, Zaniboni A, Tonini G, Buonadonna A, Amoroso D, Chiara S, Carlomagno C, Boni C, Allegrini G, Boni L, Falcone A. Начальная терапия FOLFOXIRI и бевацизумаба при метастатическом колоректальном раке. N Engl J Med 2014; 371: 1609-1618 [PMID: 25337750 DOI: 10.1056/ NEJMoa1403108]
39 Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. Metformin selectively target cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission. Cancer Res 2009; 69: 7507-7511 [PMID: 19752085 DOI: 10.1158/0008-5472.can-09-2994]
40 Cao A, Li Q, Yin P, Dong Y, Shi H, Wang L, Ji G, Xie J, Wu D. Curcumin induces apoptosis in human gastric carcinoma AGS cells and colon carcinoma HT-29 cells through mitochondrial dysfunction and endoplasmic reticulum stress. Apoptosis 2013; 18: 1391-1402 [PMID: 23881281 DOI: 10.1007/s10495-013-0871-1]
41 Wynn ML, Consul N, Merajver SD, Schnell S. Inferring the Effects of Honokiol on the Notch Signaling Pathway in SW480 Colon Cancer Cells. Cancer Inform 2014; 13: 1-12 [PMID: 25392689 DOI: 10.4137/CIN.S14060]
42 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Дихлорацетат влияет на пролиферацию, но не на выживание клеток колоректального рака человека. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
43 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Обращение гликолитического фенотипа дихлорацетатом ингибирует рост метастатических клеток рака молочной железы in vitro и in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/s10549-009-0435-9]
44 Sánchez-Aragó M, Chamorro M, Cuezva JM. Селекция раковых клеток с подавленными митохондриями запускает прогрессию рака толстой кишки. Carcinogenesis 2010; 31: 567-576 [PMID: 20080835 DOI: 10.1093/ carcin/bgq012]
45 Tzeng HF, Blackburn AC, Board PG, Anders MW. Полиморфизм и зависящая от вида инактивация глутатионтрансферазы дзета дихлорацетатом. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]
Связанный контент: