Akbar Khan, Doug Andrews, Anneke C. Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Kanada
Anneke C Blackburn, John Curtin School of Medical Research, Australische Nationaluniversität, Canberra, ACT 2601, Australien
Beiträge der Autoren: Khan A behandelte den Patienten und verfasste den größten Teil des Fallberichts; Andrews D behandelte den Patienten, entwarf die natürlichen Therapieprotokolle und war Mitverfasser des Fallberichts; Blackburn AC führte In-vitro- und In-vivo-Arbeiten durch, die die Wirkung von DCA als Zytostatikum belegen, und verfasste die Teile des Fallberichts, die sich mit der In-vitro- und In-vivo-DCA-Forschung befassen.
Stellungnahme des institutionellen Prüfungsausschusses: Nicht zutreffend.
Einverständniserklärung nach Aufklärung: Die in diesem Manuskript beschriebene Patientin hat ihr Einverständnis zur anonymen Veröffentlichung ihres Falles gegeben.
Erklärung zu Interessenkonflikten: Einer der Autoren (Khan) führt die Dichloracetat-Therapie für Krebspatienten über die Medicor-Krebszentren auf Kosten und ohne Gewinn durch. Die Klinik ist im Besitz eines Familienmitglieds dieses Autors. Die anderen Autoren haben nichts offen zu legen.
Open-Access: Dieser Artikel ist ein Open-Access-Artikel, der von einem internen Redakteur ausgewählt und von externen Gutachtern vollständig begutachtet wurde. Er wird in Übereinstimmung mit der Creative Commons Attribution Non Commercial (CC BY-NC 4.0)-Lizenz verbreitet, die es anderen erlaubt, dieses Werk zu verbreiten, zu remixen, zu adaptieren, auf diesem Werk aufzubauen und ihre abgeleiteten Werke zu anderen Bedingungen zu lizenzieren, vorausgesetzt, das Originalwerk wird ordnungsgemäß zitiert und die Nutzung ist nicht kommerziell. Siehe: http://creativecommons.org/licenses/by-nc/4.0/
Quelle des Manuskripts: Eingeladenes Manuskript
Korrespondenz mit: Akbar Khan, MD, Medizinischer Direktor,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Kanada.
[email protected]:
+1-416-2270037Fax: +1-416-2271915
Received: 30. April 2016
Peer-Review begonnen: 3. Mai 2016
Erste Entscheidung: June 17, 2016
Revised: 23. Juli 2016
Angenommen: August 6, 2016
Artikel im Druck: August 8, 2016
Online veröffentlicht: Oktober 16, 2016
Zusammenfassung
Orales Dichloracetat-Natrium (DCA) wird seit 2007 als neuartige Stoffwechseltherapie für verschiedene Krebsarten untersucht, basierend auf den Daten von Bonnet et al, dass DCA die Apoptose menschlicher Lungen-, Brust- und Gehirnkrebszellen auslösen kann. Das Ansprechen auf die Therapie wird in Humanstudien anhand der Standardkriterien für die Bewertung des Ansprechens bei soliden Tumoren gemessen, die „Ansprechen“ durch den Grad der Tumorverkleinerung oder das Verschwinden des Tumors in der Bildgebung definieren.
Blackburn et al. haben jedoch gezeigt, dass DCA in vitro und in vivo auch als Zytostatikum wirken kann, ohne Apoptose (programmierten Zelltod) auszulösen. Es wird ein Fall vorgestellt, in dem eine orale DCA-Therapie bei einer 57-jährigen Frau zu einer Stabilisierung des Kolonkarzinoms im Stadium 4 über einen Zeitraum von fast 4 Jahren führte, ohne dass es zu ernsthaften Toxizitäten kam. Da der natürliche Verlauf von Dickdarmkrebs im Stadium 4 aus einem stetigen Fortschreiten besteht, das zu Behinderung und Tod führt, zeigt dieser Fall eine neuartige Verwendung von DCA als Zytostatikum mit dem Potenzial, die langfristige Stabilität von Krebs im fortgeschrittenen Stadium zu erhalten.
Schlüsselwörter: Dichloracetat; Krebs; Dickdarm; Kolorektal; Zytostatikum; Stabilisierung; Wachstumshemmung; Intravenös
© The Author(s) 2016. Veröffentlicht von Baishideng Publishing Group Inc. All rights reserved.
Kernaussage: Orales Dichloracetat-Natrium (DCA) wurde als neuartige Stoffwechseltherapie für verschiedene Krebsarten untersucht. Das Ansprechen auf die Therapie wird in Humanstudien anhand der Standardkriterien für die Bewertung des Ansprechens bei soliden Tumoren gemessen, die das „Ansprechen“ durch den Grad der Tumorverkleinerung oder das Verschwinden des Tumors in der Bildgebung definieren.
DCA kann jedoch auch als Zytostatikum wirken, ohne Apoptose (programmierter Zelltod) auszulösen. Es wird ein Fall vorgestellt, in dem die orale DCA-Therapie bei einer 57-jährigen Frau zu einer Tumorstabilisierung eines Kolonkarzinoms im Stadium 4 über einen Zeitraum von fast 4 Jahren führte, ohne dass es zu ernsthaften Toxizitäten kam.
Khan A, Andrews D, Blackburn AC. Langfristige Stabilisierung von Dickdarmkrebs im Stadium 4 durch Natriumdichloracetat-Therapie. World J Clin Cases 2016; 4(10): 336-343
Verfügbar unter: URL: http://www.wjgnet.com/2307-8960/full/v4/i10/336.htm
DOI: http://dx.doi.org/10.12998/wjcc.v4.i10.336
EINLEITUNG
Der Wirkstoff Natriumdichloracetat (DCA) wird seit 2007 als neuartige Stoffwechseltherapie für verschiedene Krebsarten untersucht, als Bonnet et al.[1] eine kombinierte In-vitro-/In-vivo-Studie an Ratten veröffentlichten, in der die Wirksamkeit von DCA bei der Behandlung von menschlichem Lungen-, Brust- und Gehirnkrebs durch Hemmung der mitochondrialen Pyruvatdehydrogenase-Kinase nachgewiesen wurde. Stacpoole et al.[2-4] hatten zuvor mehrere Studien veröffentlicht, in denen DCA zur Behandlung der kongenitalen Laktatazidose eingesetzt wurde, die sich aus einer Reihe von vererbten mitochondrialen Erkrankungen zusammensetzt[5].
Diese Studien belegten das Sicherheitsprofil von oralem DCA beim Menschen. DCA erwies sich als sicheres Arzneimittel, das keine Herz-, Lungen-, Nieren- oder Knochenmarktoxizität aufweist[4]. Die schwerwiegendste häufige Nebenwirkung ist die periphere Neuropathie, die reversibel ist[6]. Es wurde über Delirium berichtet, das nach Absetzen von DCA reversibel ist[7]. Bei einem kleinen Prozentsatz der Patienten wurde über eine asymptomatische und reversible Erhöhung der Leberenzyme berichtet[3].
Die frühere Arbeit bei kongenitaler Laktatazidose hat den raschen Einzug von DCA in die Krebsklinik ermöglicht. Inzwischen wurden vier Berichte über klinische Krebsstudien mit DCA veröffentlicht, was darauf hindeutet, dass die potenzielle Nützlichkeit von DCA zunehmend anerkannt wird[8-11]. In diesen Studien, in denen Patienten im Spätstadium behandelt wurden, konnte jedoch nur über relativ kurze Behandlungszeiträume berichtet werden.
In der ersten Veröffentlichung von Bonnet et al.[1] aus dem Jahr 2007 wurde berichtet, dass DCA das mitochondriale Membranpotenzial reduziert, was zu selektiver Apoptose in Krebszellen führt. Als Mechanismus wurde die Hemmung der aeroben Glykolyse (Warburg-Effekt) und die Aktivierung mitochondrialer Kaliumionenkanäle identifiziert[1].
Weitere Untersuchungen von DCA bestätigten die krebshemmende Wirkung bei verschiedenen Krebsarten, darunter Dickdarm[12], Prostata[13], Eierstock[14], Neuroblastom[15], Lungenkarzinom[16], Gebärmutterhalskrebs[17], Endometrium[18], Cholangiokarzinom[19], Sarkom[20] und T-Zell-Lymphom[21].
Es wurden auch andere antineoplastische Wirkungen von DCA vorgeschlagen. Dazu gehören die Blockierung der Angiogenese[22], die Veränderung der Expression von HIF1-α[23], die Veränderung der pH-Regulatoren V-ATPase und MCT1 sowie anderer Zellüberlebensregulatoren wie PUMA, GLUT1, Bcl2 und p53[24].
Bei der Suche nach zytotoxischer Aktivität werden jedoch in vielen In-vitro-Berichten DCA-Konzentrationen verwendet, die in der Klinik wahrscheinlich nicht erreicht werden[25]. In einigen Studien wurden begrenzte Konzentrationen verwendet und festgestellt, dass DCA eher zytostatisch als zytotoxisch wirkt, aber in der Lage ist, die Apoptose mit anderen Wirkstoffen zu verstärken[26-28].
Sun et al.[26] berichteten über eine erfolgreiche In-vivo-DCA-Behandlung von Brustkrebs und stellten fest, dass DCA zytostatisch wirkt und die Proliferation hemmt, ohne die Apoptose zu erhöhen. DCA war in der Lage, die Metastasenbildung in der Lunge von Ratten in einem stark metastasierenden In-vivo-Modell von Brustkrebs erheblich zu reduzieren. Dies deutet auf eine neue Rolle von DCA als krebsstabilisierendes Mittel hin, ähnlich wie bei einer antiangiogenen Therapie.
Nach Kenntnis der Autoren sind jedoch noch keine Daten für den Menschen veröffentlicht worden, die den Einsatz von DCA zur langfristigen Aufrechterhaltung einer stabilen Erkrankung unterstützen. Infolge von Bonnets bahnbrechender DCA-Publikation begann Khan Anfang 2007 mit dem klinischen Einsatz von DCA zur Behandlung von Krebspatienten, die eine schlechte Prognose haben oder auf zugelassene Krebstherapien nicht ansprechen.
In Zusammenarbeit mit einem Arzt für Naturheilkunde (Andrews) wurde ein Protokoll mit natürlichen Medikamenten entwickelt, um die dosislimitierende neurologische Toxizität zu behandeln. Die entwickelte orale DCA-Kur umfasste drei natürliche Medikamente, Acetyl-L-Carnitin[29-31], R-Alpha-Liponsäure[32-34] und Benfotiamin[35-37], die in erster Linie der Vorbeugung von Neuropathien dienen sollten.
Beobachtungsdaten, die bei mehr als 300 Krebspatienten mit fortgeschrittener Erkrankung erhoben wurden, ergaben, dass die DCA-Therapie in 60-70 % der Fälle einen messbaren Nutzen brachte. Das Neuropathierisiko unter Einbeziehung natürlicher neuroprotektiver Wirkstoffe lag bei einer Dosierung von 20-25 mg/kg pro Tag in einem Zyklus von 2 Wochen an/1 Woche aus. Eine reversible Erhöhung der Leberenzyme wurde in dieser Patientengruppe bei etwa 2 % festgestellt (klinische Beobachtungsdaten, online veröffentlicht unter www.medicorcancer.com).
Es wird ein Patientenfall vorgestellt, der die zytostatischen Wirkungen einer über mehrere Jahre fortgesetzten oralen DCA-Behandlung veranschaulicht. Dieser Patient hatte eine schlechte Prognose (medianes Überleben von 9-12 Monaten bei Darmkrebs im Stadium 4 unter Anwendung einer aggressiven konventionellen palliativen Chemotherapie)[38]. Der Patient wurde von Khan in Zusammenarbeit mit dem Naturheilkundler Andrews behandelt, der ein Protokoll mit natürlichen neuroprotektiven Wirkstoffen entwickelte.
FALLBERICHT
Eine 57-jährige Frau suchte im März 2012 die Klinik des Autors (Khan) auf, um sich wegen eines metastasierten Kolorektalkarzinoms behandeln zu lassen. Bei der Patientin wurde Mitte 2010 ursprünglich ein Rektumkarzinom diagnostiziert, als sie ihren Arzt wegen erneuter Verstopfung und Schmerzen im unteren Rückenbereich konsultierte. Es wurde eine Koloskopie versucht, aber das Koloskop konnte nicht vorgeschoben werden, da ein teilweise blockierender Rektumtumor vorhanden war. Die Biopsie bestätigte ein mäßig differenziertes kolorektales Adenokarzinom.
Die Computertomographie (CT) zeigte damals eine Erkrankung im Stadium 4 mit mehreren Lebermetastasen von bis zu 3 cm Durchmesser, möglicherweise winzigen Lungenmetastasen und einem ringförmigen Rektumkarzinom, das nicht leicht zu messen war (die Ränder des Krebses waren auf der CT-Aufnahme nur schwer von den umliegenden Geweben zu unterscheiden).
Der Patient unterzog sich einer Ileostomie, um die Obstruktion zu umgehen, und der Rektumtumor wurde nicht entfernt. Auf die Operation folgte eine Chemotherapie, bestehend aus 5-Fluorouracil, Irinotecan, Leucovorin und Bevacizumab (FOLFIRI + Bevacizumab). Zunächst sprach der Patient auf die Chemotherapie mit einer Verringerung der Lebermetastasen, einer Verkleinerung der primären rektalen Läsion und einer Verringerung des Markers für carcinoembryonales Antigen (CEA) im Blut von 260,9 ng/ml vor der Chemotherapie auf 3,5 ng/ml unmittelbar vor Beginn der DCA-Therapie an. Danach begann das Ansprechen auf die Chemotherapie zu stagnieren. Als sich die Patientin in der Klinik des Autors vorstellte, hatte die Chemotherapie nur noch einen minimalen Krankheitsrückgang bewirkt und war im Wesentlichen nur noch stabilisierend.
Die Patientin war zuvor gesund gewesen und hatte 20 Jahre lang geraucht. Gelegentlich konsumierte sie Alkohol. In der Familie gab es eine positive Anamnese von Darmkrebs und Magenkrebs. Zu den Medikamenten gehörten die laufende Chemotherapie wie beschrieben, Wasserstoffperoxid-Einläufe, orales Vitamin C, gelegentliches orales Vitamin D, Hydromorphon mit Langzeitwirkung in einer Dosierung von 32 mg zweimal täglich und Hydromorphon mit Kurzzeitwirkung in einer Dosierung von 2-4 mg oral nach Bedarf bei Durchbruchschmerzen. Es traten keine Allergien auf.
Die funktionelle Untersuchung ergab einige leichte wunde Stellen im Mund, die mit der laufenden Chemotherapie zusammenhingen, leichten Durchfall (der bei einer Ileostomie zu erwarten war) und leichte intermittierende rektale Blutungen. Es gab schmerzende/brennende Schmerzen im unteren Rücken und im Sakralbereich mit einer Intensität von bis zu 6 von 10 und leichte Schmerzen in der rechten Schulterspitze, die sich durch die Chemotherapie verschlimmerten (es wurde vermutet, dass es sich um Schmerzen im Zusammenhang mit den Lebermetastasen handelte).
Da die Chemotherapie nach wie vor wirksam war und die Patientin keine schwerwiegenden Nebenwirkungen aufwies, bestand der erste Ansatz darin, die bestehende Therapie der Patientin zu unterstützen, nicht zu ersetzen. In Zusammenarbeit mit einem Arzt für Naturheilkunde (Andrews) wurde ein integrativer Plan erstellt.
Der Plan umfasste die zusätzliche Gabe von hochdosiertem oralen Vitamin D in Höhe von 10 000 internationalen Einheiten pro Tag, die Umstellung von oralem Vitamin C auf Vitamin C 50 g intravenös (i.v.) wöchentlich und die zusätzliche Gabe von Dichloracetat-Natrium (DCA) 3000 mg i.v. (49 mg/kg) wöchentlich (Hersteller: Tokyo Chemical Industry, Vereinigte Staaten). Um das Risiko von DCA-Nebenwirkungen zu verringern, wurden 3 natürliche Ergänzungsmittel verschrieben: Alpha-Liponsäure (racemisch) 500 mg i.v. mit jeder DCA-Dosis, orale R-Alpha-Liponsäure 150 mg dreimal täglich, orales Acetyl-L-Carnitin 500 mg dreimal täglich und orales Benfotiamin 80 mg zweimal täglich.
Die Infusionen wurden in der Nähe der Chemotherapie-Infusionen geplant (mit einem Abstand von mindestens 2 Tagen zur Chemotherapie), um mögliche Interferenzen oder Wechselwirkungen mit anderen Medikamenten zu vermeiden. Liponsäure wurde nicht an Chemotherapietagen oder innerhalb von 1 Tag vor oder nach der Chemotherapie verabreicht, da sie ein starkes Antioxidans ist und die Wirksamkeit der Chemotherapie verringern könnte. Die integrative Therapie begann im März 2012. Es wurden keine Nebenwirkungen festgestellt, so dass die DCA-Gabe auf 4000 mg i.v. (66 mg/kg) wöchentlich erhöht wurde. Die einzige Nebenwirkung, die bei der höheren DCA-Dosis festgestellt wurde, war eine leichte Sedierung nach der Injektion.
Tabelle 1 Blutbild vor Beginn der Dichloracetat-Natrium-Therapie
| Bluttest | Wert | Einheiten | Normaler Bereich |
|---|---|---|---|
| Hämoglobin | 131 | g/L | 115-155 |
| Anzahl der weißen Blutkörperchen | 6.5 | ×109/L | 4.0-11.0 |
| Blutplättchen | 202 | ×109/L | 145-400 |
| Blutzucker | 5.9 | mmol/L | 2.6-7.0 |
| Harnstoff | 6.5 | mmol/L | 2.5-8.1 |
| Kreatinin | 64 | μmol/L | 50-100 |
| Kalzium | 2.38 | mmol/L | 2.20-2.65 |
| Albumin | 43 | g/L | 35-52 |
| Bilirubin | 15 | μmol/L | < 23 |
| Natrium | 140 | mmol/L | 136-146 |
| Kalium | 4.2 | mmol/L | 3.7-5.4 |
| Chlorid | 102 | mmol/L | 95-108 |
| Alkalische Phosphatase | 1861 | U/L | 35-122 |
| LDH | 167 | U/L | 110-215 |
| GGT | 3641 | U/L | < 36 |
| AST | 331 | U/L | < 31 |
| ALT | 31 | U/L | < 36 |
Um den Krebs für die Chemotherapie zu sensibilisieren, wurde oral verabreichtes Metformin verabreicht, und zwar zunächst 500 mg einmal täglich, dann bis zu 500 mg dreimal täglich[39]. Pregabalin wurde zusätzlich verabreicht, um die neuropathischen sakralen Schmerzen zu lindern (50 mg täglich zu Beginn, titriert bis zu 50 mg dreimal täglich). Zu den Nebenwirkungen der Chemotherapie gehörten Übelkeit und Erbrechen (vor Beginn der Behandlung mit Metformin), und Metformin wurde an Tagen, an denen sich der Patient unwohl fühlte, nicht eingenommen, um eine potenzielle Toxizität zu vermeiden, falls der Patient dehydriert werden sollte.
Zu Beginn der Behandlung wurden routinemäßige Bluttests durchgeführt, darunter ein vollständiges Zellbild, ein Standard-Stoffwechselpanel, Leberenzyme und Bilirubin (Tabelle 1). Eine CT-Untersuchung lag vor, die 2 Monate vor Beginn der integrativen Therapie mit DCA durchgeführt worden war.
Nach 4 Monaten integrativer Therapie, wie beschrieben, wurde eine neue CT-Untersuchung durchgeführt (Abbildung 1), die als „stabil und unverändert“ bezeichnet wurde, wobei jedoch keine Messwerte angegeben wurden. Als Zufallsbefund wurde ein Gallenstein festgestellt (ebenfalls stabil gegenüber dem vorherigen Scan). Die Patientin war frustriert, weil keine Verbesserung festgestellt wurde und im CT-Bericht keine detaillierten Messungen angegeben waren. Es wurde versucht, eine Positronen-Emissions-Tomographie durchzuführen, um zu klären, ob es sich um einen lebenden oder einen nekrotischen Tumor handelte, aber eine staatliche Finanzierung war nicht möglich, und der Patient lehnte es ab, die Kosten für die Untersuchung privat zu tragen.
Nach einigen Diskussionen entschied sich die Patientin, die Therapie fortzusetzen und künftige CT-Untersuchungen in einem anderen Krankenhaus durchführen zu lassen. Im September 2012 wurden zunehmend Nebenwirkungen der Chemotherapie wie Müdigkeit, Übelkeit und Erbrechen festgestellt. Eine neue CT-Untersuchung ergab, dass alle Leberläsionen entweder kleiner oder nicht mehr erkennbar waren. Die größte Tumorverkleinerung betrug jedoch nur 2 mm (die 2,5 cm große Markerläsion im Lebersegment 4a verringerte sich auf 2,3 cm). Es wurden keine neuen Läsionen festgestellt.
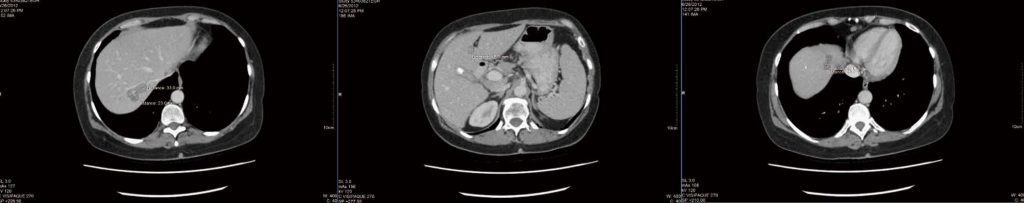
Lebermetastase.
Tabelle 2 Blutbild während der Dichloracetat-Natrium-Therapie, Januar 2013
| Bluttest | Wert | Einheiten | Normaler Bereich |
|---|---|---|---|
| Hämoglobin | 134 | g/L | 115-155 |
| Anzahl der weißen Blutkörperchen | 5.1 | ×109/L | 4.0-11.0 |
| Blutplättchen | 1421 | ×109/L | 145-400 |
| Glukose | 5.5 | mmol/L | 2.6-7.0 |
| Harnstoff | 4.1 | mmol/L | 2.5-8.1 |
| Kreatinin | 57 | μmol/L | 50-100 |
| Kalzium | 2.24 | mmol/L | 2.20-2.65 |
| Albumin | 39 | g/L | 35-52 |
| Bilirubin | 11 | μmol/L | < 23 |
| Natrium | 140 | mmol/L | 136-146 |
| Kalium | 4.2 | mmol/L | 3.7-5.4 |
| Chlorid | 106 | mmol/L | 95-108 |
| Alkalische Phosphatase | 2671 | U/L | 35-122 |
| LDH | 183 | U/L | 110-215 |
| GGT | 8371 | U/L | < 36 |
| AST | 1041 | U/L | < 31 |
| ALT | 100 | U/L | < 36 |
Nach Überprüfung des CT-Scans beschloss die Patientin, die gesamte Chemotherapie sowie Bevacizumab und Metformin abzusetzen. DCA i.v. wurde fortgesetzt, und die Dosis wurde auf 4500 mg i.v. wöchentlich erhöht. Übelkeit und Erbrechen verschwanden. Die Schmerzen blieben unter Kontrolle.
Nach 3 Monaten wurde eine neue CT-Untersuchung durchgeführt, die einen rektalen Resttumor mit Striktur und proximaler fäkaler Belastung (unverändert) sowie „Lebermetastasen, nicht signifikant verändert“ zeigte. Der Patient berichtete über ein leichtes Taubheitsgefühl in den Fingern und Zehen. Es kam zu einem weiteren Anstieg der asymptomatischen Leberenzymerhöhungen (Tabelle 2). Beides wurde als DCA-Nebenwirkung diagnostiziert. Während der bisherigen Therapie hatte der CEA-Wert leichte Schwankungen gezeigt, wurde aber insgesamt als stabil angesehen (Abbildung 2).
Die DCA-Therapie wurde für 3 Monate unterbrochen, um ein Abklingen der DCA-Nebenwirkungen zu ermöglichen.
Während dieser Zeit wurden nur natürliche Therapien verabreicht (von Andrews verschrieben). Acetyl-L-Carnitin, Benfotiamin und Alpha-Liponsäure wurden fortgesetzt, um die Erholung der DCA-Neuropathie zu beschleunigen. Curcumin[40] und Honokiol (Magnolienbaumextrakt) wurden zusätzlich eingenommen, um die Krebskontrolle aufrechtzuerhalten[41]. Während des Zeitraums, in dem DCA abgesetzt wurde, stieg der CEA-Wert von 4,1 auf 5,1 ng/ml (Abbildung 2). Die leichte DCA-Neuropathie war verschwunden und die Leberenzyme begannen sich zu verbessern.
Im März 2013 wurde aufgrund von Bedenken wegen der Kosten für die Infusionstherapie beschlossen, mit einer oralen DCA-Therapie zu beginnen. Eine neue Basis-CT-Untersuchung zeigte eine Vergrößerung einer Markerläsion im Lebersegment 7 um 1 mm und eine Vergrößerung eines aortokavalen Lymphknotens um 1 mm, wurde aber als „stabiles Erscheinungsbild des Dickdarms“ und „stabile Lebermetastasen“ bezeichnet.
DCA wurde in einer Dosis von 500 mg (8,2 mg/kg) zweimal täglich oral verabreicht, und die neuroprotektiven Ergänzungsmittel, bestehend aus oralem Acetyl-L-Carnitin, Benfotiamin und R-Alpha-Liponsäure, wurden fortgesetzt. Die Ergänzungspräparate wurden kontinuierlich verabreicht, und DCA wurde in einem Zyklus von 2 Wochen (an) und 1 Woche (aus) verabreicht.
Im Dezember 2013 wurde die Schmerzmedikation aus Gründen der Einfachheit, der besseren Schmerzkontrolle und der Kosteneinsparung von Hydromorphon auf Methadon 10 mg dreimal täglich umgestellt.
Der Patient setzte diese Behandlung mit regelmäßigen CT-Scans alle 3 bis 6 Monate fort. Aufgrund ihres vollen Terminkalenders nahm die Patientin die regelmäßigen Blutuntersuchungen nicht mehr so gewissenhaft wahr. Sie blieb hochgradig funktionstüchtig (ECOG-Stufe 1) mit einer leichten chronischen DCA-Neuropathie, die unter Kontrolle war und ihre Alltagsfunktionen nicht beeinträchtigte.
Es wurde versucht, die DCA-Dosis auf dreimal täglich 500 mg zu erhöhen, doch dies führte zu einer signifikanten asymptomatischen Erhöhung der Leberenzyme und einer Zunahme der Neuropathie. Daraufhin wurde nach einer kurzen Unterbrechung der Therapie eine DCA-Dosis von 500 mg zweimal täglich wieder aufgenommen.
Die fortlaufenden CT-Scans zeigten weiterhin eine stabile Erkrankung (Abbildung 3), und es traten keine neuen Läsionen auf. Der Gesamt-CEA-Wert hatte sich seit Beginn der DCA-Therapie nicht signifikant verändert (CEA von 3,5 zu Beginn der DCA-Therapie zu CEA von 3,7 nach fast vier Jahren Therapie). Das allgemeine Blutbild war auch an der 3-Jahres-Marke (Tabelle 3) und nach der 4-Jahres-Marke (Tabelle 4) günstig.
Zusammenfassend lässt sich sagen, dass der Patient nach einer konventionellen Chemotherapie von ca. 18 Monaten eine intravenöse DCA-Therapie mit gleichzeitiger Chemotherapie von ca. 6 Monaten erhielt, gefolgt von einer intravenösen und oralen DCA-Therapie ohne gleichzeitige konventionelle Krebstherapie für fast 4 Jahre. Während der Behandlung mit oralem DCA war die Krankheit der Patientin nach CT-Scans und nach der Messung des CEA-Tumormarkers stabil. Sie war auch klinisch stabil, d. h. die Methadondosis wurde nicht erhöht, die ECOG-Stufe 1 wurde beibehalten, die leichte DCA-Neuropathie blieb stabil, und sie konnte ihr eigenes Geschäft erfolgreich führen.
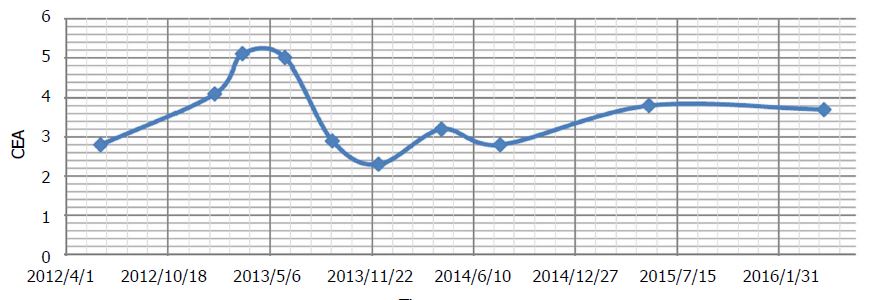
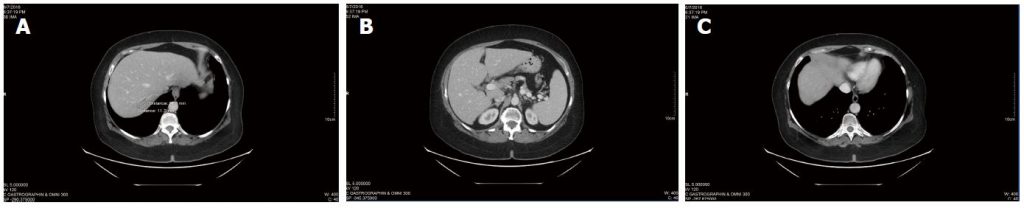
Tabelle 3 Blutbild während der Dichloracetat-Natrium-Therapie, Mai 2015
| Bluttest | Wert | Einheiten | Normaler Bereich |
|---|---|---|---|
| Hämoglobin | 134 | g/L | 115-155 |
| Anzahl der weißen Blutkörperchen | 7.7 | ×109/L | 4.0-11.0 |
| Blutplättchen | 173 | ×109/L | 145-400 |
| Glukose | 5.3 | mmol/L | 2.6-7.0 |
| Harnstoff | 5.1 | mmol/L | 2.5-8.1 |
| Kreatinin | 70 | μmol/L | 50-100 |
| Kalzium | 2.37 | mmol/L | 2.20-2.65 |
| Albumin | – | g/L | 35-52 |
| Bilirubin | 8 | μmol/L | < 23 |
| Natrium | 144 | mmol/L | 136-146 |
| Kalium | 4.1 | mmol/L | 3.7-5.4 |
| Chlorid | 104 | mmol/L | 95-108 |
| Alkalische Phosphatase | – | U/L | 35-122 |
| LDH | 174 | U/L | 110-215 |
| GGT | 1561 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 25 | U/L | < 36 |
Tabelle 4 Blutbild während der Dichloracetat-Natrium-Therapie, April 2016
| Bluttest | Wert | Einheiten | Normaler Bereich |
|---|---|---|---|
| Hämoglobin | 133 | g/L | 115-155 |
| Anzahl der weißen Blutkörperchen | 5.2 | ×109/L | 4.0-11.0 |
| Blutplättchen | 155 | ×109/L | 145-400 |
| Glukose | – | mmol/L | 2.6-7.0 |
| Harnstoff | 4.9 | mmol/L | 2.5-8.1 |
| Kreatinin | – | μmol/L | 50-100 |
| Kalzium | 2.39 | mmol/L | 2.20-2.65 |
| Albumin | 42 | g/L | 35-52 |
| Bilirubin | 9 | μmol/L | < 23 |
| Natrium | 142 | mmol/L | 136-146 |
| Kalium | 4 | mmol/L | 3.7-5.4 |
| Chlorid | 102 | mmol/L | 95-108 |
| Alkalische Phosphatase | 101 | U/L | 35-122 |
| LDH | 156 | U/L | 110-215 |
| GGT | 1491 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 28 | U/L | < 36 |
DISKUSSION
Dieser Fall einer DCA-Therapie bei einem Patienten mit Dickdarmkrebs im fortgeschrittenen Stadium 4 zeigt eine langfristig stabile Erkrankung nach klinischen, biochemischen und radiologischen Kriterien.
Die Dauer der Stabilität während der Behandlung mit DCA ohne andere aktive Chemotherapie beträgt derzeit 46 Monate (fast 4 Jahre), mit einer Überlebenszeit seit der Erstdiagnose von Darmkrebs im Stadium 4 von 6 Jahren.
Auf der Grundlage der SEER-Krebsstatistik des National Cancer Institute (1975-2011) betrug die relative 5-Jahres-Überlebensrate für Frauen, bei denen Dickdarm-/Enddarmkrebs im Stadium IV diagnostiziert wurde, 14,4 % (http://seer.cancer.gov/csr/1975_2013/). Es kann zwar nicht endgültig festgestellt werden, dass DCA wirksam ist, aber ein Überleben über diesen Zeitraum ohne laufende Chemotherapie wäre relativ unwahrscheinlich.
Es wurde über zytostatische und nicht zytotoxische Wirkungen von DCA auf kolorektale und andere Krebszellen berichtet, die diesen klinischen Befund unterstützen[23,27,42-44]. Bis heute geht es der Patientin klinisch gut, und sie wird weiterhin mit DCA behandelt.
Neben der Aufrechterhaltung einer stabilen Erkrankung zeigt dieser Fall die Verträglichkeit von oralem DCA bei einer Krebspatientin über einen viel längeren Zeitraum als in den bisher veröffentlichten klinischen Studien bei Krebspatienten berichtet. Chu et al.[11] berichteten über 24 Patienten, die im Median 2 Monate lang entweder mit 6,25 oder 12,5 mg/kg BID behandelt wurden, und zwar mit kontinuierlichem oralem DCA ohne neuroprotektive Zusätze.
Sie kamen zu dem Schluss, dass die empfohlene Phase-2-Dosis 6,25 mg/kg BID (12,5 mg/kg pro Tag) beträgt, wobei eine sorgfältige Überwachung der Neuropathie erforderlich ist. Dunbar et al.[9] empfahlen 5 mg/kg BID als Anfangsdosis für die meisten Patienten, wobei in ihrer Studie 4, 8 oder 12,5 mg/kg BID kontinuierlich verabreicht wurden (mittlere Einnahmedauer von DCA 34 Tage), ebenfalls ohne neuroprotektive Zusätze.
Der Patient in diesem Bericht nahm 500 mg BID, was 8,2 mg/kg BID entspricht, 2 Wochen lang ein und 1 Woche aus, konnte diese Dosis jedoch nicht dreimal täglich vertragen (insgesamt 25 mg/kg pro Tag). Dunbar et al.[9] schlagen vor, dass eine Genotypisierung auf Polymorphismen in GSTZ1, dem DCA-metabolisierenden Enzym in der Leber, das bei fortgesetztem DCA-Konsum inaktiviert wird[45], bei der Festlegung der Anfangsdosis für Patienten in Betracht gezogen werden sollte.
Es sind jedoch weitere Arbeiten erforderlich, um eine überzeugende Anzahl von Genotypen und Daten zur Dosisverträglichkeit zu sammeln. Derzeit läuft eine klinische Studie mit DCA bei Patienten mit multiplem Myelom, die zu diesem Datenpool beitragen soll (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr.org.au).
Weitere Studien sind erforderlich, um das optimale Dosierungsschema für eine maximal verträgliche akute oder chronische Behandlung mit DCA zu ermitteln, und um festzustellen, welche Dosis für die Wirksamkeit erforderlich ist.
Der vorgestellte Fall zeigt, dass DCA als Krebstherapie sehr vielversprechend ist. Die Patientin erzielte einen signifikanten Nutzen aus ihrer Therapie, mit geringen Nebenwirkungen und ohne hämatologische, kardiale, pulmonale oder renale Toxizität. Es wurde eine gewisse hepatische Toxizität beobachtet (Tabelle 2), die durch eine Unterbrechung der DCA-Therapie und anschließende Dosisanpassung leicht in den Griff zu bekommen war.
Es wurde über eine leichte reversible periphere Neurotoxizität berichtet. Natürliche Therapien, die mit DCA kombiniert wurden (Acetyl-L-Carnitin, Alpha-Liponsäure und Benfotiamin), halfen dem Patienten bei der Verringerung der Nebenwirkungen, sind aber nicht als Krebstherapien bekannt.
Zum jetzigen Zeitpunkt gibt es keine aktiven klinischen Studien, die die Verwendung von DCA als Zytostatikum beim Menschen untersuchen. Da DCA nicht mehr unter Patentschutz steht, ist die Beschaffung angemessener Mittel zur Unterstützung groß angelegter Versuche am Menschen eine große Herausforderung. Es ist zu hoffen, dass dieser Fall, der die Vorteile von oralem DCA veranschaulicht, zu weiteren klinischen Untersuchungen anregt.
Auf der Grundlage unserer klinischen Erfahrung in Verbindung mit bestehenden Veröffentlichungen ist die Off-Label-Therapie mit DCA eine Option für Patienten, denen nur begrenzte konventionelle Behandlungsmöglichkeiten zur Verfügung stehen, sofern sie die Risiken und Vorteile der Therapie verstehen und akzeptieren.
Dieser Fallbericht zeigt, dass DCA selbst in fortgeschrittenen Krankheitsstadien das Potenzial hat, das Leben zu verlängern, ohne die Lebensqualität des Patienten zu beeinträchtigen, im Gegensatz zur Chemotherapie mit ihren häufigen schwächenden Nebenwirkungen oder Beeinträchtigungen der physiologischen Funktionen. Angesichts der angemessenen Kosten und der geringen Toxizität verdient DCA weitere Untersuchungen.
DANKSAGUNGEN
Die Autoren danken Dr. Humaira Khan für ihre Hilfe und der Patientin für ihre Unterstützung und ihr Einverständnis, ihren Fall zu veröffentlichen.
KOMMENTARE
Merkmale des Falls
Die 57 Jahre alte Patientin stellte sich mit Verstopfung und Schmerzen im unteren Rückenbereich vor.
Klinische Diagnose
Bei der Patientin wurde ein teilweise obstruktives Rektumkarzinom diagnostiziert.
Labordiagnose
Erhöhter Tumormarker Carcinoembryonales Antigen.
Bildgebende Diagnose
Rektale Masse bei der Koloskopie des Dickdarms.
Pathologische Diagnose
Mäßig differenziertes kolorektales Adenokarzinom.
Behandlung
Ileostomie, gefolgt von einer Chemotherapie bestehend aus 5-Fluorouracil, Irinotecan, Leucovorin und Bevacizumab, dann Zusatz von Dichloracetat-Natrium (DCA), dann DCA ohne Chemo für fast 4 Jahre.
Ähnliche Berichte
Berichte über Computertomografien zeigen einen Rückgang des Krebses mit kombinierter Chemotherapie + DCA, dann eine stabile Erkrankung für fast 4 Jahre mit DCA und ohne Chemo.
Begriffserklärung
DCA: Dichloroacetat-Natrium; RECIST: Response evaluation criteria for solid tumours; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Erfahrungen und Lehren
DCA ist nicht nur ein pro-apoptotischer Wirkstoff, sondern kann auch als Zytostatikum wirken und so eine langfristige Stabilisierung von fortgeschrittenem Krebs ohne schwerwiegende Nebenwirkungen erreichen, wie dieser Fall von Rektumkarzinom zeigt.
Peer-Review
DCA, das Natriumsalz von Dichloracetat, ist eine billige chemische Verbindung, die ein deutliches Potenzial als alternative Krebstherapie gezeigt hat und in einer Reihe von Studien bei Menschen mit Hirntumoren (Glioblastomen) eingesetzt wurde. Dies ist ein gut geschriebener Fallbericht, in dem die orale DCA-Therapie zu einer Tumorstabilisierung von Dickdarmkrebs im vierten Stadium bei einer 57-jährigen Frau über einen Zeitraum von mehr als drei Jahren führte, ohne dass es zu ernsthaften Toxizitäten kam. Dieser Bericht hält, was er verspricht.
Die Autoren leisten eine solide Arbeit, indem sie die Grundlagen der DCA-Therapie und ihre Rolle bei verschiedenen Tumorarten erläutern. Zusammen mit dem Zusatz von Wirkmechanismen gegen Krebszellen und dem therapeutischen Potenzial von DCA bieten die Autoren eine gute Ressource für Leser, die mit der DCA-Therapie nicht so vertraut sind, aber auch Details liefern.
REFERENZEN
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. Eine Mitochondrien-K+-Kanal-Achse ist bei Krebs unterdrückt und ihre Normalisierung fördert die Apoptose und hemmt das Krebswachstum. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/j.ccr.2006.10.020]2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Bewertung der Langzeitbehandlung von Kindern mit kongenitaler Laktatazidose mit Dichloracetat. Pädiatrie 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/peds.2007-2062
4
Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Therapeutisches Potenzial von Dichloracetat bei Pyruvatdehydrogenase-Komplex-Mangel. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Dichloracetat verursacht toxische Neuropathie bei MELAS: eine randomisierte, kontrollierte klinische Studie. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Metabolische Modulation von Glioblastomen mit Dichloracetat. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Phase-1-Studie von Dichloracetat (DCA) bei Erwachsenen mit rezidivierenden bösartigen Hirntumoren. Invest New Drugs 2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Dichloracetat sollte bei fortgeschrittenem nicht-kleinzelligem Lungenkrebs in Verbindung mit einer platinbasierten Chemotherapie bei hypoxischen Tumoren und nicht als Einzelwirkstoff in Betracht gezogen werden. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/ s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Eine offene, einarmige Phase-I-Dosis-Eskalationsstudie von Dichloracetat (DCA) bei Patienten mit fortgeschrittenen soliden Tumoren. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichloracetat induziert Apoptose und Zellzyklus-Stillstand in kolorektalen Krebszellen. Br J Cancer 2010; 102: 1746-1752 [PMID: 20485289 DOI: 10.1038/sj.bjc.6605701]
13 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Dichloracetat (DCA) sensibilisiert sowohl Wildtyp- als auch überexprimierende Bcl-2-Prostatakrebszellen in vitro für Strahlung. Prostate 2008; 68: 1223-1231 [PMID: 18465755 DOI: 10.1002/pros.20788]
14 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Dichloracetat induziert Apoptose von epithelialen Eierstockkrebszellen durch einen Mechanismus, der die Modulation von oxidativem Stress einschließt. Reprod Sci 2011; 18: 1253-1261 [PMID: 21701041 DOI: 10.1177/1 933719111411731]
15 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Dichloroacetate inhibits neuroblastoma growth by specifically acting against malignant undifferentiated cells. Int J Cancer 2012; 130: 1484-1493 [PMID: 21557214 DOI: 10.1002/ijc.26173]
16 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines. Clin Transl Oncol 2011; 13: 43-49 [PMID: 21239354 DOI: 10.1007/s12094-011-0615-z]
17 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Nekrose des Zervixkarzinoms durch Dichloracetat, das aus elektrogesponnenen Polylactidmatten freigesetzt wird. Biomaterials 2012; 33: 4362-4369 [PMID: 22425553 DOI: 10.1016/j.biomaterials.2012.02.062]
18 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 2008; 109: 394-402 [PMID: 18423823 DOI: 10.1016/j.ygyno.2008.01.038]
19 Ishiguro T, Ishiguro R, Ishiguro M, Iwai S. Die gleichzeitige Behandlung von Dichloracetat, Omeprazol und Tamoxifen zeigte eine synergistische antiproliferative Wirkung auf bösartige Tumore: in vivo Experimente und ein Fallbericht. Hepatogastroenterology 2012; 59: 994-996 [PMID: 22580646 DOI: 10.5754/hge10507]
20 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. Der Einfluss von Natriumdichloracetat auf die oxidativen Prozesse im Sarkom 37. Exp Oncol 2011; 33: 216-221 [PMID: 22217710]
21 Kumar A, Kant S, Singh SM. Neue molekulare Mechanismen der antitumoralen Wirkung von Dichloracetat gegen T-Zell-Lymphome: Implication of altered glucose metabolism, pH homeostasis and cell survival regulation. Chem Biol Interact 2012; 199: 29-37 [PMID: 22705712 DOI: 10.1016/j.cbi.2012.06.005]
22 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Mitochondriale Aktivierung durch Hemmung von PDKII unterdrückt HIF1a-Signalisierung und Angiogenese bei Krebs. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
23 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Natriumdichloracetat (DCA) reduziert die Apoptose bei Hypoxie in kolorektalen Tumoren. Cancer Lett 2010; 297: 75-83 [PMID: 20537792 DOI: 10.1016/j.canlet.2010.04.027]
24 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
25 Kankotia S, Stacpoole PW. Dichloracetat und Krebs: neue Heimat für ein Orphan Drug? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
26 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
27 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Natriumdichloracetat greift selektiv Zellen mit Defekten im mitochondrialen ETC an. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
28 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Targeting von zwei Aspekten des Stoffwechsels in der Brustkrebsbehandlung. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
29 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy- induced peripheral neuropathy: a short review. CNS Drugs 2007; 21 Suppl 1: 39-43; Diskussion 45-46 [PMID: 17696592]
30 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxel- and cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
31 Evans JD, Jacobs TF, Evans EW. Die Rolle von Acetyl-L-Carnitin bei der Behandlung der diabetischen peripheren Neuropathie. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
32 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alpha-Liponsäure für symptomatische periphere Neuropathie bei Patienten mit Diabetes: eine Meta-Analyse randomisierter kontrollierter Studien. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
33 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. Heilende Wirkung von Alpha-Liponsäure auf periphere Neuropathie bei Typ-2-Diabetes: eine klinische Studie. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
34 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Behandlung der symptomatischen diabetischen peripheren Neuropathie mit dem Antioxidans Alpha-Liponsäure. Eine 3-wöchige multizentrische randomisierte kontrollierte Studie (ALADIN-Studie). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
35 Winkler G, Kempler P. Pathomechanismus der diabetischen Neuropathie: Hintergrund der pathogeneseorientierten Therapie. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
36 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamin B zur Behandlung der peripheren Neuropathie. Cochrane Datenbank Syst Rev 2008: CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573.pub3]
37 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosage regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [ID: 10219465 DOI: 10.1055/s-0031-1300405]
38 Loupakis F, Cremolini C, Masi G, Lonardi S, Zagonel V, Salvatore L, Cortesi E, Tomasello G, Ronzoni M, Spadi R, Zaniboni A, Tonini G, Buonadonna A, Amoroso D, Chiara S, Carlomagno C, Boni C, Allegrini G, Boni L, Falcone A. Initialtherapie mit FOLFOXIRI und Bevacizumab bei metastasiertem kolorektalem Karzinom. N Engl J Med 2014; 371: 1609-1618 [PMID: 25337750 DOI: 10.1056/ NEJMoa1403108]
39 Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. Metformin zielt selektiv auf Krebsstammzellen und wirkt zusammen mit Chemotherapie, um das Tumorwachstum zu blockieren und die Remission zu verlängern. Cancer Res 2009; 69: 7507-7511 [PMID: 19752085 DOI: 10.1158/0008-5472.can-09-2994]
40 Cao A, Li Q, Yin P, Dong Y, Shi H, Wang L, Ji G, Xie J, Wu D. Curcumin induziert Apoptose in menschlichen Magenkarzinom-AGS-Zellen und Kolonkarzinom-HT-29-Zellen durch mitochondriale Dysfunktion und endoplasmatischen Retikulumstress. Apoptosis 2013; 18: 1391-1402 [PMID: 23881281 DOI: 10.1007/s10495-013-0871-1]
41 Wynn ML, Consul N, Merajver SD, Schnell S. Inferring the Effects of Honokiol on the Notch Signaling Pathway in SW480 Colon Cancer Cells. Cancer Inform 2014; 13: 1-12 [PMID: 25392689 DOI: 10.4137/CIN.S14060]
42 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Dichloracetat beeinflusst die Proliferation, aber nicht das Überleben von menschlichen Darmkrebszellen. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
43 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Die Umkehrung des glykolytischen Phänotyps durch Dichloracetat hemmt das Wachstum metastasierender Brustkrebszellen in vitro und in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/s10549-009-0435-9]
44 Sánchez-Aragó M, Chamorro M, Cuezva JM. Die Selektion von Krebszellen mit unterdrückten Mitochondrien löst das Fortschreiten von Dickdarmkrebs aus. Carcinogenesis 2010; 31: 567-576 [PMID: 20080835 DOI: 10.1093/ carcin/bgq012]
45 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismus und speziesabhängige Inaktivierung der Glutathiontransferase zeta durch Dichloracetat. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]
Verwandter Inhalt: