Akbar Khan, Doug Andrews, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Canada
Anneke C Blackburn, John Curtin School of Medical Research, Australian National University, Canberra, ACT 2601, Australia
Contributi degli autori: Khan A ha curato il paziente e ha scritto la maggior parte della relazione sul caso; Andrews D ha curato il paziente, ha progettato i protocolli di terapia naturale e ha co-scritto la relazione sul caso; Blackburn AC ha eseguito lavori in vitro e in vivo che dimostrano gli effetti del DCA come agente citostatico e ha scritto le parti della relazione sul caso che riguardano la ricerca sul DCA in vitro e in vivo.
Dichiarazione dell’Institutional Review Board: Non applicabile.
Dichiarazione di consenso informato: La paziente descritta in questo manoscritto ha dato il consenso a pubblicare il suo caso in forma anonima.
Dichiarazione di conflitto di interessi: Uno degli autori (Khan) somministra la terapia con dicloroacetato per i pazienti oncologici attraverso i centri oncologici Medicor a titolo oneroso e senza scopo di lucro. La clinica è di proprietà di un membro della famiglia di questo autore. Gli altri autori non hanno nulla da rivelare.
Accesso libero: Questo articolo è un articolo ad accesso libero che è stato selezionato da un redattore interno e sottoposto a revisione paritaria da parte di revisori esterni. È distribuito in conformità alla licenza Creative Commons Attribuzione Non Commerciale (CC BY-NC 4.0), che consente ad altri di distribuire, remixare, adattare, costruire su quest’opera in modo non commerciale e di concedere in licenza le loro opere derivate a condizioni diverse, a condizione che l’opera originale sia adeguatamente citata e che l’uso sia non commerciale. Vedi: http://creativecommons.org/licenses/by-nc/4.0/
Fonte del manoscritto: Manoscritto su invito
Corrispondenza a: Akbar Khan, MD, Direttore medico,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. [email protected]
Telefono: +1-416-2270037
Fax: +1-416-2271915
Ricevuto: 30 aprile 2016
Inizio della revisione paritaria: 3 maggio 2016
Prima decisione: 17 giugno 2016
Revisionata: 23 luglio 2016
Accettato: 6 agosto 2016
Articolo in stampa: 8 agosto 2016
Pubblicato online: 16 ottobre 2016
Abstract
Il dicloroacetato di sodio (DCA) per via orale è stato studiato come una nuova terapia metabolica per vari tipi di cancro dal 2007, sulla base dei dati di Bonnet et al, secondo cui il DCA può innescare l’apoptosi di cellule tumorali umane del polmone, della mammella e del cervello. La risposta alla terapia negli studi sull’uomo è misurata in base ai criteri standard di valutazione della risposta per i tumori solidi, che definiscono la “risposta” in base al grado di riduzione del tumore o di scomparsa del tumore all’imaging.
Tuttavia, Blackburn et al. hanno dimostrato che il DCA può anche agire come agente citostatico in vitro e in vivo, senza causare apoptosi (morte cellulare programmata). Viene presentato un caso in cui la terapia orale con DCA ha portato alla stabilizzazione del tumore al colon di stadio 4 in una donna di 57 anni per un periodo di quasi 4 anni, senza alcuna tossicità grave. Poiché la storia naturale del tumore del colon al quarto stadio consiste in una progressione costante che porta alla disabilità e alla morte, questo caso evidenzia un nuovo uso del DCA come agente citostatico con il potenziale di mantenere la stabilità a lungo termine del tumore in stadio avanzato.
Parole chiave: Dicloroacetato; cancro; colon; colon-retto; citostatico; stabilizzazione; inibizione della crescita; per via endovenosa
© L’autore/i 2016. Pubblicato da Baishideng Publishing Group Inc. Tutti i diritti riservati.
Suggerimento di base: il dicloroacetato di sodio (DCA) per via orale è stato studiato come nuova terapia metabolica per vari tipi di cancro. La risposta alla terapia negli studi sull’uomo è misurata in base ai criteri standard di valutazione della risposta per i tumori solidi, che definiscono la “risposta” in base al grado di riduzione del tumore o di scomparsa del tumore all’imaging.
Tuttavia, il DCA può anche agire come agente citostatico, senza causare apoptosi (morte cellulare programmata). Viene presentato un caso in cui la terapia orale con DCA ha portato alla stabilizzazione del tumore allo stadio 4 in una donna di 57 anni per un periodo di quasi 4 anni, senza alcuna tossicità grave.
Khan A, Andrews D, Blackburn AC. Stabilizzazione a lungo termine del tumore del colon in stadio 4 mediante terapia con dicloroacetato di sodio. World J Clin Cases 2016; 4(10): 336-343
Disponibile da: URL: http://www.wjgnet.com/2307-8960/full/v4/i10/336.htm
DOI: http://dx.doi.org/10.12998/wjcc.v4.i10.336
INTRODUZIONE
Il dicloroacetato di sodio (DCA) è stato studiato come nuova terapia metabolica per vari tipi di cancro dal 2007, quando Bonnet et al[1] hanno pubblicato uno studio combinato in vitro/in vivo sui ratti che dimostrava l’efficacia del DCA nel trattamento dei tumori umani del polmone, della mammella e del cervello attraverso l’inibizione della piruvato deidrogenasi chinasi mitocondriale. Stacpoole et al[2-4] avevano precedentemente pubblicato diversi studi che prevedevano l’uso del DCA per il trattamento dell’acidosi lattica congenita, che è composta da un insieme di malattie mitocondriali ereditarie[5].
Questi studi hanno stabilito il profilo di sicurezza del DCA orale nell’uomo. Il DCA si è rivelato un farmaco sicuro, privo di tossicità cardiaca, polmonare, renale o del midollo osseo[4]. L’effetto collaterale comune più grave è la neuropatia periferica, che è reversibile[6]. È stato segnalato delirio, reversibile dopo la sospensione del DCA[7]. In una piccola percentuale di pazienti è stato segnalato un innalzamento asintomatico e reversibile degli enzimi epatici[3].
Il precedente lavoro sull’acidosi lattica congenita ha permesso la rapida progressione dei DCA nella clinica oncologica. Attualmente sono stati pubblicati quattro rapporti di studi clinici sul cancro che utilizzano il DCA, indicando un crescente riconoscimento della potenziale utilità del DCA[8-11]. Tuttavia, questi studi, che trattano pazienti in fase avanzata, sono stati in grado di riferire sul trattamento solo per periodi di tempo relativamente brevi.
Nell’articolo iniziale del 2007 di Bonnet et al[1], è stato riportato che il DCA ha ridotto il potenziale di membrana mitocondriale con conseguente apoptosi selettiva nelle cellule tumorali. Il meccanismo identificato era l’inibizione della glicolisi aerobica (effetto Warburg) e l’attivazione dei canali ionici mitocondriali del potassio[1].
Ulteriori indagini sul DCA hanno confermato l’attività antitumorale in diversi tipi di cancro, tra cui colon[12], prostata[13], ovaie[14], neuroblastoma[15], carcinoide polmonare[16], cervicale[17], endometriale[18], colangiocarcinoma[19], sarcoma[20] e linfoma a cellule T[21].
Sono state suggerite anche altre azioni antineoplastiche del DCA. Queste includono il blocco dell’angiogenesi[22], i cambiamenti nell’espressione di HIF1-α[23], l’alterazione dei regolatori del pH V-ATPasi e MCT1 e di altri regolatori della sopravvivenza cellulare come PUMA, GLUT1, Bcl2 e p53[24].
Tuttavia, nella ricerca dell’attività citotossica, molti studi in vitro utilizzano concentrazioni di DCA che difficilmente possono essere raggiunte in ambito clinico[25]. Alcuni studi hanno utilizzato concentrazioni limitate e hanno rilevato che il DCA è citostatico piuttosto che citotossico, ma in grado di potenziare l’apoptosi con altri agenti[26-28].
Nella relazione sul successo del trattamento in vivo con DCA del cancro al seno, Sun et al[26] hanno riscontrato che il DCA è citostatico, inibendo la proliferazione senza aumentare l’apoptosi. Il DCA è stato in grado di ridurre significativamente il carico metastatico nei polmoni dei ratti in un modello in vivo di cancro al seno altamente metastatico. Ciò suggerisce un nuovo ruolo del DCA come agente stabilizzante del cancro, simile a una terapia anti-angiogenica.
Tuttavia, a conoscenza degli autori, non sono ancora stati pubblicati dati sull’uomo a sostegno dell’uso del DCA per il mantenimento a lungo termine della malattia stabile. A seguito dell’innovativa pubblicazione di Bonnet sul DCA, all’inizio del 2007 Khan ha iniziato a utilizzare il DCA in ambito clinico per il trattamento di pazienti oncologici con prognosi infausta o che non hanno risposto alle terapie oncologiche approvate.
In collaborazione con un medico naturopata (Andrews), è stato sviluppato un protocollo di farmaci naturali per affrontare la tossicità neurologica che limitava la dose. Il regime di DCA orale sviluppato comprendeva tre farmaci naturali, l’acetil L-carnitina[29-31], l’acido R-alfa lipoico[32-34] e la benfotiamina[35-37], con lo scopo primario di prevenire la neuropatia.
Dati osservazionali raccolti su oltre 300 pazienti oncologici con malattia avanzata hanno rivelato benefici misurabili dalla terapia con DCA nel 60%-70% dei casi. Il rischio di neuropatia con l’inclusione di agenti neuroprotettivi naturali è stato di circa il 20% con un dosaggio di 20-25 mg/kg al giorno con un ciclo di 2 settimane di assunzione/1 settimana di sospensione. L’innalzamento reversibile degli enzimi epatici è stato osservato in circa il 2% di questo gruppo di pazienti (dati clinici osservazionali pubblicati online su www.medicorcancer.com).
Viene presentato un caso di paziente che illustra gli effetti citostatici del trattamento orale con DCA mantenuto per diversi anni. Questo paziente aveva una prognosi sfavorevole (sopravvivenza mediana di 9-12 mo per un tumore colorettale di stadio 4 con chemioterapia palliativa convenzionale aggressiva)[38]. Il paziente è stato trattato da Khan in collaborazione con il medico naturopata Andrews, che ha sviluppato un protocollo comprendente agenti neuroprotettivi naturali.
RELAZIONE SUL CASO
Una donna di 57 anni si è recata presso la clinica dell’autore (Khan) nel marzo 2012 per sottoporsi a terapia per un tumore metastatico del colon-retto. Alla paziente era stato originariamente diagnosticato un tumore del retto a metà del 2010, quando aveva consultato il suo medico per una nuova costipazione e un dolore alla schiena. È stata tentata una colonscopia, ma non è stato possibile far avanzare il colonscopio a causa della presenza di un tumore rettale parzialmente ostruente. La biopsia ha confermato un adenocarcinoma colorettale moderatamente differenziato.
La tomografia computerizzata (TC) effettuata all’epoca ha dimostrato una malattia in stadio 4 con metastasi epatiche multiple fino a 3 cm di diametro, possibili piccole metastasi polmonari e un carcinoma rettale anulare non facilmente misurabile (i margini del tumore erano difficili da distinguere dai tessuti circostanti alla TC).
Il paziente è stato sottoposto a un intervento di ileostomia ad ansa per bypassare l’ostruzione e il tumore rettale non è stato asportato. La chirurgia è stata seguita da una chemioterapia a base di 5-fluorouracile, irinotecan, leucovorin e bevacizumab (FOLFIRI + bevacizumab). Inizialmente il paziente ha risposto alla chemioterapia con una riduzione delle metastasi epatiche, una riduzione della lesione rettale primaria e una riduzione del marker dell’antigene carcinoembrionale (CEA) nel sangue da 260,9 ng/mL prima della chemio a 3,5 ng/mL poco prima dell’inizio della terapia con DCA. La risposta alla chemio ha poi iniziato a stabilizzarsi. Quando il paziente si è presentato alla clinica dell’autore, la chemioterapia stava causando una riduzione minima della malattia e stava essenzialmente mantenendo la stabilità.
La paziente era precedentemente sana e aveva una storia di 20 anni di fumo. Consumava occasionalmente alcolici. L’anamnesi familiare era positiva per cancro al colon e cancro gastrico. I farmaci comprendevano la chemioterapia in corso come descritto, clisteri di perossido di idrogeno, vitamina C per via orale, vitamina D per via orale occasionale, idromorfone a rilascio prolungato da 32 mg due volte al giorno e idromorfone a breve durata d’azione da 2 a 4 mg per via orale al bisogno per il dolore “da sfondamento”. Non sono state riscontrate allergie.
L’indagine funzionale ha rivelato alcune lievi piaghe alla bocca legate alla chemioterapia in corso, una lieve diarrea (prevista con un’ileostomia) e un lieve sanguinamento rettale intermittente. Si è riscontrato un dolore doloroso/bruciante nella parte bassa della schiena e nella zona sacrale, di intensità fino a 6 su 10, e un lieve dolore alla punta della spalla destra esacerbato dalla chemioterapia (ritenuto un dolore riferito alle metastasi epatiche).
Poiché la chemioterapia era ancora efficace e la paziente non presentava effetti collaterali gravi, l’approccio iniziale è stato quello di sostenere la terapia esistente della paziente, non di sostituirla. È stato elaborato un piano integrativo in collaborazione con un medico naturopata (Andrews).
Il piano consisteva nell’aggiunta di una dose elevata di vitamina D per via orale a 10.000 unità internazionali al giorno, nella sostituzione della vitamina C per via orale con 50 g di vitamina C per via endovenosa (i.v.) ogni settimana e nell’aggiunta di dicloroacetato di sodio (DCA) 3000 mg i.v. (49 mg/kg) ogni settimana (produttore: Tokyo Chemical Industry, Stati Uniti). Per ridurre il rischio di effetti collaterali del DCA, sono stati prescritti 3 integratori naturali: Acido alfa lipoico (racemico) 500 mg i.v. con ogni dose di DCA, acido R-alfa lipoico orale 150 mg 3 volte al giorno, acetil L-carnitina orale 500 mg 3 volte al giorno e benfotiamina orale 80 mg due volte al giorno.
Le infusioni sono state programmate intorno alle infusioni di chemioterapia (separate da almeno 2 giorni dalla chemioterapia) per evitare potenziali interferenze o interazioni farmacologiche. L’acido lipoico non è stato somministrato nei giorni di chemioterapia o entro 1 giorno prima o dopo la chemioterapia, poiché è un potente antiossidante e può ridurre l’efficacia della chemioterapia. La terapia integrativa è iniziata nel marzo 2012. Non sono stati notati effetti collaterali, quindi il DCA è stato aumentato a 4000 mg i.v. (66 mg/kg) settimanali. L’unico effetto collaterale osservato con la dose più elevata di DCA è stata una lieve sedazione post-infusione.
Tabella 1 Pannello ematico prima della terapia con dicloroacetato di sodio
| Esame del sangue | Valore | Unità | Intervallo di normalità |
|---|---|---|---|
| Emoglobina | 131 | g/L | 115-155 |
| Conta dei globuli bianchi | 6.5 | ×109/L | 4.0-11.0 |
| Piastrine | 202 | ×109/L | 145-400 |
| Glucosio | 5.9 | mmol/L | 2.6-7.0 |
| Urea | 6.5 | mmol/L | 2.5-8.1 |
| Creatinina | 64 | μmol/L | 50-100 |
| Calcio | 2.38 | mmol/L | 2.20-2.65 |
| Albumina | 43 | g/L | 35-52 |
| Bilirubina | 15 | μmol/L | < 23 |
| Sodio | 140 | mmol/L | 136-146 |
| Potassio | 4.2 | mmol/L | 3.7-5.4 |
| Cloruro | 102 | mmol/L | 95-108 |
| Fosfatasi alcalina | 1861 | U/L | 35-122 |
| LDH | 167 | U/L | 110-215 |
| GGT | 3641 | U/L | < 36 |
| AST | 331 | U/L | < 31 |
| ALT | 31 | U/L | < 36 |
La metformina orale è stata aggiunta per aiutare a sensibilizzare il cancro alla chemioterapia, iniziando con 500 mg per via orale una volta al giorno con titolazione fino a 500 mg 3 volte al giorno[39]. È stato aggiunto il pregabalin per controllare il dolore neuropatico sacrale (inizio con 50 mg al giorno, titolazione fino a 50 mg 3 volte al giorno). Gli effetti collaterali della chemioterapia comprendevano nausea e vomito (prima dell’inizio della metformina) e la metformina è stata saltata nei giorni in cui il paziente non si sentiva bene per evitare una potenziale tossicità, nel caso in cui il paziente si fosse disidratato.
Sono stati effettuati gli esami del sangue di routine, tra cui la conta cellulare completa, il pannello metabolico standard, gli enzimi epatici e la bilirubina (Tabella 1). Era disponibile una TAC basale, eseguita 2 mesi prima dell’inizio della terapia integrativa con DCA.
Dopo 4 mesi di terapia integrativa come descritto, è stata eseguita una nuova TC (Figura 1), che è stata segnalata come “stabile e invariata”, ma non sono state fornite misure. È stato rilevato un reperto incidentale di un calcolo biliare (anch’esso stabile rispetto alla scansione precedente). La paziente si è sentita frustrata per l’assenza di miglioramenti e di misurazioni dettagliate nel referto della TC. Si è cercato di ottenere una tomografia a emissione di positroni per chiarire la differenza tra tumori vivi e necrotici, ma non è stato possibile ottenere un finanziamento pubblico e il paziente ha rifiutato di pagare privatamente la TAC.
Dopo alcune discussioni, la paziente ha deciso di continuare la terapia e di sottoporsi a future TAC in un altro ospedale. A settembre 2012, sono stati riscontrati crescenti effetti collaterali della chemioterapia, tra cui affaticamento, nausea e vomito. Una nuova TC ha rivelato che tutte le lesioni epatiche erano “più piccole o non più identificate”. Tuttavia, la riduzione maggiore del tumore è stata di soli 2 mm (la lesione marcatrice di 2,5 cm nel segmento epatico 4a si è ridotta a 2,3 cm). Non sono state identificate nuove lesioni.
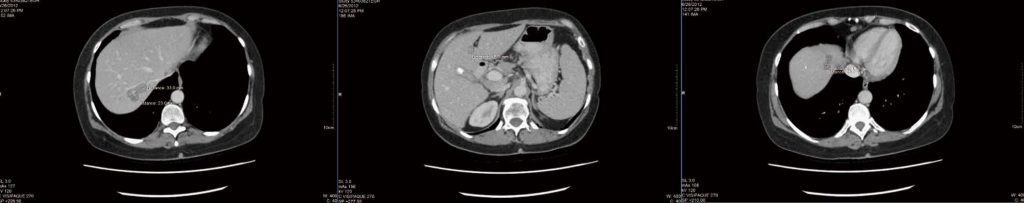
.
Tabella 2 Pannello ematico durante la terapia con sodio dicloroacetato, gennaio 2013
| Esame del sangue | Valore | Unità | Intervallo di normalità |
|---|---|---|---|
| Emoglobina | 134 | g/L | 115-155 |
| Conta dei globuli bianchi | 5.1 | ×109/L | 4.0-11.0 |
| Piastrine | 1421 | ×109/L | 145-400 |
| Glucosio | 5.5 | mmol/L | 2.6-7.0 |
| Urea | 4.1 | mmol/L | 2.5-8.1 |
| Creatinina | 57 | μmol/L | 50-100 |
| Calcio | 2.24 | mmol/L | 2.20-2.65 |
| Albumina | 39 | g/L | 35-52 |
| Bilirubina | 11 | μmol/L | < 23 |
| Sodio | 140 | mmol/L | 136-146 |
| Potassio | 4.2 | mmol/L | 3.7-5.4 |
| Cloruro | 106 | mmol/L | 95-108 |
| Fosfatasi alcalina | 2671 | U/L | 35-122 |
| LDH | 183 | U/L | 110-215 |
| GGT | 8371 | U/L | < 36 |
| AST | 1041 | U/L | < 31 |
| ALT | 100 | U/L | < 36 |
Dopo aver esaminato la TAC, la paziente ha deciso di sospendere la chemioterapia, il bevacizumab e la metformina. Il DCA i.v. è stato continuato e la dose è stata aumentata a 4500 mg i.v. settimanali. La nausea e il vomito si sono risolti. Il dolore è rimasto sotto controllo.
Dopo 3 mesi è stata eseguita una nuova TC, che ha dimostrato un tumore rettale residuo con stenosi e carico fecale prossimale (invariato) e “metastasi epatiche, non significativamente modificate”. Il paziente ha riferito un lieve intorpidimento delle dita delle mani e dei piedi. Si è verificato un ulteriore aumento dei valori asintomatici degli enzimi epatici (Tabella 2). Entrambi sono stati diagnosticati come effetti collaterali del DCA. Durante la terapia fino a questo momento, il CEA aveva mostrato lievi fluttuazioni, ma era considerato complessivamente stabile (Figura 2).
La terapia con DCA è stata interrotta per 3 mesi per consentire la risoluzione degli effetti collaterali del DCA
Durante questo periodo sono state somministrate solo terapie naturali (prescritte da Andrews). L’acetil L-carnitina, la benfotiamina e l’acido alfa lipoico sono stati continuati per accelerare il recupero della neuropatia da DCA. Sono stati aggiunti la curcumina orale[40] e l’honokiol (estratto di magnolia) nel tentativo di mantenere il controllo del cancro[41]. Durante il periodo di sospensione del DCA, il CEA è aumentato da 4,1 a 5,1 ng/mL (Figura 2). La lieve neuropatia da DCA si è risolta e gli enzimi epatici hanno iniziato a migliorare.
A marzo 2013, a causa della preoccupazione per i costi della terapia infusionale, si è deciso di iniziare la terapia orale con DCA. Una nuova TAC al basale ha dimostrato un aumento di 1 mm di una lesione marker del segmento 7 del fegato e un aumento di 1 mm di un linfonodo marker aortocavale, ma è stato riportato un “aspetto stabile del colon” e “metastasi epatiche stabili”.
Il DCA orale è stato iniziato alla dose di 500 mg (8,2 mg/kg) due volte al giorno e sono stati continuati gli integratori neuroprotettivi costituiti da acetil L-carnitina orale, benfotiamina e acido R-alfa lipoico. Gli integratori sono stati somministrati in modo continuativo e il DCA è stato somministrato con un ciclo di 2 settimane di assunzione/1 settimana di sospensione.
Nel dicembre 2013, la terapia antidolorifica è passata dall’idromorfone al metadone 10 mg 3 volte al giorno, per semplicità, per migliorare il controllo del dolore e per risparmiare sui costi.
Il paziente ha continuato a seguire questo regime con regolari TAC ogni 3-6 mesi. A causa di un’agenda di lavoro fitta di impegni, la paziente è diventata meno adempiente nei confronti dei regolari esami del sangue. È rimasta altamente funzionale (livello ECOG 1) con una lieve neuropatia cronica da DCA che è stata controllata e non ha influito sulle sue funzioni quotidiane.
Si è cercato di aumentare la dose di DCA a 500 mg 3 volte al giorno, ma ciò ha comportato un significativo innalzamento asintomatico degli enzimi epatici e un aumento della neuropatia. Di conseguenza, dopo una breve interruzione della terapia, è stata ripresa una dose di DCA di 500 mg due volte al giorno.
Le scansioni TC in corso hanno continuato a rivelare una malattia stabile (Figura 3), senza la comparsa di nuove lesioni. Il CEA complessivo non è cambiato significativamente dall’inizio della terapia con DCA (CEA di 3,5 all’inizio della terapia con DCA, a CEA di 3,7 dopo quasi 4 anni di terapia). Anche il quadro ematico generale è risultato favorevole a 3 anni (Tabella 3) e dopo 4 anni (Tabella 4).
In sintesi, dopo aver ricevuto una chemioterapia convenzionale per circa 18 mesi, il paziente ha ricevuto una terapia con DCA per via endovenosa con chemioterapia concomitante per circa 6 mesi, seguita da una terapia con DCA per via endovenosa e orale senza terapia convenzionale concomitante per quasi 4 anni. Durante il trattamento con DCA orale, la paziente ha registrato una malattia stabile alla TAC e alla misurazione del marcatore tumorale CEA. È rimasta stabile anche dal punto di vista clinico, senza escalation della dose di metadone, mantenendo il livello di funzionalità ECOG 1, con una lieve neuropatia da DCA stabile, ed è stata in grado di gestire con successo la propria attività.
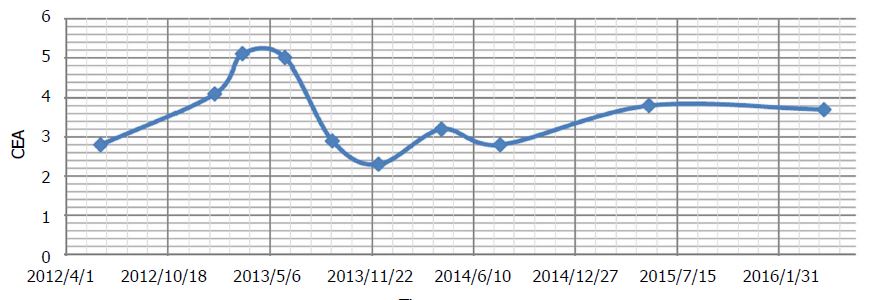
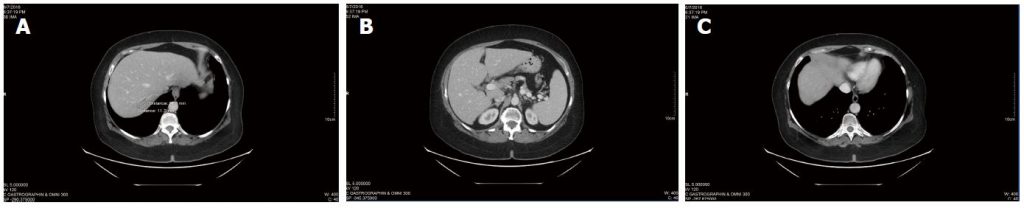
Tabella 3 Analisi del sangue durante la terapia con dicloroacetato sodico, maggio 2015
| Esame del sangue | Valore | Unità | Intervallo di normalità |
|---|---|---|---|
| Emoglobina | 134 | g/L | 115-155 |
| Conta dei globuli bianchi | 7.7 | ×109/L | 4.0-11.0 |
| Piastrine | 173 | ×109/L | 145-400 |
| Glucosio | 5.3 | mmol/L | 2.6-7.0 |
| Urea | 5.1 | mmol/L | 2.5-8.1 |
| Creatinina | 70 | μmol/L | 50-100 |
| Calcio | 2.37 | mmol/L | 2.20-2.65 |
| Albumina | – | g/L | 35-52 |
| Bilirubina | 8 | μmol/L | < 23 |
| Sodio | 144 | mmol/L | 136-146 |
| Potassio | 4.1 | mmol/L | 3.7-5.4 |
| Cloruro | 104 | mmol/L | 95-108 |
| Fosfatasi alcalina | – | U/L | 35-122 |
| LDH | 174 | U/L | 110-215 |
| GGT | 1561 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 25 | U/L | < 36 |
Tabella 4 Pannello ematico durante la terapia con dicloroacetato sodico, aprile 2016
| Esame del sangue | Valore | Unità | Intervallo di normalità |
|---|---|---|---|
| Emoglobina | 133 | g/L | 115-155 |
| Conta dei globuli bianchi | 5.2 | ×109/L | 4.0-11.0 |
| Piastrine | 155 | ×109/L | 145-400 |
| Glucosio | – | mmol/L | 2.6-7.0 |
| Urea | 4.9 | mmol/L | 2.5-8.1 |
| Creatinina | – | μmol/L | 50-100 |
| Calcio | 2.39 | mmol/L | 2.20-2.65 |
| Albumina | 42 | g/L | 35-52 |
| Bilirubina | 9 | μmol/L | < 23 |
| Sodio | 142 | mmol/L | 136-146 |
| Potassio | 4 | mmol/L | 3.7-5.4 |
| Cloruro | 102 | mmol/L | 95-108 |
| Fosfatasi alcalina | 101 | U/L | 35-122 |
| LDH | 156 | U/L | 110-215 |
| GGT | 1491 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 28 | U/L | < 36 |
DISCUSSIONE
Questo caso di terapia con DCA in un paziente con cancro del colon in stadio avanzato 4 dimostra una malattia stabile a lungo termine secondo i criteri clinici, biochimici e radiologici.
La durata della stabilità durante la terapia con DCA senza altre chemioterapie attive è attualmente di 46 mesi (quasi 4 anni), con un tempo di sopravvivenza dalla diagnosi iniziale di cancro colorettale di stadio 4 di 6 anni.
In base alla revisione delle statistiche sul cancro del National Cancer Institute (SEER) 1975-2011, il tasso di sopravvivenza relativa a 5 anni per le donne con diagnosi di cancro del colon/retto in stadio IV è stato del 14,4% (http://seer.cancer.gov/csr/1975_2013/). Sebbene non si possa concludere definitivamente che il DCA sia stato efficace, la sopravvivenza per un periodo di tempo così lungo in assenza di una chemioterapia in corso avrebbe una probabilità relativamente bassa.
Sono stati riportati effetti citostatici piuttosto che citotossici del DCA sulle cellule tumorali del colon-retto e di altri tipi di cancro, a sostegno di questo risultato clinico[23,27,42-44]. Ad oggi la paziente sta bene clinicamente e rimane in terapia con DCA.
Oltre al mantenimento di una malattia stabile, questo caso dimostra la tollerabilità del DCA orale in un paziente oncologico per periodi di tempo molto più lunghi di quelli attualmente riportati dagli studi clinici pubblicati su pazienti oncologici. Chu et al[11] hanno riferito di 24 pazienti trattati per un periodo mediano di 2 mesi a 6,25 o 12,5 mg/kg BID, con DCA orale continuo senza supplementi neuroprotettivi.
Hanno concluso che la dose raccomandata per la fase 2 era di 6,25 mg/kg BID (12,5 mg/kg al giorno), con un attento monitoraggio della neuropatia. Dunbar et al[9] hanno raccomandato 5 mg/kg BID come dose iniziale per la maggior parte dei pazienti, e nel loro studio hanno somministrato 4, 8 o 12,5 mg/kg BID in modo continuo (tempo mediano di assunzione del DCA 34 d), anche in questo caso senza integratori neuroprotettivi.
Il paziente di questa relazione ha assunto 500 mg BID, equivalenti a 8,2 mg/kg BID, 2 settimane sì e 1 no, ma non ha potuto tollerare questa dose tre volte al giorno (per un totale di 25 mg/kg al giorno). Dunbar et al[9] suggeriscono di considerare la genotipizzazione per i polimorfismi in GSTZ1, l’enzima che metabolizza il DCA nel fegato e che viene inattivato con l’uso continuativo del DCA[45], nel determinare la dose iniziale per i pazienti.
Tuttavia, sono necessari ulteriori lavori per raccogliere un numero convincente di genotipi e dati sulla tolleranza alla dose. Attualmente è in corso uno studio clinico sul DCA in pazienti affetti da mieloma multiplo che contribuirà a questo insieme di dati (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr.org.au).
Sono necessari ulteriori studi per determinare il regime di dosaggio ottimale per un trattamento acuto o cronico massimo tollerabile con il DCA e quale sia la dose necessaria per l’efficacia.
Il caso presentato indica che il DCA è molto promettente come terapia antitumorale. La paziente ha ottenuto un beneficio significativo dalla terapia, con lievi effetti collaterali e nessuna tossicità ematologica, cardiaca, polmonare o renale. È stata osservata una certa tossicità epatica (Tabella 2), che è stata facilmente gestita con l’interruzione della terapia con DCA seguita da un aggiustamento della dose.
È stata segnalata una lieve neurotossicità periferica reversibile. Le terapie naturali combinate con il DCA (acetil L-carnitina, acido alfa lipoico e benfotiamina) hanno aiutato il paziente a ridurre gli effetti collaterali, ma non sono note come terapie antitumorali.
Al momento della stesura del presente documento, non esistono studi clinici attivi sull’uso umano del DCA come agente citostatico. Dato che il DCA non è coperto da brevetto, il reperimento di fondi adeguati per sostenere studi sull’uomo su larga scala rappresenta una seria sfida. Si spera che questo caso che esemplifica i benefici del DCA orale stimoli ulteriori indagini cliniche.
Sulla base della nostra esperienza clinica, unita alle pubblicazioni esistenti, la terapia off-label con DCA è un’opzione per i pazienti che hanno a disposizione trattamenti convenzionali limitati, una volta compresi e accettati i rischi e i benefici della terapia.
Questo caso clinico dimostra che, anche nella malattia in stadio avanzato, il DCA ha il potenziale di prolungare la vita senza influire sulla qualità della vita del paziente, rispetto alla chemioterapia con i suoi frequenti effetti collaterali debilitanti o la compromissione della funzione fisiologica. Dato il costo ragionevole e la modesta tossicità, il DCA merita ulteriori indagini.
RICONOSCIMENTI
Gli autori desiderano ringraziare la dottoressa Humaira Khan per la sua assistenza e la paziente per il suo sostegno e il consenso alla pubblicazione del suo caso.
COMMENTI
Caratteristiche del caso
La paziente, una donna di 57 anni, si è presentata con costipazione e dolore lombare.
Diagnosi clinica
Al paziente è stato diagnosticato un tumore del retto parzialmente ostruente
Diagnosi di laboratorio
Marcatore tumorale dell’antigene carcinoembrionale elevato.
Diagnosi per immagini
Massa rettale vista alla colonscopia.
Diagnosipatologica
Adenocarcinoma colorettale moderatamente differenziato.
Trattamento
Ileostomia ad anello seguita da chemioterapia con 5-fluorouracile, irinotecan, leucovorin e bevacizumab, poi aggiunta di dicloroacetato di sodio (DCA), quindi DCA senza chemioterapia per quasi 4 anni.
Rapporti correlati
I rapporti della tomografia computerizzata dimostrano la riduzione del tumore con la chemioterapia combinata + DCA, quindi la stabilità della malattia per quasi 4 anni con DCA e senza chemio.
Spiegazione dei termini
DCA: dicloroacetato di sodio; RECIST: Criteri di valutazione della risposta per i tumori solidi; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Esperienze e insegnamenti
Il DCA non è solo un farmaco pro-apoptotico, ma può anche agire come agente citostatico e può quindi ottenere una stabilizzazione a lungo termine di un tumore avanzato senza gravi effetti collaterali, come illustrato da questo caso di cancro del retto
Peer-review
Il DCA, il sale di sodio del dicloroacetato, è un composto chimico a basso costo che ha mostrato un chiaro potenziale come trattamento alternativo del cancro e che è stato utilizzato in una serie di studi su persone affette da cancro al cervello, o glioblastoma. Si tratta di un caso clinico ben scritto in cui la terapia orale con DCA ha portato alla stabilizzazione del tumore del colon di stadio 4 in una donna di 57 anni per un periodo di oltre 3 anni, senza alcuna tossicità grave. Questo rapporto copre ciò che promette di fare.
Gli autori fanno un ottimo lavoro spiegando le basi della terapia con DCA e il suo ruolo in diversi tipi di tumore. Con l’aggiunta dei meccanismi d’azione contro le cellule tumorali e del potenziale terapeutico del DCA, gli autori forniscono una buona risorsa per i lettori che non hanno familiarità con la terapia con DCA, ma forniscono anche dettagli.
RIFERIMENTI
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. L’asse mitocondrio-canale K+ è soppresso nel cancro e la sua normalizzazione promuove l’apoptosi e inibisce la crescita del tumore. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/j.ccr.2006.10.020]2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Valutazione del trattamento a lungo termine di bambini con acidosi lattica congenita con dicloroacetato. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Studio clinico controllato del dicloroacetato per il trattamento dell’acidosi lattica congenita nei bambini. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Potenziale terapeutico del dicloroacetato per il deficit del complesso piruvato deidrogenasi. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Il dicloroacetato causa neuropatia tossica nella MELAS: uno studio clinico randomizzato e controllato. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Modulazione metabolica del glioblastoma con dicloroacetato. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Studio di fase 1 sul dicloroacetato (DCA) in adulti con tumori cerebrali maligni ricorrenti. Invest New Drugs 2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Il dicloroacetato dovrebbe essere considerato con la chemioterapia a base di platino nei tumori ipossici piuttosto che come agente singolo nel carcinoma polmonare non a piccole cellule in stadio avanzato. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/ s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. Studio di fase I in aperto, a braccio singolo, di dose-escalation di dicloroacetato (DCA) in pazienti con tumori solidi avanzati. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Il dicloroacetato induce apoptosi e arresto del ciclo cellulare nelle cellule di cancro del colon-retto. Br J Cancer 2010; 102: 1746-1752 [PMID: 20485289 DOI: 10.1038/sj.bjc.6605701]
13 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Il dicloroacetato (DCA) sensibilizza alle radiazioni sia le cellule di cancro alla prostata wild-type che quelle che esprimono Bcl-2 in vitro. Prostate 2008; 68: 1223-1231 [PMID: 18465755 DOI: 10.1002/pros.20788]
14 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Il dicloroacetato induce l’apoptosi delle cellule epiteliali di cancro ovarico attraverso un meccanismo che coinvolge la modulazione dello stress ossidativo. Reprod Sci 2011; 18: 1253-1261 [PMID: 21701041 DOI: 10.1177/1 933719111411731]
15 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Il dicloroacetato inibisce la crescita del neuroblastoma agendo specificamente contro le cellule indifferenziate maligne. Int J Cancer 2012; 130: 1484-1493 [PMID: 21557214 DOI: 10.1002/ijc.26173]
16 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines. Clin Transl Oncol 2011; 13: 43-49 [PMID: 21239354 DOI: 10.1007/s12094-011-0615-z]
17 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Necrosi del carcinoma cervicale da parte del dicloroacetato rilasciato da tappeti di polilattide elettrofilati. Biomaterials 2012; 33: 4362-4369 [PMID: 22425553 DOI: 10.1016/j.biomaterials.2012.02.062]
18 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Il dicloroacetato induce apoptosi nelle cellule del cancro endometriale. Gynecol Oncol 2008; 109: 394-402 [PMID: 18423823 DOI: 10.1016/j.ygyno.2008.01.038]
19 Ishiguro T, Ishiguro R, Ishiguro M, Iwai S. Il co-trattamento di dicloroacetato, omeprazolo e tamoxifene ha mostrato un effetto antiproliferativo sinergico sui tumori maligni: esperimenti in vivo e un case report. Hepatogastroenterology 2012; 59: 994-996 [PMID: 22580646 DOI: 10.5754/hge10507]
20 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. L’influenza del dicloroacetato di sodio sui processi ossidativi nel sarcoma 37. Exp Oncol 2011; 33: 216-221 [PMID: 22217710]
21 Kumar A, Kant S, Singh SM. Nuovi meccanismi molecolari dell’azione antitumorale del dicloroacetato contro il linfoma a cellule T: Implicazione dell’alterazione del metabolismo del glucosio, dell’omeostasi del pH e della regolazione della sopravvivenza cellulare. Chem Biol Interact 2012; 199: 29-37 [PMID: 22705712 DOI: 10.1016/j.cbi.2012.06.005]
22 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. L’attivazione mitocondriale tramite l’inibizione di PDKII sopprime la segnalazione di HIF1a e l’angiogenesi nel cancro. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
23 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Il dicloroacetato di sodio (DCA) riduce l’apoptosi nell’ipossia del tumore colorettale. Cancer Lett 2010; 297: 75-83 [PMID: 20537792 DOI: 10.1016/j.canlet.2010.04.027]
24 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
25 Kankotia S, Stacpoole PW. Dicloroacetato e cancro: nuova casa per un farmaco orfano? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
26 Sun RC, Board PG, Blackburn AC. Metabolismo mirato con triossido di arsenico e dicloroacetato nelle cellule di cancro al seno. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
27 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Il dicloroacetato di sodio colpisce selettivamente le cellule con difetti nell’ETC mitocondriale. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
28 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Il target di due aspetti del metabolismo nel trattamento del cancro al seno. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
29 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy- induced peripheral neuropathy: a short review. CNS Drugs 2007; 21 Suppl 1: 39-43; discussione 45-46 [PMID: 17696592]
30 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. Uno studio pilota sull’effetto dell’acetil-L-carnitina nella neuropatia periferica indotta da paclitaxel e cisplatino. Tumori 2005; 91: 135-138 [PMID: 15948540]
31 Evans JD, Jacobs TF, Evans EW. Ruolo dell’acetil-L-carnitina nel trattamento della neuropatia periferica diabetica. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
32 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Acido alfa lipoico per la neuropatia periferica sintomatica nei pazienti con diabete: una meta-analisi di studi controllati randomizzati. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
33 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. Effetto curativo dell’acido alfa-lipoico sulla neuropatia periferica nel diabete di tipo 2: uno studio clinico. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
34 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Trattamento della neuropatia periferica diabetica sintomatica con l’antiossidante acido alfa-lipoico. Uno studio multicentrico randomizzato e controllato di 3 settimane (Studio ALADIN). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
35 Winkler G, Kempler P. Pathomechanism of diabetic neuropathy: background of the pathogenesis-oriented therapy. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.156/OH.2010.28898]
36 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamina B per il trattamento della neuropatia periferica. Cochrane Database Syst Rev 2008: CD004573 [PMID: 18646107 DOI: 10.102/14651858.CD004573.pub3]
37 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosage regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
38 Loupakis F, Cremolini C, Masi G, Lonardi S, Zagonel V, Salvatore L, Cortesi E, Tomasello G, Ronzoni M, Spadi R, Zaniboni A, Tonini G, Buonadonna A, Amoroso D, Chiara S, Carlomagno C, Boni C, Allegrini G, Boni L, Falcone A. Terapia iniziale con FOLFOXIRI e bevacizumab per il cancro colorettale metastatico. N Engl J Med 2014; 371: 1609-1618 [PMID: 25337750 DOI: 10.1056/ NEJMoa1403108]
39 Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. La metformina colpisce selettivamente le cellule staminali del cancro e agisce insieme alla chemioterapia per bloccare la crescita tumorale e prolungare la remissione. Cancer Res 2009; 69: 7507-7511 [PMID: 19752085 DOI: 10.1158/0008-5472.can-09-2994]
40 Cao A, Li Q, Yin P, Dong Y, Shi H, Wang L, Ji G, Xie J, Wu D. La curcumina induce l’apoptosi nelle cellule di carcinoma gastrico umano AGS e di carcinoma del colon HT-29 attraverso la disfunzione mitocondriale e lo stress del reticolo endoplasmatico. Apoptosis 2013; 18: 1391-1402 [PMID: 23881281 DOI: 10.1007/s10495-013-0871-1]
41 Wynn ML, Consul N, Merajver SD, Schnell S. Inferring the Effects of Honokiol on the Notch Signaling Pathway in SW480 Colon Cancer Cells. Cancer Inform 2014; 13: 1-12 [PMID: 25392689 DOI: 10.4137/CIN.S14060]
42 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Il dicloroacetato influisce sulla proliferazione ma non sulla sopravvivenza delle cellule di cancro del colon-retto umano. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
43 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. L’inversione del fenotipo glicolitico mediante dicloroacetato inibisce la crescita delle cellule metastatiche di cancro al seno in vitro e in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/s10549-009-0435-9]
44 Sánchez-Aragó M, Chamorro M, Cuezva JM. La selezione di cellule tumorali con mitocondri repressi innesca la progressione del cancro del colon. Carcinogenesis 2010; 31: 567-576 [PMID: 20080835 DOI: 10.1093/ carcin/bgq012]
45 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polimorfismo e inattivazione specie-dipendente della glutatione transferasi zeta da parte del dicloroacetato. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]
Contenuti correlati: