Akbar Khan, Doug Andrews, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Canada
Anneke C Blackburn, The John Curtin School of Medical Research, The Australian National University, Canberra, ACT 2601, Australië
Bijdragen van de auteurs: Khan A behandelde de patiënt en schreef het grootste deel van het verslag; Andrews D behandelde de patiënt, ontwierp de protocollen voor natuurlijke therapie en schreef mee aan het verslag; Blackburn AC verrichtte in vitro en in vivo werk om de effecten van DCA als cytostaticum aan te tonen en schreef de delen van het verslag die betrekking hebben op het in vitro en in vivo DCA-onderzoek.
Verklaring van de onderzoeksraad: Niet van toepassing.
Informed consent verklaring: De in dit manuscript beschreven patiënte heeft toestemming gegeven om haar geval anoniem te publiceren.
Belangenverstrengeling verklaring: Een van de auteurs (Khan) geeft dichlooracetaattherapie aan kankerpatiënten via Medicor Cancer Centres tegen kosten en zonder winstoogmerk. De kliniek is eigendom van een familielid van deze auteur. De andere auteurs hebben niets openbaar te maken.
Open-access: Dit artikel is een open-access artikel dat is geselecteerd door een interne redacteur en volledig peer-reviewed door externe beoordelaars. Het wordt verspreid in overeenstemming met de Creative Commons Naamsvermelding Niet Commercieel (CC BY-NC 4.0) licentie, die anderen toestaat om te verspreiden, remixen, aan te passen, voort te bouwen op dit werk niet-commercieel, en licentie hun afgeleide werken op verschillende voorwaarden, op voorwaarde dat het oorspronkelijke werk naar behoren wordt geciteerd en het gebruik is niet-commercieel. Zie: http://creativecommons.org/licenses/by-nc/4.0/
Bron van het manuscript: Uitgenodigd manuscript
Correspondentie naar: Akbar Khan, MD, Medical Director,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canada. [email protected]
Telefoon: +1-416-2270037
Fax: +1-416-2271915
Ontvangen: 30 april 2016
Peer-review gestart: 3 mei 2016
Eerste besluit: 17 juni 2016
Herzien: 23 juli 2016
Aanvaard: 6 augustus 2016
Artikel in pers: 8 augustus 2016
Online gepubliceerd: 16 oktober 2016
Abstract
Orale dichlooracetaat natrium (DCA) wordt sinds 2007 onderzocht als een nieuwe metabolische therapie voor verschillende kankers, gebaseerd op gegevens van Bonnet et al dat DCA apoptose van menselijke long-, borst- en hersenkankercellen kan triggeren. De respons op therapie in menselijke studies wordt gemeten aan de hand van standaardcriteria voor de evaluatie van de respons op vaste tumoren, die “respons” definiëren aan de hand van de mate waarin de tumor afneemt of op beeldvorming verdwijnt.
Blackburn et al hebben echter aangetoond dat DCA ook in vitro en in vivo als cytostaticum kan werken, zonder apoptose (geprogrammeerde celdood) te veroorzaken. Er wordt een geval gepresenteerd waarin orale DCA-therapie resulteerde in tum onze stabilisatie van stadium 4 darmkanker bij een 57-jarige vrouw gedurende een periode van bijna 4 jaar, zonder ernstige toxiciteit. Aangezien de natuurlijke geschiedenis van stadium 4 darmkanker bestaat uit een gestage progressie die leidt tot invaliditeit en overlijden, wijst dit geval op een nieuw gebruik van DCA als cytostaticum met een potentieel om kanker in een gevorderd stadium op lange termijn stabiel te houden.
Trefwoorden: Dichlooracetaat; Kanker; Colon; Colorectaal; Cytostatisch; Stabilisatie; Groeiremming; Intraveneus
© De auteur(s) 2016. Gepubliceerd door Baishideng Publishing Group Inc. Alle rechten voorbehouden.
Kernpunt: Oraal dichlooracetaat-natrium (DCA) is onderzocht als een nieuwe metabole therapie voor verschillende kankers. De respons op therapie in studies bij mensen wordt gemeten aan de hand van standaard respons evaluatiecriteria voor vaste tumoren, die “respons” definiëren aan de hand van de mate van tumorreductie, of het verdwijnen van de tumor op beeldvorming.
DCA kan echter ook als cytostaticum werken, zonder apoptose (geprogrammeerde celdood) te veroorzaken. Er wordt een geval gepresenteerd waarin orale DCA-therapie resulteerde in tumorstabilisatie van stadium 4 darmkanker bij een 57-jarige vrouw gedurende een periode van bijna 4 jaar, zonder ernstige toxiciteit.
Khan A, Andrews D, Blackburn AC. Langdurige stabilisatie van stadium 4 darmkanker met behulp van natriumdichlooracetaattherapie. World J Clin Cases 2016; 4(10): 336-343
Beschikbaar vanaf: URL: http://www.wjgnet.com/2307-8960/full/v4/i10/336.htm
DOI: http://dx.doi.org/10.12998/wjcc.v4.i10.336
INLEIDING
Het geneesmiddel natriumdichlooracetaat (DCA) is onderzocht als een nieuwe metabole therapie voor verschillende vormen van kanker sinds 2007, toen Bonnet et al[1] een gecombineerde in vitro/in vivo studie bij ratten publiceerden waarin de werkzaamheid van DCA werd aangetoond bij de behandeling van menselijke long-, borst- en hersenkankers door remming van het mitochondriale pyruvaatdehydrogenase kinase. Stacpoole et al[2-4] hadden al eerder meerdere studies gepubliceerd met DCA voor de behandeling van congenitale melkziekte, die bestaat uit een verzameling van erfelijke mitochondriale ziekten[5].
Deze studies stelden het veiligheidsprofiel van oraal DCA bij mensen vast. DCA bleek een veilig geneesmiddel te zijn zonder hart-, long-, nier- of beenmergtoxiciteit[4]. De meest ernstige bijwerking bestaat uit perifere neuropathie, die omkeerbaar is[6]. Delirium is gemeld, en is omkeerbaar na staken van DCA[7]. Asymptomatische en reversibele leverenzymverhoging is gemeld bij een klein percentage van de patiënten[3].
Het eerdere werk aan congenitale melkziekte heeft de snelle progressie van DCA naar de kanker kliniek mogelijk gemaakt. Er zijn nu vier verslagen gepubliceerd van klinische kankeronderzoeken met DCA, wat duidt op een groeiende erkenning van het potentiële nut van DCA[8-11]. Deze onderzoeken, waarbij patiënten in een laat stadium werden behandeld, konden echter slechts rapporteren over de behandeling gedurende een relatief korte periode.
In het eerste artikel van Bonnet et al. uit 2007[1] werd gemeld dat DCA het mitochondriale membraanpotentieel verlaagde, wat leidde tot selectieve apoptose in kankercellen. Het vastgestelde mechanisme was remming van aerobe glycolyse (het Warburg-effect) en activering van mitochondriale kalium-ionkanalen[1].
Verder onderzoek van DCA bevestigde kankerbestrijdende activiteit in verschillende kankertypes, waaronder colon[12], prostaat[13], eierstok[14], neuroblastoom[15], longcarcinoïde[16], baarmoederhals[17], endometrium[18], cholangiocarcinoom[19], sarcoom[20] en T-cel lymfoom[21].
Er zijn ook andere antineoplastische werkingen van DCA gesuggereerd. Deze omvatten angiogeneseblokkade[22], veranderingen in de expressie van HIF1-α[23], wijziging van de pH-regulatoren V-ATPase en MCT1, en andere regulatoren voor celoverleving zoals PUMA, GLUT1, Bcl2 en p53[24].
In de zoektocht naar cytotoxische activiteit worden in veel in vitro rapporten echter concentraties DCA gebruikt die klinisch waarschijnlijk niet haalbaar zijn[25]. Sommige studies hebben beperkte concentraties gebruikt en vonden DCA eerder cytostatisch dan cytotoxisch, maar in staat om apoptose met andere middelen te versterken[26-28].
In het verslag van een succesvolle in vivo behandeling van borstkanker met DCA vonden Sun et al.[26] dat DCA cytostatisch is en de proliferatie remt zonder de apoptose te verhogen. DCA kon de metastatische belasting in de longen van ratten in een sterk uitgezaaid in vivo model van borstkanker aanzienlijk verminderen. Dit suggereert een nieuwe rol voor DCA als een kanker stabiliserend middel, vergelijkbaar met een anti-angiogene therapie.
Voor zover de auteurs weten, zijn er echter nog geen menselijke gegevens gepubliceerd die het gebruik van DCA voor het behoud op lange termijn van een stabiele ziekte ondersteunen. Als gevolg van Bonnet’s baanbrekende publicatie over DCA, begon Khan begin 2007 met het klinisch gebruik van DCA voor de behandeling van kankerpatiënten met een slechte prognose of die niet reageerden op goedgekeurde kankertherapieën.
In samenwerking met een natuurgeneeskundige (Andrews) werd een protocol van natuurlijke medicijnen ontwikkeld om de dosisbeperkende neurologische toxiciteit aan te pakken. Het orale DCA-regime dat werd ontwikkeld omvatte drie natuurlijke medicijnen acetyl-L-carnitine[29-31], R-alfaliponzuur[32-34] en benfotiamine[35-37], met als hoofddoel neuropathiepreventie.
Uit observationele gegevens van meer dan 300 kankerpatiënten met een gevorderde ziekte bleek dat DCA-therapie in 60%-70% van de gevallen meetbare voordelen opleverde. Het neuropathierisico met opname van natuurlijke neuroprotectieve middelen was ruwweg 20% bij een dosering van 20-25 mg/kg per dag in een cyclus van 2 weken op/1 weken af. Reversibele leverenzymverhoging werd vastgesteld bij ongeveer 2% in deze patiëntengroep (klinische observatiegegevens online gepubliceerd op www.medicorcancer.com).
Er wordt een geval van een patiënt gepresenteerd die de cytostatische effecten van een jarenlange orale behandeling met DCA illustreert. Deze patiënt had een slechte prognose (mediane overleving van 9-12 maanden voor stadium 4 dikkedarmkanker met agressieve conventionele palliatieve chemotherapie)[38]. De patiënt werd behandeld door Khan in samenwerking met de natuurgeneeskundige Andrews, die een protocol ontwikkelde bestaande uit natuurlijke neuroprotectieve middelen.
CASE-VERSLAG
Een 57-jarige vrouw bezocht de kliniek van de auteur (Khan) in maart 2012 op zoek naar therapie voor uitgezaaide colorectale kanker. De patiënte was oorspronkelijk gediagnosticeerd met rectale kanker medio 2010 toen ze haar arts raadpleegde voor nieuwe constipatie en lage rugpijn. Colonoscopie werd geprobeerd, maar de colonoscoop kon niet worden gevorderd vanwege de aanwezigheid van een gedeeltelijk blokkerende rectumtumor. De biopsie bevestigde een matig gedifferentieerd colorectaal adenocarcinoom.
Computerized tomography (CT) scan toonde toen stadium 4 ziekte met meerdere levermetastasen tot 3 cm in diameter, mogelijk kleine longmetastasen en een ringvormig rectumcarcinoom dat niet gemakkelijk te meten was (marges van de kanker waren moeilijk te onderscheiden van de omringende weefsels op CT scan).
De patiënt onderging een lus-ileostomie om de obstructie te omzeilen en de rectumtumor werd niet geëxcideerd. De operatie werd gevolgd door chemotherapie bestaande uit 5-fluorouracil, irinotecan, leucovorin en bevacizumab (FOLFIRI + bevacizumab). Aanvankelijk reageerde de patiënt op chemotherapie met een vermindering van de levermetastasen, een vermindering van de primaire rectale laesie en een vermindering van de bloedmarker carcino-embryonisch antigeen (CEA) van 260,9 ng/mL vóór de chemo tot 3,5 ng/mL vlak vóór de start van de DCA-therapie. De respons op de chemo begon toen te stagneren. Tegen de tijd dat de patiënt zich in de kliniek van de auteur meldde, veroorzaakte de chemotherapie een minimale vermindering van de ziekte, en werd de stabiliteit in wezen slechts gehandhaafd.
De patiënte was voorheen gezond en had een rookverleden van 20 jaar. Ze gebruikte af en toe alcohol. Er was een positieve familiegeschiedenis van darmkanker en maagkanker. De medicatie omvatte de beschreven chemotherapie, waterstofperoxideklysma’s, orale vitamine C, af en toe orale vitamine D, tweemaal daags 32 mg hydromorfon met tijdelijke afgifte en 2-4 mg kortwerkende hydromorfon oraal indien nodig voor “doorbraak”-pijn. Er waren geen allergieën.
Functioneel onderzoek bracht enkele milde mondzweren aan het licht in verband met de lopende chemotherapie, milde diarree (te verwachten met een ileostomie) en lichte intermitterende rectale bloeding. Er was pijn/brandende lage rug en sacrale pijn tot 6 op 10 intensiteit, en milde rechterschouder-pijn verergerd door chemotherapie (gevoeld als verwezen pijn in verband met levermetastasen).
Aangezien de chemotherapie nog steeds effectief was en de patiënt geen ernstige bijwerkingen ondervond, was de eerste benadering om de bestaande therapie van de patiënt te ondersteunen, niet om deze te vervangen. In samenwerking met een natuurgeneeskundige arts (Andrews) werd een integratief plan opgesteld.
Het plan bestond uit toevoeging van een hoge dosis orale vitamine D van 10.000 internationale eenheden per dag, een verandering van orale vitamine C naar vitamine C 50 g intraveneus (i.v.) per week, en toevoeging van dichlooracetaat-natrium (DCA) 3000 mg i.v. (49 mg/kg) per week (fabrikant: Tokyo Chemical Industry, Verenigde Staten). Om het risico van DCA-bijwerkingen te verminderen, werden 3 natuurlijke supplementen voorgeschreven: Alfaliponzuur (racemisch) 500 mg i.v. bij elke dosis DCA, oraal R-alfaliponzuur 150 mg 3 keer per dag, oraal acetyl-L-carnitine 500 mg 3 keer per dag, en oraal benfotiamine 80 mg 2 keer per dag.
Infusies werden gepland rond chemotherapie infusies (gescheiden door ten minste 2 d van chemotherapie) om eventuele interferentie of medicijn interacties te voorkomen. Liponzuur werd niet gegeven op chemotherapiedagen of binnen 1 dag voor of na chemotherapie, omdat het een krachtige antioxidant is en de werkzaamheid van chemotherapie kan verminderen. De integratieve therapie begon in maart 2012. Er werden geen bijwerkingen vastgesteld, dus werd DCA verhoogd tot 4000 mg i.v. (66 mg/kg) per week. De enige bijwerking bij de hogere dosis DCA was een milde sedatie na de injectie.
Tabel 1 Bloedonderzoek voorafgaand aan de behandeling met dichlooracetaat-natrium
| Bloedonderzoek | Waarde | Eenheden | Normaal bereik |
|---|---|---|---|
| Hemoglobine | 131 | g/L | 115-155 |
| Aantal witte cellen | 6.5 | ×109/L | 4.0-11.0 |
| Bloedplaatjes | 202 | ×109/L | 145-400 |
| Glucose | 5.9 | mmol/L | 2.6-7.0 |
| Ureum | 6.5 | mmol/L | 2.5-8.1 |
| Creatinine | 64 | μmol/L | 50-100 |
| Calcium | 2.38 | mmol/L | 2.20-2.65 |
| Albumine | 43 | g/L | 35-52 |
| Bilirubine | 15 | μmol/L | < 23 |
| Natrium | 140 | mmol/L | 136-146 |
| Kalium | 4.2 | mmol/L | 3.7-5.4 |
| Chloride | 102 | mmol/L | 95-108 |
| Alkalische fosfatase | 1861 | U/L | 35-122 |
| LDH | 167 | U/L | 110-215 |
| GGT | 3641 | U/L | < 36 |
| AST | 331 | U/L | < 31 |
| ALT | 31 | U/L | < 36 |
Orale metformine werd toegevoegd om de kanker gevoelig te maken voor de chemotherapie, te beginnen met 500 mg eenmaal daags oraal met titratie tot 500 mg driemaal daags[39]. Pregabaline werd toegevoegd om de neuropathische sacrale pijn te helpen beheersen (begonnen met 50 mg per dag, getitreerd tot 50 mg 3 keer per dag). Bijwerkingen van chemotherapie waren misselijkheid en braken (vóór de start van de metformine), en metformine werd overgeslagen op dagen dat de patiënt zich onwel voelde om mogelijke toxiciteit te voorkomen, mocht de patiënt uitgedroogd raken.
Er werd routinematig bloedonderzoek verricht op de basislijn, waaronder volledige celtellingen, een standaard metabool panel, leverenzymen en bilirubine (tabel 1). Er was een CT-scan beschikbaar die 2 maanden voor aanvang van de integratieve therapie met DCA was gemaakt.
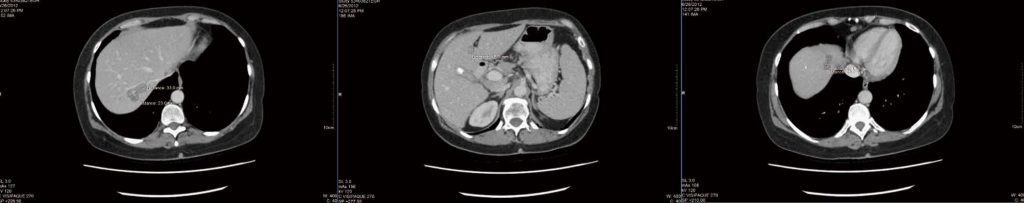
Na 4 maanden integratieve therapie zoals beschreven, werd een nieuwe CT-scan gemaakt (figuur 1), die werd gerapporteerd als “stabiel en onveranderd”, maar er werden geen metingen gegeven. Er werd een incidentele bevinding van een galsteen genoteerd (ook stabiel ten opzichte van de vorige scan). De patiënt raakte gefrustreerd omdat er geen verbetering werd vastgesteld, en in het CT-rapport werden geen gedetailleerde metingen vermeld. Er werd een poging gedaan om een positronemissietomografiescan te verkrijgen om duidelijkheid te krijgen over levende versus necrotische tumoren, maar overheidsfinanciering kon niet worden verkregen en de patiënt weigerde particulier voor de scan te betalen.
Na enige discussie koos de patiënt ervoor de therapie voort te zetten en toekomstige CT-scans in een ander ziekenhuis te laten maken. In september 2012 werden toenemende bijwerkingen van de chemotherapie geconstateerd, waaronder vermoeidheid, misselijkheid en braken. Uit een nieuwe CT-scan bleek dat alle leverlaesies “kleiner of niet meer herkenbaar” waren. De grootste tumorverkleining was echter slechts 2 mm (2,5 cm markeerlaesie in leversegment 4a verkleind tot 2,3 cm). Er werden geen nieuwe laesies geïdentificeerd.
.
Tabel 2 Bloedpanel tijdens dichlooracetaat-natriumtherapie, januari 2013
| Bloedonderzoek | Waarde | Eenheden | Normaal bereik |
|---|---|---|---|
| Hemoglobine | 134 | g/L | 115-155 |
| Aantal witte cellen | 5.1 | ×109/L | 4.0-11.0 |
| Bloedplaatjes | 1421 | ×109/L | 145-400 |
| Glucose | 5.5 | mmol/L | 2.6-7.0 |
| Ureum | 4.1 | mmol/L | 2.5-8.1 |
| Creatinine | 57 | μmol/L | 50-100 |
| Calcium | 2.24 | mmol/L | 2.20-2.65 |
| Albumine | 39 | g/L | 35-52 |
| Bilirubine | 11 | μmol/L | < 23 |
| Natrium | 140 | mmol/L | 136-146 |
| Kalium | 4.2 | mmol/L | 3.7-5.4 |
| Chloride | 106 | mmol/L | 95-108 |
| Alkalische fosfatase | 2671 | U/L | 35-122 |
| LDH | 183 | U/L | 110-215 |
| GGT | 8371 | U/L | < 36 |
| AST | 1041 | U/L | < 31 |
| ALT | 100 | U/L | < 36 |
Na beoordeling van de CT-scan besloot de patiënt alle chemotherapie, alsmede bevacizumab en metformine te staken. DCA i.v. werd voortgezet en de dosis werd verhoogd tot 4500 mg i.v. per week. Misselijkheid en braken verdwenen. De pijn bleef onder controle.
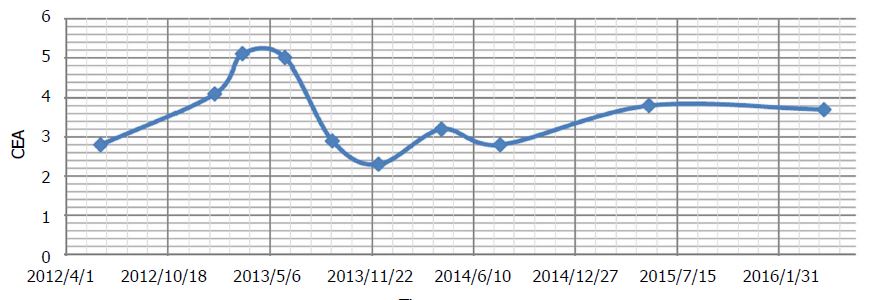
Na 3 maanden werd een nieuwe CT-scan gemaakt, die residuele rectale tumor liet zien met strictuur en proximale fecale belasting (onveranderd), en “levermetastasen, niet significant veranderd”. De patiënt meldde lichte gevoelloosheid van de vingers en tenen. Er was een verdere toename van asymptomatische leverenzymverhogingen (tabel 2). Beide werden gediagnosticeerd als DCA-bijwerkingen. Tijdens de therapie tot dan toe had CEA lichte schommelingen vertoond, maar werd over het geheel genomen als stabiel beschouwd (figuur 2).
De DCA-therapie werd gedurende 3 maanden onderbroken om de DCA-bijwerkingen te laten verdwijnen
Gedurende deze periode werden alleen natuurlijke therapieën gegeven (voorgeschreven door Andrews). Acetyl-L-carnitine, benfotiamine en alfaliponzuur werden voortgezet om het herstel van de DCA-neuropathie te versnellen. Orale curcumine[40] en honokiol (magnolia boomextract) werden toegevoegd in een poging de kanker onder controle te houden[41]. In de periode dat DCA werd gestopt, steeg CEA van 4,1 naar 5,1 ng/mL (figuur 2). Milde DCA neuropathie was verdwenen en de leverenzymen begonnen te verbeteren.
In maart 2013 werd vanwege de kosten van infuustherapie besloten om te beginnen met orale DCA-therapie. Een nieuwe baseline CT-scan toonde een toename van 1 mm in een marker laesie in leversegment 7, en een toename van 1 mm in een marker aortocavale lymfeklier, maar werd gerapporteerd als “stabiel uiterlijk van de dikke darm” en “stabiele levermetastasen”.
Orale DCA werd gestart in een dosis van 500 mg (8,2 mg/kg) tweemaal per dag, en neuroprotectieve supplementen bestaande uit orale acetyl-L-carnitine, benfotiamine en R-alfaliponzuur werden voortgezet. De supplementen werden continu gegeven, en DCA werd gegeven in een 2 wk op/1 wk af cyclus.
In december 2013 werd de pijnmedicatie omgezet van hydromorphone naar methadon 10 mg 3 keer per dag, voor eenvoud, betere pijncontrole en kostenbesparing.
De patiënt bleef dit regime volgen met regelmatige CT-scans om de 3 tot 6 maanden. De patiënte werd minder meegaand met regelmatige bloedonderzoeken vanwege een druk werkschema. Ze bleef zeer functioneel (ECOG-niveau 1) met een milde chronische DCA-neuropathie die onder controle was en haar dagelijks functioneren niet beïnvloedde.
Er werd geprobeerd DCA te verhogen tot 3 maal daags 500 mg, maar dit resulteerde in een aanzienlijke asymptomatische leverenzymverhoging en toename van de neuropathie. Bijgevolg werd na een korte onderbreking van de therapie een dosis DCA van 500 mg tweemaal daags hervat.
De CT-scans bleven stabiel (figuur 3) en er verschenen geen nieuwe laesies. De totale CEA was niet significant veranderd vanaf het begin van de DCA-therapie (CEA van 3,5 bij aanvang van de DCA-therapie tot CEA van 3,7 na bijna 4 jaar therapie). Het algemene bloedbeeld was ook gunstig na 3 jaar (tabel 3) en na 4 jaar (tabel 4).
Kortom, na conventionele chemotherapie gedurende ongeveer 18 maanden, kreeg de patiënt intraveneuze DCA-therapie met gelijktijdige chemotherapie gedurende ongeveer 6 maanden, gevolgd door intraveneuze en orale DCA-therapie zonder gelijktijdige conventionele kankertherapie gedurende bijna 4 jaar. Tijdens de behandeling met orale DCA was de ziekte van de patiënte stabiel volgens de CT-scans en stabiel volgens de CEA-tumormarker. Ze was ook klinisch stabiel met geen escalatie van de methadondosis, behoud van ECOG niveau 1 functie, stabiele milde DCA neuropathie, en ze was in staat om met succes haar eigen bedrijf te runnen.
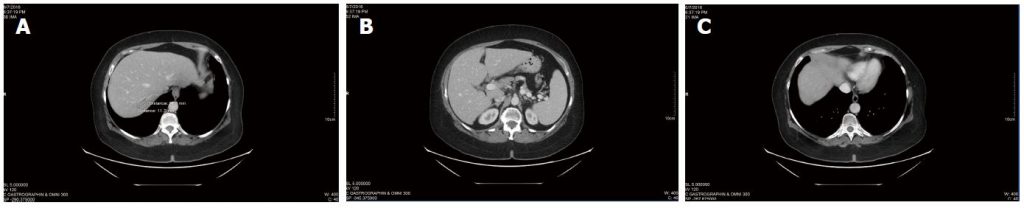
Tabel 3 Bloedpanel tijdens dichlooracetaat-natriumtherapie, mei 2015
| Bloedonderzoek | Waarde | Eenheden | Normaal bereik |
|---|---|---|---|
| Hemoglobine | 134 | g/L | 115-155 |
| Aantal witte cellen | 7.7 | ×109/L | 4.0-11.0 |
| Bloedplaatjes | 173 | ×109/L | 145-400 |
| Glucose | 5.3 | mmol/L | 2.6-7.0 |
| Ureum | 5.1 | mmol/L | 2.5-8.1 |
| Creatinine | 70 | μmol/L | 50-100 |
| Calcium | 2.37 | mmol/L | 2.20-2.65 |
| Albumine | – | g/L | 35-52 |
| Bilirubine | 8 | μmol/L | < 23 |
| Natrium | 144 | mmol/L | 136-146 |
| Kalium | 4.1 | mmol/L | 3.7-5.4 |
| Chloride | 104 | mmol/L | 95-108 |
| Alkalische fosfatase | – | U/L | 35-122 |
| LDH | 174 | U/L | 110-215 |
| GGT | 1561 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 25 | U/L | < 36 |
Tabel 4 Bloedpanel tijdens dichlooracetaat-natriumtherapie, april 2016
| Bloedonderzoek | Waarde | Eenheden | Normaal bereik |
|---|---|---|---|
| Hemoglobine | 133 | g/L | 115-155 |
| Aantal witte cellen | 5.2 | ×109/L | 4.0-11.0 |
| Bloedplaatjes | 155 | ×109/L | 145-400 |
| Glucose | – | mmol/L | 2.6-7.0 |
| Ureum | 4.9 | mmol/L | 2.5-8.1 |
| Creatinine | – | μmol/L | 50-100 |
| Calcium | 2.39 | mmol/L | 2.20-2.65 |
| Albumine | 42 | g/L | 35-52 |
| Bilirubine | 9 | μmol/L | < 23 |
| Natrium | 142 | mmol/L | 136-146 |
| Kalium | 4 | mmol/L | 3.7-5.4 |
| Chloride | 102 | mmol/L | 95-108 |
| Alkalische fosfatase | 101 | U/L | 35-122 |
| LDH | 156 | U/L | 110-215 |
| GGT | 1491 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 28 | U/L | < 36 |
DISCUSSIE
Dit geval van DCA-therapie bij een patiënt met gevorderd stadium 4 darmkanker toont een langdurig stabiele ziekte volgens klinische, biochemische en radiologische criteria.
De duur van de stabiliteit bij gebruik van DCA zonder andere actieve chemotherapie is momenteel 46 mo (bijna 4 jaar), met een overlevingstijd sinds de eerste diagnose van stadium 4 dikkedarmkanker van 6 jaar.
Op basis van de SEER-kankerstatistieken van het National Cancer Institute uit 1975-2011 was de 5-jaars relatieve overleving voor vrouwen met stadium IV colon/rectumkanker 14,4% (http://seer.cancer.gov/csr/1975_2013/). Hoewel niet definitief kan worden geconcludeerd dat DCA doeltreffend is geweest, zou overleving gedurende deze periode zonder voortdurende chemotherapie vrij onwaarschijnlijk zijn.
Cytostatische in plaats van cytotoxische effecten van DCA op colorectale en andere kankercellen zijn gerapporteerd en ondersteunen deze klinische bevinding[23,27,42-44]. Tot op heden blijft de patiënte klinisch gezond en blijft zij de DCA-therapie volgen.
Naast het behoud van een stabiele ziekte, toont dit geval de verdraagbaarheid aan van orale DCA bij een kankerpatiënt gedurende veel langere perioden dan momenteel wordt gerapporteerd uit de gepubliceerde klinische onderzoeken bij kankerpatiënten. Chu et al[11] rapporteerden over 24 patiënten die gedurende een mediane periode van 2 maanden werden behandeld met 6,25 of 12,5 mg/kg BID, op continue orale DCA zonder neuroprotectieve supplementen.
Zij concludeerden dat de aanbevolen dosis in fase 2 6,25 mg/kg BID was (12,5 mg/kg per dag), waarbij de neuropathie zorgvuldig in de gaten moest worden gehouden. Dunbar et al[9] adviseerden 5 mg/kg BID als startdosis voor de meeste patiënten, waarbij in hun proef 4, 8 of 12,5 mg/kg BID continu werd toegediend (mediane tijd op DCA 34 d), ook zonder neuroprotectieve supplementen.
De patiënt in dit rapport nam 500 mg BID, gelijk aan 8,2 mg/kg BID, 2 wk op/1 wk af, maar kon deze dosis niet driemaal daags verdragen (totaal 25 mg/kg per dag). Dunbar et al[9] suggereren dat genotypering voor polymorfismen in GSTZ1, het DCA-metaboliserende enzym in de lever dat wordt geïnactiveerd bij voortdurend gebruik van DCA[45], moet worden overwogen bij het bepalen van de startdosis voor patiënten.
Verder werk is echter nodig om overtuigende aantallen genotypes en dosis-tolerantiegegevens te verzamelen. Er loopt momenteel een klinisch onderzoek naar DCA bij multipel myeloompatiënten om bij te dragen aan deze gegevensverzameling (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr.org.au).
Verder onderzoek is nodig om het optimale doseringsregime te bepalen voor een maximaal verdraagbare acute of chronische behandeling met DCA, en ook welke dosis nodig is voor werkzaamheid.
Dit geval geeft aan dat DCA een grote belofte inhoudt als kankertherapie. De patiënte had aanzienlijk baat bij haar therapie, met milde bijwerkingen en geen hematologische, cardiale, pulmonale of renale toxiciteit. Er werd enige levertoxiciteit waargenomen (tabel 2), die gemakkelijk kon worden behandeld door onderbreking van de DCA-therapie gevolgd door aanpassing van de dosis.
Er werd lichte omkeerbare perifere neurotoxiciteit gemeld. Natuurlijke therapieën die gecombineerd werden met DCA (acetyl-L-carnitine, alfaliponzuur en benfotiamine) hielpen de patiënt bij het verminderen van de bijwerkingen, maar staan niet bekend als kankertherapie.
Op het moment van schrijven bestaan er geen actieve klinische onderzoeken naar het menselijk gebruik van DCA als cytostaticum. Omdat DCA niet meer gepatenteerd is, is het een serieuze uitdaging om voldoende middelen te vinden voor grootschalige proeven op mensen. We hopen dat dit geval, dat de voordelen van oraal DCA aantoont, verder klinisch onderzoek zal stimuleren.
Gebaseerd op onze klinische ervaring, gecombineerd met bestaande publicaties, is off-label DCA therapie een optie voor patiënten met beperkte beschikbare conventionele behandelingen, zodra zij de risico’s en voordelen van de therapie begrijpen en accepteren.
Dit casusverslag toont aan dat DCA, zelfs in een gevorderd stadium van de ziekte, het leven kan verlengen zonder de levenskwaliteit van de patiënt te beïnvloeden, in vergelijking met chemotherapie met zijn frequente invaliderende bijwerkingen of aantasting van de fysiologische functie. Gezien de redelijke kosten en bescheiden toxiciteit verdient DCA verder onderzoek.
ERKENNINGEN
De auteurs willen Dr. Humaira Khan bedanken voor haar hulp, en ook de patiënte voor haar steun en toestemming om haar geval te publiceren.
COMMENTAAR
Kenmerken van de casus
De 57-jarige vrouwelijke patiënt presenteerde zich met constipatie en lage rugpijn.
Klinische diagnose
De patiënt werd gediagnosticeerd met een gedeeltelijk verstopte rectumkanker
Laboratoriumdiagnose
Verhoogd carcino-embryonaal antigeen tumormarker.
Beeldvormingsdiagnose
Rectale massa gezien op colon colonoscopie.
Pathologische diagnose
Matig gedifferentieerd colorectaal adenocarcinoom.
Behandeling
Loop ileostomie gevolgd door chemotherapie bestaande uit 5-fluorouracil, irinotecan, leucovorin en bevacizumab, daarna toevoeging van dichlooracetaat natrium (DCA), daarna DCA zonder chemo gedurende bijna 4 jaar.
Gerelateerde rapporten
Gecomputeriseerde tomografische scan rapporten tonen vermindering van kanker met gecombineerde chemotherapie + DCA, daarna stabiele ziekte gedurende bijna 4 jaar met DCA en geen chemo.
Term uitleg
DCA: Dichlooracetaat natrium; RECIST: Response evaluation criteria for solid tumours; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Ervaringen en lessen
DCA is niet alleen een pro-apoptotisch middel, maar kan ook fungeren als cytostaticum, en kan dus op lange termijn stabilisatie van gevorderde kanker bewerkstelligen zonder ernstige bijwerkingen, zoals wordt geïllustreerd door dit geval van rectale kanker
Peer-review
DCA, het natriumzout van dichlooracetaat, is een goedkope chemische verbinding die een duidelijk potentieel heeft aangetoond als alternatieve kankerbehandeling, die is gebruikt in een aantal proeven met mensen die lijden aan hersenkanker, of glioblastoom. Dit is een goed geschreven casusverslag waarin orale DCA-therapie resulteerde in tumorstabilisatie van stadium 4 darmkanker bij een 57-jarige vrouw gedurende een periode van meer dan 3 jaar, zonder ernstige toxiciteit. Dit verslag doet wat het belooft.
De auteurs leggen de basisprincipes van DCA-therapie en de rol ervan bij verschillende tumortypes goed uit. Samen met de toevoeging van werkingsmechanismen tegen kankercellen en het therapeutisch potentieel van DCA, bieden de auteurs een goede bron voor lezers die meer onbekend zijn met DCA-therapie, maar ook details.
REFERENTIES
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/j.ccr.2006.10.020]2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/peds.2007-2062
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Metabole modulatie van glioblastoom met dichlooracetaat. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Fase 1 studie van dichlooracetaat (DCA) bij volwassenen met terugkerende kwaadaardige hersentumoren. Invest New Drugs 2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. Dichloroacetate should be considered with platinumbased chemotherapy in hypoxic tumors rather than as a single agent in advanced non-small cell lung cancer. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/ s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. A phase I open-labeled, single-arm, dose-escalation, study of dichloroacetate (DCA) in patients with advanced solid tumors. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichlooracetaat induceert apoptose en celcyclusstilstand in colorectale kankercellen. Br J Cancer 2010; 102: 1746-1752 [PMID: 20485289 DOI: 10.1038/sj.bjc.6605701]
13 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate 2008; 68: 1223-1231 [PMID: 18465755 DOI: 10.1002/pros.20788]
14 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Dichloroacetate induceert apoptose van epitheliale ovariumkankercellen via een mechanisme dat modulatie van oxidatieve stress impliceert. Reprod Sci 2011; 18: 1253-1261 [PMID: 21701041 DOI: 10.1177/1 933719111411731]
15 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Dichloroacetate inhibits neuroblastoma growth by specifically acting against malignant undifferentiated cells. Int J Cancer 2012; 130: 1484-1493 [PMID: 21557214 DOI: 10.1002/ijc.26173]
16 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. In vitro cytotoxicity of novel platinum-based drugs and dichloroacetate against lung carcinoid cell lines. Clin Transl Oncol 2011; 13: 43-49 [PMID: 21239354 DOI: 10.1007/s12094-011-0615-z]
17 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Necrose van cervicaal carcinoom door dichlooracetaat dat vrijkomt uit electrospun polylactide matten. Biomaterials 2012; 33: 4362-4369 [PMID: 22425553 DOI: 10.1016/j.biomaterials.2012.02.062]
18 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 2008; 109: 394-402 [PMID: 18423823 DOI: 10.1016/j.ygyno.2008.01.038]
19 Ishiguro T, Ishiguro R, Ishiguro M, Iwai S. Co-treatment of dichloroacetate, omeprazole and tamoxifen exhibited synergistically antiproliferative effect on malignant tumors: in vivo experiments and a case report. Hepatogastroenterology 2012; 59: 994-996 [PMID: 22580646 DOI: 10.5754/hge10507]
20 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. De invloed van natriumdichlooracetaat op de oxidatieve processen in sarcoom 37. Exp Oncol 2011; 33: 216-221 [PMID: 22217710]
21 Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma: Implication of altered glucose metabolism, pH homeostasis and cell survival regulation. Chem Biol Interact 2012; 199: 29-37 [PMID: 22705712 DOI: 10.1016/j.cbi.2012.06.005]
22 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. Mitochondrial activation by inhibition of PDKII suppresses HIF1a signaling and angiogenesis in cancer. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
23 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Natriumdichlooracetaat (DCA) vermindert apoptose in colorectale tumorhypoxie. Cancer Lett 2010; 297: 75-83 [PMID: 20537792 DOI: 10.1016/j.canlet.2010.04.027]
24 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
25 Kankotia S, Stacpoole PW. Dichloroacetate and cancer: new home for an orphan drug? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
26 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
27 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Natriumdichlooracetaat richt zich selectief op cellen met defecten in de mitochondriale ETC. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
28 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Targeting van twee aspecten van het metabolisme bij de behandeling van borstkanker. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
29 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy- induced peripheral neuropathy: a short review. CNS Drugs 2007; 21 Suppl 1: 39-43; discussion 45-46 [PMID: 17696592]
30 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxel- and cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
31 Evans JD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
32 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Alfa liponzuur voor symptomatische perifere neuropathie bij patiënten met diabetes: een meta-analyse van gerandomiseerde gecontroleerde onderzoeken. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
33 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. Curatief effect van alfa-liponzuur op perifere neuropathie bij diabetes type 2: een klinische studie. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
34 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant alpha-lipoic acid. Een multicentrisch gerandomiseerd gecontroleerd onderzoek van 3 weken (ALADIN-studie). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
35 Winkler G, Kempler P. Pathomechanism of diabetic neuropathy: background of the pathogenesis-oriented therapy. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
36 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamine B voor de behandeling van perifere neuropathie. Cochrane Database Syst Rev 2008: CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573.pub3]
37 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dose regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
38 Loupakis F, Cremolini C, Masi G, Lonardi S, Zagonel V, Salvatore L, Cortesi E, Tomasello G, Ronzoni M, Spadi R, Zaniboni A, Tonini G, Buonadonna A, Amoroso D, Chiara S, Carlomagno C, Boni C, Allegrini G, Boni L, Falcone A. Eerste therapie met FOLFOXIRI en bevacizumab voor uitgezaaide colorectale kanker. N Engl J Med 2014; 371: 1609-1618 [PMID: 25337750 DOI: 10.1056/ NEJMoa1403108]
39 Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission. Cancer Res 2009; 69: 7507-7511 [PMID: 19752085 DOI: 10.1158/0008-5472.can-09-2994]
40 Cao A, Li Q, Yin P, Dong Y, Shi H, Wang L, Ji G, Xie J, Wu D. Curcumine induceert apoptose in humaan maagcarcinoom AGS-cellen en coloncarcinoom HT-29-cellen via mitochondriale disfunctie en endoplasmatische reticulumstress. Apoptosis 2013; 18: 1391-1402 [PMID: 23881281 DOI: 10.1007/s10495-013-0871-1]
41 Wynn ML, Consul N, Merajver SD, Schnell S. Inferring the Effects of Honokiol on the Notch Signaling Pathway in SW480 Colon Cancer Cells. Cancer Inform 2014; 13: 1-12 [PMID: 25392689 DOI: 10.4137/CIN.S14060]
42 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Dichlooracetaat beïnvloedt de proliferatie maar niet de overleving van menselijke colorectale kankercellen. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
43 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/s10549-009-0435-9]
44 Sánchez-Aragó M, Chamorro M, Cuezva JM. Selection of cancer cells with repressed mitochondria triggers colon cancer progression. Carcinogenesis 2010; 31: 567-576 [PMID: 20080835 DOI: 10.1093/ carcin/bgq012]
45 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismand species-dependent inactivation of glutathione transferase zeta by dichloroacetate. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]
Gerelateerde inhoud: