Akbar Khan, Doug Andrews, Anneke C Blackburn
Akbar Khan, Douglas Andrews, Medicor Cancer Centres Inc., Toronto, ON M2N 6N4, Canadá
Anneke C Blackburn, The John Curtin School of Medical Research, The Australian National University, Canberra, ACT 2601, Australia
Contribución de los autores: Khan A trató al paciente y escribió la mayor parte del informe del caso; Andrews D trató al paciente, diseñó los protocolos de terapia natural y coescribió el informe del caso; Blackburn AC realizó trabajos in vitro e in vivo que demostraron los efectos del DCA como agente citostático y escribió las partes del informe del caso que tratan sobre la investigación in vitro e in vivo del DCA.
Declaración de la junta de revisión institucional: No procede.
Declaración de consentimiento informado: La paciente descrita en este manuscrito ha dado su consentimiento para publicar su caso de forma anónima.
Declaración de conflicto de intereses: Uno de los autores (Khan) administra la terapia con dicloroacetato a pacientes con cáncer a través de Medicor Cancer Centres a coste cero y sin ánimo de lucro. La clínica es propiedad de un familiar de este autor. Los demás autores no tienen nada que revelar.
Acceso abierto: Este artículo es un artículo de acceso abierto que fue seleccionado por un editor interno y revisado en su totalidad por revisores externos. Se distribuye de acuerdo con la licencia Creative Commons Reconocimiento No Comercial (CC BY-NC 4.0), que permite a otros distribuir, remezclar, adaptar, construir sobre esta obra sin fines comerciales, y licenciar sus obras derivadas en diferentes términos, siempre que la obra original se cite correctamente y el uso no sea comercial. Véase: http://creativecommons.org/licenses/by-nc/4.0/
Fuente del manuscrito: Manuscrito invitado
Correspondencia a: Akbar Khan, MD, Director Médico,
Medicor Cancer Centres Inc., 4576 Yonge St., Suite 301, Toronto,
ON M2N 6N4, Canadá. [email protected]
Teléfono: +1-416-2270037
Fax: +1-416-2271915
Recibido: 30 de abril de 2016
Revisión por pares iniciada: 3 de mayo de 2016
Primera decisión: 17 de junio de 2016
Revisado: 23 de julio de 2016
Aceptado: 6 de agosto de 2016
Artículo en prensa: 8 de agosto de 2016
Publicado en línea: 16 de octubre de 2016
Resumen
El dicloroacetato sódico (DCA) oral se ha investigado como terapia metabólica novedosa para varios tipos de cáncer desde 2007, basándose en los datos de Bonnet et al de que el DCA puede desencadenar la apoptosis de células humanas de cáncer de pulmón, mama y cerebro. La respuesta a la terapia en estudios con humanos se mide según los criterios estándar de evaluación de la respuesta para definiciones de tumores sólidos, que definen la «respuesta» por el grado de reducción del tumor, o la desaparición del tumor en las imágenes.
Sin embargo, Blackburn et al han demostrado que el DCA también puede actuar como agente citostático in vitro e in vivo , sin causar apoptosis (muerte celular programada). Se presenta un caso en el que la terapia oral con DCA dio lugar a la estabilización del cáncer de colon en estadio 4 en una mujer de 57 años durante un período de casi 4 años, sin toxicidad grave. Dado que la historia natural del cáncer de colon en estadio 4 consiste en una progresión constante que conduce a la discapacidad y la muerte, este caso pone de relieve un nuevo uso del DCA como agente citostático con potencial para mantener la estabilidad a largo plazo del cáncer en estadio avanzado.
Palabras clave: Dicloroacetato; Cáncer; Colon; Colorrectal; Citostático; Estabilización; Inhibición del crecimiento; Intravenoso
© El autor (es) 2016. Publicado por Baishideng Publishing Group Inc. Todos los derechos reservados.
Sugerencia principal: El dicloroacetato sódico (DCA) oral se ha investigado como una terapia metabólica novedosa para varios tipos de cáncer. La respuesta a la terapia en los estudios en humanos se mide mediante los criterios de evaluación de respuesta estándar para las definiciones de tumores sólidos, que definen la «respuesta» por el grado de reducción del tumor, o la desaparición del tumor en las imágenes.
Sin embargo, el DCA también puede actuar como agente citostático, sin causar apoptosis (muerte celular programada). Se presenta un caso en el que la terapia oral con DCA dio lugar a la estabilización tumoral de un cáncer de colon en estadio 4 en una mujer de 57 años durante un periodo de casi 4 años, sin toxicidad grave.
Khan A, Andrews D, Blackburn AC. Estabilización a largo plazo del cáncer de colon en estadio 4 mediante terapia con dicloroacetato de sodio. World J Clin Cases 2016; 4(10): 336-343
Disponible en: URL: http://www.wjgnet.com/2307-8960/full/v4/i10/336.htm
DOI: http://dx.doi.org/10.12998/wjcc.v4.i10.336
INTRODUCCIÓN
El fármaco dicloroacetato sódico (DCA) se ha investigado como terapia metabólica novedosa para varios tipos de cáncer desde 2007, cuando Bonnet et al[ 1] publicaron un estudio combinado in vitro/in vivo en ratas que demostraba la eficacia del DCA en el tratamiento de cánceres humanos de pulmón, mama y cerebro mediante la inhibición de la piruvato deshidrogenasa cinasa mitocondrial. Stacpoole et al[2-4] habían publicado previamente múltiples estudios con DCA para el tratamiento de la acidosis láctica congénita, compuesta por un conjunto de enfermedades mitocondriales hereditarias[5].
Estos estudios establecieron el perfil de seguridad del DCA oral en humanos. Se descubrió que el DCA es un fármaco seguro, sin toxicidad cardiaca, pulmonar, renal ni para la médula ósea[4]. El efecto secundario común más grave es la neuropatía periférica, que es reversible[6]. Se ha descrito delirio, que es reversible tras la interrupción del DCA[7]. En un pequeño porcentaje de pacientes se ha notificado una elevación asintomática y reversible de las enzimas hepáticas[3].
El trabajo previo en acidosis láctica congénita ha permitido la rápida progresión del DCA a la clínica del cáncer. Ya se han publicado cuatro informes de ensayos clínicos oncológicos con DCA, lo que indica un creciente reconocimiento de la utilidad potencial del DCA[8-11]. Sin embargo, estos ensayos, en los que se trataba a pacientes en estadios avanzados, sólo han podido informar sobre el tratamiento durante periodos de tiempo relativamente cortos.
En el artículo inicial de 2007 de Bonnet et al[1], se informó de que el DCA reducía el potencial de la membrana mitocondrial, lo que provocaba una apoptosis selectiva en las células cancerosas. El mecanismo identificado fue la inhibición de la glucólisis aeróbica (el efecto Warburg) y la activación de los canales de iones de potasio mitocondriales[1].
Otras investigaciones sobre el DCA confirmaron su actividad anticancerígena en varios tipos de cáncer, como el de colon[12], próstata[13], ovario[14], neuroblastoma[15], carcinoide de pulmón[16], cuello uterino[17], endometrio[18], colangiocarcinoma[19], sarcoma[20 ] y linfoma de células T[21].
También se han sugerido otras acciones antineoplásicas del DCA. Estas incluyen el bloqueo de la angiogénesis[22], cambios en la expresión de HIF1-α[23], alteración de los reguladores del pH V-ATPasa y MCT1, y otros reguladores de la supervivencia celular como PUMA, GLUT1, Bcl2 y p53[24].
Sin embargo, en la búsqueda de actividad citotóxica, muchos informes in vitro utilizan concentraciones de DCA que es poco probable que se alcancen clínicamente[25]. Algunos estudios han utilizado concentraciones restringidas y han descubierto que el DCA es citostático más que citotóxico, pero capaz de potenciar la apoptosis con otros agentes[26-28].
En el informe sobre el éxito del tratamiento in vivo con DCA del cáncer de mama, Sun et al[26] descubrieron que el DCA era citostático, inhibiendo la proliferación sin aumentar la apoptosis. El DCA fue capaz de reducir significativamente la carga metastásica en los pulmones de ratas en un modelo in vivo altamente metastásico de cáncer de mama. Esto sugiere un nuevo papel del DCA como agente estabilizador del cáncer, similar a una terapia antiangiogénica.
Sin embargo, que los autores sepan, aún no se han publicado datos en humanos que respalden el uso del DCA para el mantenimiento a largo plazo de la enfermedad estable. A raíz de la innovadora publicación de Bonnet sobre el DCA, a principios de 2007, Khan inició el uso clínico del DCA para tratar a pacientes con cáncer de mal pronóstico o que no respondían a las terapias oncológicas aprobadas.
En colaboración con un médico naturópata (Andrews), se desarrolló un protocolo de medicamentos naturales para tratar la toxicidad neurológica que limitaba la dosis. El régimen oral de DCA que se desarrolló incluía tres medicamentos naturales acetil L-carnitina[29-31], ácido R-alfa lipoico[32-34] y benfotiamina[35-37], con el propósito principal de prevenir la neuropatía.
Los datos observacionales recogidos de más de 300 pacientes con cáncer y enfermedad avanzada revelaron beneficios mensurables del tratamiento con ACA en el 60%-70% de los casos. El riesgo de neuropatía con la inclusión de agentes neuroprotectores naturales fue de aproximadamente el 20% con una dosis de 20-25 mg/kg al día en un ciclo de 2 semanas de inicio y 1 semana de finalización. Se observó una elevación reversible de las enzimas hepáticas en aproximadamente el 2% de este grupo de pacientes (datos de observación clínica publicados en línea en www.medicorcancer.com).
Se presenta el caso de un paciente que ilustra los efectos citostáticos del tratamiento oral con DCA mantenido durante varios años. Este paciente tenía un mal pronóstico (mediana de supervivencia de 9-12 meses para cáncer colorrectal en estadio 4 utilizando quimioterapia paliativa convencional agresiva)[38]. El paciente fue tratado por Khan en colaboración con el médico naturópata Andrews, que desarrolló un protocolo compuesto por agentes neuroprotectores naturales.
INFORME DEL CASO
Una mujer de 57 años acudió a la clínica del autor (Khan) en marzo de 2012 en busca de tratamiento para un cáncer colorrectal metastásico. La paciente fue diagnosticada originalmente de cáncer rectal a mediados de 2010, cuando consultó a su médico por un nuevo estreñimiento y dolor lumbar. Se intentó realizar una colonoscopia, pero no se pudo avanzar el colonoscopio debido a la presencia de un tumor rectal parcialmente obstructivo. La biopsia confirmó un adenocarcinoma colorrectal moderadamente diferenciado.
La tomografía computarizada (TC) realizada en ese momento demostró enfermedad en estadio 4 con múltiples metástasis hepáticas de hasta 3 cm de diámetro, posibles metástasis pulmonares diminutas y un carcinoma rectal anular que no era fácil de medir (los márgenes del cáncer eran difíciles de distinguir de los tejidos circundantes en la TC).
La paciente fue sometida a una ileostomía en asa para evitar la obstrucción y no se extirpó el tumor rectal. Tras la cirugía se administró quimioterapia con 5-fluorouracilo, irinotecán, leucovorina y bevacizumab (FOLFIRI + bevacizumab). Inicialmente, la paciente respondió a la quimioterapia con una reducción de las metástasis hepáticas, una reducción de la lesión rectal primaria y una reducción del marcador de antígeno carcinoembrionario (CEA) en sangre de 260,9 ng/mL antes de la quimioterapia a 3,5 ng/mL justo antes del inicio del tratamiento con DCA. A continuación, la respuesta a la quimioterapia comenzó a estabilizarse. En el momento en que la paciente acudió a la consulta de la autora, la quimioterapia estaba causando una reducción mínima de la enfermedad, y esencialmente sólo mantenía la estabilidad.
La paciente estaba sana y había fumado durante 20 años. Consumía alcohol ocasionalmente. Tenía antecedentes familiares positivos de cáncer de colon y cáncer gástrico. La medicación incluía la quimioterapia en curso descrita, enemas de peróxido de hidrógeno, vitamina C oral, vitamina D oral ocasional, hidromorfona de liberación prolongada 32 mg dos veces al día, e hidromorfona de acción corta 2-4 mg por vía oral según fuera necesario para el dolor «irruptivo». No hubo alergias.
La investigación funcional reveló algunas úlceras bucales leves relacionadas con la quimioterapia en curso, diarrea leve (esperada con una ileostomía) y sangrado rectal intermitente leve. Había dolor/ardor en la parte baja de la espalda y dolor sacro de una intensidad de hasta 6 sobre 10, y dolor leve en la punta del hombro derecho exacerbado por la quimioterapia (que se consideraba dolor referido relacionado con las metástasis hepáticas).
Dado que la quimioterapia seguía siendo eficaz y la paciente no experimentaba efectos secundarios graves, el planteamiento inicial fue apoyar la terapia existente de la paciente, no sustituirla. Se elaboró un plan integrador en colaboración con un médico naturópata (Andrews).
El plan consistía en la adición de dosis altas de vitamina D oral a 10 000 unidades internacionales por día, un cambio de vitamina C oral a vitamina C 50 g intravenosa (i.v.) semanalmente, y la adición de dicloroacetato sódico (DCA) 3000 mg i.v. (49 mg/kg) semanalmente (fabricante: Tokyo Chemical Industry, Estados Unidos). Para reducir el riesgo de efectos secundarios del DCA, se prescribieron 3 suplementos naturales: Ácido alfa lipoico (racémico) 500 mg i.v. con cada dosis de DCA, ácido R-alfa lipoico oral 150 mg 3 veces al día, acetil L-carnitina oral 500 mg 3 veces al día y benfotiamina oral 80 mg 2 veces al día.
Las infusiones se planificaron alrededor de las infusiones de quimioterapia (separadas al menos 2 días de la quimioterapia) para evitar cualquier interferencia o interacción farmacológica potencial. El ácido lipoico no se administró en los días de quimioterapia, ni 1 día antes o después de la quimioterapia, ya que es un potente antioxidante y puede reducir la eficacia de la quimioterapia. La terapia integrativa comenzó en marzo de 2012. No se observaron efectos secundarios, por lo que se aumentó el DCA a 4000 mg i.v. (66 mg/kg) semanales. El único efecto secundario observado con la dosis más alta de DCA fue una sedación leve tras la infusión.
Tabla 1 Análisis de sangre antes del tratamiento con dicloroacetato sódico
| Análisis de sangre | Valor | Unidades | Rango normal |
|---|---|---|---|
| Hemoglobina | 131 | g/L | 115-155 |
| Recuento de glóbulos blancos | 6.5 | ×109/L | 4.0-11.0 |
| Plaquetas | 202 | ×109/L | 145-400 |
| Glucosa | 5.9 | mmol/L | 2.6-7.0 |
| Urea | 6.5 | mmol/L | 2.5-8.1 |
| Creatinina | 64 | μmol/L | 50-100 |
| Calcio | 2.38 | mmol/L | 2.20-2.65 |
| Albúmina | 43 | g/L | 35-52 |
| Bilirrubina | 15 | μmol/L | < 23 |
| Sodio | 140 | mmol/L | 136-146 |
| Potasio | 4.2 | mmol/L | 3.7-5.4 |
| Cloruro | 102 | mmol/L | 95-108 |
| Fosfatasa alcalina | 1861 | U/L | 35-122 |
| LDH | 167 | U/L | 110-215 |
| GGT | 3641 | U/L | < 36 |
| AST | 331 | U/L | < 31 |
| ALT | 31 | U/L | < 36 |
Se añadió metformina oral para ayudar a sensibilizar el cáncer a la quimioterapia, empezando con 500 mg por vía oral una vez al día y aumentando hasta 500 mg 3 veces al día[39]. Se añadió pregabalina para ayudar a controlar el dolor sacro neuropático (se empezó con 50 mg al día, titulados hasta 50 mg 3 veces al día). Los efectos secundarios de la quimioterapia incluyeron náuseas y vómitos (antes del inicio de la metformina), y se omitió la metformina los días en que la paciente se encontraba mal para evitar una posible toxicidad, en caso de que la paciente se deshidratara.
Se obtuvieron análisis de sangre basales rutinarios, incluidos recuentos celulares completos, panel metabólico estándar, enzimas hepáticas y bilirrubina (Tabla 1). Se disponía de una tomografía computarizada de referencia, que se había realizado 2 meses antes del inicio de la terapia integradora con DCA.
Tras 4 meses de terapia integrativa como se ha descrito, se realizó un nuevo TAC (Figura 1), que se informó como «estable y sin cambios», pero no se dieron mediciones. Se observó un hallazgo incidental de un cálculo biliar (también estable desde la exploración anterior). El paciente se sintió frustrado porque no se observaba ninguna mejoría y en el informe del TAC no se indicaban mediciones detalladas. Se intentó obtener una tomografía por emisión de positrones para aclarar si se trataba de tumores vivos o necróticos, pero no se pudo obtener financiación pública y la paciente se negó a pagar la tomografía de forma privada.
Tras debatirlo, la paciente decidió continuar con el tratamiento y someterse a futuras tomografías en otro hospital. En septiembre de 2012, se observó un aumento de los efectos secundarios de la quimioterapia, como fatiga, náuseas y vómitos. Un nuevo TAC reveló que todas las lesiones hepáticas eran «más pequeñas o ya no se identificaban». Sin embargo, la mayor reducción tumoral fue de solo 2 mm (la lesión marcadora de 2,5 cm en el segmento hepático 4a se redujo a 2,3 cm). No se identificaron nuevas lesiones.
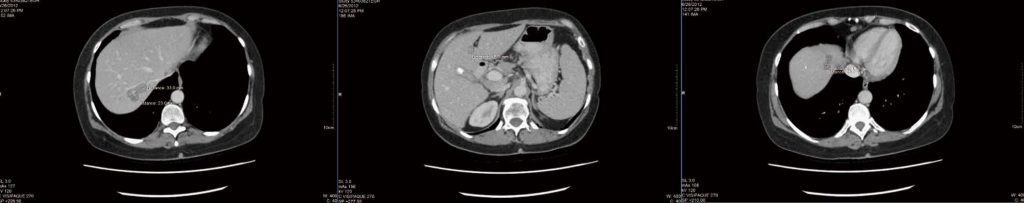
.
Tabla 2 Panel sanguíneo durante la terapia con dicloroacetato sódico, enero de 2013
| Análisis de sangre | Valor | Unidades | Rango normal |
|---|---|---|---|
| Hemoglobina | 134 | g/L | 115-155 |
| Recuento de glóbulos blancos | 5.1 | ×109/L | 4.0-11.0 |
| Plaquetas | 1421 | ×109/L | 145-400 |
| Glucosa | 5.5 | mmol/L | 2.6-7.0 |
| Urea | 4.1 | mmol/L | 2.5-8.1 |
| Creatinina | 57 | μmol/L | 50-100 |
| Calcio | 2.24 | mmol/L | 2.20-2.65 |
| Albúmina | 39 | g/L | 35-52 |
| Bilirrubina | 11 | μmol/L | < 23 |
| Sodio | 140 | mmol/L | 136-146 |
| Potasio | 4.2 | mmol/L | 3.7-5.4 |
| Cloruro | 106 | mmol/L | 95-108 |
| Fosfatasa alcalina | 2671 | U/L | 35-122 |
| LDH | 183 | U/L | 110-215 |
| GGT | 8371 | U/L | < 36 |
| AST | 1041 | U/L | < 31 |
| ALT | 100 | U/L | < 36 |
Tras la revisión del TAC, la paciente decidió suspender toda la quimioterapia, así como el bevacizumab y la metformina. Se continuó con DCA i.v. y se aumentó la dosis a 4500 mg i.v. semanales. Las náuseas y los vómitos se resolvieron. El dolor permaneció bajo control.
Se realizó un nuevo TAC a los 3 meses, que mostró tumor rectal residual con estenosis y carga fecal proximal (sin cambios), y «metástasis hepáticas, sin cambios significativos». La paciente refirió adormecimiento leve de los dedos de manos y pies. Hubo un nuevo aumento de las elevaciones asintomáticas de las enzimas hepáticas (Tabla 2). Ambos fueron diagnosticados como efectos secundarios del DCA. Durante el tratamiento hasta ese momento, el ACE había mostrado ligeras fluctuaciones, pero se consideraba estable en general (Figura 2).
El tratamiento con DCA se interrumpió durante 3 meses para permitir la resolución de los efectos secundarios del DCA
Durante este tiempo, sólo se administraron terapias naturales (prescritas por Andrews). Se continuó con acetil L-carnitina, benfotiamina y ácido alfa lipoico para acelerar la recuperación de la neuropatía por DCA. Se añadieron curcumina oral[40] y honokiol (extracto del árbol de magnolia) en un intento de mantener el control del cáncer[41]. Durante el periodo en que se suspendió el DCA, el CEA aumentó de 4,1 a 5,1 ng/mL (Figura 2). La neuropatía leve por DCA se había resuelto y las enzimas hepáticas empezaron a mejorar.
En marzo de 2013, debido a la preocupación por el coste de la terapia de infusión, se decidió comenzar la terapia oral con DCA. Un nuevo TAC basal demostró un aumento de 1 mm en una lesión marcadora del segmento hepático 7, y un aumento de 1 mm en un ganglio linfático aortocava marcador, pero se informó de «aspecto estable del colon» y «metástasis hepáticas estables».
Se inició DCA oral a una dosis de 500 mg (8,2 mg/kg) dos veces al día, y se continuó con suplementos neuroprotectores consistentes en acetil L-carnitina oral, benfotiamina y ácido R-alfa lipoico. Los suplementos se administraron de forma continua, y el DCA se administró en un ciclo de 2 semanas sí/ 1 semana no.
En diciembre de 2013, la medicación para el dolor pasó de hidromorfona a metadona 10 mg 3 veces al día, por simplicidad, mejor control del dolor y ahorro de costes.
El paciente continuó en este régimen con tomografías computarizadas regulares cada 3 a 6 meses. La paciente dejó de cumplir con los análisis de sangre regulares debido a su apretada agenda laboral. Siguió siendo muy funcional (nivel ECOG 1) con una neuropatía crónica leve por DCA que estaba controlada y no afectaba a su función diaria.
Se intentó aumentar el DCA a 500 mg 3 veces al día, pero esto provocó una elevación asintomática significativa de las enzimas hepáticas y un aumento de la neuropatía. Como resultado, se reanudó una dosis de DCA de 500 mg dos veces al día tras una breve interrupción del tratamiento.
Los TAC continuados siguieron revelando una enfermedad estable (figura 3), sin que aparecieran nuevas lesiones. El ACE global no había cambiado significativamente desde el inicio del tratamiento con DCA (ACE de 3,5 al inicio del tratamiento con DCA, a ACE de 3,7 tras casi 4 años de tratamiento). El cuadro hemático general también fue favorable a los 3 años (tabla 3) y a los 4 años (tabla 4).
En resumen, después de recibir quimioterapia convencional durante aproximadamente 18 meses, la paciente recibió tratamiento con DCA intravenoso con quimioterapia simultánea durante aproximadamente 6 meses, seguido de tratamiento con DCA intravenoso y oral sin tratamiento oncológico convencional simultáneo durante casi 4 años. Durante el tratamiento con DCA oral, la paciente experimentó una enfermedad estable en las tomografías computarizadas y en la medición del marcador tumoral CEA. También se mantuvo clínicamente estable, sin aumento de la dosis de metadona, con mantenimiento de la función en el nivel 1 del ECOG, neuropatía leve estable por DCA, y pudo dirigir su propio negocio con éxito.
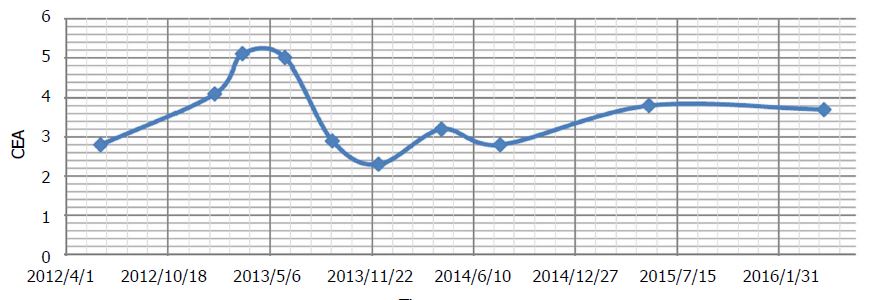
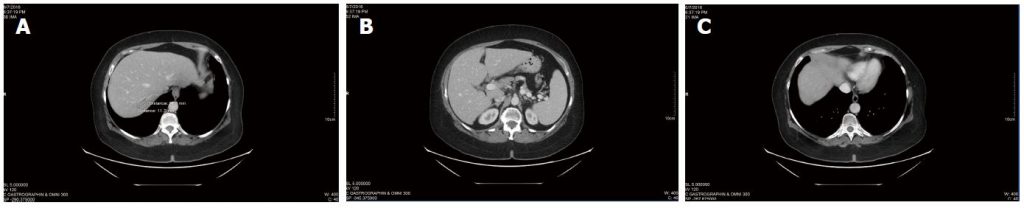
Tabla 3 Análisis de sangre durante la terapia con dicloroacetato sódico, mayo de 2015
| Análisis de sangre | Valor | Unidades | Rango normal |
|---|---|---|---|
| Hemoglobina | 134 | g/L | 115-155 |
| Recuento de glóbulos blancos | 7.7 | ×109/L | 4.0-11.0 |
| Plaquetas | 173 | ×109/L | 145-400 |
| Glucosa | 5.3 | mmol/L | 2.6-7.0 |
| Urea | 5.1 | mmol/L | 2.5-8.1 |
| Creatinina | 70 | μmol/L | 50-100 |
| Calcio | 2.37 | mmol/L | 2.20-2.65 |
| Albúmina | – | g/L | 35-52 |
| Bilirrubina | 8 | μmol/L | < 23 |
| Sodio | 144 | mmol/L | 136-146 |
| Potasio | 4.1 | mmol/L | 3.7-5.4 |
| Cloruro | 104 | mmol/L | 95-108 |
| Fosfatasa alcalina | – | U/L | 35-122 |
| LDH | 174 | U/L | 110-215 |
| GGT | 1561 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 25 | U/L | < 36 |
Tabla 4 Análisis de sangre durante el tratamiento con dicloroacetato sódico, abril de 2016
| Análisis de sangre | Valor | Unidades | Rango normal |
|---|---|---|---|
| Hemoglobina | 133 | g/L | 115-155 |
| Recuento de glóbulos blancos | 5.2 | ×109/L | 4.0-11.0 |
| Plaquetas | 155 | ×109/L | 145-400 |
| Glucosa | – | mmol/L | 2.6-7.0 |
| Urea | 4.9 | mmol/L | 2.5-8.1 |
| Creatinina | – | μmol/L | 50-100 |
| Calcio | 2.39 | mmol/L | 2.20-2.65 |
| Albúmina | 42 | g/L | 35-52 |
| Bilirrubina | 9 | μmol/L | < 23 |
| Sodio | 142 | mmol/L | 136-146 |
| Potasio | 4 | mmol/L | 3.7-5.4 |
| Cloruro | 102 | mmol/L | 95-108 |
| Fosfatasa alcalina | 101 | U/L | 35-122 |
| LDH | 156 | U/L | 110-215 |
| GGT | 1491 | U/L | < 36 |
| AST | 30 | U/L | < 31 |
| ALT | 28 | U/L | < 36 |
DISCUSIÓN
Este caso de tratamiento con DCA en un paciente con cáncer de colon avanzado en estadio 4 demuestra una enfermedad estable a largo plazo según criterios clínicos, bioquímicos y radiológicos.
La duración de la estabilidad mientras recibía DCA sin otra quimioterapia activa es actualmente de 46 meses (casi 4 años), con un tiempo de supervivencia desde el diagnóstico inicial de cáncer colorrectal en estadio 4 de 6 años.
Según la revisión de las estadísticas de cáncer SEER del Instituto Nacional del Cáncer de 1975 a 2011, la tasa de supervivencia relativa a 5 años para las mujeres diagnosticadas de cáncer de colon/recto en estadio IV fue del 14,4% (http://seer.cancer.gov/csr/1975_2013/). Aunque no se puede concluir definitivamente que el DCA haya sido eficaz, la supervivencia durante este periodo de tiempo en ausencia de quimioterapia en curso sería de una probabilidad relativamente baja.
Se han descrito efectos citostáticos más que citotóxicos del DCA en las células cancerosas colorrectales y de otros tipos, lo que respalda este hallazgo clínico[23,27,42-44]. Hasta la fecha, la paciente sigue clínicamente bien y continúa en tratamiento con DCA.
Además del mantenimiento de la enfermedad estable, este caso demuestra la tolerabilidad del DCA oral en un paciente con cáncer durante periodos de tiempo mucho más prolongados que los que se registran actualmente en los ensayos clínicos publicados en pacientes con cáncer. Chu et al[11] informaron sobre 24 pacientes tratados durante una mediana de tiempo de 2 meses con 6,25 o 12,5 mg/kg BID, con DCA oral continuo sin suplementos neuroprotectores.
Llegaron a la conclusión de que la dosis recomendada en la fase 2 era de 6,25 mg/kg BID (12,5 mg/kg al día), siendo necesario un seguimiento cuidadoso de la neuropatía. Dunbar et al[9] recomendaron 5 mg/kg BID como dosis inicial para la mayoría de los pacientes, y en su ensayo administraron 4, 8 o 12,5 mg/kg BID de forma continua (mediana de tiempo con DCA 34 d), también sin suplementos neuroprotectores.
El paciente de este informe tomó 500 mg BID, equivalentes a 8,2 mg/kg BID, 2 semanas sí/1 semana no, pero no pudo tolerar esta dosis tres veces al día (total de 25 mg/kg al día). Dunbar et al[9] sugieren que el genotipado para polimorfismos en GSTZ1, la enzima metabolizadora del DCA en el hígado que se inactiva con el uso continuado de DCA[45], debería tenerse en cuenta a la hora de determinar la dosis inicial para los pacientes.
Sin embargo, es necesario seguir trabajando para reunir un número convincente de genotipos y datos sobre la tolerancia a la dosis. Actualmente se está llevando a cabo un ensayo clínico de DCA en pacientes con mieloma múltiple para contribuir a este conjunto de datos (Australia New Zealand Clinical Trials Register #ACTRN12615000226505, http://www.anzctr.org.au).
Se necesitan más estudios para determinar el régimen de dosificación óptimo para el tratamiento agudo o crónico máximo tolerable con DCA y, de hecho, qué dosis se requiere para la eficacia.
El caso presentado indica que el DCA es muy prometedor como terapia contra el cáncer. La paciente obtuvo un beneficio significativo de su terapia, con efectos secundarios leves y sin toxicidad hematológica, cardiaca, pulmonar o renal. Se observó cierta toxicidad hepática (Tabla 2), que se controló fácilmente mediante la interrupción del tratamiento con DCA seguida de un ajuste de la dosis.
Se notificó una leve neurotoxicidad periférica reversible. Las terapias naturales que se combinaron con el DCA (acetil L-carnitina, ácido alfa lipoico y benfotiamina) ayudaron al paciente a reducir los efectos secundarios, pero no se sabe que funcionen como terapias contra el cáncer.
En el momento de escribir estas líneas, no existen ensayos clínicos activos que investiguen el uso humano del DCA como agente citostático. Debido al hecho de que el DCA no está patentado, la recaudación de fondos adecuados para apoyar ensayos a gran escala en humanos es un serio desafío. Se espera que este caso que ejemplifica los beneficios del DCA oral estimule una mayor investigación clínica.
Basándonos en nuestra experiencia clínica, combinada con las publicaciones existentes, la terapia con DCA fuera de patente es una opción para pacientes con tratamientos convencionales disponibles limitados, una vez que comprenden y aceptan los riesgos y beneficios de la terapia.
Este caso clínico demuestra que, incluso en estadios avanzados de la enfermedad, el DCA tiene el potencial de prolongar la vida sin afectar a la calidad de vida del paciente, en comparación con la quimioterapia, con sus frecuentes efectos secundarios debilitantes o el compromiso de la función fisiológica. Dado su coste razonable y su modesta toxicidad, el DCA merece una mayor investigación.
AGRADECIMIENTOS
Los autores desean dar las gracias a la Dra. Humaira Khan por su ayuda, y también a la paciente por su apoyo y consentimiento para publicar su caso.
COMENTARIOS
Características del caso
La paciente, de 57 años de edad, se presentó con estreñimiento y dolor lumbar.
Diagnóstico clínico
La paciente fue diagnosticada de un cáncer rectal parcialmente obstructivo
Diagnóstico de laboratorio
Marcador tumoral de antígeno carcinoembrionario elevado.
Diagnósticopor imagen
Masa rectal observada en la colonoscopia de colon.
Diagnósticopatológico
Adenocarcinoma colorrectal moderadamente diferenciado
Tratamiento
Ileostomía en asa seguida de quimioterapia consistente en 5-fluorouracilo, irinotecán, leucovorina y bevacizumab, luego adición de dicloroacetato sódico (DCA), luego DCA sin quimio durante casi 4 años.
Informes relacionados
Los informes de tomografía computarizada demuestran la reducción del cáncer con quimioterapia combinada + DCA, luego enfermedad estable durante casi 4 años con DCA y sin quimio.
Explicación del término
DCA: Dicloroacetato sódico; RECIST: Criterios de evaluación de la respuesta en tumores sólidos; ECOG: Eastern cooperative oncology group; SEER: Surveillance, epidemiology and end results.
Experiencias y enseñanzas
El DCA no sólo es un fármaco proapoptótico, sino que también puede actuar como agente citostático, por lo que puede lograr la estabilización a largo plazo del cáncer avanzado sin efectos secundarios graves, como ilustra este caso de cáncer rectal
Peer-review
El DCA, la sal sódica del dicloroacetato, es un compuesto químico barato que ha mostrado cierto potencial claro como tratamiento alternativo del cáncer, que se ha utilizado en varios ensayos con personas que padecían cáncer cerebral, o glioblastoma. Este es un informe de un caso bien escrito en el que la terapia oral con DCA resultó en la estabilización del tumor de cáncer de colon en estadio 4 en una mujer de 57 años durante un período de más de 3 años, sin toxicidad grave. Este informe cumple lo que promete.
Los autores hacen un trabajo sólido al explicar los fundamentos de la terapia con DCA y su papel en diferentes tipos de tumores. Junto con la adición de los mecanismos de acción contra las células cancerosas y el potencial terapéutico del DCA, los autores proporcionan un buen recurso para los lectores que están más poco familiarizados con la terapia DCA, pero también proporcionan detalles.
REFERENCIAS
1 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37-51 [PMID: 17222789 DOI: 10.1016/j.ccr.2006.10.020]2 Stacpoole PW, Kurtz TL, Han Z, Langaee T. Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 2008; 60: 1478-1487 [PMID: 18647626 DOI: 10.1016/ j.addr.2008.02.014]
3 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ. Evaluación del tratamiento a largo plazo de niños con acidosis láctica congénita con dicloroacetato. Pediatrics 2008; 121: e1223-e1228 [PMID: 18411236 DOI: 10.1542/peds.2007-2062]
4 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 2006; 117: 1519-1531 [PMID: 16651305 DOI: 10.1542/peds.2005-1226]
5 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW. Potencial terapéutico del dicloroacetato para la deficiencia del complejo piruvato deshidrogenasa. Mitochondrion 2006; 6: 126-135 [PMID: 16725381 DOI: 10.1016/j.mito.2006.04.001]
6 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, De Vivo DC. El dicloroacetato causa neuropatía tóxica en MELAS: un ensayo clínico aleatorizado y controlado. Neurology 2006; 66: 324-330 [PMID: 16476929 DOI: 10.1212/01. wnl.0000196641.05913.27]
7 Brandsma D, Dorlo TP, Haanen JH, Beijnen JH, Boogerd W. Encefalopatía grave y polineuropatía inducida por dicloroacetato. J Neurol 2010; 257: 2099-2100 [PMID: 20632025 DOI: 10.1007/ s00415-010-5654-9]
8 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Modulación metabólica del glioblastoma con dicloroacetato. Sci Transl Med 2010; 2: 31ra34 [PMID: 20463368 DOI: 10.1126/scitranslmed.3000677]
9 Dunbar EM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW. Ensayo de fase 1 de dicloroacetato (DCA) en adultos con tumores cerebrales malignos recurrentes. Invest New Drugs 2014; 32: 452-464 [PMID: 24297161 DOI: 10.1007/s10637-013-0047-4]
10 Garon EB, Christofk HR, Hosmer W, Britten CD, Bahng A, Crabtree MJ, Hong CS, Kamranpour N, Pitts S, Kabbinavar F, Patel C, von Euw E, Black A, Michelakis ED, Dubinett SM, Slamon DJ. El dicloroacetato debe considerarse con quimioterapia basada en platino en tumores hipóxicos en lugar de como agente único en el cáncer de pulmón de células no pequeñas avanzado. J Cancer Res Clin Oncol 2014; 140: 443-452 [PMID: 24442098 DOI: 10.1007/ s00432-014-1583-9]
11 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, Venner P, Michelakis ED. A phase I open-labeled, single-arm, dose-escalation, study of dichloroacetate (DCA) in patients with advanced solid tumors. Invest New Drugs 2015; 33: 603-610 [PMID: 25762000 DOI: 10.1007/s10637-015-0221-y]
12 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. El dicloroacetato induce la apoptosis y la detención del ciclo celular en células de cáncer colorrectal. Br J Cancer 2010; 102: 1746-1752 [PMID: 20485289 DOI: 10.1038/sj.bjc.6605701]
13 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate 2008; 68: 1223-1231 [PMID: 18465755 DOI: 10.1002/pros.20788]
14 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM, Diamond MP. Dicloroacetato induce la apoptosis de células epiteliales de cáncer de ovario a través de un mecanismo que implica la modulación del estrés oxidativo. Reprod Sci 2011; 18: 1253-1261 [PMID: 21701041 DOI: 10.1177/1 933719111411731]
15 Vella S, Conti M, Tasso R, Cancedda R, Pagano A. Dichloroacetate inhibits neuroblastoma growth by specifically acting against malignant undifferentiated cells. Int J Cancer 2012; 130: 1484-1493 [PMID: 21557214 DOI: 10.1002/ijc.26173]
16 Fiebiger W, Olszewski U, Ulsperger E, Geissler K, Hamilton G. Citotoxicidad in vitro de nuevos fármacos basados en platino y dicloroacetato contra líneas celulares carcinoides de pulmón. Clin Transl Oncol 2011; 13: 43-49 [PMID: 21239354 DOI: 10.1007/s12094-011-0615-z]
17 Liu D, Liu S, Jing X, Li X, Li W, Huang Y. Necrosis of cervical carcinoma by dichloroacetate released from electrospun polylactide mats. Biomaterials 2012; 33: 4362-4369 [PMID: 22425553 DOI: 10.1016/j.biomaterials.2012.02.062]
18 Wong JY, Huggins GS, Debidda M, Munshi NC, De Vivo I. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 2008; 109: 394-402 [PMID: 18423823 DOI: 10.1016/j.ygyno.2008.01.038]
19 Ishiguro T, Ishiguro R, Ishiguro M, Iwai S. Co-tratamiento de dicloroacetato, omeprazol y tamoxifeno exhibió sinérgicamente efecto antiproliferativo en tumores malignos: experimentos in vivo y un informe de caso. Hepatogastroenterology 2012; 59: 994-996 [PMID: 22580646 DOI: 10.5754/hge10507]
20 Sorokina LV, Pyatchanina TV, Didenko GV, Kaplia AA, Khyzhnyak SV. La influencia de dicloroacetato de sodio en los procesos oxidativos en el sarcoma 37. Exp Oncol 2011; 33: 216-221 [PMID: 22217710]
21 Kumar A, Kant S, Singh SM. Novel molecular mechanisms of antitumor action of dichloroacetate against T cell lymphoma: Implicación de la alteración del metabolismo de la glucosa, la homeostasis del pH y la regulación de la supervivencia celular. Chem Biol Interact 2012; 199: 29-37 [PMID: 22705712 DOI: 10.1016/j.cbi.2012.06.005]
22 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS, Michelakis ED. La activación mitocondrial mediante la inhibición de PDKII suprime la señalización de HIF1a y la angiogénesis en el cáncer. Oncogene 2013; 32: 1638-1650 [PMID: 22614004 DOI: 10.1038/onc.2012.198]
23 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. El dicloroacetato de sodio (DCA) reduce la apoptosis en la hipoxia tumoral colorrectal. Cancer Lett 2010; 297: 75-83 [PMID: 20537792 DOI: 10.1016/j.canlet.2010.04.027]
24 Anderson KM, Jajeh J, Guinan P, Rubenstein M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res 2009; 29: 4579-4588 [PMID: 20032407]
25 Kankotia S, Stacpoole PW. Dicloroacetato y cáncer: ¿nuevo hogar para un medicamento huérfano? Biochim Biophys Acta 2014; 1846: 617-629 [PMID: 25157892 DOI: 10.1016/j.bbcan.2014.08.005]
26 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011; 10: 142 [PMID: 22093145 DOI: 10.1186/1476-4598-10-142]
27 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL. Sodium dichloroacetate selectively targets cells with defects in the mitochondrial ETC. Int J Cancer 2010; 127: 2510-2519 [PMID: 20533281 DOI: 10.1002/ijc.25499]
28 Gang BP, Dilda PJ, Hogg PJ, Blackburn AC. Targeting of two aspects of metabolism in breast cancer treatment. Cancer Biol Ther 2014; 15: 1533-1541 [PMID: 25482950 DOI: 10.4161/15384047.2014.955992]
29 De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy- induced peripheral neuropathy: a short review. CNS Drugs 2007; 21 Suppl 1: 39-43; discusión 45-46 [PMID: 17696592]
30 Maestri A, De Pasquale Ceratti A, Cundari S, Zanna C, Cortesi E, Crinò L. A pilot study on the effect of acetyl-L-carnitine in paclitaxel- and cisplatin-induced peripheral neuropathy. Tumori 2005; 91: 135-138 [PMID: 15948540]
31 Evans JD, Jacobs TF, Evans EW. Role of acetyl-L-carnitine in the treatment of diabetic peripheral neuropathy. Ann Pharmacother 2008; 42: 1686-1691 [PMID: 18940920 DOI: 10.1345/aph.1L201]
32 Mijnhout GS, Kollen BJ, Alkhalaf A, Kleefstra N, Bilo HJ. Ácido alfa lipoico para la neuropatía periférica sintomática en pacientes con diabetes: un meta-análisis de ensayos controlados aleatorios. Int J Endocrinol 2012; 2012: 456279 [PMID: 22331979 DOI: 10.1155/2012/456279]
33 Liu F, Zhang Y, Yang M, Liu B, Shen YD, Jia WP, Xiang KS. Curative effect of alpha-lipoic acid on peripheral neuropathy in type 2 diabetes: a clinical study. Zhonghua Yixue Zazhi 2007; 87: 2706-2709 [PMID: 18167250]
34 Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Tratamiento de la neuropatía periférica diabética sintomática con el antioxidante ácido alfa-lipoico. A 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia 1995; 38: 1425-1433 [PMID: 8786016]
35 Winkler G, Kempler P. Pathomechanism of diabetic neuropathy: background of the pathogenesis-oriented therapy. Orv Hetil 2010; 151: 971-981 [PMID: 20519180 DOI: 10.1556/OH.2010.28898]
36 Ang CD, Alviar MJ, Dans AL, Bautista-Velez GG, Villaruz-Sulit MV, Tan JJ, Co HU, Bautista MR, Roxas AA. Vitamina B para el tratamiento de la neuropatía periférica (Revisión Cochrane traducida). Cochrane Database Syst Rev 2008: CD004573 [PMID: 18646107 DOI: 10.1002/14651858.CD004573.pub3]
37 Winkler G, Pál B, Nagybéganyi E, Ory I, Porochnavec M, Kempler P. Effectiveness of different benfotiamine dosage regimens in the treatment of painful diabetic neuropathy. Arzneimittelforschung 1999; 49: 220-224 [PMID: 10219465 DOI: 10.1055/s-0031-1300405]
38 Loupakis F, Cremolini C, Masi G, Lonardi S, Zagonel V, Salvatore L, Cortesi E, Tomasello G, Ronzoni M, Spadi R, Zaniboni A, Tonini G, Buonadonna A, Amoroso D, Chiara S, Carlomagno C, Boni C, Allegrini G, Boni L, Falcone A. Terapia inicial con FOLFOXIRI y bevacizumab para el cáncer colorrectal metastásico. N Engl J Med 2014; 371: 1609-1618 [PMID: 25337750 DOI: 10.1056/ NEJMoa1403108]
39 Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission. Cancer Res 2009; 69: 7507-7511 [PMID: 19752085 DOI: 10.1158/0008-5472.can-09-2994]
40 Cao A, Li Q, Yin P, Dong Y, Shi H, Wang L, Ji G, Xie J, Wu D. Curcumin induces apoptosis in human gastric carcinoma AGS cells and colon carcinoma HT-29 cells through mitochondrial dysfunction and endoplasmic reticulum stress. Apoptosis 2013; 18: 1391-1402 [PMID: 23881281 DOI: 10.1007/s10495-013-0871-1]
41 Wynn ML, Consul N, Merajver SD, Schnell S. Inferring the Effects of Honokiol on the Notch Signaling Pathway in SW480 Colon Cancer Cells. Cancer Inform 2014; 13: 1-12 [PMID: 25392689 DOI: 10.4137/CIN.S14060]
42 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. El dicloroacetato afecta a la proliferación pero no a la supervivencia de las células de cáncer colorrectal humano. Apoptosis 2015; 20: 63-74 [PMID: 25344893 DOI: 10.1007/s10495-014-1046-4]
43 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC. La reversión del fenotipo glucolítico por dicloroacetato inhibe el crecimiento de células de cáncer de mama metastásico in vitro e in vivo. Breast Cancer Res Treat 2010; 120: 253-260 [PMID: 19543830 DOI: 10.1007/s10549-009-0435-9]
44 Sánchez-Aragó M, Chamorro M, Cuezva JM. La selección de células cancerosas con mitocondrias reprimidas desencadena la progresión del cáncer de colon. Carcinogenesis 2010; 31: 567-576 [PMID: 20080835 DOI: 10.1093/ carcin/bgq012]
45 Tzeng HF, Blackburn AC, Board PG, Anders MW. Polymorphismand species-dependent inactivation of glutathione transferase zeta by dichloroacetate. Chem Res Toxicol 2000; 13: 231-236 [PMID: 10775321]
Contenido relacionado: