Кришан Кумар1, Саймон Вигфилд2, Гарриет Э. Ги2,5, Сесилия М. Девлин1, Дин Синглтон2, Джи-Лян Ли2, Франческа Буффа2, Мелани Хаффман1, Энтони Л. Синн3, Джейн Сильвер3, Хелен Турли2, Рассел Лик2, Адриан Л. Харрис2 и Мирча Иван4
1 Медицинский факультет, Университет Индианы, Индианаполис, IN 46202, США
2 Отделение онкологии, Институт молекулярной
медицины Уэзеролла, Оксфордский университет, Больница Джона Рэдклиффа, Оксфорд OX3 9DS, Великобритания
e-mail: [email protected]
In Vivo Therapeutics Core, Университет Индианы, Индианаполис, IN 46202, США
Отделение медицины, иммунологии и микробиологии, Университет Индианы, 980W. Walnut Street, Room C225, Indianapolis, IN 46202, USA
e-mail: [email protected]
5 Отделение радиационной онкологии, Сиднейский онкологический центр, Королевская больница им. принца Альфреда, Кампердаун, Новый Южный Уэльс 2050, Австралия
Получено: 7 ноября 2012 г.
Пересмотрено: 20 декабря 2012 г.
Принято: 2 января 2013 г.
Опубликовано онлайн: 30 января 2013 г
Аннотация
Ингибирование фактора роста эндотелия сосудов увеличивает частоту ответов на химиотерапию и выживаемость без прогрессирования при глиобластоме. Однако неизменно возникает резистентность, что вызывает острую необходимость в выявлении синергических агентов. Одной из возможных стратегий является понимание адаптации опухоли к изменениям микроокружения, вызываемым антиангиогенными препаратами, и тестирование агентов, использующих этот процесс. Мы использовали модель ксенотрансплантата глиобластомы in vivo для побега опухоли при непрерывном лечении бевацизумабом. Клетки U87-MG или U118-MG подкожно имплантировали мышам BALB/c SCID или атимичным мышам nude. Бевацизумаб вводили путем внутрибрюшинной инъекции каждые 3 дня (2,5 мг/кг/доза) и/или дихлорацетат (DCA) вводили перорально дважды в день (50 мг/кг/доза), когда объем опухоли достигал 0,3 см3, и продолжали до тех пор, пока опухоли не достигали приблизительно 1,5-2,0 см3. Анализ микрочипов устойчивых опухолей U87 выявил согласованные изменения на уровне метаболических генов, в частности, увеличивающийся разрыв между гликолизом и митохондриальным дыханием. Через 1 неделю после лечения препаратом наблюдалась высокозначимая разница между U87-MG-имплантированными атимичным мышам nude. Через 2 недели лечения бевацизумаб и DCA вместе резко блокировали рост опухоли по сравнению с любым из препаратов в отдельности. Аналогичные результаты были получены на атимичных голых мышах, имплантированных клетками U118-MG. Мы впервые продемонстрировали, что обратное изменение метаболизма, вызванное бевацизумабом, с помощью DCA негативно сказывается на росте опухоли in vivo. Поскольку DCA рассматривается как перспективный препарат, направленный на метаболизм опухоли, наши данные позволяют своевременно доказать, что сочетание его с антиангиогенной терапией представляет собой мощную антинеопластическую стратегию.
Ключевые слова: Дихлорацетат; гипоксия; бевацизумаб; окислительное фосфорилирование; гликолиз
© Springer-Verlag Berlin Heidelberg 2013
ВВЕДЕНИЕ
Молекулярная терапия, направленная на неоангиогенез и, в частности, на фактор роста эндотелия сосудов (VEGF), показала противоопухолевую активность в различных клинических ситуациях [1]. Глиобластома (ГБМ) является высоко васкуляризированной и смертельно опасной первичной опухолью мозга, медиана выживаемости которой составляет примерно 12-14 месяцев, и поэтому представляет собой важную мишень для антиангиогенных препаратов [2]. Бевацизумаб, гуманизированное анти-VEGF антитело, в настоящее время одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств в качестве препарата второй линии для лечения ГБМ, а проводимые клинические испытания направлены на оценку его потенциала в качестве препарата первой линии [3]. Однако, поскольку блокада VEGF продлевает выживаемость без прогрессирования, но не общую выживаемость, необходимо определить стратегии, которые повышают ее воздействие и задерживают возникновение резистентности [4]. Например, ограниченный прогресс был достигнут в комбинации с иринотеканом; однако не удалось продемонстрировать влияние на общую выживаемость [5]. Одним из основных ограничений в разработке синергетических комбинаций на основе анти-VEGF агентов является отсутствие надежных клинических данных, поскольку опухоли, которые становятся устойчивыми к этим агентам, не доступны для дальнейшего анализа. Более того, клеточные и молекулярные последствия лечения анти-VEGF все еще недостаточно изучены. Подробная информация на молекулярном уровне о том, как бевацизумаб воздействует на ГБМ в течение длительного периода времени, необходима не только для понимания адаптивных реакций опухоли и последующих неудач лечения, но и для разработки рациональной комбинированной терапии.
Поэтому мы попытались определить реакцию опухоли на бевацизумаб на фенотипическом и молекулярном уровне в ксенотрансплантационных моделях, полученных из клеточных линий ГБМ. Расширяя модели до окончательного терапевтического провала, несмотря на непрерывное лечение бевацизумабом, мы стремились зафиксировать адаптивные программы опухоли и соответствующую перестройку молекулярных путей с помощью анализа микрочипов. Мы предположили, что основные механизмы резистентности будут отражены в изменении этих путей, а малые молекулы, которые вмешиваются в эти процессы, представляют собой реальных кандидатов для повышения эффективности бевацизумаба. Биоинформационный анализ показал, что резистентные опухоли демонстрируют сильную подпись фактора, индуцируемого гипоксией (HIF), и сдвиг от митохондриального дыхания к гликолизу. Реактивация митохондриального дыхания с помощью сиротского препарата дихлорацетата (DCA) усиливает преходящий эффект бевацизумаба, в отличие от отсутствия аддитивного эффекта 2-дезоксиглюкозы (2-DG), которая в первую очередь направлена на гликолиз. Наши данные дают представление о пластичности метаболизма опухоли в ответ на терапевтические вызовы и предлагают новые возможности для синергетических вмешательств.
Материалы и методы
Опухолегенность in vivo
Все протоколы проводились в соответствии с требованиями Комитета по уходу и использованию животных при Университете Индианы, а также протоколами и правилами, утвержденными Министерством внутренних дел Великобритании.107 клеток U87-MG (приобретенных у ATCC) были имплантированы 6-8-недельным самкам мышей BALB/c SCID (Harlan Sprague Dawley, Inc.) подкожно в виде 100-мкл клеточной суспензии с равным объемом матригеля (BD Bioscience). Опухоли измеряли дважды в неделю штангенциркулем, а объем рассчитывали по формуле длина × ширина × высота × 0,52. Как только объем опухоли достигал 150 мм3, мышей рандомизировали на две группы с начальным размером когорты по пять мышей в группе и начинали лечение бевацизумабом (Roche), вводимым внутрибрюшинно каждые 3 дня в дозе 10 мг/кг или контрольным физраствором. Лечение продолжали до тех пор, пока опухоли не вырастали примерно до объема 600-800 мм3, после чего мышей подвергали эвтаназии и опухоли быстро иссекали хирургическим путем. Для моделей ксенотрансплантации на атимичных обнаженных мышах клетки U87-МГ имплантировали, как указано выше, 4-8-недельным самкам мышей (Harlan Laboratories, Indianapolis, IN, USA), или прививали 7 ×106 клеток U118-МГ (приобретенных у ATCC). Фрагменты опухоли обрабатывали формалиновой фиксацией перед парафиновой вставкой для IHC или замораживали для последующего выделения РНК, как описано ранее [6].
Протоколы доставки лекарств для комбинированных исследований
DCA вводили через пероральный гаваж дважды в день в дозе 50 мг/кг/доза в стерильной воде (контроль транспортного средства — стерильная вода). Эта доза была основана на опубликованных отчетах и аллометрической шкале. Таким образом, 100 мг/кг на мышь в день означает приблизительно 13 мг/кг у человека (http://home.fuse.net/clymer/minor/allometry.html), что соответствует дозам, используемым в клинических условиях. Бевацизумаб вводили внутрибрюшинно в концентрации 2,5 мг/кг/доза (U87-МГ) или 2,0 мг/кг/доза (U118-МГ). Лечение продолжали до тех пор, пока опухоли не вырастали примерно до 20 мм в диаметре, после чего мышей подвергали эвтаназии и быстро вырезали опухоли. 2-Дезоксиглюкоза (Sigma, 500 мг/кг) вводилась внутрибрюшинно ежедневно.
Подробности клеточной культуры, анализа массива генов, гистологического анализа и иммуногистохимии, сфероидов, обработанных DCA, выделения РНК и количественного анализа RT-PCR (QPCR) описаны в электронном дополнительном материале.
Статистический анализ
Статистическая значимость наблюдаемых различий между разными экспериментальными группами рассчитывалась с помощью двуххвостового t-теста. Значения P < 0,05 считались статистически значимыми.
Результаты
Создание модели опухоли с устойчивостью к бевацизумабу
Суспензии клеток U87-MG подкожно вводили в правый фланг мышей SCID. Лечение бевацизумабом (внутрибрюшинная инъекция 10 мг/кг каждые 3 дня) начинали, когда опухоли достигали в среднем 100-200 мм3. Различия между группами, получавшими и не получавшими лечение, стали заметны через 1 неделю, а примерно на 40-й день была достигнута полная устойчивость к бевацизумабу (рис. 1). Опухоли вырезали отдельно в контрольной и леченной группах в те моменты времени, когда их средние темпы роста и размеры были одинаковыми. Аналогичный ответ (т.е. первоначальный ответ с последующей резистентностью) наблюдался при использовании субмаксимальной дозы бевацизумаба (2,5 мг/кг; каждые 3 дня путем внутрибрюшинного введения) у атимичных мышей nude. Это будет подробно описано ниже в рамках исследований комбинации. Проведя иммуногистохимию стандартных сосудистых маркеров (CD31 и CD34) с последующим подсчетом плотности микрососудов, мы подтвердили, что резистентные опухоли демонстрируют значительно более редкую сосудистую сеть (рис. 1). Таким образом, терапевтическая резистентность, по-видимому, не связана в первую очередь с возобновлением васкуляризации вследствие перехода на альтернативные ангиогенные факторы роста, как это было показано в других моделях резистентности к бевацизумабу [7]. Экспрессия HIF-1α, а также карбоновой ангидразы IX (CA9), надежной мишени HIF и хорошо известного маркера гипоксии, была резко увеличена в резистентных опухолях, что указывает на то, что их рост продолжался в значительно более обедненной кислородом среде, что соответствует данным, полученным Rapisarda et al. [8].
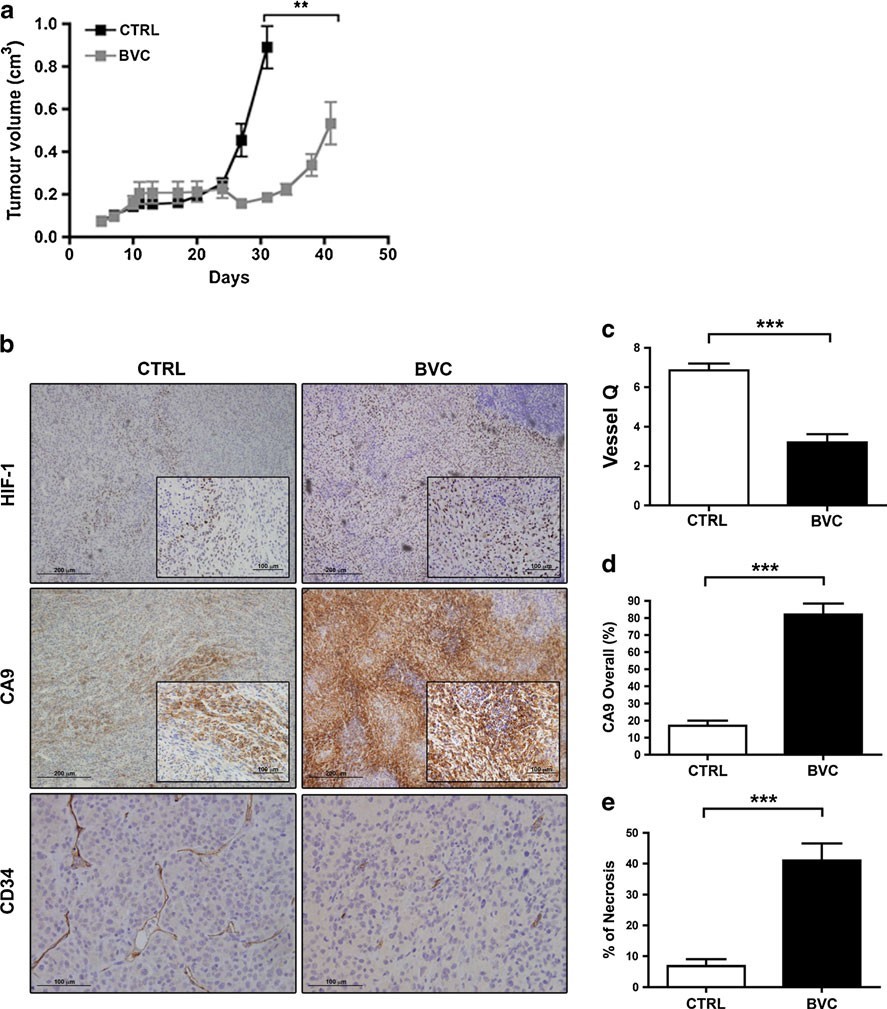
Молекулярная характеристика модели резистентности к бевацизумабу
Для того чтобы получить полное представление о молекулярных процессах, которые связаны с процессом резистентности и потенциально критичны для него, общая РНК из обработанных и не обработанных опухолей была подвергнута анализу экспрессии с использованием массивов HGU133plus2 Affymetrix. Полный набор данных для анализа экспрессии на массивах Affymetrix доступен на сайте http://www.ncbi.nlm.gog/geo/query/acc.cgi?acc=GSE37956. Центральной темой в опухолях, устойчивых к бевацизумабу, была скоординированная активация транскрипционной программы, управляемой HIF (рис. 2). Значительная часть мишеней HIF демонстрировала скоординированную регуляцию, в большинстве случаев более чем одним зондом. Примечательно, что гликолитические мишени HIF, включая альдолазы A и C, триозофосфат-изомеразу 1 и 6-фосфофрукто-2-киназу/фруктозо-2,6-бифосфатазу 3, а также индуцибельные транспортеры глюкозы GLUT1/SLC2A1 и GLUT3/SLC2A3, были сильно индуцированы, что указывает на повышенную зависимость от гликолитической утилизации глюкозы. Напротив, в опухолях, устойчивых к бевацизумабу, наблюдалась значительная репрессия на уровне генов пируватдегидрогеназы (PDH) альфа 1 и бета, которые регулируют вступление пирувата в цикл трикарбоновых кислот (TCA) [9]. Активность PDH ингибируется фосфорилированием киназами пируватдегидрогеназы (PDK). Изоформы PDK1 и PDK3, которые являются хорошо документированными мишенями HIF [10-12], были сильно повышены в опухолях, устойчивых к бевацизумабу, что еще больше подтверждает биохимический сдвиг в сторону от окислительного фосфорилирования (OXPHOS) (рис. 2). Пожалуй, самым поразительным изменением экспрессии генов в опухолях, устойчивых к бевацизумабу, было глобальное снижение уровня генов митохондриального метаболизма, в частности, членов всех пяти митохондриальных комплексов OXPHOS (рис. 2). Наконец, несколько компонентов цикла ТСА, включая фумаратгидратазу (FH) и сукцинатдегидрогеназу (SDH), были снижены (рис. 2), что может способствовать росту опухоли, поскольку они также функционируют как опухолевые супрессоры [13].
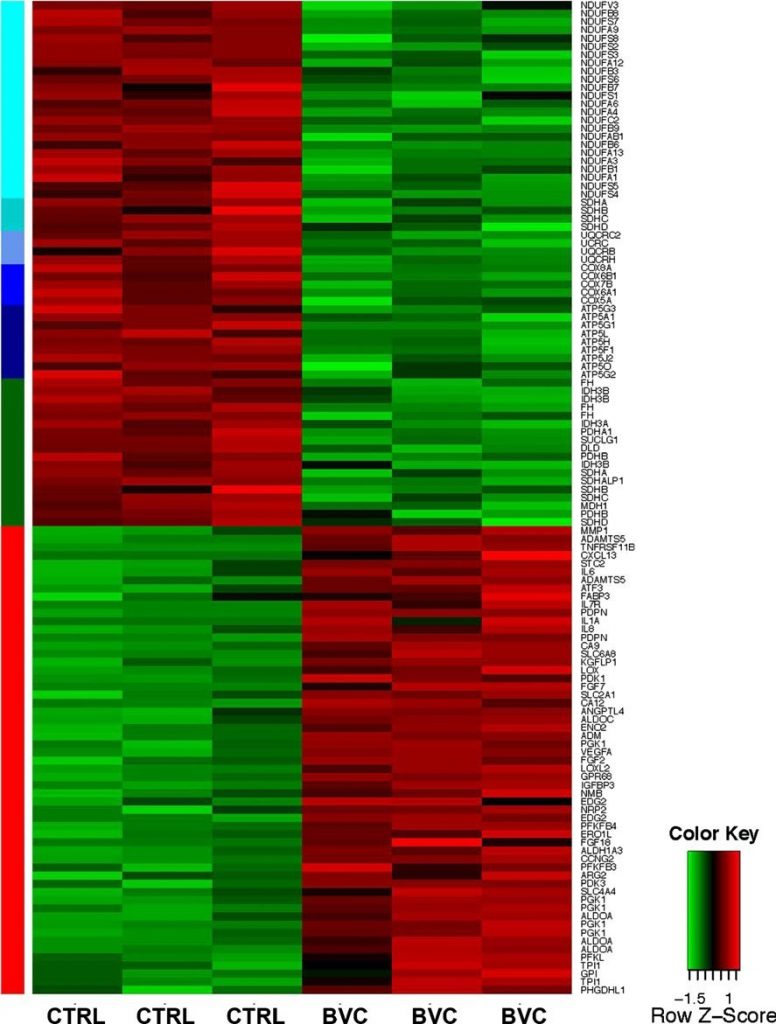
Анализ KEGG-путей подтвердил, что энергетический метаболизм представляет собой одно из доминирующих изменений, связанных с устойчивыми к бевацизумабу опухолями. Так, гликолитические гены были наиболее распространены среди генов с повышенной частотой, наряду с генами, относящимися к метаболизму фруктозы и маннозы, пентозофосфатному пути, метаболизму аминосахаров и нуклеотидных сахаров, а также метаболизму инозитолфосфата (Дополнительная таблица S1A). Гипергеометрические и скорректированные гипергеометрические значения p были ниже 0,01 для всех этих путей. Напротив, среди даунрегулярных генов, OXPHOS был самым репрессированным путем, со значением p ниже 1,00E-28, а метаболизм пирувата и цикл ТСА также демонстрировали очень значительную репрессию (Дополнительная таблица S1B). Дополнительным признаком, наблюдаемым в опухолях, устойчивых к бевацизумабу, был повышенный стресс эндоплазматического ретикулума и реакция развернутого белка. В частности, ключевые медиаторы этих ответов ATF4, 5, 6 и DDIT3/CHOP были сильно сверхэкспрессированы (дополнительная таблица S2), что согласуется с нашими предыдущими наблюдениями, согласно которым более сильная гипоксия, развивающаяся в ходе антиангиогенной терапии, активирует не-HIF пути [14].
Влияние хронической гипоксии in vitro на экспрессию генов митохондриальной OXPHOS
Чтобы выяснить, является ли гипоксия основной причиной даунрегуляции генов митохондриального дыхания и цикла Кребса, мы провели комплексное исследование in vitro влияния низкого содержания кислорода на клетки U87. Интересно, что несколько генов OXPHOS и компонентов цикла Кребса, которые были обнаружены как даунрегуляторные в массивах, также отвечали даунрегуляцией в условиях гипоксии, включая ATP5A1, ATP5G3, NDUFA9, FH и MDH1 (рис. 3). MRPL36 и MRPS11, два гена, которые считаются критическими в сборке комплексов OXPHOS [15, 16], также показали снижение уровня в условиях гипоксии, аналогично эффекту бевацизумаба (рис. 3). Тем не менее, большинство генов, которые были снижены в массивах, не продемонстрировали снижение регуляции во время гипоксического воздействия, что позволяет предположить, что за это могут отвечать другие факторы [17]. Повторное изучение массивов показало, что несколько транскрипционных факторов, регулирующих экспрессию митохондриальных генов (включая OXPHOS), были снижены: NRF1, TFAM и TFB2M [18-20] (дополнительная таблица S3).

Использование увеличенной гликолитической бреши: синергизм in vivo между бевацизумабом и DCA
Основываясь на выраженной сигнатуре усиления HIF-сигнализации и снижения митохондриальной OXPHOS, мы предположили, что устойчивые к бевацизумабу опухоли будут особенно чувствительны к митохондриальным реактиваторам. Главным кандидатом в малые молекулы из этого класса является DCA, который ингибирует активность PDK, тем самым увеличивая поток пирувата в митохондрии и способствуя окислению глюкозы вместо гликолиза [21, 22]. Принимая во внимание общепризнанные побочные эффекты антиангиогенной терапии, а также DCA, для оценки комбинации препаратов мы выбрали субмаксимальную дозу антиангиогенного агента (2,5 мг/кг; каждые 3 дня путем внутрибрюшинной инъекции) — стратегия, широко применяемая in vivo [23]. Ожидается, что такой подход также повысит нашу способность обнаружить синергизм между двумя препаратами, как с точки зрения опухолевого ответа, так и влияния на сигнализацию HIF. Действительно, лечение бевацизумабом и DCA значительно блокировало рост опухоли по сравнению с каждым из препаратов в отдельности (рис. 4A и Дополнительный рис. S1). Для того чтобы оценить общность ответа, мы исследовали дополнительный тип клеток GBM, U118. Ответ в трансплантатах на основе U118 также был гораздо более устойчивым при использовании комбинации по сравнению с отдельными препаратами (рис. 4B и Дополнительный рис. S1).
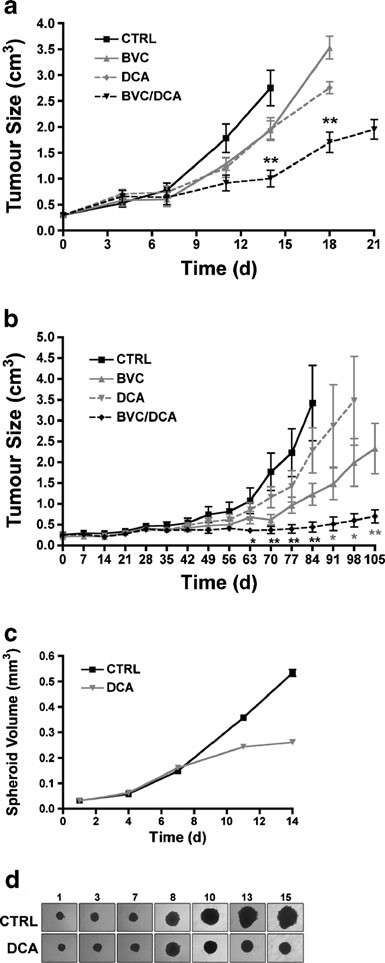
Эффективность гликолитических ингибиторов в преодолении резистентности к бевацизумабу была предложена ранее [24] без экспериментального подтверждения. DCA и 2-DG обсуждались вместе как часть этой концепции. Однако, когда 2-ДГ был протестирован параллельно с ДКА, никакого аддитивного эффекта к бевацизумабу замечено не было. Это произошло, несмотря на преходящий эффект 2-ДГ в качестве единственного агента, вводимого в концентрации, описанной в литературе (Дополнительный рис. S2). Таким образом, реактивация митохондрий и прямое ингибирование гликолиза оказывают различное действие в комбинации с бевацизумабом.
In vitro эффекты DCA
Сфероидные модели представляют собой систему промежуточной сложности между стандартными двумерными культуральными системами и опухолями in vivo из-за градиентов кислорода и питательных веществ. В отличие от монослойных систем, расширяющиеся сфероиды имитируют повышенную аваскулярность структур in vivo, растущих в присутствии бевацизумаба. Сфероиды U87 были получены, как описано [25], и выращивались в течение 7 дней, пока их размер не достиг 0,2 мм3. Сфероиды такого размера достаточно велики, чтобы обеспечить диффузию лекарственного препарата через сфероид, но также начинают формировать небольшую центральную область гипоксии и отображать градиенты питательных веществ, pH и O2. Устойчивое расхождение кинетики роста между группами, обработанными DCA и не обработанными, было замечено после 3 дней лечения. Этот эффект был устойчивым, и начиная с 6 дня ДКА значительно нарушал расширение сфероидов (рис. 4C, D
).
Влияние комбинации бевацизумаба и DCA на мишени HIF и гистологические маркеры опухолевого роста
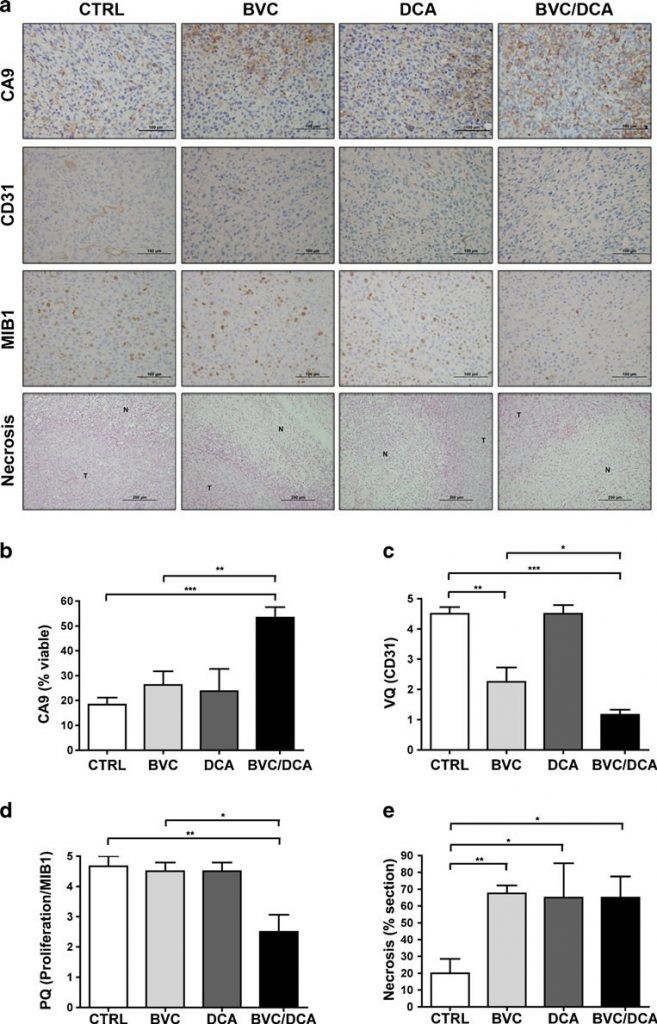
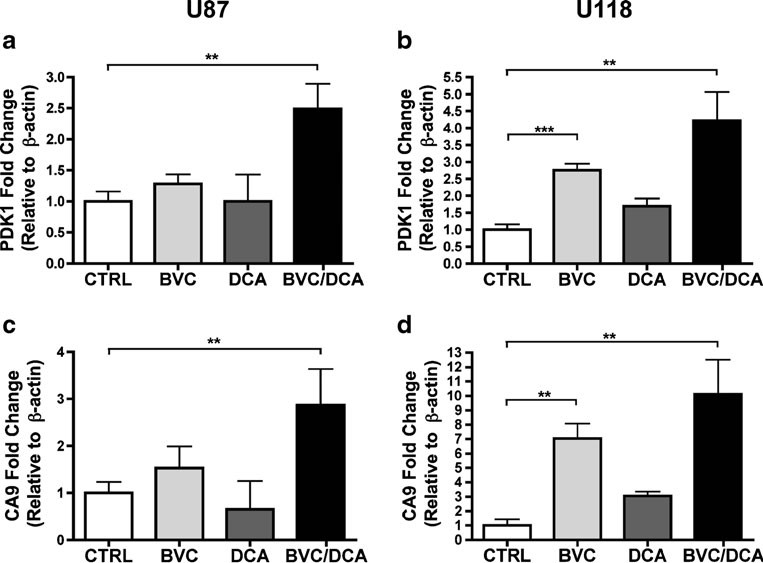
Для того чтобы выяснить, определялось ли влияние комбинации на рост опухоли в первую очередь увеличением гибели клеток или снижением пролиферации, мы провели гистологический анализ этих опухолей с использованием хорошо известных маркеров. В обработанных опухолях было больше некроза по сравнению с необработанными, но существенной разницы между препаратами по отдельности или в комбинации не наблюдалось (рис. 5). Уровень пролиферации, оцененный по количественному окрашиванию Ki-67 (MIB-1), был значительно ниже в группе с комбинацией по сравнению с опухолями, не получавшими лечения, и опухолями, получавшими только бевацизумаб, что свидетельствует о том, что эффект комбинации был преимущественно цитостатическим (рис. 5). Затем мы оценили влияние комбинации препаратов на сигнализацию HIF, используя сочетание иммуногистохимии и количественного RT-PCR (рис. 5, 6). Удивительно, но хотя известно, что DCA увеличивает потребление кислорода в различных экспериментальных системах, одного DCA было недостаточно для заметного увеличения экспрессии мишеней HIF in vivo. Однако в комбинации с бевацизумабом экспрессия CA9 резко возрастала в жизнеспособных опухолевых клетках U87. В U118, с другой стороны, субмаксимальный бевацизумаб в одиночку привел к резкому увеличению всех протестированных мишеней HIF, без дальнейшего измеримого увеличения в опухолях, обработанных комбинацией (рис. 6 и дополнительный рис. S3). Однако главная оговорка заключается в том, что опухоли, выжившие в присутствии комбинации, были значительно меньше и практически неподвижны — факторы, которые должны смягчить степень гипоксии.
Обсуждение
Основной целью нашего исследования было более глубокое понимание адаптации опухоли к бевацизумабу путем выявления путей, связанных с резистентностью, с особым акцентом на метаболические реакции. Мы остановились на гетеротопической, а не ортотопической модели, прежде всего для того, чтобы обеспечить возможность мониторинга роста и побега опухоли. Кроме того, поскольку подкожные опухоли достигают значительно большего объема, чем их ортотопические аналоги, они, вероятно, более актуальны для моделирования прогрессирующих и гипоксических злокачественных опухолей.
В недавно опубликованной ортотопической модели GBM сообщалось об усилении гипоксии после введения бевацизумаба [24, 26]; однако исследование долгосрочных различий в росте в таких системах менее осуществимо. Несмотря на «классический» статус опухолевого метаболизма в исследованиях рака и его недавнее возрождение, ни один препарат, действующий преимущественно на этом уровне, не был одобрен для рутинного клинического применения [27]. DCA, небольшая молекула, которая преодолевает барьер «кровь-мозг» [22], показала многообещающие результаты в клиническом исследовании GBM в комбинации с хирургией, темозоломидом и облучением [21], и в настоящее время проводятся многочисленные дополнительные исследования http://clinicaltrials.gov/ct2/results?term=+дихлорацетат). Однако эффект DCA как единственного агента в лучшем случае преходящ, и наши опухолевые модели, безусловно, отражают это ограничение. В недавнем исследовании обсуждалась возможность того, что лечение бевацизумабом должно сенсибилизировать опухоли как к 2-DG, так и к DCA [24], однако в наших руках эти прогнозы подтвердились только для DCA. Отсутствие измеримого аддитивного или синергического эффекта 2-ДГ вряд ли было связано с биологической неактивностью или неадекватной дозировкой, поскольку он был транзиторно эффективен как единственный агент. Остаются вопросы относительно механизма ингибирования опухоли, опосредованного DCA, в присутствии бевацизумаба. Хотя сообщалось, что DCA сам по себе блокирует ангиогенез [21], измерение средней плотности сосудов не подтвердило этого в нашей системе.
Было показано, что DCA проявляет повышенный цитотоксический эффект в условиях гипоксии в различных клеточных линиях [28]. Современная парадигма заключается в том, что DCA ускоряет потребление кислорода путем реактивации митохондрий и еще больше снижает локальное напряжение кислорода [29], тем самым создавая дополнительные трудности для выживания и/или пролиферации опухолевых клеток. Более того, было продемонстрировано, что в клетках, «перепрограммированных» на избирательное использование гликолиза для выработки АТФ из-за мутаций митохондриальной ДНК, принудительный OXPHOS, индуцированный DCA, оказывает токсическое действие. DCA также проявляет синергическую цитотоксичность in vitro в комбинации с цисплатином и топотеканом, двумя антинеопластическими агентами, которые, как известно, повреждают митохондриальную ДНК [30]. Можно предположить, что даунрегуляция митохондриальных генов в опухолях, устойчивых к бевацизумабу, представляет собой форму митохондриальной дисфункции, которая сенсибилизирует к действию DCA.
Интересно, что влияние DCA, как отдельного агента, на мишени HIF в ксенотрансплантатах было в лучшем случае незначительным, несмотря на его общепризнанное положительное влияние на потребление кислорода. Напротив, вместе с бевацизумабом DCA приводил к повышению экспрессии большинства мишеней HIF в выживших опухолях по сравнению с бевацизумабом. Возможное объяснение этих результатов заключается в том, что принудительная OXPHOS, индуцированная DCA в присутствии очень низкого уровня кислорода, может привести к увеличению продукции реактивных форм кислорода, что, в свою очередь, может способствовать дополнительной индукции HIF [31]. Кроме того, или в качестве альтернативы, DCA в присутствии бевацизумаба может привести к дальнейшему снижению локальной концентрации кислорода до уровня, при котором индукция мишеней HIF становится более очевидной при количественном анализе RT-PCR. Помимо повышенной экспрессии CA9, в опухолях, выживших в присутствии комбинации препаратов в клетках U87 или U118, наблюдалась повышенная экспрессия мишеней HIF — PDK1, 3 и GLUT1. Это может отражать более резкий метаболический сдвиг «последней инстанции», критически важный для выживания опухолевых клеток. В частности, повышенная экспрессия PDK1/3 может быть частью «последней попытки» опухолевых клеток частично противостоять действию DCA и инактивировать митохондриальную OXPHOS. Такие метаболические сдвиги в опухолях, выживших в присутствии бевацизумаба плюс DCA, могут также дать важные подсказки о том, как еще больше повысить эффективность этой комбинации. Например, можно предположить, что резистентные опухоли могут проявлять хотя бы некоторую чувствительность к дальнейшему увеличению концентрации DCA, хотя токсичность этого соединения может стать ограничивающим фактором. Регуляция опухолеспецифического CA9 также может играть важную роль в выживании опухолей, подвергшихся комбинированному лечению, поскольку он ускоряет выведение избыточногоCO2, образующегося в результате реактивации цикла Кребса [25]. Поэтому ингибиторы CA9, которые недавно показали многообещающие противораковые эффекты [32, 33], могут рассматриваться как реальные кандидаты на третий компонент комбинированной стратегии.
В заключение следует отметить, что молекулярное изучение адаптации опухоли к анти-VEGF агентам может дать ценные подсказки для создания более эффективных комбинаций, включающих воздействие на метаболизм рака.
Вклад автора
Концепция и дизайн: M.I. и A.L.H. Получение данных: K.K., S.W., H.E.G., H.T., J.L., J.S., A.L.S., R.L., D.S., C.M.D., и M.H. Анализ и интерпретация данных: М.И. и А.Л.Х. Написание, рецензирование и/или редактирование рукописи: М.И. и А.Л.Х. Административная, техническая или материальная поддержка: F.B. Руководство исследованием: M.I. и A.L.H.
Источник финансирования
Работа была поддержана грантами Cancer Research United Kingdom [S.W., A.L.H., H.T., R.L., J.L.], METOXIA p-Medicine European Union Framework 7 [D.S., F.B.], Rhodes Scholar [H.G.], стартовыми фондами Indiana University Cancer Center и American Cancer Society [M.I., C.M.D., K.K.].
Конфликт интересов
Нет потенциальных конфликтов интересов, о которых можно было бы заявить.
ССЫЛКИ
1 Cao Y, Arbiser J, D’Amato RJ, D’Amore PA, Ingber DE, Kerbel R, Klagsbrun M, Lim S, Moses MA, Zetter B et al (2011) Forty-year journey of angiogenesis translational research. Sci Transl Med 3:114rv3
2 Wick W, Wick A, Weiler M, Weller M (2011) Patterns of progression in malignant glioma following anti-VEGF therapy: perceptions and evidence. Curr Neurol Neurosci Rep 11:305-312
3 Raizer JJ, Grimm S, Chamberlain MC, Nicholas MK, Chandler JP, Muro K, Dubner S, Rademaker AW, Renfrow J, Bredel M (2010) A phase 2 trial of single-agent bevacizumab given in an every-3-week schedule for patients with recurrent high-grade gliomas. Рак 116:5297-5305
4 Bergers G, Hanahan D (2008) Modes of resistance to anti-angiogenic therapy. Nat Rev Cancer 8:592-603
5 Friedman HS, Prados MD, Wen PY, Mikkelsen T, Schiff D, Abrey LE, Yung WK, Paleologos N, Nicholas MK, Jensen R et al (2009) Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol 27:4733-4740
6 Winter SC, Shah KA, Campo L, Turley H, Leek R, Corbridge RJ, Cox GJ, Harris AL (2005) Relation of erythropoietin and erythropoietin receptor expression to hypoxia and anemia in head and neck squamous cell carcinoma. Clin Cancer Res Off J Am Assoc Cancer Res 11:7614-7620
7 Davies S, Dai D, Pickett G, Thiel KW, Korovkina VP, Leslie KK (2011) Эффекты бевацизумаба в мышиной модели рака эндометрия: определение молекулярной основы резистентности. Oncol Rep 25:855-862
8 Rapisarda A, Hollingshead M, Uranchimeg B, Bonomi CA, Borgel SD, Carter JP, Gehrs B, Raffeld M, Kinders RJ, Parchment R et al (2009) Increased antitumor activity of bevacizumab in combination with hypoxia inducible factor-1 inhibition. Mol Cancer Ther 8:1867-1877
9 Harris RA, Bowker-Kinley MM, Huang B, Wu P (2002) Regulation of the activity of the pyruvate dehydrogenase complex. Adv Enzyme Regul 42:249-259
10 Wigfield SM, Winter SC, Giatromanolaki A, Taylor J, Koukourakis ML, Harris AL (2008) PDK-1 регулирует производство лактата при гипоксии и связан с плохим прогнозом при сквамозном раке головы и шеи. Br J Cancer 98:1975-1984
11 Kim JW, Tchernyshyov I, Semenza GL, Dang CV (2006) HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia. Cell Metab 3:177-185
12 Lu CW, Lin SC, Chen KF, Lai YY, Tsai SJ (2008) Индукция киназы-3 пируватдегидрогеназы гипоксия-индуцируемым фактором-1 способствует метаболическому переключению и лекарственной устойчивости. J Biol Chem 283:28106-28114
13 Frezza C, Pollard PJ, Gottlieb E (2011) Inborn and acquired metabolic defects in cancer. J Mol Med (Berl) 89:213-220
14 Rzymski T, Milani M, Pike L, Buffa F, Mellor HR, Winchester L, Pires I, Hammond E, Ragoussis I, Harris AL (2010) Regulation of autophagy by ATF4 in response to severe hypoxia. Онкоген 29:4424-4435
15 Prestele M, Vogel F, Reichert AS, Herrmann JM, Ott M (2009) Mrpl36 важен для генерации компетентных к сборке белков во время митохондриальной трансляции. Mol Biol Cell 20:2615-2625
16 Emdadul Haque M, Grasso D, Miller C, Spremulli LL, Saada A (2008) The effect of mutated mitochondrial ribosomal proteins S16 and S22 on the assembly of the small and large ribosomal subunits in human mitochondria. Митохондрия 8:254-261
17 Tang X, Lucas JE, Chen JL, Lamonte G, Wu J, Wang MC, Koumenis C, Chi JT (2012) Functional interaction between responses to lactic acidosis and hypoxia regulates genomic transcriptional outputs. Cancer Res 72:491-502
18 Scarpulla RC (2002) Ядерные активаторы и коактиваторы в биогенезе митохондрий млекопитающих. Biochim Biophys Acta 1576:1-14
19 Falkenberg M, Gaspari M, Rantanen A, Trifunovic A, Larsson NG, Gustafsson CM (2002) Mitochondrial transcription factors B1 and B2 activate transcription of human mtDNA. Nat Genet 31:289-294
20 Larsson NG, Barsh GS, Clayton DA (1997) Structure and chromosomal localization of the mouse mitochondrial transcription factor A gene (Tfam). Mamm Genome 8:139-140
21 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D et al (2010) Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2:31ra34
22 Michelakis ED, Webster L, Mackey JR (2008) Дихлорацетат (DCA) как потенциальная метаболическая таргетная терапия рака. Br J Cancer 99:989-994
23 Pechman KR, Donohoe DL, Bedekar DP, Kurpad SN, Hoffmann RG, Schmainda KM (2011) Characterization of bevacizumab dose response relationship in U87 brain tumors using magnetic resonance imaging measures of enhancing tumor volume and relative cerebral blood volume. J Neurooncol 105:233-239
24 Keunen O, Johansson M, Oudin A, Sanzey M, Rahim SA, Fack F, Thorsen F, Taxt T, Bartos M, Jirik R et al (2011) Anti-VEGF treatment reduces blood supply and increases tumor cell invasion in glioblastoma. Proc Natl Acad Sci U S A 108:3749-3754
25 Swietach P, Patiar S, Supuran CT, Harris AL, Vaughan-Jones RD (2009) The role of carbonic anhydrase 9 in regulating extracellular and intracellular ph in three-dimensional tumor cell growths. J Biol Chem 284:20299-20310
26 de Groot JF, Fuller G, Kumar AJ, Piao Y, Eterovic K, Ji Y, Conrad CA (2010) Tumor invasion after treatment of glioblastoma with bevacizumab: radiographic and pathologic correlation in humans and mice. Нейроонкол 12:233-242
27 Kaelin WG Jr, Thompson CB (2010) Вопросы и ответы: рак: подсказки из клеточного метаболизма. Nature 465:562-564
28 Anderson KM, Jajeh J, Guinan P, Rubenstein M (2009) In vitro эффекты дихлорацетата и CO2 на гипоксические клетки HeLa. Anticancer Res 29:4579-4588
29 Chen Y, Cairns R, Papandreou I, Koong A, Denko NC (2009) Потребление кислорода может регулировать рост опухолей, новый взгляд на эффект Варбурга. PLoS One 4:e7033
30 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL (2010) Sodium dichloroacetate selectively target cells with defects in the mitochondrial ETC. Int J Cancer 127:2510-2519
31 Park JH, Kim TY, Jong HS, Kim TY, Chun YS, Park JW, Lee CT, Jung HC, Kim NK, Bang YJ (2003) Gastric epithelial reactive oxygen species prevent normoxic degradation of hypoxia-inducible factor-1alpha in gastric cancer cells. Clin Cancer Res Off J Am Assoc Cancer Res 9:433-440
32 Dubois L, Peeters S, Lieuwes NG, Geusens N, Thiry A, Wigfield S, Carta F, McIntyre A, Scozzafava A, Dogne JM et al (2011) Specific inhibition of carbonic anhydrase IX activity enhances the in vivorapeutic effect of tumor irradiation. Radiother Oncol 99:424-431
33 v Morris JC, Chiche J, Grellier C, Lopez M, Bornaghi LF, Maresca A, Supuran CT, Pouyssegur J, Poulsen SA (2011) Targeting hypoxic tumor cell viability with carbohydrate-based carbonic anhydrase IX and XII inhibitors. J Med Chem 54:6905-6918