Чжэн Ян1, Кин И. Там1
1 Факультет наук о здоровье, Университет Макао, Тайпа, Макао, Китай.
Корреспонденция: Кин Й. Там
Факультет наук о здоровье, Университет Макао, Тайпа, Макао, Китай
Тел: +853-88224988
Факс: +853-88222314.
Электронная почта: [email protected]
Получено: 15 апреля 2016 г.
Пересмотрено: 27 июля 2016 г.
Принято: 2 августа 2016 г
Аннотация
Гликолиз был замечен как преобладающий процесс утилизации глюкозы большинством раковых клеток, что получило название «эффект Варбурга». Воздействие на критические ферменты, такие как киназа пируватдегидрогеназы (PDK), которые обратно регулируют процесс гликолиза, может стать перспективным подходом для самостоятельной работы или в комбинации с другими методами лечения рака. Ингибиторы EGFR для лечения немелкоклеточного рака легких (NSCLC) десятилетиями с большим успехом применялись в клинической практике, однако их клинические преимущества были несколько затруднены растущей приобретенной резистентностью. Комбинированная лекарственная терапия является эффективной стратегией для решения этой проблемы. В данном исследовании мы использовали дихлорацетат (DCA), широко известный ингибитор PDK, вместе с эрлотинибом и гефитинибом, двумя известными ингибиторами EGFR, и продемонстрировали, что применение DCA в комбинации с эрлотинибом или гефитинибом значительно снижает жизнеспособность EGFR-мутантных клеток NSCLC (NCI-H1975 и NCI-H1650) синергетическим образом. Этот синергетический результат, по-видимому, является эффектом комбинации в стимулировании апоптоза, а не совместной супрессией сигнальных путей EGFR или PDK. Более того, мы показали, что комбинированное лечение не проявило синергетического эффекта в других клеточных линиях NSCLC без мутаций EGFR (A549 или NCI-H460). В совокупности эти наблюдения позволили предположить, что комбинированное воздействие на EGFR и PDK в клетках NSCLC оказывает синергетический эффект в зависимости от мутации EGFR.
Ключевые слова: Пируватдегидрогеназа киназа; дихлорацетат; рецептор эпидермального фактора роста; эрлотиниб; гефитиниб; комбинация препаратов
Copyright © 2016 Elsevier B.V. Все права защищены.
ВВЕДЕНИЕ
Согласно последним статистическим данным (Jemal et al., 2011), рак легких занимает первое место среди мужчин и пятое место среди женщин по числу вновь диагностированных случаев рака и смертей от рака во всем мире, причем более 80% пациентов попадают в категорию немелкоклеточного рака легких, или NSCLC (Ke et al., 2015). Традиционные стратегии лечения НМРЛК часто прибегали к химиотерапии с моноприменением или комбинированным применением препаратов на основе платины или других цитотоксических химических веществ. Однако показатели объективного ответа при использовании этих стратегий обычно были неудовлетворительными, а медиана общей выживаемости обычно составляла менее 1 года (Schiller et al., 2002, Pao and Chmielecki, 2010).
Мутация EGFR была обнаружена примерно у 30% пациентов с NSCLC, которые часто хорошо отвечали на целевую терапию (Pao and Chmielecki, 2010). Это позволило широко применять малые молекулярные ингибиторы тирозинкиназы EGFR (EGFR-TKis), которые продемонстрировали огромный успех в последние десятилетия (Hanahan и Weinberg, 2011), примером чего являются эрлотиниб и гефитиниб (Dutta и Maity, 2007). Однако при лечении пациентов ингибиторами EGFR, как правило, возникала приобретенная резистентность с несколькими идентифицированными механизмами, такими как исходная или индуцированная мутация горячей точки T790M, активированная вторичная сигнализация, такая как усиление MET или мутация PI3K, или переход эпителия в мезенхиму (EMT) (Maione et al., 2015). К сожалению, комбинированное применение ингибиторов EGFR с химиотерапией привело к более частому возникновению побочных эффектов, а не к ожидаемой пользе в виде увеличения общей выживаемости леченых объектов (Yan et al., 2015).
Метаболизм раковых клеток — это новая область, основанная на открытии и более чем полувековом исследовании «эффекта Варбурга» (Ngo et al., 2015), согласно которому раковые клетки склонны метаболизировать глюкозу посредством гликолиза, а не окислительного фосфорилирования, для получения энергии (Lu et al., 2015). Это явление послужило толчком к проведению многочисленных исследований, посвященных ключевым ферментам метаболизма глюкозы, таким как транспортеры глюкозы (GLUTs), гексокиназа2 (HK2), пируваткиназа M2 (PKM2), киназа пируватдегидрогеназы (PDK), лактатдегидрогеназа-А (LDHA) и глутаминаза, что привело к разработке нескольких ингибиторов, направленных на конкретные ферменты для противораковой терапии (Butler et al., 2013). Дихлорацетат (ДХА), являясь ингибитором PDK, может ослаблять прогрессирование рака во многих видах рака путем снижения регуляции фосфорилирования пируватдегидрогеназы (p-PDH), которая контролируется PDK (Kankotia and Stacpoole, 2014). Хотя сообщалось о нескольких комбинированных исследованиях, связанных с применением DCA для лечения NSCLC, большинство из них было посвящено классической цитотоксической химиотерапии, а именно комбинированному применению DCA и препаратов на основе платины (Garon et al., 2014, Olszewski et al., 2010). Может ли комбинация DCA с EGFR-TKi в EGFR-мутированных NSCLCs оказывать синергетический эффект на противораковую терапию, остается неизвестным.
В данном исследовании мы продемонстрировали, что совместное применение ингибиторов EGFR (Эрлотиниб или Гефитиниб) с ДКА синергично подавляло рост клеток NCI-H1975 и NCI-H1650. Кроме того, мы изучили возможные механизмы комбинированного действия ингибиторов EGFR и PDK. Мы обнаружили, что эти комбинации могут проявлять синергизм только в клеточных линиях NCI-H1975 и NCI-H460, мутантных линиях клеток EGFR NSCLC, но не в линиях клеток A549 или NCI-H460, клеточных линиях EGFR дикого типа NSCLC.
Материалы и методы
Клеточные линии и реактивы
Клеточные линии NSCLC, NCI-H1975, NCI-H1650 и A549, были приобретены в ATCC, в то время как NCI-H460 был любезно подарен профессором Томасом Ю.К. Люнгом (кафедра прикладной биологии и химической технологии, факультет прикладных наук и текстиля, Гонконгский политехнический университет). Клетки A549 культивировали в среде F-12K/DMEM 1:1 (Gibco), а другие линии клеток — в среде RPMI 1640 (Gibco) с добавлением 10% фетальной бычьей сыворотки (Gibco), в увлажненной атмосфере с 5%CO2 при 37 °C.
DCA был приобретен у Sigma и растворен в 1% ДМСО в PBS в качестве исходного раствора (1,6 М), который затем разбавляли до различных концентраций для получения конечных рабочих растворов, содержащих 0,1% ДМСО во всей среде для обработки клеток. Эрлотиниб и гефитиниб, оба от SelleckChem, были первоначально растворены в ДМСО (Sigma) для получения исходного раствора с концентрацией 160 мМ, и разбавлены до индивидуальной концентрации в рабочей среде, как и ДКА. Первичные антитела, включая p-PDH и PDH (Abcam), были получены от Cell Signaling Technology. α-Тубулин был получен от Invitrogen.
Анализ жизнеспособности клеток
Жизнеспособность клеток для каждой отдельной обработанной или необработанной клетки после указанного времени лечения оценивали с помощью МТТ-анализа. Вкратце, отдельные клетки для каждой клеточной линии высевали в 96-луночные планшеты за 24 часа до загрузки соединений. После указанного периода времени (24 ч, 48 ч и 72 ч, соответственно) культуральную среду с соединениями отбрасывали и добавляли 100 мкл свежей цельной среды, содержащей 0,5 мг/мл МТТ (3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2-H-тетразолия бромид, Sigma). После 4 ч инкубации при 37 °C растворитель удаляли и в каждую лунку добавляли 100 мкл ДМСО при осторожном встряхивании для растворения кристаллов формазана. Значение O.D. каждой лунки измеряли при 570 нм с помощью SpectraMax M5 Microplate Reader (Molecular Devices).
Расчет индекса комбинации (CI)
Для синергетической оценки жизнеспособности клеток между комбинацией и каждой из отдельных групп зачислялось значение CI, которое рассчитывалось как функция доли пораженных раковых клеток (Fa) на основе уравнения Чоу-Талалая (Chou and Talalay, 1984): CI=(D)1/(Dx)1+(D)2/(Dx)2, где (D)1 и (D)2 обозначают дозы, применяемые для достижения необходимого ответа в комбинации, а (Dx) — дозы отдельных препаратов, необходимые для достижения аналогичного ответа. Анализ значений CI проводился с помощью программного обеспечения CalcuSyn (Biosoft), при этом CI<1, CI=1 и CI>1 указывают на синергический, аддитивный и антагонистический эффекты, соответственно.
Анализ образования колоний
Все четыре клеточные линии NSCLC были посеяны в 6-луночные планшеты, каждая лунка содержала 200-800 клеток в 2 мл среды. Среду с отдельными соединениями или в комбинации добавляли через 24 часа после инокуляции клеток для непрерывного лечения в течение 3 дней, а затем заменяли средой без лекарств каждые 3 дня. через 15 дней после размещения клеток колонии клеток фиксировали в 95% этаноле в течение 15 мин, окрашивали 0,1% Crystal Violet (Sigma) и высушивали. Колонии, содержащие более 100 клеток, считались положительными.
Вестерн-блоттинг анализ
Клетки NCI-H1975 и A549 высевали в 6-луночные планшеты и обрабатывали средой, содержащей моносоединение или комбинацию, в течение определенных периодов времени. Обработанные клетки инкубировали в буфере для клеточного лизата (Cell Signaling Technology) при осторожном встряхивании в течение 15 мин, а затем центрифугировали при 12 000 об/мин при 4 °C еще 15 мин. Концентрацию белка каждого образца в супернатанте оценивали с помощью набора Pierce® BCA Protein Assay Kit (Thermo) и уравновешивали до одинакового уровня, после чего проводили денатурацию белка в течение 8 мин с загрузочным буфером SDS при 100 °C. Белки в образце разделяли электрофорезом SDS-PAGE, переносили на нитроцеллюлозную фильтровальную мембрану (Whatman), блокировали в 5% обезжиренном молоке в течение 2 ч, замораживали с желаемыми первичными антителами на ночь, затем вторичными HRP-связанными антирабитовыми или антимышиными IgG (Cell Signaling Technology) в течение 2 ч. Мембраны окончательно сканировали в Chemidoc® MP Imaging System (Bio-Rad) после 2 мин инкубации в субстрате Clarity Western ECL Substrate (Bio-Rad).
Проточная цитометрия
Клетки NCI-H1975 и A549 высевали и обрабатывали, как описано в предыдущем разделе. Обработанные клетки отделяли от дна планшетов с помощью Трипсин-ЭДТА (Gibco) и промывали PBS в течение двух раз. Детекцию апоптоза проводили с помощью набора для детекции апоптоза FITC Annexin-V (Biolegend). Вкратце, собранные образцы клеток суспендировали в 500 мкл связывающего буфера, содержащего 5 мкл Annexin V-FITC и 10 мкл йодистого пропидия (PI) в течение 15 минут перед анализом FACS на проточном цитометре Accuri C6 (BD). Образцы клеток для измерения мембранного потенциала митохондрий (ММП) инкубировали в 1 мл цельной среды, содержащей 2 мкМ JC-1 (5,5,6,6-тетрахлор-1,1,3,3-тетраэтилбензимидазоликаркоцианин йодид, Sigma) в течение 15 мин, после чего проводили одну промывку и повторное суспендирование в PBS для анализа FACS.
Статистический анализ
Все данные были представлены как среднее±S.D. IC50 отдельных соединений в указанной временной точке были выполнены с помощью GraphPad 5.1 (Prism). Статистические сравнения между различными группами образцов проводили в Excel 2010 с помощью t-теста Стьюдента. Значение P менее 0,05 считалось статистически значимым.
Результаты
Эрлотиниб, гефитиниб и DCA ослабляли пролиферацию клеток в клеточных линиях NCI-H1975 и A549 NSCLC
Мы попытались определить in vitro антиклеточный пролиферативный эффект трех выбранных соединений в клеточных линиях NCI-H1975, NCI-H1650, A549 и NCI-H460 NSCLC. Клетки обрабатывали уменьшенным в 2 раза серийным разведением каждого соединения в течение 24 ч, 48 ч или 72 ч, соответственно. Жизнеспособность клеток оценивали методом МТТ. Как показано на рис. 1, эрлотиниб, гефитиниб или DCA приводили к значительному снижению жизнеспособности клеток во всех четырех клеточных линиях дозо- и времязависимым образом. Видно, что разброс данных по IC50 ниже в 72 ч для большинства клеточных линий (см. табл. 1). Таким образом, мы выбрали 72 часа в качестве конечной точки для комбинированного лечения.
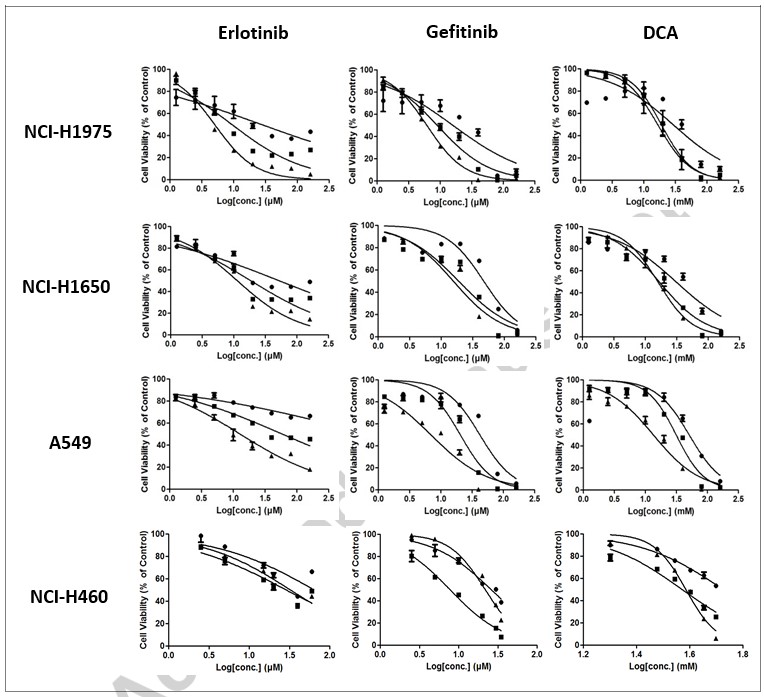
| NCI-H1975 | NCI-H1650 | A549 | NCI-H460 | ||
| Эрлотиниб (мкМ) | 24 h | 27.33±15.06 | 52.69±0.80 | Н/Д | Н/Д |
| 48 h | 9.45±1.48 | 18.67±0.66 | 59.66±3.06 | 28.72±3.29 | |
| 72 h | 5.04±0.01 | 11.42±0.10 | 13.14±3.70 | 32.66±3.32 | |
| Гефитиниб (мкМ) | 24 h | 16.22±8.37 | 47.30±3.98 | 41.96±3.38 | 26.19±1.98 |
| 48 h | 9.09±1.91 | 18.97±0.62 | 20.66±2.95 | 7.74±0.37 | |
| 72 h | 6.15±0.18 | 15.61±1.15 | 6.97±0.22 | 21.86±0.09 | |
| DCA (мМ) | 24 h | 29.51±3.25 | 31.09±4.10 | 50.25±6.89 | Н/А |
| 48 h | 19.56±6.31 | 16.84±4.53 | 31.35±1.00 | 37.26±0.47 | |
| 72 h | 16.60±4.46 | 15.81±0.26 | 13.55±2.32 | 38.47±0.35 |
Комбинированные стратегии синергично подавляли жизнеспособность клеток и значительно ингибировали образование колоний в NCI-H1975 и NCI-H1650, но не так хорошо в A549 и NCI-H460
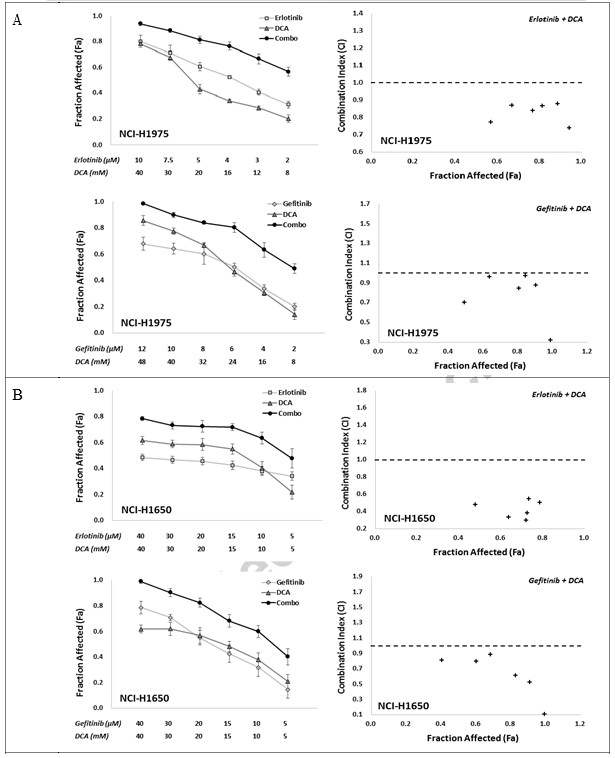
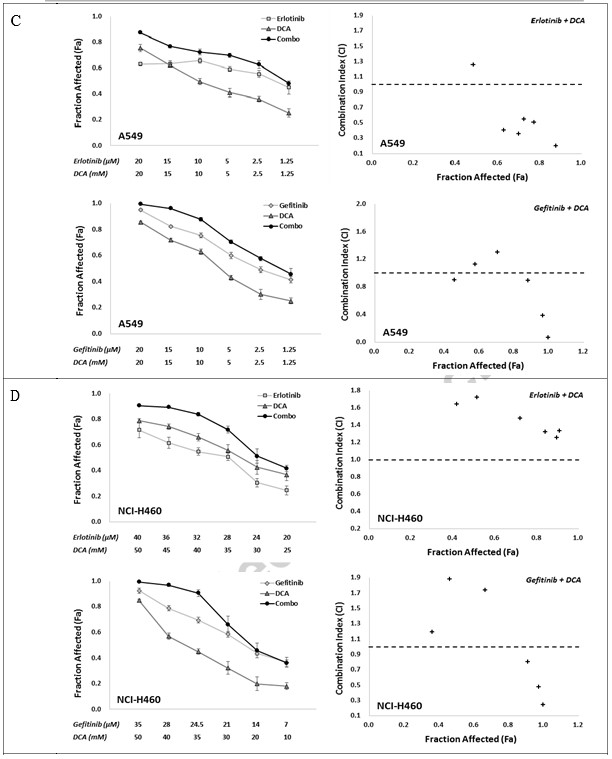
Чтобы определить in vitro синергичный ответ на комбинацию ингибиторов EGFR с DCA, мы использовали две комбинированные стратегии, а именно Эрлотиниб с DCA и Гефитиниб с DCA, с шестью отдельными точками загрузочной концентрации для каждого соединения, которые обеспечивали подавление жизнеспособности клеток примерно от IC80 до IC20 в фиксированном соотношении. Эффект комбинации оценивался с помощью МТТ-теста. Как показано на рис. 2, обе комбинации, Эрлотиниб с DCA и Гефитиниб с DCA, явно демонстрировали синергизм в клеточных линиях NCI-H1975 и NCI-H1650, где значения CI во всех объединенных группах были ниже 1 (рис. 2A и B). Для клеточных линий A549 и NCI-H460, хотя все комбинированные группы в двух стратегиях показали повышенное значение Fa по сравнению с их моноприменениями, значения CI некоторых комбинированных групп были выше 1 (рис. 2C и D), предполагая, что комбинированные стратегии в A549 и NCI-H460 не работают так же хорошо, как в NCI-H1975 и NCI-H1650.
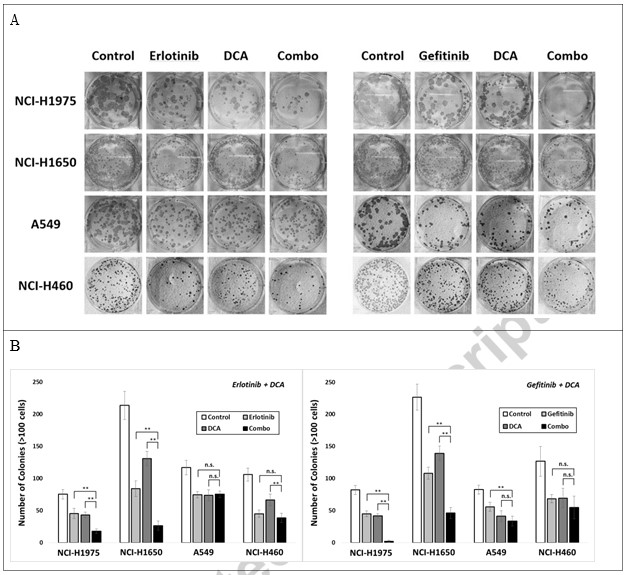
Для дальнейшего изучения, может ли комбинация ослабить образование колоний раковых клеток, мы посеяли эти четыре линии клеток в 6-луночные планшеты и обработали их Эрлотинибом, Гефитинибом или DCA в концентрациях, достигающих примерно 40% ингибирования колоний в течение 3 дней, или их комбинациями. через 15 дней после высева клеток подсчитывали колонии, содержащие более 100 клеток, данные представлены на рис. 3. Комбинированное лечение эрлотинибом и DCA значительно подавляло образование колоний в NCI-H1975 и NCI-H1650, но не в A549 и NCI-H460, что указывает на то, что комбинированная стратегия может работать только в NCI-H1975 и NCI-H1650, EGFR-мутантных клетках NSCLC.
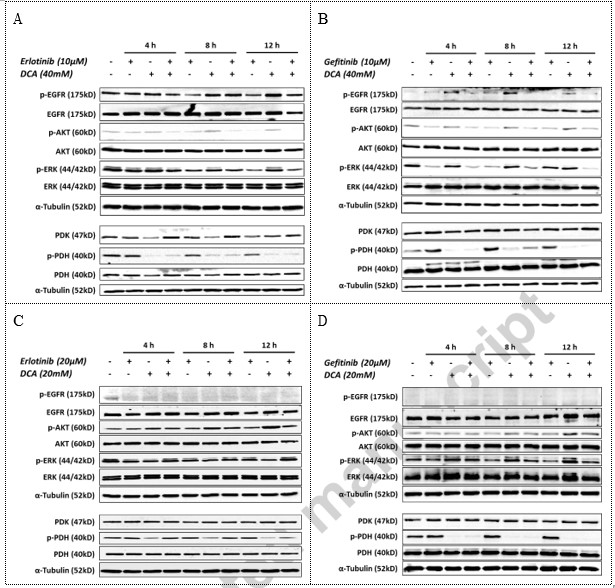
Эрлотиниб/гефитиниб и DCA действовали независимо на целевые сигнальные пути в клеточной линии NCI-H1975
Чтобы исследовать возможный эффект комбинации на сигнальные пути, мы провели вестерн-блоттинг анализ для изучения соответствующих событий фосфорилирования в клетках NCI-H1975 и A549 NSCLC в определенные моменты времени во время лечения комбинированным препаратом. Как показано на рис. 4, в мутантной линии клеток NCI-H1975 EGFR, эрлотиниб или гефитиниб подавляли уровень фосфорилированного EGFR, а также фосфорилированного AKT и фосфорилированного ERK1/2, двух ключевых белков, расположенных в нижнем течении EGFR сигнализации, но не снижали уровень фосфорилированного PDH. DCA, с другой стороны, значительно ингибировал фосфорилирование PDH, но не смог снизить уровень фосфорилированных ключевых белков EGFR-сигнализации в NCI-H1975 (рис. 4A и B). Однако в клетках НСКЛК A549 EGFR дикого типа эрлотиниб и гефитиниб не влияли на сигналы, идущие вниз по течению EGFR, например, на фосфорилированный AKT и фосфорилированный ERK, тогда как DCA значительно снижал уровень фосфорилированного PDH (рис. 4C и D). Интересно, что DCA может активировать AKT путем повышения уровня его фосфорилирования с течением времени в обоих независимых исследованиях (рис. 4C и D). Эти данные позволили предположить, что эрлотиниб и DCA действуют независимо на соответствующие сигнальные пути.
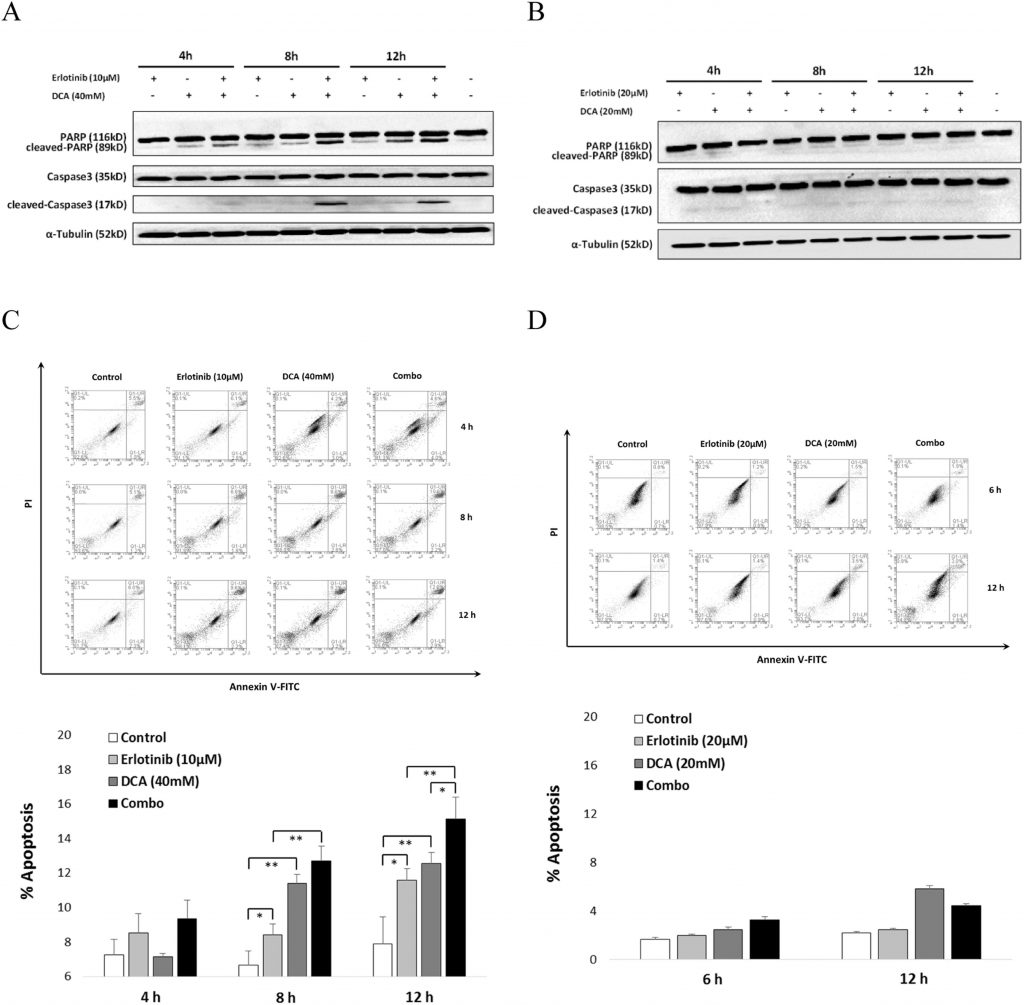
Комбинация эрлотиниба и DCA значительно усиливала апоптоз клеток в NCI-H1975, но не в A549
Чтобы объяснить синергетический эффект эрлотиниба и DCA на жизнеспособность клеток, мы проверили, способствуют ли они совместно апоптозу клеток. Как показано на рис. 5, результаты вестерн-блоттинга продемонстрировали, что эта комбинация привела к значительной активации каспазы3 и ее субстрата, расщепленного PARP, после 8 ч лечения в NCI-H1975 (рис. 5A), в то время как в A549 не наблюдалось явной активации каспазы3 или PARP (рис. 5B). Дальнейший анализ FACS показал, что эрлотиниб в сочетании с DCA способствовал значительно большему апоптозу клеток NCI-H1975, чем каждое соединение в отдельности после обработки клеток в течение 12 ч (рис. 5C), в то время как комбинация не смогла вызвать апоптоз клеток в клетках A549 ни при моноиспользовании, ни при комбинированном применении (рис. 5D). Эти результаты показали, что комбинация усиливает индукцию апоптоза клеток эротинибом и DCA только в NCI-H1975, мутантных клетках EGFR, но не в A549, клетках EGFR дикого типа NSCLC.
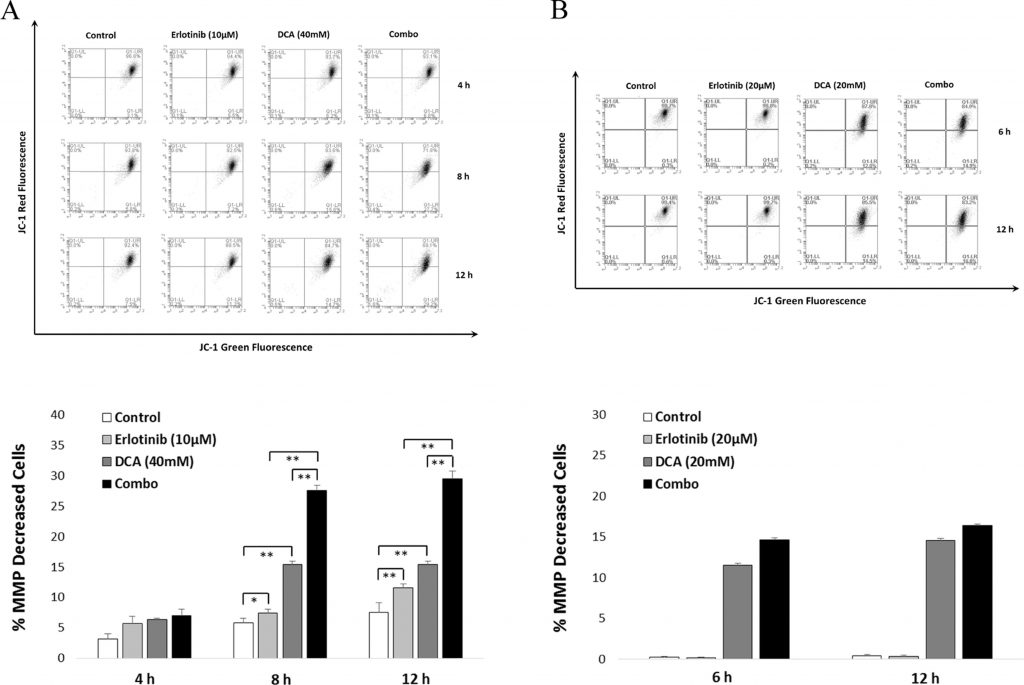
Для дальнейшего подтверждения значительного влияниякомбинированноголечения на апоптоз клеток мы использовали анализ JC-1, чтобы определить, может ли лечение привести к снижению ММП, одного из признаков апоптоза клеток. Как показано на рис. 6, данные FACS согласуются с результатами апоптоза клеток, представленными в разделе 3.4. Видно, что комбинация продемонстрировала значительное снижение ММП после 8 и 12 часов лечения по сравнению с моноприменением эрлотиниба или DCA в клетках NCI-H1975 (см. рис. 6A). Для клеток A549 снижение ММП можно было обнаружить только при применении ДКА (см. рис. 6B).
Обсуждение
Для проверки нашей гипотезы о том, что комбинация ингибиторов EGFR с ингибитором PDK, DCA, может оказывать синергическое противораковое действие на клетки NSCLC, мы применили МТТ-тест для оценки жизнеспособности клеток. Результаты, полученные в ходе исследования, хорошо согласуются с гипотезой. В частности, мы показали, что ингибиторы EGFR (Erlotinib или Gefitinib) вместе с DCA синергично снижали жизнеспособность клеток NCI-H1975 и NCI-H1650 со всеми значениями CI <1 при различных уровнях дозы комбинаций соединений, а также значительно снижали образование колоний раковых клеток (рис. 2, рис. 3). Между тем, эти синергетические эффекты не проявлялись в клеточных линиях A549 и NCI-H460 (клеточные линии EGFR дикого типа NSCLC), что указывает на то, что комбинированная стратегия, вероятно, подавляет клеточную прогрессию синергетическим образом только в NSCLC, несущих мутацию EGFR.
Velpula et al. (2013) сообщили, что введение эрлотиниба или гефитиниба снижает уровень экспрессии p-EGFR и PDK1 в U251 и 5310, а применение DCA в этих двух клетках также снижает экспрессию p-EGFR и PDK1. Вполне вероятно, что комбинированный эффект ингибиторов EGFR и PDK может быть обусловлен совместным подавлением либо EGFR, либо PDK сигнализации. Учитывая это предположение, мы провели вестерн-блоттинг анализ для оценки изменений уровня белка в этих двух сигнальных путях. Было показано, что эрлотиниб и гефитиниб ингибируют фосфорилирование EGFR, а также фосфорилирование двух его классических сигнальных белков, а именно AKT и ERK. Между тем, хотя ингибитор PDK DCA несколько снижал экспрессию PDK1, фосфорилирование PDH, ключевого фермента, ответственного за превращение пирувата в ацетил-КоА для цикла лимонной кислоты вместо запуска гликолиза (Kankotia and Stacpoole, 2014), было значительно подавлено при применении DCA (рис. 4). Очевидно, что эрлотиниб/гефитиниб и DCA не оказывали ни перекрестного, ни аддитивного ингибирующего действия на сигналы друг друга в клетках NCI-H1975. Наши данные позволили предположить, что синергетический противораковый эффект комбинированного лечения в NCI-H1975 не зависит исключительно от сигнальных путей EGFR или PDK.
Чтобы найти другие возможные механизмы эффекта комбинации, мы обратили внимание на индукцию апоптоза. Сообщалось, что эрлотиниб способен вызывать апоптоз клеток NCI-H1975 (Nie et al., 2015), а DCA также вызывает апоптоз клеток в нескольких различных раковых клетках (Madhok et al., 2010, Wong et al., 2008). Поскольку расщепление каспазы3 и ее целевого расщепляющего субстрата PARP — два элемента, участвующих в апоптозе клеток (Zhang et al., 2015), мы сначала изучили уровень активации каспазы3 и PARP в NCI-H1975 при лечении эрлотинибом или DCA, а также их комбинацией. Наши результаты показали, что расщепленный PARP размером 89 кДа увеличивался в зависимости от времени при лечении только эрлотинибом или DCA. Важно отметить, что комбинированное лечение показало значительно более высокую активность PARP по сравнению с соединениями, применяемыми по отдельности. Экспрессия расщепленной каспазы3 на 17 кДа, пик которой пришелся на 8 ч, резко возрастала при обработке клеток NCI-H1975 комбинацией эрлотиниба и DCA (рис. 5A). Эти результаты указывают на то, что эффект комбинации, вероятно, обусловлен аддитивным эффектом в стимулировании апоптоза клеток. Это также подтверждается проточным цитометрическим анализом клеток, дважды окрашенных Annexin-V и PI. Эти наблюдения согласуются с анализом активации Caspase3 и PARP, в котором комбинированное лечение привело к умеренной, но заметной индукции апоптоза клеток при обработке клеток NCI-H1975 в течение 12 ч по сравнению с применением только эрлотиниба или DCA (рис. 5B). Однако ни активации Caspase3/PARP, ни синергической индукции апоптоза клеток не наблюдалось в клеточной линии A549 (рис. 5A и B), что позволяет предположить, что стимулирование апоптоза может быть возможным механизмом комбинированного воздействия эрлотиниба и DCA на EGFR-мутантные клетки NSCLC.
Процесс апоптоза клеток можно разделить на ряд стадий, таких как изменение морфологии клетки, потеря мембранного потенциала митохондрий, изменение проницаемости, фрагментация ДНК и так далее (Fiandalo and Kyprianou, 2012). В ряде исследований сообщалось о снижении MMP как следствии лечения DCA в раковых клетках (Emadi et al., 2015). Предыдущее исследование показало, что эрлотиниб приводит к потере MMP в NSCLCs (Qian et al., 2009). Чтобы выяснить, может ли комбинация существенно повлиять на ММП в NCI-H1975, мы использовали митопробу JC-1 для оценки уровня ММП после лечения эрлотинибом, DCA или комбинацией. Как показано на рис. 6, комбинация привела к значительному снижению ММП через 8 и 12 часов лечения в клетках NCI-H1975 (но не в клетках A549), что свидетельствует о том, что эффект комбинации, индуцирующий апоптоз клеток, связан с деполяризацией мембранного потенциала митохондрий.
Подводя итог, мы продемонстрировали, что совместное применение ингибитора EGFR, а именно, эрлотиниба или гефитиниба, и ингибитора PDK, DCA, показало синергетический противораковый эффект в клетках NCI-H1975 и NCI-H1650. В качестве одного из вероятных механизмов комбинированного эффекта было определено совместное стимулирование апоптоза клеток. В частности, совместное применение эрлотиниба и DCA не только активировало каспазу3 и PARP, но и значительно снижало MMP. Более того, наши результаты показали, что эффект комбинации может проявляться только в клетках NSCLC с мутациями EGFR, исходя из наших нынешних результатов. В настоящее время в нашей лаборатории проводятся дальнейшие исследования для подтверждения этого наблюдения на большем количестве клеточных линий NSCLC.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с данной статьей.
Роль источника финансирования
Данная работа была поддержана Фондом развития науки и технологий Макао (FDCT) (ссылка на проект № 086/2014/A2) и Университетом Макао (грант № MRG021-TKY-2015-FHS).
Благодарности
Мы благодарим за финансовую поддержку Фонд развития науки и технологий Макао С.А.Р (FDCT) (проект № 086/2014/A2) и Университет Макао (грант № MRG021-TKY-2015-FHS). Мы благодарим профессора Томаса Ю.К. Люнга (PolyU, HK) за образцы клеток NCI-H460. Благодарим доктора Сяохуи Ху за полезное обсуждение и корректуру рукописи.
ССЫЛКИ
1 Батлер и др., 2013 Е.Б. Батлер, Й. Чжао, К. Муньос-Пинедо, Дж Остановка двигателя сопротивления: нацеливание на метаболизм рака для преодоления терапевтической резистентности Cancer Res., 73 (2013), pp. 2709-27172 Chou and Talalay, 1984 Т.К. Чоу, П. Талалай Количественный анализ зависимости «доза-эффект»: комбинированное воздействие нескольких лекарств или ингибиторов ферментов Adv. Enzym. Regul., 22 (1984), pp. 27-55
3 Dutta and Maity, 2007 P.R. Dutta, A. Maity Клеточные реакции на ингибиторы EGFR и их значение для терапии рака Cancer Lett., 254 (2007), pp. 165-177
4 Emadi et al., 2015 A. Emadi, M. Sadowska, B. Carter-Cooper, V. Bhatnagar, I. van der Merwe, M.J. Levis, E.A. Sausville, R.G. Lapidus Возмущение клеточного окислительного состояния, индуцированного дихлорацетатом и триоксидом мышьяка при лечении острого миелоидного лейкоза Leuk. Res., 39 (2015), pp. 719-729
5 Фиандало и Киприану, 2012 г М.В. Фиандало, Н. Киприану Контроль каспаз: протагонисты апоптоза раковых клеток Exp. Oncol., 34 (2012), pp. 165-175
6 Гарон и др., 2014 Э.Б. Гарон, Х.Р. Кристофк, В. Хосмер, К.Д. Бриттен, А. Банг, М.Дж. Крабтри, К.С. Хонг, Н. Камранпур, С. Питтс, Ф. Каббинавар, К. Патель, Э. фон Эув, А. Блэк, Э.Д. Микелакис, С.М. Дубинетт, Д.Дж. Сламон Дихлорацетат следует рассматривать вместе с химиотерапией на основе платины при гипоксических опухолях, а не как отдельный агент при распространенном немелкоклеточном раке легкого J. Cancer Res. Clin. Oncol., 140 (2014), pp. 443-452
7 Ханахан и Вайнберг, 2011 D. Hanahan, R.A. Weinberg Признаки рака: следующее поколение Cell, 144 (2011), pp. 646-674
8 Джемаль и др., 2011 A. Джемаль, Ф. Брей, М.М. Центр, Дж. Ферлей, Э. Уорд, Д. Форман Глобальная статистика по раку CA: Cancer J. Clin., 61 (2011), pp. 69-90
9 Kankotia and Stacpoole, 2014 S. Kankotia, P.W. Stacpoole Дихлорацетат и рак: новый дом для сиротского препарата? Biochim. Biophys. Acta, 1846 (2014), pp. 617-629
10 Ке и др., 2015 E.E. Ke, Q. Zhou, Y.L. Wu Новые парадигмы в целевом лечении азиатских пациентов с НСКЛК Expert Opin. Pharmacother., 16 (2015), pp. 1167-1176
11 Лу и др., 2015 J. Lu, M. Tan, Q. Cai Эффект Варбурга в опухолевой прогрессии: митохондриальный окислительный метаболизм как механизм противодействия метастазированию Cancer Lett., 356 (2015), pp. 156-164
12 Мадхок и др., 2010 Б.М. Мадхок, С. Елури, С.Л. Перри, Т.А. Хьюз, Д.Г. Джейн Дихлорацетат индуцирует апоптоз и остановку клеточного цикла в клетках колоректального рака Br. J. Cancer, 102 (2010), pp. 1746-1752
13 Maione et al., 2015 P. Maione, P.C. Sacco, A. Sgambato, F. Casaluce, A. Rossi, C. Gridelli Преодоление резистентности к таргетной терапии в ННХЛ: современные подходы и клиническое применение Ther. Adv. Med. Oncol., 7 (2015), pp. 263-273
14 Нго и др., 2015 H. Ngo, S.M. Tortorella, K. Ververis, T.C. Karagiannis Эффект Варбурга: молекулярные аспекты и терапевтические возможности Mol. Biol. Rep., 42 (2015), pp. 825-834
15 Nie et al., 2015 P. Nie, W. Hu, T. Zhang, Y. Yang, B. Hou, Z. Zou Синергетическая индукция эрлотиниб-опосредованного апоптоза ресвератролом в клетках немелкоклеточного рака легких человека путем снижения регуляции сурвивина и повышения регуляции PUMA Физиол. биохим. клетки, 35 (2015), стр. 2255-2271
16 Olszewski et al., 2010 U. Ольшевски, Т.Т. Поульсен, Э. Ульспергер, Х.С. Поульсен, К. Гайслер, Г. Гамильтон Цитотоксичность in vitro комбинаций дихлорацетата с противораковыми соединениями платины Клин. Фармакол., 2 (2010), с. 177-183
17 Pao and Chmielecki, 2010 W. Pao, J. Chmielecki Рациональное, биологически обоснованное лечение EGFR-мутантного немелкоклеточного рака легкого Nat. Rev. Cancer, 10 (2010), pp. 760-774
18 Цянь и др., 2009 X. Qian, J. Li, J. Ding, Z. Wang, W. Zhang, G. Hu Эрлотиниб активирует пути митохондриальной смерти, связанные с производством реактивных видов кислорода в клеточной линии немелкоклеточного рака легких человека A549 Clin. Exp. Pharmacol. Physiol., 36 (2009), pp. 487-494
19 Шиллер и др., 2002 J.H. Schiller, D. Harrington, C.P. Belani, C. Langer, A. Sandler, J. Krook, J. Zhu, D.H. Johnson Сравнение четырех режимов химиотерапии при распространенном немелкоклеточном раке легкого N. Engl. J. Med., 346 (2002), pp. 92-98
20 Велпула и др., 2013 К.К. Велпула, А. Бхасин, С. Асуткар, А.Дж. Цунг Комбинированное воздействие на PDK1 и EGFR вызывает регрессию глиобластомы, обращая вспять эффект Варбурга Cancer Res., 73 (2013), pp. 7277-7289
21 Вонг и др., 2008 J.Y. Wong, G.S. Huggins, M. Debidda, N.C. Munshi, I. De Vivo Дихлорацетат индуцирует апоптоз в клетках рака эндометрия Гинекол. Oncol., 109 (2008), pp. 394-402
22 Yan et al., 2015 H. Yan, H. Li, Q. Li, P. Zhao, W. Wang, B. Cao Эффективность синхронной комбинации химиотерапии и EGFR TKIs для лечения первой линии NSCLC: систематический анализ PLoS One, 10 (2015), p. e0135829
23 Zhang et al., 2015 L. Zhang, F. Dai, P.L. Sheng, Z.Q. Chen, Q.P. Xu, Y.Q. Guo Аналог ресвератрола 3,4,4′-тригидрокси-транс-стильбен индуцирует апоптоз и аутофагию в клетках немелкоклеточного рака легких человека in vitro Acta Pharmacol. Sin., 36 (2015), pp. 1256-1265
Связанный контент: