Акбар Хан
Медицинский директор, Medicor Cancer Centres Inc., Торонто, Канада
Аннотация
Почечная плоскоклеточная карцинома — это редкая форма рака почек, которая считается неизлечимой после развития метастазов. Прогноз неблагоприятный, и средняя выживаемость на поздней стадии заболевания обычно составляет несколько месяцев, несмотря на все доступные традиционные методы лечения.
Мы описываем случай 72-летней женщины с метастатической плоскоклеточной карциномой почек, которой была проведена радикальная нефрэктомия с положительными хирургическими краями, инвазией в почечные вены и метастазами в многочисленные брюшные лимфатические узлы. Она получила курс паллиативной радиотерапии на брюшную полость с 4500cGy в 25 фракциях в течение 5 недель. После лучевой терапии она получала циклическую схему перорального приема дихлорацетата натрия («ДХА»). Лечение было прекращено через 3 месяца из-за развития периферической невропатии. Последующая визуализация после завершения лечения ДХА не выявила признаков метастатической болезни. Нейропатия постепенно улучшилась, и через четыре года компьютерная томография показала отсутствие рецидива рака. Через пять лет после завершения терапии пациентка продолжает чувствовать себя хорошо, клинических признаков рецидива нет, и она ведет нормальный и активный образ жизни.
Ключевые слова: Дихлорацетат, радиотерапия, плоскоклеточная карцинома почек, ремиссия
Copyright © 2012 Akbar Khan. Это статья с открытым доступом, распространяемая по лицензии Creative Commons Attribution License unported 3.0, которая разрешает неограниченное использование, распространение и воспроизведение на любых носителях при условии, что оригинальная работа должным образом процитирована. Контактный автор: Акбар Хан E-mail: [email protected]
ВВЕДЕНИЕ
Почечная плоскоклеточная карцинома («РСКК») — это редкая форма рака почки, которая исходит из почечной лоханки. РСКК составляет около 0,5 — 0,8% всех злокачественных опухолей почек (Bhaijee 2012). Хотя при локализованном заболевании хирургическое вмешательство иногда приводит к излечению, метастатическая плоскоклеточная карцинома почки («mRSCC») считается неизлечимой (Holmang et al. 2007). В многочисленных публикациях врачей, имеющих опыт лечения РСКК, установлено, что этот тип рака является радиорезистентным, а системная химиотерапия дает незначительный эффект. (Bhandari et al. 2010), (Di Battista et al. 2012), (Kimura et al. 2000), (Li and Cheung 1987). Средняя выживаемость на поздних стадиях заболевания крайне низкая (в пределах нескольких месяцев), а пятилетняя выживаемость составляет менее 10% (Holmang et al. 2007). В обзоре 15 случаев Ли и др. сообщили, что медиана выживаемости составила 3,5 месяца (Lee et al. 1998).
Был проведен поиск в Medline (Medline RSCC 2012), чтобы определить, были ли зарегистрированы случаи длительной полной ремиссии мРЩЖ. В результате было обнаружено более 200 ссылок на РСКК, но только один опубликованный случай 5-летней полной ремиссии/излечения (Carlson 1960). В этом случае пациенту была выполнена полная нефроуретерэктомия, включая резекцию околопочечного жира и манжетки мочевого пузыря. Патология не показала вовлечения хирургических краев, и метастазы не были зарегистрированы.
Дихлорацетат натрия («ДХН») — это препарат, который широко изучался для лечения врожденного молочнокислого ацидоза, входящего в группу наследственных митохондриальных заболеваний (Stacpoole et al. 2006), (Stacpoole et al. 1992), (Stacpoole et al. 1988). Профиль безопасности применения DCA у людей был установлен в ходе этой работы. Было установлено, что это относительно безопасный препарат, без гематологической, сердечной, легочной или почечной токсичности. Основной токсичностью является неврологическая (в основном периферическая невропатия), которая является обратимой (Kaufmann et al. 2006). Наблюдался вызванный ДКА делирий, который также обратим после прекращения приема препарата (Brandsma et al. 2010). У небольшого процента пациентов может наблюдаться незначительное обратимое повышение уровня печеночных ферментов (Stacpoole et al. 2008).
В январе 2007 года была опубликована историческая статья, в которой было показано, что DCA эффективен при лечении рака груди, легких и мозга человека in vitro и in vivo (крысы) с помощью новых метаболических путей (Bonnet et al. 2007). Было показано, что DCA ингибирует митохондриальную киназу пируватдегидрогеназы, что приводит к ингибированию аэробного гликолиза, обычного пути производства энергии в раковых клетках человека (известный как эффект Варбурга). Поскольку раковые клетки обычно не способны переходить на окисление глюкозы при ингибировании гликолиза, клетки, обработанные ДКА, будут истощены в плане энергообеспечения АТФ (Xu et al. 2005). Также было продемонстрировано, что DCA избирательно запускает апоптоз в раковых клетках путем снижения мембранного потенциала гиперполяризованных митохондрий и активации калиевых каналов Kv1.5 (Bonnet et al. 2007).
С 2007 года исследования DCA продолжались, и было показано, что DCA обладает эффективностью in vitro против множества клеточных линий рака человека, включая рак яичников (Saed et al. 2011), нейробластому (Vella et al. 2012), толстую кишку (Tong et al. 2011), карциноид легкого (Fiebiger et al. 2011), шейку матки (Xie et al. 2011) и эндометрий (Wong et al. 2008). Синергизм с радиотерапией также был продемонстрирован на клеточных линиях рака простаты (Cao et al. 2008). Механизм синергизма, предложенный Cao и др., заключается в увеличении экспрессии BCL-2-ассоциированного белка X (проапоптотического внутриклеточного белка), что приводит к увеличению скорости апоптоза. DCA также показал эффективность in vivo у людей против глиобластомы (Michelakis et al. 2010).
Автор начал использовать терапию DCA «off-label» с 2007 года для лечения онкологических больных, которые имели плохой прогноз или не отвечали на традиционные методы лечения рака. Наблюдение за пациентами, получавшими терапию DCA, показало, что значительное число пациентов получает пользу от применения этого препарата либо по субъективным критериям, таким как уменьшение боли, либо по объективным критериям, таким как уменьшение опухоли (Medicor DCA Data 2009).
Презентация случая
Женщина 72 лет обратилась к семейному врачу с болями в правом бедре, гематурией и потерей веса. Ультразвуковое исследование выявило образование в правой почке. Была проведена компьютерная томография (КТ), которая показала наличие опухоли в правой почечной лоханке, верхнем и нижнем полюсах почки и распространение на проксимальный правый мочеточник (рис. 1). В брюшной полости были множественные увеличенные лимфатические узлы (Рисунок 2). Было проведено сканирование костей, которое дало отрицательный результат на наличие костных метастазов.
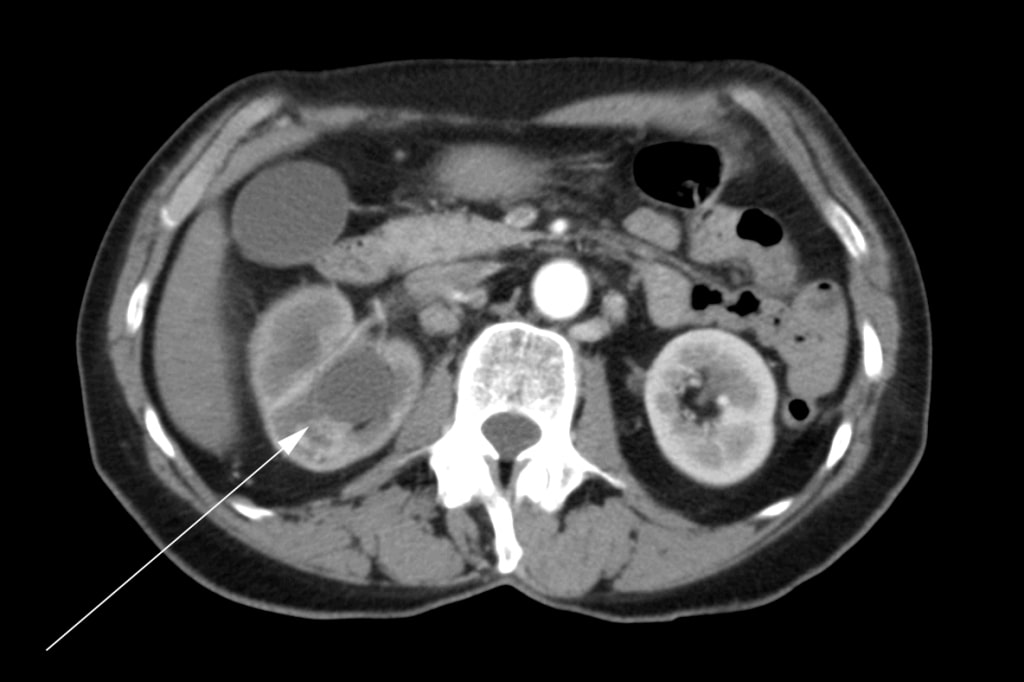
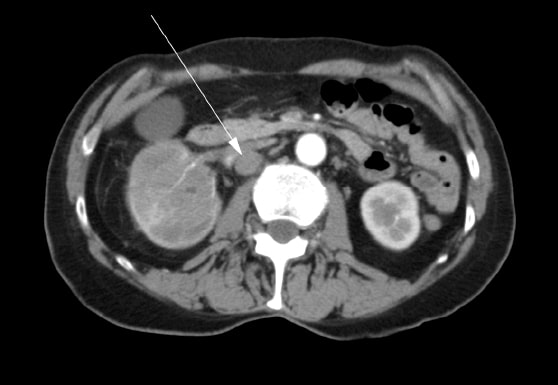
В мае 2007 года пациентке была проведена правосторонняя радикальная нефрэктомия. В оперативном отчете было отмечено, что полное иссечение было невозможно. Почечная вена была вовлечена в процесс, и ее не удалось полностью очистить от опухоли. Во время операции были визуализированы множественные патологические лимфатические узлы, простирающиеся вверх по нижней полой вене, но они не были удалены. Была проведена интраоперационная биопсия одного из лимфатических узлов. Окончательная гистопатология подтвердила диагноз плоскоклеточной карциномы почки с положительным хирургическим краем и метастазами в лимфатических узлах. После операции пациентка была направлена на консультацию к лучевому терапевту. С августа по сентябрь 2007 года она прошла курс лучевой терапии с паллиативной целью на парааортальную область брюшной полости с 4500 сГр в 25 фракциях в течение 5 недель. Была проведена консультация с медицинской онкологией, и ей не было предложено лечение химиотерапией.
Пациентка узнала об исследовании рака с помощью ДКА из местных СМИ и решила изучить возможность применения ДКА в качестве постоянного лечения, учитывая ее плохой прогноз. Она посетила клинику автора для консультации по терапии DCA.
Во время первого визита в клинику была изучена полная история болезни. При осмотре была выявлена здоровая женщина с нормальными жизненными показателями и отсутствием значимых физических проявлений. Первичные анализы крови были в целом хорошими. Единственными отклонениями были легкое повышение мочевины до 7,4 (норма 3,0 — 7,1 ммоль/л) и низкое количество лимфоцитов 0,6 (норма 1,2 — 3,4 х109/л). Это не вызвало беспокойства, так как легкое повышение мочевины или креатинина ожидалось бы у пациента после нефрэктомии.
Лечение DCA
Риски и преимущества DCA были обсуждены, и пациентка согласилась на лечение DCA, которое было начато в течение 3 недель после последней фракции паллиативной радиотерапии. Пациентка начала принимать DCA по 500 мг перорально два раза в день (18 мг/кг/день), с циклом 2 недели в день / 1 неделя перерыва. Циклическое лечение было выбрано в связи с предыдущим опытом автора о неприемлемом уровне побочных эффектов у взрослых пациентов при непрерывном приеме DCA. Ей был назначен бенфотиамин (липидорастворимая форма витамина B1) 80 мг перорально дважды в день и R-альфа-липоевая кислота 150 мг перорально 3 раза в день для снижения риска нейропатии, вызванной ДКА, поскольку оба этих природных соединения имеют доказанные преимущества при лечении нейропатии другой этиологии (Ziegler et al. 1999), (Winkler et al. 1999). Ей также начали давать пантопразол 40 мг перорально один раз в день для предотвращения расстройства желудка от DCA. После первого 3-недельного цикла доза DCA была увеличена до 500 мг перорально три раза в день (27 мг/кг/день). Дозу повышали поэтапно, чтобы обеспечить переносимость, поскольку метаболизм ДКА снижается с возрастом пациента (Shroads et al. 2008).
В течение первого месяца лечения ДКА пациентка в целом чувствовала себя хорошо, за исключением легкой усталости, которая также могла быть побочным эффектом радиотерапии. Даже при увеличении дозы DCA через 3 недели, в течение второго месяца терапии никаких проблем не возникало. Прием DCA был прекращен к концу третьего месяца из-за новых симптомов, указывающих на периферическую нейропатию.
На момент прекращения приема DCA пациентке была проведена трифазная компьютерная томография, которая не выявила никаких признаков остаточного рака. Еще через 6 месяцев пациентке была проведена КТ, которая снова не выявила признаков рака (рис. 3).
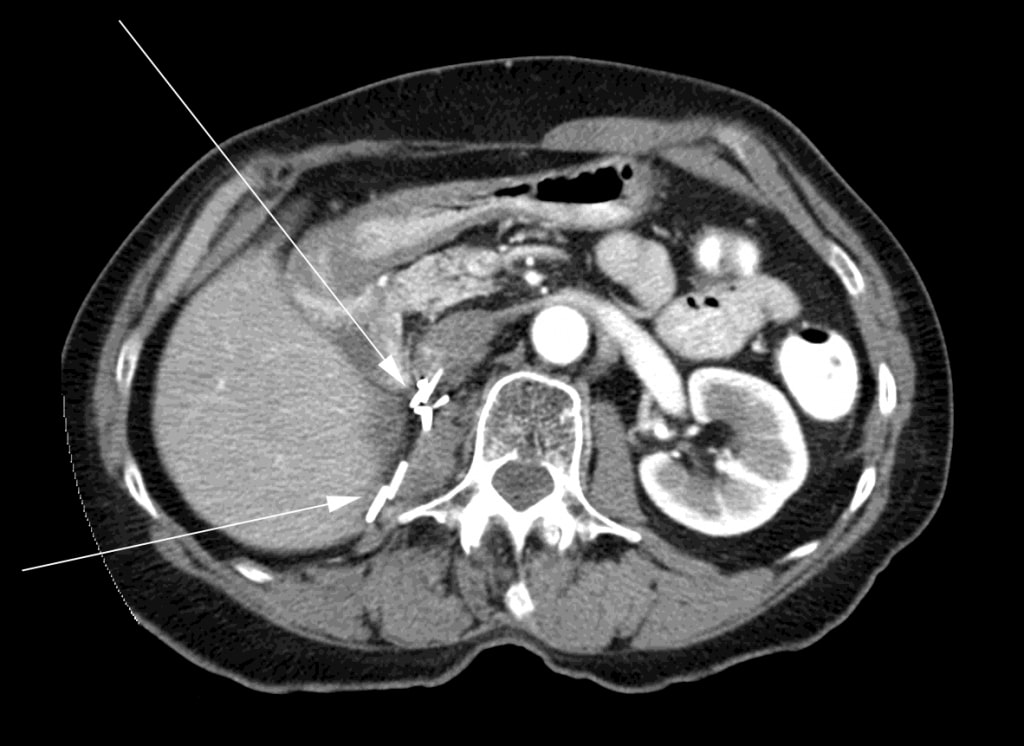
Пациентка продолжала находиться под регулярным наблюдением в онкологической клинике местной больницы, делая плановые КТ примерно каждые 6 месяцев. Последняя компьютерная томография, проведенная в октябре 2011 года, не выявила признаков рецидива РМСК. Повторный визит к радиационному онкологу в декабре 2011 года подтвердил отсутствие рецидива. Физическое обследование было нормальным, а статус работоспособности — 0 по шкале ECOG. В сентябре 2011 года исполнилось 4 года с момента лучевой терапии и начала лечения DCA, а в декабре 2011 года исполнилось 4 года с момента завершения 3-месячной терапии DCA. По состоянию на сентябрь 2012 года, 5 лет с момента начала терапии DCA, пациентка остается бессимптомной. За это время она не получала никакого другого лечения рака (включая DCA), поскольку никогда не было никаких признаков рецидива заболевания.
Обсуждение
Мы считаем, что это первый опубликованный случай длительной полной ремиссии (и вероятного излечения) МРЩЖ. В литературе, индексируемой в Medline, за 50 лет имеется только одно подобное сообщение о 5-летней полной ремиссии РСКК, однако у этого пациента не было метастатического заболевания. Наш случай заслуживает пристального внимания, поскольку РСКК является очень агрессивным заболеванием с медианой выживаемости в пределах нескольких месяцев при использовании всех доступных традиционных методов лечения.
Только радиотерапия дает мало преимуществ в выживании при РМСК (Holmang et al. 2007). Увеличение продолжительности паллиативной радиотерапии на 5 недель в данном случае еще больше снижает шансы на излечение (и без того маловероятные, исходя из типа рака) за счет снижения гибели клеток в результате процесса, называемого «ускоренной репопуляцией». Репопуляция определяется как способность клеток в ткани пополняться после дозы облучения. Репопуляция увеличивается по мере удлинения общего времени доставки дозы радиации во время курса фракционированной радиотерапии. Этот эффект уменьшает вред для здоровых тканей, но также уменьшает гибель раковых клеток, что соответствует цели паллиации. Репопуляция наиболее выражена при общей продолжительности лучевой терапии 4-6 недель и более, а эта пациентка получала фракционированную радиотерапию в течение 5 недель (Abeloff May 21, 2008).
Как отмечалось ранее, ДКА обладает синергизмом с радиотерапией при раке предстательной железы. Опыт автора в лечении пациентов с помощью DCA позволяет предположить, что синергизм с радиотерапией может иметь место при различных видах рака, помимо рака простаты. Примеры: женщина 53 лет с трехлетней полной ремиссией карциномы железы Бартолина, пролеченная с помощью облучения и адъювантного DCA, и женщина 32 лет с трехлетней полной ремиссией анапластической астроцитомы после химиолучевого лечения с адъювантным DCA (случаи готовятся к публикации).
В этом случае мРСКК адъювантное применение DCA после курса радиотерапии привело к удивительной полной ремиссии, без каких-либо вредных побочных эффектов, за исключением обратимой периферической нейропатии. У этого пациента профилактический прием бенфотиамина и R-альфа-липоевой кислоты не остановил развитие периферической нейропатии от DCA. В настоящее время автор добавляет ацетил-лкарнитин в схему профилактики нейропатии при ДКА, поскольку он также имеет доказанные преимущества при лечении нейропатии другой этиологии, например, диабетической, химиоиндуцированной и антиретровирусной нейропатии (Herzmann et al. 2005), (Quatraro et al. 1995), (De Grandis and Minardi 2002), (Bianchi et al. 2005).
В настоящее время нет активных клинических исследований, изучающих роль DCA в комбинации с радиотерапией. В настоящее время проводится одно исследование DCA в комбинации с химиотерапией и облучением при карциноме головы и шеи (Clinicaltrials.gov 2012). Из-за непатентованного статуса DCA исследователям было трудно найти средства для проведения дорогостоящих испытаний на людях. Мы надеемся, что публикация наглядных примеров, иллюстрирующих преимущества DCA в качестве адъюванта к традиционным методам лечения рака, побудит исследователей найти новые креативные механизмы сбора средств, чтобы DCA мог быть официально исследован в дальнейших испытаниях на людях. Мы надеемся, что таким образом DCA получит более широкое признание в онкологическом сообществе и будет использоваться на благо пациентов с неизлечимыми злокачественными опухолями.
Поскольку завершение клинических испытаний на людях может занять много лет, в промежуточный период мы считаем этичным с осторожностью назначать ДКА в сочетании с паллиативной радиотерапией или после нее пациентам, которые полностью понимают и принимают риски и преимущества. DCA может играть дальнейшую роль в качестве нового терапевтического подхода в сочетании с радиотерапией при радиорезистентном неметастатическом раке, но это еще предстоит выяснить.
Благодарность
Автор выражает благодарность доктору Хумайре Хан и доктору Исааку Элиасу за помощь в подготовке данного отчета, а также пациентке за согласие на публикацию ее случая.
Заявление автора о раскрытии информации
Автор назначает препараты для лечения рака (включая дихлорацетат), которые предоставляются за плату через онкологические центры Medicor. Эта клиника принадлежит члену семьи автора.
ССЫЛКИ
1 Абелофф, М. Д., Армитаж, Дж. О., Нидерхубер, Дж. Е., Кастан, М. Б. и МакКенна, В. Г. (21 мая 2008 г.). Клиническая онкология Абелова, 4-е издание, глава: Биологические эффекты радиации.2 Bhaijee, F. (2012). «Squamous Cell Carcinoma of the Renal Pelvis», Ann Diagn Pathol, 16(2), 124-7.
3 Bhandari, A., Alassi, O., Rogers, C. & MacLennan, G. T. (2010). «Squamous Cell Carcinoma of the Renal Pelvis,» J Urol, 183(5), 2023-4.
4 Bianchi, G., Vitali, G., Caraceni, A., Ravaglia, S., Capri, G., Cundari, S., Zanna, C. & Gianni, L. (2005). «Симптоматическая и нейрофизиологическая реакция нейропатии, вызванной паклитакселом или цисплатином, на пероральный ацетил-L-карнитин», Eur J Cancer, 41(12), 1746-50.
5 Бонне, С., Арчер, С. Л., Аллалунис-Тернер, Ж., Хароми, А., Болье, К., Томпсон, Р., Ли, К. Т., Лопащук, Г. Д., Puttagunta, L., Bonnet, S., Harry, G., Hashimoto, K., Porter, C. J., Andrade, M. A., Thebaud, B. & Michelakis, E. D. (2007). «Ось Митохондрия-К+ канал подавлена в раке, и ее нормализация способствует апоптозу и ингибирует рост рака», Cancer Cell, 11(1), 37-51.
6 Brandsma, D., Dorlo, T. P. C., Haanen, J. H., Beijnen, J. H. & Boogerd, W. (2010). «Severe Encephalopathy and Polyneuropathy Induced by Dichloroacetate,» J Neurol, 257(12), 2099-100.
7 Cao, W., Yacoub, S., Shiverick, K. T., Namiki, K., Sakai, Y., Porvasnik, S., Urbanek, C. & Rosser, C. J. (2008). «Дихлорацетат (DCA) сенсибилизирует как клетки рака простаты дикого типа, так и клетки с избыточной экспрессией Bcl-2 in vitro к радиации», Простата, 68(11), 1223- 31.
8 Карлсон, Х. Э. (1960). «Squamous Cell Carcinoma of the Renal Pelvis: Пятилетнее излечение», J Urol, 83, 813-4.
9 Clinicaltrials.Gov (2012). [Online], Available: http://clinicaltrials.gov/ct2/results?term= dichloroacetate+radiotherapy [accessed Sept 1, 2012].
10 De Grandis, D. & Minardi, C. (2002). «Acetyl-L-Carnitine (Levacecarnine) in the Treatment of Diabetic Neuropathy. A LongTerm, Randomised, Double-Blind, PlaceboControlled Study,» Drugs R D, 3(4), 223-31.
11 Di Battista, L., Stio, F., Guarino, S., Galani, A., Maturo, A., Dimko, M., Mancini, M. & Gallo, P. (2012). «Сквамозно-клеточная карцинома почечной лоханки с камнями и инфильтрацией нижней полой вены. Отчет о случае», G Chir, 33(5), 182-5.
12 Фибигер, В., Ольшевски, У., Ульспергер, Е., Гайслер, К. и Гамильтон, Г. (2011). «Цитотоксичность новых препаратов на основе платины и дихлорацетата против линий карциноидных клеток легких in vitro», Clin Transl Oncol, 13(1), 43-9.
13 Херцманн, К., Джонсон, М. А. и Юле, М. (2005). «Long-Term Effect of Acetyl-LCarnitine for Antiretroviral Toxic Neuropathy,» HIV Clin Trials, 6(6), 344-50.
14 Холманг, С., Леле, С. М. и Йоханссон, С. Л. (2007). «Сквамозно-клеточная карцинома почечной лоханки и мочеточника: Заболеваемость, симптомы, лечение и результаты», J Urol, 178(1), 51-6.
15 Kaufmann, P., Engelstad, K., Wei, Y., Jhung, S., Sano, M. C., Shungu, D. C., Millar, W. S., Hong, X., Gooch, C. L., Mao, X., Pascual, J. M., Hirano, M., Stacpoole, P. W., Dimauro, S. & De Vivo, D. C. (2006). «Дихлорацетат вызывает токсическую нейропатию при MELAS: рандомизированное контролируемое клиническое испытание», Неврология, 66(3), 324-30.
16 Kimura, T., Kiyota, H., Asano, K., Madarame, J., Yoshino, Y., Miki, K., Abe, K., Hasegawa, T. & Ohishi, Y. (2000). «Сквамозно-клеточная карцинома почечной лоханки с расширением нижней полой вены», Int J Urol, 7(8), 316- 9; обсуждение 320.
17 Lee, T. Y., Ko, S. F., Wan, Y. L., Cheng, Y. F., Yang, B. Y., Huang, D. L., Hsieh, H. H., Yu, T. J. & Chen, W. J. (1998). «Renal Squamous Cell Carcinoma: CT Findings and Clinical Significance,» Abdom Imaging, 23(2), 203-8.
18 Li, M. K. & Cheung, W. L. (1987). «Squamous Cell Carcinoma of the Renal Pelvis,» J Urol, 138(2), 269-71.
19 Medicor (DCA Data 2009) [онлайн], Available: www.medicorcancer.com/DCAdata.html [accessed Oct 1, 2012]. Medline (RSCC 2012) [онлайн], Доступно: http://www.ncbi.nlm.nih.gov/pubmed, Критерии поиска: Renal [title] oR kidney [Title] and («Squamous Cell Carcinoma»[Title]) [Accessed Oct 1, 2012].
20 Michelakis, E. D., Sutendra, G., Dromparis, P., Webster, L., Haromy, A., Niven, E., Maguire, C., Gammer, T. L., Mackey, J. R., Fulton, D., Abdulkarim, B., McMurtry, M. S. & Petruk, K. C. (2010). «Metabolic Modulation of Glioblastoma with Dichloroacetate,» Sci Transl Med, 2(31), 31ra34.
21 Quatraro, A., Roca, P., Donzella, C., Acampora, R., Marfella, R. & Giugliano, D. (1995). «Acetyl-L-Carnitine for Symptomatic Diabetic Neuropathy,» Diabetologia, 38(1), 123.
22 Saed, G. M., Fletcher, N. M., Jiang, Z. L., AbuSoud, H. M. & Diamond, M. P. (2011). «Dichloroacetate Induces Apoptosis of Epithelial Ovarian Cancer Cells Through a Mechanism Involving Modulation of Oxidative Stress,» Reprod Sci, 18(12), 1253- 61.
23 Shroads, A. L., Guo, X., Dixit, V., Liu, H. P., James, M. O. & Stacpoole, P. W. (2008). «Кинетика и метаболизм дихлорацетата в зависимости от возраста: Possible Relevance to Toxicity,» J Pharmacol Exp Ther, 324(3), 1163-71.
24 Stacpoole, P. W., Gilbert, L. R., Neiberger, R. E., Carney, P. R., Valenstein, E., Theriaque, D. W. & Shuster, J. J. (2008). «Оценка долгосрочного лечения детей с врожденным молочным ацидозом дихлорацетатом», Педиатрия, 121(5), E1223-8.
25 Стакпул, П. В., Керр, Д. С., Барнс, К., Банч, С. Т., Карни, П. Р., Феннелл, Е. М., Фелицын, Н. М., Гилмор, Р. Л., Грир, М., Хендерсон, Г. Н., Хатсон, А. Д., Нейбергер, Р. Е., О’Брайен, Р. Г., Перкинс, Л. А., Квислинг, Р. Г., Шроадс, А. Л., Шустер, Ж. Ж., Сильверштейн, Ж. Х., Териаке, Д. В. и Валенштейн, Э. (2006). «Контролируемое клиническое испытание дихлорацетата для лечения врожденного молочного ацидоза у детей», Педиатрия, 117(5), 1519-31.
26 Stacpoole, P. W., Lorenz, A. C., Thomas, R. G. & Harman, E. M. (1988). «Дихлорацетат в лечении молочного ацидоза», Ann Intern Med, 108(1), 58-63.
27 Stacpoole, P. W., Wright, E. C., Baumgartner, T. G., Bersin, R. M., Buchalter, S., Curry, S. H., Duncan, C. A., Harman, E. M., Henderson, G. N., Jenkinson, S. & Et Al. (1992). «Контролируемое клиническое испытание дихлорацетата для лечения молочного ацидоза у взрослых. The Dichloroacetate-Lactic Acidosis Study Group,» N Engl J Med, 327(22), 1564-9.
28 Tong, J., Xie, G., He, J., Li, J., Pan, F. & Liang, H. (2011). «Синергетический противоопухолевый эффект дихлорацетата в комбинации с 5-фторурацилом при колоректальном раке», J Biomed Biotechnol, 2011, 740564.
29 Велла, С., Конти, М., Тассо, Р., Канседда, Р. и Пагано, А. (2012). «Dichloroacetate Inhibits Neuroblastoma Growth by Specifically Acting Against Malignant Undifferentiated Cells,» Int J Cancer, 130(7), 1484-93.
30 Winkler, G., Pal, B., Nagybeganyi, E., Ory, I., Porochnavec, M. & Kempler, P. (1999). «Эффективность различных режимов дозировки бенфотиамина при лечении болезненной диабетической нейропатии», Arzneimittelforschung, 49(3), 220-4.
31 Вонг, Дж. Й. Й., Хаггинс, Г. С., Дебидда, М., Мунши, Н. К. и Де Виво, И. (2008). «Дихлорацетат индуцирует апоптоз в клетках рака эндометрия», Gynecol Oncol, 109(3), 394-402.
32 Xie, J., Wang, B. S., Yu, D. H., Lu, Q., Ma, J., Qi, H., Fang, C. & Chen, H. Z. (2011). «Дихлорацетат смещает метаболизм с гликолиза на окисление глюкозы и демонстрирует синергетическое ингибирование роста с цисплатином в клетках Hela», Int J Oncol, 38(2), 409-17.
33 Xu, R. H., Pelicano, H., Zhou, Y., Carew, J. S., Feng, L., Bhalla, K. N., Keating, M. J. & Huang, P. (2005). «Ингибирование гликолиза в раковых клетках: A Novel Strategy to Overcome Drug Resistance Associated with Mitochondrial Respiratory Defect and Hypoxia,» Cancer Res, 65(2), 613-21.
34 Ziegler, D., Hanefeld, M., Ruhnau, K. J., Hasche, H., Lobisch, M., Schutte, K., Kerum, G. & Malessa, R. (1999). «Лечение симптоматической диабетической полинейропатии антиоксидантом альфа-липоевой кислотой: A 7-Month Multicenter Randomized Controlled Trial (ALADIN III Study). Исследовательская группа ALADIN III. Alpha-Lipoic Acid in Diabetic Neuropathy,’ Diabetes Care, 22(8), 1296-301.