Сесили Абильдгаард1, Кристина Даль1, Ахмад Абдул-Ал1, Аннет Кристенсен1 и Пер Гульдберг1
1 Исследовательский центр Датского онкологического общества, Копенгаген, Дания
Корреспонденция: Пер Гульдберг, e-mail: [email protected]
Получено: 19 апреля 2017 г.
Принято: 19 июля 2017 г.
Опубликовано: 24 августа 2017 г
Аннотация
Дисрегуляция метаболизма во время прогрессии меланомы тесно связана с приобретением генетических и эпигенетических изменений в регуляторах метаболических путей. Рецептор ретиноевой кислоты бета (RARβ) эпигенетически заглушен в значительной части меланом, но связь между RARβ и метаболической перестройкой меланомы не установлена. Здесь мы показываем, что в первичных человеческих меланоцитах полностью транс ретиноевая кислота (агонист RARβ) вызывает ингибирование роста, сопровождающееся снижением гликолитического и окислительного метаболизма, тогда как селективное ингибирование RARβ приводит к увеличению базальной скорости гликолиза и повышению чувствительности к ингибированию гликолиза. В клетках меланомы ингибирование RARβ способствовало снижению митохондриального дыхания и повышению гликолитической активности, что привело к энергетическому стрессу и активации энергетического сенсора AMP-активированной протеинкиназы. Этот метаболический сдвиг повышал чувствительность как к ингибированию гликолитической активности, так и к стимуляции митохондриального метаболизма дихлорацетатом, ингибитором киназы пируватдегидрогеназы. В клетках меланомы с мутацией BRAFV600E активация RARβ антагонизировала действие ингибитора BRAF PLX4032 (вемурафениб). В совокупности эти данные свидетельствуют о том, что сигнализация RARβ участвует в регуляции клеточного метаболизма в меланоме и может стать потенциальной мишенью в комбинированных стратегиях лечения.
Ключевые слова: меланома, метаболизм рака, рецептор ретиноевой кислоты β, митохондриальное дыхание, дихлорацетат
Сокращения: ATRA: полностью транс ретиноевая кислота; DCA: дихлорацетат; ECAR: скорость внеклеточного закисления; OCR: скорость потребления кислорода; ROS: реактивные виды кислорода
© Abildgaard et al. Это статья с открытым доступом, распространяемая на условиях лицензии Creative Commons Attribution License 3.0 (CC BY 3.0), которая разрешает неограниченное использование, распространение и воспроизведение на любых носителях при условии указания автора и источника.
ВВЕДЕНИЕ
Меланома, наиболее смертоносная форма рака кожи, является причиной 50 000 смертей ежегодно, причем заболеваемость продолжает расти во всем мире. Хотя первичная кожная меланома излечивается хирургическим путем, при наиболее запущенной форме заболевания (IV стадия) 10-летняя выживаемость составляет 10-15% [1], что отражает ее известную устойчивость к традиционной противораковой терапии. Последние терапевтические достижения включают ингибиторы иммунных контрольных точек и терапию, направленную на онкогены или нижележащие эффекторы пути MAPK (например, ингибиторы BRAF и MEK). Однако развитие приобретенной лекарственной устойчивости в большинстве случаев приводит к рецидиву [2, 3].
Меланома развивается из клеток, вырабатывающих меланин, называемых меланоцитами, в результате многочисленных геномных изменений. Наиболее распространенные факторы развития меланомы включают активирующие мутации в BRAF и NRAS и инактивирующие мутации или делеции в CDKN2A (кодирующие p16INK4A и p14ARF), PTEN и TP53 [4]. Последние данные свидетельствуют о том, что общей функцией некоторых из этих генов является контроль клеточного метаболизма [5, 6]. Во время прогрессирования меланомы клеточный метаболизм перепрограммируется, что означает переход от митохондриального дыхания к аэробному гликолизу, что приводит к повышенному потреблению глюкозы и производству молочной кислоты (эффект Варбурга) [7]. Несколько отчетов, основанных на моделях меланомы in vitro и in vivo и клинических исследованиях пациентов с меланомой, продемонстрировали связь между активирующими мутациями в кодоне V600 BRAF (чаще всего BRAFV600E) и аэробным гликолизом [8-10]. На молекулярном уровне BRAFV600E регулирует окислительное фосфорилирование путем подавления главного регулятора митохондриального биогенеза PGC1α через ингибирование микрофтальмия-ассоциированного фактора транскрипции (MITF). Напротив, ингибирование BRAFV600E приводит к окислительной зависимости через индукцию PGC1α и увеличение митохондриального дыхания [11]. Соответствующее снижение гликолитической активности можно визуализировать с помощью ПЭТ-КТ-сканирования у пациентов с меланомой, получающих лечение ингибиторами BRAF, показывая уменьшение поглощения глюкозы в опухолевой ткани [10]. Клинические испытания III фазы ингибитора BRAFV600E вемурафениба (PLX4032) продемонстрировали улучшение общей и беспрогрессивной выживаемости у пациентов с метастатической меланомой [12]. Митохондриальные ингибиторы были предложены в качестве полезных адъювантов к ингибиторам BRAF-пути для улучшения эффекта или предотвращения развития лекарственной устойчивости [13-15].
В дополнение к хорошо описанным генетическим факторам, геном меланомы содержит многочисленные эпигенетические изменения. Одной из повторяющихся эпигенетических мишеней в меланоме является RARB, кодирующий рецептор ретиноевой кислоты бета (RARβ), который в 45-70% кожных меланом заглушен гиперметилированием промотора [16, 17]. В клетках меланоцитарной линии RARβ опосредует вызванное ретиноевой кислотой (витамином А) торможение роста и меланогенеза — маркера меланоцитарной дифференцировки [18]. Ранее мы показали, что активация RARβ в меланоцитах вызывает повышение уровня p14ARF [17], который защищает от дисфункции митохондрий и окислительного стресса [19]. Здесь мы показываем, что человеческие меланоциты отвечают на активацию RARβ снижением окислительного метаболизма, возможно, как часть реакции дифференциации. В клетках меланомы активация RARβ антагонизирует эффект PLX4032, тогда как ингибирование RARβ вызывает гликолитическую зависимость и энергетический стресс, делая клетки уязвимыми к лечению ингибитором киназы пируватдегидрогеназы дихлорацетатом (DCA).
РЕЗУЛЬТАТЫ
Активация RARβ снижает рост и скорость метаболизма меланоцитов
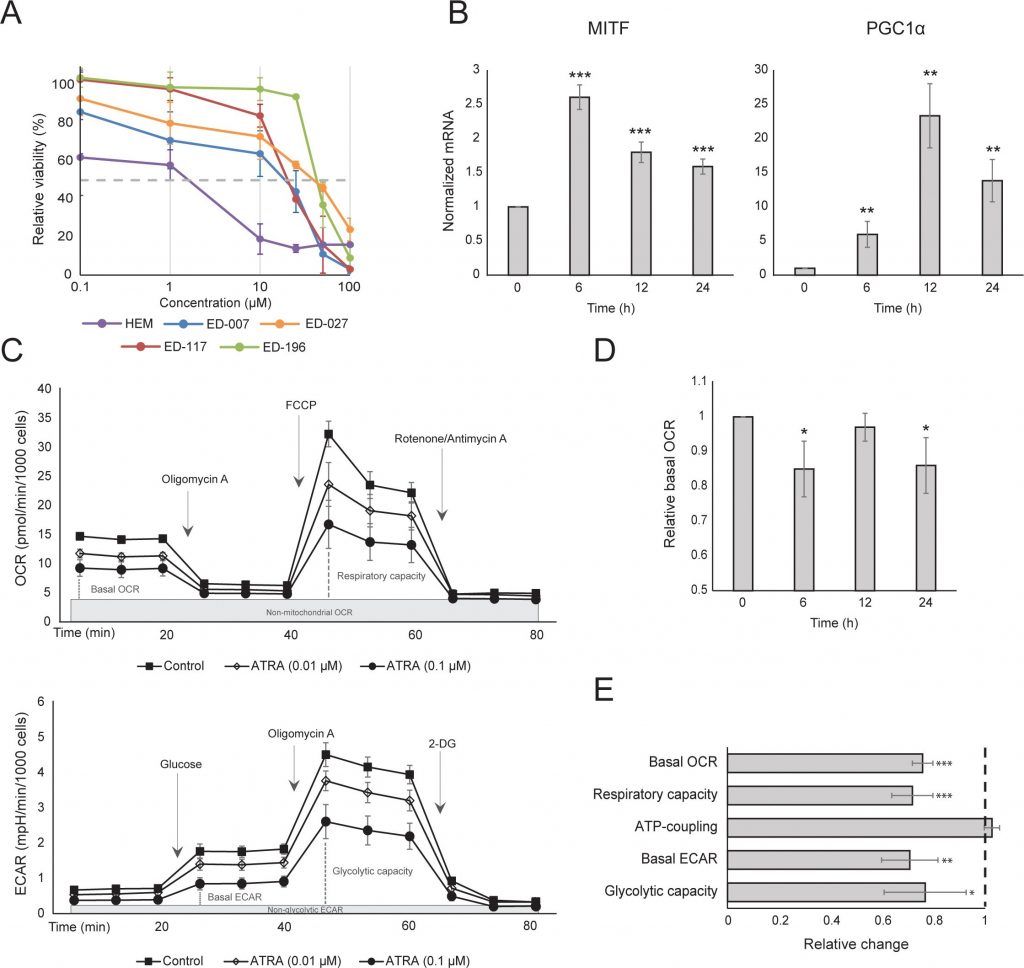
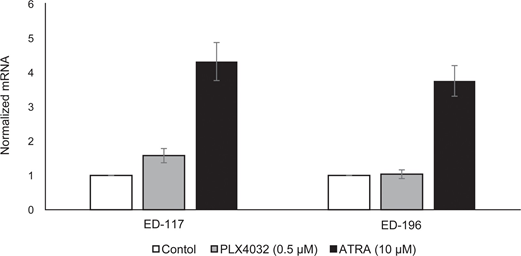
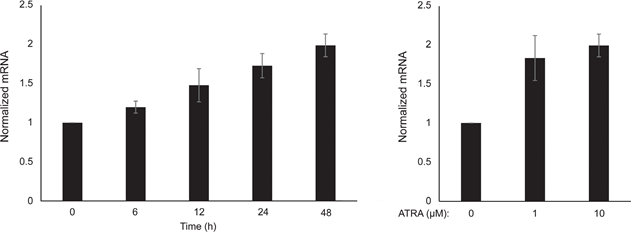
Сначала мы определили влияние активации RARβ на рост первичных эпидермальных меланоцитов человека. Клетки обрабатывали агонистом RARβ — олл-транс-ретиноевой кислотой (ATRA) в течение 6 дней, а реакцию роста определяли с помощью анализа жизнеспособности на основе кристаллического фиолетового. В соответствии с предыдущими отчетами [17, 20, 21], ATRA снижала рост меланоцитов дозозависимым образом (рис. 1А), с IC50 2,4 мкМ (табл. 1). Ранее было показано, что краткосрочное воздействие (<24 ч) ATRA индуцирует дифференцировку и меланогенез в меланоцитах, тогда как долгосрочное воздействие (>24 ч) снижает пролиферацию и индуцирует апоптоз [20, 21]. Мы обнаружили, что ATRA (0,1 мкМ) вызывает транзиторную ап-регуляцию специфического для меланоцитарной линии транскрипционного фактора MITF (микрофтальмия-ассоциированный транскрипционный фактор), экспрессия которого достигает пика через 6 ч, а затем снижается до базального уровня (рис. 1B). В клетках меланомы MITF регулирует экспрессию PGC1α, маркера окислительного фенотипа [22]. Поэтому мы исследовали экспрессию PGC1α в меланоцитах в разные моменты времени после воздействия ATRA (0,1 мкМ). Как показано на рисунке 1B, PGC1α также транзиторно повышался, с задержкой на ~6 часов по сравнению с MITF.
| Клетки/клеточные линии | Клетки/клеточные линии | Характеристики | Характеристика | Характеристика Характеристика | Значения IC50 | Значения IC50 | Значения IC50 | Значения IC50 |
|---|---|---|---|---|---|---|---|---|
| Номер ЭД | Название | Статус BRAF* | Экспрессия RARβ ** | экспрессия p14ARF | ATRA (мкМ) | LE135 (мкМ) | DCA (мМ)*** | PLX4032 (мкМ) |
| HEM# | WT | + | + | 2.4±1.6 | 2.8±0.8 | 69.1±6.4 | NA | |
| ЭД-007 | FM-3 | WT | + | — | 18.6±8.7 | 8.6±1.0 | 12.2±2.2 | NA |
| ED-027 | FM-82 | BRAFV600E | + | + | 39.8±5.3 | 10.7±1.3 | 17.7±2.1 | 0.52±0.04 |
| ED-117 | Мел-НТ3-00 | BRAFV600E | + | + | 25.5±5.0 | NA | 37.6 ±2.2 | 0.51±0.09 |
| ЭД-196 | Ма-Мел-51 | BRAFV600E | + | + | 46.2±9.1 | 8.4±0.4 | 35.8±3.2 | 0.26±0.06 |
Значения IC50 представляют собой среднее ± стандартное отклонение ≥3 независимых экспериментов.
*Подтверждено методом пиросеквенирования
**Подтверждено методом qPCR
***Значения IC50 опубликованы Abildgaard et al. [29]
#Эпидермальные меланоциты человека
В связи с ролью PGC1α в биогенезе митохондрий, мы исследовали, коррелирует ли экспрессия PGC1α с уровнем митохондриального дыхания. Используя прибор Seahorse XFe96, мы измерили скорость потребления кислорода (OCR) и скорость внеклеточного окисления (ECAR), которые являются индикаторами скорости дыхания митохондрий и гликолитической активности, соответственно. OCR и ECAR измеряли во время последовательного добавления метаболических модуляторов, что позволило определить базальные показатели и мощности двух энергетических систем (рис. 1С). Чтобы получить представление о временной зависимости реакции на ATRA, метаболические параметры измеряли после краткосрочного (6-24 ч) и долгосрочного (7 дней) воздействия. После обработки меланоцитов ATRA (0,1 мкМ) в течение 6 или 24 ч базальный OCR был снижен. Однако после 12 ч лечения OCR сравнялся с исходным уровнем (рис. 1D). Эти колебания в метаболическом состоянии совпадали с изменениями в экспрессии MITF и PGC1α. Длительное воздействие (7 дней) низкой дозы ATRA (0,01 мкМ) привело к дальнейшему снижению как базального OCR, так и дыхательной способности (Рисунок 1E).
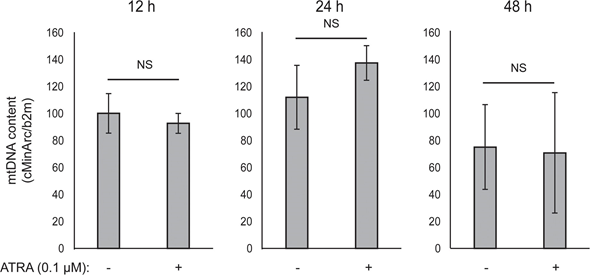
Митохондриальная АТФ-связь не была затронута ATRA (рис. 1E), что привело к чистому снижению производства АТФ в митохондриях. Было показано, что PGC1α повышает уровень uncoupling protein 2 (UCP2), что приводит к небольшому митохондриальному uncoupling [23, 24]. На экспрессию UCP2 в меланоцитах не повлияла обработка ATRA (Дополнительный рисунок 1), что еще больше подтверждает, что АТФ-связь остается неизменной во время активации RARβ. На экспрессию маркеров митохондриальной активности (COX5A, ATP5g1 и NDUFS3) и содержание митохондриальной ДНК также не повлияло лечение ATRA (0,1 мкМ) в течение 24 и 48 часов, соответственно (дополнительные рисунки 1 и 2).
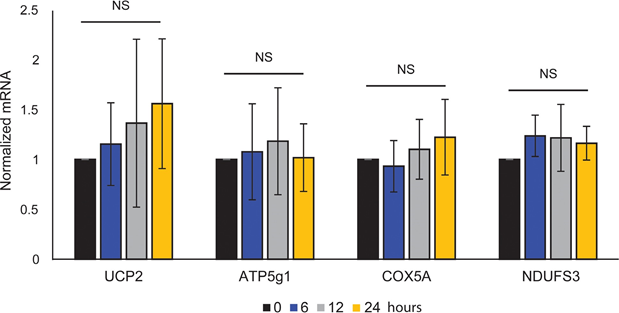
не показало статистической значимости (NS).
После 24 ч лечения ATRA гликолитическая скорость не изменилась (данные не показаны), однако через 7 дней базальная гликолитическая активность и гликолитическая емкость были значительно снижены (рис. 1E). Подавление обеих основных клеточных энергетических систем указывает на то, что меланоциты демонстрируют более низкую потребность в энергии в присутствии ATRA, что может быть следствием снижения роста клеток.
Ингибирование RARβ увеличивает базальную скорость гликолиза и способствует развитию гликолитической зависимости в меланоцитах
Проблемой при изучении клеточных эффектов ATRA является присутствие неизвестных концентраций витамина А в фетальной бычьей сыворотке, необходимого источника микроэлементов в большинстве сред для культивирования клеток [25]. Для более детального изучения роли RARβ-сигнализации в метаболизме меланоцитов мы использовали антагонист RARβ LE135, который действует на RARβ с умеренной селективностью по отношению к RARα и высокой селективностью по отношению к RARγ и RXRα [26].
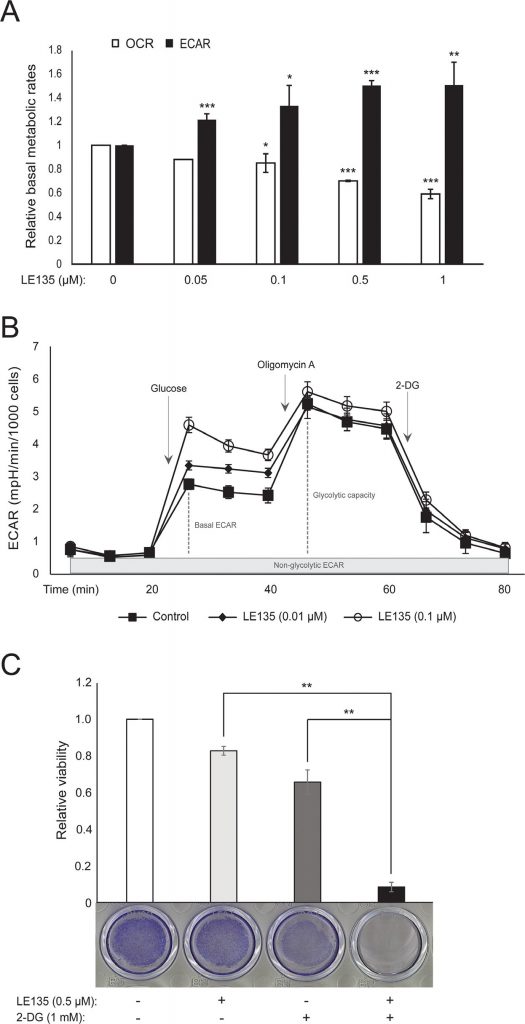
Мы повторили протоколы Seahorse, показанные на рисунке 1С, на меланоцитах, обработанных различными концентрациями LE135 в течение 24 ч и 7 дней. Через 24 ч мы наблюдали дозозависимое увеличение гликолитической активности, при этом базальный ECAR увеличился на 50%, и соответствующее снижение OCR (рис. 2A). После 7 дней лечения базальный ECAR все еще был повышен (Рисунок 2B). Значительного увеличения гликолитической способности не наблюдалось, что говорит о том, что клетки были вынуждены полагаться на гликолиз для производства энергии. Это также подтверждается большей чувствительностью этих клеток к ингибитору гликолиза 2-дезокси-D-глюкозе (2-DG) в присутствии LE135 (Рисунок 2C).
ATRA антагонизирует эффект ингибирования BRAF в клетках меланомы
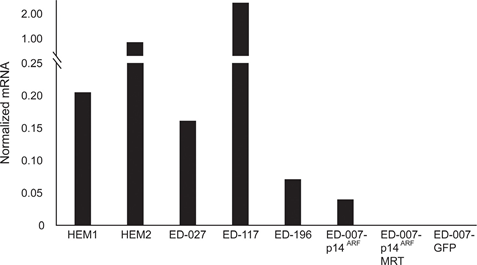
RARB заглушен гиперметилированием промотора во многих меланомах, что позволяет предположить, что он обладает опухолеподавляющими свойствами [16]. В предыдущем исследовании генетических и эпигенетических событий в 110 линиях клеток меланомы мы обнаружили 66% мутаций BRAF и 45% гиперметилирования промотора RARB, при этом корреляция между этими двумя событиями отсутствовала [17]. Чтобы расширить эти данные, мы изучили экспрессию RARβ в 84 клеточных линиях меланомы, а также в эпидермальных меланоцитах человека. Уровни экспрессии сильно различались в разных клеточных линиях меланомы, начиная от полного отсутствия экспрессии до уровней в 27 раз выше, чем в меланоцитах (рис. 3А). Как и ожидалось, гиперметилирование промотора RARB было связано с низким или необнаруживаемым уровнем экспрессии RARβ, за редким исключением. Не было обнаружено связи между мутациями BRAFV600E и уровнем экспрессии RARβ (Рисунок 3A), что позволяет предположить, что чувствительность клеток меланомы к ATRA может быть независимой от статуса BRAF.
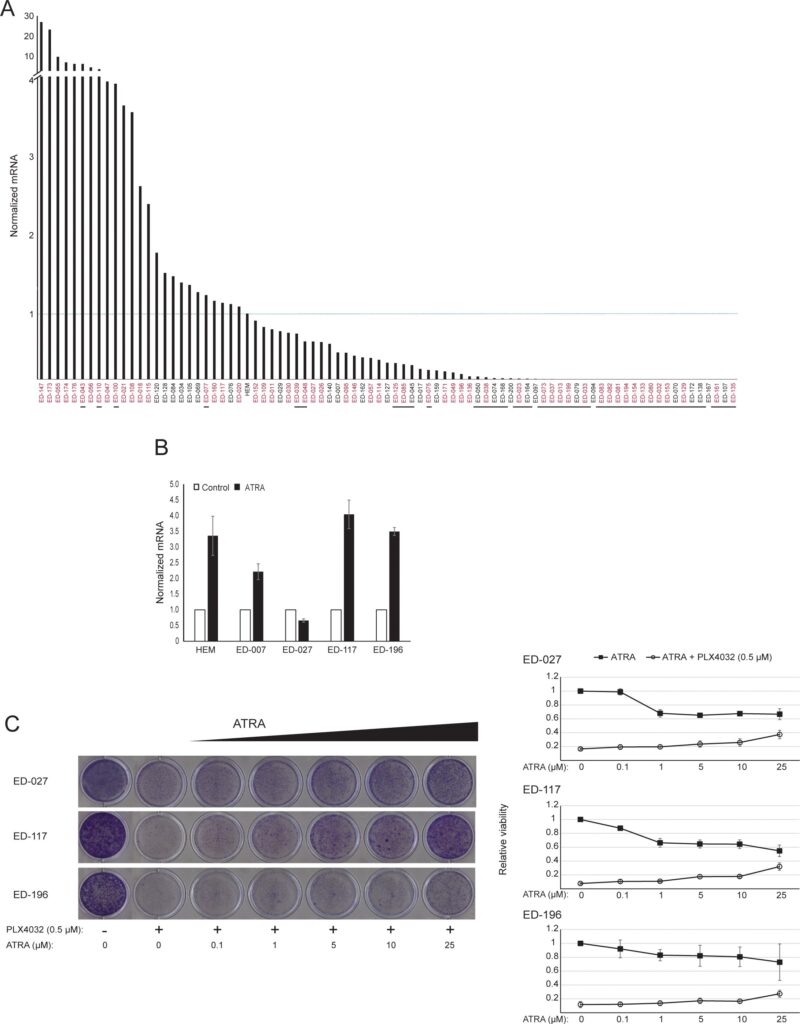
Для дальнейшего изучения роли RARβ-сигнализации в меланоме мы выбрали четыре RARβ-положительные клеточные линии меланомы (ED-007, ED-027, ED-117 и ED-196) для функционального анализа. Три из этих клеточных линий были с мутацией BRAFV600E (ED-027, ED-117 и ED-196) и одна — с диким типом BRAF (ED-007). Лечение ATRA привело к снижению роста всех четырех клеточных линий (Рисунок 1А), хотя их чувствительность была ниже, чем у меланоцитов, о чем свидетельствуют значения IC50 (Таблица 1). Известно, что экспрессия RARβ индуцируется в ответ на ATRA [27]. Как показано на рисунке 3B, RARβ индуцировался в трех из четырех клеточных линий меланомы. Несмотря на более выраженную индукцию RARβ в ED-117 и ED-196, влияние ATRA на экспрессию MITF и PGC1α было ослаблено по сравнению с меланоцитами (Дополнительный рисунок 3). Ранее было показано, что подавление оси MITF/PGC1α является следствием онкогенной активности BRAF [11], что может способствовать снижению ответа на ATRA. В соответствии с этим представлением, клетки дикого типа BRAF демонстрировали самую высокую чувствительность к ATRA, хотя и значительно более низкую, чем меланоциты (Таблица 1).
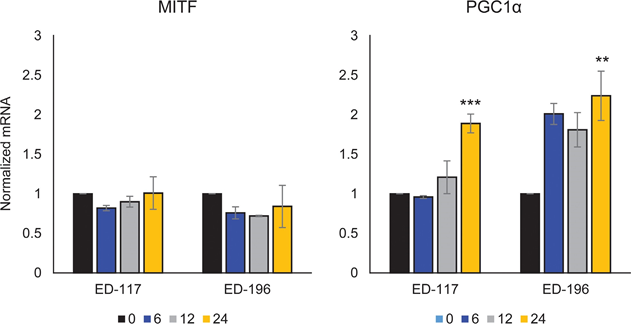
Чтобы выяснить, восстановит ли нацеливание на BRAF с помощью PLX4032 чувствительность к ATRA, мы обработали линии клеток меланомы с мутантом BRAFV600E с помощью PLX4032 в концентрации, близкой к значениям IC50 (см. таблицу 1), в сочетании с возрастающими концентрациями ATRA (0,1-25 мкМ). Интересно, что ATRA усиливала цитотоксический эффект PLX4032 во всех клеточных линиях. Дозозависимый эффект ATRA на рост клеток меланомы, обработанных PLX4032 (Рисунок 3C), указывает на антагонизм между этими двумя соединениями. Лечение PLX4032 (0,5 мкМ) не снижало экспрессию RARβ (Дополнительный рисунок 4), что указывает на другой механизм этого антагонизма.
Влияние ATRA на клеточный метаболизм зависит от статуса p14ARF
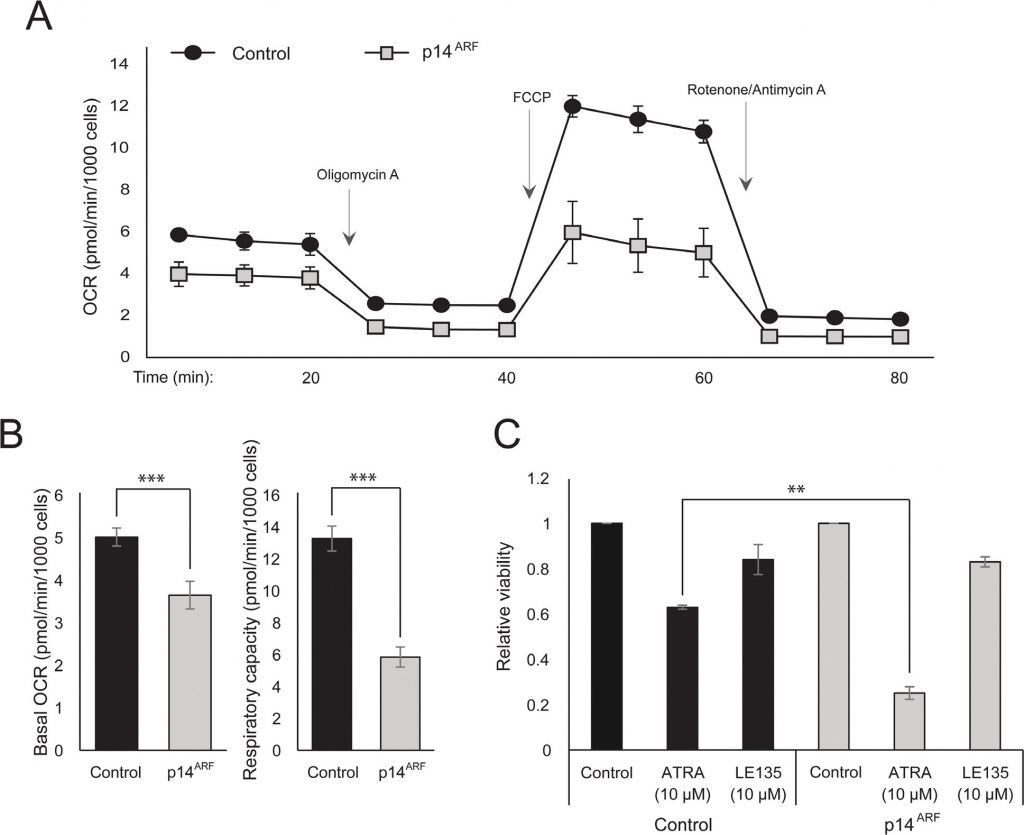
Наблюдение того, что и ATRA, и PLX4032 влияют на биогенез митохондрий, может указывать на метаболическое объяснение антагонистического эффекта этих соединений. Ранее было показано, что p14ARF экспрессируется как цитоплазматический белок в нормальных меланоцитах и защищает эти клетки от дисфункциональных митохондрий [19]. В соответствии с предыдущими результатами [17], ATRA увеличивал экспрессию p14ARF в RARβ-положительных клетках меланомы (Дополнительный рисунок 5). Парадоксально, но хотя p14ARF часто теряется в меланоме в результате делеции локуса CDKN2A, невозможно стабильно нокаутировать ARF в клетках меланомы, экспрессирующих этот ген [17]; данные не показаны). Вместо этого для изучения потенциальной роли p14ARF в опосредовании клеточного ответа на ATRA мы стабильно трансфицировали p14ARF-дефицитную клеточную линию меланомы ED-007 конструкцией EGFP-p14ARF. Экспрессия p14ARF в трансфицированных клетках была проверена с помощью qPCR (Дополнительный рисунок 6). Анализ Seahorse показал различные метаболические профили (Рисунок 4A) со значительно более низким базальным OCR и дыхательной способностью в клетках с восстановленной экспрессией p14ARF по сравнению с клетками, трансфецированными контролем (Рисунок
). Интересно, что клетки, экспрессирующие p14ARF, также показали повышенную чувствительность к ATRA (Рисунок 4C).
Блокирование RARβ вызывает гликолитическую зависимость и энергетический стресс в клетках меланомы и делает их чувствительными к дихлорацетату
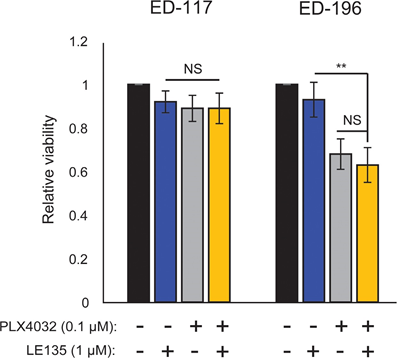
На основании обнаруженного антагонистического эффекта между PLX4032 и ATRA, мы проверили совместное действие PLX4032 и LE135 на потенциальный синергизм в клетках меланомы ED-117 и ED-196. В использованной здесь экспериментальной установке (6 дней лечения PLX4032 [0,1 мкМ] и LE135 [1 мкМ]; Дополнительный рисунок 7) не было продемонстрировано совместного ингибирования роста меланомы.
Для дальнейшего изучения влияния ингибирования RARβ на метаболизм меланомы мы измерили OCR и ECAR в RARβ-положительных клеточных линиях меланомы, обработанных LE135. Подобно тому, что наблюдалось в меланоцитах (Рисунок 2A-2B), LE135 увеличивал базальную гликолитическую скорость и снижал базальное митохондриальное дыхание в клетках меланомы (Рисунок 5A-5B). Этот метаболический сдвиг, который соответствует эффекту Варбурга, был более выражен в клетках меланомы по сравнению с меланоцитами, что привело к увеличению базальной гликолитической скорости для достижения максимальной мощности. Это было проиллюстрировано невозможностью дальнейшего увеличения ECAR после добавления олигомицина А, что указывает на отсутствие метаболической гибкости (Рисунок 5B). Для изучения влияния LE135 на клеточную биоэнергетику мы исследовали состояние фосфорилирования AMP-активируемой протеинкиназы (AMPK). AMPK определяет энергетический статус клетки, реагируя на высокий уровень AMP, который накапливается при снижении соотношения АТФ/АДФ. Таким образом, снижение производства энергии или увеличение ее потребления может способствовать повышению уровня AMP, который связывается с AMPK и приводит к его фосфорилированию и активации [28]. Лечение клеточных линий меланомы препаратом LE135 привело к фосфорилированию AMPK, что указывает на то, что клетки находятся в состоянии энергетического стресса. Рост уровня p-AMPK был заметен уже через 2 ч и далее увеличивался по крайней мере до 48 ч (Рисунок 5C). Эти результаты отличались от результатов в меланоцитах, где обработка LE135 не приводила к активации AMPK (Дополнительный рисунок 8). Как клетки меланомы, так и меланоциты показали снижение роста клеток в течение 6 дней лечения LE135 (значения IC50 представлены в таблице 1). Кроме того, как и меланоциты, LE135 сенсибилизировал клетки меланомы к ингибированию гликолиза с помощью 2-ДГ (Рисунок 5D).
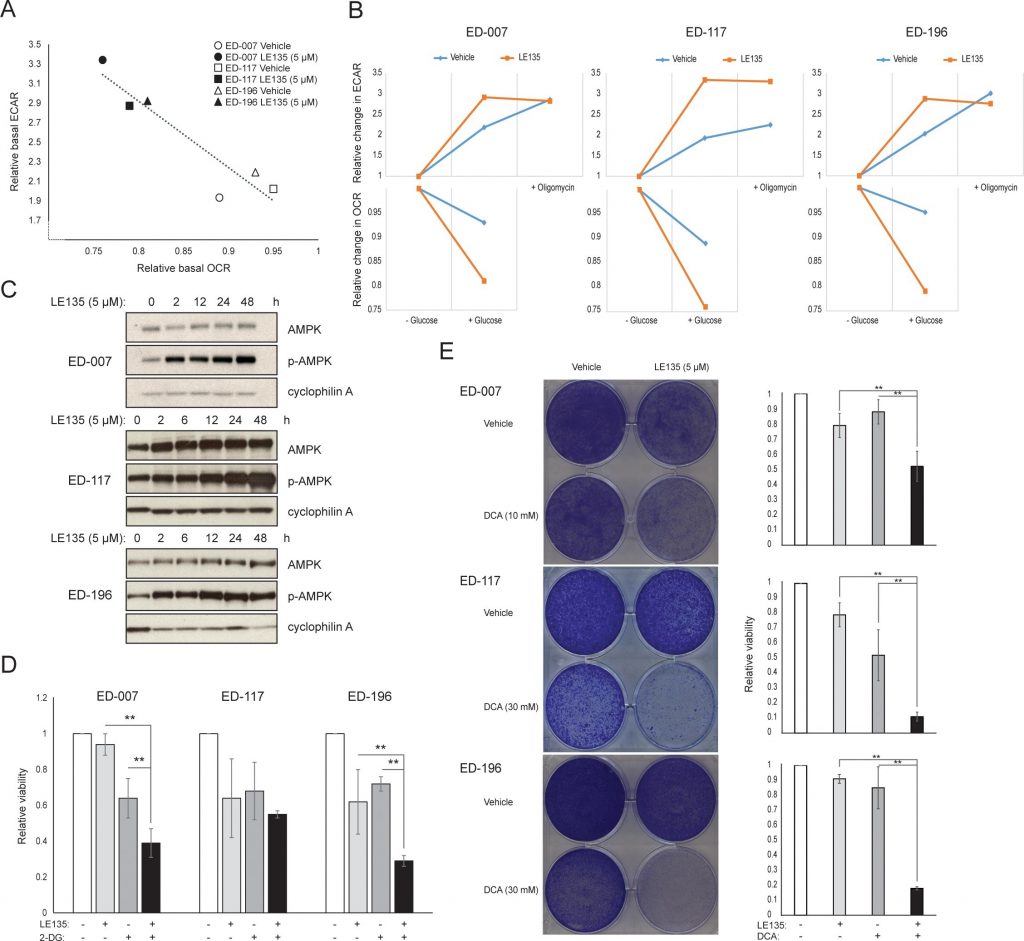
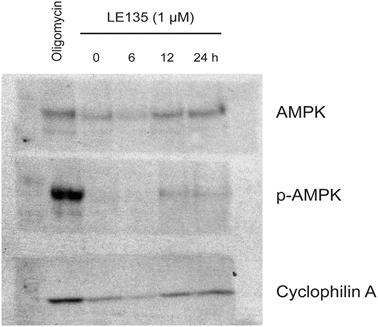
Индукция энергетического стресса с помощью LE135 в клетках меланомы, но не в меланоцитах, указывает на потенциальную терапевтическую значимость этого соединения в комбинированных стратегиях лечения. Ранее было показано, что ингибитор киназы пируватдегидрогеназы DCA подавляет рост клеток меланомы, вызывая сдвиг метаболизма в сторону от гликолиза, делая клетки зависимыми от митохондриального дыхания [9,29-32]. Кроме того, было показано, что DCA подавляет рост ряда клеточных линий меланомы, независимо от статуса BRAF и чувствительности к PLX4032 [29]. Для изучения комбинированного эффекта LE135 и DCA мы применяли концентрации ниже соответствующих значений IC50 для каждой из трех клеточных линий меланомы (см. табл. 1). Несмотря на низкий эффект на снижение роста каждого соединения по отдельности (9-21% для LE135 и 12-48% для DCA), комбинация вызывала снижение роста до 89% (рис. 5E). Эти результаты позволяют предположить, что противоположные эффекты LE135 (стимулирование гликолитической зависимости) и DCA (смещение клеток в сторону от гликолиза) могут действовать синергично для подавления роста меланомы.
ДИСКУССИЯ
ATRA и другие производные витамина А уменьшают клеточный рост и вызывают экспрессию маркеров дифференцировки в различных тканях [33, 34]. Мы обнаружили, что в первичных меланоцитах человека ATRA вызывает преходящее повышение регуляции оси MITF/PGC1α, что согласуется с ATRA-индуцированным повышением функции митохондрий, наблюдаемым в других типах клеток, таких как адипоциты и гепатоциты [35-37]. Однако длительное лечение низкими концентрациями ATRA привело к снижению клеточного роста и скорости метаболизма, что определяется снижением базального гликолиза, а также снижением митохондриального дыхания. Эти метаболические изменения в ответ на ATRA, вероятно, отражают реакцию дифференцировки в сторону непролиферативного состояния, характерного для меланоцитов, обитающих в коже. Блокирование RARβ-сигнализации в этих клетках привело к увеличению базальной гликолитической скорости и соответствующему снижению окислительного метаболизма. Селективное преимущество потери функции RARβ в меланоме, например, путем гиперметилирования RARB, может быть связано с переходом к более гликолиз-зависимому фенотипу, поддерживающему эффект Варбурга.
В отличие от ситуации в первичных меланоцитах, блокирование RARβ-сигнализации в клетках меланомы приводило к энергетическому стрессу, о чем свидетельствовала активация AMPK. Такой ответ может быть результатом меньшей способности клеток меланомы к увеличению гликолиза по сравнению с меланоцитами. В то время как меланоциты имеют относительно низкий базальный уровень гликолиза и могут переключаться на более высокую активность при необходимости, клетки меланомы характеризуются высоким уровнем гликолиза, близким к их максимальной мощности. Таким образом, меланоциты более гибко адаптируются к ингибированию сигнализации RARβ для поддержания энергетического уровня. Это указывает на существование соответствующего терапевтического окна для LE135 и других ингибиторов RARβ в комбинированной терапии, например, с DCA. Подобно метаболическим эффектам ингибирования BRAF, DCA переключает гликолитические раковые клетки с гликолиза на митохондриальное дыхание [9, 38, 39], но в отличие от PLX4032, эффект DCA не ограничивается BRAF-мутированными меланомами [29]. В предыдущем исследовании мы показали, что метаболический сдвиг, вызванный DCA, коррелирует со снижением уровня АТФ, что позволяет предположить, что DCA может воздействовать на биоэнергетический гомеостаз клеток меланомы [29]. Здесь мы обнаружили, что комбинация LE135 и DCA кооперативно ослабляет рост клеток меланомы, экспрессирующих рецептор RARβ. Лечение клеток меланомы либо DCA, либо LE135 может дать им окно для адаптации к новым метаболическим требованиям, в то время как сочетание этих препаратов ограничит метаболическую гибкость и сделает их неспособными поддерживать производство энергии, необходимое для продолжения роста.
Во многих меланомах экспрессия PGC1α низкая из-за подавления MITF онкогенными мутациями BRAF [11]. Этот фенотип поддерживает эффект Варбурга, заставляя клетки переходить на гликолиз для производства энергии. Лечение ингибиторами BRAF восстанавливает экспрессию PGC1α и смещает метаболическую модель обратно в сторону митохондриального дыхания [11, 40]. Цитотоксический эффект ингибирования BRAF может быть усилен из-за наличия дисфункциональных митохондрий в клетках меланомы, что приводит к увеличению производства ROS [13, 41]. Мы обнаружили, что ATRA усиливает рост клеток меланомы в присутствии ингибитора BRAF PLX4032. Основываясь на данных предыдущих исследований [11, 17, 19, 41] и представленных здесь результатах, мы предлагаем модель, объединяющую метаболические эффекты PLX4032 и ATRA и объясняющую их антагонизм (рис. 6). Модель предполагает двойную роль усиления сигнализации RARβ, ведущего к активации PGC1α и биогенезу митохондрий, и в то же время подавления OCR и продукции ROS через индукцию p14ARF. Модель была подтверждена результатами настоящего и более раннего исследования [17], показавшими, что лечение ATRA индуцирует экспрессию p14ARF, а восстановление p14ARF-дефицитных клеток меланомы с помощью p14ARF дикого типа снижает OCR и повышает чувствительность к ATRA. Таким образом, ATRA может снижать чувствительность RARβ-положительных меланом к PLX4032, ограничивая цитотоксичность от производства ROS. Витамин А был предложен для профилактических и терапевтических целей при многих видах рака, включая меланому [42]. Хотя клиническое подтверждение отсутствует, наши результаты свидетельствуют против применения добавок витамина А у пациентов с меланомой, проходящих лечение ингибиторами BRAF, из-за потенциального антагонизирующего эффекта.
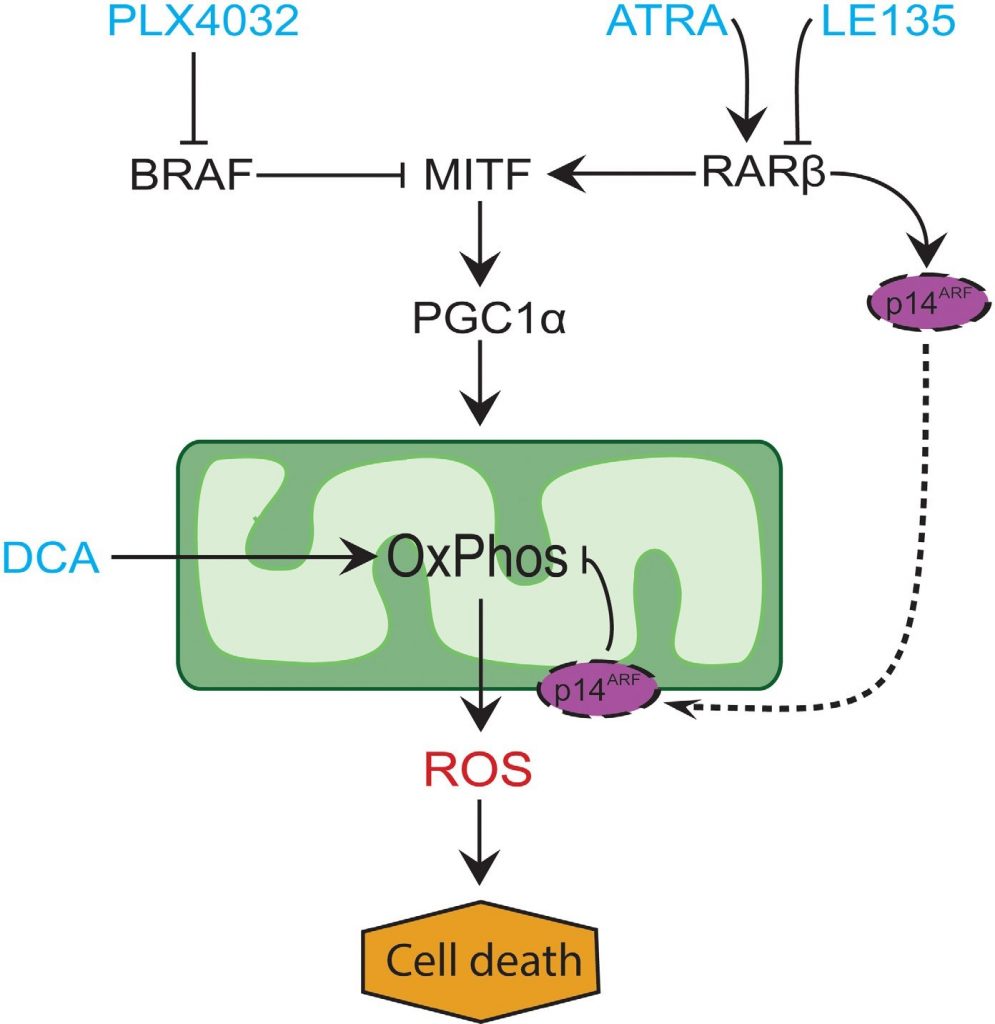
В заключение, мы выявили новую функцию RARβ-сигнализации в метаболизме клеток меланоцитов и меланомы, которая может иметь клиническое значение. Способность RARβ активировать путь MITF-PGC1α и потенциально p14ARF-зависимое снижение митохондриальной дыхательной активности отрицательно влияет на терапевтический ответ на ингибирование BRAF. Однако блокирование сигнализации RARβ способствует гликолитической зависимости в клетках меланомы и усиливает действие DCA, что потенциально может быть использовано в терапевтических целях.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы
Дихлорацетат натрия (DCA), 2-дезокси-D-глюкоза (2-DG), полностью транс ретиноевая кислота (ATRA) и LE135 были приобретены у компании Sigma-Aldrich. DCA и 2-DG были растворены в dH2Oдо рабочей концентрации 1 М. ATRA и LE135 были растворены в ДМСО до рабочей концентрации 0,1 М. PLX4032 (вемурафениб) был приобретен у Selleck Chemicals и растворен в ДМСО до рабочей концентрации 0,05 М.
Культура клеток
Линии клеток меланомы были получены из Европейской поисковой базы данных опухолевых линий (ESTDAB, ED) [43]. Статус этих клеточных линий в отношении мутаций BRAF и метилирования промотора RARB был описан ранее [17]. Первичные эпидермальные меланоциты человека (неонатальные) из легкопигментированной ткани (HEMn-LP; далее — меланоциты) были приобретены у Invitrogen (C0025C). Для экспериментов использовались меланоциты от трех разных людей (Lot № 200706893 от марта 2015 и ноября 2016 года; Lot № 1583282 от февраля 2017 года). Клеточные линии меланомы культивировали при 37°C при 5%CO2 в среде RPMI-1640, дополненной 10% фетальной бычьей сывороткой. Клетки HEMn-LP культивировали в тех же условиях в среде 254CF, дополненной 1% добавкой для роста меланоцитов человека (HMGS), включающей форбол 12-миристат 13-ацетат (PMA). Для проведения экспериментов клетки HEMn-LP культивировали в среде, дополненной HMGS-2 (без PMA). Все среды и добавки были приобретены у компании Invitrogen.
Анализ жизнеспособности клеток
Для оценки влияния исследуемых соединений на жизнеспособность клеток применяли анализ с кристаллическим фиолетовым. Клетки высевали в двух экземплярах и обрабатывали соответствующими соединениями или транспортным средством в течение 6 дней. Среду и лечебные соединения заменяли каждые 48 ч. Эксперименты повторяли три раза независимо друг от друга. После окончания периода лечения среду и неприкрепившиеся клетки удаляли, а оставшиеся клетки промывали в PBS и фиксировали глутаральдегидом в течение 15 мин. Фиксированные клетки инкубировали с раствором кристаллического фиолетового (0,1% кристаллического фиолетового, 20% CH3OH) в течение 1 ч. Количество красителя, поглощенного монослоем, пропорциональное количеству жизнеспособных клеток, прикрепившихся ко дну лунки, определяли количественно путем экстракции цвета 10% уксусной кислотой и измерения абсорбции при длине волны 595 нм. Относительная жизнеспособность после обработки ATRA, LE135 или PLX4032 использовалась для определения половины максимальной ингибирующей концентрации (IC50). Построив кривую «доза-ответ», значение IC50 оценивали как концентрацию в точке 50% жизнеспособности клеток.
Очистка ДНК и РНК
ДНК для количественного определения мтДНК и РНК для синтеза кДНК очищали одновременно с помощью набора AllPrep DNA/RNA/Protein mini kit (Qiagen) в соответствии с прилагаемым протоколом.
Анализ экспрессии
Синтез кДНК проводили с помощью qScript™ XLT cDNA SuperMix (Quanta Bioscience). Экспрессию генов PGC1α, MITF, RARβ, p14ARF, UCP2, ATP5g1, COX5A и NDUFS3 определяли с помощью количественной ПЦР в реальном времени на Roche LightCycler 2.0 с использованием набора LightCycler FastStart DNA MasterPLUS SYBR Green I (Roche). Праймеры перечислены в Дополнительной таблице 1.
| Ген | Прямой праймер | Обратный праймер |
| PGC1α* | GTAAATCTGCGGGATGATG | AATTGCTTGCGTCCACAA |
| MITF** | CCGTCTCTCTCACTGGATTGGT | TACTTGTGGTGGGGTTTTCGAG |
| p14ARF*** | CCCTCGTGTGATGCTACTGA | CATGACCTCTGGTCTTCTTAGGAAGC |
| RARβ*** | TCCTGGATTTTCTACACTGCG | AAGCAGGGTTTGTGTACACTCG |
| UCP2 | AAGACCATTGCCCGAGAGG | TTGGCTTTTCAGGAGGGCAT |
| ATP5g1* | ATCATTGGGGCTATGCCAGGAA | ATGGCGAAGAGGATGAGGA |
| COX5A* | GGGAATTGCGTAAAGGGATAA | TCCTGCTTTGTCCTTAACAACC |
| NDUFS3* | GCTGACGCCCATTGAGTCTG | GGAACTCTCTTGGCCAACTCC |
| RPLP0 | ACTAAAATCTCCAGGGGCACC | ATGACCAGCCCAAAGGAGAA |
*Последовательности праймеров опубликованы Vazquez et al. 2013 [22].
**Последовательности праймеров опубликованы Haq et al. 2014 [11].
***Последовательности праймеров опубликованы Dahl et al. 2013 [17].
Иммуноблоттинг
Образцы готовили из колб клеточных культур с помощью буфера для лизиса (SLB), дополненного бесцветным β-меркаптоэтанолом (BPB), Phospho-Stop и ингибитором протеаз (Thermo Fisher Scientific). Лизаты клеток очищали центрифугированием 20 000 об/мин в течение 3 мин. Концентрацию белка измеряли с помощью набора Qubit Protein Assay Kit (Thermo Fisher Scientific), и 50 мкг белка каждого образца загружали в 10-луночный SDS, 4-12% Bis-Tris NuPage гель (Invitrogen). Затем белки разделяли при 80 В в течение 30 мин, а затем при 110 В до завершения. Блоттинг проводили с помощью полусухого переноса на нитроцеллюлозную мембрану ECL при 3,3 мА/1 см2/1 ч/гель. После этого мембрана окрашивалась Понсо. Мембрану блокировали в 5% молоке в течение 1 ч, затем дважды промывали в течение 5 мин в TBST и окрашивали анти-AMPK или анти-p-AMPK (Thr172) антителами (Cell Signaling; 1:2000) в 5% BSA при 4°C и антителом против циклофилина А (Cell Signaling; 1:5000) в качестве контроля загрузки. После трех 10-минутных циклов промывки в TBST, мембрану окрашивали вторичным антителом (анти-кролик; DakoCytomation; 1:2000) в течение 1 ч при комнатной температуре, затем еще 3 цикла промывки. Белки визуализировали с помощью субстрата ECL Plus Western Blotting Substrate (Thermo Fisher Scientific) 1:1 в течение 2-3 мин.
Метаболический анализ
Метаболический анализ проводили на клеточных линиях меланомы и меланоцитах с помощью анализатора Seahorse XFe96 (Seahorse Bioscience, Billerica, MA), который выполняет измерения скорости внеклеточного закисления (ECAR) и скорости потребления кислорода (OCR) в режиме реального времени. Клетки высевали по 20 000 на лунку в микропланшеты Seahorse Cell Culture Microplates за 24 часа до проведения измерений. Изменения базальной активности и мощности митохондриальной и гликолитической энергетических систем определяли с помощью Mito Stress Test Kit и Glycolysis Stress Test Kit (Agilent Technologies). Анализы проводили в соответствии с прилагаемыми протоколами. Мито-стресс-тест проводили в обычной культуральной среде, тогда как в стресс-тесте гликолиза среду заменяли на среду Seahorse XF Base, дополненную L-глутамином (2 мМ), pH корректировали до 7,4, за 1 ч до измерений. При более длительном воздействии (>24 ч) клетки обрабатывали в культуральных колбах перед посевом. Все результаты были нормированы на количество посеянных клеток, так как используемые концентрации ATRA и LE135 не влияли на рост клеток в течение 24 ч. Протокол проведения анализов на аппарате Seahorse включал циклы 3 мин перемешивания/3 мин измерения. Было проведено три независимых эксперимента с 6 репликами каждого образца.
Трансфекция
Клеточную линию меланомы ED-007 трансфецировали векторами экспрессии pEGFP (контроль) или pEGFP-p14ARF (2
вектора/2 ×106 клеток), оба вектора содержали GFP в качестве репортерного гена. Конструкции были получены, как описано ранее [19]. Трансфекцию проводили с использованием технологии нуклеофекции Amaxa, буфера V, программы T-020, следуя протоколу, рекомендованному производителем. Успешность трансфекции проверяли визуально. Стабильные клоны отбирали с помощью 400 мкг/мл G418 (генетицин; Thermo Fisher Scientific). В экспериментальной установке клетки высевали без G418.
Количественное определение митохондриальной ДНК
Количественное определение митохондриальной ДНК проводили методом капельной цифровой полимеразной цепной реакции (ddPCR) с использованием системы QX200 (BioRad Laboratories, Hercules, CA, USA). Для каждой реакции использовали приблизительно 0,5 нг ДНК. Число копий митохондриальной ДНК определяли путем расчета соотношения между участком митохондриальной ДНК (mtMinArc) и однокопийным ядерным локусом (β2m), как описано Phillips et al. [44]. Праймеры, зонды и условия эксперимента перечислены в Дополнительной таблице 2.
| mtMinArc | β2m | |
| Прямой праймер* | CTAAATAGAGCCCACACGTTCCC | GCTGGGTAGCTCTAACAATGTATTATTCA |
| Обратный праймер* | AGAGCTCCCGTGTGTGGTTA | CCATGTACTAACAAATGTCTAAATGGT |
| Зонд* | 6FAM-CATCACGATGGATCACAGGT(NFQ) | VIC-CAGCAGCAGCCTATTATTCTGC(NFQ) |
| Концентрация праймера. | 75 нМ | 500 нМ |
| Температура отжига. | 50°C | 52°C |
| Количество циклов | 40 | 40 |
*Последовательности праймеров и зондов опубликованы Phillips et al. [44].
Статистический анализ
Различия между независимыми наборами данных определяли с помощью t-теста Стьюдента. Для статистического анализа дисперсии между различными методами лечения использовали односторонний ANOVA с подобранными выборками. Для определения статистической значимости использовался тест Тьюки на честное различие значимости (HSD).
Авторский вклад
CA и PG спланировали и организовали исследование. CA выполнил большинство экспериментов и обработку данных, включая культуру клеток, протоколы лечения, метаболический анализ и статистику. CD спланировал и провел трансфекцию EGFP-p14ARF и измерения мтДНК и помог интерпретировать результаты. AA выполнил и оптимизировал протоколы иммуноблоттинга и количественной ПЦР. AC выполнил анализы клеточных культур. CA и PG написали рукопись при участии и редактировании CD, AA и AC. Окончательный вариант рукописи был прочитан и одобрен всеми авторами.
КОНФЛИКТЫ ИНТЕРЕСОВ
Авторы заявляют, что у них нет конфликта интересов.
ФОНДИНГ
Данное исследование было поддержано Датским онкологическим обществом
ССЫЛКИ
1 Показатели выживаемости при раке кожи меланома, в зависимости от стадии. (cancer.org: Американское онкологическое общество).2 Nazarian R, Shi H, Wang Q, Kong X, Koya RC, Lee H, Chen Z, Lee MK, Attar N, Sazegar H, Chodon T, Nelson SF, McArthur G, et al. Melanomas acquire resistance to B-RAF (V600E) inhibition by RTK or N-RAS upregulation. Nature. 2010; 468: 973-7. https://doi.org/10.1038/nature09626.
3 Johannessen CM, Boehm JS, Kim SY, Thomas SR, Wardwell L, Johnson LA, Emery CM, Stransky N, Cogdill AP, Barretina J, Caponigro G, Hieronymus H, Murray RR, et al. COT вызывает устойчивость к ингибированию RAF через реактивацию MAP-киназного пути. Nature. 2010; 468: 968-72. https://doi.org/10.1038/nature09627.
4 Miller AJ, Mihm MC Jr. Melanoma. N Engl J Med. 2006; 355: 51-65. https://doi.org/10.1056/NEJMra052166.
5 Abildgaard C, Guldberg P. Molecular drivers of cellular metabolic reprogramming in melanoma. Trends Mol Med. 2015; 21: 164-71. https://doi.org/10.1016/j.molmed.2014.12.007.
6 Ratnikov BI, Scott DA, Osterman AL, Smith JW, Ronai ZA. Metabolic rewiring in melanoma. Oncogene. 2017; 36: 147-57. https://doi.org/10.1038/onc.2016.198.
7 Варбург О., Винд Ф., Негелейн Э. Метаболизм опухолей в организме. J Gen Physiol. 1927; 8: 519-30.
8 Hall A, Meyle KD, Lange MK, Klima M, Sanderhoff M, Dahl C, Abildgaard C, Thorup K, Moghimi SM, Jensen PB, Bartek J, Guldberg P, Christensen C. Дисфункциональное окислительное фосфорилирование делает клетки злокачественной меланомы зависимыми от гликолиза, управляемого онкогеном (V600E) BRAF. Oncotarget. 2013; 4: 584-99. https://doi.org/10.18632/oncotarget.965.
9 Parmenter TJ, Kleinschmidt M, Kinross KM, Bond ST, Li J, Kaadige MR, Rao A, Sheppard KE, Hugo W, Pupo GM, Pearson RB, McGee SL, Long GV, et al. Response of BRAF-mutant melanoma to BRAF inhibition is mediated by a network of transcriptional regulators of glycolysis. Cancer Discov. 2014; 4: 423-33. https://doi.org/10.1158/2159-8290.CD-13-0440.
10 McArthur GA, Puzanov I, Amaravadi R, Ribas A, Chapman P, Kim KB, Sosman JA, Lee RJ, Nolop K, Flaherty KT, Callahan J, Hicks RJ. Заметный, однородный и ранний [18F]фтордезоксиглюкоза-позитронно-эмиссионная томография ответ на вемурафениб при BRAF-мутантной распространенной меланоме. J Clin Oncol. 2012; 30: 1628-34. https://doi.org/10.1200/JCO.2011.39.1938.
11 Haq R, Shoag J, Andreu-Perez P, Yokoyama S, Edelman H, Rowe GC, Frederick DT, Hurley AD, Nellore A, Kung AL, Wargo JA, Song JS, Fisher DE, et al. Oncogenic BRAF regulates oxidative metabolism through PGC1alpha and MITF. Cancer Cell. 2013; 23: 302-15. https://doi.org/10.1016/j.ccr.2013.02.003.
12 Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, Dummer R, Garbe C, Testori A, Maio M, Hogg D, Lorigan P, Lebbe C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011; 364: 2507-16. https://doi.org/10.1056/NEJMoa1103782.
13 Corazao-Rozas P, Guerreschi P, Jendoubi M, Andre F, Jonneaux A, Scalbert C, Garcon G, Malet-Martino M, Balayssac S, Rocchi S, Savina A, Formstecher P, Mortier L, et al. Mitochondrial oxidative stress is the Achille’s heel of melanoma cells resistant to Braf-mutant inhibitor. Oncotarget. 2013; 4: 1986-98. https://doi.org/10.18632/oncotarget.1420.
14 Zhang G, Frederick DT, Wu L, Wei Z, Krepler C, Srinivasan S, Chae YC, Xu X, Choi H, Dimwamwa E, Ope O, Shannan B, Basu D, et al. Targeting mitochondrial biogenesis to overcome drug resistance to MAPK inhibitors. J Clin Invest. 2016; 126: 1834-56. https://doi.org/10.1172/JCI82661.
15 Livingstone E, Swann S, Lilla C, Schadendorf D, Roesch A. Combining BRAF(V) (600E) inhibition with modulators of the mitochondrial bioenergy metabolism to overcome drug resistance in metastatic melanoma. Exp Dermatol. 2015; 24: 709-10. https://doi.org/10.1111/exd.12718.
16 Hoon DS, Spugnardi M, Kuo C, Huang SK, Morton DL, Taback B. Profiling epigenetic inactivation of tumor suppressor genes in tumors and plasma from cutaneous melanoma patients. Oncogene. 2004; 23: 4014-22. https://doi.org/10.1038/sj.onc.1207505.
17 Dahl C, Christensen C, Jonsson G, Lorentzen A, Skjodt ML, Borg A, Pawelec G, Guldberg P. Mutual exclusivity analysis of genetic and epigenetic drivers in melanoma identifies a link between p14 ARF and RARbeta signaling. Mol Cancer Res. 2013; 11: 1166-78. https://doi.org/10.1158/1541-7786.MCR-13-0006.
18 Lotan R, Lotan D. Усиление экспрессии меланоцитов в культивируемых клетках меланомы мыши под действием ретиноидов. J Cell Physiol. 1981; 106: 179-89. https://doi.org/10.1002/jcp.1041060203.
19 Christensen C, Bartkova J, Mistrik M, Hall A, Lange MK, Ralfkiaer U, Bartek J, Guldberg P. A short acidic motif in ARF guards against mitochondrial dysfunction and melanoma susceptibility. Nat Commun. 2014; 5: 5348. https://doi.org/10.1038/ncomms6348.
20 Baldea I, Costin GE, Shellman Y, Kechris K, Olteanu ED, Filip A, Cosgarea MR, Norris DA, Birlea SA. Двухфазные про-меланогенные и про-апоптотические эффекты ол-транс-ретиноевой кислоты (ATRA) на человеческие меланоциты: исследование временного цикла. J Dermatol Sci. 2013; 72: 168-76. https://doi.org/10.1016/j.jdermsci.2013.06.004.
21 Kawakami T, Ohgushi A, Hirobe T, Soma Y. Анализ влияния олл-транс-ретиноевой кислоты на человеческие меланоциты и меланобласты in vitro. J Dermatol. 2017; 44: 93-4. https://doi.org/10.1111/1346-8138.13477.
22 Vazquez F, Lim JH, Chim H, Bhalla K, Girnun G, Pierce K, Clish CB, Granter SR, Widlund HR, Spiegelman BM, Puigserver P. PGC1alpha expression definines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 2013; 23: 287-301. https://doi.org/10.1016/j.ccr.2012.11.020.
23 Donadelli M, Dando I, Fiorini C, Palmieri M. UCP2, митохондриальный белок, регулируемый на нескольких уровнях. Cell Mol Life Sci. 2014; 71: 1171-90. https://doi.org/10.1007/s00018-013-1407-0.
24 Oberkofler H, Klein K, Felder TK, Krempler F, Patsch W. Role of peroxisome proliferator-activated receptor-gamma coactivator-1alpha in the transcriptional regulation of the human uncoupling protein 2 gene in INS-1E cells. Эндокринология. 2006; 147: 966-76. https://doi.org/10.1210/en.2005-0817.
25 Arigony AL, de Oliveira IM, Machado M, Bordin DL, Bergter L, Pra D, Henriques JA. Влияние микроэлементов в культуре клеток: отражение на жизнеспособности и геномной стабильности. Biomed Res Int. 2013; 2013: 597282. https://doi.org/10.1155/2013/597282.
26 Li Y, Hashimoto Y, Agadir A, Kagechika H, Zhang X. Идентификация нового класса бета-селективных антагонистов рецепторов ретиноевой кислоты и их ингибирующее действие на активность AP-1 и апоптоз, индуцированный ретиноевой кислотой, в клетках рака молочной железы человека. J Biol Chem. 1999; 274: 15360-6.
27 de The H, Marchio A, Tiollais P, Dejean A. Дифференциальная экспрессия и лигандная регуляция генов альфа и бета рецепторов ретиноевой кислоты. EMBO J. 1989; 8: 429-33.
28 Hardie DG, Hawley SA. AMP-активируемая протеинкиназа: гипотеза энергетического заряда пересмотрена. Bioessays. 2001; 23: 1112-9. https://doi.org/10.1002/bies.10009.
29 потенцирует их ответ на ингибирование BRAFV600E. J Transl Med. 2014; 12: 247. https://doi.org/10.1186/s12967-014-0247-5.
30 Populo H, Caldas R, Lopes JM, Pardal J, Maximo V, Soares P. Overexpression of pyruvate dehydrogenase kinase supports dichloroacetate as a candidate for cutaneous melanoma therapy. Expert Opin Ther Targets. 2015; 19: 733-45. https://doi.org/10.1517/14728222.2015.1045416.
31 Kluza J, Corazao-Rozas P, Touil Y, Jendoubi M, Maire C, Guerreschi P, Jonneaux A, Ballot C, Balayssac S, Valable S, Corroyer-Dulmont A, Bernaudin M, Malet-Martino M, et al. Inactivation of the HIF-1alpha/PDK3 signaling axis drives melanoma towards mitochondrial oxidative metabolism and potentiates therapeutic activity of pro-oxidants. Cancer Res. 2012; 72: 5035-47. https://doi.org/10.1158/0008-5472.CAN-12-0979.
32 Kaplon J, Zheng L, Meissl K, Chaneton B, Selivanov VA, Mackay G, van der Burg SH, Verdegaal EM, Cascante M, Shlomi T, Gottlieb E, Peeper DS. Ключевая роль митохондриального привратника пируватдегидрогеназы в индуцированной онкогенами старости. Nature. 2013; 498: 109-12. https://doi.org/10.1038/nature12154.
33 Murholm M, Isidor MS, Basse AL, Winther S, Sorensen C, Skovgaard-Petersen J, Nielsen MM, Hansen AS, Quistorff B, Hansen JB. Ретиноевая кислота по-разному влияет на экспрессию UCP1 в адипоцитах мыши и человека. BMC Cell Biol. 2013; 14: 41. https://doi.org/10.1186/1471-2121-14-41.
34 Jin W, Xu YP, Yang AH, Xing YQ. In vitro индукция и дифференцировка мезенхимальных стволовых клеток пуповины в нейроноподобные клетки под действием олл-транс-ретиноевой кислоты. Int J Ophthalmol. 2015; 8: 250-6. https://doi.org/10.3980/j.issn.2222-3959.2015.02.07.
35 Tourniaire F, Musinovic H, Gouranton E, Astier J, Marcotorchino J, Arreguin A, Bernot D, Palou A, Bonet ML, Ribot J, Landrier JF. Все-транс ретиноевая кислота индуцирует окислительное фосфорилирование и биогенез митохондрий в адипоцитах. J Lipid Res. 2015; 56: 1100-9. https://doi.org/10.1194/jlr.M053652.
36 Tripathy S, Chapman JD, Han CY, Hogarth CA, Arnold SL, Onken J, Kent T, Goodlett DR, Isoherranen N. All-trans-retinoic acid enhances mitochondrial function in models of human liver. Mol Pharmacol. 2016; 89: 560-74. https://doi.org/10.1124/mol.116.103697.
37 Watabe H, Soma Y, Ito M, Kawa Y, Mizoguchi M. All-trans retinoic acid induces differentiation and apoptosis of murine melanocyte precursors with induction of the microphthalmia-associated transcription factor. J Invest Dermatol. 2002; 118: 35-42. https://doi.org/10.1046/j.0022-202x.2001.01614.x.
38 De Preter G, Neveu MA, Danhier P, Brisson L, Payen VL, Porporato PE, Jordan BF, Sonveaux P, Gallez B. Inhibition of the pentose phosphate pathway by dichloroacetate unravels a missing link between aerobic glycolysis and cancer cell proliferation. Oncotarget. 2016; 7: 2910-20. https://doi.org/10.18632/oncotarget.6272.
39 Michelakis ED, Webster L, Mackey JR. Дихлорацетат (ДХА) как потенциальная метаболически-таргетная терапия рака. Br J Cancer. 2008; 99: 989-94. https://doi.org/10.1038/sj.bjc.6604554.
40 Corazao-Rozas P, Guerreschi P, Andre F, Gabert PE, Lancel S, Dekiouk S, Fontaine D, Tardivel M, Savina A, Quesnel B, Mortier L, Marchetti P, Kluza J. Mitochondrial oxidative phosphorylation controls cancer cell’s life and death decisions upon exposure to MAPK inhibitors. Oncotarget. 2016; 7: 39473-85. https://doi.org/10.18632/oncotarget.7790.
41 Bauer D, Werth F, Nguyen HA, Kiecker F, Eberle J. Critical role of reactive oxygen species (ROS) for synergistic enhancement of apoptosis by vemurafenib and the potassium channel inhibitor TRAM-34 in melanoma cells. Cell Death Dis. 2017; 8: e2594. https://doi.org/10.1038/cddis.2017.6.
42 Chen MC, Hsu SL, Lin H, Yang TY. Ретиноевая кислота и лечение рака. Biomedicine (Taipei). 2014; 4: 22. https://doi.org/10.7603/s40681-014-0022-1.
43 Robinson J, Roberts CH, Dodi IA, Madrigal JA, Pawelec G, Wedel L, Marsh SG. Европейская база данных опухолевых линий с возможностью поиска. Cancer Immunol Immunother. 2009; 58: 1501-6. https://doi.org/10.1007/s00262-008-0656-5.
44 Phillips NR, Sprouse ML, Roby RK. Simultaneous quantification of mitochondrial DNA copy number and deletion ratio: a multiplex real-time PCR assay. Sci Rep. 2014; 4: 3887. https://doi.org/10.1038/srep03887.