Джейсон И.Я. Вонг1, Гордон С. Хаггинс2, Марселла Дебидда4, Нихил К. Мунши4, и Иммакулата Де Виво1,3
1 Лаборатория Ченнинга, отделение медицины, Больница Бригама и Женщины и Гарвардская медицинская школа, Бостон, Массачусетс.
2 Научно-исследовательский институт молекулярной кардиологии, Медицинский центр Tufts-New England, Бостон, Массачусетс.
3 Программа по молекулярной и генетической эпидемиологии, Гарвардская школа общественного здравоохранения, Бостон, Массачусетс.
4 Центр множественной миеломы Джерома Липпера, отделение медицинской онкологии, Онкологический институт Дана-Фарбер, Гарвардская медицинская школа, Бостон, Массачусетс.
Переписка: Иммакулата Де Виво, Больница Бригама и Женщины, отделение медицины, лаборатория Ченнинг, 181 Longwood Ave, Boston, MA, 02115, USA. Телефон: 617-525-2094. Факс: 617-525-2008. [email protected].
Получено: 14 сентября 2020 г.
Принято: 4 декабря 2020 г.
Опубликовано: 9 декабря 2020 г
Аннотация
Цель: Недавнее знаковое исследование показало, что лечение дихлорацетатом (ДХА) способствует апоптозу в клеточных линиях рака легких, молочной железы и глиобластомы путем смещения метаболизма от аэробного гликолиза к окислению глюкозы в сочетании с перестройкой оси NFAT-Kv1.5. Целью данного исследования было определить, индуцирует ли DCA апоптоз в клетках рака эндометрия, и оценить механизм апоптоза.
Методы: Группа клеточных линий рака эндометрия с различной степенью дифференцировки была обработана DCA и проанализирована на предмет апоптоза с помощью проточной цитометрии. Биологические корреляты, такие как экспрессия генов, внутриклеточный Ca2+ и мембранный потенциал митохондрий, были исследованы для оценки механизма апоптоза.
Результаты: Инициация апоптоза наблюдалась в пяти клеточных линиях раковых клеток с низкой и умеренной инвазивностью, включая Ishikawa, RL95-2, KLE, AN3CA и SKUT1B, в то время как лечение не оказывало влияния на нераковые клетки 293T. Две высокоинвазивные клеточные линии аденокарциномы эндометрия, HEC1A и HEC1B, оказались устойчивыми к DCA-индуцированному апоптозу. Клеточные линии, отвечающие на апоптоз, имели значительное увеличение раннего и позднего апоптоза, снижение мембранного потенциала митохондрий и уменьшение количества транскрипта Survivin, что согласуется с механизмом, регулируемым митохондриями. Обработка DCA снижала уровень внутриклеточного кальция в большинстве клеточных линий, реагирующих на апоптоз, что предполагает вклад NFAT-Kv1.5-опосредованного пути. Обработка DCA увеличила транскрипты p53 upregulated modulator of apoptosis (PUMA) в клеточных линиях с апоптотическим ответом, что предполагает участие p53-PUMA-опосредованного механизма.
Ключевые слова: Дихлорацетат; эндометрий; рак; апоптоз; митохондрии
Заявление о конфликте интересов: Авторы заявляют об отсутствии конфликта интересов.
Выводы: Дихлорацетат эффективно сенсибилизирует большинство клеточных линий рака эндометрия к апоптозу через митохондриальные, NFAT-Kv1.5 и PUMA-опосредованные механизмы. Дальнейшее изучение терапевтического потенциала DCA в отношении рака является оправданным.
дополнительно подтверждается флуоресцентным окрашиванием TMRM в эксперименте с дозой DCA. Столбики ошибок представляют стандартную ошибку двух независимых экспериментов, проведенных в трех лунках.
ВВЕДЕНИЕ
Рак эндометрия (РЭ) — это неоплазия эпителиальной выстилки тела матки. Он является наиболее распространенной гинекологической злокачественной опухолью в США и четвертой ведущей причиной смерти от рака среди женщин [1]. Существует немного вариантов терапии без серьезных недостатков для больных с рецидивирующим или метастатическим раком эндометрия. Химиотерапия при метастатическом заболевании имеет высокие показатели токсичности, невралгии и сердечных осложнений[2, 3]. Стимулом для разработки будущих методов лечения рака будет снижение серьезных побочных эффектов при сопоставимой или более высокой эффективности по сравнению с существующими методами лечения.
Аэробный гликолиз, также известный как «эффект Варбурга», является уникальным свойством большинства раковых опухолей. Это явление характеризуется повышенным поглощением глюкозы и зависимостью от гликолиза для производства АТФ, несмотря на доступный источник кислорода [5]. Считается, что аэробный гликолиз является результатом дисфункции митохондрий, которая обеспечивает апоптотическую устойчивость раковых клеток [6]. Эта апоптотическая устойчивость обусловлена гиперполяризацией митохондриальной мембраны, которая препятствует высвобождению проапоптотических медиаторов из митохондрий в цитоплазму [4]. Гиперполяризованные митохондриальные мембраны характерны для большинства карцином, и их изменение связано с началом апоптоза [7,8].
Терапевтическое воздействие на аэробный гликолиз является новым средством воздействия на раковые клетки. Ключевым регулятором клеточного метаболизма является пируватдегидрогеназа (PDH), которая, в свою очередь, ингибируется киназой пируватдегидрогеназы (PDK). Недавнее исследование показало, что активность PDK в линиях раковых клеток может быть снижена под действием DCA [4]. Метаболическое воздействие DCA включает два синергетических механизма — проксимальный и дистальный пути [4]. В проксимальном (митохондриально-регулируемом) пути DCA связывается с PDK и ослабляет ингибирование активности PDH. Повышение активности PDH смещает метаболизм с гликолиза на окисление глюкозы и снижает гиперполяризацию мембранного потенциала митохондрий (ММП), что открывает переходные поры митохондрий (ППП). Это позволяет транслоцировать реактивные виды кислорода (ROS) и цитохром c из митохондрий в цитоплазму, впоследствии вызывая апоптоз через активацию каспаз [4]. В дистальном (NFAT-Kv1.5) пути транслоцированная ROS расширяет калиевые ионные каналы Kv1.5 на плазматической мембране. Изгнание ионов калия гиперполяризует клетку, предотвращая вольтаж-зависимый вход Ca2+. Сниженный уровень внутриклеточного Ca2+ ингибирует активацию NFAT, что еще больше увеличивает экспрессию Kv1.5, создавая петлю положительной обратной связи, что в конечном итоге приводит к снижению тонического ингибирования каспаз [4].
Между митохондриальными и р53-опосредованными путями апоптоза существует значительное перекрестное взаимодействие. р53-управляемыймодулятор апоптоза (PUMA) является одним из таких проапоптотических белков, который обеспечивает взаимодействие между митохондриальными и р53-опосредованными механизмами опухолевого супрессора. PUMA является членом семейства белков, содержащих только BH3, экспрессия которых транскрипционно регулируется p53 [9-11]. При активации различными апоптотическими стимулами PUMA транслоцируется на митохондриальную мембрану, где он антагонизирует про-суицидальные белки Bcl-2, связываясь с их BH3-доменом, индуцируя высвобождение цитохрома c и способствуя апоптозу [10,12]. В недавних исследованиях нокаутов было установлено, что PUMA является критическим медиатором р53-зависимого апоптоза в мышиных тимоцитах и клетках колоректального рака человека [13,14].
В многочисленных исследованиях было показано, что дихлорацетат способствует окислению глюкозы при различных митохондриальных нарушениях [15,16]. Кроме того, в клинических исследованиях митохондриальных энцефаломиопатий было установлено, что лечение ДХА имеет более мягкие побочные эффекты по сравнению с текущими методами лечения рака эндометрия [17]. На сегодняшний день действие DCA было изучено на ограниченном количестве линий раковых клеток, и наше понимание альтернативных апоптотических механизмов, регулируемых DCA, является недостаточным. Целью нашего исследования было определить, сенсибилизирует ли ДКА к апоптозу группу клеточных линий рака эндометрия, и оценить вклад механизмов, регулируемых митохондриями, NFAT-Kv1.5 и PUMA, в апоптотический процесс, изучив биологические корреляты.
Материалы и методы
Культура клеток
Клеточные линии AN3CA, SKUT1B, RL95-2, KLE, HEC1A и HEC1B были приобретены у American Type Culture Collection (Manassas, VA), а клеточная линия Ishikawa была приобретена у Sigma-Aldrich (St. Louis, MO). Эпителиальные клетки почек 293T, служившие нераковыми здоровыми контролями, были предоставлены Нихилом Мунши. Эпителиальная аденокарцинома молочной железы MCF7 была подарена Рамоном Парсонсом (Колумбийский университет). Клеточные линии размножались в соответствии с условиями, указанными дистрибьютором. Клеточные линии поддерживали в увлажненном инкубаторе при 37°C, 5%CO2. Ростовые среды DMEM, McCoy’s 5A, MEM и DMEM-F12 вместе с пенициллином-стрептомицином и добавками инсулина были приобретены у Gibco-Invitrogen (Карлсбад, Калифорния). Дихлорацетат (Alfa Aesar, Ward Hill, MA) растворяли до 1М рабочего раствора, стерилизовали на фильтре и затем разбавляли до лечебных концентраций в ростовой среде.
Анализ жизнеспособности клеток
Жизнеспособность клеток измеряли с помощью реактива CellTiter-Blue (Promega), который измеряет способность здоровых жизнеспособных клеток метаболизировать субстрат ресазурина до флуоресцентного продукта ресазурина. Вкратце, 3×104 клеток каждой клеточной линии были помещены в 96-луночные планшеты для культуры тканей с непрозрачными стенками и инкубированы в стандартных условиях роста в течение ночи до 60-70% конфлюентности. Затем среду в каждой лунке заменяли свежей ростовой средой, содержащей возрастающие концентрации DCA (0 мМ, 1 мМ, 5 мМ, 10 мМ). Каждая лунка была выполнена в трех экземплярах в двух или более независимых экспериментах для каждой клеточной линии. После обработки планшеты инкубировали в течение 40 часов при 37°C, после чего 20 мкл субстрата Resazurin добавляли непосредственно в каждую лунку и инкубировали еще 3 часа. Затем планшеты считывали на планшетном ридере Molecular Devices Gemini XPS (Саннивейл, Калифорния) при 560/590 нм.
Анализ апоптоза
Проточная цитометрия с окрашиванием Аннексин-V-FITC (BD Bioscience, Сан-Хосе, Калифорния) и 7-аминоактиномицином D (7-AAD) использовалась для определения того, индуцирует ли лечение ранний апоптоз. Вкратце, 5×105 клеток для каждой клеточной линии высевали в 6-луночные планшеты для культуры ткани и инкубировали в течение ночи до 60-70% конфлюентности в стандартных условиях роста. Затем среду для каждой клеточной линии заменяли свежей ростовой средой с 10 мМ дозой DCA и без нее. Группы лечения для каждой линии клеток были повторены три раза. Затем клетки инкубировали в течение 40 часов при 37°C и собирали с помощью 0,25% Трипсин-ЭДТА (Invitrogen, Карлсбад, Калифорния). Клетки промывали 1X PBS и затем окрашивали в соответствии с протоколом производителя. Проточную цитометрию проводили на BD FACSCanto II (BD Bioscience), а данные анализировали с помощью программ FlowJo 7.2.2 (Tree Star, Ashland, OR) и BD FACSDiva 6.0 (BD Bioscience).
Набор для анализа Apoptag Peroxidase Terminal dUTP Nick-end Labeling (TUNEL) (Millipore, Billerica, MA) использовался для визуализации апоптотических клеток, подвергшихся каспазозависимой фрагментации генома. Вкратце, 5×104 клеток нескольких репрезентативных клеточных линий рака эндометрия были посеяны и размножены на 4-луночных предметных стеклах (Nunc, Rochester, NY) в течение ночи. Затем среду в каждой лунке заменяли свежей ростовой средой с 10 мМ DCA или без него. Через 48 часов клетки фиксировали 1% параформальдегидом и окрашивали в соответствии с протоколом производителя. Окрашивание проводилось в центре патологии Дана Фарбер — Гарвардский онкологический центр. Изображения получали при объективе 40X на микроскопе Zeiss Axioskop 2 Plus (Торнвуд, штат Нью-Йорк) с использованием программного обеспечения AxioVs40 v.4.4.1.0 в 24-битном RGB.
Анализ клеточной пролиферации
Для измерения клеточной пролиферации использовалась проточная цитометрия с использованием бромдезоксиуридина (BrdU) (BD Bioscience) и окрашивания 7-AAD. Вкратце, несколько репрезентативных клеточных линий рака эндометрия были размножены, как описано выше для анализа на аннексин-V. Затем клетки подвергались сывороточному голоданию в течение 8 часов в ростовой среде, содержащей 0,5% FBS, чтобы сбросить клеточный цикл до фазы G0. Затем среду меняли на обычную ростовую среду с обработкой 10 мМ DCA и без нее. Через 24 часа клетки подвергали импульсной обработке в течение 2 часов 10 мкМ BrdU в ростовой среде. Затем клетки собирали, окрашивали и анализировали в соответствии с протоколом производителя.
Анализ мембранного потенциала митохондрий
Мембранный потенциал митохондрий определяли с помощью набора Mitocapture Apoptosis Detection Kit (Calbiochem). Рост, лечение и экспериментальная схема клеточных линий были идентичны описанному выше анализу на аннексин-V. После 24-часовой инкубации после обработки 10 мМ DCA и без него клетки собирали, промывали 1X PBS, окрашивали реагентом Mitocapture в соответствии с протоколом производителя и анализировали с помощью проточной цитометрии. Модифицированная версия протокола окрашивания митохондрий тетраметил родамин метиловым эфиром (TMRM) (Invitrogen, Карлсбад, Калифорния), описанная в другом месте, также использовалась для оценки MMP [18]. Вкратце, клетки размножали и обрабатывали точно так же, как в описанном выше анализе жизнеспособности клеток. После 24-часового инкубационного периода 5×104 клеток отделяли, промывали в 1X PBS, ресуспендировали в забуференном солевом растворе Хенкса (HBSS) (Sigma-Aldrich, St. Louis, MA) с 50 нМ TMRM и инкубировали в течение 30 мин при 37°C. Клетки переносили в непрозрачный 96-луночный планшет и измеряли флуоресценцию при 530/620 нм при 37°C с помощью планшетного ридера.
Уровни внутриклеточного кальция
Уровни внутриклеточного кальция измеряли с помощью FLUO-4 NW Calcium Assay (Invitrogen). Вкратце, 3×104 клеток для каждой клеточной линии высевали на отдельные 96-луночные планшеты с непрозрачными стенками и инкубировали в стандартных условиях роста в течение 8 часов. Затем среду в каждой лунке заменяли свежей ростовой средой, содержащей возрастающие концентрации DCA. Каждая группа лечения была воспроизведена в 4 лунках как минимум в двух независимых экспериментах. После 8-часовой инкубации клетки в каждой лунке обрабатывали реагентом FLUO-4 в соответствии с протоколом производителя. Затем планшеты считывали на флуоресцентном планшетном ридере при длине волны 494/516 нм.
ПЦР в реальном времени
Количественная ПЦР в реальном времени использовалась для определения количества эндогенных транскриптов Survivin и PUMA. В общей сложности 1×106 клеток для каждой клеточной линии были посеяны и выращены в 10-см планшетах для культуры ткани в течение ночи. Затем среду заменяли свежей питательной средой с обработкой или без обработки 10 мМ DCA. После инкубации в течение 40 часов 3×106 клеток из каждого планшета собирали и выделяли общую РНК с помощью набора RNeasy Plus Mini Kit (Qiagen, Valencia, CA) в соответствии с протоколом производителя. Синтез кДНК первой нити проводился с 1000 нг общей РНК и праймеров Oligo dT с использованием Superscript III Reverse Transcriptase (Invitrogen) в соответствии с протоколом производителя. Затем продукт кДНК обрабатывали РНКазой Н в течение 20 минут при 37°C и разбавляли до 100 нг/мкл. Концентрацию РНК и кДНК точно определяли с помощью спектрофотометра Nanodrop ND-1000 (Wilmington, DE).
Последовательности праймеров для Survivin были прямыми 5′-AAGAACTGGCCCTTCTTGGA-3′ и обратными 5′- CAACCGGACGAATGCTTTT-3′ (Primerbank). Последовательности праймеров для PUMA и гена домашнего хозяйства RPLP0 были описаны в предыдущих исследованиях [19, 20]. Реакционные смеси состояли из 1X Applied Biosystems SYBR Green PCR mix (Foster City, CA), 1,5 мМ MgCl2, 0,42 мМ dNTPs, 5U ABI Amplitaq Gold, 200 нг шаблона кДНК и 333 нМ прямого и обратного праймеров. Реакции проводили в трех экземплярах в двух повторных экспериментах. Условия циклирования составляли 1 цикл при 95C в течение 10:00, 33x циклов 95C в течение 0:30, 55C в течение 0:30 и 72C в течение 0:30. Пятиточечная стандартная кривая для реакций имела линейные наклоны -3,2 +/- 0,1 с коэффициентами корреляции (r2) выше 0,985. Анализ проводился с помощью системы ABI 7300 Real-Time PCR System (Фостер-Сити, Калифорния). Относительное количественное содержание целевых транскриптов, нормализованное к RPLP0, оценивали с помощью программного обеспечения ABI 7300 Real-Time PCR Systems RQ Study Software, используя метод сравнительного Ct.
Статистический анализ
Для оценки различий между группами лечения использовали t-тест Стьюдента и односторонний ANOVA. Значения p-значения ниже 0,05 считались значимыми. Анализ проводился с помощью Microsoft Excel 2007 (Redmond, WA). Графики создавались с помощью программы GraphPad Prism 5 (Сан-Диего, Калифорния).
Результаты
DCA снижает жизнеспособность клеток рака эндометрия в зависимости от дозы
Для определения влияния DCA на жизнеспособность клеток рака эндометрия каждую линию клеток выращивали в культуре с возрастающими дозами DCA. В группе из семи линий клеток рака эндометрия AN3CA, Ishikawa, RL95-2 и SKUT1B жизнеспособность снижалась на 15%-75% при увеличении концентрации ДКА (Рисунок 1A). Снижение жизнеспособности для большинства линий клеток-респондентов достигало значимости при дозе 10 мМ. Сравнение между необработанной группой и группой, обработанной 10 мМ ДКА, имело p-значения < 0,01 для AN3CA, Ishikawa, RL95-2 и SKUT1B. Незначительное снижение жизнеспособности наблюдалось при дозе 5 мМ для AN3CA и RL95-2. Таким образом, приблизительная эффективная минимальная доза DCA для этих линий клеток эндометрия в период лечения была определена в диапазоне от 5 мМ до 10 мМ. Такая концентрация дозы DCA и время лечения находятся в пределах эффективного диапазона ранее опубликованных экспериментов in vitro [21]. Статистически значимое увеличение жизнеспособности наблюдалось для HEC1A, HEC1B и KLE при увеличении концентрации DCA (p < 0,02). Как и ожидалось, статистически значимой разницы в жизнеспособности эпителиальных клеток 293T при данном диапазоне доз DCA и периоде лечения не наблюдалось (p = 0,27).
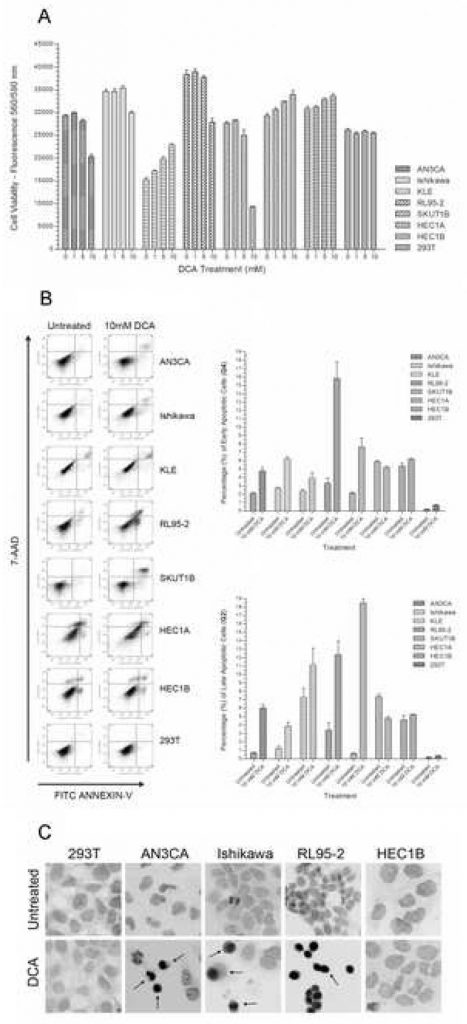
Влияние DCA на пролиферацию клеток рака эндометрия зависит от клеточной линии
Чтобы определить, связано ли наблюдаемое снижение жизнеспособности клеток при лечении DCA с эффектом пролиферации клеток, было проведено окрашивание BrdU / 7-AAD нескольких репрезентативных клеточных линий и проанализировано с помощью проточной цитометрии. В эпителиальных клетках Ishikawa, HEC1B и 293T при обработке DCA не наблюдалось существенной разницы в динамике клеточного цикла или пролиферации (Таблица 1). В клетках AN3CA обработка ДКА усиливала пролиферацию, о чем свидетельствовало значительное увеличение числа клеток в фазах S и G2/M и уменьшение числа клеток в G0/G1. В клетках RL95-2 обработка ДКА значительно уменьшила долю клеток в фазах S и G2/M и увеличила клетки в фазе G0/G1, что указывает на снижение пролиферации и остановку клеточного цикла в состоянии старения или покоя.
| Клеточная линия / лечение | % S-фаза | Stdev S фаза | % G0 / G1 Фаза | Stdev G0/G1 | % G2 / M Фаза | Stdev G2 / M фаза |
|---|---|---|---|---|---|---|
| 293T Нелеченый | 60.6 | 0.6 | 33.2 | 1.7 | 6.2 | 1.25 |
| 293T DCA | 58.1 | 2.2 | 31.7 | 2.2 | 10.2 | 0.34 |
| p-value | 0.15 | 0.14 | 0.03 | |||
| Исикава Без лечения | 61.3 | 0.4 | 27.4 | 1.8 | 11.3 | 0.96 |
| Исикава DCA | 65.9 | 4.5 | 22.9 | 4.9 | 11.2 | 0.68 |
| p-value | 0.21 | 0.25 | 0.96 | |||
| HEC1B Без лечения | 37.4 | 2.7 | 41.5 | 0.8 | 21.2 | 1.93 |
| HEC1B DCA | 42.4 | 1.5 | 34.8 | 3.6 | 22.8 | 2.15 |
| p-value | 0.19 | 0.08 | 0.47 | |||
| AN3CA Без лечения | 43.5 | 0.6 | 50.6 | 2.0 | 5.9 | 1.80 |
DCA способствует апоптозу в клетках рака эндометрия
Чтобы определить, было ли снижение жизнеспособности клеток в результате лечения DCA связано с апоптозом, а не с некрозом, было проведено окрашивание клеток Annexin-V-FITC и 7-AAD и проанализировано с помощью проточной цитометрии. Значительное увеличение от 50% до 325% наблюдалось в ранних апоптотических клетках в AN3CA, Ishikawa, KLE, RL95-2 и SKUT1B (Рисунок 1B). Значительное увеличение также наблюдалось в поздних апоптотических клетках этих клеточных линий (Рисунок 1B). В RL95-2 наблюдалось наибольшее увеличение ранних апоптотических клеток, а в KLE — наименее значительное. Увеличение процента поздних апоптотических клеток в KLE не было статистически значимым. В клетках HEC1B не наблюдалось разницы в процентном содержании ранних и поздних апоптотических клеток при лечении, в то время как в клетках HEC1A наблюдалось незначительное снижение апоптотических клеток. Клеточная линия 293T не подвергалась апоптозу при обработке DCA, а незначительное увеличение процента апоптотических клеток не было значительным (p=0,08).
Поскольку анализ Annexin-V в основном используется для выявления раннего апоптоза, анализ TUNEL был проведен на нескольких репрезентативных клеточных линиях рака эндометрия для качественного подтверждения прогрессии до позднего апоптоза путем визуализации каспазозависимой фрагментации ДНК. В соответствии с количественным анализом Аннексин-V, увеличение числа TUNEL-позитивных апоптотических клеток наблюдалось в AN3CA, Ishikawa и RL95-2 (Рисунок 1С). В клетках HEC1B и 293T при обработке 10 мМ DCA визуальной разницы в количестве TUNEL-позитивных клеток не наблюдалось.
Чтобы определить, влияет ли скорость роста на чувствительность клеточных линий рака эндометрия к лечению DCA, клетки, реагирующие и не реагирующие на апоптоз (Ishikawa и HEC1A, соответственно), выращивали в условиях недостатка сыворотки с 0,5% FBS, что сбрасывает клетки в фазу G0 и препятствует пролиферации. Сывороточное голодание не повлияло на долю ранних апоптотических клеток в клетках Ishikawa при обработке по сравнению с нормальными условиями роста. Процент ранних апоптотических клеток увеличился с 3,17% +/- 0,21% SD в необработанных до 6,20% +/- 1,04% SD p=0,05 в обработанных клетках Исикавы, что было аналогично результатам при нормальных условиях роста. Процент поздних апоптотических клеток Ишикава увеличился с 1,07% +/- 0,15% SD в необработанных до 3,57% +/- 0,49% SD p=0,02 в обработанных клетках. Клеточная линия HEC1A не показала существенной разницы в ранних и поздних апоптотических клетках. Процент ранних апоптотических клеток HEC1A составил 3,73% +/- 0,51% SD для необработанных и 1,93% +/- 0,60 SD p=0,07 для обработанных клеток. Процент поздних апоптотических клеток HEC1A составил 3,60% +/- 0,69% SD для необработанных и 4,90% +/- 1,37 SD p=0,25 для обработанных клеток.
Апоптоз опосредован снижением уровня внутриклеточного кальция
Для того чтобы определить, вносит ли дистальный путь NFAT-Kv1.5 вклад в стимулирование апоптоза ДКА, был проведен эксперимент «доза-ответ» для оценки уровня внутриклеточного Ca2+. У AN3CA, Ishikawa и SKUTB уровень внутриклеточного кальция снижался с увеличением дозы ДКА (Рисунок 2А). Снижение уровня внутриклеточного кальция в этих клеточных линиях достигло значительного уровня при концентрации 5 мМ ДКА с p < 0,03 для AN3CA, Ishikawa и SKUT1B. Клеточная линия KLE, которая показала самый мягкий апоптотический ответ, имела незначительное снижение уровня кальция при увеличении концентрации DCA. Интересно, что у RL95-2, которая имела самый сильный апоптотический ответ, не было обнаружено разницы в уровнях внутриклеточного кальция между дозами. HEC1A, который ранее не показал апоптотического ответа, действительно не имел разницы в уровнях внутриклеточного кальция при любой концентрации обработки. У HEC1B также не было разницы в уровнях кальция между группами обработки 0, 1 и 5 мМ DCA, и только небольшое снижение наблюдается при обработке 10 мМ. В 293T не было разницы в уровнях внутриклеточного кальция при увеличении концентрации DCA.
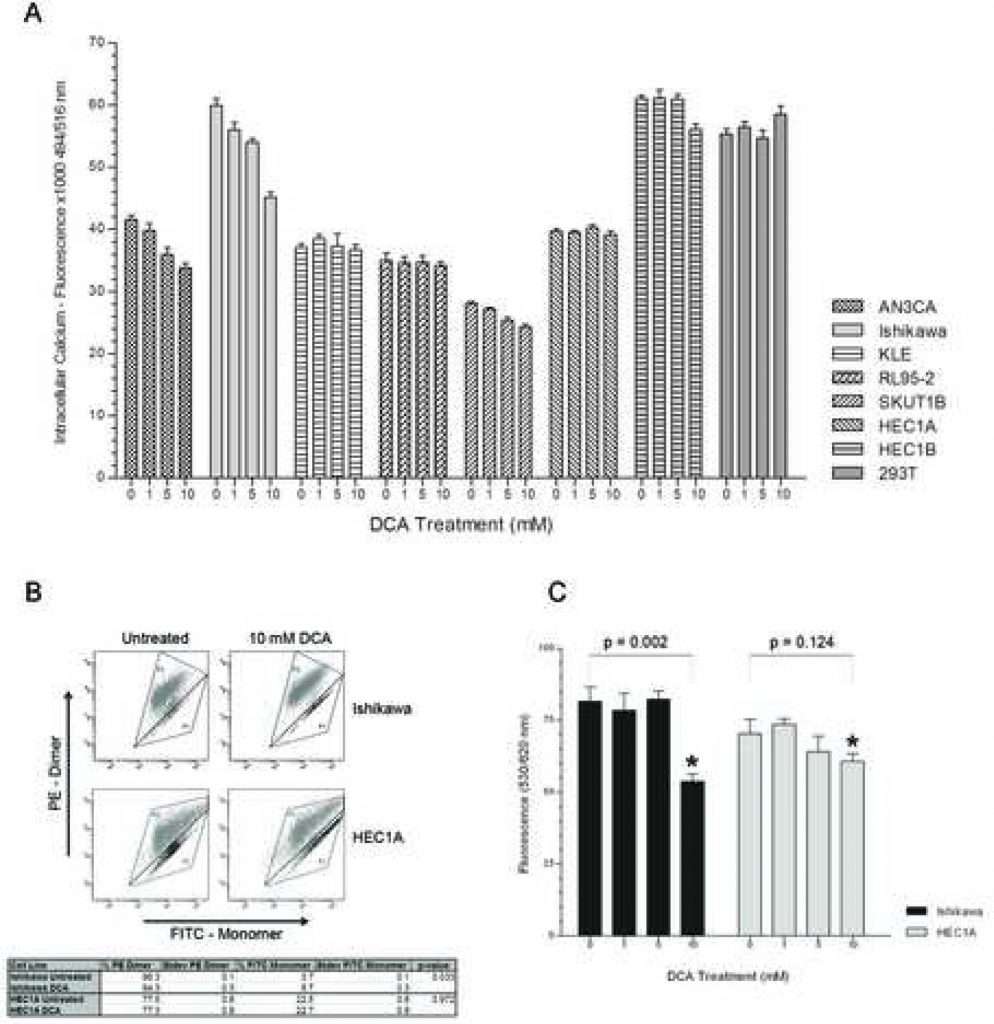
Лечение DCA уменьшает гиперполяризацию митохондриальной мембраны в клетках рака эндометрия, подвергающихся апоптозу
Чтобы оценить, способствует ли DCA инициации апоптоза через митохондриально-регулируемый механизм, ММП одного апоптотического ответчика и неответчика (Ishikawa и HEC1A соответственно) измеряли с лечением и без лечения с помощью анализа FACS. Реагент MitoCapture представляет собой катионный краситель, который в зависимости от величины трансмембранного электрического потенциала митохондрий накапливается в виде зеленого мономера в цитоплазме или красного димера в гиперполяризованных митохондриях раковых клеток [22, 23]. Обработка DCA клеточной линии Ishikawa уменьшила процент 575 нм красно-окрашенных клеток и увеличила долю 525 нм зелено-окрашенных клеток, что соответствует ее апоптотическому ответу на лечение (Рисунок 2B). Обработка DCA клеточной линии HEC1A не повлияла на процентное содержание окрашенных в красный и зеленый цвета клеток. Кроме того, необработанные клетки HEC1A имели меньшую долю красно-окрашенных клеток с гиперполяризованными митохондриальными мембранами по сравнению с клетками Ishikawa (77,5% +/- 0,6% SD против 96,3% +/- 0,1% SD, p < 0,01). Разницы в ММП неракового контроля 293T при лечении не было (данные не показаны). Модуляция ММП с помощью DCA была дополнительно подтверждена с помощью окрашивания TMRM в эксперименте с дозовой реакцией. ММП клеток Исикавы значительно снижалась при дозе ДКА 10 мМ (Рисунок 2C). Не было значительной разницы в ММП клеток HEC1A при любой концентрации обработки.
DCA снижает экспрессию Survivin
Для дальнейшего подтверждения вклада проксимального митохондриально-регулируемого пути в апоптотический ответ, количественная ПЦР в реальном времени была использована для оценки экспрессии Survivin с применением и без применения DCA. Обработка клеточных линий рака эндометрия ДКА привела к снижению на 25-50% количества мРНК Survivin в клетках с апоптотическим ответом, включая AN3CA, Ishikawa, KLE, RL95-2 и SKUT1B (Рисунок 3A). RL95-2, который продемонстрировал наибольшее увеличение ранних апоптотических клеток при лечении, также имел наименьшее количество эндогенного транскрипта Survivin. HEC1A и HEC1B, которые ранее не имели апоптотического ответа на DCA, имели 20-30% увеличение транскриптов Survivin при лечении. HEC1A имел наибольшее количество эндогенных транскриптов Survivin. Контроль 293T также показал увеличение количества транскриптов при обработке DCA.
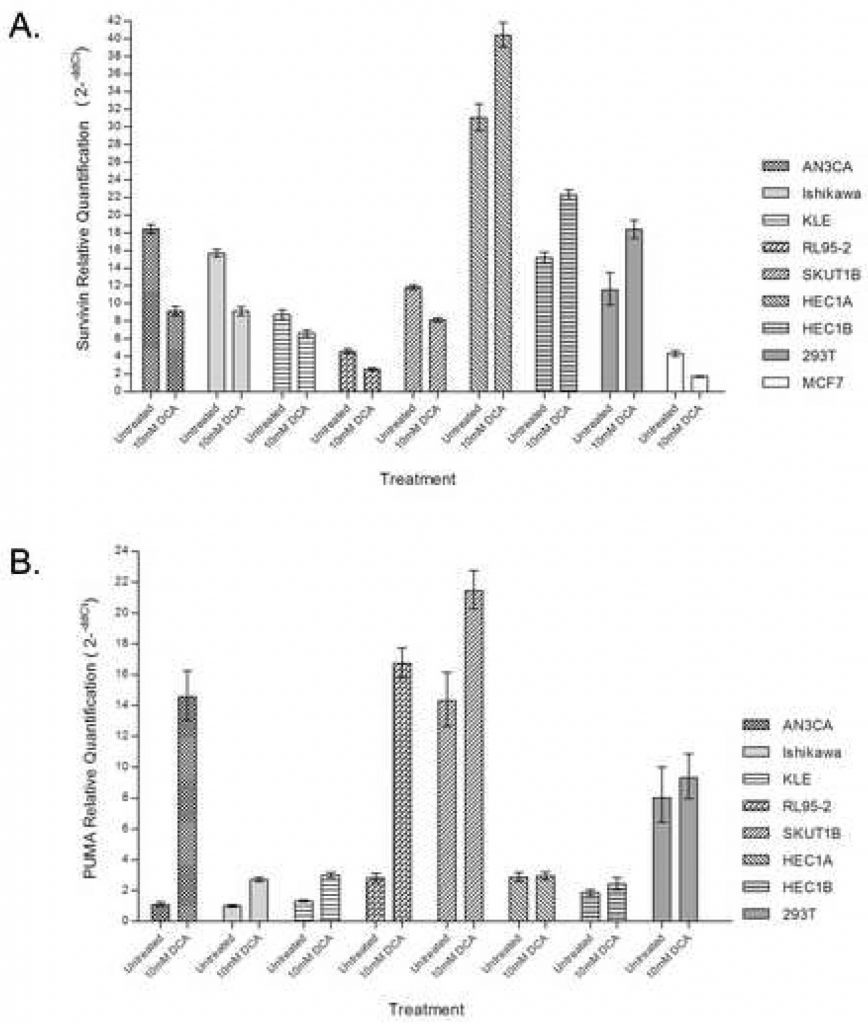
DCA увеличивает экспрессию PUMA
Для определения вклада пути PUMA в апоптоз, индуцированный DCA, использовали количественную ПЦР в реальном времени для оценки обилия транскриптов PUMA при введении DCA и без него. Лечение клеточных линий рака эндометрия с помощью DCA резко увеличило количество мРНК PUMA в клеточных линиях, которые имели апоптотический ответ, включая AN3CA, Ishikawa, KLE, RL95-2 и SKUT1B (Рисунок 3B). Наибольшая степень индукции PUMA наблюдалась в клетках AN3CA и RL95-2, где наблюдалось 14-кратное и 6-кратное увеличение соответственно. HEC1A и HEC1B, которые ранее не имели апоптотического ответа на DCA, не показали разницы в количестве транскрипта PUMA при обработке. В клетках 293T не наблюдалось разницы в количестве транскрипта PUMA при лечении.
Обсуждение
В этом исследовании мы показали, что гибель клеток рака эндометрия, вызванная ДКА, регулируется двумя основными механизмами: митохондриально-регуляторным и NFAT-Kv1.5 путями. Кроме того, мы продемонстрировали, что DCA снижает жизнеспособность клеток рака эндометрия дозозависимым образом через стимулирование апоптоза, не оказывая при этом никакого влияния на нераковые клетки 293T. Наконец, мы показали, что лечение DCA влияет на выживаемость клеток рака эндометрия через множество молекулярных механизмов, включая регуляцию мембранного потенциала митохондрий, внутриклеточного уровня Ca2+, потерю экспрессии Survivin и индукцию PUMA.
Проапоптотический ответ AN3CA, Ishikawa и SKUT1B на DCA коррелировал с дозозависимым снижением уровня внутриклеточного Ca2+, что указывает на участие механизма NFAT-Kv1.5. Для сравнения, RL95-2 (который имел наибольший апоптотический ответ на DCA) и KLE (который имел самый слабый апоптотический ответ) не показали разницы в уровнях внутриклеточного Ca2+ при любой концентрации обработки, что позволяет предположить, что путь механизма NFAT-Kv1.5 не вовлечен в механизм апоптоза этих клеточных линий. Напротив, обработка DCA задержала клетки RL95-2 в фазе G0/G1 клеточного цикла, что является отличительной чертой активации р53, сильно индуцировала экспрессию PUMA в RL95-2 и снизила экспрессию Survivin, белка, играющего критическую роль в регуляции клеточного цикла. [29].
Survivin — транскрипционно регулируемый ингибитор апоптоза, который в ответ на нарушение ММП выбрасывается из митохондрий в цитоплазму, где предотвращает активацию каспаз, подавляет апоптоз и способствует прогрессии опухоли [26, 27]. Предыдущие исследования показали положительную корреляцию между повышенной экспрессией Survivin и классом опухоли карциномы эндометрия [27,28]. Мы обнаружили, что количество транскрипта Survivin значительно снизилось во всех клеточных линиях рака эндометрия, которые имели апоптотический ответ на DCA. Наши результаты показывают, что митохондриально-регулируемый путь вносит свой вклад в апоптотический ответ в клеточных линиях рака эндометрия, чувствительных к ДКА.
Транскрипт PUMA был значительно увеличен во всех клеточных линиях рака эндометрия, которые имели апоптотический ответ на ДКА. Результат может свидетельствовать о вкладе пути p53-PUMA с митохондриальными и ионными канальными механизмами в DCA-индуцированный апоптоз. Повышение экспрессии PUMA может противодействовать про-спасительному эффекту Bcl-2 на митохондриальной мембране в клеточных линиях, позволяя увеличить транслокацию апоптотических медиаторов из митохондрий в цитоплазму, что способствует активации каспаз и апоптозу.
Две клеточные линии, HEC1A и HEC1B, обе высокоинвазивные, с повышенной лекарственной устойчивостью и более высоким классом опухоли [24] по сравнению с другими клеточными линиями эндометрия, были устойчивы к DCA. Действительно, обе клеточные линии показали повышенную экспрессию Survivin, экспрессию PUMA, на которую не повлияло лечение DCA, и меньшую долю клеток с гиперполяризованными митохондриальными мембранами. Эти данные свидетельствуют о меньшей зависимости от аэробного гликолиза. Мы рассмотрели вопрос о том, могут ли мутации в DCA-связывающем домене человеческого белка PDK2 объяснить различия в реакции на лечение HEC1A и HEC1B. Однако при анализе последовательности всех клеточных линий мутаций в двух экзонах, кодирующих предполагаемый DCA-связывающий домен, обнаружено не было (данные не показаны).
В целом, наше исследование показывает, что дихлорацетат эффективно сенсибилизирует большинство мало- и умеренно инвазивных клеток рака эндометрия к апоптозу. Наши коллективные данные свидетельствуют о том, что апоптоз соответствует митохондриальному и NFAT-Kv1.5-опосредованному путям. Кроме того, наши данные позволяют предположить, что путь PUMA может быть вовлечен в стимулирование апоптоза под действием DCA. Будущие исследования должны быть направлены на изучение более широкого спектра типов раковых клеток в дополнение к определению механизмов, которые обеспечивают апоптотическую устойчивость к DCA. Наиболее потенциально информативным направлением является функциональная характеристика роли пути PUMA в DCA-индуцированном апоптозе.
Дополнительный материал
| Линия клеток рака эндометрия | Тип опухоли | Степень дифференцировки | Инвазивность | статус р53 |
| AN3CA | Эпителиальная аденокарцинома | Недифференцированная (30, 31) | Умеренная (25, 32) | Мутантная (33) |
| KLE | Аденокарцинома | Плохо дифференцированная (31, 34, 35) | Умеренная (36) | Мутантная (33) |
| Исикава | Эпителиальная аденокарцинома | Хорошо дифференцированная (25, 37) | Низкий (25) | Мутантная (33) |
| RL95-2 | Эпителиальная карцинома | Умеренно дифференцированная (31, 35, 38) | Зависит от числа пассажей (39) | Мутант (делеция кодона) (33) |
| СКУТ1В | Мезодермальная лейомиосаркома | Хорошо дифференцированная | Умеренно-высокая (40) | н/а |
| HEC1A | Эпителиальная аденокарцинома | Умеренно дифференцированная (31, 41) | Высокая (25, 42) | Мутантная (33) |
| HEC1B | Эпителиальная аденокарцинома | Умеренно дифференцированная (31, 41) | Высокая (25, 42) | Мутант (33) |
Благодарности
Мы хотели бы поблагодарить доктора Джона Дейли из центра проточной цитометрии HemNeo компании Dana Farber за техническое обучение и доктора Сабину Синьоретти из центра патологии онкологического центра Dana Farber — Harvard Cancer Center за иммуногистохимическую поддержку.
Грантовая поддержка: Этот проект был поддержан грантами Национальных институтов здравоохранения под номерами CA082838 и CA101501.
ССЫЛКИ
1 Роуз П. Карцинома эндометрия. New England Journal of Medicine. 1996;335(9):640-649. [PubMed] br>2 Ingram SS, Rosenman J, Heath R, Morgan TM, Moore D, Varia M. The predictive value of progesterone receptor levels in endometrial cancer. Int J Radiat Oncol Biol Phys. 1989;17(1):21-27. [PubMed] br>3 Randall ME, Filiaci VL, Muss H, et al. Randomized phase III trial of whole-abdominal irradiation versus doxorubicin and cisplatin chemotherapy in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol. 2006;24(1):36-44. [PubMed] br>4 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11(1):37-51. [PubMed] br>5 Chen Z, Lu W, Garcia-Prieto C, Huang P. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr. 2007 [PubMed] br>6 Kim JW, Dang CV. Молекулярная сладость рака и эффект Варбурга. Cancer Res. 2006;66(18):8927-8930. [PubMed] br>7 Chen LB. Мембранный потенциал митохондрий в живых клетках. Annu Rev Cell Biol. 1988;4:155-181. [PubMed] br>8 Heerdt BG, Houston MA, Augenlicht LH. Внутренний митохондриальный мембранный потенциал клеток карциномы толстой кишки связан с вероятностью прогрессирования опухоли. Cancer Res. 2005;65(21):9861-9867. [PubMed] br>9 Han J, Flemington C, Houghton AB, et al. Expression of bbc3, a pro-apoptotic BH3-only gene, is regulated by diverse cell death and survival signals. Proc Natl Acad Sci U S A. 2001;98(20):11318-11323. [PMC free article] [PubMed] br>10 Nakano K, Vousden KH. PUMA, новый проапоптотический ген, индуцируется p53. Mol Cell. 2001;7(3):683-694. [PubMed] br>11 Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA индуцирует быстрый апоптоз клеток колоректального рака. Mol Cell. 2001;7(3):673-682. [PubMed] br>12 Willis SN, Adams JM. Жизнь в равновесии: как BH3-онли белки индуцируют апоптоз. Curr Opin Cell Biol. 2005;17(6):617-625. [PMC free article] [PubMed] br>13 Jeffers JR, Parganas E, Lee Y, et al. Puma — важный медиатор p53-зависимых и -независимых апоптотических путей. Cancer Cell. 2003;4(4):321-328. [PubMed] br>14 Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA опосредует апоптотический ответ на p53 в клетках колоректального рака. Proc Natl Acad Sci U S A. 2003;100(4):1931-1936. [PMC free article] [PubMed] br>15 Abemayor E, Kovachich GB, Haugaard N. Effects of dichloroacetate on brain pyruvate dehydrogenase. J Neurochem. 1984;42(1):38-42. [PubMed] br>16 Lopaschuk GD, Saddik M. The relative contribution of glucose and fatty acids to ATP production in hearts reperfused after ischemia. Mol Cell Biochem. 1992;116(1–2):111–116. [PubMed] br>17 Stacpoole PW. Фармакология дихлорацетата. Metabolism. 1989;38(11):1124–1144. [PubMed] br>18 Wong A, Cortopassi GA. Высокопроизводительное измерение мембранного потенциала митохондрий в линии нейрональных клеток с помощью флуоресцентного планшетного ридера. Biochem Biophys Res Commun. 2002;298(5):750-754. [PubMed] br>19 Yan J, Jiang J, Lim CA, Wu Q, Ng HH, Chin KC. BLIMP1 регулирует рост клеток через репрессию транскрипции p53. Proc Natl Acad Sci U S A. 2007;104(6):1841-1846. [PMC free article] [PubMed] br>20 Bieche I, Parfait B, Tozlu S, Lidereau R, Vidaud M. Количественное определение экспрессии генов рецепторов андрогена в спорадических опухолях молочной железы с помощью RT-PCR в реальном времени: доказательства того, что MYC является AR-регулируемым геном. Carcinogenesis. 2001;22(9):1521–1526. [PubMed] br>21 Hassoun EA, Ray S. Индукция окислительного стресса и клеточной смерти побочными продуктами дезинфекции питьевой воды, дихлорацетатом и трихлорацетатом в клетках J774.A1. Сравнительная биохимия и физиология Токсикология и фармакология. 2003;135(2):119-128. [PubMed] br>22 Di Lisa F, Silverman HS, Hansford RG. Митохондриальная функция и повреждение клеток в одиночных сердечных миоцитах, подвергнутых аноксии и реоксигенации. Transplant Proc. 1995;27(5):2829-2830. [PubMed] br>23 Piccoli C, Scrima R, Boffoli D, Capitanio N. Контроль цитохром c оксидазой клеточной системы окислительного фосфорилирования зависит от энергетического состояния митохондрий. Biochem J. 2006;396(3):573-583. [PMC свободная статья] [PubMed] br>24 Liang Y, O’Driscoll L, McDonnell S, et al. Enhanced in vitro invasiveness and drug resistance with altered gene expression patterns in a human lung carcinoma cell line after pulse selection with anticancer drugs. Int J Cancer. 2004;111(4):484-493. [PubMed] br>25 Sillem M, Prifti S, Koumouridis A, et al. Инвазивность соответствует дифференциации, а не секреции протеиназ в клеточных линиях рака эндометрия. Европейский журнал гинекологической онкологии. 1999;20(5–6):367–370. [PubMed] br>26 Dohi T, Okada K, Xia F, et al. Комплекс IAP-IAP ингибирует апоптоз. J Biol Chem. 2004;279(33):34087–34090. [PubMed] br>27 Ambrosini G, Adida C, Altieri DC. Новый антиапоптозный ген, сурвивин, экспрессируемый в раке и лимфоме. Nat Med. 1997;3(8):917-921. [PubMed] br>28 Erkanli S, Bolat F, Kayaselcuk F, Demirhan B, Kuscu E. COX-2 and survivin are overexpressed and positively correlated in endometrial carcinoma. Gynecol Oncol. 2007;104(2):320-325. [PubMed] br>29 Li F, Ambrosini G, Chu EY, et al. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396(6711):580–584. [PubMed] br>30 Rice LW, Stone RL, Xu M, et al. Biologic targets for therapeutic intervention in endometrioid endometrial adenocarcinoma and malignant mixed mullerian tumors. Am J Obstet Gynecol. 2006;194(4):1119-1126. обсуждение 26-28. [PubMed] br>31 Nagamani M, Stuart CA. Специфическое связывание и стимулирующая рост активность инсулина в клетках рака эндометрия в культуре. Am J Obstet Gynecol. 1998;179(1):6-12. [PubMed] br>32 Zhao Y, Yamashita T, Ishikawa M. Регулирование опухолевой инвазии геном HOXB13, сверхэкспрессированным в раке эндометрия человека. Oncol Rep. 2005;13(4):721-726. [PubMed] br>33 Yaginuma Y, Westphal H. Analysis of the p53 gene in human uterine carcinoma cell lines. Cancer Res. 1991;51(24):6506-6509. [PubMed] br>34 Richardson GS, Dickersin GR, Atkins L, et al. KLE: клеточная линия с дефектным рецептором эстрогена, полученная из недифференцированного рака эндометрия. Gynecol Oncol. 1984;17(2):213-230. [PubMed] br>35 Carter CA, Parham GP. Состояние дифференцировки влияет на ответ клеток аденокарциномы эндометрия на ретиноевую кислоту. Anticancer Research. 1997;17(3C):1973–1983. [PubMed] br>36 Yabushita H, Narumiya H, Hiratake K, et al. The association of transforming growth factor-beta 1 with myometrial invasion of endometrial carcinomas through effects on matrix metalloproteinase. J Obstet Gynaecol Res. 2000;26(3):163-170. [PubMed] br>37 Holinka CF, Hata H, Kuramoto H, et al. Responses to estradiol in a human endometrial adenocarcinoma cell line (Ishikawa) Journal of Steroid Biochemistry. 1986;24(1):85-89. [PubMed] br>38 Way DL, Grosso DS, Davis JR, et al. Characterization of a new human endometrial carcinoma (RL95-2) established in tissue culture. In Vitro. 1983;19(3 part 1):147-158. [PubMed] br>39 Sundareshan P, Hendrix MJ. Growth, morphologic, and invasive characteristics of early and late passages of a human endometrial carcinoma cell line (RL95-2) In Vitro Cell Dev Biol. 1992;28A(7-8):544-552. [PubMed] br>40 Colombatti A, Russo P, Cervi M, et al. Differential Expression of IRS-1 and IRS-2 in Uterine Leiomyosarcomas with Distinct Oncogenic Phenotypes: Отсутствие корреляции с сигнальными событиями в нисходящем потоке. Sarcoma. 2002;6(3):89-96. br>41 Kuramoto H, Tamura S, Notake Y. Создание клеточной линии аденокарциномы эндометрия человека in vitro. Am J Obstet Gynecol. 1972;114(8):1012–1019. br>42 Sieuwerts AM, Klijn JG, Foekens JA. Оценка инвазивного потенциала клеточных линий гинекологических опухолей человека с помощью камерного анализа Бойдена in vitro: влияние способности клеток мигрировать через мембрану фильтра. Clin Exp Metastasis. 1997;15(1):53-62.
Связанный контент: