Tiziana Tataranni 1, Francesca Agriesti 1, Consiglia Pacelli 2, Vitalba Ruggieri 1, Ilaria Laurenzana 1, Carmela Mazzoccoli 1 , Gerardo Della Sala 1, Concetta Panebianco 3, Valerio Pazienza 3, Nazzareno Capitanio 2 и Claudia Piccoli 1,2,*
1 Лаборатория доклинических и трансляционных исследований, IRCCS-CROB, Реферальный онкологический центр Базиликаты, 85028 Рионеро-ин-Вульф (Pz), Италия; [email protected] (T.T.); [email protected] (F.A.); [email protected] (V.R.); [email protected] (I.L.); [email protected] (C.M.); [email protected] (G.D.S.).)
2 Кафедра клинической и экспериментальной медицины, Университет Фоггии, 71100 Фоггия, Италия; [email protected] (C.P.); [email protected] (N.C.)
3 Отделение гастроэнтерологии, госпиталь IRCCS «Casa Sollievo della Sofferenza», 71013 Сан Джованни Ротондо, Италия; [email protected] (C.P.); [email protected] (V.P.
* Корреспонденция: [email protected]; Тел: +39-0881-588-060
Received: 21 февраля 2019 г.
Принято: 15 мая 2019 г.
Опубликовано: 18 мая 2019 г
Аннотация
Нацеливание на метаболизм представляет собой возможный успешный подход к лечению рака. Дихлорацетат (ДХА) — это препарат, который, как известно, переключает метаболизм с анаэробного гликолиза на митохондриальное окислительное фосфорилирование путем стимуляции PDH. В данном исследовании мы изучили реакцию двух линий клеток рака поджелудочной железы на DCA в двухмерных и трехмерных клеточных культурах, а также в мышиной модели. PANC-1 и BXPC-3, обработанные DCA, показали заметное снижение пролиферации и миграции клеток, которое не коррелировало с усилением апоптоза, что указывает на цитостатический, а не цитотоксический эффект. Несмотря на активацию PDH, лечение DCA привело к снижению потребления кислорода митохондриями без влияния на гликолиз. Более того, DCA вызвал увеличение производства ROS, мтДНК и маркера митофагии LC3B-II в обеих клеточных линиях, но снизил маркеры слияния митохондрий только в BXPC-3. Примечательно, что DCA снижал экспрессию маркеров раковых стволовых клеток CD24/CD44/EPCAM только в PANC-1, но подавлял образование сфероидов/жизнеспособность в обеих клеточных линиях. В ксенотрансплантационной мышиной модели рака поджелудочной железы лечение DCA приводило к замедлению прогрессии рака. В совокупности наши результаты ясно показывают, что эффективность DCA в подавлении роста рака механистически зависит от фенотипа клеток и от множества путей, не являющихся мишенями. В этом контексте нововведение о том, что DCA может влиять на раковые стволовые клетки, имеет терапевтическое значение.
Ключевые слова: метаболизм; митохондрии; раковые стволовые клетки
© 2019 авторы. Лицензиат MDPI, Базель, Швейцария. Данная статья является статьей с открытым доступом и распространяется на условиях лицензии Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/).
ВВЕДЕНИЕ
Протоковая аденокарцинома поджелудочной железы (PDAC) — очень агрессивный рак, с низким процентом пациентов, подлежащих хирургической резекции, и высокой рефрактерностью к традиционным методам лечения [1,2]. Поэтому для улучшения текущих схем лечения настоятельно требуются более эффективные препараты. Помимо роста клеток, восстановления ДНК, инвазивности и ангиогенеза, клетки РПЖ отличаются мутациями в генах, участвующих в метаболизме [1,3]. Новые терапевтические стратегии, направленные на метаболизм, становятся перспективными подходами для преодоления химиорезистентности [4]. Однако меж- и внутриопухолевая гетерогенность часто приводит к различным метаболическим фенотипам, что также является следствием многочисленных взаимодействий с микроокружением опухоли [5]. Это создает терапевтические ограничения и подчеркивает важность предварительной метаболической характеристики опухолевых линий, предшествующей введению эффективных препаратов. Недавно мы продемонстрировали, что две клеточные линии рака поджелудочной железы, характеризующиеся различным метаболическим профилем, дают несхожий ответ на лишение глюкозы/замену галактозы — подход, способный перестроить энергетический метаболизм [6]. Более того, наша группа уже продемонстрировала эффективность дихлорацетата (DCA), ингибитора киназы пируватдегидрогеназы (PDK), для уничтожения культивируемых клеток, полученных из карцином ротовой полости человека, причем этот эффект обратно коррелировал с митохондриальной дыхательной способностью опухолевых клеток [7]. Несколько исследований in vivo и in vitro описывают способность DCA увеличивать окислительное фосфорилирование митохондрий (OxPhos), обращая вспять эффект Варбурга и избирательно воздействуя на опухолевые клетки [8,9]. Кроме того, обширная литература демонстрирует эффективность DCA для повышения химиочувствительности при нескольких видах рака [10,11]. Лечение DCA было предложено для исследований in vitro и in vivo также при раке поджелудочной железы [8,12,13,14]. Тем не менее, необходимы дальнейшие исследования, чтобы лучше определить эффективность препарата при этом типе рака, уточнить возможные дополнительные механизмы, приводящие к гибели клеток, и изучить возможные дальнейшие способы ограничения возникающих побочных эффектов. В данном исследовании мы проанализировали воздействие DCA на две клеточные линии PDAC, PANC-1 и BXPC-3, выбранные в том числе из-за схожих условий роста и хорошо охарактеризованного гено-/фенотипа [6,15,16]. Широкое профилирование метаболитов и транскриптома клеточных линий PDAC выявило три подтипа опухолей, причем PANC-1 и BXPC-3 принадлежат к липогенному кластеру, отличительной особенностью которого является зависимость от окисления глюкозы и метаболизма, связанного с митохондриями [17]. Испытав DCA на 2D и 3D культурах клеточных линий PDAC, мы продемонстрировали, что препарат негативно влияет на жизненно важные параметры, снижая митохондриальную дыхательную активность и, что особенно важно, компартмент раковых стволовых клеток. Более того, мы показали, что DCA также способен смягчать рост опухоли in vivo в модели ксенотрансплантированных мышей PDAC.
Материалы и методы
Культура клеток
Клетки PANC-1 и BXPC-3 были приобретены в Американской коллекции типовых культур (ATCC, Manassas, VA, USA) и культивировались при 37 °C в 5%CO2 увлажненной атмосфере в полной среде RPMI, дополненной 10% фетальной бычьей сывороткой, пенициллином-стрептомицином (100 U/mL) и 2 мМ глютамина, концентрация глюкозы обычно составляла 10 мМ или 1 мМ, когда это было указано. Дихлорацетат (ДХА) был приобретен у компании Sigma-Aldrich (Сент-Луис, МО, США). Для каждого эксперимента in vitro клетки обрабатывали DCA 4 мМ и 10 мМ в указанное время.
Кривые роста клеток
Кривые роста клеток проводили, как описано ранее [18].
Мониторинг пролиферации клеток в режиме реального времени с помощью системы xCELLigence
Эксперименты xCELLigence проводили с использованием прибора RTCA (анализатор клеток в режиме реального времени) в соответствии с инструкциями производителя (ACEA Biosciences, San Diego, CA, USA). Оптимальное число посева было предварительно определено путем титрования клеток и экспериментов по росту (данные не показаны). Затем высевали 2500 клеток/лунку и автоматически отслеживали их пролиферацию каждые 30 мин. Через 24 ч после высева клетки обрабатывали DCA. Клеточный индекс отслеживался до 90 часов от посева. Данные анализировали с помощью программного обеспечения xCELLigence (версия 2.0, Acea biosciences, San Diego, CA, USA) и выражали как среднее ± SD клеточного индекса, нормализованного к последнему клеточному индексу, зарегистрированному до момента добавления DCA.
Анализ апоптоза
После инкубации с DCA клетки окрашивали Annexin-V-FITC и PI (BD Biosciences). Живые, апоптотические и некротические клетки определяли с помощью проточной цитометрии (Navios, Beckman Coulter, Brea, CA, USA). Было проведено три независимых эксперимента. Всего было получено104 события для каждого образца.
Миграционный анализ
Влияние DCA на миграционные способности PANC-1 и BXPC-3 оценивали с помощью анализа царапин. Вкратце, клетки высевали в шестилуночные культуральные планшеты и культивировали до полной конфлюентности. Затем в каждой лунке делали три параллельные линейные раны с помощью пластикового наконечника пипетки объемом 200 мкл. Затем клетки обрабатывали DCA, и способность к заживлению ран, отслеживаемую в разные моменты времени, оценивали количественно через 48 ч. Для оценки миграции клеток фотографировали три репрезентативных изображения поцарапанных областей из каждой лунки. Скорость миграции клеток рассчитывали по следующей формуле: [1 — (ширина царапины через 48 ч/0 ширина царапины через 48 ч)] × 100%.
Измерения лактата
Набор для колориметрического анализа лактата (Abcam, Cambridge, MA, USA) использовали в соответствии с протоколом производителя, а обнаруженную концентрацию лактата (внутриклеточную или высвобожденную) нормировали на количество клеток.
Анализ метаболических потоков и ферментативной активности митохондриального дыхательного комплекса
Скорость потребления кислорода (OCR) и скорость внеклеточного закисления (ECAR) измеряли в адгезивных клетках PANC-1 и BXPC-3 с помощью анализатора внеклеточных потоков XF96 (Seahorse Bioscience, Billerica, MA, США), как описано ранее [19]. Вкратце, для анализа OCR после измерения базального дыхания в каждую лунку последовательно вносили олигомицин (1 мкМ), FCCP (1 мкМ) и ротенон + антимицин А (1 мкМ + 1 мкМ) для оценки, соответственно, сопряжения дыхательной цепи, максимального и немитохондриального потребления кислорода. Для анализа ECAR гликолитический поток (базальный гликолиз, гликолитический потенциал и гликолитический резерв) анализировали путем последовательного добавления 10 мМ глюкозы, 1 мкМ олигомицина и 100 мМ 2-дезоксиглюкозы. Значения OCR и ECAR были нормализованы на содержание белка в каждой лунке, определенное с помощью BCA assay (Thermo Scientific, Waltham, MA, USA).
Количественное определение митохондриальной ДНК
Измерение числа копий мтДНК, относительно числа копий ядерной ДНК, определяли, как описано ранее [6].
Визуализация мтΔΨ и ROS
Клетки, культивируемые с низкой плотностью на покрытых фибронектином 35-мм посуде со стеклянным дном (Eppendorf, Amburgo, Германия), инкубировали в течение 20 минут при 37 °C с 2
TMRE, 10
мкМDCF (Molecular Probes, Eugene, OR, USA) для мониторинга мтΔΨ и ROS, соответственно. Окрашенные клетки промывали PBS и просматривали с помощью конфокального лазерного сканирующего микроскопа Leica TCS SP8. Сбор, хранение и анализ данных проводили с помощью специального инструментального программного обеспечения от Leica (LAS-X, Ветцлар, Германия).
Вестерн-блоттинг анализ
Аликвоты, содержащие 40 мкг белков из каждого лизата клеток, подвергали SDS полиакриламидному гель-электрофорезу и переносили на поливинилидендифторидную мембрану с помощью Trans Blot Turbo Transfer System. Мембраны (Bio-Rad Laboratories, Hercules, CA, США) зондировали следующими первичными антителами: пируватдегидрогеназа E1-альфа (PDH) и pPDHSer293 (1:500, Abcam, Cambridge, UK), LC3B (1:1000 Cell Signaling Technology), TOM20 (1:1000, Santa Cruz Biotechnology, Santa Cruz, CA, USA), DRP1 (1:1000, BD Bioscences), OPA-1 (1:1000, BD Bioscences), MFN1 (1:1000, Santa Cruz), MFN2 (1:1000, Abnova, Tapei, Taiwan) и CASPASE 3 (1:1000, Cell Signaling Technology, Danvers, MA, USA). После инкубации с соответствующим подходящим вторичным антителом, конъюгированным с пероксидазой хрена (1:2500; Cell Signaling Technology), сигналы развивались с помощью набора для усиленной хемилюминесценции (ClarityTM Western ECL Substrate, Bio-Rad) и системы визуализации ChemiDoc XRS + (BioRad), а затем анализировались с помощью программного обеспечения Image Lab (версия 4.1, Bio-Rad, Hercules, CA, USA). Интенсивность полос LC3B-II (соответствующей расщепленной фракции), TOM20, DRP1, OPA-1, MFN1 и MFN2 была нормирована на сигнал β-актина, а фосфорилирование PDH было нормировано на общее количество белков.
Проточно-цитометрическая детекция поверхностных маркеров
Выраженность поверхностных маркеров CD44, CD24 и EPCAM оценивали с помощью цитофлуориметрического анализа в PANC-1 и BXPC-3, обработанных DCA в течение 24 ч. Вкратце, после трипсинизации клетки инкубировали в темноте при комнатной температуре в течение 15 мин с CD44-APC, EPCAM-FITC и CD24-PE прямо конъюгированными моноклональными антителами (BDB). Цитофлуориметрический анализ проводили с помощью Navios (Beckman Coulter). Испускаемый флуоресцентный сигнал 10 000 событий для каждого образца был получен и проанализирован с помощью программного обеспечения Kaluza Analysis (версия 1.3, Beckman Coulter, Brea, CA, США).
Обратная транскрипция и анализ ПЦР в реальном времени
Один микрограмм общей РНК, выделенной с помощью реагента Trizol (Life Technologies, Paisley, UK) в соответствии с инструкцией производителя и количественно измеренной на спектрофотометре Nanodrop (Thermo Fisher Scientific, Waltham, MA, USA), был использован в реакции обратной транскрипции (ОТ) с использованием набора для синтеза кДНК первой нити Transcriptor (Roche Diagnostic, Penzberg, Germany) в соответствии с инструкциями производителя. Количественная полимеразная цепная реакция (ПЦР) в реальном времени проводилась в двух экземплярах с использованием QuantiTect Primer Assay (Qiagen, Базель, Швейцария) для выявления мРНК Lin28. Количественное определение уровня мРНК проводили на приборе для ПЦР в реальном времени LightCycler® 480. Относительные количества Lin28 были нормализованы по отношению к экспрессии GAPDH с помощью программного обеспечения Light Cycler® 480 версии 1.5 (ROCHE) с использованием метода 2ΔΔCt.
3D культуры
Клетки PANC-1 и BXPC-3 отделяли с помощью трипсина-ЭДТА и подсчитывали. Затем 1000 клеток/лунку высевали в 96-луночные круглодонные планшеты с ультранизким прикреплением и культивировали в RPMI. Для оценки эффекта DCA на предварительно сформированные сфероиды 3D-культуры поддерживали в течение 7 дней, получая сфероиды. Затем среду заменяли свежей, и сфероиды обрабатывали DCA 4 мМ и 10 мМ в течение 72 ч. Чтобы оценить влияние DCA на формирование сфероидов, DCA добавляли к клеточной суспензии при посеве в планшеты с ультранизким прикреплением, и культуру поддерживали в течение 7 дней. Сфероиды фотографировали на инвертированном оптическом микроскопе (Axio Vert A1, Zeiss, Oberkochen, Германия) и измеряли их диаметр с помощью программы визуализации ZEISS ZEN. Жизнеспособность сфероидов оценивали с помощью MTS-анализа. В каждую лунку 3D культуры сфероидов добавляли раствор водного порошка реагента MTS CellTiter 96® (Promega, Madison, WI, США) и PMS (Sigma Aldrich, Saint Louis, MO, США). После 2 ч инкубации при 37 °C измеряли абсорбцию при 490 нм и рассчитывали процент жизнеспособности в каждой лунке, используя необработанные сфероиды как 100%.
Исследования на животных
Испытания на животных проводились в аккредитованном AAALAC (Association for Assessment and Accreditation of Laboratory Animal Care International, Frederick, MD USA) экспериментальном центре под номером разрешения ANM14_002/468862. Общее количество 5 ×106 раковых клеток BxPC-3-luc культивировали, ресуспендировали в 0,1 мл смеси PBS/матригель (1:1) и затем вводили внутривенно в правый фланг 5-6-недельных мышей Nu/Nu nude. Когда размер опухоли достигал среднего объема 100 мм3, мышей-носителей опухоли BxPC-3-luc случайным образом распределяли на 2 группы (6 мышей на группу). Группа 1 (нормальный физраствор, в/в, qw), группа 2 (DCA, мг/кг, в/в, qw). Животные имели свободный доступ к воде. DCA растворяли для получения конечной концентрации 100 мг/кг/день (s.c: подкожно; i.p: внутрибрюшинно; qw: один раз в неделю).
Статистический анализ
Экспериментальные данные выражены как среднее ± стандартная ошибка среднего (SEM) или среднее ± стандартное отклонение (SD). Данные сравнивали с помощью непарного t-теста Стьюдента или одностороннего Anova с последующим тестом Бонферрони. Значение p < 0,05 принималось как статистически значимое.
Результаты
DCA отрицательно влияет на пролиферацию, выживаемость и миграцию клеток в клеточных линиях PANC-1 и BXPC-3
Для данного исследования были выбраны две клеточные линии PDAC: PANC-1 и BXPC-3. PANC-1 — это клеточная линия протокового происхождения, полученная из карциномы поджелудочной железы. Она может метастазировать, но имеет низкую способность к дифференцировке и несет мутации в KRAS и TP53 и гомозиготную делецию в CDKN2A/p16 [16]. BxPC-3 — это первичная клеточная линия, полученная из аденокарциномы, с умеренной дифференцировкой и эпителиальной морфологией. Она экспрессирует муцин и высокие уровни ангиогенных факторов и маркеров стволовых клеток рака [16,20], не имеет мутаций KRAS, но имеет мутации в TP53 и гомозиготные делеции в CDKN2A/p16 и SMAD4/DPC4 [16]. Влияние DCA на параметры жизнеспособности клеточных линий PANC-1 и BXPC-3 оценивали в концентрациях 4 мМ и 10 мМ, уже протестированных и доказавших свою эффективность, как показано в нашем предыдущем исследовании [7]. Сначала мы провели анализ роста клеток в течение 72 ч, который выявил значительную дозо- и времязависимую чувствительность обеих клеточных линий к обработке DCA (рис. 1A,B). В частности, PANC-1 и BXPC-3 демонстрировали сходный блок клеточного роста при обработке 10 мМ DCA, начиная с первого дня инкубации, и наоборот, при более низкой дозе 4 мМ клеточная линия PANC-1 оказалась значительно более чувствительной к препарату.
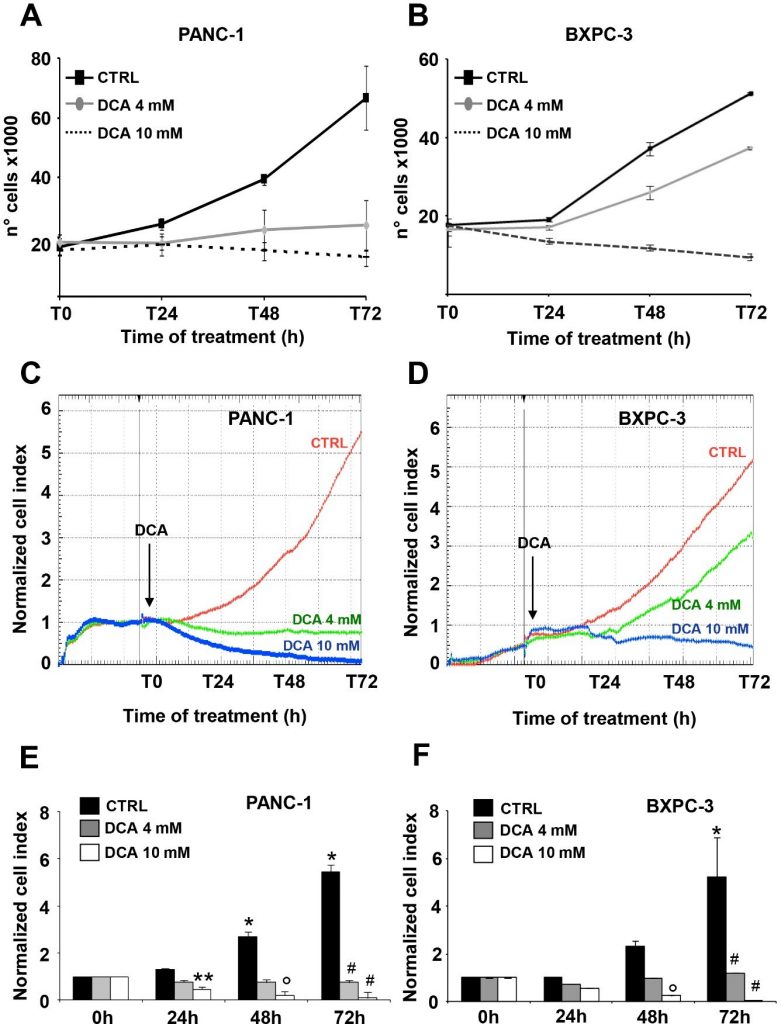
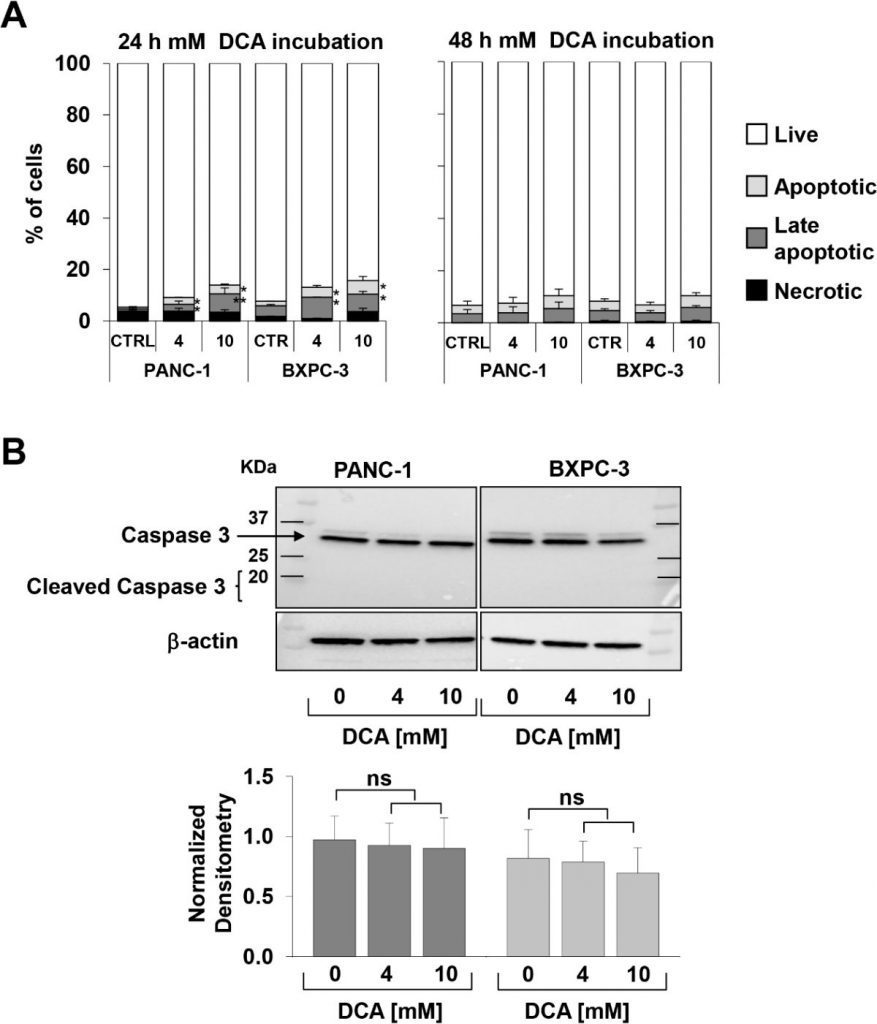
Приведенное выше наблюдение, особенно интересное в связи с известной химиорезистентностью клеточной линии PANC-1 [21,22], побудило нас проверить ингибирование роста клеток, опосредованное DCA, с помощью другого подхода. Для этого мы в режиме реального времени отслеживали динамические изменения пролиферации и жизнеспособности клеток с помощью импедансной технологии. Как показано на рисунке 1C-F, обработка 10 мМ DCA резко снижала пролиферацию клеток в обеих клеточных линиях, в то время как обработка 4 мМ DCA вызывала гораздо более сильный ингибирующий эффект в PANC-1 по сравнению с линиями клеток BXPC-3. Следует отметить, что эффект ДКА был хорошо заметен уже через 24 часа инкубации с препаратом. Анализ роста клеток в режиме реального времени также проводился при низком содержании глюкозы в среде культивирования (т.е. 1 мМ в RPMI). Как и ожидалось, скорость роста обеих клеточных линий PDAC была сильно подавлена, учитывая их метаболическую зависимость от окисления глюкозы [17]. Однако разная чувствительность при обработке 4 мМ DCA была подтверждена и при низком уровне глюкозы (Дополнительный рисунок S1). Для оценки жизненных параметров мы использовали анализ аннексина V-FITC/PI и оценивали с помощью проточной цитометрии относительное количество некротических, поздних и ранних апоптотических клеток. Полученные результаты показали, что после 24 ч инкубации с DCA клеточные линии PANC-1 и BXPC-3 демонстрировали небольшое, но значительное дозозависимое увеличение апоптоза по сравнению с необработанными клетками. Однако количество апоптотических клеток было относительно низким (т.е. < 10% при более высокой концентрации DCA) и не увеличивалось в течение 48 ч после обработки DCA (рис. 2A). Соответственно, экспрессия нерасщепленной каспазы 3 не изменилась после обработки ДКА, и не было обнаружено заметного количества ее расщепленной формы (рис. 2В). Этот результат указывает на цитостатическую, а не цитотоксическую активность препарата в обеих клеточных линиях, что объясняет заметное снижение скорости роста, показанное на рисунках 1A-D.
Далее мы оценили влияние DCA на подвижность клеток, проведя анализ заживления ран. Миграционная способность, наблюдаемая в разные моменты времени, была измерена через 48 ч после обработки 4 мМ и 10 мМ DCA. Клетки PANC-1 и BXPC-3 снизили свою подвижность при обработке более высокой дозой DCA, в то время как на миграционную способность BXPC-3 не повлияла обработка 4 мМ DCA, которая, напротив, вызвала задержку в способности закрытия раны у клеток PANC-1, что подтверждает их большую чувствительность к препарату, обнаруживаемому в более низкой концентрации (Дополнительный рисунок S2).
DCA изменяет энергетический метаболизм клеток в клеточных линиях PDAC
Для того чтобы исследовать связь между антипролиферативным эффектом, вызванным DCA, и изменениями в метаболизме клеточных линий PDAC, мы оценили эффективность соединения для ингибирования его признанной мишени — киназы пируватдегидрогеназы (PDK), оценив состояние фосфорилирования субъединицы E1α (остаток S293) комплекса пируватдегидрогеназы (PDC) методом вестерн-блоттинга в PANC-1 и BXPC-3. Как показано на рисунке 3A,B, нормализованный уровень P-PDH-E1 был значительно снижен в обеих клеточных линиях, в то время как уровень экспрессии общей PDH был сопоставим и, как ожидалось, не изменялся под действием лекарственной терапии. Неожиданно, вне- и внутриклеточное производство лактата, по-видимому, не было затронуто в обеих клеточных линиях PDAC, обработанных DCA (Дополнительный рисунок S3).
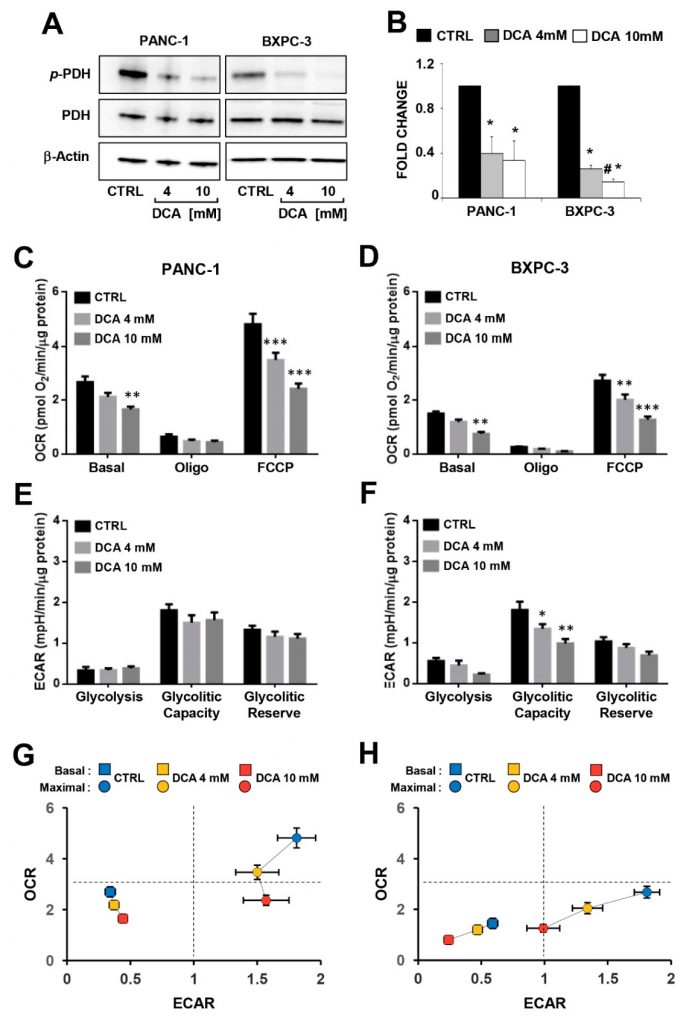
Затем мы проанализировали основные метаболические потоки путем измерения внеклеточного закисления и потребления кислорода с помощью технологии SeaHorse. При оценке метаболических потоков после 24-часовой инкубации с DCA не было отмечено значительных изменений в обеих клеточных линиях PDAC (Дополнительный рисунок S4). Более длительное (т.е. 48 ч) воздействие DCA вызвало дозозависимое снижение скорости потребления кислорода митохондриями (OCRs) в обеих клеточных линиях PANC-1 и BXPC-3 в базальных условиях, а также в присутствии ингибитора АТФ-синтазы олигомицина или разобщителя FCCP (т.е. максимальной дыхательной способности) (Рисунок 3C,D). Следует отметить, что дыхательная активность митохондрий была значительно выше в PANC-1, чем в BXPC-3, что указывает на более зависимый от OxPhos метаболический фенотип. Скорость внеклеточного окисления (ECAR), которая связана с гликолитическим потоком, не претерпела значительных изменений после обработки PANC-1 ДКА, в то время как в BXPC-3 при более высокой концентрации ДКА наблюдалось ингибирование базальной ECAR и дозозависимое снижение гликолитической способности (Рисунок 3E,F). Следовательно, ДКА повлиял на общий биоэнергетический профиль базальных и стимулированных потоков обеих клеток PDAC, при этом у PANC-1 наблюдалось снижение способности OxPhos, а у BXPC-3 — более сильное нарушение обоих метаболических потоков (Рисунок 3Г,З). Измерение метаболических потоков в условиях роста с низким содержанием глюкозы привело к снижению OCR в обеих клеточных линиях (в большей степени в BXPC-3) и повышению ECAR в BXPC-3. Обработка DCA (48 ч) вызвала у обеих клеточных линий значительно меньший ингибирующий эффект на OCR (особенно при 4 мМ) при низкой глюкозе по сравнению с режимом высокой глюкозы. В PANC-1 обработка DCA не вызвала значительного изменения ECAR, тогда как в BxPC-3 наблюдалось ингибирование на 40-50%, однако оно не зависело от наличия глюкозы (рис. S5). В целом, эти неожиданные наблюдения показали, что в клетках PDAC, несмотря на то, что DCA, по-видимому, способен активировать PDH, не было достигнуто обратного эффекта Варбурга. Вместо этого, лечение DCA вызвало биоэнергетический кризис, что привело к затуханию роста клеток по механизму «вне мишени».
DCA индуцирует производство ROS в клеточных линиях PDAC и дифференциально влияет на биогенез и динамику митохондрий
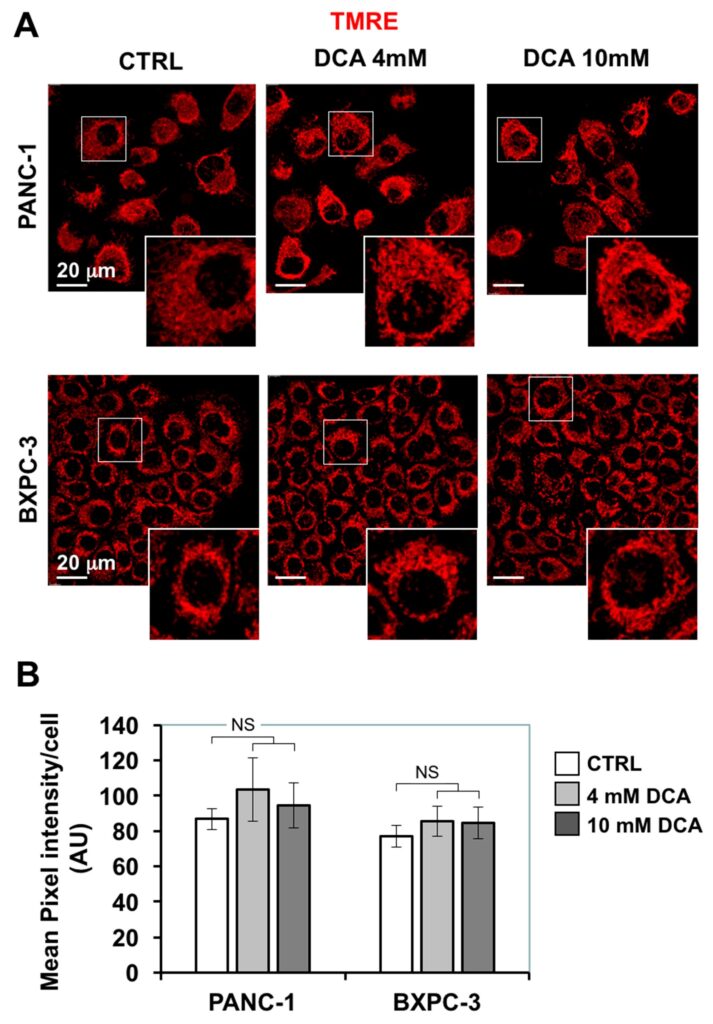
Угнетение митохондриального дыхания, вызванное DCA, заставило нас исследовать дальнейшие функции митохондрий. Во-первых, мы оценили морфо-функциональную архитектуру митохондриального компартмента с помощью конфокальной микроскопии с использованием флуоресцентного ΔΨ-зонда TMRE, который накапливается в дышащих митохондриях. На рисунке 4A показано, что в PANC-1 сигнал, связанный с TMRE, имеет вид диффузных частиц, в значительной степени распределенных в цитоплазме, что свидетельствует о преобладании фрагментированной, а не взаимосвязанной структуры. Аналогичная картина наблюдалась и в более мелких клетках BXPC-3, которые, однако, демонстрировали кольцевую внутриядерную компартментализацию. Обработка DCA в течение 24 часов не вызвала значительных изменений ни в интенсивности флуоресцентного сигнала TMRE, ни в его морфологическом виде.
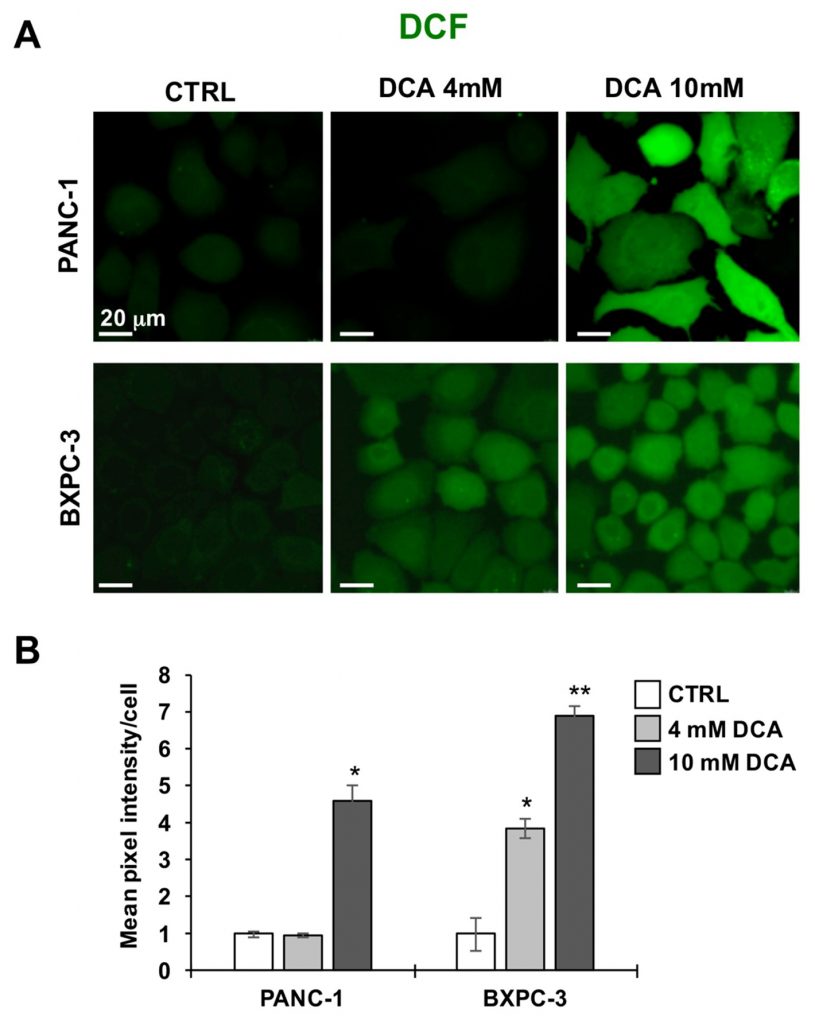
Далее мы исследовали две линии клеток PDAC на предмет их окислительно-восстановительного тонуса с помощью перекисного зонда DCF. На рисунках 5A, B показано, что обработка 10 мМ DCA в течение 24 ч вызвала значительное увеличение сигнала, связанного с DCF, в клеточных линиях PANC-1 и BXPC-3 по сравнению с исходным уровнем без обработки. Этот результат указывает на прооксидативный дисбаланс или окислительно-восстановительное состояние, вызванное воздействием DCA.
Представленный выше анализ был дополнен измерением митохондриальной ДНК (мтДНК). Как показано на рисунке 6A, число копий мтДНК на клетку было значительно выше в PANC-1, чем в BXPC-3, что соответствует более активной дыхательной деятельности. После обработки DCA в обеих клеточных линиях PDAC наблюдалось прогрессивное дозозависимое увеличение мтДНК. Это, вероятно, было связано с компенсаторной реакцией на дисфункцию OxPhos, вызванную DCA.
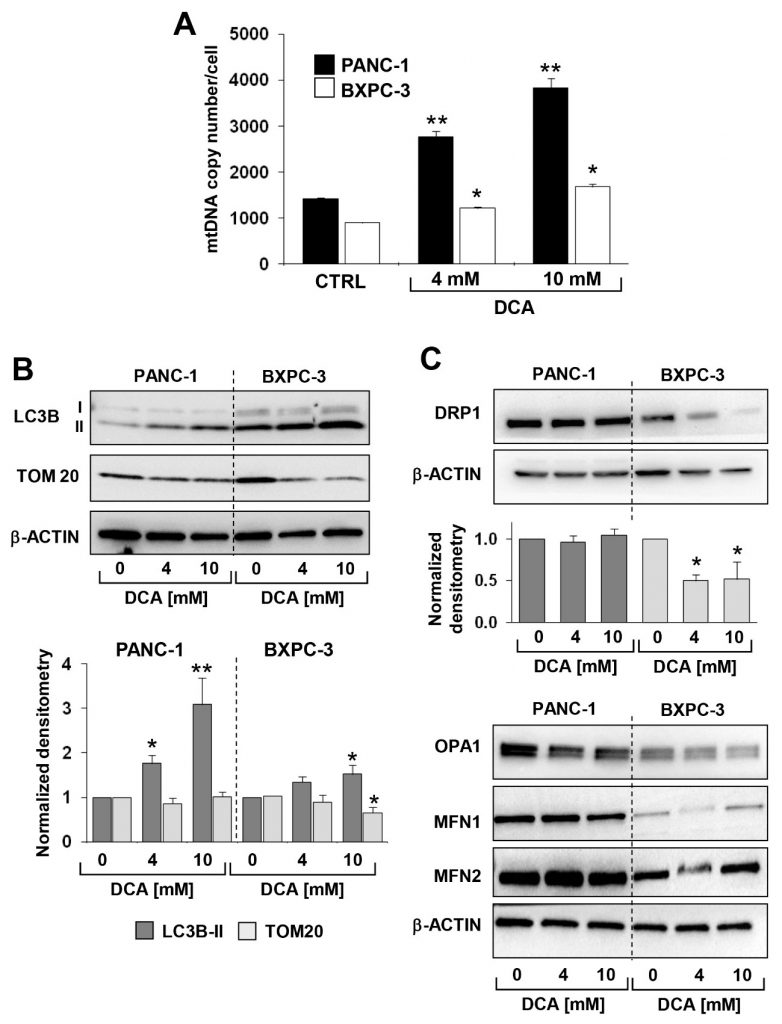
Далее мы оценили с помощью иммуноблотинга уровень экспрессии белков, которые, как известно, участвуют в клиренсе митохондрий (т.е. митофагии) и их динамике. На рисунке 6B,C показано, что экспрессия маркера аутофагосом LC3B-II была значительно выше в BXPC-3, чем в PANC-1, и что DCA вызывал дозозависимое прогрессивное увеличение этого маркера в обеих клеточных линиях. Однако TOM20, маркер внешней митохондриальной мембраны, значительно снизился только в линии клеток BXPC-3. Анализ факторов, участвующих в процессинге слияния/деления митохондрий, показал, что все они экспрессировались на более высоких уровнях в PANC-1 по сравнению с BXPC-3, но с дифференциальным влиянием на них обработки DCA (Рисунок 6C). В частности, только DRP1, фактор, участвующий в делении митохондрий, снизился после обработки DCA в BXPC-3. В PANC-1 не было обнаружено значительных изменений в экспрессии DRP1, а также факторов OPA1, MFN1 и MFN2, индуцирующих слияние митохондрий, в обеих клеточных линиях после обработки DCA (Дополнительный рисунок S6). В совокупности эти наблюдения свидетельствуют о более динамичном профиле митохондриального компартмента в PANC-1, который подвергается активному слиянию-расщеплению митохондрий при очевидно низком уровне переработки митофагии. И наоборот, клетки BXPC-3 фенотипически выглядят более склонными к контролю качества органелл. Это может быть связано с более фрагментированным видом митохондриальной сети в клетках BXPC-3. Обработка DCA вызвала явное увеличение митофагического маркера LC3B в обеих клеточных линиях, которое, однако, оставалось гораздо более значительным в BXPC-3.
DCA дифференцированно влияет на фракцию раковых стволовых клеток в клеточных линиях PDAC
Для изучения возможных дополнительных механизмов цитостатического эффекта DCA мы решили проверить его влияние на фракцию раковых стволовых клеток (CSC) клеточных линий PDAC. Для этого мы оценили экспрессию фактора эмбриональных стволовых клеток Lin28, вовлеченного в клеточный метаболизм [23] и являющегося биомаркером плохого прогноза развития рака [24,25]. На рисунке 7А показано, что 48 ч обработки DCA вызвали значительное снижение экспрессии Lin28 в обеих клеточных линиях, причем BXPC-3 оказалась более чувствительной, чем PANC-1. Аналогичный результат был получен в 3D культурах, полученных из обеих клеточных линий (Рисунок 7B).
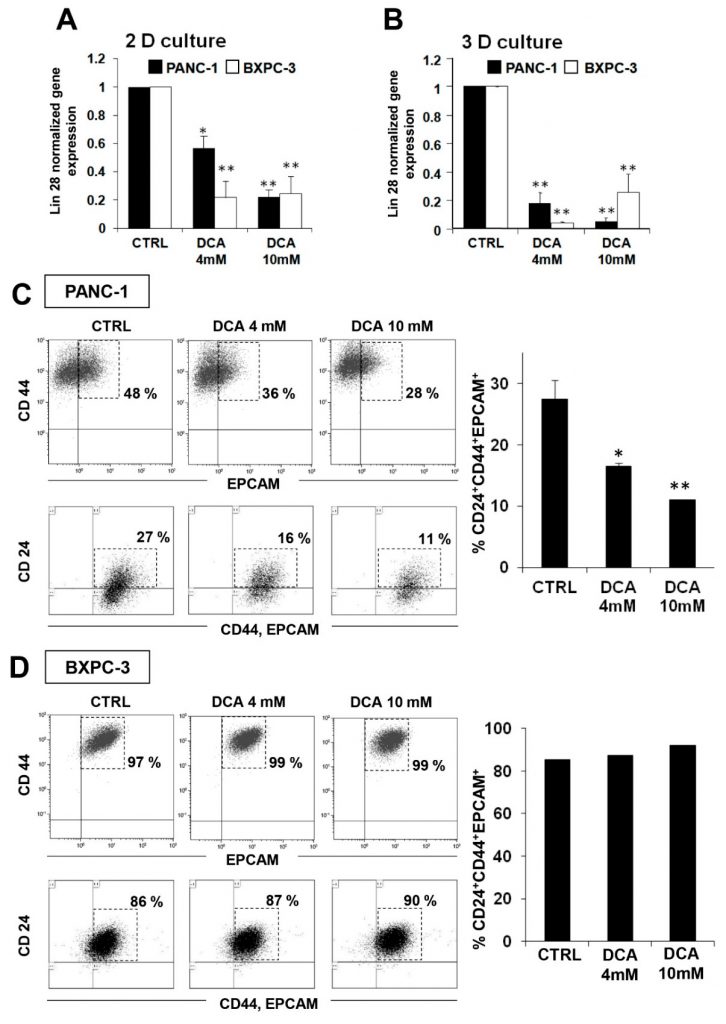
Это наблюдение побудило нас углубить влияние DCA на КСК с помощью FACS-анализа специфических поверхностных маркеров панкреатических КСК CD24, CD44 и EPCAM [26,27]. На рисунке 7C показано значительное дозозависимое снижение количества CD24+/CD44+/EPCAM+ клеток в клетках PANC-1, обработанных в течение 48 ч ДКА. Следует отметить, что при обработке 4 мМ DCA интенсивность флуоресценции в клетках PANC-1 снижалась почти на 50%, тогда как при обработке 10 мМ более сильное снижение интенсивности флуоресценции наблюдалось уже после 24 ч обработки и не изменилось после 48 ч обработки (данные не показаны). Напротив, хотя маркеры CSC экспрессировались примерно в 90% клеток BXPC-3, на их экспрессию не влияла обработка DCA (рис. 7D). Недавно сообщалось, что не только абсолютный уровень экспрессии данных маркеров, но и их соотношение позволяет выявить субпопуляцию с более выраженными признаками стволовости. В частности, соотношение CD44/CD24 является более надежным маркером КСК в опухолевом генезе и метастазировании [28]. В соответствии с этим представлением, важно, что соотношение экспрессии CD44/CD24 в PANC-1 было в 8 раз выше, чем в BXPC-3 (Дополнительный рисунок S7), что указывает на то, что, несмотря на меньшую заселенность, компартмент CSC качественно более похож на стволовые клетки. И наоборот, низкий уровень экспрессии маркеров КСК, широко распространенных в популяции BXPC-3, фенотипирует их как ранние прогениторы.
Влияние DCA на 3D-культуры
Для дальнейшего изучения противоопухолевых свойств DCA мы проанализировали его биологическое действие на альтернативном испытательном стенде, состоящем из 3D-культур PANC-1 и BXPC-3. Все больше доказательств свидетельствует о том, что сфероиды, полученные из раковых клеток, обогащены КСК или клетками с характеристиками, связанными со стволовыми клетками [29,30]. На рисунке 8А представлены микрофотографии сфероидов, полученных после 7 дней культивирования, на которых можно четко отметить разницу в размере и компактности пограничного слоя между клеточными линиями PANC-1 и BXPC-3. В частности, сфероиды, полученные из клеток PANC-1, выглядели более крупными и с неровными границами по сравнению с теми, что были получены из клеток BXPC-3. Обработка DCA в течение 72 часов изменила морфологию сфероидов, которые постепенно становились менее четкими. Это было особенно заметно в сфероидах, полученных из PANC-1, при обработке 10 мМ DCA. В соответствии с этим наблюдением, в сфероидах PANC-1 и BXPC-3 наблюдалось прогрессирующее дозозависимое снижение жизнеспособности клеток.
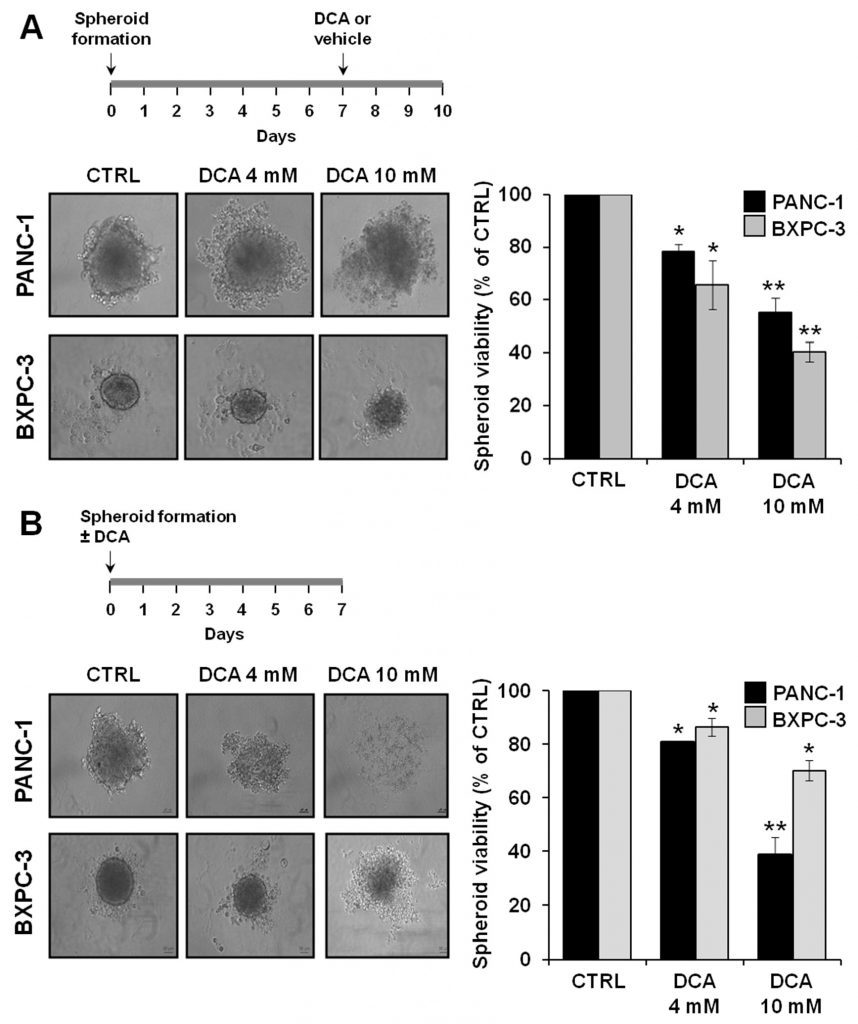
Мы также исследовали способность DCA влиять на формирование сфероидов, обрабатывая суспензию клеток при посеве. Как показано на рисунке 8B, DCA сильно влиял на формирование сфероидов в обеих клеточных линиях PDAC, причем PANC-1 оказался более чувствительным к препарату. Соответственно, жизнеспособность клеток сфероидов PANC-1 пострадала значительно больше, чем сфероидов BXPC-3.
DCA замедляет прогрессирование рака в ксенотрансплантационной мышиной моделирака подже
лудочной железы
В
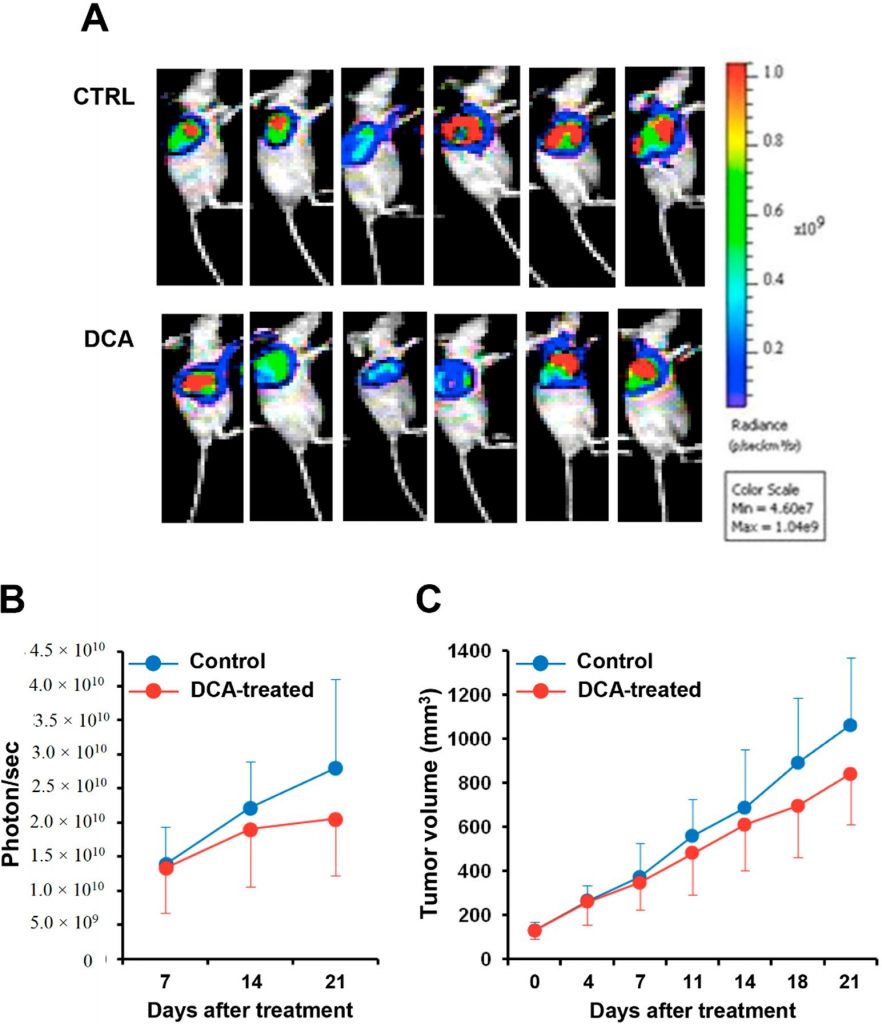
заключение мы оценили эффект введения DCA в ксенотрансплантационной мышиной модели рака поджелудочной железы. Люцифераза-экспрессирующую клеточную линию BXPC-3 вводили мышам nude и после достижения объема 100 мм3 обрабатывали DCA или транспортным средством в течение трех недель. На рисунке 9A показана биолюминесцентная визуализация опухолевой массы у мышей, обработанных DCA, и контрольных мышей. Количественная оценка сигнала биолюминесценции показала замедление прогрессирования опухоли поджелудочной железы у мышей, получавших ДКА, что подтверждается уменьшением на 25-30% как интенсивности сигнала биолюминесценции опухолевой массы, так и ее объема по сравнению с мышами, получавшими транспортное средство (Рисунок 9B,C). Однако из-за большой межиндивидуальной вариабельности различия не достигли статистической значимости.
4. Обсуждение
Аберрантные метаболические процессы обычно происходят в раковых клетках, поэтому воздействие на метаболизм представляет собой новую стратегию лечения опухолей, включая рак поджелудочной железы [31,32,33]. Гетерогенность опухоли может привести к появлению злокачественных клеток с различным метаболическим фенотипом и, следовательно, разной чувствительностью к метаболическим препаратам, как в случае с гемцитабином, к которому у большинства пациентов с раком поджелудочной железы развивается устойчивость [17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34].
В настоящем исследовании мы проверили эффективность метаболического препарата DCA в 2D и 3D культурах двух различных хорошо изученных клеточных линий рака поджелудочной железы (т.е. PANC-1 и BXPC-3), а также в ксенотрансплантационной модели рака поджелудочной железы. Обе клеточные линии, выращенные в монослое, показали выраженную чувствительность к DCA в самой высокой концентрации (т.е. 10 мМ), которая останавливала пролиферацию клеток и сильно подавляла их миграционную способность. Тестирование препарата в более низкой концентрации (т.е. 4 мМ DCA) выявило более высокую чувствительность клеточной линии PANC-1. Это наблюдение представляет интерес, поскольку PANC-1, по имеющимся данным, является агрессивной и химиорезистентной клеточной линией [21,22,35].
Анализ параметров жизнеспособности обеих клеточных линий PDAC, обработанных DCA, выявил ограниченный процент апоптотических/некротических клеток, что свидетельствует о цитостатическом, а не цитотоксическом эффекте препарата, подтверждая предыдущие отчеты [36,37].
Основной эффект DCA обычно связывают с его способностью вызывать метаболический переход от гликолиза к митохондриальному окислению глюкозы. Это достигается путем ингибирования киназы PDH PDK, тем самым переводя PDH в более активное нефосфорилированное состояние [38,39]. Следовательно, пируват превращается в ацетил-КоА, который входит в цикл трикарбоновых кислот и служит топливом для митохондриального окислительного фосфорилирования.
Однако в данном исследовании мы обнаружили, что, несмотря на значительное дефосфорилирование PDH, вызванное DCA, активации митохондриальной дыхательной активности не наблюдалось в обеих обработанных препаратом клеточных линиях PDAC. Напротив, DCA вызывал дозозависимое снижение митохондриального OxPhos, которое сочеталось с ингибированием гликолитической способности в BXPC-3.
Этот результат также несколько удивил, учитывая, что в предыдущем исследовании с клеточными линиями рака ротовой полости мы продемонстрировали, что клетки PE15, характеризующиеся устойчивым OxPhos, были устойчивы к лечению DCA, в то время как клетки HSC2/3, демонстрирующие гликолитический профиль, оказались более чувствительными к препарату с заметным влиянием также на морфо-функциональные параметры митохондрий [7]. Более того, в другом исследовании с клеточными линиями PANC-1 и BXPC-3 мы продемонстрировали дифференциальную чувствительность к депривации глюкозы/замене галактозы — условию, которое также усиливает окислительный метаболизм, причем более гликолитические клетки BXPC-3 оказались более уязвимыми [6]. Это позволило нам предположить, что различная чувствительность разных клеточных линий к препаратам или условиям, способствующим прооксидативному метаболическому сдвигу, зависит от их базового метаболического профиля, причем более уязвимыми являются те, которые в большей степени полагаются на гликолиз и/или имеют низкую дыхательную способность.
Угнетающее действие DCA на митохондриальное дыхание, по-видимому, не привело к изменениям морфологии митохондрий, хотя в клетках BXPC-3, обработанных DCA, наблюдалось значительное снижение фактора, способствующего делению, Drp1. Вероятно, базальный фрагментированный фенотип митохондриальной сети в BXPC-3 скрыт, чтобы оценить дальнейшую фрагментацию митохондрий. Однако число копий мтДНК на клетку было значительно увеличено в обеих клеточных линиях PDAC, что, вероятно, связано с компенсаторным механизмом вследствие митохондриальной дисфункции, ведущей к активации митофагии, о чем свидетельствует увеличение расщепленной формы LC3B-II. Наблюдаемая повышенная продукция ROS в клеточных линиях PDAC, обработанных DCA, может вызывать контроль качества органелл для удаления поврежденных митохондрий. Дисбаланс гомеостаза ROS обычно связывают с дисфункцией митохондриальной дыхательной цепи, хотя взаимосвязь часто не ясна (т.е. причина, следствие, порочный круг). Обычно митофагия считалась механизмом про-выживания, защищающим клетки в стрессовых условиях (онкогенная функция) [40], однако недавно было показано, что дисрегуляция митофагии способствует лекарственной устойчивости (опухолеподавляющая роль) [41]. В любом случае, индукция и ингибирование митофагии при прогрессировании рака все еще остается спорным вопросом.
Все вышеперечисленные наблюдения не позволяют нам обосновать цитостатический эффект DCA как просто связанный с метаболической перестройкой клеток PDAC. Необходимо учитывать, что DCA может воздействовать и на другие клеточные пути, помимо PDK. Действительно, сообщалось, что DCA влияет на путь биосинтеза КоА [42], активирует сигнальный путь AMPK [43], антагонизирует с ацетатом [44] и нарушает катаболизм тирозина [45]. Более того, сравнение профилей метаболитов в клетках, обработанных DCA или более селективными новыми ингибиторами PDK, привело к различным результатам [46]. Это побудило нас исследовать дополнительные потенциальные внецелевые эффекты DCA для объяснения его эффективности в поражении опухолевых клеток.
Раковые стволовые клетки (РСК) представляют собой часть всей опухолевой массы и несут ответственность за рефрактерность к терапии рака, распространение метастазов и рецидив опухоли [47], тем самым вызывая растущий интерес как мишени для разработки новых противораковых методов лечения [48]. Насколько нам известно, нет данных о влиянии DCA на стволовые клетки рака поджелудочной железы. Чтобы изучить этот интригующий аспект, мы сначала оценили влияние DCA на экспрессию Lin 28, выявив значительное дозозависимое снижение экспрессии в обеих клеточных линиях. Следует отметить, что экспрессия Lin28 строго связана с метаболизмом, поскольку он способен регулировать прогрессию раковых клеток через PDK1 и вызывать энергетический переключатель [49]. Lin28 участвует в формировании КСК [50], а его аберрантная экспрессия связана со многими неопластическими заболеваниями человека, включая рак поджелудочной железы [51,52]. FACS-анализ экспрессии поверхностных антигенов CD44, CD24 и EPCAM, обычно характерных для панкреатических КСК [53], показал, что лечение DCA снизило процент тройной положительной фракции в PANC-1. В отличие от этого, мы не обнаружили никаких изменений, вызванных DCA, в BXPC-3, которые в основном состояли из трипл-позитивных клеток. Следует учитывать, что хотя более 90% BXPC-3 были положительными в отношении маркеров стволовых клеток, уровень их экспрессии был относительно низким. Напротив, PANC-1 экспрессировал более высокие уровни маркеров стволовости, хотя только менее чем в 30% клеточной популяции, что указывает на более молодой фенотип КСК, характеризующий это подмножество клеток. С этим наблюдением согласуется представление о том, что не абсолютная экспрессия маркеров CSC, а их соотношение «квалифицирует» склонность раковых клеток к стволовости [28]. Учитывая, что соотношение экспрессии CD44/CD24 в PANC-1 намного выше, чем в BXPC-3, это указывает на то, что, несмотря на меньшую заселенность, компартмент CSC в PANC-1 качественно более похож на стволовые клетки. И наоборот, низкий уровень экспрессии маркеров CSC, широко распространенных в популяции клеток BXPC-3, фенотипирует их как ранние прогениторы. Это различие в двух клеточных линиях рака поджелудочной железы может объяснить их различные метаболические фенотипы и чувствительность к химиотерапевтическим препаратам, а также к DCA.
Технология трехмерных (3D) клеточных культур стала основным направлением исследований в области биологии опухолевых клеток. По сравнению с 2D, 3D культуры клеточных линий обогащены КСК [30,54] и, имитируя метаболические и пролиферативные градиенты опухолей in vivo, обеспечивают более надежный прогноз ответа на возможное лечение [55,56]. С этой точки зрения, мы проверили эффективность DCA на 3D культурах, полученных из PANC-1 и BXPC-3, и показали, что лечение DCA нарушило структуру и жизнеспособность уже сформированных сфероидов и нарушило формирование сфероидов из обеих клеточных линий. В частности, при более высокой дозе DCA почти полностью подавлял образование сфероидов из PANC-1. В соответствии с нашими наблюдениями в двумерных культурах, сфероиды BXPC-3 были менее чувствительны к воздействию DCA, чем сфероиды PANC-1. Аналогичным образом, в 2D-культурах в сфероидах обеих клеточных линий также наблюдалось значительное снижение экспрессии Lin28. Хотя описанные выше изменения в уровне экспрессии широко признанных маркеров КСК в 2D и 3D культурах не являются убедительным доказательством влияния DCA на стволовой компартмент PDAC, тем не менее, они дают до сих пор неоцененные подсказки, заслуживающие дальнейшего изучения. На уровне in vivo лечение DCA вызвало замедление, хотя и не значительное, роста рака у мышей, несущих опухоль BxPC-3-luc, по сравнению с контрольными мышами, что оценивалось по снижению количества фотонов и уменьшению объема опухоли.
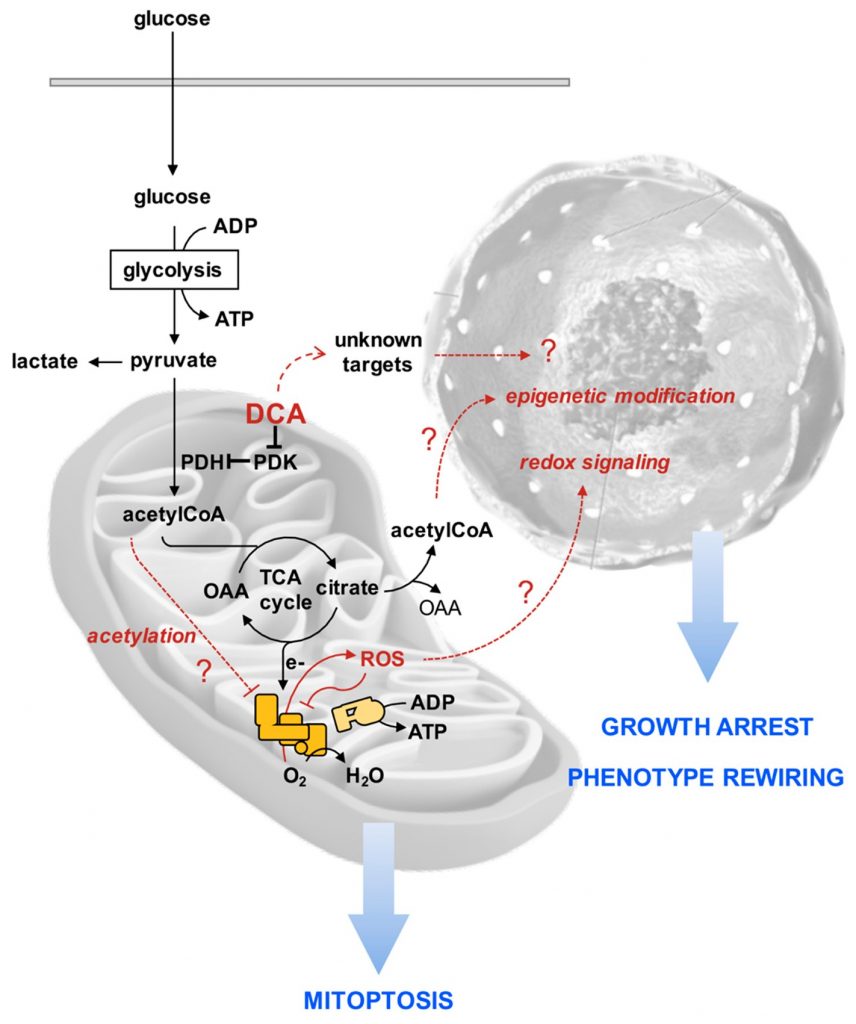
Чтобы объяснить загадочное воздействие DCA на клеточные линии PDAC, о котором сообщалось в нашем исследовании, мы предложили следующую гипотетическую последовательность событий, призванную стимулировать дальнейшие исследования (рис. 10). Мы предполагаем, что в результате усиленного окисления пирувата больше восстановительных эквивалентов передается в митохондриальную дыхательную цепь с генерацией ROS. Дыхательные комплексы являются как производителями, так и мишенями ROS [57], таким образом, создавая порочный круг, ведущий к прогрессирующему ингибированию функционального переноса электронов по всей дыхательной цепи, способствуя дальнейшему ROS-генному отводу электронов на O2. Кроме того, затухание дыхательной активности может привести к накоплению промежуточных продуктов цикла трикарбоновых кислот, а также ацетил-КоА. Когда последний накапливается, он, как известно, вызывает лизин-ацетилирование и ингибирование функции ряда митохондриальных белков, включая комплексы дыхательной цепи [58,59]. Прогрессирующему повреждению/дисфункции митохондрий противодействует регуляция митофагии. Как и вызывают ли эти опосредованные DCA митохондриальные изменения остановку роста и перестройку клеточного фенотипа, в частности, отсека стволовых клеток рака, еще предстоит выяснить. Однако ряд данных свидетельствует о том, что прооксидантное состояние приводит к выходу стволовых клеток из их недифференцированного состояния и индуцирует/благоприятствует приверженности [60,61]. Более того, эпигенетические модификации, например, вызывающие ремоделирование хроматина, регулируют баланс между плюрипотентностью и дифференцировкой стволовых клеток [62,63]. Возможно, остановка цикла ТСА может вызвать отток цитрата в цитозоль, где он высвобождает ацетил-КоА, тем самым повышая его доступность для ацетилирования гистонов. Очевидно, что другие нехарактеризованные мишени DCA могут вносить свой вклад или даже доминировать в наблюдаемых эффектах препарата.
В заключение, наши результаты ясно показывают, что эффективность DCA в подавлении роста раковых клеток не всегда причинно связана с его документированным стимулирующим действием на активность PDH и, следовательно, обратным эффектом Варбурга. В зависимости от фенотипа клеток необходимо механистически рассматривать и другие внеклеточные мишени. В этом контексте доказательство, полученное в данном исследовании, о том, что компартмент КСК в клеточных линиях, полученных из PDAC, может быть затронут лечением DCA, является актуальным. Было бы целесообразно проверить, происходит ли это в других типах раковых клеток, и в нашей лаборатории ведется работа в этом направлении. Последние исследовательские проекты по разработке поверхностно-функционализированных наночастиц, нагруженных дихлорацетатом [64], и многофункциональных препаратов, полученных на основе химиотерапевтических агентов с DCA в качестве лиганда [65], могут помочь в разработке правильной целевой фармакологической формулы для создания новых эффективных терапевтических стратегий для борьбы с раком поджелудочной железы, а также с другими типами рака.
Дополнительные материалы
Следующие материалы доступны онлайн на сайте https://www.mdpi.com/2073-4409/8/5/478/s1: Рисунок S1: Влияние DCA на пролиферацию клеток, оцененную методом XCELLigence в среде с низким содержанием глюкозы; Рисунок S2: Заживление царапин; Рисунок S3: Влияние DCA на выработку лактата; Рисунок S4: Влияние 24-часовой обработки DCA на метаболические потоки; Рисунок S5: Сравнительное влияние DCA на метаболические потоки в клеточных линиях PDAC в условиях культивирования с низким содержанием глюкозы (LG) и высоким содержанием глюкозы (HG); Рисунок S6: Экспрессия белков факторов, участвующих в делении-слиянии митохондрий (OPA1, MFN1/2); Рисунок S7: Оценка стволовости в клеточных линиях PDAC.
Авторские взносы
T.T. планирование, исследование и написание статьи; F.A., C.P. (Consiglia Pacelli) и C.M. исследование; V.R. и I.L. курирование данных; G.D.S. визуализация; C.P. (Concetta Panebianco) и V.P. животная модель; N.C. обзор и редактирование, и C.P. (Claudia Piccoli) концептуализация, контроль.
Финансирование
Это исследование финансировалось текущими исследовательскими фондами Министерства здравоохранения Италии для IRCCS CROB и грантами Министерства здравоохранения Италии через Отдел гастроэнтерологии (RC1703GA31 и RC1803GA30) больницы IRCCS «Casa Sollievo della Sofferenza».
Конфликты интересов
Авторы заявляют об отсутствии конфликта интересов.
ССЫЛКИ
1 Ying, H.; Dey, P.; Yao, W.; Kimmelman, A.C.; Draetta, G.F.; Maitra, A.; DePinho, R.A. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2016, 30, 355-385. [CrossRef]2 Hidalgo, M. Pancreatic cancer. N. Engl. J. Med. 2010, 362, 1605-1617. [CrossRef] [PubMed]
3 Camelo, F.; Le, A. The Intricate Metabolism of Pancreatic Cancers. Adv. Exp. Med. Biol. 2018, 1063, 73-81. [PubMed]
4 Adamska, A.; Domenichini, A.; Falasca, M. Pancreatic Ductal Adenocarcinoma: Current and Evolving Therapies. Int. J. Mol. Sci. 2017, 18, E1338. [CrossRef] [PubMed]
5 Gentric, G.; Mieulet, V.; Mechta-Grigoriou, F. Heterogeneity in Cancer Metabolism: Новые концепции в старой области. Antioxid. Redox Signal. 2017, 26, 462-485. [CrossRef]
6 Tataranni, T.; Agriesti, F.; Ruggieri, V.; Mazzoccoli, C.; Simeon, V.; Laurenzana, I.; Scrima, R.; Pazienza, V.; Capitanio, N.; Piccoli, C. Rewiring carbohydrate catabolism differentially affect survival of pancreatic cancer cell lines with diverse metabolic profiles. Oncotarget 2017, 8, 41265-41281. [CrossRef]
7 Ruggieri, V.; Agriesti, F.; Scrima, R.; Laurenzana, I.; Perrone, D.; Tataranni, T.; Mazzoccoli, C.; Lo Muzio, L.; Capitanio, N.; Piccoli, C. Dichloroacetate, a selective mitochondria-targeting drug for oral squamous cell carcinoma: A metabolic perspective of treatment. Oncotarget 2015, 6, 1217-1230. [CrossRef]
8 Anderson, K.M.; Jajeh, J.; Guinan, P.; Rubenstein, M. In vitro эффекты дихлорацетата и CO2 на гипоксические клетки HeLa. Anticancer Res. 2009, 29, 4579-4588.
9 Chen, Y.; Cairns, R.; Papandreou, I.; Koong, A.; Denko, N.C. Потребление кислорода может регулировать рост опухолей, новый взгляд на эффект Варбурга. PLoS ONE 2009, 4, e7033. [CrossRef]
10 Lu, X.; Zhou, D.; Hou, B.; Liu, Q.X.; Chen, Q.; Deng, X.F.; Yu, Z.B.; Dai, J.G.; Zheng, H. Dichloroacetate enhances the antitumor efficacy of chemotherapeutic agents through inhibiting autophagy in non-small-cell lung cancer. Cancer Manag. Res. 2018, 10, 1231-1241. [CrossRef]
11 Yang, C.; Wu, T.; Qin, Y.; Qi, Y.; Sun, Y.; Kong, M.; Jiang, X.; Qin, X.; Shen, Y.; Zhang, Z. A facile doxorubicin-dichloroacetate conjugate nanomedicine with high drug loading for safe drug delivery. Int. J. Nanomed. 2018, 13, 1281-1293. [CrossRef]
12 Rajeshkumar, N.V.; Yabuuchi, S.; Pai, S.G.; De Oliveira, E.; Kamphorst, J.J.; Rabinowitz, J.D.; Tejero, H.; Al-Shahrour, F.; Hidalgo, M.; Maitra, A.; et al. Treatment of Pancreatic Cancer Patient-Derived Xenograft Panel with Metabolic Inhibitors Reveals Efficacy of Phenformin. Clin. Cancer Res. 2017, 23, 5639-5647. [CrossRef]
13 Khan, A.; Marier, D.; Marsden, E.; Andrews, D.; Eliaz, I. A novel form of dichloroacetate therapy for patients with advanced cancer: Отчет о 3 случаях. Altern. Ther. Health Med. 2014, 20 (Suppl. 2), 21-28.
14 Hanberry, B.S.; Berger, R.; Zastre, J.A. Высокая доза витамина B1 снижает пролиферацию в линиях раковых клеток аналогично дихлорацетату. Cancer Chemother. Pharm. 2014, 73, 585-594. [CrossRef]
15 Lowe, A.W.; Olsen, M.; Hao, Y.; Lee, S.P.; Taek Lee, K.; Chen, X.; van de Rijn, M.; Brown, P.O. Gene expression patterns in pancreatic tumors, cells and tissues. PLoS ONE 2007, 2, e323. [CrossRef]
16 Deer, E.L.; González-Hernández, J.; Coursen, J.D.; Shea, J.E.; Ngatia, J.; Scaife, C.L.; Firpo, M.A.; Mulvihill, S.J. Phenotype and genotype of pancreatic cancer cell lines. Pancreas 2010, 39, 425-435. [CrossRef]
17 Daemen, A.; Peterson, D.; Sahu, N.; McCord, R.; Du, X.; Liu, B.; Kowanetz, K.; Hong, R.; Moffat, J.; Gao, M.; et al. Metabolite profiling stratifies pancreatic ductal adenocarcinomas into subtypes with distinct sensitivities to metabolic inhibitors. Proc. Natl. Acad. Sci. USA 2015, 112, E4410-E4417. [CrossRef]
18 Mazzoccoli, C.; Ruggieri, V.; Tataranni, T.; Agriesti, F.; Laurenzana, I.; Fratello, A.; Capitanio, N.; Piccoli, C. N-acetylaspartate (NAA) induces neuronal differentiation of SH-SY5Y neuroblastoma cell line and sensitizes it to chemotherapeutic agents. Oncotarget 2016, 7, 26235-26246. [CrossRef]
19 Scrima, R.; Menga, M.; Pacelli, C.; Agriesti, F.; Cela, O.; Piccoli, C.; Cotoia, A.; De Gregorio, A.; Gefter, J.V.; Cinnella, G.; et al. Para-hydroxyphenylpyruvate inhibits the pro-inflammatory stimulation of macrophage preventing LPS-mediated nitro-oxidative unbalance and immunometabolic shift. PLoS ONE 2017, 12, e0188683. [CrossRef]
20 Fredebohm, J.; Boettcher, M.; Eisen, C.; Gaida, M.M.; Heller, A.; Keleg, S.; Tost, J.; Greulich-Bode, K.M.; Hotz-Wagenblatt, A.; Lathrop, M.; et al. Establishment and characterization of a highly tumourigenic and cancer stem cell enriched pancreatic cancer cell line as a well defined model system. PLoS ONE 2012, 7, e48503. [CrossRef]
21 Fryer, R.A.; Barlett, B.; Galustian, C.; Dalgleish, A.G. Mechanisms underlying gemcitabine resistance in pancreatic cancer and sensitisation by the iMiD™ lenalidomide. Anticancer Res. 2011, 31, 3747-3756.
22 Yin, T.; Wei, H.; Gou, S.; Shi, P.; Yang, Z.; Zhao, G.; Wang, C. Cancer stem-like cells enriched in Panc-1 spheres possess increased migration ability and resistance to gemcitabine. Int. J. Mol. Sci. 2011, 12, 1595-
23 Jun-Hao, E.T.; Gupta, R.R.; Shyh-Chang, N. Lin28 and let-7 in the Metabolic Physiology of Aging. Trends Endocrinol. Metab. 2016, 27, 132-141. [CrossRef] [PubMed]
24 Zhang, J.; Ratanasirintrawoot, S.; Chandrasekaran, S.; Wu, Z.; Ficarro, S.B.; Yu, C.; Ross, C.A.; Cacchiarelli, D.; Xia, Q.; Seligson, M.; et al. LIN28 Regulates Stem Cell Metabolism and Conversion to Primed Pluripotency. Cell Stem Cell 2016, 19, 66-80. [CrossRef] [PubMed]
25 Wang, X.; Weng, M.; Jin, Y.; Yang, W.; Wu, D.; Wang, T.; Li, X. Beyond an oncogene, Lin28 is a master regulator of cancer progression. Histol. Histopathol. 2018, 33, 327-334. [PubMed]
26 Li, C.; Heidt, D.G.; Dalerba, P.; Burant, C.F.; Zhang, L.; Adsay, V.; Wicha, M.; Clarke, M.F.; Simeone, D.M. Identification of pancreatic cancer stem cells. Cancer Res. 2007, 67, 1030-1037. [CrossRef]
27 Ohara, Y.; Oda, T.; Sugano, M.; Hashimoto, S.; Enomoto, T.; Yamada, K.; Akashi, Y.; Miyamoto, R.; Kobayashi, A.; Fukunaga, K.; et al. Histological and prognostic importance of CD44(+)/CD24(+)/EpCAM(+) expression in clinical pancreatic cancer. Cancer Sci. 2013, 104, 1127-1134. [CrossRef]
28 Li, W.; Ma, H.; Zhang, J.; Zhu, L.; Wang, C.; Yang, Y. Author Correction: Unraveling the roles of CD44/CD24 and ALDH1 as cancer stem cell markers in tumorigenesis and metastasis. Sci. Rep. 2018, 8, 4276. [CrossRef] [PubMed]
29 Melissaridou, S.; Wiechec, E.; Magan, M.; Jain, M.V.; Chung, M.K.; Farnebo, L.; Roberg, K. The effect of 2D and 3D cell cultures on treatment response, EMT profile and stem cell features in head and neck cancer. Cancer Cell Int. 2019, 19, 16. [CrossRef] [PubMed]
30 Ishiguro, T.; Ohata, H.; Sato, A.; Yamawaki, K.; Enomoto, T.; Okamoto, K. Tumor-derived spheroids: Значение для стволовых клеток рака и клинического применения. Cancer Sci. 2017, 108, 283-289. [CrossRef]
31 Luo, J.; Solimini, N.L.; Elledge, S.J. Principles of cancer therapy: Онкогенная и неонкогенная зависимость. Cell 2009, 136, 823-837. [CrossRef]
32 Vivanco, I. Targeting molecular addictions in cancer. Br. J. Cancer 2014, 111, 2033-2038. [CrossRef]
33 Belizário, J.E.; Sangiuliano, B.A.; Perez-Sosa, M.; Neyra, J.M.; Moreira, D.F. Using Pharmacogenomic Databases for Discovering Patient-Target Genes and Small Molecule Candidates to Cancer Therapy. Фронт. Pharmacol. 2016, 7, 312. [CrossRef]
34 Grasso, C.; Jansen, G.; Giovannetti, E. Drug resistance in pancreatic cancer: Impact of altered energy metabolism. Crit. Rev. Oncol. Hematol. 2017, 114, 139-152. [CrossRef]
35 Huanwen, W.; Zhiyong, L.; Xiaohua, S.; Xinyu, R.; Kai, W.; Tonghua, L. Intrinsic chemoresistance to gemcitabine is associated with constitutive and laminin-induced phosphorylation of FAK in pancreatic cancer cell lines. Mol. Cancer 2009, 8, 125. [CrossRef]
36 Федорчук А.Г., Пясковская О.Н., Горбик Г.В., Прохорова И.В., Колесник Д.Л., Соляник Г.И. Эффективность дихлорацетата натрия против глиомы С6 зависит от графика введения и дозы. Эксп. Oncol. 2016, 38, 80-83. [CrossRef]
37 Ma, W.; Zhao, X.; Wang, K.; Liu, J.; Huang, G. Dichloroacetic acid (DCA) synergizes with the SIRT2 inhibitor Sirtinol and AGK2 to enhance anti-tumor efficacy in non-small cell lung cancer. Cancer Biol. Ther. 2018, 19, 835-846. [CrossRef]
38 Michelakis, E.D.; Sutendra, G.; Dromparis, P.; Webster, L.; Haromy, A.; Niven, E.; Maguire, C.; Gammer, T.L.; Mackey, J.R.; Fulton, D.; et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci. Transl. Med. 2010, 2, 31ra34. [CrossRef]
39 Papandreou, I.; Goliasova, T.; Denko, N.C. Anticancer drugs that target metabolism: Is dichloroacetate the new paradigm? Int. J. Cancer 2011, 128, 1001-1008. [CrossRef]
40 Yan, C.; Li, T.S. Dual Role of Mitophagy in Cancer Drug Resistance. Anticancer Res. 2018, 38, 617-621.
41 Praharaj, P.P.; Naik, P.P.; Panigrahi, D.P.; Bhol, C.S.; Mahapatra, K.K.; Patra, S.; Sethi, G.; Bhutia, S.K. Intricate role of mitochondrial lipid in mitophagy and mitochondrial apoptosis: Its implication in cancer therapeutics. Cell Mol. Life Sci. 2018. [CrossRef]
42 Dubuis, S.; Ortmayr, K.; Zampieri, M. A framework for large-scale metabolome drug profiling links coenzyme A metabolism to the toxicity of anti-cancer drug dichloroacetate. Commun. Biol. 2018, 1, 101. [CrossRef]
43 Li, X.; Liu, J.; Hu, H.; Lu, S.; Lu, Q.; Quan, N.; Rousselle, T.; Patel, M.S.; Li, J. Dichloroacetate Ameliorates Cardiac Dysfunction Caused by Ischemic Insults Through AMPK Signal Pathway-Not Only Shifts Metabolism. Toxicol. Sci. 2019, 167, 604-617. [CrossRef]
44 El Sayed, S.M.; Baghdadi, H.; Ahmed, N.S.; Almaramhy, H.H.; Mahmoud, A.A.; El-Sawy, S.A.; Ayat, M.; Elshazley, M.; Abdel-Aziz, W.; Abdel-Latif, H.M.; et al. Dichloroacetate is an antimetabolite that antagonizes acetate and deprives cancer cells from its benefits: Новая медицинская гипотеза, основанная на доказательствах. Med. Hypotheses 2019, 122, 206-209. [CrossRef] [PubMed]
45 Guo, X.; Dixit, V.; Liu, H.; Shroads, A.L.; Henderson, G.N.; James, M.O.; Stacpoole, P.W. Inhibition and recovery of rat hepatic glutathione S-transferase zeta and alteration of tyrosine metabolism following dichloroacetate exposure and withdrawal. Drug Metab. Dispos. 2006, 34, 36-42. [CrossRef]
46 Zhang, W.; Hu, X.; Zhou, W.; Tam, K.Y. Liquid Chromatography-Tandem Mass Spectrometry Method Revealed that Lung Cancer Cells Exhibited Distinct Metabolite Profiles upon the Treatment with Different Pyruvate Dehydrogenase Kinase Inhibitors. J. Proteome Res. 2018, 17, 3012-3021. [CrossRef]
47 Prasetyanti, P.R.; Medema, J.P. Intra-tumor heterogeneity from a cancer stem cell perspective. Mol. Cancer 2017, 16, 41. [CrossRef] [PubMed]
48 Chen, L.S.; Wang, A.X.; Dong, B.; Pu, K.F.; Yuan, L.H.; Zhu, Y.M. Новая перспектива в терапии рака: Нацеливание на раковые стволовые клетки для искоренения рака. Chin. J. Cancer 2012, 31, 564-572. [CrossRef]
49 Ma, X.; Li, C.; Sun, L.; Huang, D.; Li, T.; He, X.; Wu, G.; Yang, Z.; Zhong, X.; Song, L.; et al. Lin28/let-7 axis regulates aerobic glycolysis and cancer progression via PDK1. Nat. Commun. 2014, 5, 5212. [CrossRef]
50 Zhou, J.; Ng, S.B.; Chng, W.J. LIN28/LIN28B: новый онкогенный драйвер в стволовых клетках рака. Int. J. Biochem. Cell Biol. 2013, 45, 973-978. [CrossRef] [PubMed]
51 Wang, Y.; Li, J.; Guo, S.; Ouyang, Y.; Yin, L.; Liu, S.; Zhao, Z.; Yang, J.; Huang, W.; Qin, H.; et al. Lin28B facilitates the progression and metastasis of pancreatic ductal adenocarcinoma. Oncotarget 2017, 8, 60414-60428. [CrossRef] [PubMed]
52 Balzeau, J.; Menezes, M.R.; Cao, S.; Hagan, J.P. The LIN28/let-7 Pathway in Cancer. Front. Genet. 2017, 8, 31. [CrossRef] [PubMed]
53 Ishiwata, T.; Matsuda, Y.; Yoshimura, H.; Sasaki, N.; Ishiwata, S.; Ishikawa, N.; Takubo, K.; Arai, T.; Aida, J. Pancreatic cancer stem cells: Особенности и методы обнаружения. Патол. Oncol. Res. 2018, 24, 797-805. [CrossRef]
54 Ravi, M.; Ramesh, A.; Pattabhi, A. Contributions of 3D Cell Cultures for Cancer Research. J. Cell Physiol. 2017, 232, 2679-2697. [CrossRef]
55 Friedrich, J.; Seidel, C.; Ebner, R.; Kunz-Schughart, L.A. Spheroid-based drug screen: Соображения и практический подход. Nat. Protoc. 2009, 4, 309-324. [CrossRef]
56 Gutierrez-Barrera, A.M.; Menter, D.G.; Abruzzese, J.L.; Reddy, S.A. Создание трехмерных культур эпителиальных клеток протока поджелудочной железы человека. Биохим. Biophys. Res. Commun. 2007, 358, 698-703. [CrossRef]
57 Dröse, S.; Brandt, U.; Wittig, I. Mitochondrial respiratory chain complexes as sources and targets of thiol-based redox-regulation. Biochim. Biophys. Acta 2014, 1844, 1344-1354. [CrossRef]
58 Carrico, C.; Meyer, J.G.; He, W.; Gibson, B.W.; Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metab. 2018, 27, 497-512. [CrossRef]
59Cela, O.; Scrima, R.; Pazienza, V.; Merla, G.; Benegiamo, G.; Augello, B.; Fugetto, S.; Menga, M.; Rubino, R.; Fuhr, L.; et al. Clock genes-dependent acetylation of complex I sets rhythmic activity of mitochondrial OxPhos. Biochim. Biophys. Acta 2016, 1863, 596-606. [CrossRef]
60 Chaudhari, P.; Ye, Z.; Jang, Y.Y. Roles of reactive oxygen species in the fate of stem cells. Antioxid. Redox Signal. 2014, 20, 1881-1890. [CrossRef]
61 Ding, S.; Li, C.; Cheng, N.; Cui, X.; Xu, X.; Zhou, G. Redox Regulation in Cancer Stem Cells. Oxid. Med. Cell. Longev. 2015. [CrossRef] [PubMed]
62 Trisciuoglio, D.; Di Martile, M.; Del Bufalo, D. Emerging Role of Histone Acetyltransferase in Stem Cells and Cancer. Stem Cells Int. 2018, 2018, 8908751. [CrossRef]
63 Yadav, T.; Quivy, J.P.; Almouzni, G. Chromatin plasticity: A versatile landscape that underlies cell fate and identity. Science 2018, 361, 1332-1336. [CrossRef]
64 Abánades Lázaro, I.; Haddad, S.; Rodrigo-Muñoz, J.M.; Orellana-Tavra, C.; Del Pozo, V.; Fairen-Jimenez, D.; Forgan, R.S. Mechanistic Investigation into the Selective Anticancer Cytotoxicity and Immune System Response of Surface-Functionalized, Dichloroacetate-Loaded, UiO-66 Nanoparticles. ACS Appl. Mater Interfaces 2018, 10, 5255-5268. [CrossRef] [PubMed]
65 Petruzzella, E.; Sirota, R.; Solazzo, I.; Gandin, V.; Gibson, D. Triple action Pt(iv) derivatives of cisplatin: A new class of potent anticancer agents that overcome resistance. Chem. Sci. 2018, 9, 4299-4307. [CrossRef]
Связанный контент: