Зайда Торрес-Кавазос1, Мойсес Армидес Франко-Молина2, Сильвия Елена Сантана-Крымская2, Кристина Родригес-Падилья2, Хорхе Рамзи Кавас-Гарза1, Густаво Эрнандес-Видаль1, Густаво Морено-Деголладо1, и Диана Элиза Самора-Авила1
1 Posgrado Conjunto de las Facultades de Agronomía y Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexico
2 Laboratorio de Inmunología y Virología, Unidad C, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León,
Ave. Universidad S/N, Cd. Universitaria, San Nicolás de los Garza, N. L., CP 66455, Mexico
Переписка: Moisés Armides Franco-Molina; [email protected]
Received: 13 июля 2020
Пересмотрено: 28 сентября 2020
Принято: 14 октября 2020 г.
Опубликовано: 7 ноября 2020 г
Аннотация
Нашей основной целью было оценить эффективность серебра и дихлорацетата натрия в качестве двухфункциональных агентов для использования в лечении меланомы. Данная стратегия направлена на повышение активности этих двух соединений, которые влияют на целостность ДНК и митохондрии на разных уровнях. Кроме того, мы оценили, является ли механизм гибели клеток, индуцированный нашими препаратами, иммуногенной гибелью клеток. Для оценки противоопухолевой эффективности мы оценивали объем опухоли и продукцию фактора некроза опухоли-α, ядерного фактора κ B (оба методом ELISA), а также уровень оксида азота (набор для колориметрического анализа на нитрат/нитрит); для оценки иммуногенной гибели клеток мы оценивали высвобождение молекулярных паттернов, ассоциированных с опасностью, с помощью иммуногистохимии и проточной цитометрии, а также с помощью теста in vivo. Наши результаты показали, что комбинация коллоидного серебра и дихлорацетата натрия более эффективна, чем каждое средство в отдельности, и что противоопухолевый механизм не связан с иммуногенной гибелью клеток. Кроме того, данное исследование может внести широкий вклад в разработку наночастиц серебра, нагруженных дихлорацетатом, и в разработку целевых фармакологических препаратов для борьбы с меланомой, а также другими видами рака.
Научный редактор: Янис Толеданьо Маганья
Copyright © 2020 Zaida Torres-Cavazos et al. Это статья открытого доступа, распространяемая на условиях лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение в любых средствах массовой информации при условии надлежащего цитирования оригинальной работы.
ВВЕДЕНИЕ
Таргетная терапия повысила шансы на выживание людей с меланомой [1]; однако раковые клетки, присутствующие в опухоли, предпочитают различные метаболические пути [2]; как следствие, опухоль в конечном итоге становится устойчивой к таргетной терапии, особенно к той, которая направлена против одной мишени [3].
Разработка терапии на основе серебра является многообещающим инструментом в лечении рака. Ионы серебра и серебряные наночастицы вызывают окислительный стресс, дисфункцию митохондриальных мембран, повреждение ДНК и регуляцию цитокинов [4]. Точный механизм действия зависит от физических и химических свойств наночастицы и типа рака [5]. Кроме того, клиническое применение коллоидного серебра в бактерицидных и противовирусных целях доказывает безопасность этого метода лечения [6],
7].
Дихлорацетат натрия (ДХА) — аналог пирувата, который вмешивается в гликолиз опухоли (эффект Варбурга), уменьшает злокачественность рака и снижает выработку лактата, изменяя метаболические пути раковых клеток [8]. Снижение уровня лактата противодействует кислотному состоянию опухолевой микросреды, уменьшая рост и метастазирование опухоли [8]. WZB117, бис-гидроксибензоат, 2-дезокси-d-глюкоза, метформин и DCA снижают гликолиз и блокируют поглощение глюкозы в раковых клетках. При низком внутриклеточном уровне глюкозы биосинтетические пути, такие как генезис нуклеотидов и аминокислот, прерываются из-за нехватки промежуточных молекул, что ставит крест на пролиферации клеток. Несмотря на его использование в качестве монотерапии или в сочетании с химиотерапией, сообщалось о небольшом количестве или полном отсутствии побочных эффектов [9].
В связи с этими действиями мы рассмотрели иммуногенную гибель клеток как возможный механизм действия, так как все больше исследований показывают, что клеточные и митохондриальные молекулярные паттерны, связанные с опасностью (DAMPs), могут активно высвобождаться при воздействии внешних стимулов [10]. Высвобождение аларминов (Hsp70, HSP90, кальретикулин, HMGB1, АТФ, ДНК и РНК) и опухолевых неоантигенов вызывает опухоль-специфический иммунный ответ, который уничтожает живые раковые клетки и остатки опухолевой ткани, предотвращая рецидив рака [11].
Основной целью данного исследования было использование серебра и DCA в качестве двухфункциональных агентов, влияющих на целостность ДНК и активность митохондрий, для усиления противоопухолевого ответа при лечении меланомы. Кроме того, данное исследование может послужить отправной точкой для следующего этапа разработки целевой фармакологической рецептуры наночастиц серебра, нагруженных дихлорацетатом.
Материалы и методы
Реактивы
Раствор пенициллина-стрептомицина, раствор фиколла-гипака, раствор трипсина-ЭДТА, среда RPMI-1640, модифицированная среда Дульбекко для орлов (DMEM/F-12) и 1% раствор антибиотиков-антимикотиков были получены от Life Technologies GIBCO, Grand Island, NY, США. Фетальная бычья сыворотка (FBS) была приобретена у Sigma-Aldrich (Сент-Луис, МО).
Культура клеток
Клеточная линия мышиной меланомы B16F10 была приобретена у American Type Culture Collection (ATCC, Manassas, VA, USA). Клетки выращивали и поддерживали в среде Dulbecco’s Modified Eagle’s Medium, дополненной 10% фетальной бычьей сывороткой (FBS) и 1% раствором пенициллина-стрептомицина при 37°C и 5%CO2 атмосфере.
Жизнеспособность клеток
эмбрионов (5 ×103 клеток/лунку) высевали на 96 плоскодонных луночных планшетов и инкубировали в течение 24 ч при 37°C в атмосфере 5%CO2. После инкубации культуральную среду удаляли и добавляли Ag (0,8 мМ — 6:5 × 10-5мМ) или DCA (75 мМ/мл — 750 мМ/мл), разведенные в той же среде. Затем пластины инкубировали в течение 4 часов при 37°C и 5%CO2 атмосфере. После этого супернатант удаляли, а клетки дважды промывали средой DMEM/F-12. Жизнеспособность клеток определяли методом ресазурина (Alamar Blue), а цитотоксичность выражали как концентрацию 50% ингибирования роста клеток (LD50). Результаты представлены как среднее ± стандартное отклонение (SD) трех независимых экспериментов. В дальнейших экспериментах использовали LD50 каждого вида лечения.
Определение гибели клеток
Для определения гибели клеток мы следовали методике, описанной Родригесом-Салазаром и др. [12]. Вкратце, клетки B16F10 (1 ×105) были посеяны в 12-луночные планшеты и культивировались в течение ночи в 5%CO2 при 37°C. Клетки обрабатывали AgC (LD50) или DCA (LD50) или комбинацией AgC (LD25) + DCA (LD25) в течение 5 часов. После обработки клетки собирали, промывали фосфатно-буферным солевым раствором (PBS) и ресуспендировали в 100мкл 1× буфера для связывания (0,1 М Hepes pH 7,4, 1,4 М NaCl и 25 мМ CaCl2; Sigma-Aldrich; Merck KGaA, Дармштадт, Германия), дополненного APC-конъюгированным Annexin V (5мкл/образец) и йодистым пропидием (1мкл/образец), инкубировали при 4°C и выдерживали в темноте в течение 15 мин. Анализ методом проточной цитометрии проводили на цитометре Accuri C6; для анализа данных использовали программное обеспечение BD Accuri C6 Software версии 1.0.264.21 (обе компании BD Biosciences, Сан-Хосе, Калифорния, США).
Животные
Самки мышей C57BL/6 в возрасте 6 и 10 недель с массой тела около 23 (±2) г были приобретены в Harlan Laboratories (Мехико, Мексика). Мышей содержали при температуре 25-29°C и 12-часовом световом и 12-часовом темном цикле. Пища и вода предоставлялись ad libitum. Протокол эксперимента был одобрен Комитетом по этическому рассмотрению экспериментов на животных факультета биологических наук Автономного университета Нуэво-Леон (Сан-Николас-де-лос-Гарса, Мексика).
Имплантация опухолей и лечение
Опухоли индуцировали подкожно, вводя 1 x106 клеток B16F10 в 200 мклфосфатно-буферного солевого раствора (PBS). Через семь дней после трансплантации клеток B16F10 появилась заметная опухолевая масса, и мышей случайным образом распределили на четыре группы (по пять мышей на группу). Контрольная группа получала только физиологический раствор. Группа DCA получала 50 мг/кг DCA, а группа Ag — 28 мг/кг Ag. Физраствор, Ag и DCA вводились в опухоль перитуморально, ежедневно, в течение 21 дня. Наконец, группа Ag + DCA получала те же дозы Ag и DCA противоопухолевым путем каждые два дня, чередуя лечение. Длина и ширина опухоли измерялись еженедельно, а объем опухоли определялся по уравнению: L x W2, где L — самая длинная сторона, а W — самая короткая сторона. Животных умерщвляли в конечной точке исследования (21 день), а опухоли вырезали для дальнейших экспериментов.
ELISA для активной субъединицы NF-κBp65
Для измерения активации субъединицы NF-κBp65 из 3 x106 опухолевых клеток готовили ядерные экстракты, используя набор Nuclear Extract Kit в соответствии с протоколом производителя. Уровни концентрации ядерного p65 определяли с помощью чувствительного анализа ELISA (TRANS-AM, Active Motif, Rixensart, Бельгия).
Продукция TNF-α и NO
Опухоли мацерировали в RPMI, супернатант собирали, доводили до концентрации белка по БСА и хранили при -20°C для оценки. TNF-α измеряли в супернатанте опухоли с помощью иммуноферментного анализа (TNF alpha Mouse ELISA Kit; Invitrogen; Thermo Fisher Scientific; Viena, Austria). Все процедуры анализа проводились в соответствии с протоколом производителя.
Для измерения уровня NO в гомогенатах тканей опухоли использовался набор для определения нитрата/нитрита в соответствии с протоколом, установленным производителем (Nitrate/Nitrite colorimetric assay kit; Cayman Chemical, США).
Иммуноцитохимия для определения HMGB1, HSP70 и HSP90
Клетки (100 x103 клеток/лунку) высевали на стеклянные покровные стекла при 37°C и 5%CO2
течение 24 часов. После этого клетки обрабатывали Ag LD50 (2,8 x 10-5 мМ), DCA LD50 (195 мМ) или Ag + DCA LD50 (2,8 x 10-5мМ и 135 мМ, соответственно) при 37°C и 5%CO2 в течение 4 часов. Затем клетки фиксировали метанолом, блокировали нормальной лошадиной сывороткой (2,5%) (Vector Laboratories, ABC Kit) в течение 20 минут и инкубировали в течение 4 часов с мышиными моноклональными антителами против HMGB1 (sc-56698), HSP70 (sc-24) или HSP90 (sc-7947), используемыми в разведении 1 :1000. Затем клетки инкубировали с HRP-биотинилированным анти-мышиным/кроличьим IgG (Vector Laboratories, ABC Kit) в течение 1 часа и раствором Avidin-DH (Vector Laboratories, ABC Kit) в течение 30 минут; после этого добавляли DAB (3,3-диаминобензидин). Хромоген DAB дает коричневую реакцию в присутствии пероксидазы (HRP). Слайды контрастировали гематоксилином Майера, обезвоживали в спирто-ксилоловом градиенте и монтировали с помощью Entellan® (синтетическая смола) на стеклянные предметные стекла. Необработанные клетки B16F10 использовались в качестве контроля базальной экспрессии HMGB1, HSP70 и HSP90. Экспрессию HMGB1, HSP70 и HSP90 (интенсивность окрашивания DAB) проводили с использованием программного обеспечения Fiji (ImageJ) версии 2.0, как описано Patera (2019). Данные представлены как оптическая плотность DAB (=log (максимальная интенсивность/средняя интенсивность)) пяти срезов на слайде. Было проведено три независимых эксперимента.
Проточная цитометрия для определения кальретикулина
Клетки (50 x103 клеток/лунку) высевали на ультранизкопористые 24-луночные планшеты при 37°C и 5%CO2. После этого клетки обрабатывали Ag LD50 (2,8 x 10-5мМ), DCA LD50 (195 мМ) или Ag + DCA LD50 (2,4 x 10-5 мМ и 135 мМ, соответственно) при 37°C и 5%CO2 в течение 4 часов. Затем клетки восстанавливали и окрашивали поликлональным антителом к кальретикулину, конъюгированным с фикоэритрином, в течение 1 часа при 37°C и 5%CO2. Клетки промывали PBS+бычий сывороточный альбумин (БСА) (1% ) и ресуспендировали в 200мкл PBS. Регистрация событий проводилась на проточном цитометре Accouri C6 (BD Biosciences, Сан-Хосе, Калифорния, США).
Эксперименты по противоопухолевой вакцинацииin vivo
Для приготовления клеточного лизата мы следовали протоколу, описанному Rodríguez-Salazar et al. [12] с незначительными изменениями. Вкратце, клетки B16F10 (5 x106) обрабатывали in vitro Ag (LD50) или DCA (LD50) или комбинацией Ag (LD25) + DCA (LD25) в течение 5 часов. После этого клетки центрифугировали при 260 × g в течение 10 мин и дважды промывали PBS. Наконец, клетки ресуспендировали в 200мкл PBS и инокулировали подкожно в левый фланг мыши. Через 7 дней мышей заражали 5 x105 живыми клетками B16F10, ресуспендированными в 200 мклPBS, путем подкожной инъекции в правый фланг. Частоту появления и рост опухолей измеряли каждый день в двух местах инъекции в течение 30 дней с помощью цифрового штангенциркуля. Объем опухоли рассчитывали по формуле: V = (L x W2)/2, где V — объем опухоли, L — длина опухоли, а W — ширина опухоли, та же формула, которая ранее использовалась Родригесом-Салазаром и другими [12].
Статистический анализ
Статистический анализ проводился с использованием одностороннего дисперсионного анализа (ANOVA) с последующим тестом Даннетта, если не указано иное. Статистически значимым различие считалось при . Все эксперименты проводились в трех экземплярах.
Результаты
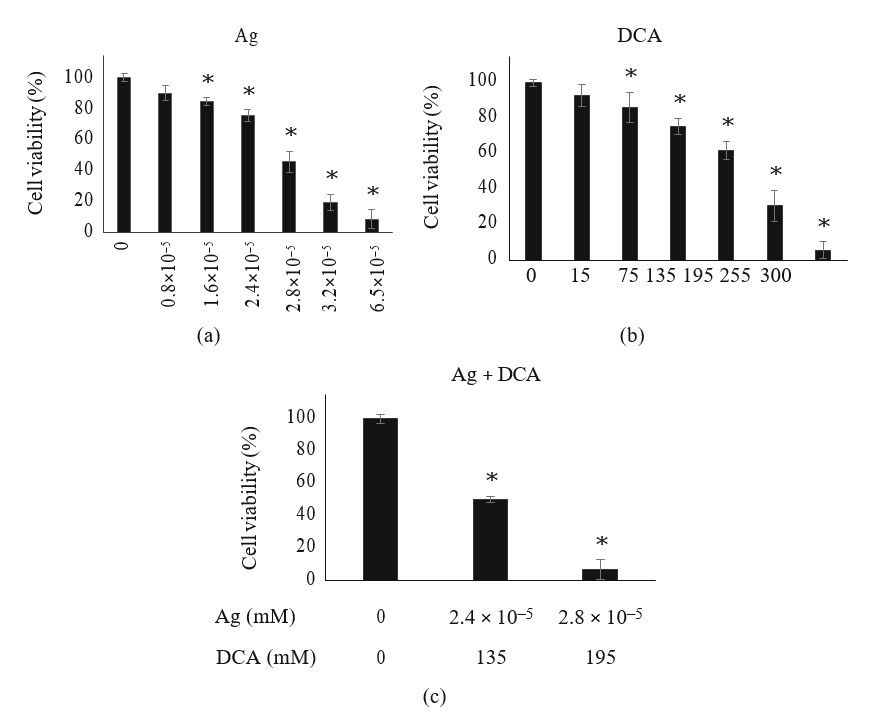
DCA-Ag снижал жизнеспособность клеток меланомы B16F10
Обработка Ag или DCA вызывала снижение жизнеспособности клеток B16F10 в дозозависимой манере по сравнению с контролем (p < 0:01) (рис. 1(a) и 1(b)). DL25 (2,4 ×105мМ) и DL50 (2,8 ×105) были определены для Ag (рис. 1(a)); DL25 (135 мМ) и DL50 (195 мМ) были также определены для DCA (рис. 1(b)). Для достижения DL25 и DL50 в комбинаторной постановке требовались более низкие дозы Ag и DCA (Рисунок 1(c)).
Ag-DCA индуцированная регрессия опухоли
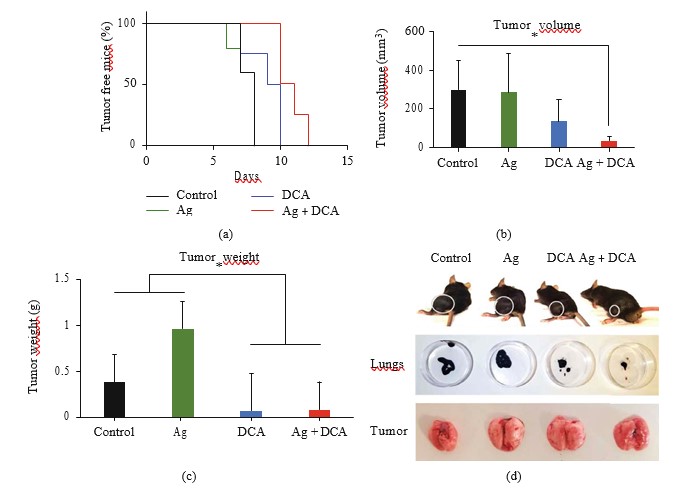
Введение Ag, DCA и Ag + DCA индуцировало регрессию объема опухоли (p < 0:05) в зависимости от времени, наблюдая лучший эффект у мышей, получавших Ag + DCA (рис. 2(a)).
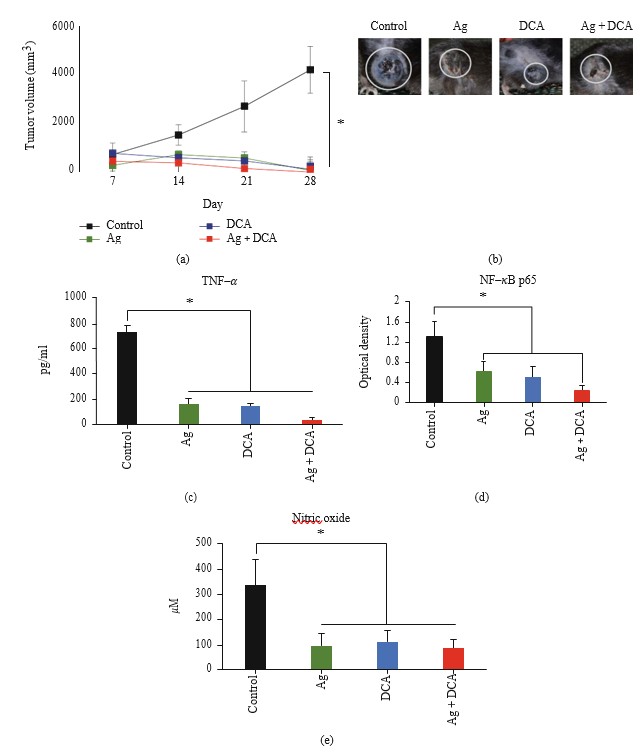
Лечение Ag, DCA и Ag + DCA снижало TNF-α, NF-κB и оксид азота
Все виды лечения значительно снижали (p < 0:05) продукцию TNF-α (рис. 2(c)), активность NFκB (рис. 2(d)) и производство оксида азота (NO) по сравнению с контрольной группой; существенной разницы между группами лечения не наблюдалось (рис. 2(c)-2(e)).
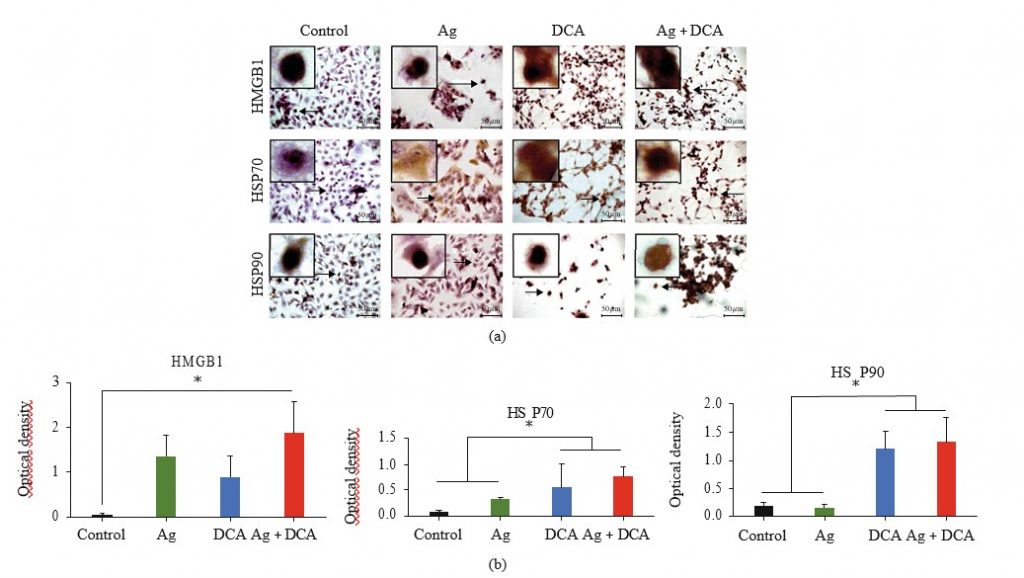
Экспрессия и локализация HMGB1, HSP70 и HSP90 в клетках B16F10, обработанных Ag, DCA или Ag + DCA
Локализация HMGB1, HSP70 и HSP90 определялась с помощью микроскопии (рис. 3(a)). В контрольных условиях HMGB1, HSP70 и HSP90 не обнаруживались или локализовались в ядре (рис. 3(a)). Обработка Ag мобилизовала HSP70 в цитоплазму и клеточную мембрану, обработка DCA мобилизовала HMGB1 и HSP70 в цитоплазму и клеточную мембрану, а комбинированная обработка AgDCA мобилизовала HMGB1, HSP70 и HSP90 в цитоплазму и клеточную мембрану (Рисунок 3(a)). Все виды обработки значительно увеличили (p < 0:05) экспрессию HMGB1 и HSP70; однако только DCA и Ag + DCA значительно увеличили (p < 0:05) HSP90 по сравнению с контролем (необработанные клетки B16F10) (Рисунок 3(b)).
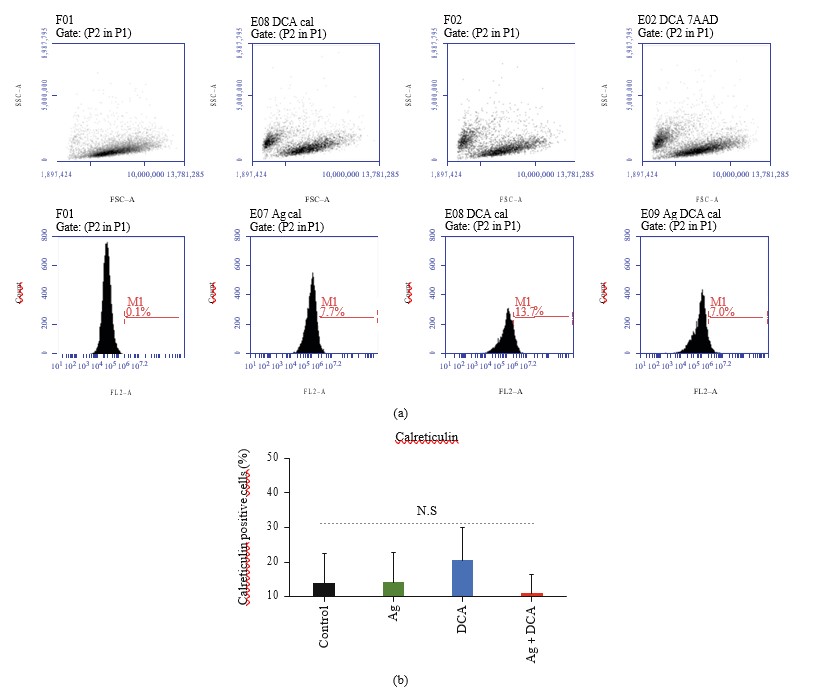
Экспозиция кальретикулина в клетках, обработанных Ag, DCA или Ag + DCA
Обработка Ag, DCA и Ag + DCA не вызывает экспозиции поверхности кальретикулина в клетках B16F10 по сравнению с контролем (необработанные клетки B16F10) (рис. 4(a) и 4(b)).
Ag, DCA или Ag + DCA не вызывают иммуногенной гибели клеток
Клетки B16F10, лизированные Ag, DCA и AgDCA, не предотвращают имплантацию опухоли мышам C57BL/6 (рис. 5(a)-5(d)).
Обсуждение
Цитотоксический эффект коллоидного серебра (Ag), дихлорацетата натрия (DCA) и их комбинации был оценен против клеток мышиной меланомы B16F10. Наши результаты показывают, что Ag обладает антипролиферативным действием против клеток B16F10, о чем ранее сообщала наша исследовательская группа [13]. Дальнейшие сообщения о цитотоксической активности серебра против клеток меланомы относятся к серебряным наночастицам, хотя предполагаемый механизм токсичности остается тем же [14]. DCA также проявлял антипролиферативный эффект против клеток меланомы. Аналогичным образом, Ривера-Лазарин и др. сообщили о дозозависимом снижении жизнеспособности клеток B16F10, обработанных DCA [15].
Цитотоксическая активность Ag и DCA увеличивалась при комбинированном лечении. Этого следовало ожидать, поскольку комбинация двух или более агентов является краеугольным камнем в лечении рака; она позволяет одновременно воздействовать на ключевые пути, добиваясь повышения эффективности [16].
После наблюдения усиления цитотоксического эффекта мы проверили, коррелируют ли наши результаты с противоопухолевой активностью in vivo. На уровне опухоли было отмечено образование некроза; стоит отметить, что поражения полностью заживали во всех случаях ликвидации опухоли. Поражения кожи могут возникать из-за сверхэкспрессии фактора некроза опухоли альфа [17]. Наши результаты показали более высокие уровни TNF-α в нелеченных меланомах и значительное снижение этого фактора в ответ на все наши методы лечения. TNF-α коррелирует с агрессивностью меланомы и метастатическим потенциалом in vivo [18], а о его сверхэкспрессии в первичных меланомах сообщали Rossi и другие [19].
Важно отметить, что TNF-α является плейотропным цитокином, и его проапоптотические эффекты против раковых клеток широко описаны [20]; однако клетки меланомы сопротивляются TNF-α-индуцированномуапоптозу через NF-κBи оксид азота [21].
В данном исследовании наши результаты показали снижение NF-κBи оксида азота у мышей, получавших Ag, DCA или комбинацию обоих препаратов, что коррелирует с регрессией опухоли. Ванг и др. сообщили, что NF-κBподавляет TNF-α-опосредованныйапоптоз через активацию антиапоптотических белков TRAF1, TRAF2, c-IAP1 и c-IAP2 [22]. С другой стороны, Salvucci и др. сообщили о производстве оксида азота в клетках меланомы человека, а блокирование этого производства вызывает гибель клеток меланомы человека [23]. В частности, оксид азота ингибирует по крайней мере семь каспаз через s-нитрозилирование [24]
.
Несмотря на наши наблюдения, важно отметить, что TNF-α, NF-κBи NO обладают плейотропным действием, и их роль в меланоме изучена недостаточно хорошо. Однако мы подчеркиваем, что наши результаты свидетельствуют о том, что снижение уровня этих молекул коррелирует с регрессией опухоли и заживлением ран.
Многие противораковые методы лечения способны вызывать гибель раковых клеток, что приводит к ликвидации опухоли и избавлению пациента от злокачественной опухоли. Однако только индукторы иммуногенной гибели клеток могут предотвратить рецидив рака. Поэтому препараты, индуцирующие иммуногенную гибель клеток, представляют собой недавнюю инновацию в области онкоиммунотерапии [25], как, например, использование иммуномодулятора IMMUNEPOTENT CRP, который недавно продемонстрировал эту способность [12]. Мы задались целью оценить, способны ли наши методы лечения вызывать иммуногенную гибель клеток.
Присутствие аларминов in vitro указывает на потенциал индуцировать иммуногенную гибель клеток [26]. Однако, несмотря на зависимое от обработки увеличение HMGB1, HSP70 и HSP90 (но не кальретикулина), вакцинация мышей клетками B16F10, лизированными Ag, DCA или комбинацией Ag + DCA, не вызвала иммуногенной гибели клеток, о чем свидетельствует появление опухоли у всех мышей (вакцинированных или невакцинированных) после заражения жизнеспособными клетками B16F10. Рост опухоли указывает на то, что специфический иммунный ответ не был индуцирован вакцинами. Причиной этого может быть то, что DCA, Ag и DCA + Ag не индуцируют высвобождение DAMPs в скоординированном пространственно-временном паттерне; поэтому им не хватает способности индуцировать цитокины и эффективную презентацию антигена [27].
В заключение следует отметить, что комбинация Ag и DCA обладает потенциальными противоопухолевыми свойствами против клеток меланомы, однако механизм противоопухолевого действия in vivo не является иммуногенной гибелью клеток. Дальнейшие исследования для выяснения механизма гибели клеток важны для разработки стратегий и комбинаций с клинической эффективностью против меланомы.
Доступность данных
Данные, связанные с этой рукописью, доступны по обоснованному запросу.
Конфликты интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Данное исследование было поддержано грантом «Fondo Sectorial de Investigación para la Educación» A1-S-35951, CONACYT, Мексика. Мы благодарим г-жу С. Алехандру Арреолу Триану за редактирование рукописи.
ССЫЛКИ
1 Д. Б. Джонсон и Дж. А. Сосман, «Обновленная информация о таргетной терапии меланомы», «Current Treatment Options in Oncology», том 14, № 2, стр. 280-292, 2013.
2 E. A. Zaal и C. R. Berkers, «The influence of metabolism on drug response in cancer,» Frontiers in Oncology, vol. 8, p. 500, 2018.
3 Z.-F. Lim and P. C. Ma, «Emerging insights of tumor heterogeneity and drug resistance mechanisms in lung cancer targeted therapy,» Journal of Hematology & Oncology, vol. 12, no. 1, p. 134, 2019.
4 V. De Matteis, M. Cascione, C. Toma, and S. Leporatti, «Silver nanoparticles: synthetic routes, in vitro toxicity and theranostic applications for cancer disease,» Nanomaterials, vol. 8, no. 5, p. 319, 2018.
5 N. Durán, W. J. Fávaro, and A. B. Seabra, «What do we really know about nanotoxicology of silver nanoparticles in vivo? Новые аспекты, возможные механизмы и перспективы», Current Nanoscience, vol. 16, no. 3, pp. 292-320, 2020.
6 M. Ahamed, M. S. AlSalhi, and M. K. J. Siddiqui, «Silver nanoparticle applications and human health,» Clinica Chimica Acta, vol. 411, no. 23-24, pp. 1841-1848, 2010.
7 K. Habiba, K. Aziz, K. Sanders et al., «Повышение эффективности лучевой терапии колоректального рака с помощью серебряных нанопризм, украшенных графеном, в качестве радиосенсибилизаторов», Scientific Reports, vol. 9, no. 1, p. 17120, 2019.
8 T. Tataranni and C. Piccoli, «Dichloroacetate (DCA) and cancer: an overview towards clinical applications,» Oxidative Medicine and Cellular Longevity, vol. 2019, 14 pages, 2019.
9 С. Пустыльников, Ф. Костабиле, С. Беги и А. Фаччабене, «Таргетинг митохондрий при раке: современные концепции и подходы к иммунотерапии», Translational Research, vol. 202, pp. 35-51, 2018.
10 S. Grazioli and J. Pugin, «Mitochondrial damage-associated molecular patterns: from inflammatory signaling to human diseases,» Frontiers in Immunology, vol. 9, p. 832, 2018.
11 Y. Nie, D. Yang, and J. J. Oppenheim, «Alarmins and antitumor immunity,» Clinical Therapeutics, vol. 38, no. 5, pp. 1042-1053, 2016.
12 M. Rodríguez-Salazar, M. A. Franco-Molina, E. Mendoza-Gamboa et al., «The novel immunomodulator IMMUNEPOTENT CRP combined with chemotherapy agent increased the rate of immunogenic cell death and prevented melanoma growth,» Oncology Letters, vol. 14, no. 1, pp. 844-852, 2017.
13 C. A. Sierra Rivera, M. A. Franco Molina, E. Mendoza Gamboa, P. Zapata Benavides, R. S. Tamez Guerra, and C. Rodriacute guez Padilla, «Potential of colloidal or silver nanoparticles to reduce the growth of B16F10 melanoma tumors,» African Journal of Microbiology Research, vol. 7, no. 22, pp. 2745-2750, 2013.
14 L. M. Valenzuela-Salas, N. G. Girón-Vázquez, J. C. García-Ramos et al., «Antiproliferative and antitumour effect of nongenotoxic silver nanoparticles on melanoma models,» Oxidative Medicine and Cellular Longevity, vol. 2019, 12 pages, 2019.
15 A. L. R. LazarAAn, A. Zugasti Cruz, G A.¡n. A. de la PeAAa, S. Y. S. Belmares, and C. A. Sierra Rivera, «Synergistic cytotoxic effect of sodium dichloroacetate combined with chemotherapeutic drugs on B16F10 murine melanoma cell line,» Biomedical Research, vol. 30, no. 1, 2019.
16 R. B. Mokhtari, T. S. Homayouni, N. Baluch et al., «Combination therapy in combating cancer,» Oncotarget, vol. 8, no. 23, pp. 38022-38043, 2017.
17 A. M. Brotas, J. M. T. Cunha, E. H. J. Lago, C. C. N. Machado, and S. C. S. Carneiro, «Tumor necrosis factor-alpha and the cytokine network in psoriasis,» Anais Brasileiros de Dermatologia, vol. 87, no. 5, pp. 673-683, 2012.
18 S. Moretti, C. Pinzi, A. Spallanzani et al., «Immunohistochemical evidence of cytokine networks during progression of human melanocytic lesions,» International Journal of Cancer, vol. 84, no. 2, pp. 160-168, 1999.
19 S. Rossi, M. Cordella, C. Tabolacci et al., «TNF-alpha и металлопротеазы как ключевые игроки в агрессивности клеток меланомы», Journal of Experimental & Clinical Cancer Research, vol. 37, no. 1, p. 326, 2018.
20 A. Montfort, C. Colacios, T. Levade, N. Andrieu-Abadie, N. Meyer, and B. Ségui, «The TNF paradox in cancer progression and immunotherapy,» Frontiers in Immunology, vol. 10, p. 1818, 2019.
21 V. A. Soldatenkov, A. Dritschilo, Z. Ronai, and S. Y. Fuchs, «Inhibition of homologue of Slimb (HOS) function sensitizes human melanoma cells for apoptosis,» Cancer Research, vol. 59, no. 20, pp. 5085-5088, 1999.
22 C. Wang, M. W. Mayo, R. G. Korneluk, D. V. Goeddel, and Baldwin AS Jr, «NF-B antiapoptosis: induction of TRAF1 and TRAF2 and c-IAP1 and c-IAP2 to suppress caspase-8 activation,» Science, vol. 281, no. 5383, pp. 1680-1683, 1998.
23 O. Salvucci, M. Carsana, I. Bersani, G. Tragni, and A. Anichini, «Antiapoptotic role of endogenous nitric oxide in human melanoma cells,» Cancer Research, vol. 61, no. 1, pp. 318-326, 2001.
24 L. Rössig, B. Fichtlscherer, K. Breitschopf et al., «Оксид азота ингибирует каспазу-3 путем S-нитрозирования in vivo,» Журнал биологической химии, том 274, № 11, стр. 6823-6826, 1999.
25 B. Rapoport and R. Anderson, «Realizing the clinical potential of immunogenic cell death in cancer chemotherapy and radiotherapy,» International Journal of Molecular Sciences, vol. 20, no. 4, p. 959, 2019.
26 A. Терензи, К. Пиркер, Б. К. Кепплер и В. Бергер, «Противораковые металлические препараты и иммуногенная гибель клеток», Журнал неорганической биохимии, т. 165, с. 71-79, 2016.
27 O. Kepp, L. Menger, E. Vacchelli et al., «Crosstalk between ER stress and immunogenic cell death,» Cytokine & Growth Factor Reviews, vol. 24, no. 4, pp. 311-318, 2013.