Гюльсах АЛБАЙРАК1, Эче КОНАК1, Умит Акин ДЕРЕ2, Хакан ЭММЕЗ2
1 Университет Гази, медицинский факультет, кафедра медицинской биологии и генетики, Анкара, Турция
Университет Гази, медицинский факультет, кафедра нейрохирургии, Анкара, Турция
Корреспонденция: Ece KONAC; E-mail: [email protected]
Получено: 16 января 2020 г.
Принято: 3 июля 2020 г.
Опубликовано: 29 декабря 2020 г
Аннотация
Цель: изучить влияние метформина, дихлорацетата (ДХА) и мемантина на клетки глиобластомы человека T98G и U87-MG для многонаправленного воздействия на метаболизм опухолевых клеток.
МАТЕРИАЛЫ И МЕТОДЫ: Уровни IC50 для метформина, DCA, метформин+DCA и мемантина были определены методом МТТ в клетках T98G и U87-MG in vitro. Экспрессию белков Casp3, Bcl-2, Bax, c-Myc и GSK-3B исследовали после лечения. Пятнадцать опухолевых тканей GBM+ были оценены на предмет экспрессии Casp-3, Bcl-2, Bad, Bax и апоптотических белков.
Результаты: препараты, направленные на метаболизм раковых клеток, метформин, DCA, метформин+DCA и мемантин вызывали цитотоксичность в дозозависимой манере в клетках T98G и U87-MG. IC50 для мемантина составляет 0,5 мМ (p<0,01), что почти в 10 раз ниже, чем у метформина. Пятнадцать опухолевых тканей GBM+ имели дифференциальную экспрессию апоптотических белков.
Заключение: Мемантин обладает противораковым механизмом действия в клетках T98G и U87-MG, однако такой механизм требует более глубокого изучения для лечения ГБМ.
Ключевые слова: Глиобластома, раковая клетка, метаболизм, метформин, дихлорацетат, мемантин
DOI: 10.5137/1019-5149.JTN.29176-20.3
ВВЕДЕНИЕ
Глиобластома (ГБМ) является одной из наиболее агрессивных опухолей центральной нервной системы и составляет приблизительно 50% всех глиальных опухолей [12,27]. Медиана выживаемости пациентов с ГБМ не меняется signicantly при использовании современных стандартов лечения, которые включают резекцию опухоли с последующей радиотерапией и лечение темозоломидом. Медиана выживаемости составляет примерно 12-14 месяцев, несмотря на комбинированное использование хирургического вмешательства, радиотерапии и химиотерапии [7,23].
Опухоли ГБМ имеют широкий спектр генетических вариаций, что приводит к dierent терапевтическим ответам [5,9,21]. Внутриопухолевая гетерогенность может быть ключом к выявлению причины неудачного лечения [22]. Химиотерапевтические препараты, такие как темозоламид, увеличивают мутационную нагрузку в геноме рака по сравнению с нелеченными клетками GBM [17]. Поэтому в лечении ГБМ срочно необходимы альтернативные терапевтические подходы.
Метформин — распространенный противодиабетический препарат, используемый для лечения диабета 2 типа [18]. Установлено, что лечение метформином связано со снижением риска развития нескольких видов рака, однако его воздействие на ГБМ не было хорошо изучено [4,24]. Лечение метформином снижает устойчивость к темозоломиду в клетках ГБМ [26]. Метформин, однако, имеет проблемы с безопасностью в клинических условиях, поскольку в большинстве доклинических работ использовались сверхфизиологические дозы метформина [25]. В данном исследовании мы стремились преодолеть эту проблему, изучая эффект метформина в комбинации с дихлорацетатом (DCA), который направлен на метаболизм раковых клеток посредством ингибирования киназы пируватдегидрогеназы [11]. Целевое воздействие на метаболизм раковых клеток может иметь значение для лечения агрессивного ГБМ. Кроме того, мы стремились изучить профили экспрессии апоптотических белков, чтобы лучше понять ГБМ на молекулярном уровне. Мы также стремились вмешаться в метаболизм раковых клеток с помощью метформина, DCA и мемантина в клеточных линиях T98G и U87-MG GBM.
Материалы и методы
Культура клеток и химические вещества
Клеточные линии глиобластомы человека
и U87-MG были предоставлены ATCC. Клетки T98G и U87-MG выращивали в среде DMEM/F12, дополненной 10% фетальной бычьей сывороткой (FBS) (Sigma-Aldrich, St Louis, MO, USA). Клетки выращивали в 5%CO2 инкубаторе при 37° C. Метформин, дихлорацетат и мемантин были предоставлены компанией SigmaAldrich, Сент-Луис, МО, США. Клетки обрабатывали этими агентами в течение 48 ч. для определения уровня IC50. Все агенты были растворены в стерильной дистиллированной воде.
Анализ цитотоксичности клеток
3X103 клеток T98G и U87-MG высевали в 96-луночный планшет и культивировали в течение ночи. Различные концентрации метформина, DCA и мемантина были использованы в МТТ анализе. Добавляли раствор МТТ (5 мг/мл в PBS) и клетки инкубировали в течение 4 часов при 37°C. Для солюбилизации кристаллов добавляли ДМСО. Коэффициент абсорбции измеряли с помощью SpectraMax M3 (Molecular Devices, США)
Образцы пациентов с GBM и выделение белка из опухоли
В общей сложности 17 образцов опухолевой ткани GBM были собраны в Университете Гази, на кафедре нейрохирургии, в период с апреля 2015 по апрель 2016 года с одобрения Комитета по этике клинических исследований Университета Гази. Образцы опухоли были свежезаморожены при температуре -80°C. Две опухолевые ткани были исключены из исследования, так как в их патологоанатомических заключениях был обнаружен GBM (-). 0.1 грамм образца опухолевой ткани гомогенизировали в буфере для лизиса RIPA. Лизат центрифугировали в течение 15 минут при 14 000 об/мин и собирали супернатант для проведения количественного анализа белка BCA. Образцы хранили при -80 °C для дальнейшей обработки.
Вестерн-блоттинг
Клетки T98G и U87-MG промывали PBS и соскабливали в буфер для лизиса RIPA, содержащий 1 мМ PMSF, после чего проводили соникацию. Образцы центрифугировали в течение 15 минут при 13500 об/мин при 4°C и собирали супернатант. Количественное определение белков проводили с помощью набора BCA Assay Kit (Thermo Pierce, Rockford, IL, USA). Белковые лизаты (20 мкг) прогревали в течение 5 минут при 95°C в LDS нередуцирующем буфере для образцов (Pierce, Rockford, IL, USA), затем загружали в 10% Трис-глицин гель, переносили на PVDF мембрану (Pierce, Rockford, IL, USA). Мембраны блокировали в течение 1 часа при комнатной температуре и инкубировали в течение ночи при 4°C с первичными антителами к Casp3, Bcl2, Bad, Bax, GSK-3B, C-Myc и β-актину (Thermo Pierce, Rockford, IL, USA). Блоты визуализировали с помощью субстрата Luminata Forte Western HRP (Merck Millipore, Дармтадт, Германия). Хемилюминесцентные сигналы иммуноблотов документировали с помощью Gel Logic 2200 Pro (Carestream Health; Рочестер, штат Нью-Йорк, США).
Статистический анализ
Эксперименты проводились в трех экземплярах. Уровни IC50 метформина, дихлорацетата и мемантина для клеточных линий T98G и U87-MG рассчитывали с помощью программы Graph-Pad Prism7. Результаты выражали как среднее±стандартное отклонение. p<0,05 считалось статистически значимым.
Результаты
Влияние метформина, DCA, метформина+DCA и мемантина на цитотоксичность клеток T98G и U87-MG GBM
Метформин снижал жизнеспособность клеток T98G и U87- MG раковых клеток GBM человека дозозависимым образом, как показано на рисунке 1A, обработка 45мМ и 25мМ метформина снижала жизнеспособность клеток в течение 48 часов (p<0.01). Мы исследовали влияние DCA на клетки T98G и U87-MG в течение 48 часов, диапазон концентраций DCA 10-60 мМ был протестирован на клетках. DCA снижал жизнеспособность клеток при концентрации 45 мМ, как показано на рисунке 1B (p<0,01). Различные концентрации метформина+DCA также были протестированы на клетках GBM с целью снижения дозы IC50. Комбинация метформин+DCA снижала жизнеспособность клеток до более низких доз, IC50 доза для комбинированного лечения была определена как 20 мМ DCA и 20 мМ метформина для клеток T98G и U87MG в течение 48 часов, как показано на рисунке 1С (p<0,01). Кроме того, мемантин влиял на клеточную токсичность дозозависимым образом, как показано на рисунке 1D. 0.концентрация 125-5 мМ мемантина была протестирована на клетках T98G и U87MG в течение 48 часов, и значение IC50 было определено как 0,5 мМ для клеток T98G и U87MG (p<0,01).
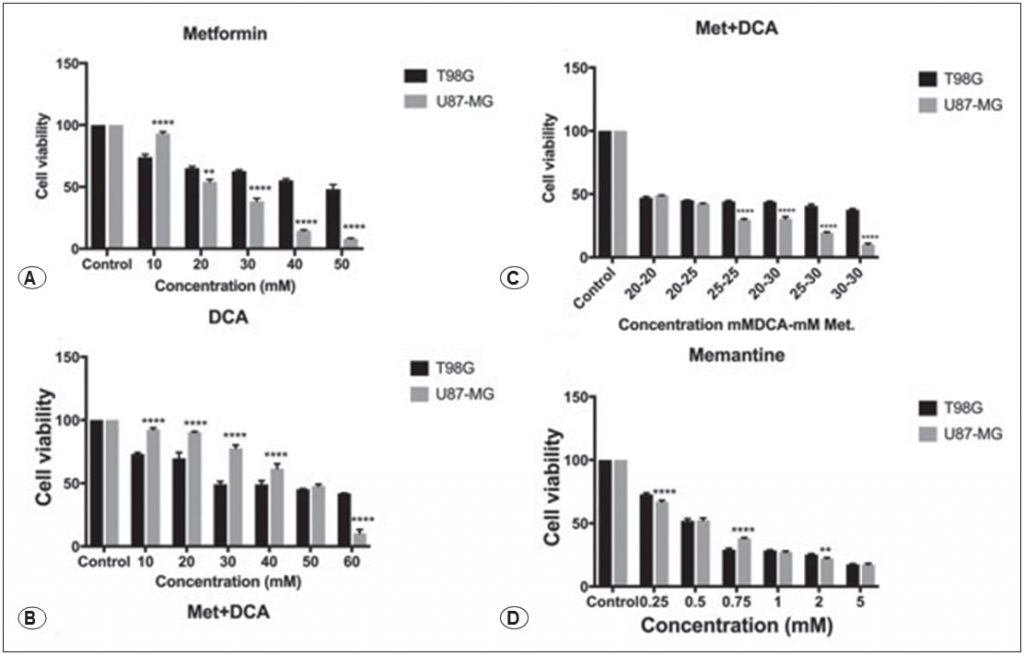
Влияние метформина, DCA, метформина+DCA и мемантина на уровни экспрессии белков Casp3, Bcl2, Bax, c-Myc, GSK3B
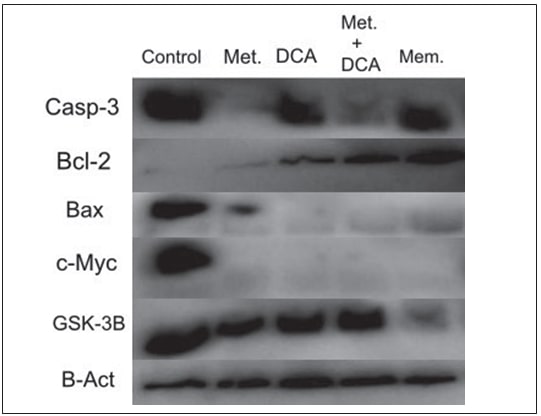
Клетки T98G обрабатывали 45 мМ метформина, 45 мМ DCA, 20 мМ метформина в сочетании с 20 мМ DCA и 0,5 мМ мемантина в течение 48 часов. Клетки U87-MG обрабатывали 25 мМ метформином, 45 мМ DCA, 20 мМ метформином в сочетании с 20 мМ DCA и 0,5 мМ мемантином в течение 48 часов. Экспрессия белков, связанных с апоптозом и прогрессией клеточного цикла, т.е. Casp3, Bcl2, Bax, c-Myc и GSK3B, оценивалась с помощью вестерн-блота. Метформин и комбинация метформин-ДКА снижали экспрессию белка Casp-3 в клетках T98G (Рисунок 2), в то время как экспрессия белка Casp-3 увеличивалась при всех видах лечения (метформин, ДКА, метформин+ДКА, мемантин) в клетках U87-MG (Рисунок 3). Экспрессия белка Bcl-2 увеличивалась при лечении DCA, метформином+DCA и мемантином, в то время как экспрессия белка Bax снижалась при всех видах лечения клеток T98G. Экспрессия белка c-Myc снижалась при вышеуказанных видах лечения (метформин, DCA, метформин+DCA, мемантин) в клетках T98G. Лечение мемантином подавляло экспрессию белка GSK3B в клетках T98G (Рисунок 2).

Дифференциальные профили экспрессии белковв опухолевых тканяхGBM-позитивных
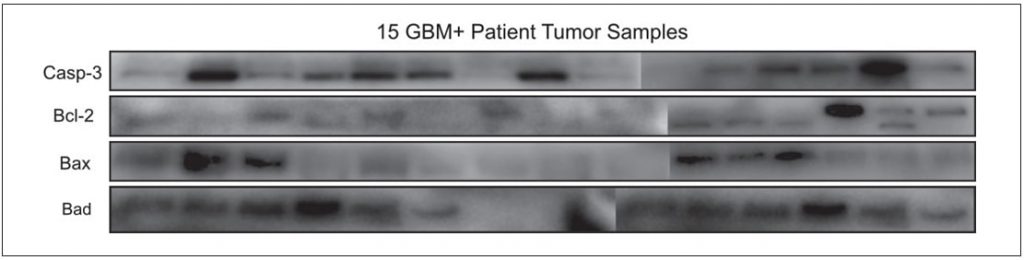
образцов опухолевых тканей GBM-позитивных опухолей были охарактеризованы с точки зрения апоптоза, поскольку это может быть индикатором прогрессирования заболевания. Пятнадцать образцов опухолевой ткани GBM+ были исследованы на профили экспрессии белков Casp-3, Bcl-2, Bad, Bax. Было установлено, что исследуемые апоптотические белки дифференциально экспрессируются у каждого пациента (Рисунок 4).
Обсуждение
Применение антиангиогенного препарата бевацизумаб при ГБМ показало улучшение общей выживаемости пациентов, однако этот вывод остается спорным [6]. В эпоху персонализированной медицины существует потребность в альтернативных схемах лечения столь агрессивной опухоли GBM.
Глюкозо- и глутаминовая зависимость раковых клеток известна как отличительная черта раковых опухолей [16]. Аберрантный метаболизм глюкозы определяется как движущая сила агрессивности и химиорезистентности GBM. В настоящее время интерес к метаболизму опухоли в лечении рака расширился за пределы метаболизма глюкозы и включает другие молекулы, такие как глутамин. Поэтому очень важно получить больше информации о метаболизме глутамина в раковых клетках [2]. Поэтому целью настоящего исследования является воздействие на метаболизм глюкозы и глутамина с помощью метформина, ДКА и мемантина.
Механизм действия метформина на раковые клетки известен своей избирательностью в отношении раковых стволовых клеток. Этот механизм может зависеть от метаболизма глутамина [8]. DCA — ингибитор киназы пируватдегидрогеназы, который обращает вспять эффект Варбурга [20]. Чувствительность опухолевых клеток к ингибированию гликолиза может быть достигнута путем двойного воздействия с помощью метформина и DCA. Кроме того, лекарство от болезни Альцгеймера мемантин имеет гораздо более низкую дозу IC50 по сравнению с метформином. Относительно более низкая доза IC50 для мемантина (0,5 мМ), таким образом, может преодолеть проблемы, связанные с супрафизиологической дозой метформина в клинических условиях. Недавно синтезированные производные мемантина также проявили противоопухолевую активность в клеточной линии U87-MG GBM [3]. Таргетинг сигнальных путей, связанных с рецептором NMDA, с помощью мемантина может улучшить лечение глиомы и ГБМ [1,14]. Просветление противоракового механизма мемантина в отношении клеток GBM, таким образом, обещает стать новым препаратом нового назначения.
Дифференциальные профили экспрессии белков 15 опухолевых тканей GBM+ для апоптотических генов Casp-3, Bcl-2, Bad, Bax также подтверждают гетерогенную природу заболевания. Положительная экспрессия Bax была значительно связана с лучшей выживаемостью в большой серии опухолей [19]. Таким образом, профиль экспрессии белка Bax может быть прогностически значимым для ответа на лечение ГБМ. Активация каспазы-3 является предиктором выживаемости без прогрессирования у пациентов с ГБМ [13].
Молекулярная стратификация пациентов необходима для выделения групп пациентов, которые с наибольшей вероятностью получат пользу от выбранного протокола лечения.
В недавнем исследовании, переходящем в фазу II, ученые изучали максимально переносимые дозы мемантина, мефлохина и метформина в комбинации с темозоломидом. Марака и др. пришли к выводу, что эти препараты можно безопасно сочетать с темозоломидом при недавно диагностированном ГБМ [10]. Однако при использовании комбинированных схем лечения были зарегистрированы некоторые побочные эффекты, и этот подход был подвергнут тщательному анализу, что привело к путанице в вопросе о том, мемантин или мефлохин вызвали наблюдаемые побочные эффекты [15]. При использовании комбинаций лекарственных препаратов крайне важно понимать их взаимодействие с другими препаратами и/или фармакокинетические взаимодействия.
ЗАКЛЮЧЕНИЕ
Наши результаты, полученные in vitro, доказывают возможность использования препарата Альцгеймера мемантина в лечении ГБМ в более низких дозах по сравнению с метформином. Свойства мемантина проникать через кровеносный барьер мозга также являются перспективными для лечения ГБМ. Представляет интерес и то, что мемантин может стать альтернативной неоадъювантной терапией, особенно для пожилых онкологических больных. Это утверждение требует дальнейшего изучения с помощью рандомизированных контролируемых исследований.
БЛАГОДАРНОСТИ
Это исследование было поддержано научным грантом Совета по научным и технологическим исследованиям Турции, TUBITAK (проект №: SBAG- 214S578).
ССЫЛКИ
1 Altinoz MA, Elmaci I: Таргетинг оксида азота и NMDA рецептор-ассоциированных путей в лечении глиальных опухолей высокого класса. Гипотезы для нитромемантина и нитронов. Оксид азота 79:68-83, 2018 г2 Altman BJ, Stine ZE, Dang CV: От Кребса до клиники: Метаболизм глутамина в терапии рака. Nat Rev Cancer 16(10):619- 634, 2016
3 Cacciatore I, Fornasari E, Marinelli L, Eusepi P, Ciulla M, Ozdemir O, Tatar A, Turkez H, Di Stefano A: Memantinederived drugs as potential antitumor agents for the treatment of glioblastoma. Eur J Pharm Sci 109:402-411, 2017
4 Ferla R, Haspinger E, Surmacz E: Metformin inhibits leptininduced growth and migration of glioblastoma cells. Oncology Letters 4(5):1077-1081, 2012 г
5 Inda MD, Bonavia R, Seoane J: Glioblastoma multiforme: Взгляд внутрь ее гетерогенной природы. Cancers 6(1):226-239, 2014
6 Johnson DR, Omuro AM, Ravelo A, Sommer N, Guerin A, Ionescu-Ittu R, Shi S, Macalalad A, Uhm JH: Overall survival in patients with glioblastoma before and after bevacizumab approval. Текущие медицинские исследования и мнения 34(5):813- 820, 2018 г
7 Khosla D: Одновременная терапия для улучшения радиотерапевтических результатов при глиобластоме. Ann Transl Med 4(3):54, 2016
8 Kim JH, Lee KJ, Seo Y, Kwon JH, Yoon JP, Kang JY, Lee HJ, Park SJ, Hong SP, Cheon JH, Kim WH: Effects of metformin on colorectal cancer stem cells depend on alterations in glutamine metabolism. Научные доклады 8(1):409, 2018 г
9 Liu Y, Xu X, Yin L, Zhang X, Li L, Lu H: Relationship between glioblastoma heterogeneity and survival time: Анализ текстуры магнитно-резонансной томографии. Am J Neuroradiol 38(9):1695-1701, 2017 г
10 Maraka S, Groves MD, Mammoser AG, Melguizo-Gavilanes I, Conrad CA, Tremont-Lukats IW, Loghin ME, O’Brien BJ, Puduvalli VK, Sulman EP, Hess KR: Phase 1 lead-in to a phase 2 factorial study of temozolomide plus memantine, mefloquine, and metformin as postradiation adjuvant therapy for newly diagnosed glioblastoma. Cancer 125(3):424-433, 2019
11 Michelakis ED, Webster L, Mackey JR: Dichloroacetate (DCA) как потенциальная метаболическая таргетная терапия рака. Br J Cancer 99(7):989-994, 2008 г
12 Mrugala MM: Достижения и проблемы в лечении глиобластомы: взгляд клинициста. Discov Med 15(83):221-230, 2013 г
13 Murphy ÁC, Weyhenmeyer B, Schmid J, Kilbride SM, Rehm M, Huber HJ, Senft C, Weissenberger J, Seifert V, Dunst M, Mittelbronn M: Activation of executioner caspases is a predictor of progression-free survival in glioblastoma patients: Подход системной медицины. Cell Death Dis 4(5):e629, 2013 г
14 Müller-Längle A, Lutz H, Hehlgans S, Rödel F, Rau K, Laube B: NMDA рецептор-опосредованные сигнальные пути повышают устойчивость к радиации, выживание и миграцию в клетках глиобластомы — потенциальная цель для адъювантной радиотерапии. Cancers (4):503, 2019
15 Nevin RL: Неожиданно низкая частота нейропсихиатрических побочных эффектов, связанных с мефлохином, перепрофилированным для лечения глиобластомы. Cancer 125(8):1384-1385, 2019
16 Panchanathan RS, Sittur MG, Aoun RJ, Pines AR, Swanson KR, Bendok BR: War on glioblastoma multiforme: 2-pronged siege on glutamine. Мировая нейрохирургия 91:254-256, 2016 г
17 Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL, Olivi A, McLendon R, Rasheed BA, Keir S, Nikolskaya T, Nikolsky Y, Busam DA, Tekleab H, Diaz Jr LA, Hartigan J, Smith DR, Strausberg RL, Nagahashi Marie SK, Oba Shinjo SM, Yan H, Riggins GJ, Bigner DD, Karchin R, Papadopoulos N, Parmigiani G, Vogelstein B, Velculescu VE, Kinzler KW: Интегрированный геномный анализ мультиформной глиобластомы человека. Наука 321(5897):1807-1812, 2008 г
18 Rojas LBA, Gomes MB: Метформин: старое, но все еще лучшее лечение диабета 2 типа. Diabetol Metab Syndr 5(1):6, 2013 г
19 Ruano Y, Mollejo M, Camacho FI, de Lope AR, Fiaño C, Ribalta T, Martinez P, Hernández Moneo JL, Meléndez B: Identification of survival related genes of the phosphatidylinositol 3′ kinase signaling pathway in glioblastoma multiforme. Рак 112(7):1575-1584, 2008 г
20 Shen H, Decollogne S, Dilda PJ, Hau E, Chung SA, Luk PP, Hogg PJ, McDonald KL: Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 34(1):14, 2015 г
21 Soeda A, Hara A, Kunisada T, Yoshimura SI, Iwama T, Park DM: The evidence of glioblastoma heterogeneity. Научные доклады 5:7979, 2015
22 Sottoriva A, Spiteri I, Piccirillo SG, Touloumis A, Collins VP, Marioni JC, Curtis C, Watts C, Tavaré S: Intratumor heterogeneity in human glioblastoma reflects cancer evolutionary dynamics. Proc Natl Acad Sci U S A 110(10):4009- 4014, 2013 г
23 Stupp R, Mason WP, Van Den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO, European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group: Радиотерапия плюс сопутствующий и адъювантный темозоломид при глиобластоме. N Engl J Med 352(10):987-996, 2005 г
24 Quinn BJ, Kitagawa H, Memmott RM, Gills JJ, Dennis PA: Перепозиционирование метформина для профилактики и лечения рака. Trends in Endocrinology & Metabolism 24(9):469-480, 2013
25 Whitburn J, Edwards CM, Sooriakumaran P: Метформин и рак простаты: Новая роль для старого препарата. Current Urology Reports 18(6):46, 2017
26 Yang SH, Li S, Lu G, Xue H, Kim DH, Zhu JJ, Liu Y: Лечение метформином снижает устойчивость клеток глиобластомы к темозоломиду. Oncotarget 7(48):78787-78803, 2016 г
27 Zhang X, Zhang W, Cao WD, Cheng G, Zhang YQ: Glioblastoma multiforme: Молекулярная характеристика и современная стратегия лечения. Exp Ther Med 3(1):9-14, 2012
Связанный контент: