Cecilie Abildgaard1, Christina Dahl1, Ahmad Abdul-Al1, Annette Christensen1 en Per Guldberg1
1 Onderzoekscentrum van de Deense Kankerbestrijding, Kopenhagen, Denemarken
Correspondentie: Per Guldberg, e-mail: [email protected]
Ontvangen: 19 april 2017
Geaccepteerd: 19 juli 2017
Gepubliceerd: 24 augustus 2017
Abstract
Dysregulatie van het metabolisme tijdens de progressie van melanomen is nauw verbonden met de overname van genetische en epigenetische wijzigingen in regulatoren van metabole paden. Retinoïnezuurreceptor beta (RARβ) is epigenetisch uitgeschakeld in een groot deel van de melanomen, maar een verband tussen RARβ en metabole herbedrading van melanoom is niet vastgesteld. Hier tonen wij aan dat in primaire menselijke melanocyten all-trans retinoïnezuur (een RARβ-agonist) groeiremming induceerde, gepaard gaande met een afname van zowel het glycolytisch als het oxidatief metabolisme, terwijl selectieve remming van RARβ leidde tot een toename van de basale glycolytische snelheid en een verhoogde gevoeligheid voor remming van de glycolyse. In melanoomcellen bevorderde remming van RARβ een lagere mitochondriale ademhaling en een hogere glycolytische activiteit, wat leidde tot energetische stress en activering van de energiesensor AMP-geactiveerd proteïnekinase. Deze metabole verschuiving verhoogde de gevoeligheid voor zowel glycolytische remming als stimulering van het mitochondriaal metabolisme met dichlooracetaat, een remmer van pyruvaatdehydrogenase kinase. In melanoomcellen met de BRAFV600E-mutatie antagoneerde RARβ-activering het effect van de BRAF-remmer PLX4032 (vemurafenib). Tezamen suggereren deze gegevens dat RARβ-signalering betrokken is bij de regulering van het celmetabolisme in melanoom en een potentieel doelwit kan vormen voor gecombineerde behandelingsstrategieën.
Trefwoorden: melanoom, kankermetabolisme, retinoïnezuurreceptor β, mitochondriale ademhaling, dichlooracetaat
Afkortingen: ATRA: all-trans retinoïnezuur; DCA: dichlooracetaat; ECAR: extracellulaire verzuringssnelheid; OCR: zuurstofconsumptiesnelheid; ROS: reactieve zuurstofsoorten
© Abildgaard et al. Dit is een open-access artikel verspreid onder de voorwaarden van de Creative Commons Naamsvermelding Licentie 3.0 (CC BY 3.0), die onbeperkt gebruik, distributie en reproductie toestaat in elk medium, op voorwaarde dat de oorspronkelijke auteur en bron worden gecrediteerd.
INLEIDING
Melanoom, de meest dodelijke vorm van huidkanker, veroorzaakt jaarlijks 50.000 doden en de incidentie blijft wereldwijd toenemen. Hoewel primair cutaan melanoom te genezen is door chirurgie, wordt de meest gevorderde vorm van de ziekte (stadium IV) geassocieerd met een 10-jaars overleving van 10-15% [1], als gevolg van de beruchte weerstand tegen conventionele antikankertherapie. Recente therapeutische vorderingen omvatten immuuncheckpoint-remmers en therapieën gericht op oncogenen of downstream-effectors van de MAPK-route (bv. BRAF- en MEK-remmers). De ontwikkeling van verworven geneesmiddelenresistentie leidt echter in de meeste gevallen uiteindelijk tot herval [2, 3].
Melanoom ontwikkelt zich vanuit melanine producerende cellen, melanocyten genaamd, door de verwerving van meerdere genomische veranderingen. De meest voorkomende oorzaken van melanoom zijn activerende mutaties in BRAF en NRAS en inactiverende mutaties of deleties in CDKN2A (coderend voor p16INK4A en p14ARF), PTEN en TP53 [4]. Recent bewijs suggereert dat een gemeenschappelijke functie van sommige van deze genen de controle van het celmetabolisme is [5, 6]. Tijdens de progressie van melanoom wordt het cellulaire metabolisme geherprogrammeerd, wat een verschuiving inhoudt van mitochondriale ademhaling naar aërobe glycolyse, wat leidt tot een verhoogd glucoseverbruik en melkzuurproductie (het Warburg-effect) [7]. Verschillende rapporten gebaseerd op in vitro en in vivo modellen van melanoom en klinische studies van melanoompatiënten hebben een verband aangetoond tussen activerende mutaties op codon V600 van BRAF (meestal BRAFV600E) en aerobe glycolyse [8-10]. Op moleculair niveau reguleert BRAFV600E de oxidatieve fosforylering door onderdrukking van de hoofdregulator van mitochondriale biogenese, PGC1α, via remming van de microphthalmia-geassocieerde transcriptiefactor (MITF). Inhibitie van BRAFV600E leidt daarentegen tot oxidatieve verslaving door inductie van PGC1α en verhoogde mitochondriale ademhaling [11]. De overeenkomstige afname van de glycolytische activiteit kan worden gevisualiseerd door PET-CT scanning bij melanoompatiënten die worden behandeld met BRAF-remmers, waarbij een verminderde opname van glucose in het tumorweefsel wordt aangetoond [10]. Fase III klinische studies van de BRAFV600E-remmer vemurafenib (PLX4032) toonden verbeterde algehele en progressievrije overleving aan bij patiënten met metastatisch melanoom [12]. Mitochondriale remmers zijn voorgesteld als nuttige adjuvans voor BRAF-pathway-remmers om het effect te verbeteren of de ontwikkeling van geneesmiddelenresistentie te voorkomen [13-15].
Naast de goed gekarakteriseerde genetische factoren bevat het melanoomgenoom talrijke epigenetische wijzigingen. Een van de steeds terugkerende epigenetische doelwitten in melanoom is RARB, die codeert voor de retinoïnezuurreceptor beta (RARβ) en die in 45-70% van de cutane melanomen door hypermethylering van de promotor tot zwijgen wordt gebracht [ 16, 17]. In cellen van de melanocytaire lijn medieert RARβ retinoïnezuur (vitamine A) geïnduceerde groeiremming en melanogenese, een marker van melanocytaire differentiatie [18]. Wij hebben eerder aangetoond dat activering van RARβ in melanocyten leidt tot upregulatie van p14ARF [17], dat beschermt tegen mitochondriale disfunctie en oxidatieve stress [19]. Hier laten we zien dat menselijke melanocyten reageren op RARβ-activatie door het oxidatieve metabolisme te verminderen, mogelijk als onderdeel van een differentiatierespons. In melanoomcellen antagoneert activering van RARβ het effect van PLX4032, terwijl remming van RARβ glycolytische afhankelijkheid en energetische stress induceert, waardoor de cellen kwetsbaar worden voor behandeling met de pyruvaat dehydrogenase kinase remmer dichlooracetaat (DCA).
RESULTATEN
RARβ-activatie vermindert de groei en metabolische snelheid van melanocyten
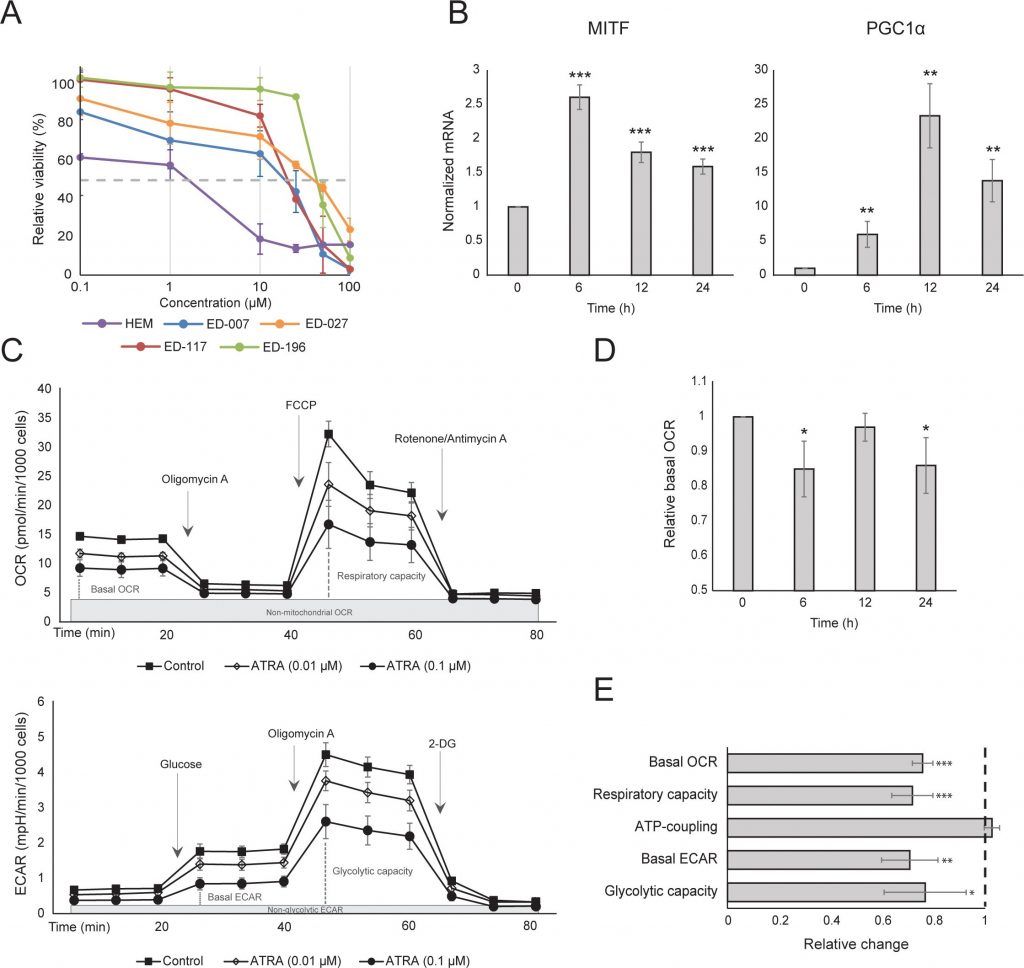
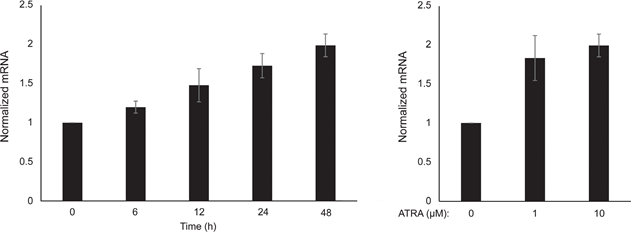
Wij bepaalden eerst het effect van RARβ-activatie op de groei van primaire humane epidermale melanocyten. De cellen werden gedurende 6 dagen behandeld met de RARβ-agonist all-trans retinoic acid (ATRA), en de groeireactie werd bepaald met een op kristalviolet gebaseerde levensvatbaarheidstest. In overeenstemming met eerdere rapporten [17, 20, 21] verminderde ATRA de groei van melanocyten op dosisafhankelijke wijze (figuur 1A), met een IC50 van 2,4 μM (tabel 1). Eerder is aangetoond dat kortdurende behandeling (<24 uur) met ATRA differentiatie en melanogenese in melanocyten induceert, terwijl langdurige blootstelling (>24 uur) de proliferatie vermindert en apoptose induceert [20, 21]. Wij vonden dat ATRA (0,1 μM) voorbijgaande up-regulatie van de melanocytaire lineage-specifieke transcriptiefactor MITF (microphthalmia-geassocieerde transcriptiefactor) induceerde, met een piek in de expressie na 6 uur en vervolgens afnemend tot het basale niveau (figuur 1B). In melanoomcellen regelt MITF de expressie van PGC1α, een marker van een oxidatief fenotype [22]. Daarom onderzochten wij de expressie van PGC1α in melanocyten op verschillende tijdstippen na blootstelling aan ATRA (0,1 μM). Zoals getoond in figuur 1B was PGC1α ook tijdelijk geüpreguleerd, met een vertraging van ~6 uur ten opzichte van MITF.
| Cellen/cellijnen | Cellen/cellijnen | Kenmerken | Kenmerken | Kenmerken | IC50-waarden | IC50-waarden | IC50-waarden | IC50-waarden |
|---|---|---|---|---|---|---|---|---|
| ED-nummer | Naam | BRAF-status* | RARβ expressie** | p14ARF expressie | ATRA (μM) | LE135 (μM) | DCA (mM)*** | PLX4032 (μM) |
| HEM# | WT | + | + | 2.4±1.6 | 2.8±0.8 | 69.1±6.4 | NA | |
| ED-007 | FM-3 | WT | + | – | 18.6±8.7 | 8.6±1.0 | 12.2±2.2 | NA |
| ED-027 | FM-82 | BRAFV600E | + | + | 39.8±5.3 | 10.7±1.3 | 17.7±2.1 | 0.52±0.04 |
| ED-117 | Mel-NT3-00 | BRAFV600E | + | + | 25.5±5.0 | NA | 37.6 ±2.2 | 0.51±0.09 |
| ED-196 | Ma-Mel-51 | BRAFV600E | + | + | 46.2±9.1 | 8.4±0.4 | 35.8±3.2 | 0.26±0.06 |
IC50-waarden vertegenwoordigen het gemiddelde ± standaardafwijking van ≥3 onafhankelijke experimenten.
*Bevestigddoor pyrosequencing
**Bevestigddoor qPCR
***IC50-waarden gepubliceerd door Abildgaard et al. [29]
#Menselijke epidermale melanocyten
Vanwege de rol van PGC1α in de mitochondriale biogenese hebben we vervolgens onderzocht of PGC1α-expressie correleerde met het niveau van de mitochondriale ademhaling. Met het Seahorse XFe96 instrument maten we de zuurstofverbruikssnelheid (OCR) en de extracellulaire verzuringssnelheid (ECAR), die indicatoren zijn van respectievelijk de mitochondriale ademhalingssnelheid en de glycolytische activiteit. OCR en ECAR werden gemeten tijdens de opeenvolgende toevoeging van metabole modulatoren, waardoor de basissnelheden en capaciteiten van de twee energiesystemen konden worden bepaald (figuur 1C). Om inzicht te krijgen in de tijdsafhankelijkheid van ATRA-reacties werden metabole parameters gemeten na zowel kortdurende (6-24 uur) als langdurige (7 dagen) blootstelling. Bij behandeling van melanocyten met ATRA (0,1 μM) gedurende 6 of 24 uur werd de basale OCR verminderd. Na 12 uur behandeling was de OCR echter vergelijkbaar met de uitgangsniveaus (figuur 1D). Deze schommelingen in de metabolische toestand vielen samen met veranderingen in de expressie van MITF en PGC1α. Langdurige blootstelling (7 dagen) aan een lage dosis ATRA (0,01 μM) resulteerde in een verdere afname van zowel de basale OCR als de ademhalingscapaciteit (figuur 1E).
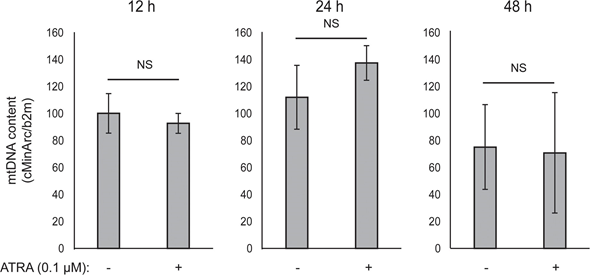
Mitochondriale ATP-koppeling werd niet beïnvloed door ATRA (figuur 1E), waardoor de ATP-productie van de mitochondriën netto afnam. PGC1α blijkt ontkoppelingseiwit 2 (UCP2) te upreguleren, wat leidt tot een lichte mitochondriale ontkoppeling [23, 24]. UCP2-expressie in melanocyten werd niet beïnvloed door ATRA-behandeling (aanvullende figuur 1), wat verder ondersteunt dat de ATP-koppeling onveranderd bleef tijdens RARβ-activering. Expressie van markers van mitochondriale activiteit (COX5A, ATP5g1 en NDUFS3) en mitochondriaal DNA-gehalte werden ook niet beïnvloed door behandeling met ATRA (0,1 μM) gedurende respectievelijk 24 en 48 uur (aanvullende figuren 1 en 2).
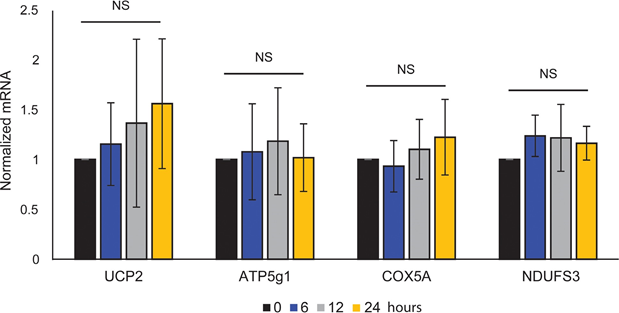
toonde geen statistische significantie (NS).
Er was geen verandering in de glycolytische snelheid na 24 uur ATRA-behandeling (gegevens niet getoond); na 7 dagen waren de basale glycolytische activiteit en de glycolytische capaciteit echter aanzienlijk verminderd (figuur 1E). De onderdrukking van beide belangrijke cellulaire energiesystemen wijst erop dat melanocyten een lagere energiebehoefte vertonen in aanwezigheid van ATRA, hetgeen een gevolg zou kunnen zijn van een verminderde celgroei.
RARβ-remming verhoogt de basale glycolytische snelheid en bevordert glycolytische afhankelijkheid in melanocyten
Eenuitdaging bij het bestuderen van de cellulaire effecten van ATRA is de aanwezigheid van onbekende concentraties vitamine A in foetaal runderserum, een essentiële bron van micronutriënten in de meeste celkweekmedia [25]. Om de rol van RARβ-signalering in het melanocytenmetabolisme nader te bestuderen, gebruikten wij daarom de RARβ-antagonist LE135, die gericht is tegen RARβ met een matige selectiviteit ten opzichte van RARα en een hoge selectiviteit ten opzichte van RARγ en RXRα [26].
Wij herhaalden de Seahorse-protocollen in figuur 1C op melanocyten die gedurende 24 uur en 7 dagen met verschillende concentraties LE135 waren behandeld. Na 24 uur zagen wij een dosisafhankelijke toename van de glycolytische activiteit, waarbij de basale ECAR tot 50% toenam, en een overeenkomstige vermindering van de OCR (figuur 2A). De basale ECAR was nog steeds verhoogd na 7 dagen behandeling (figuur 2B). Er was geen significante toename van de glycolytische capaciteit, wat suggereert dat de cellen gedwongen werden voor de energieproductie een beroep te doen op glycolyse. Dit werd verder ondersteund door een grotere gevoeligheid van deze cellen voor de glycolyse-remmer 2-deoxy-D-glucose (2-DG), in aanwezigheid van LE135 (figuur 2C).
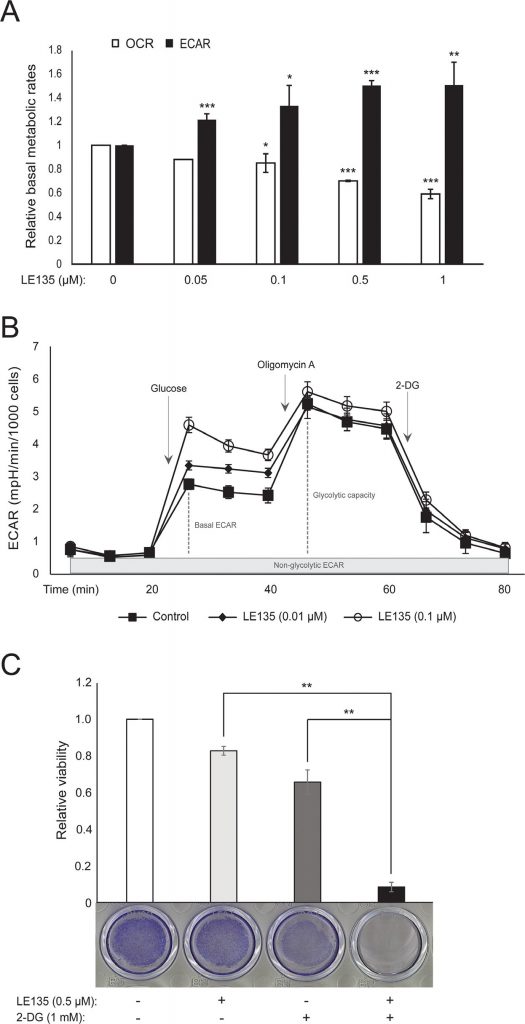
ATRA antagoniseert het effect van BRAF-remming in melanoomcellen
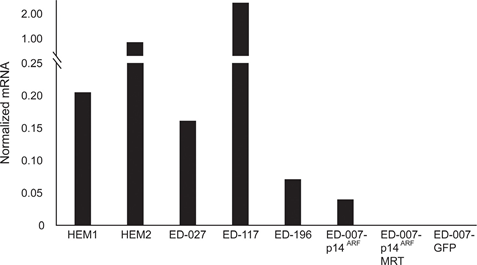
RARB is in veel melanomen tot zwijgen gebracht door hypermethylering van de promotor, hetgeen suggereert dat het tumoronderdrukkende eigenschappen bezit [16]. In een eerdere studie van genetische en epigenetische gebeurtenissen in 110 melanoomcellijnen vonden wij een prevalentie van 66% voor BRAF-mutaties en 45% voor RARB-promotorhypermethylering, zonder correlatie tussen deze twee gebeurtenissen [17]. Ter uitbreiding van deze gegevens onderzochten wij de RARβ-expressie in 84 van deze melanoomcellijnen en in menselijke epidermale melanocyten. De expressieniveaus varieerden sterk tussen de melanoomcellijnen, variërend van volledig ontbreken van expressie tot niveaus die tot 27 maal hoger waren dan die van melanocyten (figuur 3A). Zoals verwacht ging hypermethylering van de RARB-promotor gepaard met lage tot niet-detecteerbare niveaus van RARβ-expressie, op enkele uitzonderingen na. Er was geen verband tussen BRAFV600E-mutaties en RARβ-expressieniveaus (figuur 3A), hetgeen suggereert dat de gevoeligheid van melanoomcellen voor ATRA onafhankelijk kan zijn van de BRAF-status.
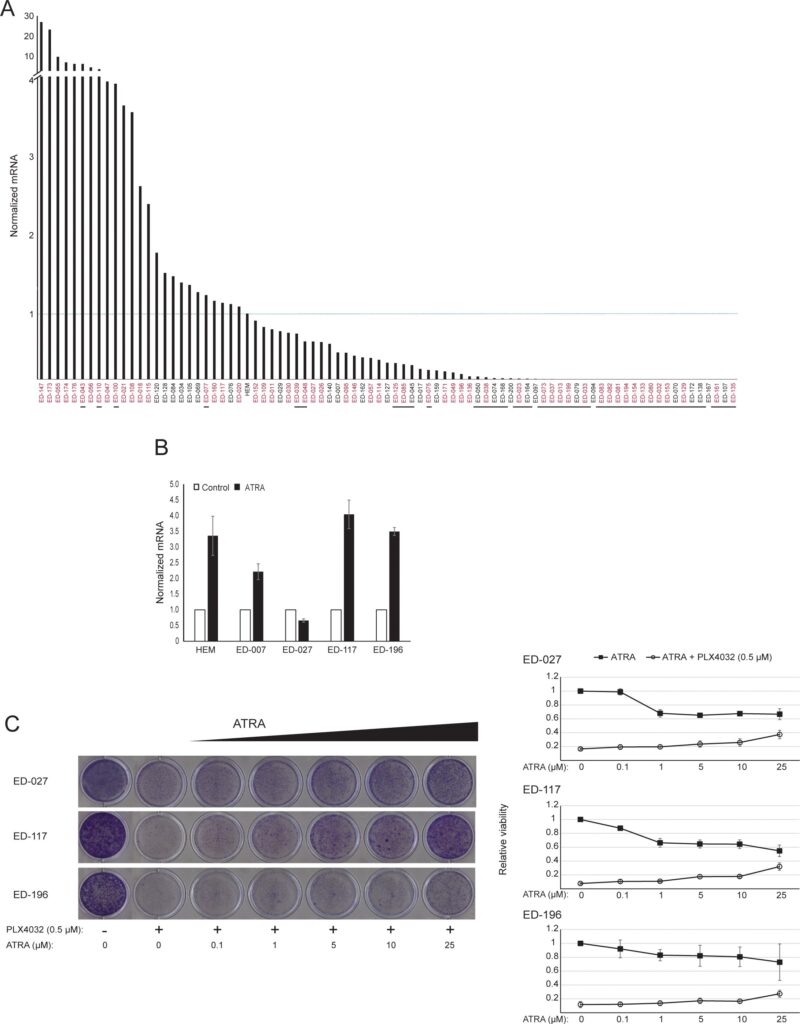
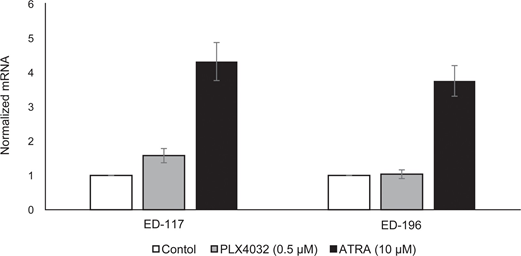
Om de rol van RARβ-signalering in melanoom verder te bestuderen, selecteerden wij vier RARβ-positieve melanoomcellijnen (ED-007, ED-027, ED-117 en ED-196) voor functionele analyse. Drie van deze cellijnen waren BRAFV600E gemuteerd (ED-027, ED-117 en ED-196) en één was BRAF wild type (ED-007). Behandeling met ATRA leidde tot verminderde groei van alle vier de cellijnen (figuur 1A), hoewel hun gevoeligheid lager was dan die van melanocyten, zoals blijkt uit de IC50-waarden (tabel 1). Het is bekend dat RARβ-expressie wordt geïnduceerd in reactie op ATRA [27]. Zoals blijkt uit figuur 3B, werd RARβ geïnduceerd in 3 van de vier melanoomcellijnen. Ondanks een meer uitgesproken RARβ-inductie in ED-117 en ED-196 werd het effect van ATRA op de expressie van MITF en PGC1α afgezwakt in vergelijking met melanocyten (aanvullende figuur 3). Eerder werd aangetoond dat onderdrukking van de MITF/PGC1α-as een gevolg is van oncogene BRAF-activiteit [11], hetgeen zou kunnen bijdragen tot een lagere respons op ATRA. In overeenstemming met dit idee vertoonden de BRAF-wildtype cellen de hoogste gevoeligheid voor ATRA, hoewel nog steeds aanzienlijk lager dan melanocyten (tabel 1).
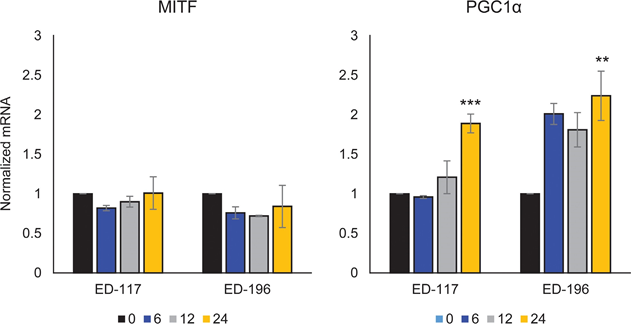
Om te onderzoeken of targeting van BRAF met PLX4032 de gevoeligheid voor ATRA zou herstellen, behandelden wij de BRAFV600E-mutante melanoomcellijnen met PLX4032 in een concentratie dicht bij de IC50-waarden (zie tabel 1) in combinatie met oplopende concentraties ATRA (0,1-25 μM). Interessant is dat ATRA het cytotoxische effect van PLX4032 in alle cellijnen redde. Het dosisafhankelijke effect van ATRA op de groei van met PLX4032 behandelde melanoomcellen (figuur 3C) wijst op antagonisme tussen beide verbindingen. Behandeling met PLX4032 (0,5 μM) verminderde de RARβ-expressie niet (aanvullende figuur 4), wat wijst op een ander mechanisme voor dit antagonisme.
Het effect van ATRA op het celmetabolisme wordt beïnvloed door de p14ARF-status
De waarneming dat zowel ATRA als PLX4032 de mitochondriale biogenese beïnvloeden, zou kunnen wijzen op een metabole verklaring voor het antagonistische effect van deze verbindingen. Eerder werd aangetoond dat p14ARF tot expressie komt als cytoplasmatisch eiwit in normale melanocyten en deze cellen beschermt tegen disfunctionele mitochondriën [19]. In overeenstemming met eerdere bevindingen [17] verhoogde ATRA de expressie van p14ARF in RARβ-positieve melanoomcellen (aanvullende figuur 5). Paradoxaal genoeg, hoewel p14ARF vaak verloren gaat in melanoom door deletie van de CDKN2A locus, is het niet mogelijk ARF stabiel uit te schakelen in melanoomcellen die dit gen tot expressie brengen [17]; en gegevens niet getoond). Om de potentiële rol van p14ARF bij het mediëren van een cellulaire respons op ATRA te bestuderen, transfecteerden wij in plaats daarvan de p14ARF-deficiënte ED-007 melanoomcellijn stabiel met een EGFP-p14ARF construct. De expressie van p14ARF in de getransfecteerde cellen werd geverifieerd met qPCR (aanvullende figuur 6). Seahorse analyse toonde verschillende metabole profielen (figuur 4A) met een aanzienlijk lagere basale OCR en ademhalingscapaciteit in cellen met herstelde p14ARF expressie in vergelijking met controle getransfecteerde cellen (figuur 4B). Interessant is dat p14ARF-drukkende cellen ook een verhoogde gevoeligheid voor ATRA vertoonden (figuur 4C).
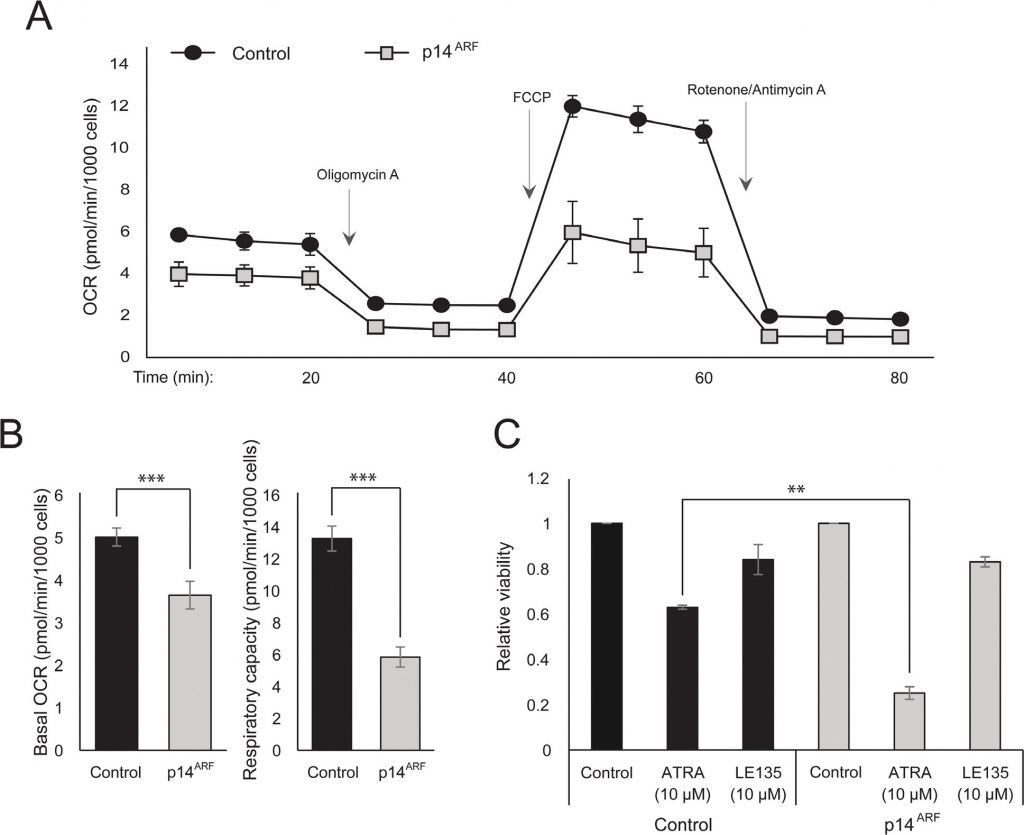
Blokkering van RARβ induceert glycolytische afhankelijkheid en energetische stress in melanoomcellen en maakt hen gevoelig voor dichlooracetaat
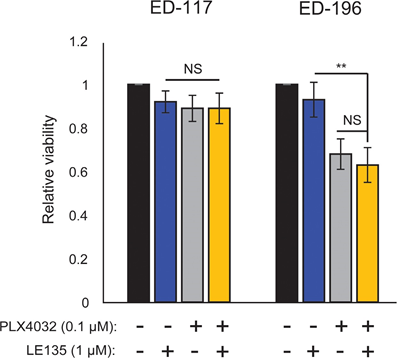
Op basis van de bevinding van een antagonistisch effect tussen PLX4032 en ATRA hebben wij het gecombineerde effect van PLX4032 en LE135 getest op potentieel synergisme in ED-117- en ED-196-melanoomcellen. In de hier gebruikte experimentele opzet (6 dagen behandeling met PLX4032 [0,1 μM] en LE135 [1 μM]; aanvullende figuur 7) werd geen coöperatieve remming van de melanoomgroei aangetoond.
Om het effect van RARβ-remming op het melanoommetabolisme verder te bestuderen, hebben wij OCR en ECAR gemeten in RARβ-positieve melanoomcellijnen die met LE135 waren behandeld. Net als bij melanocyten (figuur 2A-2B) verhoogde LE135 de basale glycolytische snelheid en verminderde de basale mitochondriale ademhaling in melanoomcellen (figuur 5A-5B). Deze metabole verschuiving, die in overeenstemming is met het Warburg-effect, was duidelijker in melanoomcellen dan in melanocyten, en leidde tot een verhoging van de basale glycolytische snelheid om de maximale capaciteit te bereiken. Dit werd geïllustreerd door het onvermogen om ECAR verder te verhogen na toevoeging van oligomycine A, wat wijst op een gebrek aan metabole flexibiliteit (figuur 5B). Om het effect van LE135 op de cellulaire bioenergetica te onderzoeken, onderzochten wij de fosforyleringsstatus van AMP-geactiveerd proteïnekinase (AMPK). AMPK detecteert de cellulaire energiestatus door te reageren op hoge niveaus van AMP, dat zich ophoopt naarmate de ATP/ADP-ratio daalt. Zo kan een verminderde energieproductie of een verhoogd energieverbruik een stijging van AMP bevorderen, dat zich bindt aan AMPK en leidt tot de fosforylering en activering ervan [28]. Behandeling van melanoomcellijnen met LE135 leidde tot fosforylering van AMPK, wat aangeeft dat de cellen onder energetische stress staan. De stijging van de p-AMPK-niveaus was al na 2 uur zichtbaar en nam verder toe tot minstens 48 uur (figuur 5C). Deze bevindingen verschilden van die in melanocyten, waar behandeling met LE135 niet leidde tot activering van AMPK (aanvullende figuur 8). Zowel melanoomcellen als melanocyten vertoonden een vermindering van de celgroei gedurende 6 dagen behandeling met LE135 (IC50-waarden in tabel 1). Bovendien maakte LE135, net als melanocyten, melanoomcellen gevoelig voor glycolytische remming met 2-DG (figuur 5D).
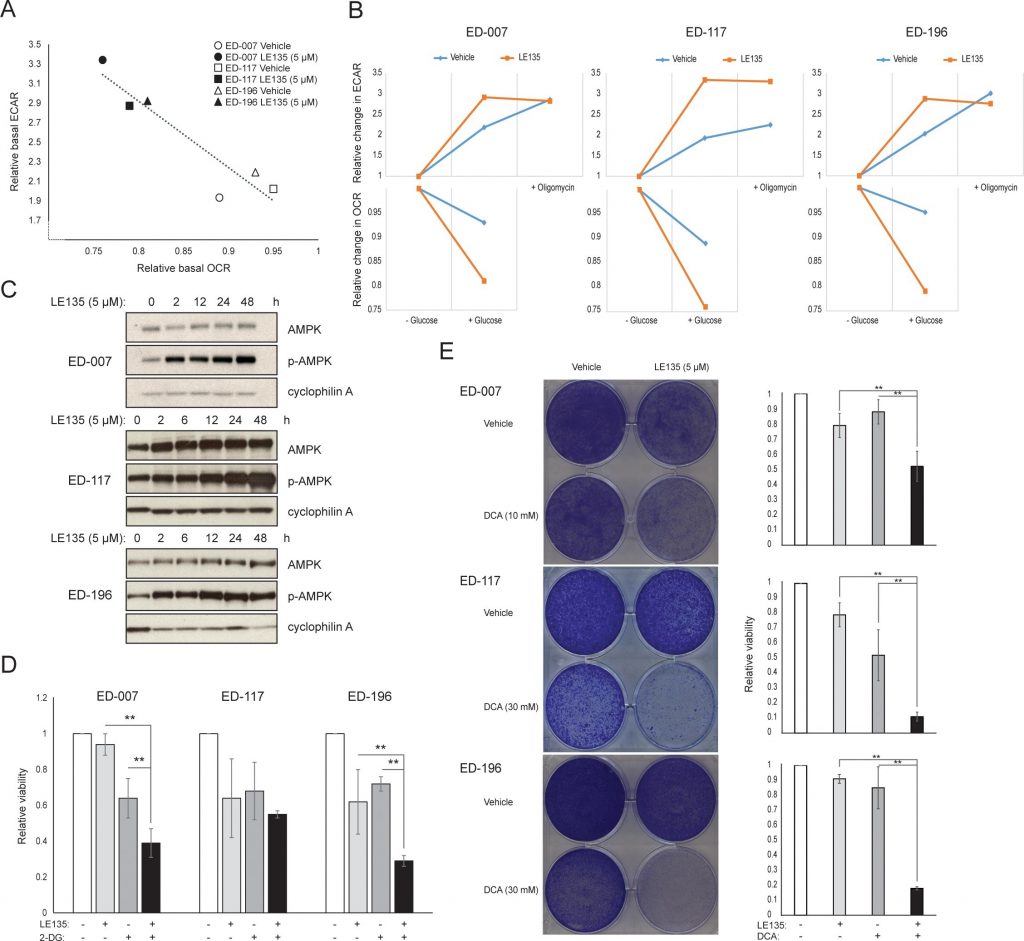
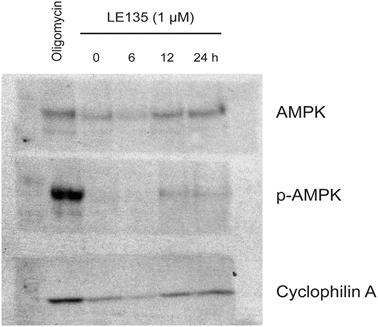
De inductie van energiespanning met LE135 in melanoomcellen maar niet in melanocyten wijst op een mogelijke therapeutische relevantie van deze verbinding in combinatiebehandelingsstrategieën. Van de pyruvaatdehydrogenase kinase-remmer DCA is eerder aangetoond dat deze de groei van melanoomcellen remt door een verschuiving in het metabolisme teweeg te brengen, weg van de glycolyse, waardoor de cellen afhankelijk worden van mitochondriale ademhaling [9,29-32]. Bovendien is aangetoond dat DCA de groei van een reeks melanoomcellijnen remt, onafhankelijk van de BRAF-status en de gevoeligheid voor PLX4032 [29]. Om het gecombineerde effect van LE135 en DCA te bestuderen, pasten wij concentraties toe die lager waren dan de respectieve IC50-waarden voor elk van de drie melanoomcellijnen (zie tabel 1). Ondanks een laag effect op de groeivermindering van elke verbinding afzonderlijk (9-21% voor LE135 en 12-48% voor DCA), leidde de combinatie tot een vermindering tot 89% (figuur 5E). Deze resultaten suggereren dat de tegengestelde effecten van LE135 (bevordering van glycolytische afhankelijkheid) en DCA (verschuiving van de cellen weg van glycolyse) synergetisch kunnen werken om de groei van het melanoom te remmen.
DISCUSSIE
ATRA en andere vitamine A-derivaten verminderen de celgroei en induceren de expressie van differentiatiemarkers in diverse weefsels [33, 34]. Wij vonden dat ATRA in primaire menselijke melanocyten voorbijgaande upregulatie van de MITF/PGC1α-as induceert, in overeenstemming met de door ATRA geïnduceerde toename van de mitochondriale functie die is waargenomen in andere celtypen zoals adipocyten en hepatocyten [35-37]. Langdurige behandeling met lage concentraties ATRA leidde echter tot vermindering van de celgroei en de metabolische snelheid, zoals bepaald door lagere basale glycolyse en lagere mitochondriale ademhaling. Deze metabole veranderingen in reactie op ATRA weerspiegelen waarschijnlijk een differentiatierespons naar de niet-proliferatieve toestand die melanocyten in de huid kenmerkt. Het blokkeren van RARβ-signalering in deze cellen resulteerde in een toename van de basale glycolytische snelheid en een overeenkomstige afname van het oxidatieve metabolisme. Het selectieve voordeel van het verlies van de RARβ-functie in melanomen, bijvoorbeeld door hypermethylering van RARB, zou verband kunnen houden met de overgang naar een meer glycolyse-afhankelijk fenotype dat het Warburg-effect ondersteunt.
In tegenstelling tot de situatie in primaire melanocyten leidde het blokkeren van RARβ-signalering in melanoomcellen tot energetische stress, zoals blijkt uit de activering van AMPK. Deze respons zou het gevolg kunnen zijn van een lagere capaciteit van melanoomcellen om de glycolyse te verhogen in vergelijking met melanocyten. Terwijl melanocyten een relatief laag basaal glycolytisch niveau hebben en naar een hogere activiteit kunnen overschakelen wanneer dat nodig is, worden melanoomcellen gekenmerkt door een hoge glycolytische snelheid die dicht bij hun maximale capaciteit ligt. Melanocyten kunnen zich dus flexibeler aanpassen aan remming van de RARβ-signalering om het energieniveau op peil te houden. Dit wijst erop dat er een relevant therapeutisch venster bestaat voor LE135 en andere RARβ-remmers in combinatietherapieën, bijvoorbeeld met DCA. Vergelijkbaar met de metabole effecten van BRAF-remming schakelt DCA kankercellen om van glycolyse naar mitochondriale ademhaling [9, 38, 39], maar in tegenstelling tot PLX4032 is het effect van DCA niet beperkt tot BRAF-gemuteerde melanomen [29]. In een eerdere studie toonden wij aan dat de door DCA geïnduceerde metabole verschuiving correleerde met een verlaging van de ATP-niveaus, wat suggereert dat DCA de bio-energetische homeostase van melanoomcellen zou kunnen aanpakken [29]. Hier vonden wij dat de combinatie van LE135 en DCA gezamenlijk de groei van melanoomcellen die de RARβ-receptor tot expressie brengen, verminderde. Behandeling van melanoomcellen met ofwel DCA ofwel LE135 zou hen een venster kunnen bieden om zich aan te passen aan de nieuwe metabolische eisen, terwijl een combinatie van de behandelingen de metabolische flexibiliteit zou beperken en hen niet in staat zou stellen de voor voortdurende groei vereiste energieproductie in stand te houden.
In veel melanomen is de expressie van PGC1α laag door onderdrukking van MITF door oncogene BRAF-mutaties [11]. Dit fenotype ondersteunt het Warburg-effect door de cellen te dwingen over te schakelen op glycolyse voor energieproductie. Behandeling met BRAF-remmers herstelt de expressie van PGC1α en verschuift het stofwisselingspatroon terug naar mitochondriale ademhaling [11, 40]. Het cytotoxische effect van BRAF-remming kan worden versterkt door de aanwezigheid van disfunctionele mitochondriën in melanoomcellen, wat resulteert in verhoogde ROS-productie [13, 41]. Wij vonden dat ATRA de groei van melanoomcellen versterkt in aanwezigheid van de BRAF-remmer PLX4032. Op basis van kennis uit eerdere studies [11, 17, 19, 41] en de hier gepresenteerde bevindingen stellen wij een model voor dat de metabole effecten van PLX4032 en ATRA integreert en hun antagonisme verklaart (figuur 6). Het model suggereert een tweeledige rol van verhoogde RARβ-signalering, die leidt tot activering van PGC1α en mitochondriale biogenese, terwijl tegelijkertijd OCR en ROS-productie worden onderdrukt door inductie van p14ARF. Het model werd ondersteund door bevindingen in deze en een eerdere studie [17] waaruit blijkt dat behandeling met ATRA de expressie van p14ARF induceert, en dat reconstitutie van p14ARF-deficiënte melanoomcellen met wild-type p14ARF de OCR verlaagt en de gevoeligheid voor ATRA verhoogt. ATRA zou dus de gevoeligheid van RARβ-positieve melanomen voor PLX4032 kunnen verminderen door de cytotoxiciteit van de ROS-productie te beperken. Vitamine A is voorgesteld voor profylactische en therapeutische doeleinden bij vele soorten kanker, waaronder melanoom [42]. Hoewel klinische validatie ontbreekt, pleiten onze resultaten tegen het gebruik van vitamine A-suppletie bij melanoompatiënten die worden behandeld met BRAF-remmers, vanwege het mogelijke antagonistische effect.
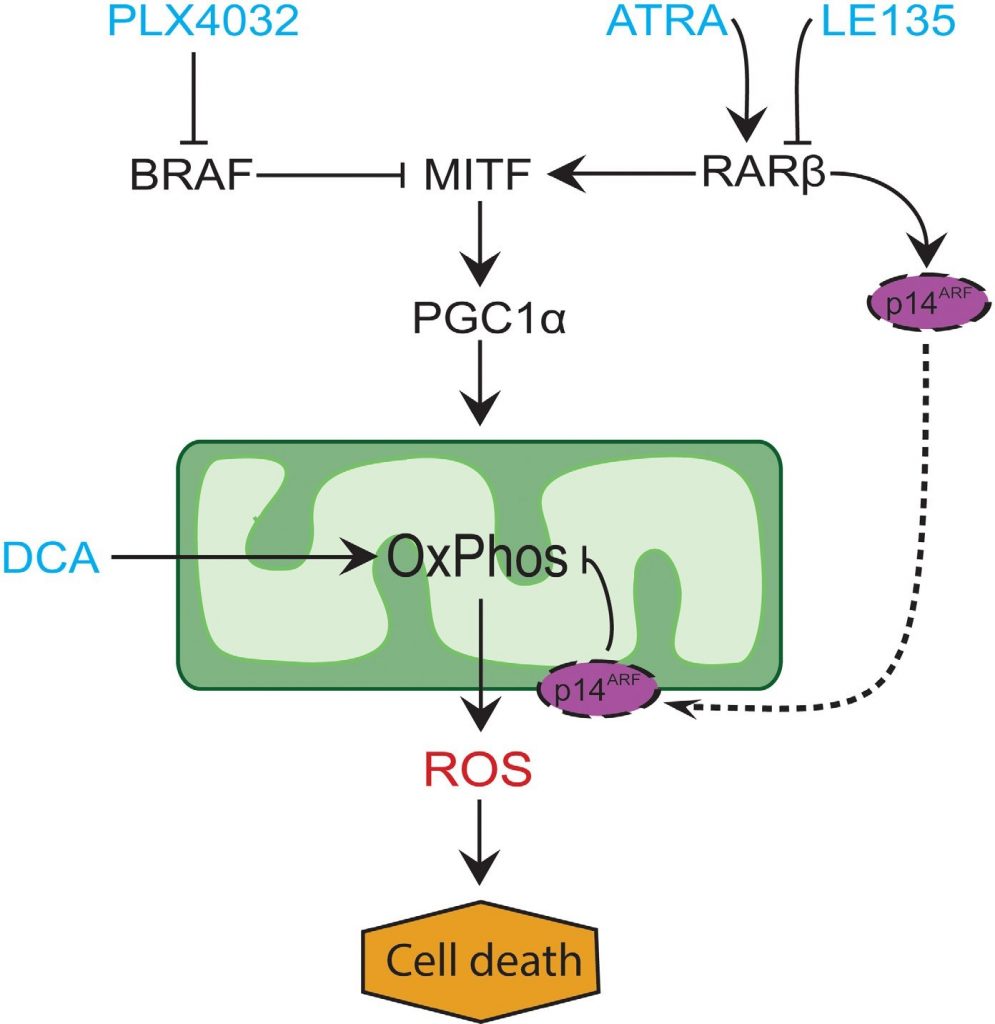
Kortom, wij hebben een nieuwe functie van RARβ-signalering in het melanocytaire en melanoomcelmetabolisme ontdekt, die klinische implicaties zou kunnen hebben. Het vermogen van RARβ om de MITF-PGC1α pathway te activeren, en mogelijk een p14ARF-afhankelijke vermindering van de mitochondriale ademhalingsactiviteit, beïnvloedt de therapeutische respons op BRAF-remming negatief. Het blokkeren van RARβ signalering bevordert echter de glycolytische afhankelijkheid in melanoomcellen en versterkt het effect van DCA, hetgeen mogelijk therapeutisch kan worden benut.
MATERIALEN EN METHODEN
Reagentia
Natriumdichlooracetaat (DCA), 2-deoxy-D-glucose (2-DG), all-trans retinoïnezuur (ATRA) en LE135 werden gekocht bij Sigma-Aldrich. DCA en 2-DG werden opgelost in dH2Otot een werkvoorraadconcentratie van 1 M. ATRA en LE135 werden opgelost in DMSO tot een werkvoorraadconcentratie van 0,1 M. PLX4032 (vemurafenib) werd gekocht bij Selleck Chemicals en opgelost in DMSO tot een werkvoorraadconcentratie van 0,05 M.
Celcultuur
Melanoomcellijnen werden verkregen uit de European Searchable Tumor Line Database (ESTDAB, ED) [43]. De status van deze cellijnen met betrekking tot BRAF-mutaties en RARB-promoter-methylering is eerder beschreven [17]. Primaire menselijke epidermale melanocyten (neonataal) van licht gepigmenteerd weefsel (HEMn-LP; melanocyten genoemd) werden gekocht bij Invitrogen (C0025C). Melanocyten van drie verschillende individuen werden gebruikt voor de experimenten (lotnr. 200706893 van mrt. 2015 en nov. 2016; lotnr. 1583282 van feb. 2017). Melanoomcellijnen werden gekweekt bij 37°C onder 5%CO2 in RPMI-1640 medium aangevuld met 10% foetaal runderserum. HEMn-LP cellen werden onder dezelfde omstandigheden gekweekt in 254CF medium aangevuld met 1% human melanocyte growth supplement (HMGS) inclusief phorbol 12-myristate 13-acetate (PMA). Voor experimentele opstellingen werden HEMn-LP-cellen gekweekt in medium aangevuld met HMGS-2 (zonder PMA). Alle media en supplementen werden gekocht van Invitrogen.
Analyse van de levensvatbaarheid van de cellen
Eenkristalviolettest werd toegepast om het effect van de bestudeerde verbindingen op de levensvatbaarheid van de cellen te evalueren. De cellen werden in duplo uitgezaaid en gedurende 6 dagen behandeld met de relevante verbindingen of voertuigcontrole. Het medium en de behandelde verbindingen werden om de 48 uur vervangen. Na de behandelingsperiode werden medium en niet-aangesloten cellen verwijderd, en de resterende cellen werden gewassen in PBS en gedurende 15 minuten gefixeerd met glutaaraldehyde. De gefixeerde cellen werden geïncubeerd met kristalvioletoplossing (0,1% kristalviolet, 20% CH3OH) gedurende 1 uur. De hoeveelheid kleurstof die door de monolaag werd opgenomen, evenredig met het aantal levensvatbare cellen dat aan de putbodem was gehecht, werd gekwantificeerd door de kleur te extraheren met 10% azijnzuur en de absorptie te meten bij een golflengte van 595 nm. De relatieve levensvatbaarheid na behandeling met ATRA, LE135 of PLX4032 werd gebruikt om de halfmaximale remmende concentratie (IC50) te bepalen. Door de dosis-responscurve uit te zetten, werd de IC50-waarde geschat als de concentratie op het punt van 50% levensvatbaarheid van de cellen.
DNA- en RNA-zuivering
DNA voor kwantificering van mtDNA en RNA voor cDNA-synthese werden gelijktijdig gezuiverd met AllPrep DNA/RNA/Proteïne-minikit (Qiagen) volgens het bijgeleverde protocol.
Expressieanalyse
Synthese van cDNA werd uitgevoerd met de qScript™ XLT cDNA SuperMix (Quanta Bioscience). De genexpressie van PGC1α, MITF, RARβ, p14ARF, UCP2, ATP5g1, COX5A en NDUFS3 werd bepaald met kwantitatieve real-time PCR op Roche LightCycler 2.0 met behulp van de LightCycler FastStart DNA MasterPLUS SYBR Green I kit (Roche). De primers staan vermeld in aanvullende tabel 1.
| Gen | Voorwaartse primer | Omgekeerde primer |
| PGC1α* | GTAAATCTGCGGGATGG | AATTGCTTGCGTCCACAAA |
| MITF** | CCGTCTCTCACTGGATTGGT | TACTTGGTGGGGTTTTCGAG |
| p14ARF*** | CCCTCGTGCTGATGCTACTGA | CATGACCTGGTCTTCTAGGAAGC |
| RARβ*** | TCCTGGATTTCTACACTGCG | AAGCAGGGTTTGTACACTCG |
| UCP2 | AAGACCATTGCCCGAGAGG | TTGGCTTTCAGGAGGGCAT |
| ATP5g1* | ATCATTGGCTATGCCAGGAA | ATGGCGAAGAGGATGAGGA |
| COX5A* | GGGAATTGCGTAAAGGGATAA | TCCTGCTTTGTCCTTAACAACC |
| NDUFS3* | GCTGACGCCCATTGAGTCTG | GGAACTCTCTTGGGCCAACTCC |
| RPLP0 | ACTAAAATCTCCAGGGGCACC | ATGACCAGCCCAAAGGAGAA |
*Primer-sequenties gepubliceerd door Vazquez et al. 2013 [22].
**Primer-sequenties gepubliceerd door Haq et al. 2014 [11].
***Primer-sequenties gepubliceerd door Dahl et al. 2013 [17].
Immunoblotting
Monsterswerden bereid uit celcultuurkolven met lysisbuffer (SLB) aangevuld met kleurloze β-mercaptoethanol (BPB), fosfostop en proteaseremmer (Thermo Fisher Scientific). Cellysaten werden gezuiverd door centrifugatie bij 20.000 rpm gedurende 3 min. De eiwitconcentratie werd gemeten met de Qubit Protein Assay Kit (Thermo Fisher Scientific), en 50 μg eiwit van elk monster werd geladen op een 10-well SDS, 4-12% Bis-Tris NuPage gel (Invitrogen). Eiwitten werden vervolgens gescheiden bij 80 V gedurende 30 minuten, gevolgd door 110 V tot voltooiing. Blotting werd uitgevoerd met een halfdroge transfer op een ECL-nitrocellulosemembraan bij 3,3 mA/1 cm2/1 h/gel. Daarna werd het membraan gekleurd met Ponceau. Het membraan werd geblokkeerd in 5% melk gedurende 1 uur, vervolgens tweemaal gedurende 5 minuten gewassen met TBST en gekleurd met anti-AMPK of anti-p-AMPK (Thr172) antilichamen (Cell Signaling; 1:2000) in 5% BSA bij 4°C en met een anti-cyclophilin A antilichaam (Cell Signaling; 1:5000) als laadcontrole. Na drie wascycli van 10 minuten met TBST werd het membraan gekleurd met het secundaire antilichaam (anti-rabbit; DakoCytomation; 1:2000) gedurende 1 uur bij kamertemperatuur, gevolgd door nog eens 3 wascycli. Eiwitten werden gevisualiseerd met ECL Plus Western Blotting Substrate (Thermo Fisher Scientific) 1:1 gedurende 2-3 minuten.
Metabole analyse
Metabole analyse werd uitgevoerd op melanoomcellijnen en melanocyten met een Seahorse XFe96 analyzer (Seahorse Bioscience, Billerica, MA), die real-time metingen verricht van de extracellulaire verzuring (ECAR) en het zuurstofverbruik (OCR). De cellen werden met 20.000 per well in Seahorse Cell Culture Microplates gezaaid, 24 uur voor de metingen. Veranderingen in de basisactiviteit en de capaciteit van de mitochondriale en glycolytische energiesystemen werden bepaald met behulp van de Mito Stress Test Kit en de Glycolysis Stress Test Kit (Agilent Technologies). De tests werden uitgevoerd volgens de verstrekte protocollen. De Mito Stress Test werd uitgevoerd in het gewone kweekmedium, terwijl bij de glycolyse stress test het medium werd vervangen door Seahorse XF Base medium aangevuld met L-glutamine (2 mM), pH aangepast tot 7,4, 1 uur voor de metingen. Voor langere blootstellingen (> 24 uur) werden de cellen behandeld in kweekflessen vóór het zaaien. Alle resultaten werden genormaliseerd naar het aantal gezaaide cellen, aangezien de gebruikte concentraties ATRA en LE135 geen invloed hadden op de celgroei gedurende 24 uur. Het protocol voor het uitvoeren van de assays in de Seahorse-machine omvatte cycli van 3 min mengen/3 min meten. Er werden drie onafhankelijke experimenten uitgevoerd met 6 herhalingen van elk monster.
Transfectie
De ED-007 melanoomcellijn werd getransfecteerd met pEGFP (controle) of pEGFP-p14ARF expressievectoren (2 ug vector/2 ×106 cellen), beide met GFP als reportergen. De constructen werden verkregen zoals eerder beschreven [19]. Transfectie werd uitgevoerd met behulp van de Amaxa nucleofectietechnologie, buffer V, programma T-020, volgens het door de fabrikant aanbevolen protocol. Succesvolle transfectie werd visueel geverifieerd. Stabiele klonen werden geselecteerd met behulp van 400 ug/ml G418 (geneticine; Thermo Fisher Scientific). In de experimentele opzet werden de cellen gezaaid zonder G418.
Kwantificering van mitochondriaal DNA
MitochondriaalDNA werd gekwantificeerd door druppelvormige digitale polymerasekettingreactie (ddPCR) met behulp van het QX200-systeem (BioRad Laboratories, Hercules, CA, USA). Voor elke reactie werd ongeveer 0,5 ng DNA gebruikt. Het mitochondriale kopiegetal werd bepaald door de verhouding te berekenen tussen een mitochondriale DNA-plaats (mtMinArc) en een nucleaire locus met één kopie (β2m), zoals beschreven door Phillips et al. [44]. Primers, probes en experimentele omstandigheden staan vermeld in aanvullende tabel 2.
| mtMinArc | β2m | |
| Voorwaartse primer* | CTAAATAGCCCACGTTCCC | GCTGGGTAGCTCTAAACAATGTATTCA |
| Omgekeerde primer* | AGAGCTCCCGTGAGTGGTTA | CCATGTACTAACAAATGTCTAAAATGGT |
| Probe* | 6FAM-CATCACGATGGATCACAGGT(NFQ) | VIC-CAGCAGCCTATTCTGC(NFQ) |
| Primer conc. | 75 nM | 500 nM |
| Uitgloeitemp. | 50°C | 52°C |
| Aantal cycli | 40 | 40 |
*Primer- en probe-sequenties gepubliceerd door Phillips et al. [44].
Statistische analyse
Verschillen tussen onafhankelijke datasets werden bepaald met de Student’s t-test. Voor de statistische analyse van de variantie tussen de verschillende behandelingen werd gebruik gemaakt van one-way matched-samples ANOVA. Tukey’s honest significance difference (HSD) multi-vergelijkingstest werd gebruikt om de statistische significantie te bepalen.
Bijdragen van de auteurs
CA en PG planden en organiseerden het onderzoek. CA voerde het merendeel van de experimenten en de verwerking van gegevens uit, waaronder celkweek, behandelingsprotocollen, metabole analyse en statistiek. CD plande en voerde de EGFP-p14ARF transfectie en mtDNA metingen uit en hielp bij de interpretatie van de resultaten. AA voerde immunoblotting- en kwantitatieve PCR-protocollen uit en optimaliseerde deze. AC voerde celkweek assays uit. CA en PG schreven het manuscript met bijdragen en bewerkingen van CD, AA en AC. Het definitieve manuscript werd door alle auteurs gelezen en goedgekeurd.
BELANGENCONFLICTEN
De auteurs verklaren dat zij geen belangenconflicten hebben.
FINANCIERING
Deze studie werd ondersteund door de Deense Kankerbestrijding
VERWIJZINGEN
1 Overlevingspercentages voor melanoom huidkanker, per stadium. (cancer.org: American Cancer Society).2 Nazarian R, Shi H, Wang Q, Kong X, Koya RC, Lee H, Chen Z, Lee MK, Attar N, Sazegar H, Chodon T, Nelson SF, McArthur G, et al. Melanomen verwerven resistentie tegen B-RAF (V600E) remming door RTK of N-RAS upregulatie. Nature. 2010; 468: 973-7. https://doi.org/10.1038/nature09626.
3 Johannessen CM, Boehm JS, Kim SY, Thomas SR, Wardwell L, Johnson LA, Emery CM, Stransky N, Cogdill AP, Barretina J, Caponigro G, Hieronymus H, Murray RR, et al. COT drijft resistentie tegen RAF-inhibitie op via reactivering van MAP-kinase pathway. Nature. 2010; 468: 968-72. https://doi.org/10.1038/nature09627.
4 Miller AJ, Mihm MC Jr. Melanoma. N Engl J Med. 2006; 355: 51-65. https://doi.org/10.1056/NEJMra052166.
5 Abildgaard C, Guldberg P. Molecular drivers of cellular metabolic reprogramming in melanoma. Trends Mol Med. 2015; 21: 164-71. https://doi.org/10.1016/j.molmed.2014.12.007.
6 Ratnikov BI, Scott DA, Osterman AL, Smith JW, Ronai ZA. Metabole herbedrading in melanoom. Oncogene. 2017; 36: 147-57. https://doi.org/10.1038/onc.2016.198.
7 Warburg O, Wind F, Negelein E. The metabolism of tumors in the body. J Gen Physiol. 1927; 8: 519-30.
8 Hall A, Meyle KD, Lange MK, Klima M, Sanderhoff M, Dahl C, Abildgaard C, Thorup K, Moghimi SM, Jensen PB, Bartek J, Guldberg P, Christensen C. Disfunctionele oxidatieve fosforylering maakt kwaadaardige melanoomcellen verslaafd aan glycolyse aangedreven door het (V600E) BRAF oncogen. Oncotarget. 2013; 4: 584-99. https://doi.org/10.18632/oncotarget.965.
9 Parmenter TJ, Kleinschmidt M, Kinross KM, Bond ST, Li J, Kaadige MR, Rao A, Sheppard KE, Hugo W, Pupo GM, Pearson RB, McGee SL, Long GV, et al. Response of BRAF-mutant melanoma to BRAF inhibition is mediated by a network of transcriptional regulators of glycolysis. Cancer Discov. 2014; 4: 423-33. https://doi.org/10.1158/2159-8290.CD-13-0440.
10 McArthur GA, Puzanov I, Amaravadi R, Ribas A, Chapman P, Kim KB, Sosman JA, Lee RJ, Nolop K, Flaherty KT, Callahan J, Hicks RJ. Marked, homogene en vroege [18F]fluorodeoxyglucose-positron emissie tomografie respons op vemurafenib in BRAF-mutant gevorderd melanoom. J Clin Oncol. 2012; 30: 1628-34. https://doi.org/10.1200/JCO.2011.39.1938.
11 Haq R, Shoag J, Andreu-Perez P, Yokoyama S, Edelman H, Rowe GC, Frederick DT, Hurley AD, Nellore A, Kung AL, Wargo JA, Song JS, Fisher DE, et al. Oncogene BRAF reguleert oxidatief metabolisme via PGC1alpha en MITF. Cancer Cell. 2013; 23: 302-15. https://doi.org/10.1016/j.ccr.2013.02.003.
12 Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, Dummer R, Garbe C, Testori A, Maio M, Hogg D, Lorigan P, Lebbe C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med. 2011; 364: 2507-16. https://doi.org/10.1056/NEJMoa1103782.
13 Corazao-Rozas P, Guerreschi P, Jendoubi M, Andre F, Jonneaux A, Scalbert C, Garcon G, Malet-Martino M, Balayssac S, Rocchi S, Savina A, Formstecher P, Mortier L, et al. Mitochondrial oxidative stress is the Achille’s heel of melanoma cells resistant to Braf-mutant inhibitor. Oncotarget. 2013; 4: 1986-98. https://doi.org/10.18632/oncotarget.1420.
14 Zhang G, Frederick DT, Wu L, Wei Z, Krepler C, Srinivasan S, Chae YC, Xu X, Choi H, Dimwamwa E, Ope O, Shannan B, Basu D, et al. Targeting mitochondrial biogenesis to overcome drug resistance to MAPK inhibitors. J Clin Invest. 2016; 126: 1834-56. https://doi.org/10.1172/JCI82661.
15 Livingstone E, Swann S, Lilla C, Schadendorf D, Roesch A. Combining BRAF(V) (600E) inhibition with modulators of the mitochondrial bioenergy metabolism to overcome drug resistance in metastatic melanoma. Exp Dermatol. 2015; 24: 709-10. https://doi.org/10.1111/exd.12718.
16 Hoon DS, Spugnardi M, Kuo C, Huang SK, Morton DL, Taback B. Profiling epigenetic inactivation of tumor suppressor genes in tumors and plasma from cutaneous melanoma patients. Oncogene. 2004; 23: 4014-22. https://doi.org/10.1038/sj.onc.1207505.
17 Dahl C, Christensen C, Jonsson G, Lorentzen A, Skjodt ML, Borg A, Pawelec G, Guldberg P. Mutual exclusivity analysis of genetic and epigenetic drivers in melanoma identifies a link between p14 ARF and RARbeta signaling. Mol Cancer Res. 2013; 11: 1166-78. https://doi.org/10.1158/1541-7786.MCR-13-0006.
18 Lotan R, Lotan D. Enhancement of melanotic expression in cultured mouse melanoma cells by retinoids. J Cell Physiol. 1981; 106: 179-89. https://doi.org/10.1002/jcp.1041060203.
19 Christensen C, Bartkova J, Mistrik M, Hall A, Lange MK, Ralfkiaer U, Bartek J, Guldberg P. A short acidic motif in ARF guards against mitochondrial dysfunction and melanoma susceptibility. Nat Commun. 2014; 5: 5348. https://doi.org/10.1038/ncomms6348.
20 Baldea I, Costin GE, Shellman Y, Kechris K, Olteanu ED, Filip A, Cosgarea MR, Norris DA, Birlea SA. Biphasic pro-melanogenic and pro-apoptotic effects of all-trans-retinoic acid (ATRA) on human melanocytes: time-course study. J Dermatol Sci. 2013; 72: 168-76. https://doi.org/10.1016/j.jdermsci.2013.06.004.
21 Kawakami T, Ohgushi A, Hirobe T, Soma Y. Analysis of the effects of all-trans retinoic acid on human melanocytes and melanoblasts in vitro. J Dermatol. 2017; 44: 93-4. https://doi.org/10.1111/1346-8138.13477.
22 Vazquez F, Lim JH, Chim H, Bhalla K, Girnun G, Pierce K, Clish CB, Granter SR, Widlund HR, Spiegelman BM, Puigserver P. PGC1alpha expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 2013; 23: 287-301. https://doi.org/10.1016/j.ccr.2012.11.020.
23 Donadelli M, Dando I, Fiorini C, Palmieri M. UCP2, a mitochondrial protein regulated at multiple levels. Cell Mol Life Sci. 2014; 71: 1171-90. https://doi.org/10.1007/s00018-013-1407-0.
24 Oberkofler H, Klein K, Felder TK, Krempler F, Patsch W. Role of peroxisome proliferator-activated receptor-gamma coactivator-1alpha in the transcriptional regulation of the human uncoupling protein 2 gene in INS-1E cells. Endocrinology. 2006; 147: 966-76. https://doi.org/10.1210/en.2005-0817.
25 Arigony AL, de Oliveira IM, Machado M, Bordin DL, Bergter L, Pra D, Henriques JA. De invloed van micronutriënten in celkweek: een reflectie op levensvatbaarheid en genomische stabiliteit. Biomed Res Int. 2013; 2013: 597282. https://doi.org/10.1155/2013/597282.
26 Li Y, Hashimoto Y, Agadir A, Kagechika H, Zhang X. Identification of a novel class of retinoic acid receptor beta-selective retinoid antagonists and their inhibitory effects on AP-1 activity and retinoic acid-induced apoptosis in human breast cancer cells. J Biol Chem. 1999; 274: 15360-6.
27 de The H, Marchio A, Tiollais P, Dejean A. Differential expression and ligand regulation of the retinoic acid receptor alpha and beta genes. EMBO J. 1989; 8: 429-33.
28 Hardie DG, Hawley SA. AMP-activated protein kinase: the energy charge hypothesis revisited. Bioessays. 2001; 23: 1112-9. https://doi.org/10.1002/bies.10009.
29 versterkt hun reactie op BRAFV600E-remming. J Transl Med. 2014; 12: 247. https://doi.org/10.1186/s12967-014-0247-5.
30 Populo H, Caldas R, Lopes JM, Pardal J, Maximo V, Soares P. Overexpression of pyruvate dehydrogenase kinase supports dichloroacetate as a candidate for cutaneous melanoma therapy. Expert Opin Ther Targets. 2015; 19: 733-45. https://doi.org/10.1517/14728222.2015.1045416.
31 Kluza J, Corazao-Rozas P, Touil Y, Jendoubi M, Maire C, Guerreschi P, Jonneaux A, Ballot C, Balayssac S, Valable S, Corroyer-Dulmont A, Bernaudin M, Malet-Martino M, et al. Inactivation of the HIF-1alpha/PDK3 signaling axis drives melanoma toward mitochondrial oxidative metabolism and potentiates the therapeutic activity of pro-oxidants. Cancer Res. 2012; 72: 5035-47. https://doi.org/10.1158/0008-5472.CAN-12-0979.
32 Kaplon J, Zheng L, Meissl K, Chaneton B, Selivanov VA, Mackay G, van der Burg SH, Verdegaal EM, Cascante M, Shlomi T, Gottlieb E, Peeper DS. A key role for mitochondrial gatekeeper pyruvate dehydrogenase in oncogene-induced senescence. Nature. 2013; 498: 109-12. https://doi.org/10.1038/nature12154.
33 Murholm M, Isidor MS, Basse AL, Winther S, Sorensen C, Skovgaard-Petersen J, Nielsen MM, Hansen AS, Quistorff B, Hansen JB. Retinoïnezuur heeft verschillende effecten op UCP1 expressie in muis en menselijke adipocyten. BMC Cell Biol. 2013; 14: 41. https://doi.org/10.1186/1471-2121-14-41.
34 Jin W, Xu YP, Yang AH, Xing YQ. In vitro inductie en differentiatie van navelstreng mesenchymale stamcellen tot neuron-achtige cellen door all-trans retinoïnezuur. Int J Ophthalmol. 2015; 8: 250-6. https://doi.org/10.3980/j.issn.2222-3959.2015.02.07.
35 Tourniaire F, Musinovic H, Gouranton E, Astier J, Marcotorchino J, Arreguin A, Bernot D, Palou A, Bonet ML, Ribot J, Landrier JF. All-trans retinoïnezuur induceert oxidatieve fosforylering en mitochondriumbiogenese in adipocyten. J Lipid Res. 2015; 56: 1100-9. https://doi.org/10.1194/jlr.M053652.
36 Tripathy S, Chapman JD, Han CY, Hogarth CA, Arnold SL, Onken J, Kent T, Goodlett DR, Isoherranen N. All-trans-retinoic acid enhances mitochondrial function in models of human liver. Mol Pharmacol. 2016; 89: 560-74. https://doi.org/10.1124/mol.116.103697.
37 Watabe H, Soma Y, Ito M, Kawa Y, Mizoguchi M. All-trans retinoic acid induceert differentiatie en apoptose van murine melanocyte precursors met inductie van de microphthalmia-associated transcription factor. J Invest Dermatol. 2002; 118: 35-42. https://doi.org/10.1046/j.0022-202x.2001.01614.x.
38 De Preter G, Neveu MA, Danhier P, Brisson L, Payen VL, Porporato PE, Jordan BF, Sonveaux P, Gallez B. Inhibition of the pentose phosphate pathway by dichloroacetate unravels a missing link between aerobic glycolysis and cancer cell proliferation. Oncotarget. 2016; 7: 2910-20. https://doi.org/10.18632/oncotarget.6272.
39 Michelakis ED, Webster L, Mackey JR. Dichlooracetaat (DCA) als een potentiële metabool-gerichte therapie voor kanker. Br J Cancer. 2008; 99: 989-94. https://doi.org/10.1038/sj.bjc.6604554.
40 Corazao-Rozas P, Guerreschi P, Andre F, Gabert PE, Lancel S, Dekiouk S, Fontaine D, Tardivel M, Savina A, Quesnel B, Mortier L, Marchetti P, Kluza J. Mitochondrial oxidative phosphorylation controls cancer cell’s life and death decisions upon exposure to MAPK inhibitors. Oncotarget. 2016; 7: 39473-85. https://doi.org/10.18632/oncotarget.7790.
41 Bauer D, Werth F, Nguyen HA, Kiecker F, Eberle J. Critical role of reactive oxygen species (ROS) for synergistic enhancement of apoptosis by vemurafenib and the potassium channel inhibitor TRAM-34 in melanoma cells. Cell Death Dis. 2017; 8: e2594. https://doi.org/10.1038/cddis.2017.6.
42 Chen MC, Hsu SL, Lin H, Yang TY. Retinoïnezuur en de behandeling van kanker. Biomedicine (Taipei). 2014; 4: 22. https://doi.org/10.7603/s40681-014-0022-1.
43 Robinson J, Roberts CH, Dodi IA, Madrigal JA, Pawelec G, Wedel L, Marsh SG. The European searchable tumor line database. Cancer Immunol Immunother. 2009; 58: 1501-6. https://doi.org/10.1007/s00262-008-0656-5.
44 Phillips NR, Sprouse ML, Roby RK. Simultaneous quantification of mitochondrial DNA copy number and deletion ratio: a multiplex real-time PCR assay. Sci Rep. 2014; 4: 3887. https://doi.org/10.1038/srep03887.