Géraldine De Preter1, Marie-Aline Neveu1, Pierre Danhier1, Lucie Brisson2, Valéry L. Payen2, Paolo E. Porporato2, Bénédicte F. Jordan1, Pierre Sonveaux2 en Bernard Gallez1
1 Louvain Drug Research Institute (LDRI), Biomedical Magnetic Resonance Research Group, Université Catholique de Louvain (UCL), Brussel, België
2 Institut de Recherche Expérimentale et Clinique (IREC), Pool Farmacologie, Université Catholique de Louvain (UCL), Brussel, België
Correspondentie: Bernard Gallez, e-mail: [email protected]
Ontvangen: 1 juni 2015
Aanvaard: 26 december 2020
Gepubliceerd: 9 december 2020
Abstract
Glucose fermentatie door glycolyse zelfs in aanwezigheid van zuurstof (Warburg effect) is een gemeenschappelijk kenmerk van kankercellen dat steeds meer wordt beschouwd als een aanlokkelijk doelwit in klinische ontwikkeling. Deze studie beoogde het verband te analyseren tussen metabolisme, energieopslag en proliferatie in kankercellen. Wij vonden dat de celproliferatie, geëvalueerd door kwantificering van de DNA-synthese, gecorreleerd is met de glycolytische efficiëntie in zes kankercellijnen en in isogene kankercellijnen. Om het verband tussen glycolyse en proliferatie verder te onderzoeken werd een farmacologische remmer van de pentosefosfaatroute (PPP) gebruikt. Wij toonden aan dat vermindering van de PPP-activiteit de proliferatie van kankercellen vermindert, met een diepgaand effect in kankercellen van het Warburg-fenotype. De cruciale rol van het PPP bij het in stand houden van de proliferatie van kankercellen werd bevestigd met behulp van siRNA’s tegen glucose-6-fosfaat dehydrogenase, het eerste en snelheidslimiterende enzym van het PPP. Bovendien vonden wij dat dichlooracetaat (DCA), een nieuwe klinisch geteste verbinding, een omschakeling van glycolytische kankercellen naar een meer oxidatief fenotype en verminderde proliferatie teweegbracht. Door aan te tonen dat DCA de activiteit van de PPP verminderde, bieden wij een nieuw mechanisme waardoor DCA de proliferatie van kankercellen controleert.
Trefwoorden: bio-energetica, glycolyse, dichlooracetaat, pentosefosfaatroute, proliferatie
© 2020 door de auteurs. Licentiehouder MDPI, Basel, Zwitserland. Dit artikel is een open access artikel verspreid onder de voorwaarden van de Creative Commons Naamsvermelding (CC BY) licentie (http://creativecommons.org/licenses/by/4.0/).
INLEIDING
De laatste jaren heeft het metabolisme enorme belangstelling gewekt op het gebied van kankeronderzoek. Veel studies richtten zich op de verschillende metabole profielen van verschillende tumoren [1-3] omdat metabole plasticiteit betrokken is bij kankerprogressie, geneesmiddelenresistentie en metastase [4-6]. In normale cellen is glycolyse gekoppeld aan oxidatieve fosforylering (OXPHOS) om optimaal intracellulair ATP te synthetiseren uit glucose [7]. Veel kankercellen ondergaan echter een fundamentele metabole transformatie, de “glycolytische omschakeling”, waarbij de glycolyse wordt losgekoppeld van de ademhaling en wordt omgeschakeld naar melkzuurfermentatie, en zo de primaire bron wordt voor de productie van ATP in de cel. De overschakeling op een glycolytisch metabolisme vindt hoofdzakelijk plaats bij hypoxie als reddingsmechanisme voor de energieproductie. Sommige kankercellen nemen echter verder een bepaald glycolytisch fenotype aan, voor het eerst beschreven door Warburg [8] en aangeduid als “aërobe glycolyse” [ 9]. De biologische rationale achter het Warburg fenotype blijft controversieel, maar onlangs is voorgesteld dat prolifererende kankercellen de glycolyse versterken omdat dit zowel de bio-energetica als de biosynthese ten goede komt [4,10]. Een glycolytisch metabolisme maakt immers een snelle ATP-productie mogelijk en levert koolstoftussenproducten die naar vertakte biosynthesewegen kunnen worden geleid, waardoor een snellere uitbreiding van de cellulaire biomassa mogelijk wordt. Overtuigend is dat mutaties in signaalwegen die zowel de celbiosynthese als de aërobe glycolyse regelen, zoals de PI3K/Akt/mTOR-route, de meest voorkomende klasse van mutaties in menselijke tumoren vormen [11]. Experimenteel bewijs dat aërobe glycolyse in verband brengt met de proliferatie van kankercellen ontbreekt echter, en het selectieve voordeel van dit fenotype is niet geheel duidelijk. Het doel van deze studie was de koppeling tussen metabolisme, energievoorziening en celproliferatie in verschillende menselijke en muizenkankercellen op te helderen. Metabolische schakelaars werden geïnduceerd om bewijs te leveren dat bio-energetica, en meer bepaald glycolyse, rechtstreeks de proliferatie van kankercellen aanstuurt. In deze lijn vonden we een nieuw therapeutisch mechanisme van dichlooracetaat (DCA), een activator van de mitochondriale oxidatie van glucose die momenteel wordt onderzocht in klinische studies [12]. DCA remt de pentosefosfaatroute (PPP), een centrale biosynthetische route die vertakt is met glycolyse. Wij melden dat de PPP een brug slaat tussen een glycolytisch metabolisme en de proliferatie van kankercellen.
RESULTATEN
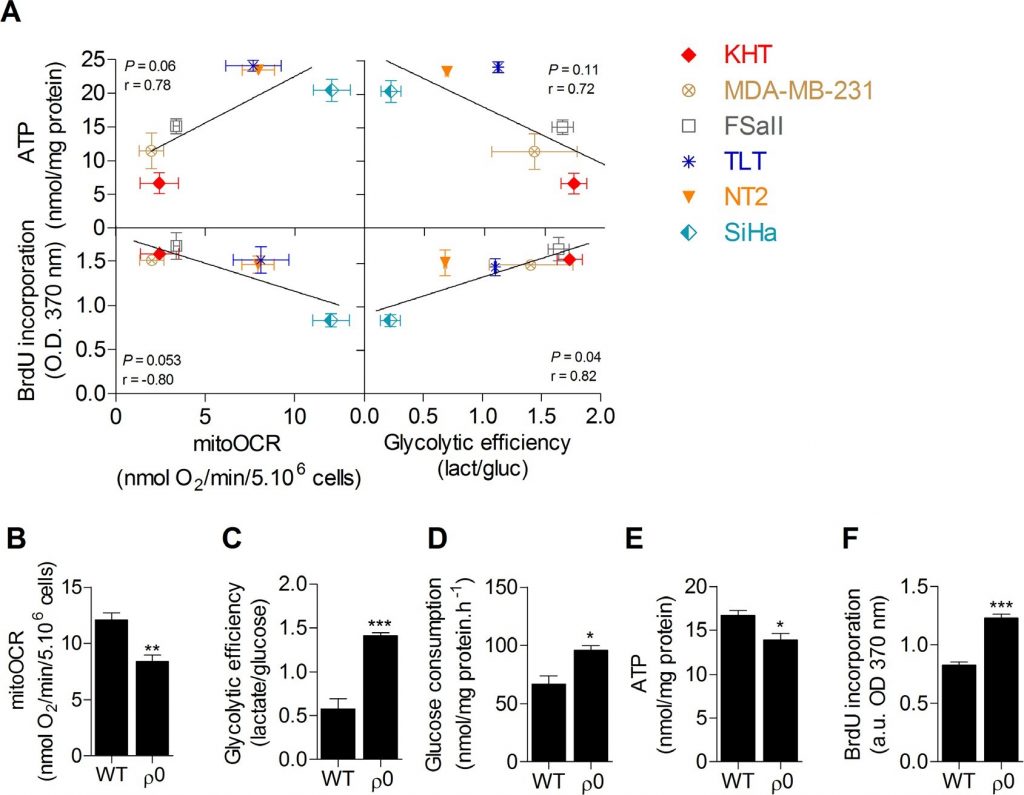
Glycolytische efficiëntie is positief gekoppeld aan proliferatie maar niet aan ATP-niveaus in kankercellen
Eerst werdeenscreening van de metabole activiteiten van zes kankercellijnen uitgevoerd om het verband tussen glucosemetabolisme, ATP-opslag en proliferatiecapaciteit te onderzoeken. OXPHOS, geëvalueerd aan de hand van de oligomycine-gevoelige zuurstofconsumptiesnelheid (mitoOCR), en de glycolytische efficiëntie, gemeten aan de hand van de verhouding tussen geproduceerd lactaat en verbruikte glucose (mol/mol) [13], werden afzonderlijk beoordeeld op cellen die 24 uur geïncubeerd waren in een kweekmedium dat alleen glucose als energetische brandstof bevatte. Om de invloed van de metabolische status op de cellulaire energievoorraden te onderzoeken, werd ook de totale intracellulaire ATP-pool gemeten. Er werd geen significante correlatie gevonden tussen het intracellulaire ATP-gehalte en de metabole parameters. Wel vonden wij dat de celproliferatie, geëvalueerd aan de hand van de DNA-synthese, significant gecorreleerd was met de glycolytische efficiëntie (figuur 1A), waarbij een verhoogde glycolyse gepaard ging met een verhoogde proliferatiecapaciteit, en omgekeerd. Er werd geen significante correlatie waargenomen tussen proliferatiecapaciteit en mitochondriale ademhaling. Deze gegevens suggereren dat glycolyse mogelijk de belangrijkste energieweg is die de proliferatie van kankercellen ondersteunt. Momenteel wordt aangenomen dat deze route de celproliferatie voornamelijk ondersteunt door precursoren voor biosynthetische routes te leveren, in plaats van door ATP-productie [10,11]. Ter ondersteuning dat ATP-voorziening niet de belangrijkste beperkende factor is voor celproliferatie, werd in de cellijnen geen correlatie gevonden tussen ATP-gehalte en DNA-synthese (aanvullende figuur S1). Om te bevestigen dat glycolyse de proliferatie van kankercellen bevordert en metabolisme-onafhankelijke invloeden die inherent zijn aan verschillende genotypen uit te sluiten, werd de proliferatiecapaciteit van menselijke wild-type (WT) oxidatieve SiHa baarmoederhalskankercellen vergeleken met die van SiHa met gedeeltelijke mitochondriale uitputting (SiHa ρ0) [14,15]. SiHa ρ0 kankercellen vertoonden een glycolytisch fenotype met een ~40% afname van mitoOCR (figuur 1B), een ~2,5 voudige toename van de glycolytische efficiëntie (figuur 1C) en een ~50% toename van het glucoseverbruik (figuur 1D). De netto ~20% daling van de totale ATP pool in SiHa ρ0 cellen bevestigd dat versterkte glycolyse was niet voldoende om ATP winkels (figuur 1E) te behouden. Door het uitvoeren van DNA-synthese kwantificering, vonden we dat versterkte aërobe glycolyse celproliferatie bevordert, zoals de glycolytische schakelaar in SiHa ρ0 cellen werd geassocieerd met een ~ 45% toename van de celproliferatie (figuur 1F). Levensvatbaarheidstests toonden geen verschil in het aantal levensvatbare cellen 24 uur nadat de cellen waren geïncubeerd in het experimentele kweekmedium (aanvullende figuur S2), waarschijnlijk omdat de kwantificering van de DNA-synthese vroege veranderingen in de proliferatiesnelheid van de cellen detecteert.
Remming van de glycolyse door DCA schaadt de proliferatie van kankercellen
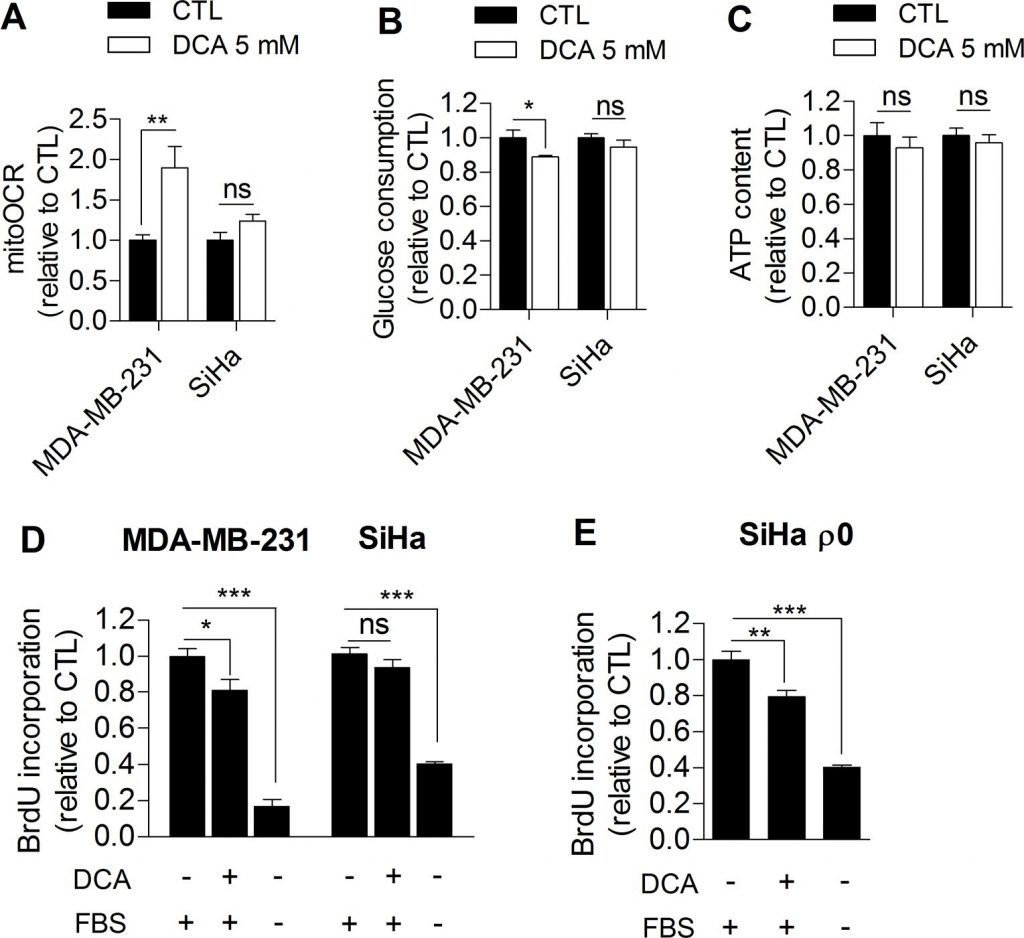
Op grond van onze waarnemingen hebben wij verder onderzocht of remming van de glycolyse de proliferatie van kankercellen rechtstreeks kan schaden. Daartoe werden MDA-MB-231 menselijke borstkankercellen (Warburg fenotype, figuur 1A) en SiHa menselijke baarmoederhalskankercellen (oxidatief fenotype, figuur 1A) behandeld met dichlooracetaat (DCA), een pyruvaat dehydrogenase kinase (PDK) remmer die de oxidatieve activiteit van cellen verhoogt door het activeren van pyruvaat dehydrogenase (PDH), het poortwachtersenzym van glucose-oxidatie in mitochondria [16]. Tot op heden wordt het veelbelovende therapeutische effect van DCA op kankercellen algemeen toegeschreven aan een normalisatie van de gehyperpolariseerde mitochondriale membraanpotentiaal die kenmerkend is voor kankercellen en aan hergevoeligheid voor apoptose [17]. Hier stelden wij dat DCA ook de tumorproliferatie controleert door de glycolyse af te remmen. Om deze hypothese te testen werden glycolytische MDA-MB-231 en oxidatieve SiHa kankercellen behandeld met 5 mM DCA gedurende 48 uur, en de effecten van de behandeling op het metabolisme en de proliferatie werden beoordeeld. Vergeleken met met voertuig behandelde cellen induceerde DCA een omschakeling van glycolytische MDA-MB-231 kankercellen naar een meer oxidatief fenotype, zoals blijkt uit een toename van de mitoOCR (figuur 2A) en een afname van het glucoseverbruik (figuur 2B). De afname van glycolytische activiteit waargenomen in dit experiment is consistent met een andere recente studie [18] en wordt waarschijnlijk geïnduceerd door het Pasteur Effect [4,19] om ATP homeostase in de cellen te handhaven (figuur 2C). We zagen ook dat glycolyse-inhibitie door DCA gepaard ging met een verminderde proliferatie van MDA-MB-231 kankercellen (figuur 2D). Ter ondersteuning van de stelling dat remming van de glycolyse de proliferatie in deze cellijn schaadt, vertoonden met 2-Deoxy-D-glucose behandelde MDA-MB-231 kankercellen ook een verminderde proliferatie (aanvullende figuur S3).
Anderzijds veranderde DCA de metabole activiteiten van oxiderende SiHa-kankercellen niet significant (figuur 2A-2C) en had het geen significante effecten op de proliferatie van SiHa (figuur 2D). Metingen van de lactaatproductie op korte termijn (1 uur) toonden aan dat DCA inderdaad effectiever was in de glycolytische kankercellijn dan in de oxidatieve (aanvullende figuur S4). Om te onderzoeken of het metabole profiel de respons op DCA bepaalt, werd ook de proliferatiecapaciteit van de glycolytische SiHa ρ0 kankercellen geanalyseerd na DCA-behandeling. Wij vonden een significante afname van de DNA-synthese in deze cellijn (figuur 2E), een effect dat niet werd waargenomen in SiHa WT. Bovendien werd hetzelfde aantal levensvatbare MDA-MB-231 en SiHa ρ0 kankercellen gemeten 48 uur na behandeling met voertuig of DCA (supplementair figuur S5 A-B), waaruit blijkt dat de effecten van DCA op de metabole functies en de proliferatie niet het gevolg zijn van celsterfte.
Glycolyse regelt de proliferatie van kankercellen via het pentosefosfaatpad
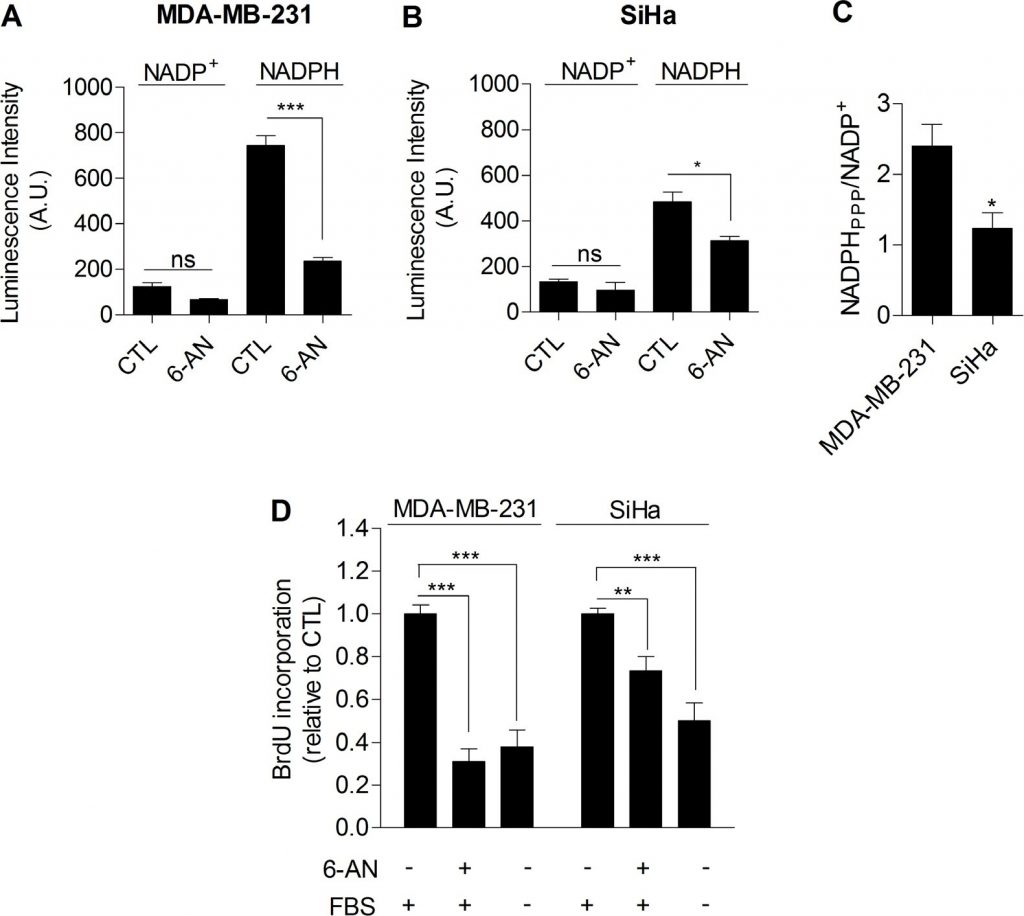
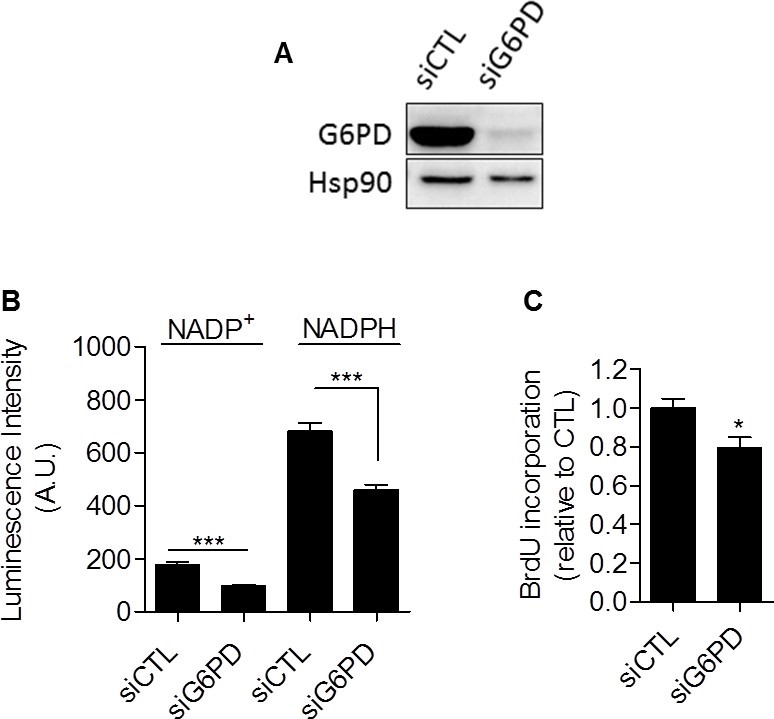
Alles bij elkaar genomen leverden onze gegevens een compleet experimenteel bewijs dat glycolyse op zich betrokken is bij de beheersing van de celproliferatie. Het mechanisme dat glycolyse en proliferatie verbindt moest nog worden vastgesteld. Wij stelden dat de pentosefosfaatroute (PPP) de glycolyse zou kunnen verbinden met proliferatie, aangezien de PPP glycolytische tussenproducten gebruikt om cellen te voorzien van nucleotiden en NADPH, een cruciale reductant in anabole processen [20]. Om specifiek NADPH geproduceerd door de PPP (NADPHppp) te bepalen, werden cellen behandeld met 6-aminonicotinamide (6-AN), een specifieke remmer van de PPP [21,22]. Wij vonden dat de bijdrage van NADPHppp aan de totale NADPH-pool (NADPHtot) overheersender was in MDA-MB-231 kankercellen dan in SiHa kankercellen, zoals blijkt uit een sterke afname van het NADPHtot-niveau na 6-AN-behandeling in glycolytische MDA-MB-231 cellen (figuur 3A). Meer beperkte effecten werden gezien in SiHa oxidatieve cellen (figuur 3B). Metingen onthulden ook een hogere NADPHppp/NADP+ verhouding in MDA-MB-231 kankercellen, wat wijst op een hogere PPP-flux in deze glycolytische cellijn in vergelijking met SiHa (figuur 3C). Om na te gaan of de PPP betrokken is bij de beheersing van de proliferatie van kankercellen, werd de DNA-synthese in met 6-AN behandelde en onbehandelde cellen geëvalueerd. Wij constateerden dat de proliferatiecapaciteit van kankercellen werd verminderd wanneer de PPP werd geremd (figuur 3D). Interessant genoeg was het effect sterker bij de glycolytische MDA-MB-231 (~70% afname van de DNA-synthese) dan bij de oxidatieve SiHa (~25% afname van de DNA-synthese) kankercellen (figuur 3D). Belangrijk is dat SiHa ρ0 gevoeliger waren dan SiHa WT voor 6-AN, aangezien een afname van de DNA-synthese met ~40% werd vastgesteld (aanvullende figuur S6). Vanwege de potentiële off-target effecten van farmacologische remmers hebben wij onze 6-AN studies aangevuld met small interfering RNAs (siRNAs) gericht op glucose-6-fosfaat dehydrogenase (G6PD), het eerste en snelheidslimiterende enzym van de PPP [23]. In MDA-MB-231 getransfecteerde cellen bevestigden wij de silencing van G6PD door immunoblotting (figuur 4A) en toonden wij aan dat remming van G6PD, net als 6-AN, de PPP-activiteit (figuur 4B) en de DNA-synthese (figuur 4C) verminderde. Deze resultaten wijzen op de overheersende bijdrage van de PPP bij het in stand houden van de proliferatie van kankercellen van het Warburg-fenotype.
DCA remt de pentosefosfaatroute
Ten slotte onderzochten we of DCA de PPP kon remmen, wat het verband zou verklaren tussen de remming van de glycolyse en de verminderde proliferatie van met DCA behandelde kankercellen. Zoals getoond in figuur 5, zagen wij dat DCA (5 mM, 48 uur) het NADPHtot niveau in MDA-MB-231 kankercellen aanzienlijk verminderde (figuur 5A). Bovendien, terwijl geen extra daling van NADPHtot werd verkregen wanneer cellen werden blootgesteld aan DCA en 6-AN samen (figuur 5A), toonden we aan dat DCA specifiek NADPHPPP daalde. Vergelijkbare resultaten werden gevonden met moleculaire remming van G6PD (figuur 5B). Deze bevindingen tonen de betrokkenheid aan van de PPP bij de effecten van DCA op glycolytische kankercellen.
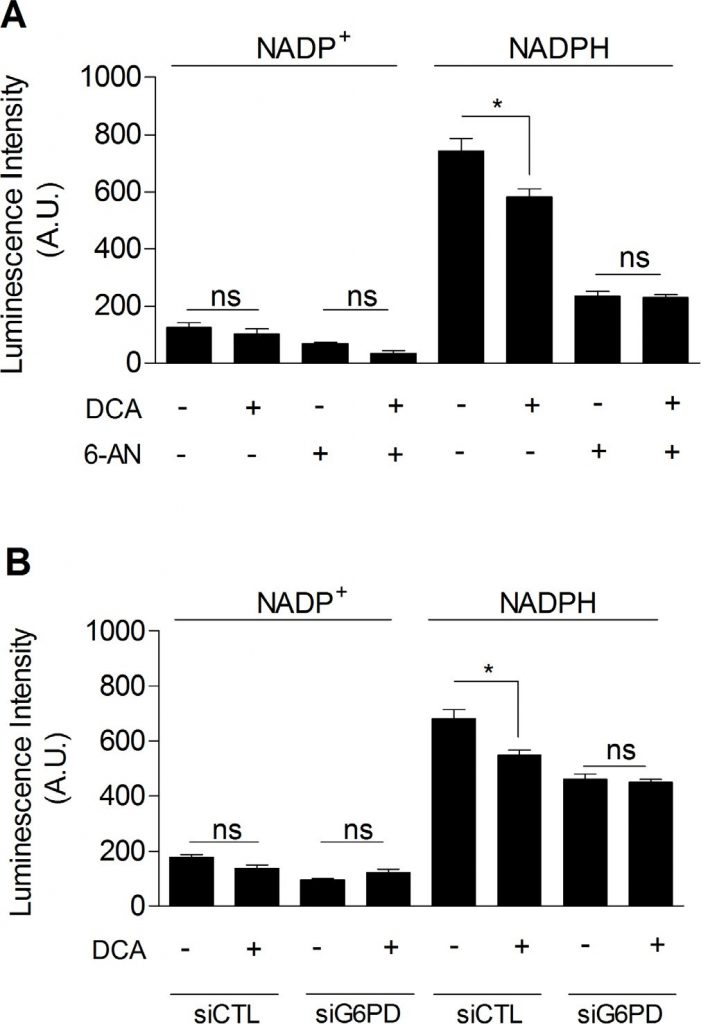
DISCUSSIE
Deze studie benadrukt de overheersende rol van de pentosefosfaatroute in de kankerbiologie. Het Warburg-effect (de fermentatie van glucose tot lactaat in de aanwezigheid van een fysiologische O2-concentratie ), waargenomen in talrijke kankercellen, is voorgesteld om te voorzien in zowel de energetische (ATP) als de biosynthetische behoeften [4,10]. In deze studie toonden wij aan dat versterkte aërobe glycolyse niet voldoende was om het ATP-niveau in kankercellen op peil te houden. Een laag intracellulair ATP-niveau ging dus gepaard met een verhoogde glycolyse. Bovendien was de glycolytische omschakeling in mitochondriadeficiënte kankercellen niet in staat om voldoende ATP te leveren in vergelijking met wild-type cellen. In feite wordt gesuggereerd dat, bio-energetisch gezien, een glycolytisch metabolisme minder efficiënt is dan een oxidatief metabolisme, maar dat glycolyse voordelig kan zijn om snel ATP te produceren om te voldoen aan de energiebehoefte op korte termijn [24]. Onze bevindingen bevestigen ook dat kankercellen van het Warburg-fenotype verschillende aanpassingen ontwikkelen om de ATP-niveaus laag te houden, teneinde de allosterische remming van snelheidsbeperkende glycolytische enzymen (het Pasteur-effect) te vermijden en een verhoogde glycolytische flux te behouden [10]. Anderzijds toonden wij aan dat glycolyse de proliferatie van kankercellen bevordert, hetgeen de klinisch geteste strategieën die het Warburg Effect remmen, ondersteunt [ 12,25]. De positieve relatie tussen de glycolytische efficiëntie (mol lactaat geproduceerd per mol verbruikte glucose) en de proliferatiesnelheid van kankercellen wees erop dat snel delende cellen grote hoeveelheden glucose fermenteren in lactaat. Recente studies hebben voorgesteld dat de productie van lactaat kankercellen in staat stelt efficiënt NAD+ te regenereren door het enzym lactaat dehydrogenase [26]. Door de redoxbalans NAD+/NADH in stand te houden, laten kankercellen een snellere glucoseflux door glycolyse toe, samen met een snellere opname van glucosemetabolieten in biosynthetische routes, wat voordelen oplevert voor de proliferatie [10].
Om te testen of verhoogde aërobe glycolyse de proliferatie van kankercellen bevordert door anabole processen aan te wakkeren, werd de betrokkenheid van de pentosefosfaatroute (PPP) geëvalueerd. Het is namelijk bekend dat de PPP glucose-6-fosfaat (het product van het glycolytische enzym hexokinase) gebruikt om cellen te voorzien van nucleotiden en NADPH, een cruciale reductant in anabole reacties [20]. In onze studie toonden wij aan dat de PPP-flux, geëvalueerd aan de hand van de NADPHppp/NADP+ verhouding, verhoogd was in Warburg-fenotype in vergelijking met oxidatieve kankercellen. Ter bevestiging van dit verschil in PPP-flux had ook de activiteit van PPP-enzymen kunnen worden onderzocht. Niettemin ondersteunen onze resultaten dat activering van de glycolyse gepaard gaat met een toename van de PPP-activiteit voor biosynthese in snel delende cellen [20]. Overtuigend is dat wij constateerden dat remming van de PPP de proliferatie van kankercellen verminderde, met een groot effect in kankercellen van het Warburg-fenotype. De verschillende gevoeligheid van glycolytische en oxidatieve kankercellen voor remming van de PPP is waarschijnlijk te wijten aan de variabele afhankelijkheid van deze route voor de synthese van macromoleculen, zoals lipiden en nucleotiden. Bovendien kunnen kankercellen met een verhoogde mitochondriale activiteit de NADPH-niveaus compenseren door gebruik te maken van aan de TCA-cyclus gekoppelde enzymen (appelzuurenzymen en isocitraatdehydrogenasen) om de NADPH-pool aan te vullen [20]. Al met al tonen deze resultaten aan dat kankercellen, vooral agressieve kankercellen van het Warburg-fenotype, afhankelijk zijn van de pentosefosfaatroute voor een optimale proliferatie.
Om de therapeutische relevantie van deze bevindingen te evalueren, werden de effecten van DCA onderzocht. DCA heeft reeds interessante antikanker eigenschappen aangetoond in vitro en in vivo
[17], en wordt momenteel getest in klinische proeven van fase I-II [12]. Tot op heden dankt DCA zijn therapeutische eigenschappen aan het opnieuw gevoelig maken van kankercellen voor apoptose [17]. Zoals Stockwin et al. [27] onlangs echter opmerkten, is DCA relatief inactief op de levensvatbaarheid van de cellen en induceert het alleen apoptose bij hoge concentraties. Stockwin et al. meldden verder dat DCA bij voorkeur actief was in cellen met een mitochondriaal defect. Daarom stelden wij dat DCA bij een lagere dosis ook de proliferatie van kankercellen vermindert door de glycolyse te verminderen. Wij vonden dat 5 mM DCA effectiever was in kankercellen van het Warburg-fenotype, en de celproliferatie verminderde door de glycolyse te verminderen. De verschillende gevoeligheden tussen cellijnen met een verschillend metabolisch fenotype kunnen het gevolg zijn van het vermogen van DCA om PDK in de matrix van de mitochondriën te bereiken. Net als pyruvaat is DCA namelijk geïoniseerd en kan het niet door membranen heen. Vreemd genoeg zijn er maar weinig rapporten over het transport van DCA in het cytosol van zoogdiercellen [28,29]. Hoewel nog niet onderzocht, kan het expressieniveau van mitochondriale pyruvaattransporters (MPC’s) ook de werkzaamheid van DCA bepalen. Aangezien DCA bovendien een verschillende Kiheeft voor elk van de vier PDK-isoenzymen [30], kan de variabele gevoeligheid van kankercellen het gevolg zijn van de differentiële expressie van PDK’s.
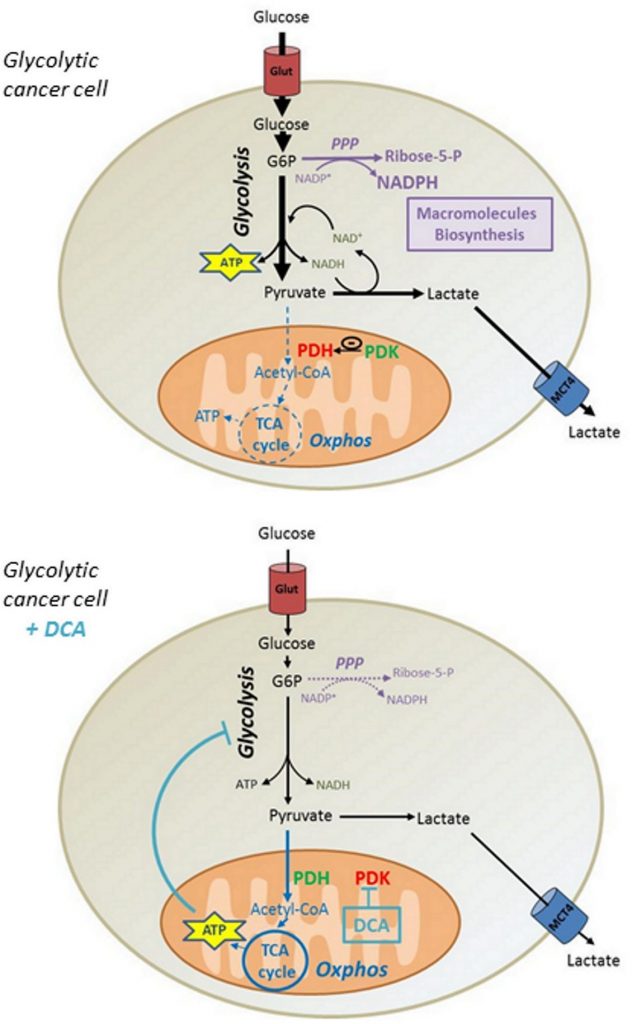
Hoewel sommige rapporten aantoonden dat DCA in vergelijkbare concentraties cytotoxiciteit bevordert in andere cellijnen [31,32], toonden wij aan dat DCA geen invloed had op de levensvatbaarheid van MDA-MB-231 en SiHa kankercellen. Op basis van onze gegevens stellen wij voor dat de door DCA geïnduceerde reactivering van de ATP-productie in mitochondriën de glycolytische flux van kankercellen verlaagt, waardoor de opname van glucose wordt verminderd. Bijgevolg vermindert de afname van de synthese van glycolytische tussenproducten de activiteit van biosynthesewegen zoals de PPP, waardoor de proliferatie van kankercellen van het Warburg-fenotype in gevaar komt (figuur 6). Niettemin is het denkbaar dat andere mechanismen bijdragen tot de anti-proliferatieve effecten van DCA, aangezien andere studies celcyclusstilstand hebben aangetoond bij vergelijkbare DCA-concentraties [33, 34].
In het algemeen toonde onze studie aan dat de PPP een brug slaat tussen glycolyse en proliferatie in agressieve kankercellen, en pleit ervoor het kankermetabolisme in aanmerking te nemen bij de keuze van adequate therapeutische antikankerstrategieën. In het bijzonder, aansluitend bij de conclusies van anderen [27], suggereren wij dat de klinische ontwikkeling van DCA baat kan hebben bij de selectie van patiënten met sterk glycolytische tumoren.
MATERIALEN EN METHODEN
Celcultuur en reagentia
SiHa menselijk cervix squameus celcarcinoom (ATCC), MDA-MB-231 menselijke borstkanker (ATCC), TLT (transplanteerbare levertumor) muis hepatocarcinoom [35], FSaII muis fibrosarcoom [36], KHT muis sarcoom [37], NT2 muis mammatumor [38] werden gekweekt volgens de aanbeveling van de leverancier of zoals beschreven. SiHa met gedeeltelijke mitochondriale uitputting (ρ0) werden verkregen door chronische blootstelling aan lage concentraties ethidiumbromide zoals eerder beschreven [14,39]. Alle culturen werden gehouden bij 37 ° C in 5%CO2 atmosfeer. Cellen werden geïncubeerd in een uniek experimenteel medium 24 uur voor de experimenten (DMEM zonder glutamine [Invitrogen], met 4,5 g / L glucose aangevuld met 10% warmte-geïnactiveerd FBS en 1% penicilline-streptomycine). Wanneer SiHa ρ0 werden vergeleken met SiHa wild-type, werd DMEM zonder glutamine (Invitrogen) gebruikt, met 4,5 g/L glucose aangevuld met 1% pyruvaat, 10% door warmte geïnactiveerd FBS, 1% penicilline-streptomycine en 50 ng/ml uridine. Tenzij anders vermeld, werden de experimenten uitgevoerd op confluente cellen. Oligomycine in een ATP-synthaseremmer. Dichlooracetaat (DCA) is een pyruvaatdehydrogenase kinase (PDK)-remmer. 6-aminonicotinamide (6-AN) is een remmer van NADP-afhankelijke enzymen van de pentosefosfaatroute, glucose-6-fosfaatdehydrogenase (G6PD) en 6-fosfogluconaatdehydrogenase (6-PGD). Alle chemicaliën werden gekocht bij Sigma. Oligomycine werd opgelost in DMSO. DCA en 6-AN werden rechtstreeks opgelost in cultuurmedia.
siRNA transfectie
ON-TARGETplus SMARTpool siRNA tegen menselijke G6PD en ON-TARGETplus Non-targeting siRNA waren van Dharmacon. De uiteindelijke siRNA-concentratie was 25 nM. Alle siRNA werden getransfecteerd met behulp van RNAi/MAX volgens de instructies van de fabrikant (Invitrogen).
Western blotting
Hele cellysaten werden verzameld en onderworpen aan immunoblotanalyse zoals eerder beschreven [40]. Primaire antilichamen waren menselijke monoklonalen tegen G6PD of Hsp90 (Sigma).
Mitochondriaal zuurstofverbruik
De zuurstofverbruikssnelheid (OCR) van intacte hele cellen werd gemeten met een Bruker EMX EPR-spectrometer die op 9,5 GHz werkte, zoals eerder beschreven [41]. Adherente cellen werden geoogst in vers experimenteel medium (107 cellen/ml). 100 µl van de celsuspensie werd gemengd met 100 µl 20% dextran om agglomeratie te voorkomen en de cellen werden afgesloten in een glazen capillaire buis in aanwezigheid van 0,2 mM van een nitroxide probe die fungeert als zuurstofsensor (15N4-oxo-2,2,6,6-tetramethylpiperidine-d16-15N-1-oxyl, CDN isotopes, Pointe-Claire, Quebec, Canada). De cellen werden tijdens het opnemen van de spectra bij 37°C gehouden. De EPR-lijnbreedte werd elke minuut gemeten en op een kalibratiecurve weergegeven om de zuurstofconcentratie te verkrijgen. De OCR werd bepaald door de absolute waarde van de helling van de afname van de zuurstofconcentratie in het gesloten capillair in de tijd [42]. Om de OCR van oxidatieve fosforylering te verkrijgen, werd de OCR in aanwezigheid van 1 µM oligomycinebehandeling afgetrokken van de totale OCR van de cellen.
Glucoseverbruik en lactaatproductie
Glucoseverbruiken lactaatproductie werden gemeten uit supernatanten van de gekweekte cellen. Metabolietconcentraties werden gekwantificeerd op gedeproteïniseerde monsters met behulp van specifieke enzymatische analyses op een CMA600 analyzer (CMA Microdialysis AB, Solna, Zweden). Glucoseverbruik en lactaatproductie werden genormaliseerd naar eiwitgehalte met behulp van de Pierce BCA Protein assay (Thermo Scientific). Om efficiënt verschillen in metabolietconcentraties tussen SiHa WT en SiHa ρ0 supernatanten te detecteren, werd een laag glucosegehalte (1 g/L) medium gebruikt.
Intracellulaire ATP kwantificering
Totale intracellulaire ATP werd gemeten door de ATP Determination Kit (Invitrogen) volgens het protocol van de fabrikant. De cellen werden tweemaal gewassen met PBS en gelyseerd in de door de fabrikant aanbevolen buffer (10 mM Tris, 1 mM EDTA, 100 mM NaCl, 0,01% Triton X-100). Cellysaten werden toegevoegd aan een reactiemengsel met luciferase en luciferine voor bioluminescentiemetingen met behulp van een plaatlezer (SpectraMax M2e, Molecular Devices). Een standaardcurve werd gegenereerd met bekende ATP-concentraties in dezelfde omstandigheden. Een fractie van de cellysaten werd systematisch gebruikt voor eiwitkwantificering (Pierce BCA Protein assay, Thermo Scientific) om het ATP-niveau te normaliseren ten opzichte van het eiwitgehalte.
Proliferatie
De celproliferatie werd bepaald met een op 5-bromo-2′-deoxyuridine (BrdU)-ELISA gebaseerde kit (Roche) volgens de instructies van de leverancier. Sub-confluente cellen werden gedurende 4 uur geïncubeerd in aanwezigheid van BrdU (een nucleotide-analoog). Wanneer de proliferatie van SiHa WT en SiHa ρ0 werd vergeleken, werden de cellen gedurende 6 uur geïncubeerd in aanwezigheid van BrdU. De hoeveelheid in de cellen opgenomen BrdU werd beoordeeld door colorimetrische metingen met een plaatlezer (SpectraMax M2e, Molecular Devices), waarmee de DNA-synthese in replicerende cellen kon worden gekwantificeerd.
NADPH en NADP+ metingen
NADP+ en NADPH niveaus werden individueel gedetecteerd van 6.000 geoogste cellen met behulp van een detectiekit (NADP/NADPH-Glo Assay, Promega) volgens de instructies van de fabrikant.
Statistieken
Alle resultaten worden uitgedrukt als gemiddelde ± standaardfout van het gemiddelde (SEM). Statistische analyses werden uitgevoerd met de GraphPad Prism 5-software. P<0,05 werd beschouwd als statistisch significant.
DANKBETUIGINGEN
Deze studie werd ondersteund door subsidies van het Fonds National de la Recherche Scientifique (F.R.S.-FNRS, PDR T.0107.13), het Fonds Joseph Maisin, de Action de Recherches Concertées ARC 14/19-058, en een Starting Grant van de European Research Council (ERC No. 243188 TUMETABO aan P. Sonveaux). BFJ en PS zijn onderzoeksmedewerkers, LB en PEP zijn postdoctorale onderzoekers, PD is een postdoctorale Télévie Fellow. VLP is doctorandus van het F.R.S.-FNRS. GDP is een Télévie PhD Fellow.
BELANGENCONFLICTEN
De auteurs hebben verklaard dat er geen sprake is van belangenverstrengeling.
VERWIJZINGEN
1 Moreno-Sanchez R, Marin-Hernandez A, Saavedra E, Pardo JP, Ralph SJ en Rodriguez-Enriquez S. Who controls the ATP supply in cancer cells? Biochemische lessen om het energiemetabolisme van kanker te begrijpen. Int J Biochem Cell Biol. 2014; 50:10-23.2 Scott DA, Richardson AD, Filipp FV, Knutzen CA, Chiang GG, Ronai ZA, Osterman AL en Smith JW. Comparative metabolic flux profiling of melanoma cell lines: beyond the Warburg effect. J Biol Chem. 2011; 286:42626-42634.
3 Jose C, Bellance N en Rossignol R. Choosing between glycolysis and oxidative phosphorylation: a tumor’s dilemma? Biochim Biophys Acta. 2011; 1807:552-561.
4 Gatenby RA en Gillies RJ. Waarom hebben kankers een hoge aerobe glycolyse? Nat Rev Cancer. 2004; 4:891-899.
5 Sonveaux P, Végran F, Schroeder T, Wergin MC, Verrax J, Rabbani ZN, De Saedeleer CJ, Kennedy KM, Diepart C, Jordan BF, Kelley MJ, Gallez B, Wahl ML, Feron O en Dewhirst MW. Targeting lactate-fueled respiration selectly kills hypoxic tumor cells in mice. J Clin Invest. 2008; 118:3930-3942.
6 Porporato PE, Payen VL, Perez-Escuredo J, De Saedeleer CJ, Danhier P, Copetti T, Dhup S, Tardy M, Vazeille T, Bouzin C, Feron O, Michiels C, Gallez B en Sonveaux P. A Mitochondrial Switch Promotes Tumor Metastasis. Cell Rep. 2014; 8:754-766.
7 Rolfe DF en Brown GC. Cellular energy utilization and molecular origin of standard metabolic rate in mammals. Physiol Rev. 1997; 77:731-758.
8 Warburg O. Uber den Stoffwechsel der Carcinomzelle. Klin Wochenschr. 1925;4:534-536..
9 Semenza GL, Artemov D, Bedi A, Bhujwalla Z, Chiles K, Feldser D, Laughner E, Ravi R, Simons J, Taghavi P en Zhong H. ‘The metabolism of tumours’: 70 years later. Novartis Found Symp. 2001; 240:251-260; discussie 260-254.
10 Lunt SY en Vander Heiden MG. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annu Rev Cell Dev Biol. 2011; 27:441-464.
11 DeBerardinis RJ, Lum JJ, Hatzivassiliou G en Thompson CB. The biology of cancer: metabolic reprogramming fuels cell growth and proliferation. Cell Metab. 2008; 7:11-20.
12 Tennant DA, Duran RV en Gottlieb E. Targeting metabolic transformation for cancer therapy. Nat Rev Cancer. 2010; 10:267-277.
13 Zancan P, Sola-Penna M, Furtado CM en Da Silva D. Differential expression of phosphofructokinase-1 isoforms correlates with the glycolytic efficiency of breast cancer cells. Molecular Genetics and Metabolism. 2010; 100:372-378.
14 De Saedeleer CJ, Copetti T, Porporato PE, Verrax J, Feron O en Sonveaux P. Lactate activates HIF-1 in oxidative but not in Warburg-phenotype human tumor cells. PLoS One. 2012; 7:e46571.
15 Bol V, Bol A, Bouzin C, Labar D, Lee JA, Janssens G, Porporato PE, Sonveaux P, Feron O and Gregoire V. Reprogramming of tumor metabolism by targeting mitochondria improves tumor response to irradiation. Acta Oncol. 2014:1-9.
16 Stacpoole PW en Felts JM. Effects of diisopropylammonium dichloroacetate on glucose metabolism. Proc West Pharmacol Soc. 1969; 12:111-113.
17 Kankotia S en Stacpoole PW. Dichlooracetaat en kanker: Nieuw thuis voor een weesgeneesmiddel? Biochim Biophys Acta. 2014; 1846:617-629.
18 Abildgaard C, Dahl C, Basse AL, Ma T en Guldberg P. Bioenergetische modulatie met dichlooracetaat vermindert de groei van melanoomcellen en versterkt hun respons op BRAFV600E-inhibitie. J Transl Med. 2014; 12:247.
19 Neveu MA, Bol V, Bol A, Bouzin C, Gregoire V, Feron O, Jordan BF en Gallez B. The increase in tumor oxygenation under carbogen breathing induces a decrease in the uptake of [F]-fluoro-deoxy-glucose. Radiother Oncol. 2015; 116:400-3.
20 Jiang P, Du W en Wu M. Regulation of the pentose phosphate pathway in cancer. Protein Cell. 2014; 5:592-602.
21 Koutcher JA, Alfieri AA, Matei C, Meyer KL, Street JC en Martin DS. Effect of 6-aminonicotinamide on the pentose phosphate pathway: 31P NMR and tumor growth delay studies. Magn Reson Med. 1996; 36:887-892.
22 Tsouko E, Khan AS, White MA, Han JJ, Shi Y, Merchant FA, Sharpe MA, Xin L en Frigo DE. Regulation of the pentose phosphate pathway by an androgen receptor-mTOR-mediated mechanism and its role in prostate cancer cell growth. Oncogenesis. 2014; 3:e103.
23 Krebs HA en Eggleston LV. De regulatie van de pentosefosfaatcyclus in rattenlever. Adv Enzyme Regul. 1974; 12:421-434.
24 Epstein T, Xu L, Gillies RJ en Gatenby RA. Separation of metabolic supply and demand: aerobic glycolysis as a normal physiological response to fluctuating energetic demands in the membrane. Cancer Metab. 2014; 2:7.
25 Chen X, Qian Y en Wu S. The Warburg effect: Evolving Interpretations of an established concept. Free Radic Biol Med. 2015; 79:253-263.
26 Porporato PE, Dhup S, Dadhich RK, Copetti T en Sonveaux P. Anticancer targets in the glycolytic metabolism of tumors: a comprehensive review. Front Pharmacol. 2011; 2:49.
27 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG en Newton DL. Natriumdichlooracetaat richt zich selectief op cellen met defecten in de mitochondriale ETC. Int J Cancer. 2010; 127:2510-2519.
28 Babu E, Ramachandran S, CoothanKandaswamy V, Elangovan S, Prasad PD, Ganapathy V en Thangaraju M. Role of SLC5A8, a plasma membrane transporter and a tumor suppressor, in the antitumor activity of dichloroacetate. Oncogene. 2011; 30:4026-4037.
29 Jackson VN en Halestrap AP. The kinetics, substrate, and inhibitor specificity of the monocarboxylate (lactate) transporter of rat liver cells determined using the fluorescent intracellular pH indicator, 2′,7′-bis(carboxyethyl)-5(6)-carboxyfluorescein. J Biol Chem. 1996; 271:861-868.
30 Bowker-Kinley MM, Davis WI, Wu P, Harris RA en Popov KM. Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex. Biochem J. 1998; 329:191-196.
31 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B en Michelakis ED. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007; 11:37-51.
32 Pajuelo-Reguera D, Alan L, Olejar T en Jezek P. Dichloroacetate stimulates changes in the mitochondrial network morphology via partial mitophagy in human SH-SY5Y neuroblastoma cells. Int J Oncol. 2015; 46:2409-2418.
33 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, McMurtry MS en Michelakis ED. Mitochondriale activering door remming van PDKII onderdrukt HIF1a signalering en angiogenese in kanker. Oncogene. 2013; 32:1638-1650.
34 Hong SE, Shin KS, Lee YH, Seo SK, Yun SM, Choe TB, Kim HA, Kim EK, Noh WC, Kim JI, Hwang CS, Lee JK, Hwang SG, Jin HO en Park IC. Inhibition of S6K1 enhances dichloroacetate-induced cell death. J Cancer Res Clin Oncol. 2015; 141:1171-1179.
35 Taper HS, Woolley GW, Teller MN en Lardis MP. A new transplantable mouse liver tumor of spontaneous origin. Cancer Res. 1966; 26:143-148.
36 Volpe JP, Hunter N, Basic I en Milas L. Metastatic properties of murine sarcomas and carcinomas. I. Positive correlation with lung colonization and lack of correlation with s.c. tumor take. Clin Exp Metastasis. 1985; 3:281-294.
37 Rockwell S en Kallman RF. Growth and cell population kinetics of single and multiple KHT sarcomas. Cell Tissue Kinet. 1972; 5:449-457.
38 Reilly RT, Gottlieb MB, Ercolini AM, Machiels JP, Kane CE, Okoye FI, Muller WJ, Dixon KH en Jaffee EM. HER-2/neu is een doelwit voor tumorafstoting in getolereerde HER-2/neu-transgene muizen. Cancer Res. 2000; 60:3569-3576.
39 King MP en Attardi G. Human cells lacking mtDNA: repopulation with exogenous mitochondria by complementation. Science. 1989; 246:500-503.
40 Feron O, Belhassen L, Kobzik L, Smith TW, Kelly RA en Michel T. Endothelial nitric oxide synthase targeting to caveolae. Specific interactions with caveolin isoforms in cardiac myocytes and endothelial cells. J Biol Chem. 1996; 271:22810-22814.
41 Diepart C, Verrax J, Calderon PB, Feron O, Jordan BF and Gallez B. Comparison of methods for measuring oxygen consumption in tumor cells in vitro. Anal Biochem. 2010; 396:250-256.
42 Jordan BF, Gregoire V, Demeure RJ, Sonveaux P, Feron O, O’Hara J, Vanhulle VP, Delzenne N en Gallez B. Insulin increases the sensitivity of tumors to irradiation: involvement of an increase in tumor oxygenation mediated by a nitric oxide-dependent decrease of the tumor cells oxygen consumption. Cancer Res. 2002; 62:3555-3561.
Gerelateerde inhoud: