Sven de Mey 1, Inès Dufait 1, Heng Jiang 1, Cyril Corbet 2, Hui Wang 1, Melissa Van De Gucht 1, Lisa Kerkhove 1, Ka Lun Law 1, Hugo Vandenplas 3, Thierry Gevaert 1, Olivier Feron 2 en Mark De Ridder 1,*
1 Departement Radiotherapie, Universitair Ziekenhuis Brussel, Vrije Universiteit Brussel, 1090 Brussel, België; [email protected] (S.d.M.); [email protected] (I.D.); [email protected] (H.J.); [email protected] (H.W.); [email protected] (M.V.D.G.); [email protected] (L.K.); [email protected] (K.L.L.); [email protected] (T.G.)
2 Pool Farmacologie en Therapeutica (FATH), Institut de Recherche Expérimentale et Clinique (IREC), UCLouvain, 1200 Brussel, België; [email protected] (C.C.); [email protected] (O.F.)
3 Afdeling Medische Oncologie, Universitair Ziekenhuis Brussel, Vrije Universiteit Brussel, 1090 Brussel, België; [email protected]
Correspondentie: [email protected]
Ontvangen: 14 september 2020
Geaccepteerd: 4 december 2020
Gepubliceerd: 9 december 2020
Abstract
Mitochondriaal metabolisme is een aantrekkelijk doelwit voor kankertherapie. Het herprogrammeren van metabole paden kan mogelijk tumoren met beperkte behandelingsmogelijkheden, zoals triple-negatieve borstkanker (TNBC), gevoelig maken voor chemo- en/of radiotherapie. Dichlooracetaat (DCA) is een specifieke remmer van het pyruvaat dehydrogenase kinase (PDK), wat leidt tot een verhoogde productie van reactieve zuurstofsoorten (ROS). ROS zijn de primaire effectormoleculen van straling en een toename daarvan zal de radiorespons versterken. In deze studie evalueerden we de effecten van DCA en radiotherapie op twee TNBC-cellijnen, namelijk EMT6 en 4T1, onder aerobe en hypoxische omstandigheden. Zoals verwacht verminderde DCA-behandeling de gefosforyleerde pyruvaatdehydrogenase (PDH) en verlaagde zowel de extracellulaire verzuringssnelheid (ECAR) als de lactaatproductie. Opmerkelijk genoeg leidde DCA-behandeling tot een aanzienlijke toename van de ROS-productie (tot het 15-voudige) in hypoxische kankercellen, maar niet in aerobe cellen. Dienovereenkomstig radicaliseerde DCA hypoxische tumorcellen en 3D-sferoïden, terwijl de intrinsieke radiosensitiviteit van de tumorcellen onveranderd bleef. Onze resultaten suggereren dat DCA, hoewel beschreven als een oxidatieve fosforylering (OXPHOS)-bevorderend geneesmiddel, ook de hypoxische radiorespons kan verhogen. Deze studie baant daarom de weg voor het aanpakken van het mitochondriaal metabolisme van hypoxische kankercellen, met name om radioresistentie te bestrijden.
Trefwoorden: dichlooracetaat; hypoxische stralingsgevoeligheid; borstkanker; reactieve zuurstofspecies
© 2020 door de auteurs. Licentiehouder MDPI, Basel, Zwitserland. Dit artikel is een open access artikel verspreid onder de voorwaarden van de Creative Commons Naamsvermelding (CC BY) licentie (http://creativecommons.org/licenses/by/4.0/).
INLEIDING
Borstkanker is wereldwijd de meest voorkomende vorm van kanker bij vrouwen en leidt jaarlijks tot 627.000 sterfgevallen [1]. In de afgelopen decennia is aanzienlijke vooruitgang geboekt in de behandeling van borstkanker. Er zijn echter slechts beperkte therapieën beschikbaar voor patiënten met triple-negatieve/basis-achtige borstkankers [2,3,4]. De standaardbehandeling van hoog-risico borstkankers bestaat uit neoadjuvante chemotherapie en chirurgie, gevolgd door postoperatieve bestraling van de hele borstkas/borstwand. Tegenwoordig richten onderzoekers zich ofwel op hypofractionering van de adjuvante radiotherapie (FAST-Forward trial [5] of op de combinatie van chemotherapie met preoperatieve radiotherapie. De preoperatieve radiotherapie zou kunnen leiden tot een betere ziektevrije overleving en levenskwaliteit [6,7,8,9,10,11].
Het belangrijkste effect van straling, met name van straling met lage lineaire energieoverdracht, is de inductie van reactieve zuurstofspecies (ROS). Tijdens radiotherapie worden ROS gecreëerd door de radiolyse van water in een extracellulaire omgeving, die toxisch zijn voor tumorcellen en nabijgelegen normaal weefsel. Ongeveer twee derde van de door straling veroorzaakte DNA-schade wordt toegeschreven aan ROS in zoogdiercellen [12]. De reactie van de cellen op door straling veroorzaakte DNA-schade is sterk afhankelijk van de aanwezigheid van zuurstof. Zuurstofmoleculen kunnen namelijk door vrije radicalen veroorzaakte DNA-schade repareren. Dit wordt de “zuurstoffixatiehypothese” genoemd [ 12,13]. In afwezigheid van zuurstof worden DNA-radicalen gereduceerd door verbindingen die sulfhydrylgroepen bevatten, die het DNA in zijn oorspronkelijke vorm herstellen. Volgens deze hypothese is hypoxie, gedefinieerd door een laag zuurstofgehalte in de tumor, een van de belangrijkste oorzaken van het klinisch falen van radiotherapie [14,15]. Hypoxie is een algemeen kenmerk van het tumormilieu. ROS en hypoxie zijn twee factoren met tegengestelde effecten op de radiorespons van de tumor [16]. De algemeen aanvaarde hypothese stelde dat er minder oxidatieve stress optrad in hypoxische gebieden van de tumor door het tekort aan ROS-substraat zuurstof. Recent is echter gebleken dat cellen onder hypoxische omstandigheden meer ROS genereren, voornamelijk via het mitochondriaal metabolisme [ 17,18,19,20].
Een kenmerkende eigenschap van tumorcellen is het vermogen om hun metabolisme te veranderen, waardoor ze energie en metabolieten krijgen die nodig zijn voor hun groei en overleving in omstandigheden met weinig voedingsstoffen en zuurstof. In aanwezigheid van O2 passen kankercellen echter ook hun metabolisme aan in de richting van glycolyse, waarbij de mitochondriale pyruvaatoxidatie wordt omgebogen naar lactaatproductie [21,22]. Dit effect wordt het Warburg-effect genoemd. Recente rapporten wijzen erop dat het Warburg-effect betrokken is bij de weerstand tegen cytotoxische stress veroorzaakt door chemotherapie of radiotherapie [23,24,25,26,27]. Behandelingsmethoden die het glycolytisch metabolisme blokkeren of verminderen, kunnen dus de gevoeligheid van tumorcellen voor radiotherapie vergroten.
Onder hypoxische omstandigheden veroorzaakt hypoxia-induceerbare factor 1-alpha (HIF1α) een toename van de expressie van pyruvaat dehydrogenase kinases (PDK1-4) [28]. Deze enzymen zijn verantwoordelijk voor de metabolismeschakeling in de mitochondria door het reguleren van de fosforyleringsstatus (d.w.z. activiteitstoestand) van pyruvaatdehydrogenase (PDH), dat een belangrijk poortwachter-eiwit is tussen glycolyse en mitochondriale oxidatieve fosforylering (OXPHOS). Dichlooracetaat (DCA), een PDK-remmer met een klein molecuul, kan het Warburg-effect omkeren door PDH te activeren en het pyruvaatmetabolisme terug te leiden naar de mitochondriën. Remming van PDK door DCA wordt gebruikt voor de behandeling van melkziekte en erfelijke mitochondriale ziekten [29,30]. Al deze waarnemingen hebben ertoe geleid DCA te beschouwen als een potentieel geneesmiddel tegen kanker [30,31].
Er is aangetoond dat DCA de radiosensitiviteit van dikke darm- en prostaatkankercellen, slokdarmkraakcelcarcinoom en glioblastoomtumoren verhoogt [32,33,34,35]. Toch is er geen vergelijkbaar onderzoek uitgevoerd op borstkankercellen. Het belangrijkste mechanisme van radiosensitisatie in deze modellen werd toegeschreven aan oxidatieve stress. Tegelijkertijd droegen ook celcyclusstilstand in de G2-M-fase en een verminderde mitochondriale reservecapaciteit bij tot de radiosensitiserende effecten. Op basis van de eerder beschreven resultaten lopen er momenteel twee klinische proeven (één bij hoofd-halscarcinoom en één bij glioblastoom) waarin de antitumoreffecten van een gecombineerde behandeling met DCA en radiotherapie worden onderzocht [36,37]. Al het preklinische onderzoek is uitgevoerd onder aerobe omstandigheden, maar er zijn geen gegevens beschikbaar over de effecten van DCA-behandeling onder hypoxische omstandigheden. Daarom onderzochten we in de huidige studie eerst de hypothese dat DCA lactaat verlaagt en het metabolisme overschakelt van een glycolytisch fenotype naar OXPHOS. Vervolgens bepaalden we of DCA hypoxische borstkankercellen radiosensitief kan maken en onderzochten we de onderliggende mechanismen. De bevindingen van deze studie kunnen belangrijke implicaties hebben voor klinische proeven gericht op het gebruik van PDK-remmers om de radiorespons bij borstkankerpatiënten te verbeteren.
Resultaten
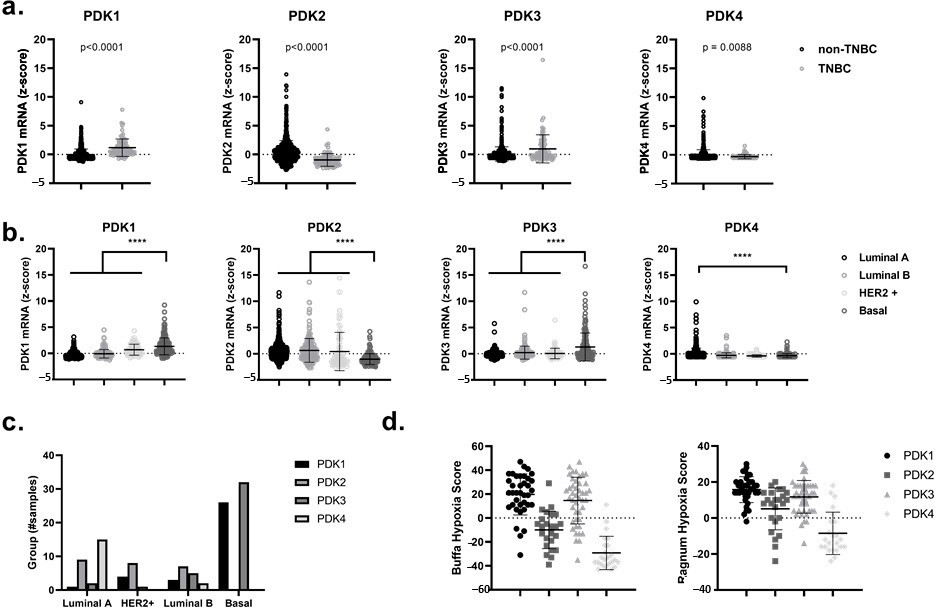
Hoge expressie van PDK1 en PDK3 in Triple-Negative Breast Cancer (TNBC) en Basal-Like Breast Cancer Patients is Correlated with a Hypoxia-Related Gene Signature
Allereerst hebben we met behulp van het online en publiek toegankelijke cBioPortal for Cancer Genomics, analyseerden we de mRNA-niveaus van de vier verschillende PDK-isomeren, namelijk PDK1, PDK2, PDK3 en PDK4, in patiënt-afgeleide gegevens van de primaire borstkankertumorset TCGA (PanCancer Atlas and Cell 2015) [38,39]. Wij toonden een significante toename (p < 0,0001) in de expressie van PDK1 en PDK3 in TNBC versus niet-TNBC en in basaalachtige borstkankers ten opzichte van andere subtypen zoals luminaal A, luminaal B en HER2-verrijkte borstkankers (figuur 1a-c). Met name de upregulatie van PDK1 en PDK3 bij borstkankerpatiënten kon worden gecorreleerd met hogere Ragnum en Buffa hypoxiescores [40,41] (figuur 1d). Deze hypoxiescores zijn gebaseerd op differentiële expressie van specifieke hypoxiegerelateerde genen en zijn vrij toegankelijk via cBioPortal for Cancer Genomics. De waargenomen upregulatie van PDK1 en PDK3 in basaal-achtige borstkankers en hun correlatie met een hypoxisch fenotype (dat verband houdt met de activering van een HIF1α-afhankelijk transcriptioneel programma), suggereert dat het gebruik van PDK-remmers een aantrekkelijke therapeutische modaliteit zou kunnen zijn voor hypoxische radiosensitisatie [42,43,44].
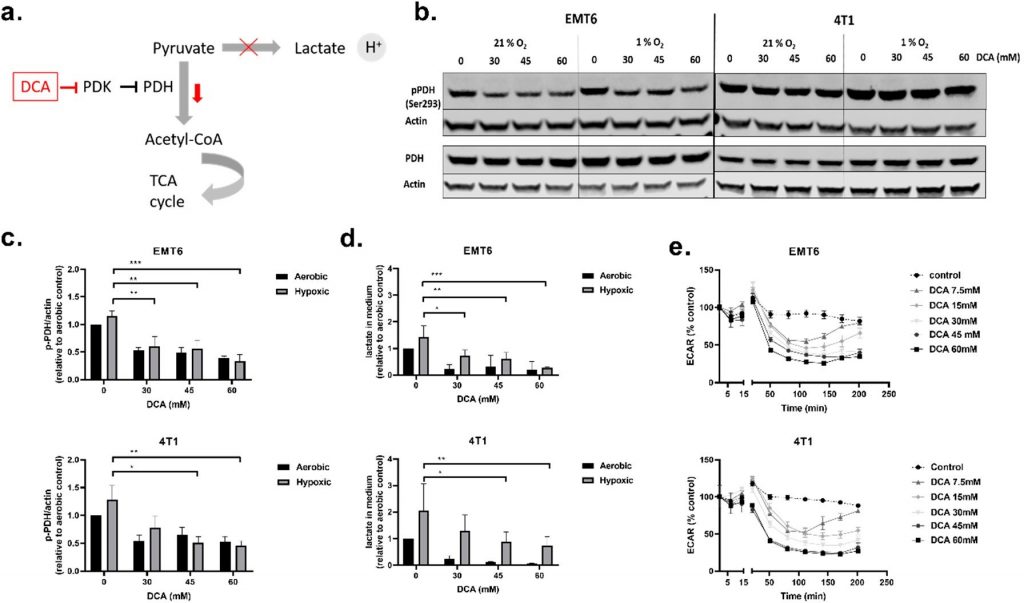
DCA verminderde gefosforyleerd PDH, het extracellulaire lactaatgehalte en de extracellulaire verzuringssnelheid (ECAR)
We begonnen onze in vitro experimenten met het uitvoeren van levensvatbaarheidstests (figuur S1a, b) om de groeiremmende eigenschappen van DCA te bepalen. DCA verminderde de levensvatbaarheid van de cellen op dosisafhankelijke wijze in EMT6- en 4T1-kankercellen, ongeacht de O2-status (figuur S1a). Uit een proliferatietest bleek ook dat bij toenemende DCA-concentraties een verschuiving optrad van groeivertraging naar cytostatische en zelfs cytotoxische effecten (figuur S1b).
Vervolgens onderzochten wij de invloed van DCA op de activiteit van PDK1-4 en het metabolisme van TNBC-cellen. PDH is een belangrijk poortwachter-eiwit van glycolyse en mitochondriaal OXPHOS, wat betekent dat PDH de snelheidsbeperkende decarboxylering van pyruvaat in acetyl-CoA katalyseert. PDH wordt geremd door fosforylering (op Ser293) door PDK, en deze remming kan worden omgekeerd door defosforylering door pyruvaatdehydrogenase-fosfatase (PDP) [45,46] (figuur 2a). Bij aanvaardbare toxische doses (30 mM, 45 mM en 60 mM) evalueerden wij het effect van DCA op de PDK-activiteit door het meten van de niveaus van gefosforyleerd PDH (p-PDH), lactaat in het extracellulaire medium en de ECAR van de cellen in real-time (figuur 2b-e). Alle drie doses DCA verminderden de hoeveelheid p-PDH in EMT6- en 4T1-cellen op dosisafhankelijke wijze onder zowel zuurstofrijke als hypoxische omstandigheden. De afname van p-PDH was significant voor alle doses DCA in EMT6, terwijl in 4T1 alleen 45 mM en 60 mM p-PDH significant verminderden in hypoxische omstandigheden (figuur 2b,c). Om het effect van lagere doses DCA te evalueren, bleek dat in EMT6-cellen de hoeveelheid p-PDH begint af te nemen bij behandeling met 3 mM DCA en in 4T1-cellen bij behandeling met 10 mM DCA (figuur S2a,b). De hoeveelheid lactaat in het medium was verhoogd onder hypoxische omstandigheden in vergelijking met aërobe omstandigheden in beide cellijnen, hetgeen een netto toename van de glycolytische omzet in O2-arme cellen ondersteunt [47,48]. In overeenstemming met de Western blot resultaten leidde behandeling met DCA tot een dosis-afhankelijke afname van lactaat in het medium voor beide cellijnen (figuur 2d). Hoewel de vermindering van lactaatafgifte dramatisch was onder aërobe omstandigheden, werd ook onder hypoxie een dosisafhankelijke vermindering van de productie van het eindglycolytische product waargenomen. Tenslotte veroorzaakte DCA vanaf een dosis van 7,5 mM een tijdsafhankelijke vermindering van ECAR in zowel EMT6 als 4T1 (figuur 2e). De initiële daling van ECAR na behandeling met doses lager dan 30 mM DCA werd in EMT6 na 2,5 uur ongedaan gemaakt. In 4T1 namen we hetzelfde effect waar met DCA-doses lager dan 15 mM. Deze resultaten wijzen erop dat de behandeling van muriene TNBC-cellijnen met DCA de PDH-fosforylering remt en de omvang van de glycolyse vermindert, zowel onder aërobe als onder hypoxische omstandigheden.
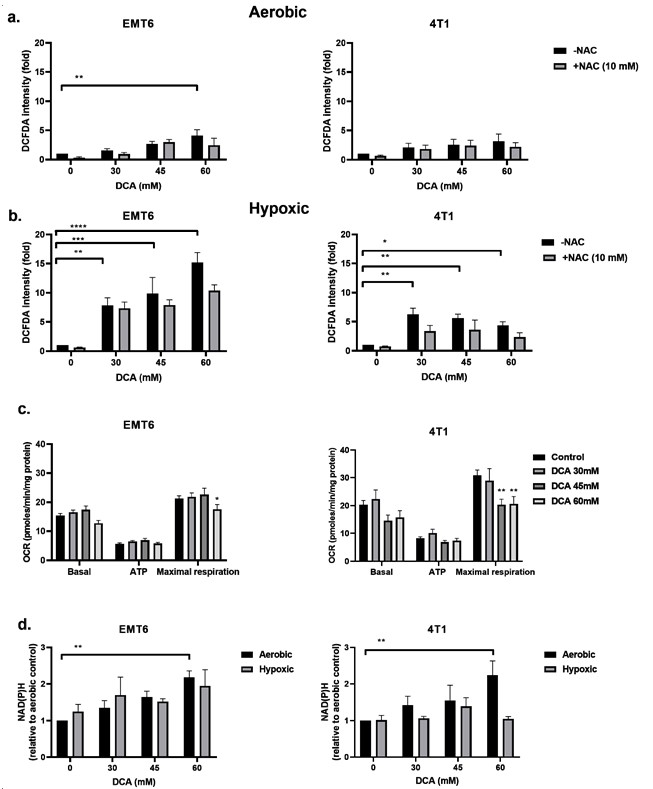
DCA induceert ROS-productie in hypoxische kankercellen
De remming van PDK en activering van PDH worden in verband gebracht met de upregulatie van intracellulaire ROS [49,50]. ROS is van centraal belang bij het genereren van DNA-schade na bestraling. Wij onderzochten de ROS-niveaus in EMT6- en 4T1-cellen onder aërobe en hypoxische omstandigheden met behulp van de CM-H2DCFDA-sonde. Zoals blijkt uit figuur 3a,b, veroorzaakte DCA een dosisafhankelijke ROS-productie in zowel EMT6 als 4T1. Onder aërobe omstandigheden veroorzaakte alleen de hoogste dosis (60 mM) DCA een significante ROS-regulering tot vijfmaal de controle voor EMT6-cellen. In 4T1 cellen werd onder aërobe omstandigheden geen significante verhoging van ROS waargenomen. De toename van ROS werd gedeeltelijk tegengegaan door toevoeging van de ROS-vanger N-acetyl-cysteïne (NAC). Onder hypoxische omstandigheden toonden wij een dosisafhankelijke toename van ROS aan tot het 15-voudige in EMT6-cellen en tot het vijfvoudige in 4T1-cellen; de laagste dosis DCA leidde zelfs tot een significante toename van ROS in beide celtypen (figuur 3b).
Wij redeneerden dat de verhoogde ROS-productie onder hypoxie het gevolg zou kunnen zijn van de gecombineerde effecten van een veranderde mitochondriale elektronentransportketen (door de vermindering van O2 als uiteindelijke elektronenacceptor) en het gedwongen DCA-gedreven pyruvaat-oxidatiemetabolisme. Met de Seahorse analyzer vonden wij dat DCA geen invloed had op de basale ademhaling en ATP productie, maar de maximale ademhalingscapaciteit in EMT6 en 4T1 tumorcellen aanzienlijk verminderde (figuur 3c). Een andere mogelijkheid is dat DCA het NAD(P)H-niveau verhoogt, wat samenhangt met een verhoogde productie van ROS. Wij zagen dat onder aërobe omstandigheden de behandeling van DCA een dosisafhankelijke verhoging van NAD(P)H in EMT6 en 4T1 cellen tot gevolg had (figuur 3d). Onder hypoxische omstandigheden toonden wij een mogelijke toename van NAD(P)H in EMT6-cellen die werden behandeld met 60 mM DCA, maar geen toename in 4T1-cellen (figuur 3d). Samen met de bovenstaande ROS-gegevens suggereren deze bevindingen dat terwijl het mitochondriale metabolisme nog steeds behouden blijft, een lokale toename van ROS-productie bij blootstelling aan DCA de integriteit en de functie van mitochondriën kan veranderen.
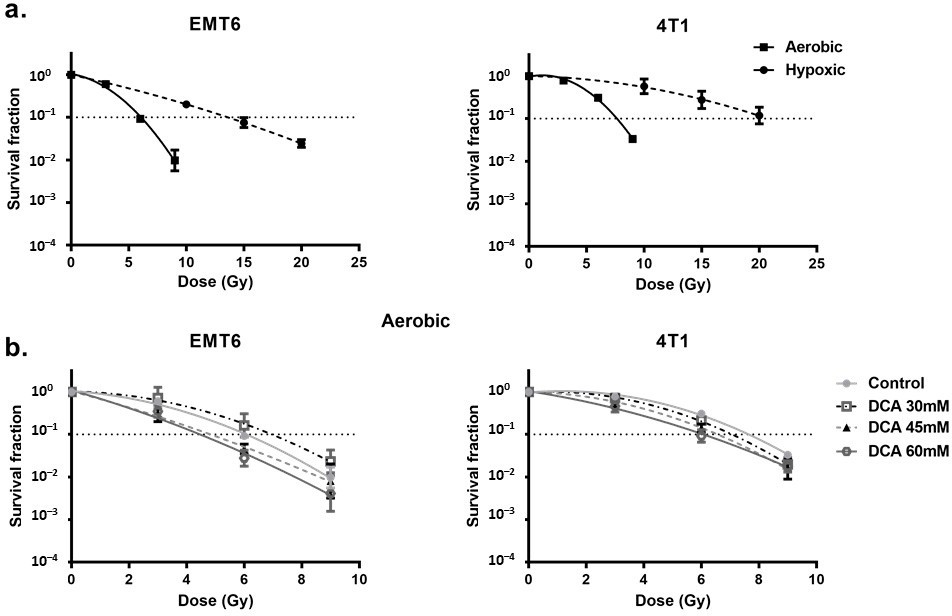
DCA radiosensitiseert hypoxische cellen via ROS
Eerst keken we naar de door hypoxie geïnduceerde radioresistentie van de cellen. Wij vonden een sterk verminderde radiorespons bij vergelijking van hypoxische met aërobe omstandigheden, met een zuurstofverhogingsratio van 2,7 en 2,3 voor respectievelijk EMT6 en 4T1 tumorcellen (figuur 4a). In deze setting zagen wij dat DCA-behandeling een klein effect van intrinsieke radiosensitisatie veroorzaakte in EMT6 maar niet in 4T1 cellen (figuur 4b). Interessant genoeg, in overeenstemming met de resultaten van ROS-generatie onder hypoxische omstandigheden, overwon 60 mM DCA significant (p < 0,05) de hypoxische radioresistentie met versterkingsratio’s van 2,3 en 1,5 bij 60 mM voor respectievelijk EMT6 en 4T1 tumorcellen (figuur 5a). Het radiosensitiserende effect werd omgekeerd door NAC in zowel EMT6 als 4T1 cellen (figuur 5b). De primaire oorzaak van stralingsgeïnduceerde celdood door ROS is de inductie van dubbelstrengsbreuken in het DNA (ds-DNA) [12,51]. Daarom onderzochten we de ds-DNA-schade na behandeling met DCA door de fosforyleringstoestand van γH2AX onder hypoxische omstandigheden te kwantificeren. Zoals blijkt uit figuur 5c, verhoogde DCA de vorming van ds-DNA-schade in zowel EMT6 als 4T1 op dosisafhankelijke wijze.
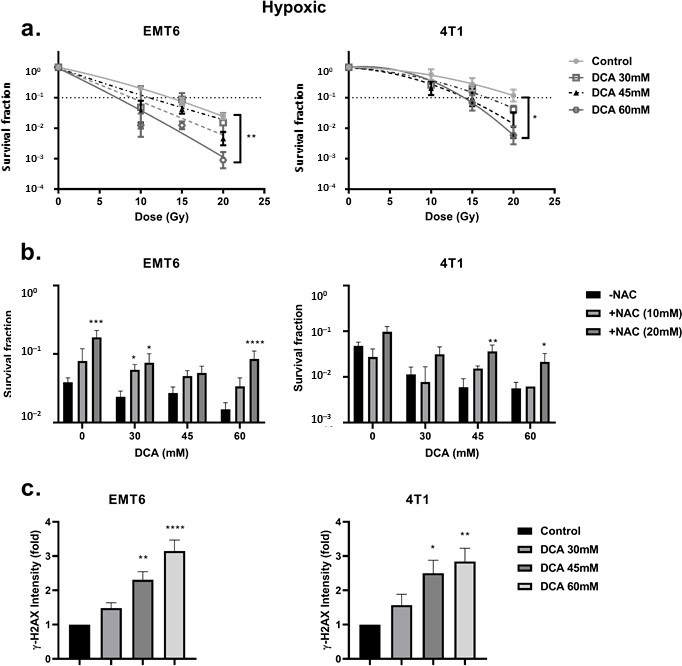
DCA radiosensitiseert 3D-celculturen (sferoïden)
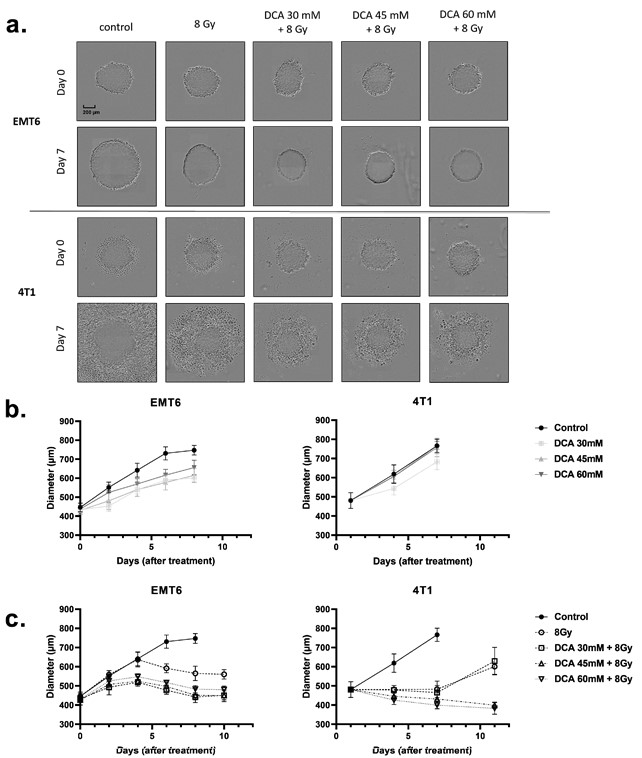
De bovenstaande bevindingen brachten ons ertoe te onderzoeken of DCA ook de radiosensitiviteit van driedimensionale (3D) celkweekmodellen (figuur 6a-c) zou kunnen verbeteren, die de fysisch-chemische eigenschappen van de tumormicro-omgeving, waaronder zuurstofgradiënten, beter nabootsen. Met behulp van sferoïden verkregen uit EMT6- en 4T1-celculturen hebben we de sferoïdengroei gemeten na DCA-behandeling en radiotherapie (figuur 6a). DCA-behandeling alleen leidde tot een kleine groeivertraging bij de EMT6-cellen, maar veranderde de groei van de 4T1-sferoïden niet (figuur 6b). Bestraling met 8 Gy verminderde de groei van tumorsferoïden, een effect dat nog werd versterkt door de combinatie met DCA-behandeling (figuur 6a,c). Opmerkelijk is dat, terwijl cytotoxische effecten werden waargenomen in 4T1 sferoïden (zoals blijkt uit halo’s van dode cellen), cytostatische effecten werden waargenomen in EMT6 sferoïden (figuur 6a).
De combinatie van DCA en radiotherapie vertraagt de tumorgroei niet in vivo
Vervolgens onderzochten we of het in vitro voordeel van de combinatie van DCA en radiotherapie in vivo gevalideerd kon worden (figuur S3a-d). Muizen geïnjecteerd met EMT6- of 4T1-borstkankercellen werden blootgesteld aan een enkele fractie (respectievelijk 12 Gy of 15 Gy) (figuur S3a,c) of gefractioneerde (respectievelijk 5*4 Gy of 5*6 Gy) (figuur S3b,d) bestraling. De enkelvoudige en gefractioneerde stralingsdoses per tumortype zijn vergelijkbaar in biologische effectieve dosis (BED) en verschillen in functie van de intrinsieke radiosensitiviteit van de gebruikte cellijnen. Belangrijk is dat injectie met DCA i.p. of i.t. gedurende 10 dagen veilig was zonder merkbare toxiciteit te veroorzaken (figuur S4a-d). Bestraling alleen vertraagde de tumorgroei in EMT6 gedurende zeven dagen met een enkele fractie en vier dagen voor gefractioneerde bestraling (figuur S3a,b). In 4T1-tumoren vertraagde bestraling de tumorgroei met vijf dagen voor een enkele fractie en tien dagen voor gefractioneerde bestraling, zoals verwacht (figuur S3c,d). DCA (300 mg/kg), via intraperitoneale (ip) of intratumorale (it) injectie, vertraagde de tumorgroei niet, evenmin als de combinatie van DCA met bestraling (figuur S3a-d). Vervolgens valideerden wij of de behandeling van DCA hypoxie in tumoren kon induceren (figuur S3e,f). Hoewel de mate van pimonidazool-gekleurde hypoxie niet veranderde in EMT6-tumoren, werd een trend naar afname van hypoxie waargenomen in reactie op DCA in 4T1-tumoren.
Bespreking
Het doel van deze studie was te onderzoeken of DCA gericht op het mitochondriaal metabolisme TNBC/basaal-achtige borstkankercellen zou kunnen sensibiliseren voor radiotherapie. De meeste TNBC en basaalachtige borstkankers zijn agressieve tumoren waarvoor de behandelingsmogelijkheden beperkt zijn en de prognose slecht [2,3,4]. Deze tumoren vertonen een versterkt glycolytisch fenotype dat hun slechte prognose ondersteunt en bovendien gecorreleerd is met radioresistentie [52]. In de huidige studie vonden wij dat de mRNA-niveaus voor twee van de vier PDK-isovormen (PDK1 en PDK3) zijn verhoogd in de subtypes TNBC en basaalachtige borstkanker. De overexpressie van PDK’s is vastgesteld in verscheidene menselijke tumormonsters [42,53,54,55,56,57,58,59,60,61], en veel kankercellijnen vertonen een aanzienlijke upregulatie van PDK-isovormen [50,62,63]. Er is gemeld dat PDK-overexpressie in verband wordt gebracht met een slechte prognose in verschillende tumortypes [53,54,55,56,57,58,59,60,61]. De overexpressie van PDK’s in kankercellen wordt beïnvloed door verschillende transcriptiefactoren, zoals HIF1 [28,64]. HIF1 onderdrukt actief OXPHOS door de genen die coderen voor PDK1 en PDK3 rechtstreeks te transactiveren. PDK fosforyleert en inactiveert op zijn beurt PDH [42]. Als zodanig kan de upregulatie van PDK’s in kanker direct worden teruggevoerd op zowel transformerende mutaties als de hypoxische tumormicro-omgeving. In overeenstemming met deze bevindingen zagen wij dat de upregulatie van PDK1 en PDK3 mRNA gecorreleerd is met hypoxie-gerelateerde genprofielen. Metabole herprogrammering door het richten van de PDK-enzymen, om over te schakelen van glycolyse naar OXPHOS, lijkt daarom een veelbelovende therapeutische weg om borstkankers met beperkte therapiemogelijkheden te behandelen.
De belangrijkste bevinding van onze studie is dat de PDK-remmer DCA de glycolytische activiteit van borstkankercellen kan verlagen in aanwezigheid van zuurstof, maar ook onder hypoxie [29]. Wij vonden dat DCA de hoeveelheid gefosforyleerd PDH verlaagt en een dosisafhankelijke daling van de extracellulaire lactaatniveaus en ECAR teweegbrengt in aërobe en hypoxische cellen. Vervolgens combineerden wij DCA en radiotherapie onder de hypothese dat door het glycolytische fenotype om te keren en meer pyruvaat naar mitochondriale oxidatie te leiden, tumorcellen meer ROS zouden kunnen produceren en gevoeliger zouden worden voor bestraling. Intrinsieke radiosensitiserende effecten van DCA zijn inderdaad gemeld voor glioblastoomcellen [34,35], niet-kleincellige longcarcinoomcellen (NSCLC) [65,66], colorectale cellen [35], prostaatkankercellen [32] en radioresistente medulloblastoomcellen [ 67]. De voorgestelde mechanismen zijn celcyclusstilstand in de G2-M-fase, waardoor extra DNA-schade ontstaat en opeenvolgende celdood als reactie op verhoogde mitochondriale ROS-productie. In de huidige studie vonden wij dat, terwijl minimale radiosensitiserende effecten werden waargenomen met de hoogste niet-toxische concentratie van DCA onder aërobe omstandigheden, DCA hypoxische borstkankercellen sterk radiosensitiseerde, zowel in 2D als in 3D sferoïden. Hoewel ROS in theorie worden geassocieerd met oxidatieve mechanismen, bestaat er een partnerschap tussen hypoxie en ROS in tumoren. Hypoxie versterkt de generatie van ROS via verlenging van de levensduur van de semiquinon radicalen; omgekeerd helpen ROS tumorcellen zich aan te passen aan hypoxie via stabilisatie van HIF1-α [16,68]. Extracellulaire insulten kunnen dit partnerschap echter verbreken door overmatige ROS-productie op gang te brengen, wat de mitochondriale ademhaling schaadt en dus de hypoxische fractie in tumoren vermindert [16,69,70]. In dit verband remt arseentrioxide het zuurstofverbruik van tumorcellen door een toename van intracellulaire ROS, hetgeen leidt tot een versterkte radiorespons [71]. Ook de onderdrukking van glycolyse zou de radiorespons verhogen. Dit kan gebeuren via ritonavir (glucosetransporterremmer), 2-deoxyglucose (hexokinaseremmer) en lonidamine (hexokinaseremmer), die worden onderzocht in klinische proeven bij verschillende soorten kanker [72,73,74,75]. Een andere mogelijkheid is dat na behandeling met DCA ROS ontstaan door de inductie van NADPH-oxidase [76]. Er is echter geen direct bewijs gevonden dat DCA NADPH oxidase kan upreguleren [77]. Wij zagen een dosis-afhankelijke toename van NAD(P)H onder aërobe omstandigheden, maar niet onder hypoxische omstandigheden in EMT6 en 4T1 cellen. Wij veronderstellen daarom dat de toename van NAD(P)H en de upregulatie van NADPH oxidases slechts een ondergeschikte rol speelt bij de toename van ROS onder hypoxische omstandigheden. Volgens ons is het primaire mechanisme van de waargenomen radiosensitiserende effecten zeer waarschijnlijk het gevolg van de vele malen hogere ROS-productie (tot 15 maal) na DCA-behandeling onder hypoxische omstandigheden.
In overeenstemming met de literatuur hebben wij aangetoond dat suprafysiologische concentraties DCA nodig zijn om veranderingen in de metabolische activiteit, verhoogde ROS-vorming en radiosensitisatie uit te lokken [29]. Onze centrale hypothese is dat deze effecten het gevolg zijn van PDK-remming door DCA [78]. De concentraties die nodig zijn om de gemeten resultaten te induceren zijn echter verschillende malen hoger dan de inhibitieconstante (Ki) van PDK1-4. Het is opmerkelijk dat DCA fysiologisch bestaat als een anion, relatief membraan-ondoorlaatbaar is ondanks zijn kleine omvang en daarom de mitochondriale pyruvaatdrager nodig heeft voor mitochondriale opname [79,80]. De conjugatie van DCA aan een lipofiele drager versterkte echter het mitochondriaal transport. Het verlaagde de IC50-waarde van DCA van millimolair naar het lage micromolaire bereik, wat ruim binnen de Ki van PDK1-4 ligt [81]. DCA bootst de effectieve remming van PDK1-4 door siRNA na, en DCA toegevoegd aan PDK siRNA had geen bijkomende effecten [49,50,60,82,83,84,85,86,87,88]. Vervolgens zou een kleine molecule-achtige DCA direct of indirect andere cellulaire en moleculaire doelen kunnen beïnvloeden. Uit recent onderzoek bleek dat DCA-behandeling de concentratie van elke TCA-intermediair verhoogde, maar geen invloed had op de glucose-opname of de glycolyse [89]. Andere onderzoekers toonden aanwijzingen dat DCA de novo biosynthese van CoA kan verhogen. Aangezien hoge concentraties CoA toxisch kunnen zijn voor cellen, zou dit metabolisch effect gedeeltelijk verantwoordelijk kunnen zijn voor de door DCA gemedieerde toxiciteit voor kankercellen [90]. Recent onderzoek introduceerde een nieuwe hypothese, die suggereert dat de doeltreffendheid van DCA tegen kanker zou kunnen voortvloeien uit zijn vermogen om acetaat tegen te gaan. Hoge acetaatniveaus kunnen de DNA-, RNA- en eiwitsynthese versterken. Bovendien kan het in verband worden gebracht met resistentie tegen geneesmiddelen tegen kanker [91]. Tenslotte ontdekten onderzoekers dat DCA de AMPK signaalroute kan activeren, wat leidt tot een cascade van downstream metabole en antikanker effecten [92,93]. Onze hypothese blijft echter dat onder hypoxische omstandigheden de toediening van pyruvaat in de mitochondriën een verhoging van de ROS-niveaus veroorzaakt, waardoor kankercellen radiosensitief worden. Wij slaagden er niet in deze effecten in vivo te recapituleren, en er is meer werk nodig om te bepalen hoe de radiosensitiserende effecten van DCA in hypoxische tumorcompartimenten kunnen worden vertaald. Farmacokinetische problemen in verband met DCA-toediening in vivo kunnen worden uitgesloten, en de gebruikte dosis DCA (150 mg/kg) ligt ruim binnen de in de literatuur gebruikte doses [29]. De menselijke equivalente dosis van onze in vivo gebruikte dosis DCA is 12 mg/kg/d, ruim binnen de tolerante zone die in klinische proeven wordt gebruikt. Een mogelijke verklaring voor onze mislukte in vivo experimenten is dat een hogere DCA-dosis nodig is om in vivo een radiosensitiserend effect te hebben. In de afgelopen 30 jaar is DCA inderdaad met redelijk succes toegediend als onderzoeksgeneesmiddel voor de behandeling van diabetes type 2, verworven en aangeboren hyperlipoproteïnemie, myocardischemie, verworven en aangeboren melkziekte en meer recentelijk kanker [29,30]. Verschillende fase I/II proeven onderzoeken de veiligheid van DCA en zijn activiteit als middel tegen kanker. DCA wordt snel geabsorbeerd en kan zelfs de bloed-hersenbarrière passeren. Twee fase I-proeven onderzochten de veiligheid van oraal DCA bij patiënten met terugkerende kwaadaardige hersentumoren of metastasen naar de hersenen van kankers buiten het centrale zenuwstelsel [94,95]. Deze studies gaven aan dat DCA over het algemeen goed wordt verdragen door patiënten. Een andere verklaring voor het raadselachtige verschil tussen de in vitro en in vivo effecten is eigenlijk eerder gelegen in veranderingen in de metabole fenotypen wanneer kankercellen (ectopisch) in vivo worden geïnjecteerd. De verhoogde in vitro radiosensitiviteit van DCA wordt namelijk bereikt onder omstandigheden van hypoxie en een hoog glycolytisch metabolisme, zodat de verschuiving van glycolyse naarOXPHOS kan worden waargenomen bij DCA-behandeling, samen met extra ROS-opregulering.
De beperkte mate van hypoxie in in vivo tumoren kan dus wijzen op een beperkt vermogen van DCA om een verschuiving te induceren die reeds aanwezig is in goed door zuurstof verrijkte tumoren die grotendeels afhankelijk zijn van OXPHOS. Verder onderzoek is gerechtvaardigd om de radiosensitiserende effecten van DCA te testen in borsttumormodellen van muizen die gekenmerkt worden door beperkte angiogenese en verhoogde hypoxische fracties.
Concluderend tonen wij aan dat DCA de hypoxische radioresistentie van borstkankercellen in 2D- en 3D-systemen overwint, wat voornamelijk kan worden toegeschreven aan de upregulatie van ROS. Opmerkelijk is dat de door DCA geïnduceerde verschuiving in het metabolisme van glycolyse naarOXPHOS ook oxidatieve stress veroorzaakt onder hypoxische omstandigheden. DCA wordt al vele jaren gebruikt voor de behandeling van metabolische aandoeningen en erfelijke mitochondriale ziekten. In de afgelopen tien jaar is DCA grotendeels opnieuw gebruikt als geneesmiddel tegen kanker, met veelbelovende preklinische gegevens, casusverslagen en klinische proeven, zoals eerder beschreven. De huidige preklinische resultaten geven aan dat verder onderzoek naar het antikankerpotentieel van DCA noodzakelijk is, aangezien hypoxische tumorcellen niet gespaard blijven door de PDK-remmer die dodelijke oxidatieve stress kan induceren, in het bijzonder in combinatie met radiotherapie.
Materialen en methoden
TCGA borstkanker cohort analyse
De PDK1-4 mRNA expressieprofielen (RNA Seq V2 RSEM of log RNA Seq V2 RSEM) werden opgevraagd van de cBioPortal website in de vorm van z-score-getransformeerde data [38,39]. De opgevraagde gegevens werden beoordeeld uit 1084 openbaar beschikbare gevallen van borstkanker van de TCGA PanCancer Atlas en uit 817 borstkankergevallen van de TCGA Cell 2015 database. Voor de TCGA cell 2015 dataset werd de analyse van PDK1-4 uitgevoerd door de triple-negatieve subpopulatie te vergelijken met de rest van de borstkankergevallen. Triple-negatieve borstkanker werd bepaald door een “negatieve” status voor de immunohistochemische scores van oestrogeenreceptor (ER), progesteronreceptor (PR) en humane epidermale groeifactorreceptor 2 (HER2) genen (in totaal 83 gevallen). In de TCGA PanCancer Atlas database werd de analyse van PDK1-4 expressie uitgevoerd over verschillende Pam50 categorieën. Pam50 is een handtekening van 50 genen die borstkanker indeelt in vijf moleculaire intrinsieke subtypes: Luminaal A, Luminaal B, HER2-verrijkt, Basaal-achtig en Normaal-achtig. TCGA borstkanker mRNA expressie en klinische gegevens werden direct geanalyseerd op de cBioPortal website of gedownload voor verdere analyse. De Buffa en Ragnum hypoxia score analyse van de monsters waar PDK1-4 een expressie hebben van een z-score hoger dan 2 werden direct gedaan op de cBioPortal website.
Cellijnen en chemicaliën
De muriene mammara adenocarcinoom EMT6 cellijn werd vriendelijk ter beschikking gesteld door Edith Lord (University of Rochester, Cancer Center, New York), en 4T1 cellen werden verkregen van American Type Culture Collection. Alle experimenten werden uitgevoerd in Roswell Park Memorial Institute 1640 medium (Thermo Fisher Scientific, Waltham, MA, USA) aangevuld met 10% foetaal runderserum (Greiner Bio-One, Kremsmünster, Oostenrijk). HEPES-buffer werd gebruikt voor alle behandelingen van de cellen. Chemicaliën werden verkregen van Sigma-Aldrich (Sigma-Aldrich, St. Louis, MO, USA) tenzij anders vermeld
Behandelingen
EMT6 en 4T1 werden gekweekt tot confluentie en gedurende 16 uur behandeld met DCA in de aangegeven concentraties. N-acetylcysteïne (NAC) werd in 10 mM of 20 mM aan de kweken toegevoegd, zowel 1 uur vóór als tijdens de behandeling met DCA. Daarna werden de culturen gebruikt voor verdere analyse zoals hieronder beschreven. De behandeling werd uitgevoerd in aërobe of hypoxische omstandigheden. Hypoxie werd geïnduceerd door incubatie in stikstof/koolstofdioxide-gecompenseerd gas met 1% zuurstof [96]
MTT-test
De cytotoxiciteit van DCA werd beoordeeld met de MTT-test zoals elders beschreven <a href=”#97″>[97,</a></sup><a href=”#98″><sup>98]</sup>.</a> Kort gezegd werden de cellen gekweekt in 96-wellsplaten en behandeld met de aangegeven concentraties. Na de behandeling werd het medium opgezogen en werd 50 µL MTT-reagens (5 mg/mL) toegevoegd gedurende 1,5 uur. Vervolgens werd 200 µL MTT-oplosmiddel (19:1 DMSO/HCL) toegevoegd en bijgemengd om de formazankristallen die in de cellen ontstonden, op te lossen. De absorptie werd gemeten bij een golflengte van 540 nm met behulp van een spectrofotometer (Bio-Rad Laboratories, Hercules, CA, USA). De levensvatbaarheid van de cellen werd bepaald door de behandelde cellen te normaliseren ten opzichte van de onbehandelde controlecellen.</p>
<p><strong>Kinetische groeitest<br></strong>De invloed van DCA op de proliferatie van de EMT6- en 4T1-cellen werd beoordeeld met behulp van een kinetische groeitest. De cellen werden opgekweekt tot confluentie in 96-wells kweekplaten en behandeld met DCA bij de aangegeven concentraties in 6 herhalingen. Fotomicrofoto’s werden om de twee uur genomen met een Incucyte live cell imager (Essen Biosciences, Newark, Verenigd Koninkrijk), en de confluentie van de culturen werd gemeten met behulp van Incucyte software (Incucyte ZOOM 2018A, Essen Biosciences) over 80 uur in cultuur.</p>
<p><strong>Western blot<br></strong>Western blot analyses werden uitgevoerd zoals eerder beschreven <sup><a href=”#99″>[99]</a></sup>. Kort gezegd werden de cellen gelyseerd in 1% triton-X-buffer aangevuld met een fosfataseremmer (P5726), proteaseremmer (P8340) en leupeptinetrifluoracetaat (L2023). De lysaten werden gecentrifugeerd en de eiwitconcentratie werd bepaald met de Bio-Rad DC protein assay (Bio-Rad 500-0116). Gelijkwaardige hoeveelheden eiwit werden geladen op een 12% oplossende acrylamidegel. Eiwitoverdracht vond een nacht plaats bij 4 °C met behulp van een nitrocellulosemembraan (0,45 µM, Thermo 88018, Thermo Fisher Scientific). De membranen werden geblokkeerd met 5% BSA in TBS en gewassen (TBST). Geblokkeerde membranen werden een nacht bij 4 °C gelabeld met primair antilichaam. Primaire antilichamen werden gelabeld met nabij-infrarood secundaire antilichamen (IRDyes 680 RD of 800 CW, LI-COR Biosciences, Lincoln, NE, USA), gedetecteerd en gekwantificeerd met behulp van Odyssey Fc Imaging System (LI-COR Biosciences). Primaire antilichamen waren: fosfo-PDH (ABS204, MERCK, Darmstadt, Duitsland), totaal-PDH (C54G1, celsignalering), antibeta ACTIN (A1978), en antialpha TUBULIN (T9026).</p>
<p><strong>Lactaattest<br></strong>Na de behandeling werd de L-lactaattest uitgevoerd volgens de instructies van de fabrikant. Kort gezegd werd het supernatant van de cellen genomen en aan de masterreactiemix toegevoegd. Hierna vond een incubatieperiode van 30 minuten plaats bij kamertemperatuur in het donker. Vervolgens werd de absorptie gemeten bij 570 nm en werd de hoeveelheid L-lactaat in het medium berekend. Bovendien werden de cellen gelyseerd en werd de totale hoeveelheid eiwitten onderzocht met de BCA-eiwitbepaling (23227, Thermo Fisher); deze stap werd uitgevoerd om de lactaatwaarden te normaliseren naar de hoeveelheid eiwitten in de cel.</p>
<p><strong>Seahorse Metabolic Profiling<br></strong>Oxygen consumption rate (OCR) en extracellulaire verzuring (ECAR) werden bepaald met een Seahorse XF96 analyzer (Agilent Technologies, Santa Clara, CA, USA) zoals eerder gerapporteerd <sup><a href=”#100″>[100]</a></sup>. Kort gezegd werden 1,5 × 10<sup>5</sup> cellen uitgezaaid in 96-wellsplaten. Cellen werden vervolgens behandeld met DCA, hetzij ’s nachts (voor OCR-metingen) of gedurende 3 uur (tijdens de Seahorse run, voor ECAR). De cellen werden geëquilibreerd in ongebufferd Dulbecco’s Modified Eagle Medium (DMEM) medium met 2 mM glutamine en 10 mM glucose bij 37 °C in een CO<sub>2</sub>-vrije incubator en vervolgens gemeten met een Seahorse-analyzer. Om gedetailleerde informatie over de elektronentransportketen in de mitochondriën te verkrijgen, werden achtereenvolgens specifieke remmers toegevoegd, bestaande uit oligomycine, FCCP, rotenon en antimycine A. ECAR werd genormaliseerd naar het basisniveau.</p>
<p><strong>ROS-productie<br></strong>Het intracellulaire niveau van ROS werd gedetecteerd met behulp van 5-(6)-chloormethyl-2′,7′-dichlorodihydro-fluoresceïne-diacetaat (CM-H<sub>2</sub>DCFDA), een oxidatiegevoelige fluorescerende probe (Abcam, Cambridge, Verenigd Koninkrijk) zoals eerder beschreven <sup><a href=”#97″>[97]</a></sup>. Kort gezegd werden de cellen na behandeling gekleurd met 5 uM CM-H2DCFDA bij 37 °C gedurende 30 minuten. De gemiddelde fluorescentie-intensiteit werd gemeten met een FACSCanto flowcytometer (BD Bioscience, Franklin lakes, NJ, USA) en geanalyseerd met de Flowjo-software (BD Bioscience).</p>
<p><strong>NAD(P)H Meting<br></strong>Het intracellulaire niveau van NAD(P)H werd gedetecteerd met de Cell Meter<sup>TM</sup> intracellulaire NADH/NADPH flowcytometrische analyse kit (AAT BioQuest, Sunnyvale, CA, USA), volgens de instructies van de fabrikant. Kort gezegd werden de cellen na behandeling gekleurd met JZLA707 NAD(P)H-sensor bij 37 °C gedurende 45 min. De gemiddelde fluorescentie-intensiteit werd gemeten met een FACSCanto flowcytometer (BD Bioscience) en geanalyseerd met de Flowjo-software (BD Bioscience).</p>
<p><strong>Radiation and Clonogenic Assay<br></strong>Na behandeling werden de cellen bestraald met de aangegeven doses op een 6 MV Linac (Varian Truebeam STx, Palo Alto, CA, USA; BrainLAB AG, Feldkirchen, Duitsland) en opnieuw uitgezaaid in 6-well platen voor kolonievorming. Vóór het zaaien werden de cellen geteld en genormaliseerd ten opzichte van de controleomstandigheden. Na 7-12 dagen werden de culturen gefixeerd met kristalviolet en werden de kolonies (>50 cellen) geteld. Overlevingsfracties (SF) werden gemodelleerd volgens het lineair-kwadratisch model met behulp van GraphPad Prism 8 software (GraphPad Prism Software Inc, San Diego, CA, USA). Radiosensitisatie werd geëvalueerd op het niveau van 0,1 overlevende fracties.</p>
<p><strong>Driedimensionale (3D) celculturen (sferoïden)<br></strong>Sferoïden werden bereid met EMT6- en 4T1-cellen door 4000 cellen per putje te zaaien in een 96-wells-plaat met ultra-lage bevestiging (Corning, Corning, NY, VS). DCA werd toegevoegd aan het medium wanneer de sferoïden ongeveer 500 µm in diameter waren. Daarna werden de sferoïden bestraald bij 8 Gy, en de behandeling werd gewassen met vers medium dat om de 3 dagen werd ververst. De sferoïden werden gedurende 10 dagen gevolgd met het IncuCyte Live Cell Imaging System (Essen Bioscience).</p>
<p><strong>Muis Tumormodel<br></strong>4T1 en EMT6 tumorcellen (0,5 × 10<sup>6</sup>) werden geënt in de linker achterpoot van syngene Balb/c muizen (vrouwtjes, 7-9 weken oud; Charles River Laboratories, L’Arbresle Cedex, Frankrijk). Wanneer de tumoren ongeveer 150 mm<sup>3</sup> bereikten, werden de muizen gerandomiseerd en gedurende 10 opeenvolgende dagen behandeld met DCA 300 mg/kg (intraperitoneaal of intratumoraal). De muizen werden bestraald met een enkelvoudige dosis van 12 Gy (EMT6-tumoren) of 15 Gy (4T1-tumoren) of een gefractioneerd bestralingsschema van 5*4 Gy (EMT6-tumoren) en 5*6 Gy (4T1-tumoren) wanneer de tumoren ongeveer 150 mm3 bereikten. De bestraling werd toegediend met een 6 MV Linac (Varian Truebeam STx). Tijdens het gehele verloop van het experiment werden de tumoren gemeten met een elektronische schuifmaat, en het tumorvolume werd berekend aan de hand van de volgende formule Volume = (Lengte × Breedte<sup>2</sup>) × 0,5. De experimenten werden goedgekeurd door het Ethisch Comité voor het gebruik van proefdieren van de Vrije Universiteit Brussel (ethische dossiernummers: 16-552-2 (18/4/2017) en 18-552-2 (1/6/2018) </p>
<p><strong>Pimonidazole Staining on Tumor Sections<br></strong>Tumoren werden geënt zoals beschreven in deel 4.13. Na de behandeling werd pimonidazol (60 mg/kg; Hypoxyprobe) i.v. in de staartader geïnjecteerd. Tumoren werden 1,5 uur later uitgesneden, gewogen, ingevroren en opgeslagen in plastic flesjes bij -80 °C. Tumorsecties (5 µm) werden vervolgens immunologisch gekleurd met een anti-Pimo konijnenantilichaam (Hypoxyprobe, Burlington, MA, USA), dat werd gekleurd met een anti-rabbit FITC antilichaam (Abcam). De tumorglaasjes werden gemonteerd met montagevloeistof (DAKO montage medium, Agilent) gemengd met dapi (Sigma-Aldrich) en bedekt met een dekglaasje. Beelden werden verkregen met fluorescentie confocale microscopie (EVOS FL, Thermo Fisher) en geanalyseerd met ImageJ.</p>
<p><strong>Statistieken</strong><br>Alle analyses werden uitgevoerd met GraphPad Prism 8.4.3. Gegevens worden uitgedrukt als gemiddelde ± SEM van ten minste drie onafhankelijke experimenten, tenzij anders aangegeven. Ongepaarde <em>t</em>-test, one-way ANOVA gevolgd door een Dunnett’s multiple comparison test en two-way ANOVA met Dunnett’s, Sidak’s of Tukey’s multiple comparison test werden gebruikt voor statistische analyses: * <em>p</em> < 0,05, ** <em>p</em> < 0,01, *** <em>p</em> < 0,001, **** <em>p</em> < 0,0001.</p>
<h2>Bijlage materialen</h2>
<p>Aanvullend materiaal is te vinden op https://www.mdpi.com/1422-0067/21/24/9367/s1.</p>
<h2>Bijdragen van auteurs</h2>
<p>Conceptualisatie, S.d.M., I.D. en H.J.; data curation, S.d.M., C.C., K.L.L. en H.V.; onderzoek, S.d.M.; methodologie, T.G.; supervisie, I.D., H.J., O.F. en M.D.R.; visualisatie, S.d.M.; schrijven oorspronkelijk ontwerp, S.d.M.; schrijven-revisie en redactie, I.D., C.C., H.W., M.V.D.G., L.K., O.F. en M.D.R. Alle auteurs bespraken de resultaten en droegen bij aan het uiteindelijke manuscript. Alle auteurs hebben de gepubliceerde versie van het manuscript gelezen en goedgekeurd.</p>
<h2>Financiering</h2>
<p>Dit werk werd ondersteund door het strategisch onderzoeksprogramma “Societal Benefit of Markerless Stereotactic Body Radiotherapy: a Statistical Support based on Quantitative Imaging” (Zwaartepunt, SRP 53, 2019-2024) van de onderzoeksraad van de Vrije Universiteit Brussel.</p>
<h2>Erkenningen</h2>
<p>De auteurs bedanken Valeri Verovski voor de waardevolle en constructieve suggesties.</p>
<h2>Belangenverstrengeling</h2>
<p>De auteurs verklaren geen potentiële belangenconflicten te hebben.</p>
<h2>Aantekening uitgever:</h2>
<p>MDPI blijft neutraal met betrekking tot jurisdictionele claims in gepubliceerde kaarten en institutionele affiliaties.</p>
<h2>Afkortingen</h2>
<figure class=”wp-block-table”><table><tbody><tr><td>DCA</td><td>Dichlooracetaat</td></tr><tr><td>ECAR</td><td>Extracellulaire verzuringsgraad</td></tr><tr><td>NAC</td><td>N-acetyl-cysteïne</td></tr><tr><td>OCR</td><td>Oxygen consumption rate</td></tr><tr><td>OXPHOS</td><td>Oxidatieve fosforylering</td></tr><tr><td>PDH</td><td>Pyruvaat dehydrogenase</td></tr><tr><td>PDK</td><td>Pyruvaat dehydrogenase kinase</td></tr><td>PDP</td><td>Pyruvaat dehydrogenase fosfatase</td></tr><tr><td>ROS</td><td>Reactieve zuurstofsoorten</td></tr><tr><td>TBNC</td><td>Triple-negatieve borstkanker</td></tr></tbody></table></figure>
<h2>Verwijzingen</h2>
<span id=”1″ class=”references blue-text”>1</span> Wereldgezondheidsorganisatie. Borstkanker. Online beschikbaar: https://www.who.int/cancer/prevention/ diagnosis-screening/breast-cancer/en/ (geraadpleegd op 10 september 2020).
<br><span id=”2″ class=”referencess blue-text”>2</span> Bianchini, G.; Balko, J.M.; Mayer, I.A.; Sanders, M.E.; Gianni, L. Triple-negatieve borstkanker: Uitdagingen en mogelijkheden van een heterogene ziekte. Nat. Rev. Clin. Oncol. 2016, 13, 674-690. [CrossRef] [PubMed]
<br><span id=”3″ class=”referencess blue-text”>3</span> Fragomeni, S.M.; Sciallis, A.; Jeruss, J.S. Molecular subtypes and local-regional control of breast cancer. Surg. Oncol. Clin. N. Am. 2018, 27, 95-120. [CrossRef] [PubMed]
<br><span id=”4″ class=”referencess blue-text”>4</span> Prat, A.; Pineda, E.; Adamo, B.; Galván, P.; Fernández, A.; Gaba, L.; Díez, M.; Viladot, M.; Arance, A.; Muñoz, M. Clinical implications of the intrinsic molecular subtypes of breast cancer. Borst 2015, 24 (Suppl. 2), S26-S35. [CrossRef] [PubMed]
<br><span id=”5″ class=”referencess blue-text”>5</span> Brunt, A.M.; Haviland, J.S.; Wheatley, D.A.; Sydenham, M.A.; Alhasso, A.; Bloomfield, D.J.; Chan, C.; Churn, M.; Cleator, S.; Coles, C.E.; et al. Hypofractionated breast radiotherapy for 1 week versus 3 weken (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomised, phase 3 trial. Lancet 2020, 395, 1613-1626. [CrossRef]
<br><span id=”6″ class=”referencess blue-text”>6</span> Poleszczuk, J.; Luddy, K.; Chen, L.; Lee, J.K.; Harrison, L.B.; Czerniecki, B.J.; Soliman, H.; Enderling, H. Neoadjuvante radiotherapie van borstkanker in een vroeg stadium en ziektevrije overleving op lange termijn. Breast Cancer Res. 2017, 19, 1-7. [CrossRef]
<br><span id=”7″ class=”referencess blue-text”>7</span> Lightowlers, S.V.; Boersma, L.J.; Fourquet, A.; Kirova, Y.M.; Offersen, B.V.; Poortmans, P.; Scholten, A.N.; Somaiah, N.; Coles, C.E. Preoperatieve borstbestralingstherapie: Indicaties en perspectieven. Eur. J. Cancer 2017, 82, 184-192. [CrossRef]
<br><span id=”8″ class=”referencess blue-text”>8</span> Palta, M.; Yoo, S.; Adamson, J.D.; Prosnitz, L.R.; Horton, J.K. Preoperative single fraction partial breast radiotherapy for early-stage breast cancer. Int. J. Radiat. Oncol. Biol. Phys. 2012, 82, 37-42. [CrossRef]
<br><span id=”9″ class=”referencess blue-text”>9</span> Horton, J.K.; Blitzblau, R.C.; Yoo, S.; Geradts, J.; Chang, Z.; Baker, J.A.; Georgiade, G.S.; Chen, W.; Siamakpour-Reihani, S.; Wang, C.; et al. Preoperative Single-Fraction Partial Breast Radiation Therapy: A Novel Phase 1, Dose-Escalation Protocol with Radiation Response Biomarkers. Int. J. Radiat. Oncol. Biol. Phys. 2015, 92, 846-855. [CrossRef]
<br><span id=”10″ class=”referencess blue-text”>10</span> Roth, S.L.; Audretsch, W.; Bojar, H.; Lang, I.; Willers, R.; Budach, W. Retrospectieve studie van neoadjuvante versus adjuvante radiochemotherapie bij lokaal gevorderde niet-inflammatoire borstkanker: Overlevingsvoordeel in cT2-categorie door neoadjuvante radiochemotherapie. Strahlentherapie und Onkologie 2010, 186, 299-306. [CrossRef]
<br><span id=”11″ class=”referencess blue-text”>11</span> Pre- of postoperatieve versnelde radiotherapie. Online beschikbaar: https://ClinicalTrials.gov/show/ NCT03783364 (geraadpleegd op 27 augustus 2020).
<br><span id=”12″ class=”referencess blue-text”>12</span> Hall, E.J.; Giaccia, A.J. Radiobiology for the Radiologist; Lippincott Williams & Wilkins: Philadelphia, PA, USA, 2012; Volume 7.
<br><span id=”13″ class=”referencess blue-text”>13</span> De Ridder, M.; Tournel, K.; Van Nieuwenhove, Y.; Engels, B.; Hoorens, A.; Everaert, H.; De Beeck, B.O.; Vinh-Hung, V.; De Grève, J.; Delvaux, G.; et al. Phase II study of preoperative helical tomotherapy for rectal cancer. Int. J. Radiat. Oncol. Biol. Phys. 2008, 70, 728-734. [CrossRef]
<br><span id=”14″ class=”referencess blue-text”>14</span> Gray, L.H.; Conger, A.D.; Ebert, M.; Hornsey, S.; Scott, O.C. The concentration of oxygen dissolved in tissues at the time of irradiation as a factor in radiotherapy. Br. J. Radiol. 1953, 26, 638-648. [CrossRef] [PubMed]
<br><span id=”15″ class=”referencess blue-text”>15</span> Brown, J.M.; Wilson, W.R. Exploiting tumor hypoxia in cancer treatment. Nat. Rev. Cancer 2004, 4, 437-447. [CrossRef] [PubMed]
<br><span id=”16″ class=”referencess blue-text”>16</span> Wang, H.; Jiang, H.; Van De Gucht, M.; De Ridder, M. Hypoxic Radioresistance: Can ROS Be the Key to Overcome It? Cancers 2019, 11, 112. [CrossRef] [PubMed]
<br><span id=”17″ class=”referencess blue-text”>17</span> Guzy, R.D.; Schumacker, P.T. Oxygen sensing by mitochondria at complex III: The paradox of increased reactive oxygen species during hypoxia. Exp. Physiol. 2006, 91, 807-819. [CrossRef]
<br><span id=”18″ class=”referencess blue-text”>18</span> Chandel, N.S.; McClintock, D.S.; Feliciano, C.E.; Wood, T.M.; Melendez, J.A.; Rodriguez, A.M.; Schumacker, P.T. Reactive oxygen species generated at mitochondrial complex III stabilize hypoxia-inducible factor-1alpha during hypoxia: A mechanism of O2 sensing. J. Biol. Chem. 2000, 275. [CrossRef]
<br><span id=”19″ class=”referencess blue-text”>19</span> Azimi, I.; Petersen, R.M.; Thompson, E.W.; Roberts-Thomson, S.J.; Monteith, G.R. Hypoxia-induced reactive oxygen species mediate N-cadherin and SERPINE1 expression, EGFR signalling and motility in MDA-MB-468 breast cancer cells. Sci. Rep. 2017, 7, 1-11. [CrossRef]
<br><span id=”20″ class=”referencess blue-text”>20</span> Johnson, M.K.; Vathanayagam, R.R.; Wang, E.S. Hypoxia-Associated Effects on Reactive Oxygen Species Generation by Human Acute Myeloid Leukemia Cells. Blood 2011, 118, 4998. [CrossRef]
<br><span id=”21″ class=”referencess blue-text”>21</span> Hanahan, D.; Weinberg, R.A. Hallmarks of Cancer: The Next Generation. Cell 2011, 144, 646-674. [CrossRef]
<br><span id=”22″ class=”referencess blue-text”>22</span> Warburg, O. On the origin of cancer cells. Science 1956, 123, 309-314. [CrossRef]
<br><span id=”23″ class=”referencess blue-text”>23</span> Pitroda, S.P.; Wakim, B.T.; Sood, R.F.; Beveridge, M.G.; Beckett, M.A.; MacDermed, D.M.; Weichselbaum, R.R.; Khodarev, N.N. STAT1-afhankelijke expressie van energiemetabolische paden verbindt tumorgroei en radioresistentie met het Warburg-effect. BMC Med. 2009, 7, 68. [CrossRef]
<br><span id=”24″ class=”referencess blue-text”>24</span> Song, K.; Li, M.; Xu, X.; Xuan, L.I.; Huang, G.; Liu, Q. Resistentie tegen chemotherapie is geassocieerd met veranderd glucosemetabolisme in acute myeloïde leukemie. Oncol. Lett. 2016, 12, 334-342. [CrossRef]
<br><span id=”25″ class=”referencess blue-text”>25</span> Zhou, Y.; Tozzi, F.; Chen, J.; Fan, F.; Xia, L.; Wang, J.; Gao, G.; Zhang, A.; Xia, X.; Brasher, H.; et al. Intracellulaire ATP-niveaus zijn een centrale determinant van chemoresistentie in darmkankercellen. Cancer Res. 2012, 72, 304-314. [CrossRef] [PubMed]
<br><span id=”26″ class=”referencess blue-text”>26</span> Shimura, T.; Noma, N.; Sano, Y.; Ochiai, Y.; Oikawa, T.; Fukumoto, M.; Kunugita, N. AKT-gemedieerde verhoogde aerobe glycolyse veroorzaakt verworven radioresistentie door menselijke tumorcellen. Radiother. Oncol. 2014, 112, 302-307. [CrossRef] [PubMed]
<br><span id=”27″ class=”referencess blue-text”>27</span> Sattler, U.G.; Meyer, S.S.; Quennet, V.; Hoerner, C.; Knoerzer, H.; Fabian, C.; Yaromina, A.; Zips, D.; Walenta, S.; Baumann, M.; et al. Glycolytic metabolism and tumor response to fractionated irradiation. Radiother. Oncol. 2010, 94, 102-109. [CrossRef] [PubMed]
<br><span id=”28″ class=”referencess blue-text”>28</span> Kim, J.W.; Tchernyshyov, I.; Semenza, G.L.; Dang, C.V. HIF-1-gemedieerde expressie van pyruvaat-dehydrogenase kinase: A Metabolic Switch Required for Cellular Adaptation to Hypoxia. Cell Metab. 2006, 3, 177-185. [CrossRef] [PubMed]
<br><span id=”29″ class=”referencess blue-text”>29</span> Kankotia, S.; Stacpoole, P.W. Dichloroacetate and cancer: Nieuw thuis voor een weesgeneesmiddel? Biochim. Biophys. Acta 2014, 1846, 617-629. [CrossRef]
<br><span id=”30″ class=”referencess blue-text”>30</span> James, M.O.; Jahn, S.C.; Zhong, G.; Smeltz, M.G.; Hu, Z.; Stacpoole, P.W. Therapeutische toepassingen van dichlooracetaat en de rol van glutathione transferase zeta-1. Pharmacol. Ther. 2017, 170, 166-180. [CrossRef] <br><span id=”31″ class=”referencess blue-text”>31</span> Tataranni, T.; Piccoli, C. Dichloroacetate (DCA) and Cancer: Een overzicht naar klinische toepassingen. Oxidatieve Med. Cell. Longev. 2019, 2019, 1-14. [CrossRef]
<br><span id=”32″ class=”referencess blue-text”>32</span> Cao, W.; Yacoub, S.; Shiverick, K.T.; Namiki, K.; Sakai, Y.; Porvasnik, S.; Urbanek, C.; Rosser, C.J. Dichloroacetate (DCA) sensibiliseert zowel wild-type als over-expressing Bcl-2 prostaatkankercellen in vitro voor straling. Prostaat 2008, 68, 1223-1231. [CrossRef]
<br><span id=”33″ class=”referencess blue-text”>33</span> Dong, G.; Chen, Q.; Jiang, F.; Yu, D.; Mao, Q.; Xia, W.; Shi, R.; Wang, J.; Xu, L. Diisopropylamine Dichloroacetate Enhances Radiosensitization in Esophageal Squamous Cell Carcinoma by Increasing Mitochondria-Derived Reactive Oxygen Species Levels. Oncotarget 2016, 7, 68170-68178. [CrossRef]
<br><span id=”34″ class=”referencess blue-text”>34</span> Shen, H.; Hau, E.; Joshi, S.; Dilda, P.J.; McDonald, K.L. Sensitization of Glioblastoma Cells to Irradiation by Modulating the Glucose Metabolism. Mol. Cancer Ther. 2015, 14, 1794-1804. [CrossRef] [PubMed]
<br><span id=”35″ class=”referencess blue-text”>35</span> Zwicker, F.; Kirsner, A.; Peschke, P.; Roeder, F.; Debus, J.; Huber, P.E.; Weber, K.J. Dichloroacetate induceert tumorspecifieke radiosensitiviteit in vitro maar dempt stralingsgeïnduceerde tumorgroei vertraging in vivo. Strahlentherapie und Onkologie 2013, 189, 684-692. [CrossRef] [PubMed]
<br><span id=”36″ class=”referencess blue-text”>36</span> Combinatie van radiotherapie en temozolomide met dichlooracetaat bij patiënten met nieuw gediagnosticeerd glioblastoom. Online beschikbaar: https://ClinicalTrials.gov/show/NCT00703859 (geraadpleegd op 13 juli 2020).
<br><span id=”37″ class=”referencess blue-text”>37</span> Studie van DCA (dichlooracetaat) in combinatie met Cisplatine en definitieve bestraling bij hoofd-halscarcinoom. Online beschikbaar: https://ClinicalTrials.gov/show/NCT01386632 (geraadpleegd op 13 juli 2020).
<br><span id=”38″ class=”referencess blue-text”>38</span> Cerami, E.; Gao, J.; Dogrusoz, U.; Gross, B.E.; Sumer, S.O.; Aksoy, B.A.; Jacobsen, A.; Byrne, C.J.; Heuer, M.L.; Larsson, E.; et al. The cBio cancer genomics portal: Een open platform voor het verkennen van multidimensionale kanker genomics gegevens. Cancer Discov. 2012, 2, 401-404. [CrossRef] [PubMed]
<br><span id=”39″ class=”referencess blue-text”>39</span> Gao, J.; Aksoy, B.A.; Dogrusoz, U.; Dresdner, G.; Gross, B.; Sumer, S.O.; Sun, Y.; Jacobsen, A.; Sinha, R.; Larsson, E.; et al. Integratieve analyse van complexe kankergenomics en klinische profielen met behulp van het cBioPortaal. Sci. Signal. 2013, 6. [CrossRef] [PubMed]
<br><span id=”40″ class=”referencess blue-text”>40</span> Ragnum, H.B.; Vlatkovic, L.; Lie, A.K.; Axcrona, K.; Julin, C.H.; Frikstad, K.M.; Hole, K.H.; Seierstad, T.; Lyng, H. The tumour hypoxia marker pimonidazole reflects a transcriptional programme associated with aggressive prostate cancer. Br. J. Cancer 2015, 112, 382-390. [CrossRef]
<br><span id=”41″ class=”referencess blue-text”>41</span> Buffa, F.M.; Harris, A.L.; West, C.M.; Miller, C.J. Large meta-analysis of multiple cancers reveals a common, compact and highly prognostic hypoxia metagene. Br. J. Cancer 2010, 102, 428-435. [CrossRef]
<br><span id=”42″ class=”referencess blue-text”>42</span> Zhang, W.; Zhang, S.L.; Hu, X.; Tam, K.Y. Targeting Tumor Metabolism for Cancer Treatment: Is Pyruvate Dehydrogenase Kinases (PDK’s) een levensvatbaar doelwit tegen kanker? Int. J. Biol. Sci. 2015, 11, 1390-1400. [CrossRef]
<br><span id=”43″ class=”referencess blue-text”>43</span> Tang, L.; Wei, F.; Wu, Y.; He, Y.; Shi, L.; Xiong, F.; Gong, Z.; Guo, C.; Li, X.; Deng, H.; et al. Role of metabolism in cancer cell radioresistance and radiosensitization methods. J. Exp. Clin. Cancer Res. 2018, 37, 1-15. [CrossRef]
<br><span id=”44″ class=”referencess blue-text”>44</span> Stacpoole, P.W. Therapeutic Targeting of the Pyruvate Dehydrogenase Complex/Pyruvate Dehydrogenase Kinase (PDC/PDK) Axis in Cancer. J. Natl. Cancer Inst. 2017, 109. [CrossRef]
<br><span id=”45″ class=”referencess blue-text”>45</span> Saunier, E.; Benelli, C.; Bortoli, S. The Pyruvate Dehydrogenase Complex in Cancer: An Old Metabolic Gatekeeper Regulated by New Pathways and Pharmacological Agents. Int. J. Cancer 2016, 138, 809-817. [CrossRef]
<br><span id=”46″ class=”referencess blue-text”>46</span> Kolobova, E.; Tuganova, A.; Boulatnikov, I.; Popov, K.M. Regulation of pyruvate dehydrogenase activity through phosphorylation at multiple sites. Biochem. J. 2001, 358, 69-77. [CrossRef] [PubMed]
<br><span id=”47″ class=”referencess blue-text”>47</span> Corbet, C.; Pinto, A.; Martherus, R.; de Jesus, J.P.S.; Polet, F.; Feron, O. Acidosis Drives the Reprogramming of Fatty Acid Metabolism in Cancer Cells through Changes in Mitochondrial and Histone Acetylation. Cell Metab. 2016, 24, 311-323. [CrossRef]
<br><span id=”48″ class=”referencess blue-text”>48</span> Heiden, M.G.V.; Cantley, L.C.; Thompson, C.B. Understanding theWarburg effect: The metabolic requirements of cell proliferation. Science 2009, 324, 1029-1033. [CrossRef] [PubMed]
<br><span id=”49″ class=”referencess blue-text”>49</span> Bonnet, S.; Archer, S.L.; Allalunis-Turner, J.; Haromy, A.; Beaulieu, C.; Thompson, R.; Lee, C.T.; Lopaschuk, G.D.; Puttagunta, L.; Bonnet, S.; et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007, 11, 37-51. [CrossRef] [PubMed]
<br><span id=”50″ class=”referencess blue-text”>50</span> Woolbright, B.L.; Choudhary, D.; Mikhalyuk, A.; Trammel, C.; Shanmugam, S.; Abbott, E.; Pilbeam, C.C.; Taylor, J.A. The Role of Pyruvate Dehydrogenase Kinase-4 (PDK4) in Bladder Cancer and Chemoresistance. Mol. Cancer Ther. 2018, 17, 2004-2012. [CrossRef] [PubMed]
<br><span id=”51″ class=”referencess blue-text”>51</span> Okamoto, S.; Narita, T.; Sasanuma, H.; Takeda, S.; Masunaga, S.-I.; Bessho, T.; Tano, K. Impact of DNA repair pathways on the cytotoxicity of piperlongumine in chicken DT40 cell-lines. Genes Cancer 2014, 5, 285-292. [CrossRef] [PubMed]
<br><span id=”52″ class=”referencess blue-text”>52</span> Sun, X.; Wang, M.; Yu, X.; Guo, J.; Sun, T.; Li, X.; Yao, L.; Dong, H.; Xu, Y. Metabolic Reprogramming in Triple-Negative Breast Cancer. Front. Oncol. 2020, 10, 428. [CrossRef]
<br><span id=”53″ class=”referencess blue-text”>53</span> Lu, C.-W.; Lin, S.-C.; Chien, C.-W.; Lin, S.-C.; Lee, C.-T.; Lin, B.-W.; Lee, J.-C.; Tsai, S.-J. Overexpression of pyruvate dehydrogenase kinase 3 increases drug resistance and early recurrence in colon cancer. Am. J. Pathol. 2011, 179, 1405-1414. [CrossRef]
<br><span id=”54″ class=”referencess blue-text”>54</span> Jha, M.K.; Suk, K. Pyruvaatdehydrogenase kinase als potentieel therapeutisch doelwit voor kwaadaardige gliomen. Brain Tumor Res. Treat. 2013, 1, 57-63. [CrossRef]
<br><span id=”55″ class=”referencess blue-text”>55</span> Blouin, J.M.; Penot, G.; Collinet, M.; Nacfer, M.; Forest, C.; Laurent-Puig, P.; Coumoul, X.; Barouki, R.; Benelli, C.; Bortoli, S. Butyraat lokt een metabole switch uit in menselijke darmkankercellen door zich te richten op het pyruvaat dehydrogenase complex. Int. J. Cancer 2011, 128, 2591-2601. [CrossRef]
<br><span id=”56″ class=”referencess blue-text”>56</span> Hur, H.; Xuan, Y.; Kim, Y.B.; Lee, G.; Shim, W.; Yun, J.; Ham, I.H.; Han, S.U. Expression of pyruvate dehydrogenase kinase-1 in gastric cancer as a potential therapeutic target. Int. J. Oncol. 2013, 42, 44-54. [CrossRef] [PubMed]
<br><span id=”57″ class=”referencess blue-text”>57</span> Wigfield, S.M.; Winter, S.C.; Giatromanolaki, A.; Taylor, J.; Koukourakis, M.L.; Harris, A.L. PDK-1 regelt de lactaatproductie in hypoxie en is geassocieerd met een slechte prognose in hoofd-hals squameuze kanker. Br. J. Cancer 2008, 98, 1975-1984. [CrossRef] [PubMed]
<br><span id=”58″ class=”referencess blue-text”>58</span> Sun, W.; Zhou, S.; Chang, S.S.; McFate, T.; Verma, A.; Califano, J.A. Mitochondrial mutations contribute to HIF1alpha accumulation via increased reactive oxygen species and up-regulated pyruvate dehydrogenease kinase 2 in head and neck squamous cell carcinoma. Clin. Cancer Res. 2009, 15, 476-484. [CrossRef] [PubMed]
<br><span id=”59″ class=”referencess blue-text”>59</span> Shen, Y.C.; Ou, D.L.; Hsu, C.; Lin, K.L.; Chang, C.Y.; Lin, C.Y.; Liu, S.H.; Cheng, A.L. Activating oxidative phosphorylation by a pyruvate dehydrogenase kinase inhibitor overcomes sorafenib resistance of hepatocellular carcinoma. Br. J. Cancer 2013, 108, 72-81. [CrossRef] [PubMed]
<br><span id=”60″ class=”referencess blue-text”>60</span> Fujiwara, S.; Kawano, Y.; Yuki, H.; Okuno, Y.; Nosaka, K.; Mitsuya, H.; Hata, H. PDK1 inhibition is a novel therapeutic target in multiple myeloma. Br. J. Cancer 2013, 108, 170-178. [CrossRef]
<br><span id=”61″ class=”referencess blue-text”>61</span> Guda, M.R.; Asuthkar, S.; Labak, C.M.; Tsung, A.J.; Alexandrov, I.; Mackenzie, M.J.; Prasad, D.V.; Velpula, K.K. Targeting PDK4 inhibits breast cancer metabolism. Am. J. Cancer Res. 2018, 8, 1725-1738.
<br><span id=”62″ class=”referencess blue-text”>62</span> Roh, J.L.; Park, J.Y.; Kim, E.H.; Jang, H.J.; Kwon, M. Activering van mitochondriale oxidatie door PDK2-inhibitie keert cisplatineresistentie in hoofd-halskanker om. Cancer Lett. 2016, 371, 20-29. [CrossRef]
<br><span id=”63″ class=”referencess blue-text”>63</span> Dupuy, F.; Tabariès, S.; Andrzejewski, S.; Dong, Z.; Blagih, J.; Annis, M.G.; Omeroglu, A.; Gao, D.; Leung, S.; Amir, E.; et al. PDK1-Dependent Metabolic Reprogramming Dictates Metastatic Potential in Breast Cancer. Cell Metab. 2015, 22, 577-589. [CrossRef]
<br><span id=”64″ class=”referencess blue-text”>64</span> McFate, T.; Mohyeldin, A.; Lu, H.; Thakar, J.; Henriques, J.; Halim, N.D.; Wu, H.; Schell, M.J.; Tsang, T.M.; Teahan, O.; et al. Pyruvate dehydrogenase complex activity controls metabolic and malignant phenotype in cancer cells. J. Biol. Chem. 2008, 283, 22700-22708. [CrossRef]
<br><span id=”65″ class=”referencess blue-text”>65</span> Shavit, R.; Ilouze, M.; Feinberg, T.; Lawrence, Y.R.; Tzur, Y.; Peled, N. Mitochondrial induction as a potential radio-sensitizer in lung cancer cells-A short report. Cell. Oncol. 2015, 38, 247-252. [CrossRef]
<br><span id=”66″ class=”referencess blue-text”>66</span> Allen, K.T.; Chin-Sinex, H.; DeLuca, T.; Pomerening, J.; Sherer, J.; Watkins, J.; Foley, J.; Jesseph, J.; Mendonca, M. Dichloroacetate alterations Warburg metabolism, inhibits cell growth, and increases the X-ray sensitivity of human A549 and H1299 NSC lung cancer cells. Free Radic. Biol. Med. 2015, 89, 263-273. [CrossRef] [PubMed]
<br><span id=”67″ class=”referencess blue-text”>67</span> Sun, L.; Moritake, T.; Ito, K.; Matsumoto, Y.; Yasui, H.; Nakagawa, H.; Hirayama, A.; Inanami, O.; Tsuboi, K. Metabolic analysis of radioresistant medulloblastoma stem-like clones and potential therapeutic targets. PLoS ONE 2017, 12, e0176162. [CrossRef] [PubMed]
<br><span id=”68″ class=”referencess blue-text”>68</span> Sabharwal, S.S.; Schumacker, P.T. Mitochondriale ROS in kanker: Initiatiefnemers, versterkers of een achilleshiel? Nat. Rev. Cancer 2014, 14, 709-721. [CrossRef] [PubMed]
<br><span id=”69″ class=”referencess blue-text”>69</span> Feng, H.; Wang, J.; Chen, W.; Shan, B.; Guo, Y.; Xu, J.; Wang, L.; Guo, P.; Zhang, Y. Hypoxia-induced autophagy as an additional mechanism in human osteosarcoma radioresistance. J. Bone Oncol. 2016, 5, 67-73. [CrossRef]
<br><span id=”70″ class=”referencess blue-text”>70</span> Samanta, D.; Park, Y.; Andrabi, S.A.; Shelton, L.M.; Gilkes, D.M.; Semenza, G.L. PHGDH Expression Is Required for Mitochondrial Redox Homeostasis, Breast Cancer Stem Cell Maintenance, and Lung Metastasis. Cancer Res. 2016, 76, 4430-4442. [CrossRef]
<br><span id=”71″ class=”referencess blue-text”>71</span> Diepart, C.; Karroum, O.; Magat, J.; Feron, O.; Verrax, J.; Calderon, P.B.; Grégoire, V.; Leveque, P.; Stockis, J.; Dauguet, N.; et al. Behandeling met arseentrioxide verlaagt het zuurstofverbruik van tumorcellen en radiosensitiseert vaste tumoren. Cancer Res. 2012, 72, 482-490. [CrossRef]
<br><span id=”72″ class=”referencess blue-text”>72</span> Maggiorella, L.; Wen, B.; Frascogna, V.; Opolon, P.; Bourhis, J.; Deutsch, E. Combined radiation sensitizing and anti-angiogenic effects of ionizing radiation and the protease inhibitor ritonavir in a head and neck carcinoma model. Anticancer Res. 2005, 25, 4357-4362.
<br><span id=”73″ class=”referencess blue-text”>73</span> Dwarakanath, B.S. Cytotoxiciteit, radiosensitisatie en chemosensitisatie van tumorcellen door 2-deoxy-D-glucose in vitro. J. Cancer Res. Ther. 2009, 5 (Suppl. 1), 27-31. [CrossRef]
<br><span id=”74″ class=”referencess blue-text”>74</span> Kim, J.H.; Kim, S.H.; He, S.Q.; Alfieri, A.A.; Young, C.W. Potentiation of radiation effects on multicellular tumor spheroids (MTS) of HeLa cells by lonidamine. Int. J. Radiat. Oncol. Biol. Phys. 1989, 16, 1277-1280. [CrossRef]
<br><span id=”75″ class=”referencess blue-text”>75</span> Nath, K.; Guo, L.; Nancolas, B.; Nelson, D.S.; Shestov, A.A.; Lee, S.C.; Roman, J.; Zhou, R.; Leeper, D.B.; Halestrap, A.P.; et al. Mechanism of antineoplastic activity of lonidamine. Biochim. Biophys Acta 2016, 1866, 151-162. [CrossRef]
<br><span id=”76″ class=”referencess blue-text”>76</span> Blackburn, A.C.; Matthaei, K.I.; Lim, C.; Taylor, M.C.; Cappello, J.Y.; Hayes, J.D.; Anders, M.W.; Board, P.G. Deficiëntie van glutathione transferase zeta veroorzaakt oxidatieve stress en activering van antioxidant response pathways. Mol. Pharmacol. 2006, 69, 650-657. [CrossRef] [PubMed]
<br><span id=”77″ class=”referencess blue-text”>77</span> Theodoratos, A.; Tu, W.J.; Cappello, J.; Blackburn, A.C.; Matthaei, K.; Board, P.G. Phenylalanine-induced leucopenia in genetic and dichloroacetic acid generated deficiency of glutathione transferase Zeta. Biochem. Pharmacol. 2009, 77, 1358-1363. [CrossRef] [PubMed]
<br><span id=”78″ class=”referencess blue-text”>78</span> Michelakis, E.D.; Webster, L.; Mackey, J.R. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br. J. Cancer 2008, 99, 989-994. [CrossRef] [PubMed]
<br><span id=”79″ class=”referencess blue-text”>79</span> Stacpoole, P.W. De farmacologie van dichlooracetaat. Metabolisme 1989, 38, 1124-1144. [CrossRef]
<br><span id=”80″ class=”referencess blue-text”>80</span> Halestrap, A.P. De mitochondriale pyruvaatdrager. Kinetiek en specificiteit voor substraten en remmers. Biochem. J. 1975, 148, 85-96. [CrossRef]
<br><span id=”81″ class=”referencess blue-text”>81</span> Pathak, R.K.; Marrache, S.; Harn, D.A.; Dhar, S. Mito-DCA: A mitochondria targeted molecular scaffold for efficacious delivery of metabolic modulator dichloroacetate. ACS Chem. Biol. 2014, 9, 1178-1187. [CrossRef]
<br><span id=”82″ class=”referencess blue-text”>82</span> Gang, B.P.; Dilda, P.J.; Hogg, P.J.; Blackburn, A.C. Targeting of two aspects of metabolism in breast cancer treatment. Cancer Biol. Ther. 2014, 15, 1533-1541. [CrossRef]
<br><span id=”83″ class=”referencess blue-text”>83</span> Sutendra, G.; Dromparis, P.; Kinnaird, A.; Stenson, T.H.; Haromy, A.; Parker, J.M.R.; McMurtry, M.S.; Michelakis, E.D. Mitochondriale activering door remming van PDKII onderdrukt HIF1a signalering en angiogenese in kanker. Oncogene 2013, 32, 1638-1650. [CrossRef]
<br><span id=”84″ class=”referencess blue-text”>84</span> Xuan, Y.; Hur, H.; Ham, I.H.; Yun, J.; Lee, J.Y.; Shim, W.; Kim, Y.B.; Lee, G.; Han, S.U.; Cho, Y.K. Dichloroacetate attenuates hypoxia-induced resistance to 5-fluorouracil in gastric cancer through the regulation of glucose metabolism. Exp. Cell Res. 2014, 321, 219-230. [CrossRef]
<br><span id=”85″ class=”referencess blue-text”>85</span> Cesi, G.; Walbrecq, G.; Zimmer, A.; Kreis, S.; Haan, C. ROS production induced by BRAF inhibitor treatment rewires metabolic processes affecting cell growth of melanoma cells. Mol. Cancer 2017, 16, 1-16. [CrossRef]
<br><span id=”86″ class=”referencess blue-text”>86</span> Kluza, J.; Corazao-Rozas, P.; Touil, Y.; Jendoubi, M.; Maire, C.; Guerreschi, P.; Jonneaux, A.; Ballot, C.; Balayssac, S.; Valable, S.; et al. Inactivation of the HIF-1α/PDK3 signaling axis drives melanoma toward mitochondrial oxidative metabolism and potentiates the therapeutic activity of pro-oxidants. Cancer Res. 2012, 72, 5035-5047. [CrossRef] [PubMed]
<br><span id=”87″ class=”referencess blue-text”>87</span> Sun, H.; Zhu, A.; Zhou, X.; Wang, F. Suppression of pyruvate dehydrogenase kinase-2 re-sensitizes paclitaxel-resistant human lung cancer cells to paclitaxel. Oncotarget 2017, 8, 52642-52650. [CrossRef] [PubMed]
<br><span id=”88″ class=”referencess blue-text”>88</span> Velpula, K.K.; Bhasin, A.; Asuthkar, S.; Tsung, A.J. Combined targeting of PDK1 and EGFR triggers regression of glioblastoma by reversing the Warburg effect. Cancer Res. 2013, 73, 7277-7289. [CrossRef] [PubMed]
<br><span id=”89″ class=”referencess blue-text”>89</span> Zhang, W.; Hu, X.; Zhou, W.; Tam, K.Y. Liquid Chromatography-Tandem Mass Spectrometry Method Revealed that Lung Cancer Cells Exhibited Distinct Metabolite Profiles upon the Treatment with Different Pyruvate Dehydrogenase Kinase Inhibitors. J. Proteome Res. 2018, 17, 3012-3021. [CrossRef]
<br><span id=”90″ class=”referencess blue-text”>90</span> Dubuis, S.; Ortmayr, K.; Zampieri, M. A framework for large-scale metabolome drug profiling links coenzyme A metabolism to the toxicity of anti-cancer drug dichloroacetate. Commun. Biol. 2018, 1, 1-11. [CrossRef]
<br><span id=”91″ class=”referencess blue-text”>91</span> El Sayed, S.M.; Baghdadi, H.; Ahmed, N.S.; Almaramhy, H.H.; Mahmoud, A.A.; El-Sawy, S.A.; Ayat, M.; Elshazley, M.; Abdel-Aziz, W.; Abdel-Latif, H.M.; et al. Dichloroacetate is een antimetaboliet die acetaat tegengaat en kankercellen de voordelen ervan ontneemt: Een nieuwe evidence-based medische hypothese. Med. Hypotheses 2019, 122, 206-209. [CrossRef]
<br><span id=”92″ class=”referencess blue-text”>92</span> Li, X.; Liu, J.; Hu, H.; Lu, S.; Lu, Q.; Quan, N.; Rousselle, T.; Patel, M.S.; Li, J. Dichloroacetate Ameliorates Cardiac Dysfunction Caused by Ischemic Insults Through AMPK Signal Pathway-Not Only Shifts Metabolism. Toxicol. Sci. 2019, 167, 604-617. [CrossRef]
<br><span id=”93″ class=”referencess blue-text”>93</span> Li, W.; Saud, S.M.; Young, M.R.; Chen, G.; Hua, B. Targeting AMPK for cancer prevention and treatment. Oncotarget 2015, 6, 7365-7378. [CrossRef]
<br><span id=”94″ class=”referencess blue-text”>94</span> Dunbar, E.M.; Coats, B.S.; Shroads, A.L.; Langaee, T.; Lew, A.; Forder, J.R.; Shuster, J.J.; Wagner, D.A.; Stacpoole, P.W. Phase 1 trial of dichloroacetate (DCA) in adults with recurrent malignant brain tumors. Onderzoek. New Drugs 2014, 32, 452-464. [CrossRef]
<br><span id=”95″ class=”referencess blue-text”>95</span> Michelakis, E.D.; Sutendra, G.; Dromparis, P.; Webster, L.; Haromy, A.; Niven, E.; Maguire, C.; Gammer, T.L.; Mackey, J.R.; Fulton, D.; et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci. Transl. Med. 2010, 2. [CrossRef]
<br><span id=”96″ class=”referencess blue-text”>96</span> De Ridder, M.; Verovski, V.N.; Chiavaroli, C.; Berge, D.L.V.D.; Monsaert, C.; Law, K.; Storme, G.A. Het radiosensitiserende effect van immunoadjuvant OM-174 vereist samenwerking tussen immuun- en tumorcellen via interferon-gamma en induceerbaar stikstofoxidesynthase. Int. J. Radiat. Oncol. Biol. Phys. 2006, 66, 1473-1480. [CrossRef] [PubMed]
<br><span id=”97″ class=”referencess blue-text”>97</span> Wang, H.; Bouzakoura, S.; de Mey, S.; Jiang, H.; Law, K.; Dufait, I.; Corbet, C.; Verovski, V.; Gevaert, T.; Feron, O.; et al. Auranofin radiosensitizes tumor cells through targeting thioredoxin reductase and resulting overproduction of reactive oxygen species. Oncotarget 2017, 8, 35728-35742. [CrossRef] [PubMed]
<br><span id=”98″ class=”referencess blue-text”>98</span> de Mey, S.; Jiang, H.; Corbet, C.; Wang, H.; Dufait, I.; Law, K.; Bastien, E.; Verovski, V.; Gevaert, T.; Feron, O.; et al. Antidiabetic Biguanides Radiosensitize Hypoxic Colorectal Cancer Cells Through a Decrease in Oxygen Consumption. Front. Pharmacol. 2018, 9, 1073. [CrossRef] [PubMed]
<br><span id=”99″ class=”referencess blue-text”>99</span> Noeparast, A.; Teugels, E.; Giron, P.; Verschelden, G.; De Brakeleer, S.; Decoster, L.; De Grève, J. Non-V600 BRAF mutaties recurrently found in lung cancer predict sensitivity to the combination of Trametinib and Dabrafenib. Oncotarget 2016, 8, 60094-60108. [CrossRef]
<br><span id=”100″ class=”referencess blue-text”>100</span> Polet, F.; Corbet, C.; Pinto, A.; Rubio, L.I.; Martherus, R.; Bol, V.; Drozak, X.; Grégoire, V.; Riant, O.; Feron, O. Reduceren van de serine beschikbaarheid vult de remming van het glutamine metabolisme aan om leukemiecelgroei te blokkeren. Oncotarget 2015, 7, 1765-1776. [CrossRef]
<p></p>
<p>Gerelateerde inhoud:</p>
<figure class=”wp-block-embed is-type-wp-embed is-provider-dca-guide wp-block-embed-dca-guide”><div class=”wp-block-embed__wrapper”>
</div></figuur>
<figure class=”wp-block-embed is-type-wp-embed is-provider-dca-guide wp-block-embed-dca-guide”><div class=”wp-block-embed__wrapper”>
</div></figuur>