Helena Populo1,2, Regina Caldas1,2,3, Jose Manuel Lopes1,2,4,5, Joana Pardal5, Valdemar Maximo1,2,4 & Paula Soares†,2,4
† Instituut voor Onderzoek en Innovatie in Gezondheid (Instituto de Investigacao e Inovacao em Saude), Universiteit van Porto, Porto, Portugal
1 Instituut voor Moleculaire Pathologie en Immunologie van de Universiteit van Porto (IPATIMUP), Universiteit van Porto, Porto, Portugal
Tel: +22 557 0700; Fax: +22 557 0799; E-mail: [email protected]
2 Instituut voor Onderzoek en Innovatie in Gezondheid (Instituto de Investigacao e Inovac¸aoem Saude), Universiteit van Porto, Porto, Portugal
3 Faculteit Geneeskunde, Universiteit van Porto, Porto, Portugal
4 Afdeling Pathologie en Oncologie, Faculteit Geneeskunde, Universiteit van Porto, Porto, Portugal
5 Dienst Anatomische Pathologie Ziekenhuis Sao Joao, Porto, Portugal
Online gepubliceerd: 14 mei 2015
Abstract
Doelstelling: We wilden nagaan of er bewijs is om dichlooracetaat (DCA), dat de pyruvaat dehydrogenase kinase (PDK) remt en de metabole verschuiving van kankercellen van glycolyse naar oxidatieve fosforylering omkeert, te beschouwen als een veelbelovend geneesmiddel voor de therapie van cutane melanoom (CM) patiënten.
Onderzoeksopzet en methoden: We beoordeelden het expressieprofiel van PDK 1, 2 en 3 in een reeks melanoommonsters, om na te gaan of melanoomtumoren de DCA-doelwitten tot expressie brengen, of deze expressie correleert met de activering van belangrijke signaalcascades voor melanomagenese en ook met de prognose van melanoompatiënten. We hebben ook de gevoeligheid van melanoom cellijnen voor DCA behandeling vastgesteld, door hun metabole veranderingen, proliferatie en overleving te beoordelen.
Resultaten: Wij constateerden dat zowel PDK 1 als 2 isovormen overgeëxpresseerd zijn in CM vergeleken met nevi, waarbij deze expressie geassocieerd is met de expressie van de mTOR pathway effectors en onafhankelijk is van de BRAF mutatiestatus. Melanoma-cellijnen behandeld met DCA vertoonden een verschuiving in het metabolisme, dat wil zeggen een daling van het glucoseverbruik en de lactaatproductie, downregulatie van de proliferatie, een stijging van de apoptose en een daling van de activering van het mTOR-traject.
Conclusie: Onze resultaten suggereren dat PDK-expressie een rol kan spelen bij de ontwikkeling van melanoom en dat DCA nuttig kan zijn voor CM-therapie, alleen of in combinatie met mTOR-remmers.
Trefwoorden: dichlooracetaat, melanoom, metabolisme, mTOR, pyruvaat dehydrogenase kinase
© 2015 Informa UK, Ltd. ISSN 1472-8222, e-ISSN 1744-7631
INLEIDING
Cutaan melanoom (CM) is een zeer agressieve maligniteit, en hoewel het de minst voorkomende vorm van huidkanker is, is het verantwoordelijk voor het merendeel van de sterfgevallen door huidkanker. Aangezien de incidentie van CM toeneemt, is het momenteel de meest waarschijnlijke invasieve kanker die zich bij mannen vóór de leeftijd van 50 jaar ontwikkelt [1,2]. Blootstelling aan UV-straling wordt beschouwd als de belangrijkste risicofactor voor melanomagenese [2]. CM kan worden ingedeeld in verschillende histologische subtypes, waarbij het meest voorkomende oppervlakkig spreidend melanoom (SSM) is, gevolgd door nodulair melanoom (NM), lentigo maligna melanoom (LMM) en acraal lentineus melanoom (ALM). SSM en NM ontstaan in de huid met intermitterende blootstelling aan de zon, terwijl LMM voorkomt in chronisch aan de zon blootgestelde huid en ALM zich beperkt tot de huid zonder blootstelling aan de zon. Deze histologische classificatie heeft geen prognostische waarde [3,4]. Bij de stadiëring van CM wordt rekening gehouden met tumordikte, ulceratie, mitotische snelheid, knooppuntbetrokkenheid en de aanwezigheid van metastasen [5]. Gelukkig worden de meeste gevallen van CM in een vroeg stadium gediagnosticeerd, met een 5-jaarsoverleving van 98% [1]. Bij patiënten met gemetastaseerd melanoom is de mediane overleving echter slechts 8-9 maanden [5].
CM is een zeer heterogene tumor en vele celsignaalroutes zijn gedereguleerd in melanomagenese [6,7]. De MAPK pathway is constitutief geactiveerd in de meerderheid van CMs. NRAS-mutaties zijn gemeld in 10-20% van de CM’s, waarbij NRASQ61K/R het meest voorkomt. BRAF-mutaties, met name de BRAFV600E-mutatie, werden in 40-60% van de gevallen vastgesteld. Onze groep observeerde een associatie tussen de aanwezigheid van BRAF-mutaties en de recent beschreven TERT-promotermutaties in CM [8]. BRAFV600E, en in mindere mate NRASQ61K/R mutaties werden ook gerapporteerd in bijna 80% van de nevi (goedaardige melanocytaire laesies die in 25% van de gevallen worden beschouwd als voorlopers van CM), wat erop wijst dat de activering van de MAPK pathway noodzakelijk maar niet voldoende kan zijn voor de ontwikkeling van melanoom [7,9,10]. BRAFV600E is in feite gerelateerd aan oncogeen-geïnduceerde senescentie en kan daarom in veel nevi leiden tot een toestand van groeirestrictie [11]. Activering van de PI3K-AKTmTOR-route kan dit senescentiefenotype overwinnen en de tumorgroei stimuleren [12]. Onze groep heeft het belang van de PI3K-AKT-mTOR-route in de agressiviteit van CM bevestigd door de activering ervan te associëren met de aanwezigheid van BRAF-mutaties en slechtere prognosekenmerken. Overexpressie van mTOR pathway-effectors was namelijk geassocieerd met een hogere mitotische snelheid, een hoger Clark-niveau, een grotere tumordikte en de aanwezigheid van huidzweren [13].
Vóór 2011 waren de behandelingsopties voor patiënten met gevorderde CM hoofdzakelijk gebaseerd op conventionele chemotherapie, die een lage respons en geringe effecten op de totale overleving (OS) van de patiënten had. Sindsdien werden vijf nieuwe geneesmiddelen goedgekeurd voor patiënten met stadium IV CM [14]. Ipilimumab, een anti-CTLA4 antilichaam, liet duidelijke verbeteringen zien in de OS van de patiënten, maar de bijwerkingen maakten het niet geschikt voor alle patiënten [15]. Vemurafenib en dabrafenib, selectieve remmers van BRAFV600E, en trametinib, een MEK-remmer, richten zich alle op de MAPK-route en bereikten naar verluidt responspercentages van meer dan 50%, zelfs beter dan die van ipilimumab. Hun verbeteringen in OS zijn echter niet langer dan 7 – 8 maanden als gevolg van de ontwikkeling van resistentie [16-18]. Onlangs werd een andere immuunmodulator, pembrolizumab, een antilichaam tegen de geprogrammeerde doodsreceptor-1 (PD-1), goedgekeurd voor de behandeling van patiënten met onresectabel of metastatisch melanoom en ziekteprogressie na ipilimumab of, indien BRAFV600-mutatie positief, een BRAF-remmer [19]. Klinische proeven met geneesmiddelen die gericht zijn op de PI3K-AKT-mTOR-route zijn aan de gang [4,14], maar nieuwe therapeutische benaderingen zijn gerechtvaardigd.
Het metabolisme van kankercellen verschilt van dat van normale cellen. In normale cellen kan glucose, afhankelijk van de beschikbaarheid van O2, gedeeltelijk worden gemetaboliseerd tot lactaat via glycolyse in hypoxische omstandigheden, of het kan volledig worden geoxideerd totCO2 in aanwezigheid van O2, via mitochondriale oxidatieve fosforylering, een efficiënter energieproces. Kankercellen daarentegen metaboliseren de meeste glucose tot lactaat, ongeacht hun O2-aanvoer, het zogenaamde Warburg-effect [20,21]. De verwerving van dit glycolytisch fenotype in kankercellen wordt niet volledig begrepen, maar er is wel een essentiële rol erkend voor de transcriptiefactor hypoxia-inducerende factor 1a (HIF1-α) [22]. Van het HIF1-α eiwit is bekend dat het wordt gestabiliseerd onder hypoxie, maar oncogene paden, zoals de MAPK en de mTOR paden, lijken ook de activering ervan in kanker te bemiddelen (figuur 1) [22,23]. Er zijn sterke aanwijzingen dat CM dit glycolytische fenotype verwerft, hetgeen kan worden bevestigd door FDGPET scanning van patiënten [24-27]. In feite lijkt HIF1-α overgeëxpresseerd te zijn in CM, omdat de huid een mild-hypoxische omgeving is en de productie van melanine indirect de expressie van HIF1-α stimuleert door ROS-productie [28-30]. Toch moet de cytoplasmatische glycolyse worden losgekoppeld van de mitochondriale oxidatieve fosforylering, zodat het meeste pyruvaat kan worden omgezet in lactaat. Dit laatste proces wordt gestuurd door pyruvaat dehydrogenase kinase (PDK), een enzym dat door HIF1-α wordt gestimuleerd (figuur 1) [ 31,32].
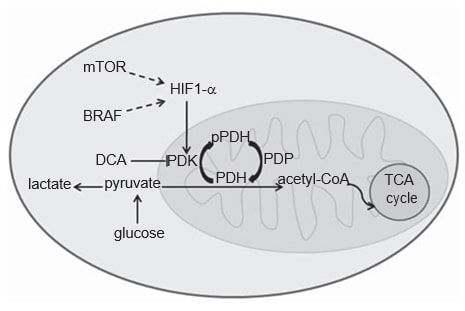
PDK is een onderdeel van het mitochondriale pyruvaatdehydrogenase complex (PDC). Het PDC bestaat uit het enzym pyruvaatdehydrogenase (PDH) en zijn regulerende eiwitten: PDK dat door PDH te fosforyleren optreedt als remmer, en pyruvaat dehydrogenase fosfatase dat PDH activeert door defosforylering [33]. Gedefosforyleerd PDH katalyseert de oxidatieve decarboxylering van pyruvaat in acetyl-CoA,CO2 en NADH (H+ ), en verbindt zo de glycolytische route met de oxidatieve route van de tricarbonzuurcyclus (figuur 1) [ 33]. Er zijn vier isovormen van PDK (1, 2, 3, 4) die verschillen in hun intrinsieke activiteit, weefseldistributie en gevoeligheid voor hun selectieve remmer, dichlooracetaat (DCA) [33-35]. Hoewel PDK1 de enige is die kan binden aan alle PDH-fosforyleringsplaatsen, blijkt PDK3 de meest actieve isovorm te zijn [33]. PDK2 is het gevoeligst voor remming door DCA en komt alom tot expressie in verschillende menselijke weefsels, terwijl de andere weefselspecifieker zijn [33,34]. PDK4 is hoofdzakelijk gerelateerd aan fysiologische metabole flexibiliteit en is de enige isovorm die niet door HIF1-α wordt gestimuleerd [ 32,36]. De expressie van PDK-isovormen is geëvalueerd in verschillende soorten kanker, namelijk hoofd-hals squameus celcarcinoom (HNSCC) [37], colonkanker [38], niercelcarcinoom [39] en maagkanker [ 40].
DCA is gebruikt bij de behandeling van aandoeningen die gepaard gaan met melkzuurgasvorming in het kader van mitochondriale disfunctie, zoals aangeboren mitochondriale ziekten [35]. In niet-kleincellige long-, glioblastoma- en borstkankercellen meldden Bonnet et al. dat DCA apoptose induceert en de celgroei vermindert, door bevordering van glucose-oxidatie, mitochondriale membraandepolarisatie en ROS-productie [41]. Deze effecten zijn herhaald in verschillende kankermodellen en lijken selectief te zijn in kankercellen [35,41,42]. Bovendien kan DCA ook angiogenese onderdrukken door indirecte remming van HIF1-α [43]. Al deze gegevens, gecombineerd met het bekende veiligheidsprofiel bij de mens, bewijzen dat DCA een veelbelovend geneesmiddel is voor kankertherapie. Een klinische studie om het effect van DCA bij glioblastomapatiënten te evalueren was reeds
Cutaan melanoom (CM) is een zeer agressieve maligniteit, en hoewel het de minst voorkomende vorm van huidkanker is, is het verantwoordelijk voor de meerderheid van sterfgevallen door huidkanker. Aangezien de incidentie van CM toeneemt, is het momenteel de meest waarschijnlijke invasieve kanker die zich bij mannen vóór de leeftijd van 50 jaar ontwikkelt [1,2]. Blootstelling aan UV-straling wordt beschouwd als de belangrijkste risicofactor voor melanomagenese [2]. CM kan worden ingedeeld in verschillende histologische subtypes, waarbij het meest voorkomende oppervlakkig spreidend melanoom (SSM) is, gevolgd door nodulair melanoom (NM), lentigo maligna melanoom (LMM) en acraal lentineus melanoom (ALM). SSM en NM ontstaan in de huid met intermitterende blootstelling aan de zon, terwijl LMM voorkomt in chronisch aan de zon blootgestelde huid en ALM zich beperkt tot de huid zonder blootstelling aan de zon. Deze histologische classificatie heeft geen prognostische waarde [3,4]. Bij de stadiëring van CM wordt rekening gehouden met tumordikte, ulceratie, mitotische snelheid, knooppuntbetrokkenheid en de aanwezigheid van metastasen [5]. Gelukkig worden de meeste gevallen van CM in een vroeg stadium gediagnosticeerd, met een 5-jaarsoverleving van 98% [1]. Voor patiënten met gemetastaseerd melanoom is de mediane overleving echter slechts 8-9 maanden [5]. CM is een zeer heterogene tumor en veel celsignaalroutes zijn gedereguleerd in melanomagenese [6,7]. De MAPK pathway is constitutief geactiveerd in de meerderheid van CMs. NRAS-mutaties zijn gemeld in 10-20% van de CM’s, waarbij NRASQ61K/R het meest voorkomt. BRAF-mutaties, met name de BRAFV600E-mutatie, werden in 40-60% van de gevallen vastgesteld. Onze groep observeerde een associatie tussen de aanwezigheid van BRAF-mutaties en de recent beschreven TERT-promotermutaties in CM [8]. BRAFV600E, en in mindere mate NRASQ61K/R mutaties werden ook gerapporteerd in bijna 80% van de nevi (goedaardige melanocytaire laesies die in 25% van de gevallen worden beschouwd als voorlopers van CM), wat erop wijst dat de activering van de MAPK pathway noodzakelijk maar niet voldoende kan zijn voor de ontwikkeling van melanoom [7,9,10]. BRAFV600E is in feite gerelateerd aan oncogeen-geïnduceerde senescentie en kan daarom in veel nevi leiden tot een toestand van groeirestrictie [11]. Activering van de PI3K-AKTmTOR-route kan dit senescentiefenotype overwinnen en de tumorgroei stimuleren [12]. Onze groep heeft het belang van de PI3K-AKT-mTOR-route in de agressiviteit van CM bevestigd door de activering ervan te associëren met de aanwezigheid van BRAF-mutaties en slechtere prognosekenmerken. Overexpressie van mTOR pathway-effectors was namelijk geassocieerd met een hogere mitotische snelheid, een hoger Clark-niveau, een grotere tumordikte en de aanwezigheid van huidzweren [13].
Vóór 2011 waren de behandelingsopties voor patiënten met gevorderde CM hoofdzakelijk gebaseerd op conventionele chemotherapie, die een lage respons en geringe effecten op de totale overleving (OS) van de patiënten had. Sindsdien werden vijf nieuwe geneesmiddelen goedgekeurd voor patiënten met stadium IV CM [14]. Ipilimumab, een anti-CTLA4 antilichaam, liet duidelijke verbeteringen zien in de OS van de patiënten, maar de bijwerkingen maakten het niet geschikt voor alle patiënten [15]. Vemurafenib en dabrafenib, selectieve remmers van BRAFV600E, en trametinib, een MEK-remmer, richten zich alle op de MAPK-route en bereikten naar verluidt responspercentages van meer dan 50%, zelfs beter dan die van ipilimumab. Hun verbeteringen in OS zijn echter niet langer dan 7 – 8 maanden als gevolg van de ontwikkeling van resistentie [16-18]. Onlangs werd een andere immuunmodulator, pembrolizumab, een antilichaam tegen de geprogrammeerde doodsreceptor-1 (PD-1), goedgekeurd voor de behandeling van patiënten met niet-resectabel of metastatisch melanoom en ziekteprogressie na ipilimumab of, indien BRAFV600-mutatie positief, een BRAF-remmer [19]. Klinische proeven met geneesmiddelen die gericht zijn op de PI3K-AKT-mTOR pathway zijn aan de gang [4,14], maar nieuwe therapeutische benaderingen zijn gerechtvaardigd. Het metabolisme van kankercellen verschilt van dat van normale cellen. In normale cellen kan glucose, afhankelijk van de beschikbaarheid van O2, gedeeltelijk worden gemetaboliseerd tot lactaat via glycolyse in hypoxische omstandigheden, of het kan volledig worden geoxideerd totCO2 in aanwezigheid van O2, via mitochondriale oxidatieve fosforylering, een efficiënter energieproces. Kankercellen daarentegen metaboliseren de meeste glucose tot lactaat, ongeacht hun O2-aanvoer, het zogenaamde Warburg-effect [20,21]. De verwerving van dit glycolytisch fenotype in kankercellen wordt niet volledig begrepen, maar er is wel een essentiële rol erkend voor de transcriptiefactor hypoxia-inducerende factor 1a (HIF1-α) [22]. Van het HIF1-α eiwit is bekend dat het wordt gestabiliseerd onder hypoxie, maar oncogene paden, zoals de MAPK en de mTOR paden, lijken ook de activering ervan in kanker te bemiddelen (figuur 1) [22,23]. Er zijn sterke aanwijzingen dat CM dit glycolytische fenotype verwerft, hetgeen kan worden bevestigd door FDGPET scanning van patiënten [24-27]. In feite lijkt HIF1-α overgeëxpresseerd te zijn in CM, omdat de huid een mild-hypoxische omgeving is en de productie van melanine indirect de expressie van HIF1-α stimuleert door ROS-productie [28-30]. Toch moet de cytoplasmatische glycolyse worden losgekoppeld van de mitochondriale oxidatieve fosforylering, zodat het meeste pyruvaat kan worden omgezet in lactaat. Dit laatste proces wordt aangedreven door pyruvaat dehydrogenase kinase (PDK), een enzym dat door HIF1-α wordt gestimuleerd (figuur 1) [31,32]. PDK is een onderdeel van het mitochondriale pyruvaat dehydrogenase complex (PDC). Het PDC bestaat uit het enzym pyruvaatdehydrogenase (PDH) en zijn regulerende eiwitten: PDK dat door PDH te fosforyleren optreedt als remmer, en pyruvaat dehydrogenase fosfatase dat PDH activeert door defosforylering [33]. Gedefosforyleerd PDH katalyseert de oxidatieve decarboxylering van pyruvaat in acetyl-CoA,CO2 en NADH (H+ ), en verbindt zo de glycolytische route met de oxidatieve route van de tricarbonzuurcyclus (figuur 1) [ 33]. Er zijn vier isovormen van PDK (1, 2, 3, 4) die verschillen in hun intrinsieke activiteit, weefseldistributie en gevoeligheid voor hun selectieve remmer, dichlooracetaat (DCA) [33-35]. Hoewel PDK1 de enige is die kan binden aan alle PDH-fosforyleringsplaatsen, blijkt PDK3 de meest actieve isovorm te zijn [33]. PDK2 is het gevoeligst voor remming door DCA en komt alom tot expressie in verschillende menselijke weefsels, terwijl de andere weefselspecifieker zijn [33,34]. PDK4 is hoofdzakelijk gerelateerd aan fysiologische metabole flexibiliteit en is de enige isovorm die niet door HIF1-α wordt gestimuleerd [ 32,36]. De expressie van PDK-isovormen is geëvalueerd in verschillende soorten kanker, namelijk hoofd-hals squameus celcarcinoom (HNSCC) [37], colonkanker [38], niercelcarcinoom [39] en maagkanker [ 40]. DCA is gebruikt bij de behandeling van aandoeningen die gepaard gaan met melkzuurgasvorming in het kader van mitochondriale disfunctie, zoals aangeboren mitochondriale ziekten [35]. In niet-kleincellige long-, glioblastoma- en borstkankercellen meldden Bonnet et al. dat DCA apoptose induceert en de celgroei vermindert, door bevordering van glucose-oxidatie, mitochondriale membraandepolarisatie en ROS-productie [41]. Deze effecten zijn herhaald in verschillende kankermodellen en lijken selectief te zijn in kankercellen [35,41,42]. Bovendien kan DCA ook angiogenese onderdrukken door indirecte remming van HIF1-α [43]. Al deze gegevens, gecombineerd met het bekende veiligheidsprofiel bij de mens, bewijzen dat DCA een veelbelovend geneesmiddel is voor kankertherapie. Er werd reeds een klinische studie uitgevoerd om het effect van DCA bij glioblastomapatiënten te evalueren, waarbij verhoogde apoptose en verminderde angiogenese werden gerapporteerd, met veelbelovende resultaten bij vier van de vijf patiënten [44].
In de huidige studie werd de expressie van PDK 1 – 3 isovormen in CM beoordeeld en de associatie ervan met de expressie van belangrijke signaalwegcascades voor melanomagenese en met de prognose van melanoompatiënten geëvalueerd. Ook werden in vitro studies uitgevoerd om het effect van DCA-behandeling op het metabolisme, de proliferatie en de overleving van melanoomcellijnen met verschillende genetische profielen te beoordelen.
Materialen en methoden
Monsterselectie, klinisch-pathologische en prognostische parameters
Formalinefixed, paraffine-embedded weefsel van 120 gevallen van CM en van 22 melanocytaire nevi (12 samengestelde nevi en 10 Spitz nevi) werd verkregen van de dienst Anatomische Pathologie van het Ziekenhuis S. Joa˜o, Porto, en van het Ziekenhuis S. Marcos, Braga. Klinisch-pathologische (tabel 1) en follow-up gegevens werden verkregen uit de dossiers van de patiënten en de Oncologieregisters van het ziekenhuis S. Joa˜o en van het ziekenhuis S. Marcos, en van RORENO (Oncologieregister van de regio Noord). Alle gevallen werden herzien en gestagd volgens de 7e editie van AJCC [5]. De follow-upgegevens omvatten de recidieven en metastasen (DFS; n = 108) en het aantal sterfgevallen als gevolg van het melanoom (ziektespecifieke mortaliteit; OS; n = 118). De gemiddelde follow-up tijd van de patiënten voor DFS was 51 maanden (SE ± 3,59, range 1-195) en voor OS 55 maanden (SE ± 3,48, range 1 – 207). Dit werk werd goedgekeurd door de plaatselijke ethische commissie en was in overeenstemming met de nationale ethische regels.
Immunohistochemische analyse
Kleuring voor de geanalyseerde eiwitten werd uitgevoerd op paraffinestukken van 3 µm van representatieve tumorgebieden, gemonteerd op met poly-L-lysine gecoate objectglaasjes. De secties werden gedeparaffineerd en gehydrateerd, gevolgd door een microgolf antigeen retrieval procedure met 10 mM natriumcitraat buffer pH 6.0 met 1 mM EDTA pH 9.0 (PDK2), of EDTA buffer pH 9.0 (PDK1 en PDK3). De secties werden overnacht bij 4°C in een vochtige kamer geïncubeerd met de primaire antilichamen PDK1 (polyklonaal, konijn, 1:50), PDK2 (polyklonaal, konijn, 1:150), PDK3 (monoklonaal, muis, 1:500), alle van Sigma-Aldrich Co. (St. Louis, Missouri, USA). De detectie werd verkregen met het Envision G/2 System/AP (K5355; Dako, Denemarken). anti-alkalische fosfatase methode (APAAP), en de kleur werd ontwikkeld met permanent rood chromogeen. De objectglaasjes werden gecontrasteerd met hematoxyline en vervolgens gemonteerd met een watermengbaar inbedmiddel. De APAAP-methode werd toegepast om interferentie van melaninepigmentatie met immunohistochemische analyse te voorkomen. Menselijk maagweefsel werd gebruikt als negatieve (weglating van primair antilichaam) en positieve controle.
Immunohistochemische evaluatie
Drie waarnemers (J.M.L., H.P. en R.C.) beoordeelden de immunoreactiviteit van de tumorcellen zonder kennis van de klinische gegevens van de gevallen. De immunoreactiviteit van aangrenzend niet-tumorweefsel werd gebruikt als interne controle. Een IHC-score werd vastgesteld voor PDK1 – 3, en is het resultaat van de vermenigvuldiging van de intensiteitsscore van de kleuring (negatief = 0, zwak = 1, matig = 2 en sterk = 3) en de uitbreidingsscore van de immunoreactiviteit van de tumorcellen (0 – 5% = 0, 6 – 25% = 1, 26 – 50% = 2, 51 – 75% = 3, 76 – 100% = 4). De IHC-scores werden vervolgens ingedeeld als negatief/laag (scorewaarde £ 4) en matig/hoog (scorewaarde > 4). Analyses van de MAPK- en de PI3KAKT-mTOR-cascades in een deel van de serie zijn eerder gedaan [13] en de resultaten zijn in deze studie gebruikt.
DNA-extractie en mutatieanalyse
Extractie van DNA uit tumoren kleiner dan 5 mm werd uitgevoerd na microdissectie met PALM MicroLaser Systems (PALM, Duitsland) en met behulp van de Quiamp DNA-microkit (Quiagen, Hilden). Bij tumoren groter dan 5 mm werd DNA-extractie uitgevoerd door handmatige dissectie van 10 µm hele secties van in paraffine ingebed weefsel met behulp van de Invisorb spin tissue mini kit (Invitek, Berlijn). BRAF exon 15 en NRAS exon 2 fragmenten werden geamplificeerd door polymerase chain reaction (PCR) met behulp van eerder beschreven primers [45]. Genomisch DNA (25 – 100 ng) werd geamplificeerd door PCR met de volgende cyclische condities: 35 s bij 94°C, 40 s bij 58°C voor BRAF en 57°Cvoor NRAS, en 45 s bij 72°Cgedurende 40 cycli.
| Klinisch-pathologische kenmerken | |
| Aantal gevallen (n) | 120 |
| Mediane leeftijd (± SD) | 61.5 ± 17.0 |
| Geslacht (n [%]) | |
| Vrouwelijk | 68 (56.7) |
| Mannelijk | 52 (43.3) |
| Blootstelling aan de zon (n [%]) | |
| Afwezig | 27 (22.7) |
| Intermitterend | 72 (60.5) |
| Chronisch | 20 (16.8) |
| Histologisch subtype (n [%]) | |
| LMM | 16 (13.3 |
| ALM | 24 (20.0) |
| NM | 19 (15.8) |
| SSM | 61 (50.8) |
| Mediaan dikte (mm) | 3.7 (0 — 70) |
| Epidermale ulceratie (n [%]) | |
| Afwezig | 79 (65.8) |
| Aanwezig | 41 (34.2) |
| Mitotisch percentage (n [%]) | |
| < 1/mm2 | 45 (37.5) |
| ≥1/mm2 | 75 (62.5 |
| pT (n [%]) | |
| ≤ pT2 | 62 (51.7) |
| >pT2 | 58 (48.3) |
Alle PCR-producten werden gezuiverd en direct gesequeneerd op een ABI Prism 3130 xl automatische sequencer (Perkin-Elmer, Foster City, CA) met behulp van de ABI Prism Dye Terminator Cycle sequencing Kit (Perkin-Elmer). De sequencingreactie werd uitgevoerd in de voorwaartse richting, en een onafhankelijke PCR-amplificatie, in de voorwaartse en de achterwaartse richting, werd uitgevoerd in monsters waarvan vermoed werd dat zij mutaties bevatten. Ook hier is de BRAF- en NRAS-mutatieanalyse in een deel van de serie eerder uitgevoerd [13] en de resultaten zijn in deze studie gebruikt.
Cellijnen en kweekomstandigheden
In dit werk zijn twee cellijnen gebruikt, A375 huidmelanoomcellijn die drager is van BRAFV600E en Mewo huidmelanoomcellijn die drager is van BRAFwt. Beide cellijnen werden getest op de aanwezigheid van mycoplasma.
A375 werd gehandhaafd in RPMI-medium (Gibco/BRL – Invitrogen) en Mewo werd gehandhaafd in DMEM-medium (Gibco/BRL – Invitrogen). Alle media werden aangevuld met 10% foetaal runderserum, 100 U/ml penicilline en 100 µg/ml streptomycine. De cellijnen werden onderhouden in een vochtige atmosfeer (5%CO2) bij 37°C.
Behandeling van melanoomcellijnen met DCA
NatriumDCA, gekocht bij Sigma-Aldrich (St. Louis, MO, EUA), werd opgelost in dH2Oen toegevoegd aan het kweekmedium en gebruikt voor 24 en 48 uur behandeling. Melanoomcellen geïncubeerd met kweekmedium aangevuld met dH2Odienden als controle.
Levensvatbaarheidstest
De effecten van DCA op de groei van melanoomcellijnen werden geanalyseerd met de PrestoBlue (PB) test. De cellen werden in 96-wellsplaten gezaaid bij een dichtheid van 5 103 in 200 µl medium. Na 24 uur werd het medium vervangen door een medium met 5, 20, 40 en 60 mM DCA. De cellen werden gedurende 24 en 48 uur geïncubeerd, gewassen met PBS (pH 7,4) en getest op celgroei met behulp van PB volgens de instructies van de fabrikant. Tijdens de incubatie met de cellen wordt het PB-reagens gewijzigd door het reducerende milieu van de levensvatbare cellen en wordt het sterk fluorescerend. De fluorescentie werd gemeten met een microplaatlezer (Synergy HT Multi-Mode Microplate Reader, BioTek Instruments Inc., Winooski, VT, USA) bij een excitatie- en emissiegolflengte van respectievelijk 560 en 590 nm. De absorptie van de wells met kweekmedium en tumorcellen werd gebruikt als controle en elke experimentele conditie werd geëvalueerd in drievoud en herhaald in tweevoud. Door de gemeten fluorescentie/absorptie van de putjes met DCA te vergelijken met de metingen van de putjes met onbehandelde cellen, was het mogelijk dosis-respons profielen te genereren en IC50 (de concentratie die de overleving voor 50% remt) waarden te bepalen, met behulp van GraphPadPrism5.0 (GraphPad Software, Inc., La Jolla, CA).
Glucose- en lactaatkwantificatie
Voor glucose- en lactaatspiegelmetingen werden melanoomcellen uitgezet in 6-wellsplaten bij een uiteindelijke dichtheid van 2 105 cellen/well en geïncubeerd bij 37°C gedurende 24 uur. De cellen werden vervolgens behandeld met 35 mM DCA. Als controle werden de cellen geïncubeerd met het medium (dH2O). Na 24 en 48 uur behandeling werd het kweekmedium verzameld. De glucoseniveaus in het geconditioneerde medium in de cultuur werden gekwantificeerd met de Glucose GOD/PAP Kit (Roche Applied Sciences) en afgetrokken van de oorspronkelijke niveaus (0 uur). Lactaat werd op soortgelijke wijze gekwantificeerd met behulp van de LO-POD enzymatische colorimetrische test (Spinreact, Sant Esteve de Bas, Spanje).
Celcyclus- en apoptoseanalyse
Voor celcyclusprofiel en apoptoseanalyse werden melanoomcellen uitgezet in 6-wellsplaten bij een uiteindelijke dichtheid van 1 105 cellen/well en geïncubeerd bij 37°C gedurende 24 uur. De cellen werden vervolgens behandeld met DCA bij 35 mM gedurende 24 en 48 uur behandeling. Als controle werden de cellen geïncubeerd met het medium (dH2O). Voor de analyse van de celcyclus werden de cellen vervolgens geoogst en een nacht gefixeerd in ijskoude 70% ethanol. Daarna werden de cellen vóór de analyse geresuspendeerd in PBS met 0,1 mg/ml RNase A en 5 µg/ml propidiumjodide. Voor apoptosemetingen werden de cellen geoogst en de apoptoseniveaus werden geanalyseerd door middel van flowcytometrie met behulp van de Annexin-V FITC Apoptosis Kit (Clontech Laboratories, Inc., Saint-Germainen-Laye, Frankrijk) volgens de instructies van de fabrikant. Flowcytometrie-analyse van cellulair DNA-gehalte en fosfatidylserine-expiratie werd uitgevoerd met een flowcytometer (BD Accuri C6), waarbij ten minste 20.000 gebeurtenissen per monster werden uitgezet. De gegevens werden geanalyseerd met de software FlowJo 7.6.5 (Tree Star, Inc., Ashland, USA).
Western blot analyse en antilichamen
De cellenwerden gedurende 15 minuten bij 4°C gelyseerd met RIPA-buffer (1% NP-40 in 150 mM NaCl, 50 mM Tris (pH 7,5), 2 mM EDTA) die fosfatase- en proteaseremmers bevatte. Eiwitten werden gekwantificeerd met een aangepaste Bradford-test (Biorad). Eiwitmonsters (50 µg) werden gescheiden in 10% SDS/ PAGE-gels en geëlektrobloteerd op Hybond ECL-membraan (Amersham Biosciences). We gebruikten de volgende primaire antilichamen: PDH en pPDH Ser293, van Abcam; PDK1 (Sigma-Aldrich), PDK2 (Sigma-Aldrich), HIF1-α (Transduction Laboratories) en de mTOR pathway-effectors pS6 Ser235/236, s6, p-4EBP1 Thr37/46, 4EBP1, alle van Cell Signaling Technology. Secundaire antilichamen werden geconjugeerd met peroxidase (Santa Cruz Biotechnology) en gevisualiseerd met de ECL-detectieoplossing. Membranen werden opnieuw gekleurd met een geit polyklonaal anti-actine (Santa Cruz Biotechnology) antilichaam voor eiwitbelastingscontrole. Alle experimenten en kwantificaties (met behulp van Bio-Rad Quantity One 1-D Analysis software (versie 4.6.6)) werden in drievoud uitgevoerd.
Statistische analyse
De statistische analyse werd uitgevoerd met behulp van STAT VIEW-J 5.0 (SAS Institute, Inc., Cary, NC). Het verband tussen het gemiddelde expressieniveau (score) van de immunohistochemische markers en de klinisch-pathologische parameters werd geëvalueerd met behulp van ANOVA. Waar nodig werden correcties voor meervoudige vergelijking uitgevoerd met de post hoc Bonferroni en Tamhane tests. De correlatie tussen de immunoreactiviteitsscore van de verschillende markers werd beoordeeld met Fisher’s exact test. De gegevens van de experimenten met cellijnen werden geanalyseerd met de ongepaarde tweezijdige Student’s t-test. De Kaplan-Meier methode en de log-rank test werden gebruikt om de overlevingsgegevens van het melanoom te evalueren. Univariate en multivariate analyses werden uitgevoerd om de prognostische waarde van covariaten met betrekking tot OS en DFS te bepalen met behulp van het Cox regressiemodel. OS en DFS werden berekend vanaf het tijdstip van diagnose tot aan overlijden ten gevolge van ziekte of metastase, respectievelijk gecensureerd op het tijdstip van de laatste follow-up of overlijden dat geen verband hield met de ziekte. Een p-waarde < 0,05 werd als statistisch significant beschouwd.
Resultaten
Expressie van PDK’s in CM en nevi
Zowel in CM als in nevi laesies kwamen PDK 1-, 2- en 3-isovormen niet alleen tot expressie in melanocyten/melanoomcellen, maar ook in keratinocyten en in de cellen van talgklieren en haarfollikels. De expressieniveaus van alle geanalyseerde PDK-isovormen waren onderling positief gecorreleerd, hetgeen wijst op een gelijktijdige expressie van deze eiwitten (tabel 2).
| Eiwit | Gemiddeld expressieniveau (± SD) | Correlatie (p-waarde) | Correlatie (p-waarde) | Correlatie (p-waarde) |
| PDK1 | 4.8 ± 3.5 | < 0.01* | < 0.01§ | |
| PDK2 | 4.6 ± 3.6 | < 0.01† | ||
| PDK3 | 7.0 ± 3.2 |
*Tussen PDK1 en PDK2; † tussen PDK2 en PDK3; § tussen PDK1 en PDK3.
PDK1 immunohistochemische expressie
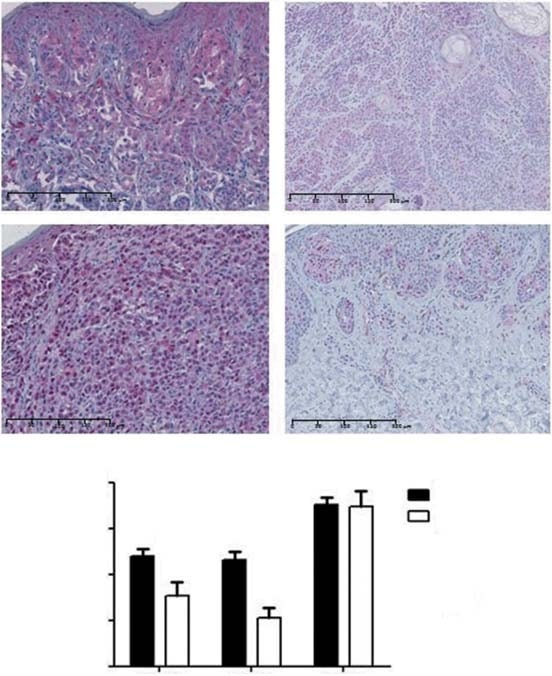
Cytoplasmatische PDK1-kleuring werd waargenomen in 88% van CM en 76% van nevi (figuur 2A). Negatieve/lage kleuring werd waargenomen in 52 en 76% en matige/hoge kleuring in 48 en 24% van respectievelijk melanomen en nevi. Daarom vertoonden CM significant hogere gemiddelde niveaus van PDK1-expressie dan nevi (p = 0,03; figuur 2B). Wat de histologische subtypen van CM betreft, vertoonde LMM hogere PDK1-expressieniveaus dan NM (p = 0,04) en ALM (p = 0,04). Er werd geen verband gevonden tussen de expressie van PDK1 en het type blootstelling aan de zon. Wat de prognostische factoren betreft, kwam PDK1 meer tot expressie in tumoren van £ 1 mm dik (p = 0,02). Hogere PDK1-expressieniveaus waren geassocieerd met lagere tumorstadia (p = 0,04), maar niet met de algehele en ziektevrije overleving van de patiënten. Wij evalueerden ook of de expressie van PDK-isovormen gerelateerd was aan de MAPK- en de PI3K-AKT-mTOR-paden. Er werd geen verband gevonden tussen de expressie van PDK1 en BRAF/NRAS-mutaties of met de activering van de MAPK-route (geëvalueerd aan de hand van pERK-expressie). PDK1-expressie was positief gecorreleerd met de expressie van eiwitten van de PI3K-AKT-mTOR-cascade, namelijk mTOR en 4EBP1 (respectievelijk p = 0,02 en p = 0,04).
PDK2 immunohistochemische expressie
PDK2 vertoonde zowel nucleaire als cytoplasmatische expressie in 87% van CM en 83% van nevi (figuur 2A). Negatieve/lage kleuring werd waargenomen in 58 en 89% en matige/hoge kleuring in respectievelijk 42 en 11% van de melanomen en nevi. Het gemiddelde expressieniveau van PDK2 was hoger in CM dan in nevi (p < 0,01; figuur 2B). Wat de histologische subtypen van CM betreft, vertoonden SSM hogere niveaus van PDK2-expressie dan ALM (p = 0,02). Wij vonden geen verband tussen het type blootstelling aan de zon en de expressie van PDK2. Lagere tumorstadia vertoonden significant hogere niveaus van PDK2 (p = 0,02), hoewel er geen associatie werd gevonden tussen de expressie van deze isovorm en de belangrijkste prognostische factoren van CM, noch met de algehele en ziektevrije overleving van de patiënten. PDK2-expressie was niet geassocieerd met BRAF/NRAS-mutatiestatus of met de activering van de MAPK-route. Er werd een significante positieve correlatie gevonden tussen PDK2-expressie en AKT-expressie van de PI3K-AKT-mTOR-cascade (p = 0,03).
PDK3 immunohistochemische expressie
PDK3 vertoonde cytoplasmatische expressie in alle CM en nevi. Negatieve/lage kleuring werd waargenomen in 28 en 22% en matige/hoge kleuring in respectievelijk 72 en 78% van het CM en de nevi. Het expressieniveau van de PDK3-isovorm was vergelijkbaar tussen CM en nevi (figuur 2B). Er waren geen significante verschillen bij vergelijking van het gemiddelde niveau van PDK3-expressie tussen CM-subtypes en het type blootstelling aan de zon. Tumoren met een dikte van £ 1 mm en die met lagere stadia vertoonden hogere niveaus van PDK3 (p = 0,01 en p < 0,01, respectievelijk). Ulceratie, mitotisch percentage en algehele en ziektevrije overleving van de patiënten waren niet significant geassocieerd met PDK3-expressie. Er werd geen verband gevonden tussen de expressie van PDK3 en BRAF/NRAS-mutaties of de activering van de MAPK-cascade. Wat de PI3K-AKT-mTOR-route betreft, was PDK3-expressie positief gecorreleerd met de totale AKT-, mTOR- en 4EBP1-expressie (respectievelijk p < 0,01, p < 0,01 en p = 0,04). Vanwege de algemene expressie van PDK3 in elke CM en nevi, werd deze PDK-isovorm niet meegenomen in de daaropvolgende in vitro analyse.
Het effect van DCA-behandeling op de levensvatbaarheid van melanoomcellijnen
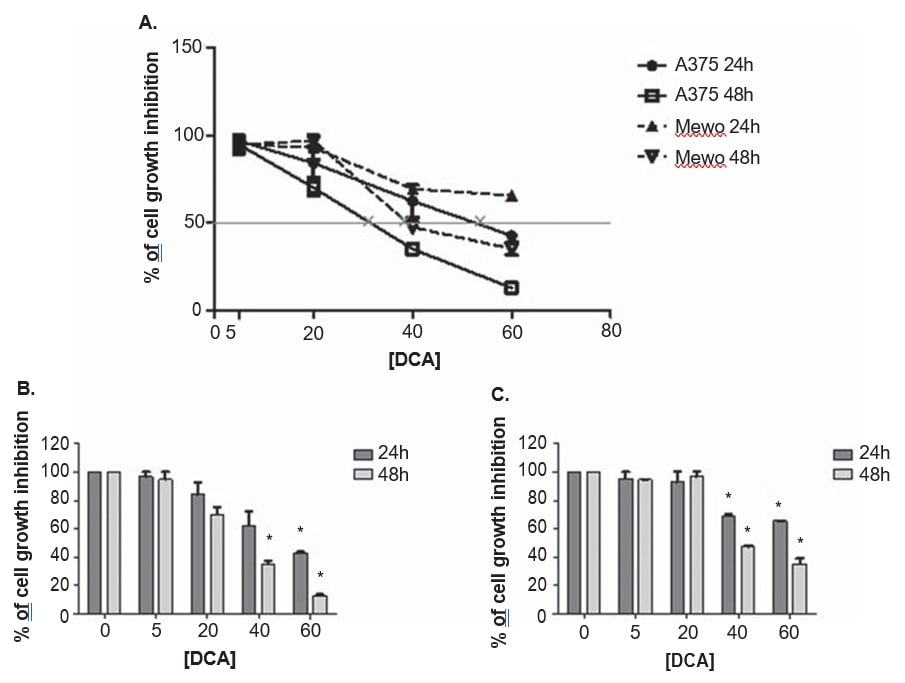
De melanoomcellijnen A375 en Mewo werden blootgesteld aan oplopende concentraties DCA om het effect op de levensvatbaarheid van de cellen vast te stellen met behulp van de PrestoBlue-test. DCA verminderde de levensvatbaarheid van beide cellijnen op dosisafhankelijke wijze na 24 en 48 uur behandeling, hoewel A375 iets gevoeliger was voor DCA-behandeling, met een hogere groeiremming in vergelijking met de Mewo-cellijn (figuur 3). Het effect van DCA op de levensvatbaarheid van A375-cellen werd waargenomen na behandeling met 5 mM en was in de Mewo-cellijn intensiever na behandeling met 20 mM, met remmingswaarden variërend van 3 tot 87% in A375 en 5 tot 65% in Mewo. De IC50-waarden werden geschat op 33 ± 5,5 mM voor A375 en 39,9 ± 2,2 mM voor de Mewo-cellijn, na 48 uur DCA-behandeling (figuur 3).
Het effect van DCA-behandeling op het glucoseverbruik en de lactaatproductieniveaus van melanoomcellijnen
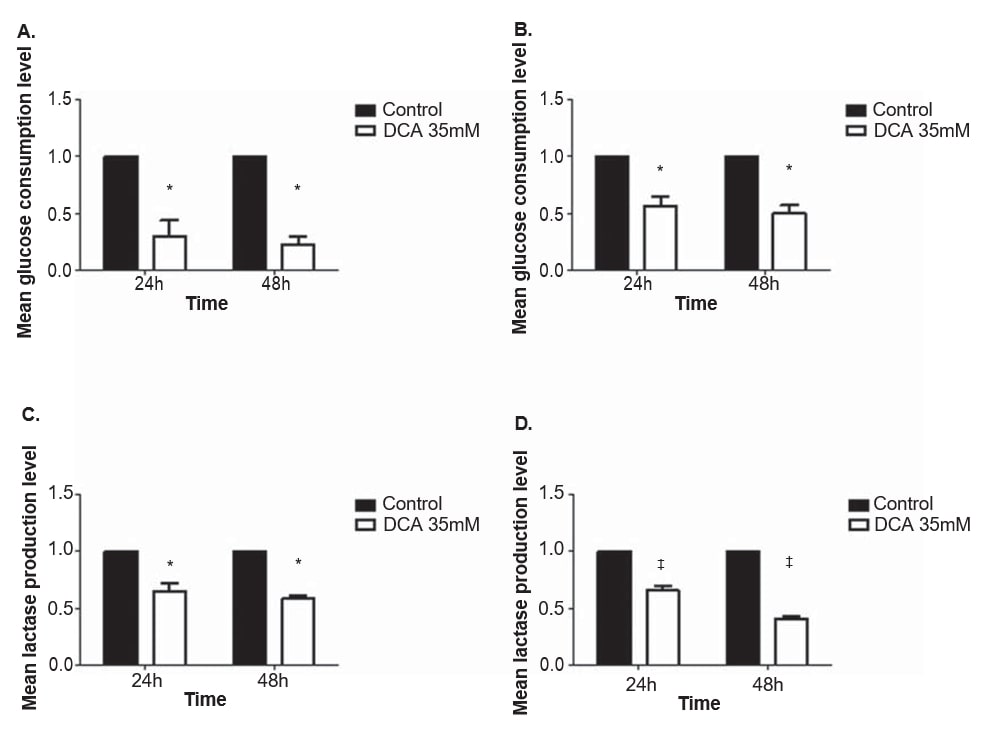
Om het effect van DCA op het metabolisme van melanoomcellijnen te evalueren, werden de glucose- en lactaatniveaus gekwantificeerd in het kweekmedium na 24 en 48 uur behandeling met 35 mM DCA, een concentratie in de buurt van de IC50 voor beide cellijnen. Het verbruik van glucose en de productie van lactaat daalden in beide melanoomcellijnen na behandeling met DCA (figuur 4). De cellijnen A375 en Mewo vertoonden zowel na 24 als 48 uur DCA-behandeling een significante daling van het glucoseverbruik (p = 0,01 en p < 0,01, respectievelijk). Het lactaatproductieniveau was ook significant gedaald na 24 en 48 uur in A375 (p = 0,01 en p < 0,01, respectievelijk) en in Mewo (p < 0,01) cellijnen.
Het effect van DCA-behandeling op de PDK- en mTOR-trajecteffectoren en op de expressie van HIF1-α in melanoomcellijnen
De doeltreffendheid van DCA-behandeling in het remmen van de PDK-activiteit werd geëvalueerd door de expressie van de gefosforyleerde downstream-effector PDH te analyseren met behulp van western blot. Na 24 uur na DCA-behandeling werd in beide cellijnen een significante remming van de fosforylering van PDH waargenomen (p < 0,01; figuur 5). De expressie van PDK1 en PDK2 werd niet veranderd door DCA-behandeling (figuur 5), zoals verwacht. De expressie van de twee downstream-effectors en uitlezingen van de activering van de mTOR-route, S6 en 4EBP1, werd ook geëvalueerd. Hoewel DCA-behandeling de expressie van S6 en 4EBP1 niet veranderde, nam het expressieniveau van de gefosforyleerde vormen van beide eiwitten af in A375 (p = 0,03 en niet significant, respectievelijk) en in Mewo (p < 0,01 en p = 0,01, respectievelijk; figuur 5). Aangezien DCA de HIF1-α niveaus kan beïnvloeden, werd de expressie van dit eiwit ook geëvalueerd, en er werd geen verandering waargenomen na DCA behandeling (figuur 5). Vergelijkbare resultaten werden verkregen bij 48 uur na DCA-behandeling, die de fosforylering van PDH in beide cellijnen aanzienlijk remt (p <0,01). Het expressieniveau van de gefosforyleerde vormen van S6 en 4EBP1 was significant gedaald in A375 (p = 0,01 en p = 0,02, respectievelijk) en in Mewo (p = 0,01 en niet significant, respectievelijk). De expressie van PDK1, PDK2 en HIF1-α was niet veranderd (gegevens niet getoond).
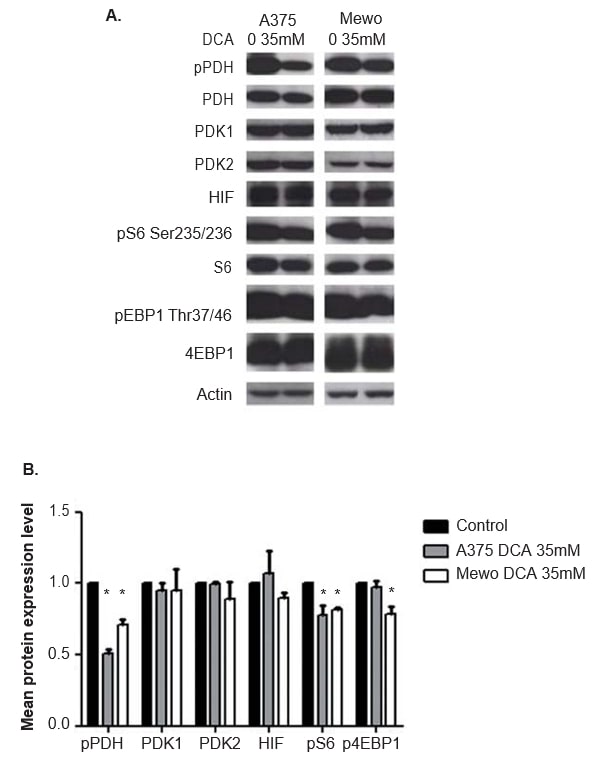
Het effect van DCA-behandeling op de celcyclus en apoptose van melanoomcellijnen
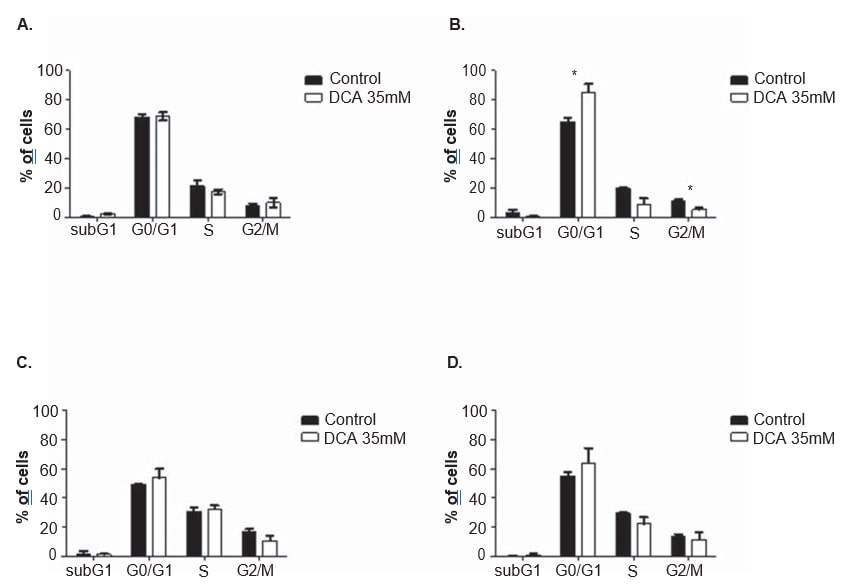
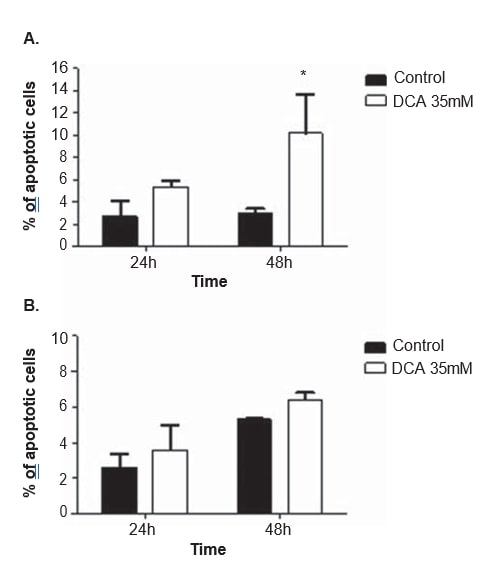
Om het werkingsmechanisme van DCA te verduidelijken, werden in beide cellijnen celcyclusanalyse en apoptosemetingen uitgevoerd, na 24 en 48 uur behandeling met 35 mM DCA. De celcyclus werd geanalyseerd met propidiumjodide. Na 48 uur behandeling met DCA vertoonde de A375-cellijn een significante toename van het percentage cellen in de G0/G1-fase van de celcyclus (van 65,0 ± 4,9% in niet-behandelde cellen tot 85,2 ± 10,2% in met DCA behandelde cellen; p = 0,04), een significante afname in G2/M (van 11..3 ± 1,3% waargenomen in niet-behandelde cellen tot 5,2 ± 2,2% in met DCA behandelde cellen; p = 0,01) en een afname, zonder de drempel van statistische significantie te bereiken, in de S-fase (van 19,7 ± 1,8% waargenomen in niet-behandelde cellen tot 9,1 ± 6,7% in met DCA behandelde cellen; p = 0,06; figuur 6). Dezelfde tendens werd waargenomen in de Mewo-cellijn 48 uur na DCA-behandeling (toename van het percentage cellen in G0/G1, en afname in S en G2/M), hoewel dit geen statistische significantie bereikte (figuur 6). Flowcytometrie-analyse werd uitgevoerd na kleuring met Annexin V/Propidiumjodide. Er werd een significante toename van het aantal apoptotische cellen in A375-cellijn na 48 uur DCA-behandeling waargenomen (3,0 ± 0,5% in niet-behandelde cellen tot 16,9 ± 4,6% in met DCA behandelde cellen; p < 0,01; figuur 7). Er werd een niet-significante toename van het percentage apoptotische cellen in A375-cellijn na 24 uur en in Mewo-cellijn na 24 en 48 uur behandeling met DCA waargenomen.
Bespreking
In dit werk hebben we voor het eerst vastgesteld dat CM de PDK1 en PDK2 eiwitten overexpresseert. PDK’s zijn belangrijke eiwitten, gereguleerd door HIF1-α, die kwaadaardige cellen naar het fenotype van aërobe glycolyse leiden, een kenmerk van kanker [20,22,31].
Het Warburg-effect wordt beschouwd als een weerstandsfactor tegen conventionele chemotherapieën [21]. De overexpressie van PDK in CM bracht ons ertoe het effect van DCA-behandeling in melanoomcellijnen te evalueren. Wij constateerden dat DCA-behandeling het glucoseverbruik en de lactaatproductie in melanoomcellijnen vermindert, wat overeenkomt met het effect van DCA op de verschuiving van aërobe glycolyse naar oxidatieve fosforylering dat eerder in kankercellen is gemeld [41]. Deze verschuiving in het glucosemetabolisme is waarschijnlijk het gevolg van de waargenomen significante afname van de expressie van de gefosforyleerde vorm van PDH, hetgeen ook de werkzaamheid van de behandeling met DCA bevestigt. Het is relevant te vermelden dat de juiste aflezing van het effect van DCA het niveau van gefosforyleerd PDH is, aangezien DCA, door de activiteit van PDK te remmen en niet de expressie ervan, de fosforylering van PDH stimuleert (figuur 1).
Wij constateerden een dosisafhankelijke afname van de levensvatbaarheid van de cellen na behandeling met DCA in beide melanoomcellijnen. Ook werd een verlaging van de proliferatie, via G0/G1-stilstand, samen met een toename van de apoptose waargenomen in beide cellijnen, maar alleen statistisch significant in A375-cellijn. Het feit dat de in deze studie gekozen concentratie DCA (35 mM) iets onder de IC50 voor de Mewo-cellijn ligt, kan het minder uitgesproken effect verklaren dat in die cellen is waargenomen.
De relatie tussen DCA en HIF-1a bij kanker is niet helemaal duidelijk, aangezien DCA het zuurstofverbruik en de ROS-productie in het weefsel verhoogt, wat zou moeten leiden tot respectievelijk een verhoging of stabilisering van HIF-1a [46,47]. Omgekeerd meldden sommige auteurs dat DCA leidt tot een afname van de expressie van HIF1-α [25,48,49]. In ons werk werd geen verandering waargenomen in het HIF1-α niveau na DCA behandeling van melanoom cellijnen, hetgeen overeenkomt met Shahrzad et al. die meldden dat HIF1-α expressie alleen afneemt na DCA behandeling in hypoxische omstandigheden [49].
Om de door mutant BRAF geïnduceerde senescentie te overwinnen en over te gaan tot agressievere fenotypen, activeert CM waarschijnlijk andere signaalcascades, zoals de mTOR-route [12]. Deze pathway draagt bij aan het Warburg-effect door het bevorderen van HIF1-α activiteit, die op zijn beurt de PDK expressie kan verhogen [23,31]. Wij hebben eerder een volledige activering van deze pathway in CM gerapporteerd [13]. In deze studie zagen wij een gelijktijdige expressie van PDK 1, 2 en 3 en van de mTOR pathway-effectors in CMs. De expressie van de PDK-isovormen in CM correleerde positief met de expressie van mTOR, alsook met upstream en downstream effectoren van deze pathway: AKT en 4EBP1. Bovendien zagen wij een significante afname van pS6 en p4EBP1 in A375 en Mewo-cellijnen na behandeling met DCA.
Nevi delen een aantal genetische veranderingen met CM, aangezien beide een hoge frequentie van BRAF-mutaties vertonen [10]. Hoewel op een veel lager niveau, werd de expressie van PDK ook waargenomen in nevi. Wij onderzochten of de BRAF-mutatiestatus en de downstream activering van ERK geassocieerd konden worden met een hogere expressie van PDK. Wij vonden geen verband in nevi noch in CM. A375-cellijn heeft de BRAFV600E-mutatie en Mewo-cellijn is wild type voor dit gen, en de respons van beide cellijnen op DCA-behandeling was vergelijkbaar, ondanks de variabele intensiteit. In feite werd reeds gemeld dat de BRAF-mutatiestatus de gevoeligheid voor DCA-behandeling niet verandert [50]. Deze resultaten contrasteren met onze eerdere bevindingen met mTOR-trajectremmers in verschillende van melanoom afgeleide cellijnen, waar we een hogere gevoeligheid voor RAD001-behandeling vonden in de CM-cellijnen met BRAFV600E-mutatie [51].
PDK-isovormen kwamen tot expressie in het cytoplasma van de melanoomcellen, wat de bekende mitochondriale functie van dergelijke isovormen ondersteunt [33]. Wat PDK2 betreft, werd in de meeste CM-gevallen een nucleaire expressie waargenomen. Deze nucleaire locatie is ook gerapporteerd voor PDK1 in HNSCC [37]. Voor zover bekend moet de rol van PDK in de kern nog worden opgehelderd, maar onlangs werd een nucleaire functie naar voren gebracht voor PDH, de downstream effector van PDK. Sutendra et al. meldden dat PDH betrokken is bij de nucleaire vorming van acetyl-CoA [52]. In reactie op stimulatie door groeifactor transloceren PDH en zijn fosfatase van de mitochondria, waar het wordt geremd door PDK, naar de kern, maar een nucleaire locatie voor PDK werd niet geïdentificeerd [ 52]. Toch zijn er aanwijzingen dat sommige glycolytische enzymen betrokken zijn bij andere cellulaire functies dan de glycolyse, namelijk bij de regulering van de transcriptie [ 53]. Aanvullende studies zijn nodig om op te helderen of PDK ook een nucleaire functie heeft.
Bij niercelcarcinoom werd gemeld dat de expressie van PDK1 afneemt naarmate de tumor vordert [39]. In ons werk bleek PDK ook meer tot expressie te komen in lagere tumorstadia, zonder de algehele en ziektevrije overleving van de melanoompatiënten te beïnvloeden. Daarentegen werd PDK-overexpressie geïdentificeerd als een marker van tumorprogressie, slechte prognose en recidief, in HNSCC en maagkanker [37,40,54]. Hoewel ons doel niet was de prognostische rol van PDK in CM te onderzoeken, suggereren onze resultaten dat PDK’s in CM mogelijk een actievere rol spelen bij de ontwikkeling van melanoom dan bij de progressie van melanoom. Wij zijn ons ervan bewust dat onze serie voornamelijk bestaat uit primair CM en dat verdere studies in gevorderd (metastatisch) melanoom nodig zijn om deze kwestie op te helderen.
Met deze studie wilden wij biomarkers onderzoeken voor nieuwe therapeutische benaderingen bij CM-patiënten. Onze resultaten suggereren een mogelijk nut van DCA bij de behandeling van CM patiënten, in overeenstemming met Abildgaard et al. die een afname van ATP niveaus en melanoomgroei rapporteerden bij behandeling met DCA [50]. Deze auteurs meldden ook een synergetische combinatie tussen DCA en een BRAF-remmer, vemurafenib [50 ]. Bovendien tonen onze resultaten een gelijktijdige expressie van PDK en mTOR pathway effectors in CM en downregulatie van mTOR pathway activiteit door DCA behandeling. Gezien de resultaten van Hong et al. die een synergetisch effect rapporteerden van de combinatie van DCA met een S6K1 (mTOR pathway effector) remmer [55], is het verleidelijk te speculeren dat een synergetisch therapeutisch effect kan worden bereikt in CM door de combinatie van DCA met een directe mTOR remmer.
Conclusie
Wij melden voor het eerst de overexpressie van PDK1 en 2 in CM in vergelijking met nevi. De expressie van PDK’s bleek geassocieerd met de expressie van mTOR pathway-effectors en niet gerelateerd aan de BRAF-mutatiestatus. DCA-behandeling leidt tot een verschuiving in metabolisme, downregulatie van proliferatie, verhoogde apoptose en verminderde activering van het mTOR-traject in melanoomcellijnen. Al deze resultaten tezamen concluderen wij dat PDK-expressie een rol kan spelen bij de ontwikkeling van melanoom en dat remming ervan door DCA alleen of in combinatie met directe mTOR-remmers CM-patiënten ten goede kan komen.
Dankbetuigingen
Wij zijn alle patiënten dankbaar die aan dit onderzoek hebben deelgenomen, evenals de artsen die klinische, pathologische en follow-up informatie hebben verstrekt. Wij danken Dr Madalena Pinto, van CEQUIMED, Faculteit Farmacie, Universiteit van Porto, Portugal, die zo vriendelijk was ons de A375 huidmelanoom cellijn te bezorgen, en Dr Marc Mareel, van de Afdeling Radiotherapie en Nucleaire Geneeskunde, Universitair Ziekenhuis Gent, België, die zo vriendelijk was ons de Mewo huidmelanoom cellijn te bezorgen. Wij danken Gabriela Almeida voor de nuttige technische adviezen met betrekking tot de PB-test. Wij danken ook professor Manuel Sobrinho Simões voor het kritisch lezen van dit manuscript. H Pópulo en R Caldas hebben in gelijke mate bijgedragen aan dit werk.
Belangenverklaring
Deze studie werd ondersteund door de Portugese Stichting voor Wetenschap en Technologie door middel van Post-Doc subsidie aan HP (Ref.: SFRH/BPD/85249/2012). Verdere financiering werd verkregen uit het project “Micro-omgeving, metabolisme en kanker” dat gedeeltelijk werd ondersteund door Programa Operacional Regional do Norte (ON.2 – O Novo Norte) in het kader van het Quadro de Referência Estratégico Nacional (QREN) en het Fundo Europeu de Desenvolvimento Regional (FEDER). IPATIMUP omvat de onderzoekseenheid i3S, die gedeeltelijk wordt gesteund door FCT, de Portugese Stichting voor Wetenschap en Technologie. Dit werk werd gefinancierd door FEDER-middelen via het operationele programma voor concurrentiefactoren – COMPETE en nationale fondsen via de FCT, in het kader van de projecten “PEst-C/SAU/LA0003/2013” De auteurs melden geen potentiële belangenconflicten. De auteurs hebben geen andere relevante affiliaties of financiële betrokkenheid bij een organisatie of entiteit met een financieel belang in of een financieel conflict met het onderwerp of de materialen besproken in het manuscript, afgezien van die openbaar gemaakt.
VERWIJZINGEN
1 Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA Cancer J Clin 2014;64(1):9-29
2 Nikolaou V, Stratigos AJ. Opkomende trends in de epidemiologie van melanoom. Br J Dermatol 2014;170(1):11-19
3 Smoller BR. Histologische criteria voor de diagnose van primair cutaan kwaadaardig melanoom. Mod Pathol 2006;19(Suppl 2):S34-40
4 Populo H, Soares P, Lopes JM. Insights into melanoma: targeting the mTOR pathway for therapeutics. Expert Opin Ther Targets 2012;16(7):689-705
5 Balch CM, Gershenwald JE, Soong SJ, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009;27(36):6199-206
6 Lopez-Bergami P, Fitchman B, Ronai Z. Understanding signaling cascades in melanoma. Photochem Photobiol 2008;84(2):289-306
7 Bertolotto C. Melanoom: van melanocyt tot genetische veranderingen en klinische opties. Scientifica 2013;2013:22
8 Populo H, Boaventura P, Vinagre J, et al. TERT-promotermutaties in huidkanker: de effecten van blootstelling aan de zon en X-straling. J Invest Dermatol 2014;134(8):2251-7
9 Vlier DE. Voorlopers van melanoom en hun mimiek: nevi van bijzondere plaatsen. Modern pathology Inc 2006;19(Suppl 2):S4-20
10 Kumar R, Angelini S, Snellman E, et al. BRAF-mutaties zijn veel voorkomende somatische gebeurtenissen
11 in melanocytaire nevi. J Invest Dermatol 2004;122(2):342-8 Michaloglou C, Vredeveld LC, Soengas MS, et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature 2005;436(7051):720-4
12 Vredeveld LC, Possik PA, Smit MA, et al. Abrogation of BRAFV600E-induced senescence by PI3K pathway activation contributes to melanomagenesis. Genes Dev 2012;26(10):1055-69
13 Populo H, Soares P, Faustino A, et al. mTOR pathway activation in cutaneous melanoma is associated with poorer prognosis characteristics. Pigment Cell Melanoma Res 2011;24(1):254-7
14 Olszanski AJ. Current and future roles of targeted therapy and immunotherapy in advanced melanoma. J manag Care Spec Pharm 2014;20(4):346-56
15 Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010;363(8):711-23
16 Chapman PB, Hauschild A, Robert C, et al. Verbeterde overleving met vemurafenib in melanoom met BRAF V600E-mutatie. N Engl J Med 2011;364(26):2507-16
17 Flaherty KT, Robert C, Hersey P, et al. Verbeterde overleving met MEK-remming in BRAF-gemuteerd melanoom. N Engl J Med 2012;367(2):107-14
18 Ballantyne AD, Garnock-Jones KP. Dabrafenib: eerste wereldwijde goedkeuring. Drugs 2013;73(12):1367-76
19Beschikbaar via:http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm412861.htm
20 Gillies RJ, Robey I, Gatenby RA. Oorzaken en gevolgen van een verhoogd glucosemetabolisme bij kanker. J Nucl Med 2008;49(Suppl 2):24S-42S
21 Zhao Y, Butler EB, Tan M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death Dis 2013;4:e532
22 Semenza GL. HIF-1 medieert metabole reacties op intratumorale hypoxie en oncogene mutaties. J Clin Invest 2013;123(9):3664-71
23 Wouters BG, Koritzinsky M. Hypoxia signalling through mTOR and the unfolded protein response in cancer. Nat Rev Cancer 2008;8(11):851-64
24 Scott DA, Richardson AD, Filipp FV, et al. Comparative metabolic flux profiling of melanoma cell lines: beyond the Warburg effect. J Biol Chem 2011;286(49):42626-34
25 Kluza J, Corazao-Rozas P, Touil Y, et al. Inactivation of the HIF-1alpha/PDK3 signaling axis drives melanoma toward mitochondrial oxidative metabolism and potentiates the therapeutic activity of pro-oxidants. Cancer Res 2012;72(19):5035-47
26 Baudy AR, Dogan T, Flores-Mercado JE, et al. FDG-PET is een goede biomarker van zowel vroege respons als verworven resistentie in BRAFV600-mutante melanomen die worden behandeld met vemurafenib en de MEK-remmer GDC-0973. EJNMMI onderzoek 2012;2(1):22
27 Hall A, Meyle KD, Lange MK, et al. Dysfunctionele oxidatieve fosforylering maakt kwaadaardige melanoomcellen verslaafd aan glycolyse aangedreven door het (V600E)BRAF oncogen. Oncotarget 2013;4(4):584-99
28 Kumar SM, Yu H, Edwards R, et al. Mutant V600E BRAF verhoogt hypoxia inducible factor-1alpha expressie in melanoom. Cancer Res 2007;67(7):3177-84
29 Kuphal S, Winklmeier A, Warnecke C, et al. Constitutive HIF-1 activity in malignant melanoma. Eur J Cancer 2010;46(6):1159-69
30 Slominski A, Kim TK, Brozyna AA, et al. The role of melanogenesis in regulation of melanoma behavior: Melanogenesis leads to stimulation of HIF-1alpha expression and HIF-dependent attendant pathways. Archives of biochemistry and biophysics 2014;563:79-93
31 Kim JW, Tchernyshyov I, Semenza GL, et al. HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia. Cell Metab 2006;3(3):177-85
32 Lu CW, Lin SC, Chen KF, et al. Induction of pyruvate dehydrogenase kinase-3 by hypoxia-inducible factor-1 promotes metabolic switch and drug resistance. J Biol Chem 2008;283(42):28106-14
33 Patel MS, Korotchkina LG. Regeling van het pyruvaat dehydrogenase complex. Biochem Soc Trans 2006;34(Pt 2):217-22
34 Bowker-Kinley MM, Davis WI, Wu P, et al. Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex. Biochem J 1998;329(Pt 1):191-6
35 Papandreou I, Goliasova T, Denko NC. Antikankermedicijnen die het metabolisme aanpakken: is dichlooracetaat het nieuwe paradigma? Int J Cancer 2011;128(5):1001-8
36 Zhang S, Hulver MW, McMillan RP, et al. The pivotal role of pyruvate dehydrogenase kinases in metabolic flexibility. Voeding & metabolisme 2014;11(1):10
37 Wigfield SM, Winter SC, Giatromanolaki A, et al. PDK-1 regelt lactaatproductie in hypoxie en is geassocieerd met slechte prognose in hoofd-hals squameuze kanker. Br J Cancer 2008;98(12):1975-84
38 Lu CW, Lin SC, Chien CW, et al. Overexpressie van pyruvaat dehydrogenase kinase 3 verhoogt medicijnresistentie en vroeg recidief in darmkanker. Am J Pathol 2011;179(3):1405-14
39 Baumunk D, Reichelt U, Hildebrandt J, et al. Expressieparameters van de metabolic pathway-genen pyruvaat dehydrogenase kinase-1 (PDK-1) en DJ-1/PARK7 in niercelcarcinoom (RCC). World J Urol 2013;31(5):1191-6
40 Hur H, Xuan Y, Kim YB, et al. Expressie van pyruvaat dehydrogenase kinase-1 in maagkanker als potentieel therapeutisch doelwit. Int J Oncol 2013;42(1):44-54
41 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007;11(1):37-51
42 Kankotia S, Stacpoole PW. Dichlooracetaat en kanker: Nieuw thuis voor een weesgeneesmiddel? Biochimica et biophysica acta 2014;1846(2):617-29
43 Sutendra G, Dromparis P, Kinnaird A, et al. Mitochondriale activering door remming van PDKII onderdrukt HIF1a signalering en angiogenese in kanker. Oncogene 2013;32(13):1638-50
44 Michelakis ED, Sutendra G, Dromparis P, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010;2(31):31ra34
45 Castro P, Rebocho AP, Soares RJ, et al. PAX8-PPARgamma herschikking wordt frequent gedetecteerd in de folliculaire variant van papillair schildkliercarcinoom. J Clin Endocrinol Metab 2006;91(1):213-20
46 Sun W, Zhou S, Chang SS, et al. Mitochondriale mutaties dragen bij aan HIF1alpha accumulatie via verhoogde reactieve zuurstofspecies en upgereguleerde pyruvaat dehydrogenase kinase 2 in hoofd-hals plaveiselcelcarcinoom. Clin Cancer Res 2009;15(2):476-84
47 Cairns RA, Bennewith KL, Graves EE, et al. Pharmacologically increased tumor hypoxia can be measured by 18F-Fluoroazomycin arabinoside positron emission tomography and enhances tumor response to hypoxic cytotoxin PR-104. Clin Cancer Res 2009;15(23):7170-4
48 Sun RC, Board PG, Blackburn AC. Targeting metabolism with arsenic trioxide and dichloroacetate in breast cancer cells. Mol Cancer 2011;10:142
49 Shahrzad S, Lacombe K, Adamcic U, et al. Sodium dichloroacetate (DCA) reduces apoptosis in colorectal tumor hypoxia. Cancer Lett 2010;297(1):75-83
50 Abildgaard C, Dahl C, Basse AL, et al. Bioenergetische modulatie met dichlooracetaat vermindert de groei van melanoomcellen en versterkt hun respons op BRAFV600E-inhibitie. J Transl Med 2014;12:247
51 Populo H, Tavares S, Faustino A, et al. GNAQ en BRAF mutaties tonen differentiële activering van de mTOR pathway in menselijke getransformeerde cellen. Peer J 2013;1:e104
52 Sutendra G, Kinnaird A, Dromparis P, et al. Een nucleair pyruvaat dehydrogenase complex is belangrijk voor de generatie van acetyl-CoA en histonacetylering. Cell 2014;158(1):84-97
53 Kim JW, Dang CV. Veelzijdige rollen van glycolytische enzymen. Trends Biochem Sci 2005;30(3):142-50
54 Xuan Y, Hur H, Ham IH, et al. Dichloroacetate attenuates hypoxia-induced resistance to 5-fluorouracil in gastric cancer through the regulation of glucose metabolism. Exp Cell Res 2014;321(2):219-30
55 Hong SE, Shin KS, Lee YH, et al. Inhibition of S6K1 enhances dichloroacetate-induced cell death. J Cancer Res Clin Oncol 2014.