Akbar Khan
Medisch directeur, Medicor Cancer Centres Inc., Toronto, Canada
Abstract
Nier squameus celcarcinoom is een zeldzame vorm van nierkanker die als ongeneeslijk wordt beschouwd zodra er zich metastasen ontwikkelen. De prognose is slecht en de gemiddelde overleving van ziekte in een vergevorderd stadium is meestal enkele maanden, ondanks alle beschikbare conventionele therapieën.
Wij beschrijven het geval van een 72-jarige vrouw met metastatisch nier squameus celcarcinoom die een radicale nefrectomie onderging met positieve chirurgische marges, nieraderinvasie en uitzaaiingen naar meerdere abdominale lymfeklieren. Zij kreeg een kuur palliatieve radiotherapie naar de buik met 4500cGy in 25 fracties over 5 weken. Na de radiotherapie werd ze behandeld met een cyclisch regime van oraal natriumdichlooracetaat (“DCA”). De behandeling werd na 3 maanden gestaakt vanwege de ontwikkeling van perifere neuropathie. Follow-upbeelden na beëindiging van de DCA-behandeling toonden geen tekenen van metastatische ziekte. De neuropathie verbeterde geleidelijk en vier jaar later toonde computertomografie geen terugkeer van de kanker aan. Vijf jaar na voltooiing van de therapie voelt de patiënt zich nog steeds goed zonder klinische tekenen van terugkeer en leidt hij een normaal en actief leven.
Trefwoorden: Dichlooracetaat, radiotherapie, nier squameus celcarcinoom, remissie
Copyright © 2012 Akbar Khan. Dit is een open access artikel verspreid onder de Creative Commons Attribution License unported 3.0, die onbeperkt gebruik, distributie en reproductie toestaat in elk medium, op voorwaarde dat het originele werk correct wordt geciteerd. Contactpersoon auteur: Akbar Khan E-mail: [email protected]
INLEIDING
Renaal plaveiselcelcarcinoom (“RSCC”) is een zeldzame vorm van nierkanker die uitgaat van het nierbekken. RSCC omvat ongeveer 0,5 – 0,8% van alle kwaadaardige niertumoren (Bhaijee 2012). Hoewel chirurgie soms curatief is voor gelokaliseerde ziekte, wordt metastatisch renaal plaveiselcelcarcinoom (“mRSCC”) als ongeneeslijk beschouwd (Holmang et al. 2007). Verschillende publicaties van artsen met ervaring in de behandeling van RSCC hebben aangetoond dat dit kankertype radioresistent is en dat systemische chemotherapie weinig voordeel oplevert. (Bhandari et al. 2010), (Di Battista et al. 2012), (Kimura et al. 2000), (Li en Cheung 1987). De gemiddelde overleving van ziekte in een vergevorderd stadium is uiterst slecht (in de orde van enkele maanden) en de vijfjaarsoverleving bedraagt naar verluidt minder dan 10% (Holmang et al. 2007). In een overzicht van 15 gevallen meldden Lee et al. een mediane overleving van 3,5 maanden (Lee et al. 1998).
Er werd gezocht in Medline (Medline RSCC 2012) om na te gaan of er gevallen van langdurige volledige remissie van mRSCC waren geregistreerd. Dit onthulde meer dan 200 citaties van RSCC, maar slechts één gepubliceerd geval van 5 jaar volledige remissie/kuur (Carlson 1960). In dit geval onderging de patiënt een volledige nefro-ureterectomie, inclusief resectie van peri-renaal vet en een blaasmanchet. Pathologie toonde geen betrokkenheid van chirurgische marges aan en er werden geen metastasen gerapporteerd.
Natriumdichlooracetaat (“DCA”) is een geneesmiddel dat uitgebreid is bestudeerd voor de behandeling van congenitale melkziekte, die bestaat uit een groep erfelijke mitochondriale ziekten (Stacpoole et al. 2006), (Stacpoole et al. 1992), (Stacpoole et al. 1988). Het veiligheidsprofiel van het gebruik van DCA bij de mens is door deze werkzaamheden vastgesteld. Het is een relatief veilig middel gebleken, zonder hematologische, cardiale, pulmonale of renale toxiciteit. De voornaamste toxiciteit is neurologisch (voornamelijk perifere neuropathie) en deze is omkeerbaar (Kaufmann et al. 2006). Er is een DCA-geïnduceerd delirium waargenomen, dat eveneens reversibel is bij staken van het geneesmiddel (Brandsma et al. 2010). Lichte omkeerbare leverenzymverhoging kan voorkomen bij een klein percentage van de patiënten (Stacpoole et al. 2008).
In januari 2007 werd een belangrijk artikel gepubliceerd waarin werd aangetoond dat DCA effectief was bij de behandeling van menselijke borst-, long- en hersenkankers in vitro en in vivo (ratten) via nieuwe metabolische routes (Bonnet et al. 2007). Aangetoond werd dat DCA de mitochondriale pyruvaatdehydrogenase kinase remde, wat resulteerde in een remming van aërobe glycolyse, de gebruikelijke route voor energieproductie in menselijke kankercellen (bekend als het Warburg-effect). Aangezien kankercellen doorgaans niet in staat zijn over te schakelen op glucose-oxidatie wanneer de glycolyse wordt geremd, zullen de met DCA behandelde cellen hun ATP-energievoorraad kwijtraken (Xu et al. 2005). Ook werd aangetoond dat DCA selectief apoptose in kankercellen teweegbrengt door een verlaging van de membraanpotentiaal van gehyperpolariseerde mitochondriën en door activering van de spanningsgevoelige kaliumkanalen Kv1.5 (Bonnet et al. 2007).
Sinds 2007 is het onderzoek naar DCA voortgezet en DCA is in vitro werkzaam gebleken tegen meerdere menselijke kankercellijnen, waaronder eierstokkanker (Saed et al. 2011), neuroblastoom (Vella et al. 2012), dikke darm (Tong et al. 2011), longcarcinoïde (Fiebiger et al. 2011), baarmoederhalskanker (Xie et al. 2011) en endometriumkanker (Wong et al. 2008). Synergisme met radiotherapie is ook aangetoond bij prostaatkankercellijnen (Cao et al. 2008). Een mechanisme voor het synergisme voorgesteld door Cao et al. is een verhoogde expressie van BCL-2-geassocieerd X-eiwit (een pro-apoptotisch intracellulair eiwit) dat resulteert in een verhoogde snelheid van apoptose. DCA is ook in vivo werkzaam gebleken bij mensen tegen glioblastoom (Michelakis et al. 2010).
De auteur begon “off-label” DCA-therapie te gebruiken vanaf 2007 voor de behandeling van kankerpatiënten met een slechte prognose of die niet hadden gereageerd op conventionele kankertherapieën. Uit observatie van met DCA behandelde patiënten bleek dat een aanzienlijk aantal baat had bij het gebruik van dit geneesmiddel, hetzij volgens subjectieve criteria zoals pijnvermindering, hetzij volgens objectieve criteria zoals tumorkrimp (Medicor DCA Data 2009).
Presentatie van gevallen
Een 72-jarige vrouw meldde zich aanvankelijk bij haar huisarts met pijn in de rechterheup, hematurie en gewichtsverlies. Via echografie werd een massa in de rechter nier vastgesteld. Er werd een computertomografie (“CT”) gemaakt waarop een tumor te zien was in het rechter nierbekken, de bovenste en onderste polen van de nier en een uitbreiding naar de proximale rechter ureter (figuur 1). Er waren meerdere vergrote lymfeklieren in de buik (figuur 2). Er werd een botscan gemaakt die negatief was voor botmetastasen.
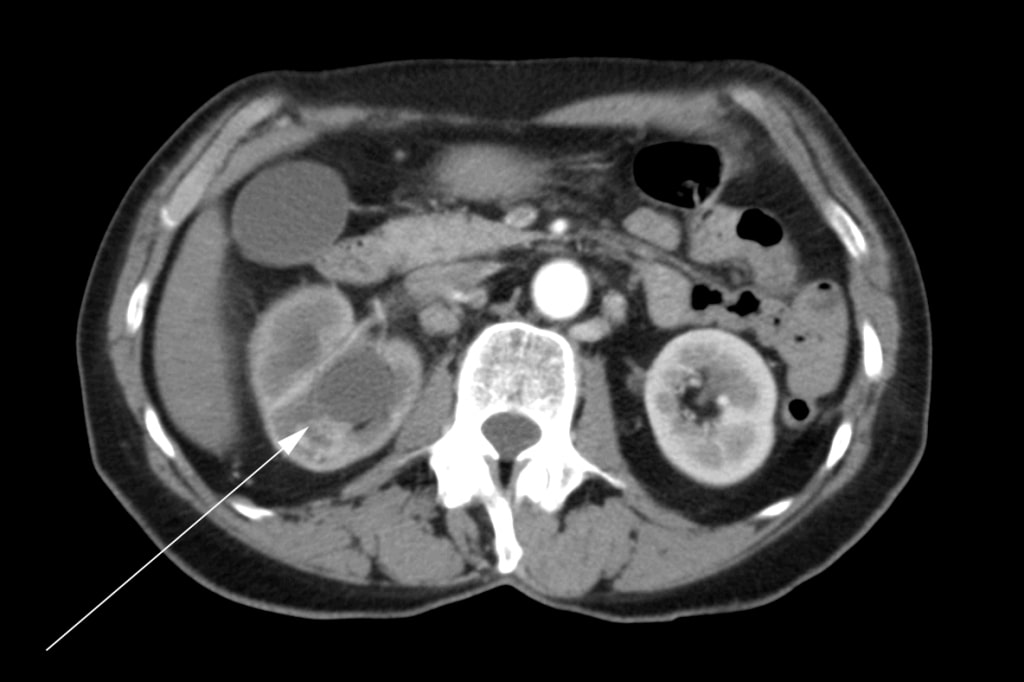
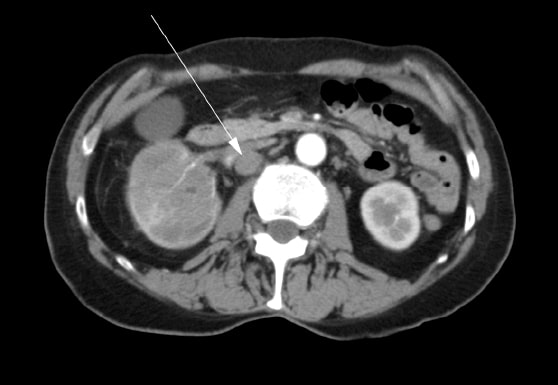
De patiënt onderging een rechter radicale nefrectomie in mei 2007. In het operatieverslag werd opgemerkt dat een volledige excisie niet mogelijk was. De nierader was betrokken en deze kon niet volledig worden vrijgemaakt van de tumor. Meerdere pathologische lymfeklieren die zich uitstrekten tot aan de vena cava werden ten tijde van de operatie gevisualiseerd, maar niet verwijderd. Een intraoperatieve biopsie van een van de lymfeklieren werd uitgevoerd. Definitieve histopathologie bevestigde de diagnose van nier squameus celcarcinoom met positieve chirurgische marges en lymfekliermetastasen. Postoperatief werd de patiënte doorverwezen voor radiotherapie. Zij kreeg van augustus tot september 2007 een bestralingskuur met palliatieve intentie in het para-aortale gebied van de buik met 4500cGy in 25 fracties over 5 weken. Medische oncologie werd geraadpleegd en zij kreeg geen behandeling met chemotherapie aangeboden.
De patiënte hoorde via de lokale media over het kankeronderzoek met DCA, en besloot de optie van DCA als lopende behandeling te onderzoeken, gezien haar slechte prognose. Ze bezocht de kliniek van de auteur voor een consultatie van de DCA-therapie.
Bij het eerste bezoek aan de kliniek werd haar volledige geschiedenis doorgenomen. Het onderzoek toonde een gezond uitziende vrouw met normale vitale functies en geen significante lichamelijke bevindingen. De eerste bloedtesten waren over het algemeen goed. De enige afwijkingen waren een lichte verhoging van het ureum met 7,4 (normaal 3,0 – 7,1 mmol/L), en een laag lymfocytengetal van 0,6 (normaal 1,2 – 3,4 x109/L). Dit was niet verontrustend omdat een lichte verhoging van ureum of creatinine te verwachten is bij een patiënt na een nefrectomie.
DCA-behandeling
De risico’s en voordelen van DCA werden besproken en de patiënte stemde in met DCA-behandeling, die binnen 3 weken na de laatste fractie palliatieve radiotherapie werd gestart. De patiënt werd gestart met DCA 500 mg oraal, tweemaal per dag (18mg/kg/dag), in een cyclus van 2 weken op / 1 week af. De cyclische behandeling werd gekozen vanwege eerdere ervaringen van de auteur met een onaanvaardbaar niveau van bijwerkingen bij volwassen patiënten die continue DCA-dosering gebruikten. Ze kreeg benfotiamine (een in vet oplosbare vorm van vitamine B1) 80 mg oraal voorgeschreven, tweemaal daags, en R-alfaliponzuur 150 mg oraal, driemaal daags, om het risico van DCA-neuropathie te verminderen, aangezien beide natuurlijke verbindingen bewezen voordelen hebben bij de behandeling van neuropathie van andere etiologieën (Ziegler et al. 1999), (Winkler et al. 1999). Ze begon ook met 40 mg pantoprazol, eenmaal daags oraal, om maagklachten door DCA te voorkomen. Na de eerste cyclus van 3 weken werd de DCA verhoogd tot 500 mg driemaal daags oraal (27mg/kg/dag). De dosis werd stapsgewijs verhoogd om de verdraagbaarheid te waarborgen vanwege het verminderde metabolisme van DCA bij een gevorderde leeftijd van de patiënt (Shroads et al. 2008).
De patiënt voelde zich over het algemeen goed tijdens de eerste maand van de DCA-behandeling, met uitzondering van lichte vermoeidheid, die ook een bijwerking van de radiotherapie kan zijn geweest. Zelfs met de verhoogde dosis DCA na 3 weken werden geen problemen ervaren gedurende de tweede maand van de therapie. DCA werd tegen het einde van de derde maand gestopt vanwege nieuwe symptomen die wezen op perifere neuropathie.
Op het moment dat de DCA werd gestopt, maakte de patiënt een driefasige CT-scan die geen bewijs van restkanker liet zien. Na nog eens 6 maanden maakte de patiënt een CT-scan die opnieuw geen bewijs van kanker liet zien (figuur 3).
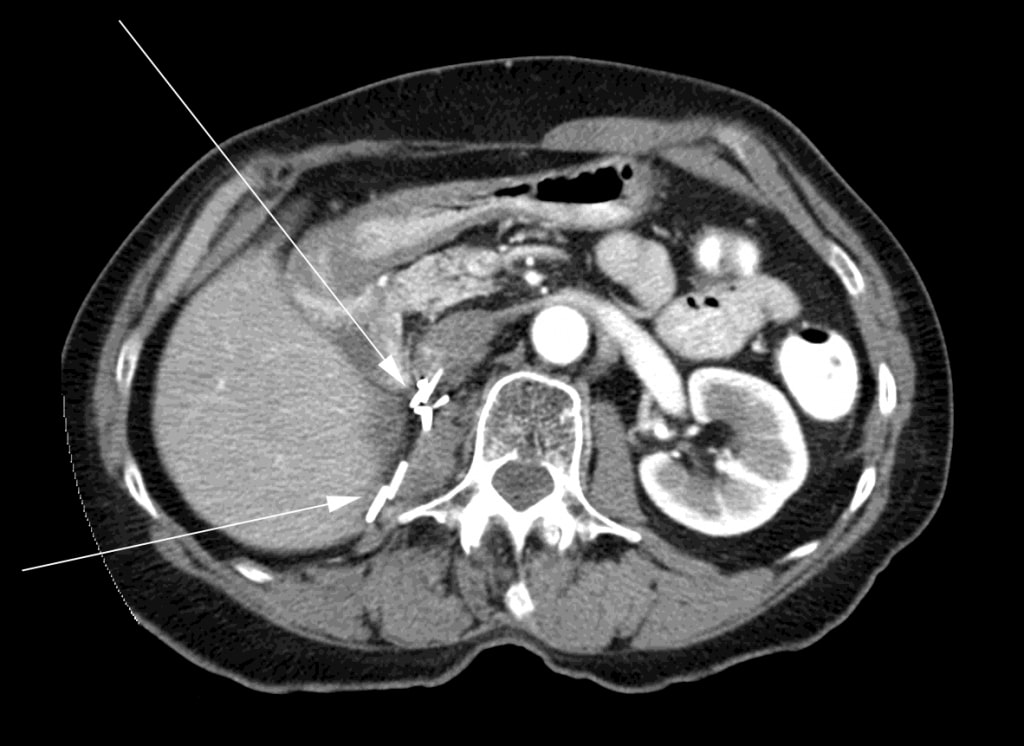
De patiënte bleef regelmatig gecontroleerd worden in de oncologische kliniek van haar plaatselijke ziekenhuis met routine CT-scans om de 6 maanden. De laatste CT-scan van oktober 2011 toonde geen bewijs van recidief mRSCC. Een vervolgbezoek aan de radioloog in december 2011 bevestigde de afwezigheid van een recidief. Lichamelijk onderzoek was normaal en haar prestatiestatus was ECOG-niveau 0. In september 2011 was het 4 jaar na bestraling en start van de DCA-behandeling, en in december 2011 was het 4 jaar na voltooiing van 3 maanden DCA-therapie. Vanaf september 2012, 5 jaar na de start van de DCA-therapie, is de patiënte nog steeds asymptomatisch. Ze kreeg geen andere kankerbehandeling gedurende deze periode (inclusief DCA) aangezien er nooit aanwijzingen waren voor een terugkeer van de ziekte.
Bespreking
Wij menen dat dit het eerste gepubliceerde geval is van langdurige volledige remissie (en waarschijnlijke genezing) van mRSCC. Er is slechts één vergelijkbaar geval van 5 jaar volledige remissie van RSCC in de Medline-geïndexeerde literatuur van 50 jaar geleden, maar die patiënt had geen metastatische ziekte. Ons geval verdient bijzondere aandacht omdat mRSCC zeer agressief is met een mediane overleving van enkele maanden met alle beschikbare conventionele therapie.
Radiotherapie alleen biedt weinig overlevingsvoordeel voor mRSCC (Holmang et al. 2007). De verlengde behandelingsduur van 5 weken van palliatieve radiotherapie in dit geval vermindert de kans op genezing (die gezien het type kanker in eerste instantie onwaarschijnlijk is) nog verder door de verminderde celdoding via een proces dat “versnelde repopulatie” wordt genoemd. Herbevolking wordt gedefinieerd als het vermogen van cellen in een weefsel om zich na een bestralingsdosis aan te vullen. Repopulatie neemt toe naarmate de totale behandelingstijd voor het toedienen van een stralingsdosis tijdens een cursus gefractioneerde radiotherapie langer wordt. Dit effect vermindert de schade aan gezond weefsel, maar vermindert ook het doden van kankercellen – in overeenstemming met het doel van palliatie. Repopulatie is het meest uitgesproken bij een totale bestralingstijd van 4-6 weken en langer, en deze patiënte kreeg haar gefractioneerde radiotherapie over 5 weken (Abeloff 21 mei 2008) .
Zoals eerder opgemerkt heeft DCA synergisme met radiotherapie bij prostaatkanker. De ervaring van de auteur met de behandeling van patiënten met DCA suggereert dat het synergisme met radiotherapie kan optreden bij diverse andere soorten kanker dan prostaatkanker. Voorbeelden zijn: een 53-jarige vrouw met een 3-jarige volledige remissie van Bartholins kliercarcinoom, behandeld met bestraling en adjuvant DCA, en een 32-jarige vrouw met een 3-jarige volledige remissie van anaplastisch astrocytoom na chemoradiatie met adjuvant DCA (casussen in voorbereiding voor publicatie).
In dit geval van mRSCC leidde het adjuvante gebruik van DCA na een bestralingskuur tot een verrassende volledige remissie, zonder schadelijke bijwerkingen afgezien van omkeerbare perifere neuropathie. Bij deze patiënt hebben de profylactische benfotiamine en R-alfa liponzuur de ontwikkeling van perifere neuropathie door DCA niet verhinderd. De auteur voegt nu acetyl-Lcarnitine toe aan de DCA neuropathiepreventie, omdat het ook bewezen voordelen heeft bij de behandeling van neuropathie van andere etiologieën, zoals diabetische, chemo-geïnduceerde en antiretrovirale neuropathie (Herzmann et al. 2005), (Quatraro et al. 1995), (De Grandis en Minardi 2002), (Bianchi et al. 2005).
Momenteel zijn er geen actieve klinische studies die de rol van DCA in combinatie met radiotherapie alleen onderzoeken. Eén studie onderzoekt momenteel DCA in combinatie met chemotherapie en bestraling voor hoofd-hals carcinoom (Clinicaltrials.gov 2012). Door de niet-merkgebonden status van DCA is het voor onderzoekers moeilijk geweest om fondsen te werven om dure humane studies uit te voeren. Het is onze hoop dat de publicatie van duidelijke gevallen die de voordelen van DCA als adjuvans voor traditionele kankertherapieën illustreren, onderzoekers zal motiveren om creatieve nieuwe fondsenwervingsmechanismen te vinden zodat DCA formeel kan worden onderzocht in verdere humane studies. Wij hopen dat DCA daardoor breder geaccepteerd zal worden in de oncologische gemeenschap, en gebruikt zal worden ten voordele van patiënten met een ongeneeslijke maligniteit.
Aangezien het vele jaren kan duren voordat klinische proeven op mensen zijn afgerond, geloven wij dat het in de tussentijd ethisch verantwoord is om DCA voorzichtig “off-label” voor te schrijven in combinatie met of na palliatieve radiotherapie, voor patiënten die de risico’s en voordelen volledig begrijpen en aanvaarden. DCA kan een verdere rol spelen als een nieuwe therapeutische benadering in combinatie met radiotherapie voor radioresistente niet-metastatische kankers, maar dit moet nog worden opgehelderd.
Erkenning
De auteur wil Dr. Humaira Khan en Dr. Isaac Eliaz bedanken voor hun hulp bij de voorbereiding van dit verslag, en ook de patiënte voor haar toestemming om haar geval te publiceren.
Verklaring van de auteur
De auteur schrijft medicijnen voor de behandeling van kanker voor (waaronder dichlooracetaat) die tegen betaling worden verstrekt door Medicor Kankercentra. Deze kliniek is eigendom van een familielid van de auteur.
REFERENTIES
1 Abeloff, M. D., Armitage, J. O., Niederhuber, J. E., Kastan, M. B. & McKenna, W. G. (21 mei 2008). Abeloff’s Clinical Oncology, 4th Edition, Chapter: Biologische effecten van straling.2 Bhaijee, F. (2012). “Squamous Cell Carcinoma of the Renal Pelvis,” Ann Diagn Pathol, 16(2), 124-7.
3 Bhandari, A., Alassi, O., Rogers, C. & MacLennan, G. T. (2010). “Squamous Cell Carcinoma of the Renal Pelvis,” J Urol, 183(5), 2023-4.
4 Bianchi, G., Vitali, G., Caraceni, A., Ravaglia, S., Capri, G., Cundari, S., Zanna, C. & Gianni, L. (2005). “Symptomatic and Neurophysiological Responses of Paclitaxel- or Cisplatin-Induced Neuropathy to Oral Acetyl-L-Carnitine,” Eur J Cancer, 41(12), 1746-50.
5 Bonnet, S., Archer, S. L., Allalunis-Turner, J., Haromy, A., Beaulieu, C., Thompson, R., Lee, C. T., Lopaschuk, G. D., Puttagunta, L., Bonnet, S., Harry, G., Hashimoto, K., Porter, C. J., Andrade, M. A., Thebaud, B. & Michelakis, E. D. (2007). “A Mitochondria- K+ Channel Axis Is Suppressed in Cancer and Its Normalization Promotes Apoptosis and Inhibits Cancer Growth,” Cancer Cell, 11(1), 37-51.
6 Brandsma, D., Dorlo, T. P. C., Haanen, J. H., Beijnen, J. H. & Boogerd, W. (2010). “Severe Encephalopathy and Polyneuropathy Induced by Dichloroacetate,” J Neurol, 257(12), 2099-100.
7 Cao, W., Yacoub, S., Shiverick, K. T., Namiki, K., Sakai, Y., Porvasnik, S., Urbanek, C. & Rosser, C. J. (2008). “Dichloroacetate (DCA) Sensitizes Both Wild-Type and Over Expressing Bcl-2 Prostate Cancer Cells in Vitro to Radiation,” Prostate, 68(11), 1223- 31.
8 Carlson, H. E. (1960). “Squamous Cell Carcinoma of the Renal Pelvis: A Five Year Cure,” J Urol, 83, 813-4.
9 Clinicaltrials.Gov (2012). [Online], Available: http://clinicaltrials.gov/ct2/results?term= dichloroacetate+radiotherapy [accessed sept 1, 2012].
10 De Grandis, D. & Minardi, C. (2002). “Acetyl-L-Carnitine (Levacecarnine) in de behandeling van diabetische neuropathie. A LongTerm, Randomised, Double-Blind, Placebo-Controlled Study,” Drugs R D, 3(4), 223-31.
11 Di Battista, L., Stio, F., Guarino, S., Galani, A., Maturo, A., Dimko, M., Mancini, M. & Gallo, P. (2012). “Squamous Cell Carcinoma of the Renal Pelvis with Stones and Inferior Vena Cava Infiltration. Case Report,” G Chir, 33(5), 182-5.
12 Fiebiger, W., Olszewski, U., Ulsperger, E., Geissler, K. & Hamilton, G. (2011). “In Vitro Cytotoxicity of Novel Platinum-Based Drugs and Dichloroacetate against Lung Carcinoid Cell Lines,” Clin Transl Oncol, 13(1), 43-9.
13 Herzmann, C., Johnson, M. A. & Youle, M. (2005). “Long-Term Effect of Acetyl-LCarnitine for Antiretroviral Toxic Neuropathy,” HIV Clin Trials, 6(6), 344-50.
14 Holmang, S., Lele, S. M. & Johansson, S. L. (2007). “Plaveiselcelcarcinoom van het nierbekken en de urineleider: Incidence, Symptoms, Treatment and Outcome,” J Urol, 178(1), 51-6.
15 Kaufmann, P., Engelstad, K., Wei, Y., Jhung, S., Sano, M. C., Shungu, D. C., Millar, W. S., Hong, X., Gooch, C. L., Mao, X., Pascual, J. M., Hirano, M., Stacpoole, P. W., Dimauro, S. & De Vivo, D. C. (2006). “Dichloroacetate Causes Toxic Neuropathy in MELAS: A Randomized, Controlled Clinical Trial,” Neurology, 66(3), 324-30.
16 Kimura, T., Kiyota, H., Asano, K., Madarame, J., Yoshino, Y., Miki, K., Abe, K., Hasegawa, T. & Ohishi, Y. (2000). “Squamous Cell Carcinoma of the Renal Pelvis with Inferior Vena Caval Extension,” Int J Urol, 7(8), 316- 9; Discussion 320.
17 Lee, T. Y., Ko, S. F., Wan, Y. L., Cheng, Y. F., Yang, B. Y., Huang, D. L., Hsieh, H. H., Yu, T. J. & Chen, W. J. (1998). “Renal Squamous Cell Carcinoma: CT Findings and Clinical Significance,” Abdom Imaging, 23(2), 203-8.
18 Li, M. K. & Cheung, W. L. (1987). “Squamous Cell Carcinoma of the Renal Pelvis,” J Urol, 138(2), 269-71.
19 Medicor (DCA Data 2009) [online], Available: www.medicorcancer.com/DCAdata.html [accessed Oct 1, 2012]. Medline (RSCC 2012) [online], Beschikbaar: http://www.ncbi.nlm.nih.gov/pubmed, Zoekcriteria: Renal [title] oR kidney [Title] en (“Squamous Cell Carcinoma”[Title]) [Accessed Oct 1, 2012].
20 Michelakis, E. D., Sutendra, G., Dromparis, P., Webster, L., Haromy, A., Niven, E., Maguire, C., Gammer, T. L., Mackey, J. R., Fulton, D., Abdulkarim, B., McMurtry, M. S. & Petruk, K. C. (2010). “Metabolic Modulation of Glioblastoma with Dichloroacetate,” Sci Transl Med, 2(31), 31ra34.
21 Quatraro, A., Roca, P., Donzella, C., Acampora, R., Marfella, R. & Giugliano, D. (1995). “Acetyl-L-Carnitine for Symptomatic Diabetic Neuropathy,” Diabetologia, 38(1), 123.
22 Saed, G. M., Fletcher, N. M., Jiang, Z. L., AbuSoud, H. M. & Diamond, M. P. (2011). “Dichloroacetate Induces Apoptosis of Epithelial Ovarian Cancer Cells Through a Mechanism Involving Modulation of Oxidative Stress,” Reprod Sci, 18(12), 1253- 61.
23 Shroads, A. L., Guo, X., Dixit, V., Liu, H. P., James, M. O. & Stacpoole, P. W. (2008). “Age-Dependent Kinetics and Metabolism of Dichloroacetate: Possible Relevance to Toxicity,” J Pharmacol Exp Ther, 324(3), 1163-71.
24 Stacpoole, P. W., Gilbert, L. R., Neiberger, R. E., Carney, P. R., Valenstein, E., Theriaque, D. W. & Shuster, J. J. (2008). “Evaluation of Long-Term Treatment of Children with Congenital Lactic Acidosis with Dichloroacetate,” Pediatrics, 121(5), E1223-8.
25 Stacpoole, P. W., Kerr, D. S., Barnes, C., Bunch, S. T., Carney, P. R., Fennell, E. M., Felitsyn, N. M., Gilmore, R. L., Greer, M., Henderson, G. N., Hutson, A. D., Neiberger, R. E., O’Brien, R. G., Perkins, L. A., Quisling, R. G., Shroads, A. L., Shuster, J. J., Silverstein, J. H., Theriaque, D. W. & Valenstein, E. (2006). “Controlled Clinical Trial of Dichloroacetate for Treatment of Congenital Lactic Acidosis in Children,” Pediatrics, 117(5), 1519-31.
26 Stacpoole, P. W., Lorenz, A. C., Thomas, R. G. & Harman, E. M. (1988). “Dichloroacetate in the Treatment of Lactic Acidosis,” Ann Intern Med, 108(1), 58-63.
27 Stacpoole, P. W., Wright, E. C., Baumgartner, T. G., Bersin, R. M., Buchalter, S., Curry, S. H., Duncan, C. A., Harman, E. M., Henderson, G. N., Jenkinson, S. & Et Al. (1992). “A Controlled Clinical Trial of Dichloroacetate for Treatment of Lactic Acidosis in Adults. The Dichloroacetate-Lactic Acidosis Study Group,” N Engl J Med, 327(22), 1564-9.
28 Tong, J., Xie, G., He, J., Li, J., Pan, F. & Liang, H. (2011). “Synergistic Antitumor Effect of Dichloroacetate in Combination with 5- Fluorouracil in Colorectal Cancer,” J Biomed Biotechnol, 2011, 740564.
29 Vella, S., Conti, M., Tasso, R., Cancedda, R. & Pagano, A. (2012). “Dichloroacetate Inhibits Neuroblastoma Growth by Specific Acting Against Malignant Undifferentiated Cells,” Int J Cancer, 130(7), 1484-93.
30 Winkler, G., Pal, B., Nagybeganyi, E., Ory, I., Porochnavec, M. & Kempler, P. (1999). “Effectiveness of Different Benfotiamine Dosimens in the Treatment of Painful Diabetic Neuropathy,” Arzneimittelforschung, 49(3), 220-4.
31 Wong, J. Y. Y., Huggins, G. S., Debidda, M., Munshi, N. C. & De Vivo, I. (2008). “Dichloroacetate Induces Apoptosis in Endometrial Cancer Cells,” Gynecol Oncol, 109(3), 394-402.
32 Xie, J., Wang, B. S., Yu, D. H., Lu, Q., Ma, J., Qi, H., Fang, C. & Chen, H. Z. (2011). “Dichloroacetate Shifts the Metabolism from Glycolysis to Glucose Oxidation and Exhibits Synergistic Growth Inhibition with Cisplatin in Hela Cells,” Int J Oncol, 38(2), 409-17.
33 Xu, R. H., Pelicano, H., Zhou, Y., Carew, J. S., Feng, L., Bhalla, K. N., Keating, M. J. & Huang, P. (2005). “Inhibitie van glycolyse in kankercellen: A Novel Strategy to Overcome Drug Resistance Associated with Mitochondrial Respiratory Defect and Hypoxia,” Cancer Res, 65(2), 613-21.
34 Ziegler, D., Hanefeld, M., Ruhnau, K. J., Hasche, H., Lobisch, M., Schutte, K., Kerum, G. & Malessa, R. (1999). “Treatment of Symptomatic Diabetic Polyneuropathy with the Antioxidant Alpha-Lipoic Acid: A 7-Maand Multicenter Randomized Controlled Trial (ALADIN III Study). ALADIN III Studiegroep. Alpha-Lipoic Acid in Diabetic Neuropathy,” Diabetes Care, 22(8), 1296-301.