Margaret O James*,1 & Peter W Stacpoole2,3
1 Afdeling Medicinale Chemie, Universiteit van Florida, Gainesville, FL 32610-0485, USA
2 Afdeling Geneeskunde, College of Medicine, Universiteit van Florida, Gainesville, FL 32610-0485, USA
3 Afdeling Biochemie & Moleculaire Biologie, Universiteit van Florida, Gainesville, FL 32610-0485, USA
Correspondentie: Tel: +1 352 273 7707 Email: [email protected]
Ingediend: 16 december 2015
Aanvaard: 17 februari 2016
Gepubliceerd: 4 mei 2016
Abstract
Het onderzoeksgeneesmiddel dichlooracetaat (DCA) is een stofwisselingsregelaar die met succes is gebruikt om verworven en aangeboren stofwisselingsziekten en, recentelijk, vaste tumoren te behandelen. Het klinisch gebruik ervan heeft uitdagingen aan het licht gebracht bij het kiezen van de juiste doses. Chronische toediening van DCA leidt tot remming van het DCA-metabolisme en mogelijke accumulatie tot niveaus die leiden tot bijwerkingen. Dit komt doordat de omzetting van DCA in glyoxylaat wordt gekatalyseerd door één enzym, glutathiontransferase zeta 1 (GSTZ1-1), dat door DCA wordt geïnactiveerd. SNP’s in het GSTZ1-gen leiden tot expressie van polymorfe varianten van het enzym die verschillen in activiteit en snelheid van inactivering door DCA onder fysiologische omstandigheden: deze eigenschappen leiden tot aanzienlijke variatie tussen mensen in de farmacokinetiek van DCA.
Trefwoorden: dichlooracetaat; GSTZ1; farmacogenetica
Klinisch gebruik van dichlooracetaat
Voor zo’n eenvoudige molecule heeft DCA een opmerkelijk rijke en diverse farmacologische portefeuille, die bijna een eeuw oud is [1,2]. Het moderne gebruik ervan als onderzoeksgeneesmiddel begon echter in 1970, toen het selectieve vermogen ervan om de bloedglucosespiegel bij diabetici, maar niet bij niet-diabetici, te verlagen werd ontdekt [3] en vervolgens bij de mens werd bevestigd [4]. In de jaren zeventig en tachtig werden vele metabolische eigenschappen van DCA met betrekking tot het glucose- en vetmetabolisme vastgesteld. De meeste farmacologische effecten zijn echter terug te brengen tot enkele basisgebieden en werkingsmechanismen. Ten eerste is DCA een niet-competitieve remmer van het endoplasmatisch reticulumenzym HMG CoA-reductase, dat de snelheidsbeperkende stap in de cholesterolbiosynthese katalyseert. De remmende werking van DCA wordt zowel in de lever van knaagdieren [5] als in menselijke leukocyten [6] waargenomen; dit verklaart waarschijnlijk de met het geneesmiddel samenhangende verlaging van het totale cholesterolgehalte en van het lipoproteïnegehalte met lage dichtheid (LDL) bij patiënten met LDL-receptornegatieve homozygote familiaire hypercholesterolemie [7] en de aanwijzing als eerste weesgeneesmiddel voor deze zeldzame ziekte. Ten tweede remt DCA de novo hepatische triglyceridensynthese bij niet-diabetische knaagdieren [5] en verlaagt het de circulerende triglyceride- en lipoproteïnespiegels met zeer lage dichtheid bij patiënten met diabetes mellitus type 2 [4]. Het vermindert ook de ketonlichamen in het bloed bij ratten met experimenteel geïnduceerde diabetische ketoacidose [8,9]. De precieze mechanismen die ten grondslag liggen aan deze effecten op de vetsynthese en -oxidatie zijn onbekend. Ten derde stimuleert DCA de mitochondriale PDC, die pyruvaat onomkeerbaar oxideert tot acetyl co-enzym A (acetyl CoA) [10], een eigenschap die wordt gedeeld door bepaalde andere gehalogeneerde korte keten vetzuren [11]. Het is het vermogen van DCA om de PDC-activiteit te wijzigen dat verreweg het grootste experimentele en klinische onderzoek naar deze ongewone molecule heeft gegenereerd.
PDC wordt post-translationeel geregeld, voornamelijk door omkeerbare fosforylering van één of meer van drie serineresten op de E1α-subeenheid van het eerste enzym PDH van PDC, dat pyruvaat decarboxyleert [12]. Vier PDH-kinasen (PDK1-4) en twee PDH-fosfatasen (PDP 1 en 2) voeren dit regulerende aspect van PDC bij de mens uit, waarbij het gefosforyleerde enzym katalytisch inactief is. PDK’s komen verschillend tot expressie in weefsels, hoewel PDK2 alom aanwezig is [13]. Pyruvaat, het substraat voor de PDC-reactie, remt PDK’s door binding aan een kleine pocket in de N-terminus van het kinase, wat leidt tot stimulatie van de PDC-activiteit. Daarentegen leidt accumulatie van de reactieproducten, acetyl CoA en NADH, tot activering van de PDK en remming van de PDC. DCA, een structureel analoog van pyruvaat, hecht zich ook aan de pyruvaat-bindingsplaats, wat leidt tot remming van PDK’s met als volgorde PDK2>PDK1˜PDK4>>PDK3 [13]. Chronische blootstelling aan geneesmiddelen in vitro [14,15] en in vivo [16] kan PDC stabiliseren en de omzet ervan verminderen, wat een tweede mechanisme is waardoor DCA de activiteit van het complex verhoogt en een verklaring biedt voor de langdurige farmacologische effecten ervan na intrekking van de drug [4].
Hoewel DCA een relatief zwakke PDK-remmer is (Ki 0,2 mM voor PDK2), zijn de effecten op aspecten van het intermediaire metabolisme diepgaand en houden rechtstreeks verband met de centrale rol die de PDC speelt bij de regulering van de brandstofselectie en de bio-energetica van eukaryotische cellen [17,18]. DCA is nog geen door de Amerikaanse FDA goedgekeurd onderzoeksgeneesmiddel. Het wordt echter nog steeds uitgebreid onderzocht als metabole modulator voor verschillende aangeboren en verworven stofwisselingsstoornissen, op basis van zijn stimulerende werking op de PDC (tabel 1).
| Eigenschap | Mechanisme | Ref. |
|---|---|---|
| Verhoogd OXPHOS en bio-energetica | ↓ PDK ↑ PDC | [2,10] |
| Verlaagde bloedglucose bij vasten of diabetes | ↓ PDK ↑ PDC | [4] |
| Verlaagd lactaat in bloed en liquor | ↓ PDK ↑ PDC | [19] |
| Verlaagd bloed totaal en LDL cholesterol | ↓ HMG CoA reductase → ↓ cholesterolsynthese | [6,7] |
| Verlaagde triglyceriden en VLDL-cholesterol in het bloed | ↓ hepatische TG synthese → ↓ VLDL synthese | [4] |
| Omkering van Warburg effect bij kanker, PAH en andere proliferatieve aandoeningen | ↓ PDK ↑ PDC | [20] |
CSF: Cerebrospinaal vocht; HMG CoA: Hydroxymethylglutaryl co-enzym A; LDL: lipoproteïne met lage dichtheid; OXPHOS: Oxidatieve fosforylering; PAH: Pulmonale arteriële hypertensie; PDC: Pyruvaat dehydrogenase complex; PDK: Pyruvaat dehydrogenase kinase; TG: Triglyceride; VLDL: Very low-density lipoprotein.
Farmacokinetiek & klaring
Oraal DCA wordt snel geabsorbeerd en heeft een biologische beschikbaarheid die de eenheid benadert na zowel orale als parenterale toediening [21,22]. Het geneesmiddel kan binnen 15 minuten na een orale dosis van 50 mg/kg in het plasma van mensen worden gedetecteerd. Bij voorheen naïeve proefpersonen heeft oraal of intraveneus DCA een plasmahalfwaardetijd van ongeveer 1 uur [23]. De snelheid van het metabolisme bij gezonde soorten is: muis>rat>mens≥hond [22-25].
Vroege farmacokinetische onderzoeken van een eenmalige dosis intraveneus DCA beschreven een niet-lineaire kinetiek bij doses ≥35 mg/kg [26]. Later bleek dat de plasmaklaring afnam bij herhaalde intraveneuze toediening van 50 mg/kg lichaamsgewicht bij ernstig zieke volwassenen met melkziekte [27,28]. Vertraagde plasmaklaring van het geneesmiddel dat oraal werd toegediend bij een dosis van 50 mg/kg werd ook waargenomen bij gezonde volwassenen, die weken tot maanden nodig hadden voordat de oorspronkelijke klaringssnelheid werd bereikt bij een tweede dosis [22].
Belangrijke vooruitgang in het begrijpen van dit ongewone kenmerk van de farmacokinetiek van DCA kwam voort uit bewijzend onderzoek naar de klinische toxicologie ervan. Chronische DCA kan een reversibele perifere neuropathie veroorzaken bij alle diersoorten [21,23], een effect dat 25 jaar geleden voor het eerst klinisch werd waargenomen bij een 16-jarige jongen die 50 mg/kg/dag kreeg gedurende ongeveer 4 maanden [7]. In een gerandomiseerd, gecontroleerd onderzoek (RCT) met 43 jonge kinderen met verschillende soorten primaire mitochondriale ziekten (gemiddelde leeftijd bij binnenkomst: 5,6 jaar) werd DCA oraal toegediend in een dosis van 12,5 mg/kg om de 12 uur gedurende 6 maanden daarentegen goed verdragen en veroorzaakte het geen nadelige veranderingen in de elektrische geleiding van de perifere zenuw, vergeleken met placebo [29], hoewel enige asymptomatische achteruitgang in de zenuwgeleiding werd gevonden bij langere blootstelling aan het geneesmiddel [30]. Daarentegen werd een RCT van 30 oudere adolescenten en volwassenen (gemiddelde leeftijd bij binnenkomst: 30 jaar) met een genetische mitochondriale ziekte, die werden blootgesteld aan de identieke dosis en het identieke doseringsschema van DCA als in de pediatrische studie, voortijdig gestopt vanwege verergering of nieuw begin van perifere neuropathie [31], een veel voorkomende complicatie van mitochondriale ziekten [32,33]. Toen de kinetiek van DCA in deze twee patiëntenpopulaties werd vergeleken, werd ontdekt dat de plasmaklaring van chronische DCA duidelijk langzamer was in de oudere groep [34], een bevinding die werd bevestigd in studies met ratten [34,35]. Deze bevindingen gaven aanleiding tot studies naar de enzymatische biotransformatie van DCA.
Belang van glutathiontransferase zeta 1 in de biotransformatie van DCA
Kleine carboxylzuren worden vaak geglucuronideerd [36] of omgezet in hun co-enzym A-derivaten en vervolgens in aminozuurconjugaten [37], maar er zijn geen aanwijzingen dat DCA een glucuronide, een co-enzym A-derivaat of een aminozuurconjugaat vormt [2, James MO, ongepubliceerde gegevens]. In plaats daarvan is DCA een substraat voor een ongebruikelijk GST-enzym, GSTZ1-1, dat het omzet in glyoxylaat in een reactie die glutathion (GSH) vereist maar niet verbruikt [38,39]. Net als andere GST’s is GSTZ1-1 actief in de dimere vorm, en het actieve enzym is een homodimeer. Dechlorering van DCA tot glyoxylaat, gekatalyseerd door GSTZ1-1, is de enige route van primair metabolisme van DCA die in de lever is waargenomen [35]. GSTZ1-1, ook bekend als MAAI, katalyseert niet alleen het DCA-metabolisme, maar heeft ook een belangrijke fysiologische functie in het katabolisme van tyrosine, waar het maleylacetoacetaat (MAA) en maleylaceton (MA) isomeriseert tot fumarylacetoacetaat en fumarylaceton in reacties die GSH vereisen maar niet verbruiken (figuur 1) [40,41]. Biotransformatie van DCA tot glyoxylaat beëindigt zijn farmacologisch en therapeutisch belangrijke activiteiten die hierboven zijn besproken; de activiteit van GSTZ1-1 regelt dus de werkingsduur van DCA.
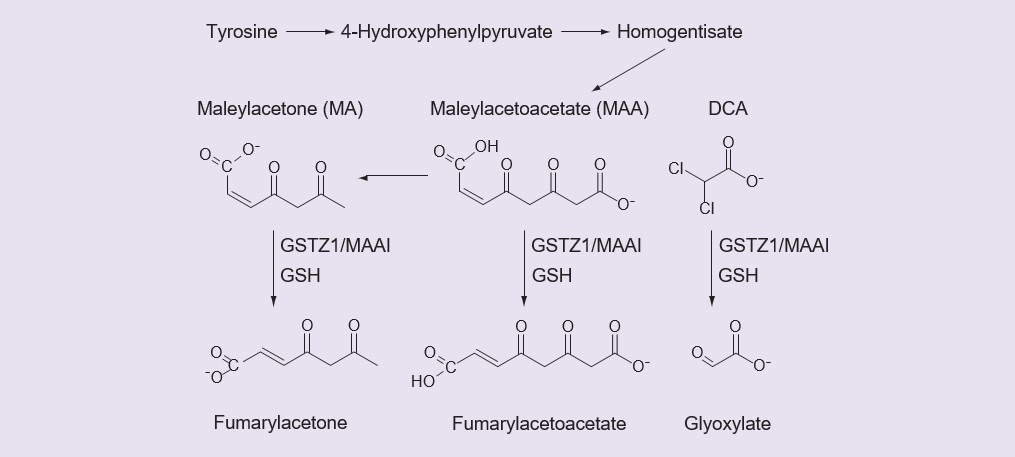
De inactieve metaboliet DCA, glyoxylaat, wordt verder gemetaboliseerd tot kooldioxide, glycine en oxalaat. Fumarylaceton en fumarylacetoacetaat worden verder gemetaboliseerd door fumarylacetoacetaat hydrolase. DCA: Dichlooracetaat: GSH: Glutathion; MA: Maleylaceton; MMA: Maleyacetoacetaat.
De lever is de belangrijkste plaats waar GSTZ1-1 tot expressie komt, waar het zowel in het cytosol als in de mitochondriale matrix wordt aangetroffen [38,42]. Dierstudies hebben zeer lage niveaus van GSTZ1-1 expressie aangetoond in de nieren, het hart, het maagdarmkanaal en de hersenen [43]. De rol van extrahepatische weefsels in het DCA-metabolisme bij mensen is niet in detail onderzocht, maar één studie toonde aan dat DCA niet uit het bloed werd geklaard tijdens de anhepatische fase van levertransplantatiepatiënten die DCA kregen toegediend om melkzuurgasvorming tegen te gaan, wat aangeeft dat er geen metabolisme plaatsvond [44]. De anhepatische fase was van korte duur (gemiddeld 73 minuten), dus de gegevens waren beperkt, maar deze studie suggereert een kleine rol van andere weefsels dan de lever in de eliminatie van DCA, althans voor een enkele dosis.
Inhibitie van GSTZ1-1 door DCA
Studies met dieren en met tot expressie gebrachte menselijke GSTZ1-1 eiwitten hebben aangetoond dat de reden dat meervoudige doses DCA veel langzamer worden geëlimineerd dan een enkele dosis, is dat DCA een op het mechanisme gebaseerde remmer van GSTZ1-1
[25,34,45-47]. Tijdens de biotransformatie van DCA worden adducten aan het GSTZ1-1 eiwit gevormd die het eiwit inactiveren en vermoedelijk de proteolyse in gang zetten [48,49]. Toediening van DCA aan ratten leidt tot verlies van activiteit en expressie van GSTZ1-1 op een dosis- en tijdsafhankelijke manier: het verlies van de GSTZ1-1 functie was meer uitgesproken en hield langer aan bij volwassen ratten dan bij jonge ratten [34,35]. Dit effect van leeftijd op het verlies van de GSTZ1-1 functie na toediening van DCA werd waargenomen bij mensen, waarbij kinderen een kleinere toename van de plasmahalfwaardetijd en een geringere afname van de klaring vertoonden dan volwassenen [34]. Verlies van GSTZ1-1 (MAAI) beïnvloedt niet alleen de farmacokinetiek van DCA, maar leidt ook tot accumulatie van de fysiologische substraten MA en, vermoedelijk, MAA, die beide reactieve moleculen zijn die adducten kunnen vormen met cellulaire macromoleculen [34,45]. Remming van MAAI leidt ook tot afleiding van tyrosinekoolstof naar de vorming van succinylaceton. Deze molecule remt een proximale stap in de heemsynthese, waardoor accumulatie van de reactieve molecule δ-aminolevulinaat (δ-ALA) optreedt. Zowel MA als δ-ALA nemen toe in het bloed en/of de urine van mensen die chronisch aan DCA worden blootgesteld [34]: de klinische toxicologische betekenis van dit effect moet nog worden aangetoond.
Andere metabolieten van DCA
De enige andere bekende primaire metaboliet van DCA is monochloorazijnzuur (MCA), dat af en toe in sporen in het bloed is aangetroffen na toediening van DCA [34]. Het MCA lijkt te worden gevormd uit DCA in de rode bloedcellen [34]. Er zijn geen aanwijzingen voor de vorming van MCA uit DCA in de lever. Voor praktische doeleinden bepaalt de omzetting van DCA in glyoxylaat de farmacokinetiek van de eliminatie van DCA, dus kennis van de factoren die de snelheid en omvang van het GSTZ1-1-gekatalyseerde DCA-metabolisme bij mensen beïnvloeden is belangrijk voor een veilige en effectieve dosering van patiënten.
Relevant voor de effecten van DCA-behandeling is dat glyoxylaat verder kan worden gemetaboliseerd tot kooldioxide via een carboligase enzym, tot glycine door een of meer aminotransferase enzymen of kan worden geoxideerd tot oxalaat [35]. Bewijs voor alle drie de routes werd verkregen uit studies waarin ratten werden gedoseerd met DCA [35]. Van deze routes zou alleen de vorming van oxalaat schadelijk kunnen zijn voor een patiënt, maar bij de rat was de vorming van oxalaat een minder belangrijke route [35]. Kritiek zieke volwassen patiënten met lactose die werden behandeld met intraveneus DCA of placebo in een gerandomiseerd gecontroleerd klinisch onderzoek werden beoordeeld op oxalaatstenen en oxalaat-gerelateerde toxiciteit; er werden geen aanwijzingen gevonden voor verschillen tussen de DCA- en placebogroepen [50]. Ook orale toediening van DCA gedurende meerdere jaren in een onderzoek bij kinderen met congenitale vormen van melkzuursyndroom gaf geen aanwijzingen voor oxalaatstenen of toxiciteit [ 51].
Polymorfe varianten van GSTZ1
Vanaf het moment dat GSTZ1 (NM_145870) bij de mens werd ontdekt, werd vermoed dat het allelvarianten vertoonde [52]. Latere studies hebben SNP’s in de coderende en niet-coderende gebieden van het gen aan het licht gebracht. Wij leren nog steeds over de eventuele effecten van de meeste van deze SNPs op de expressie, stabiliteit en activiteit van GSTZ1 met DCA. Dit is een actief onderzoeksgebied, aangezien deze factoren de farmacokinetiek en uiteindelijk het veilige gebruik van DCA beïnvloeden. SNPs die leiden tot aminozuurveranderingen in het uitgedrukte eiwit hebben aandacht gekregen, evenals SNPs die de vertaling van GSTZ1 en uiteindelijk de expressieniveaus van het enzymeiwit lijken te beïnvloeden.
Varianten in de aminozuursequentie van het uitgedrukte enzymeiwit
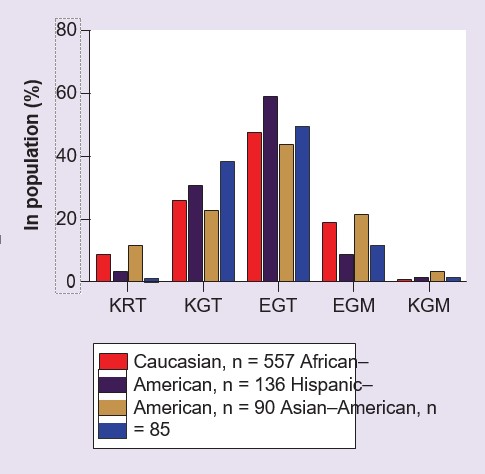
In de coderende regio van GSTZ1 zijn drie veel voorkomende SNP’s geïdentificeerd [53,54], die aanleiding geven tot vijf haplotypen (tabel 2). Deze vijf haplotypes komen bij mensen voor met verschillende frequenties, afhankelijk van de etniciteit (figuur 2), maar de meest frequent gevonden variant in alle tot nu toe bestudeerde populaties, aanwezig bij ongeveer 50% van de mensen, is GSTZ1C [54-56]. Dit haplotype wordt ook EGT genoemd, wat wijst op de afwijkende aminozuren op de posities 32, 42 en 82 in het enzymeiwit [54,55]. Momenteel is er relatief weinig informatie over de incidentie van de vijf gemeenschappelijke haplotypes in andere populaties dan Kaukasische. Uitgedrukte recombinante menselijke GSTZ1A-1A, 1B-1B, 1C-1C en 1D-1D eiwitten zijn bestudeerd met DCA als substraat, en het bleek dat GSTZ1A-1A (KRT/KRT) een hogere activiteit had dan de andere varianten [54,57]. GSTZ1F is een zeldzame variant (Tabel 2) en de eigenschappen van het recombinante eiwit zijn niet bestudeerd. Een individuele persoon kan homo- of heterozygoot zijn voor deze haplotypes. Voor heterozygoten is het niet bekend of één variant preferentieel tot expressie komt op eiwitniveau, maar levercytosolfracties bereid van individuen die de GSTZ1A-variant op één allel dragen, hebben een hogere in vitro activiteit met DCA dan die zonder dit allel [56], hetgeen de mogelijkheid van preferentiële expressie van het enzymeiwit van de KRT-variant suggereert.
E: Glutaminezuur; G: Glycine; K: Lysine: M: Metionine; T: Threonine.
| Variant | Nucleotide positie | Aminozuurpositie | Percentage in populatie (%)† | ||||
| 94 | 124 | 245 | 32 | 42 | 82 | ||
| GSTZ1A | A | A | C | Lys (K) | Arg (R) | Thr (T) | 1-10 |
| GSTZ1B | A | G | C | Lys (K) | Gly (G) | Thr (T) | 25-35 |
| GSTZ1C | G | G | C | Glu (E) | Gly (G) | Thr (T) | 45-55 |
| GSTZ1D | G | G | T | Glu (E) | Gly (G) | Met (M) | 10-20 |
| GSTZ1F | A | G | T | Lys (K) | Gly (G) | Met (M) | <1 |
De polymorfe varianten van GSTZ1-1 bij de mens en hun geschatte frequentie in de populatie.
†Deincidentie van elk haplotype verschilt per etnische groep, zie figuur 2 en [54-56].
Glu (E): Glutaminezuur; Gly (G): Glycine; Lys (K): Lysine: Met (M): Methionine; Thr (T): Threonine.
.
Studies met de tot expressie gebrachte recombinante menselijke GSTZ1A-1A, 1B-1B, 1C-1C en 1D-1D eiwitten onderzochten ook de activiteit met het fysiologisch belangrijke substraat, MA [54]. De snelheid van het MA-metabolisme vertoonde een ander patroon dan de activiteiten gemeten met DCA als substraat, in die zin dat de GSTZ1C-1C (EGT/EGT) variant de hoogste activiteit met MA had en GSTZ1A-1A de laagste [54].
Naast de hierboven beschreven algemeen voorkomende varianten is er bewijs voor twee andere coderende sequentievarianten. Een daarvan werd gevonden in de expressed sequence tag database en kreeg de naam GSTZ1E [54], maar deze variant, met proline in plaats van leucine op positie 23, is niet bij mensen gevonden. Een andere variant werd gevonden in een vrijwilliger voor farmacokinetisch onderzoek van DCA. Deze persoon, die heterozygoot was voor KGT/KGM (1B/1F), elimineerde zelfs een enkele dosis DCA extreem langzaam; sequentiebepaling van het DNA van deze persoon onthulde een nieuwe SNP in exon vijf van GSTZ1, die resulteerde in methionine in plaats van valine op positie 99 van het eiwit [55]. Op basis van de kristalstructuur van GSTZ1B [58] bevindt positie 99 zich in een α-helicale bundel. Ondanks het zoeken naar deze variant in levermonsters die een lage activiteit met DCA vertoonden [56], zijn er nog geen andere personen met dit polymorfisme geïdentificeerd.
Polymorfismen in de promotorregio
In genomische DNA-monsters van Afrikaanse en Australische Europese proefpersonen werden tien SNP’s gevonden in een regio die 1500 nucleotiden stroomopwaarts van de transcriptiestartplaats van GSTZ1 ligt, waarvan wordt aangenomen dat het de promotorregio van het gen
[59]. Twee van deze SNP’s, -1002G>A en -289C>T werden in verband gebracht met respectievelijk een afname en een toename van de promotoractiviteit, zoals beoordeeld in HepG2-cellen. Latere studies met DNA van levermonsters toonden aan dat bij Kaukasisch-Amerikanen maar niet bij Afro-Amerikanen het A-allel van SNP rs 7975, dat resulteerde in expressie van lysine in plaats van glutaminezuur op positie 32 van het eiwit, in linkage disequilibrium was met het A-allel van de promotor regio SNP -1002 G>A, rs7160195, en resulteerde in verminderde expressie van GSTZ1-1 eiwit met lysine (K) op positie 32 [60]. De verminderde expressie werd waargenomen bij zowel heterozygoten als homozygoten voor GSTZ1A (KRT), GSTZ1B (KGT) en GSTZ1F (KGM) bij Kaukasisch-Amerikanen [60]. Er was geen effect op de expressie van K-bevattende GSTZ1-1 varianten in levermonsters bestudeerd van Afro-Amerikanen. Om nog onduidelijke redenen waren er geen verschillen in de mRNA-niveaus van GSTZ1 tussen haplotypes, wat wijst op een ontkoppeling van de resultaten voor eiwitexpressie en mRNA-expressie [60]. Het vinden van een lagere expressie van het GSTZ1-1 eiwit voor K-bevattende haplotypes bij blanken suggereert dat er bij deze personen (behalve bij degenen met KRT) sprake zal zijn van een verlaagd tempo van het initiële metabolisme van DCA. Verder roept dit de mogelijkheid op dat blanken met K-bevattende haplotypes die behandeld worden met DCA een minder efficiënte hersynthese van het GSTZ1-1 eiwit ervaren, wat leidt tot een nog tragere eliminatie dan mensen zonder dit haplotype.
Invloed van GSTZ1-varianten op de farmacokinetiek van DCA bij mensen
Ervan uitgaande dat de bijwerkingen van chronische DCA-behandeling verband houden met accumulatie van ofwel DCA zelf ofwel de reactieve endogene substraten voor GSTZ1, MAA en MA, is er een overtuigend argument dat het veilige klinische gebruik van DCA gestuurd moet worden door inzicht in de variabiliteit in eliminatie van het geneesmiddel bij mensen tijdens chronische behandeling. De dosering van DCA zou dan kunnen worden verlaagd bij mensen die een trage eliminatie vertonen, terwijl de effectieve bloedspiegels gehandhaafd blijven. Als het mogelijk zou zijn om te voorspellen wie DCA langzaam elimineert, op basis van hun genetische samenstelling, zou een diagnostische test kunnen worden uitgevoerd om het genotype voor GSTZ1 te verkrijgen, en zou de dosis kunnen worden gebaseerd op het genotype. Dit zou minder duur zijn dan het herhaaldelijk meten van de DCA-niveaus in het bloed. Hiertoe is de farmacokinetiek van DCA onderzocht bij menselijke vrijwilligers en bij patiënten. In één onderzoek bij menselijke vrijwilligers werden de deelnemers gegenotypeerd en werd de farmacokinetiek van DCA bestudeerd na een enkele dosis van 25 mg/kg of vijf opeenvolgende dagelijkse doses van 25 mg/kg/dag [55]. Zoals blijkt uit tabel 3, vertoonden personen met ten minste één EGT-variant van GSTZ1 een grotere klaring van DCA na vijf doses dan degenen die geen EGT in hun genotype hadden. Figuur 3 illustreert de kinetiek van DCA-eliminatie uit plasma bij één snelle en één langzame metaboliseerder van DCA uit dit onderzoek [55]. Vergelijkbare resultaten werden gevonden bij patiënten met een genetische mitochondriale ziekte die elke 12 uur 12,5 mg/kg DCA kregen gedurende 6, 12 of 30 maanden [55,61]. Uit dit werk blijkt ook dat de niveaus van MA uitgescheiden in de urine, een andere maat voor verminderde activiteit van GSTZ1/MAAI, hoger waren bij vrijwilligers en patiënten zonder EGT in hun genotype (Tabel 3).
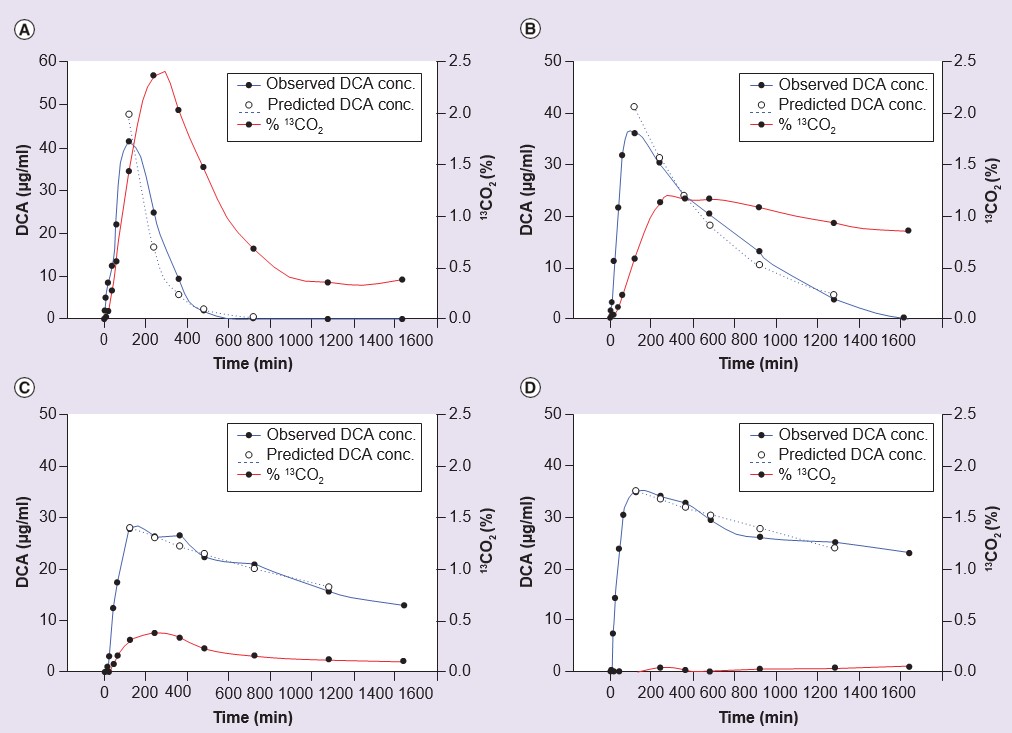
conc.: Concentratie; DCA: Dichlooracetaat.
| Sunject, duur van de DCA-behandeling | Plasmaklaring, mml/min | Maleylacetonuitscheiding, μg/g creatinine | Ref. | ||
| EGT drager | EGT niet-drager | EGT drager | EGT niet-drager | ||
| Vrijwilligers, 5 dagen | 2.22 ± 0.72 (7) | 0.73 ± 0.84* (5) | Niet gedetecteerd | 7.2 ± 4.1* | [55] |
| Patiënten, 12 maanden | 2.16 ± 0.99 (4) | 0.91, 0.17 | – | – | [55] |
| Patiënten, 6 maanden | 1.90 ± 1.13 (11) | 0.53 ± 0.35* (6) | 1.2 ± 0.9 | 6.9 ± 2.6* | [61] |
| Patiënten, 30 maanden | 2.08 ± 1.10 (11) | 0.67 ± 0.45* (6) | 1.9 ± 1.1 | 5.5 ± 1.2* | [61] |
De weergegeven waarden zijn het gemiddelde ± standaarddeviatie (n) of individuele waarden wanneer n < 3.
*Significant verschillend van EGT-dragers, p < 0,05.
De etnische afkomst van de vrijwilligers was als volgt:
EGT-dragers: vier Kaukasisch-Amerikaanse, twee Afro-Amerikaanse, één Aziatisch-Amerikaanse; EGT-niet-dragers: vijf Kaukasisch-Amerikaanse. De etniciteit van de patiënten was niet beschikbaar.
DCA: Dichlooracetaat.
De analyse van de gegevens van de onderzoeken naar de farmacokinetiek van DCA bij vrijwilligers suggereerde dat, zoals in vitro werd vastgesteld (zie hieronder), personen die de GSTZ1A-variant, die codeert voor KRT, op één allel hebben, een snellere initiële klaring van DCA vertonen dan anderen. Deze personen vertoonden ook een grotere afname van de klaring na vijf doses. De ratio van de klaring vanaf de eerste tot de vijfde dosis was 3,6 ± 0,8 (gemiddelde ± standaardfout van het gemiddelde, n = 5) bij degenen met de variant voor GSTZ1C (coderend voor EGT) maar niet GSTZ1A, en was 18,2 ± 9,3 (n = 5) bij degenen met de GSTZ1A-variant op ten minste één allel. Een persoon die homozygoot was voor GSTZ1A vertoonde de grootste verandering van de eerste tot de vijfde dosis, waarbij de klaring daalde van 16,7 tot 0,31 ml/min [55]. Het verschil in gemiddelde verandering in klaring was niet statistisch significant, vanwege de grote variabiliteit in de groep die homo- of heterozygoot was voor GSTZ1A, maar het wees op een trend die overeenkwam met in vitro studies naar de gevoeligheid van de verschillende haplotypes voor inactivering door DCA.
In vitro studies van het DCA-metabolisme
Verder inzicht in de rol van het genotype in het DCA-metabolisme is verkregen uit studies naar de expressie en activiteit van GSTZ1 met DCA in het cytosol en de mitochondriën van de menselijke lever.
Ontogenese van de activiteit
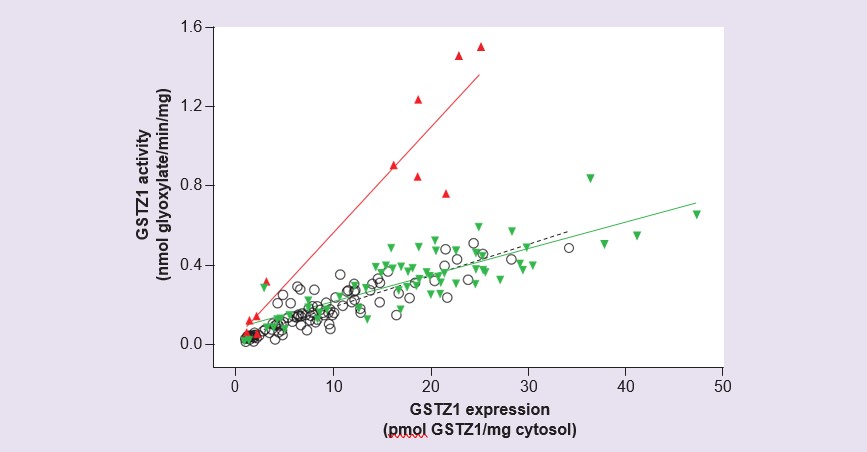
Studies met menselijk levercytosol, bereid uit een panel van 230 levermonsters van donoren in het leeftijdsbereik van zwangerschapsdag 42 tot 84 jaar, hebben zeer lage of niet detecteerbare expressie en activiteit van GSTZ1 prenataal en in de eerste twee levensweken aangetoond: daarna nemen activiteit en expressie geleidelijk toe [56]. Expressie en activiteit bereikten niveaus in het volwassen bereik tegen de leeftijd van 7 jaar, maar er werd aanzienlijke interindividuele variabiliteit gevonden. Meting van activiteit met DCA en expressie van GSTZ1-eiwit in deze monsters liet zien dat monsters van personen met de GSTZ1A-variant op één allel een hogere verhouding activiteit/expressie hadden dan alle andere (figuur 4). Dit kwam overeen met bevindingen van tot expressie gebrachte recombinante menselijke GSTZ1A-1A die voor deze variant een hogere activiteit met DCA lieten zien [54], en met farmacokinetische studies bij vrijwilligers waarbij personen met één GSTZ1A-gen een snelle initiële klaring van DCA hadden [55]. Hoewel de ontwikkelingsstudie aantoonde dat de activiteit bij kinderen jonger dan 7 jaar lager was dan bij volwassenen, betekent de grotere omvang van de lever van kinderen in verhouding tot de lichaamsmassa dat per kilogram lichaamsgewicht de activiteit met DCA vergelijkbaar is bij volwassenen en kinderen van 2 maanden tot 7 jaar [56].
Effect van chloride op inactivatie van GSTZ1 door DCA
Schijnbaar in strijd met de waarneming dat het KRT-eiwit geassocieerd is met een sneller metabolisme van DCA in vitro [56], en een snellere eliminatie van een enkele dosis DCA [55], is de bevinding dat degenen met de GSTZ1A-variant op één allel een grotere afname in klaring vertoonden na herhaalde doses DCA dan degenen die homozygoot waren voor GSTZ1C. Recente bevindingen over het effect van chloride op de inactivering van GSTZ1-1 zouden deze verschillen kunnen verklaren. Gebleken is dat chloride GSTZ1-1 beschermt tegen inactivering door DCA bij fysiologisch relevante concentraties in de lever [62,63], maar het GSTZ1-1 in levercytosol van degenen die heterozygoot waren voor GSTZ1A was minder beschermd tegen inactivering door fysiologisch (38 mM) chloride dan degenen met andere GSTZ1 allelvarianten (Tabel 4). Het effect van chloride was zodanig dat de GSTZ1-1-enzymen in levers van personen met de GSTZ1A-variant op één allel tweemaal zo snel werden geïnactiveerd als die met andere haplotypes. Het exacte mechanisme van het chloride-effect moet nog worden vastgesteld, maar dit verschijnsel is één verklaring voor het grotere verlies aan klaring van DCA na chronische dosering bij personen met één of meer kopieën van de GSTZ1A-variant. Zoals hierboven opgemerkt, draagt de lagere expressie van het enzym bij Kaukasische personen met lysine (K) op positie 32 van het eiwit waarschijnlijk bij aan de zeer lage klaring.
.
| Haplotype | EC50 mM | Inactivatiehalfwaardetijd, u zonder Cl- | Inactivatiehalfwaardetijd, u met 38 mM Cl- |
|---|---|---|---|
| EGT/EGT | 15 ± 3.1 (3) | 0.53, 0.49 | 5.73, 5.02 |
| KRT/EGT | 36 ± 2.2 (3) | 0.38, 0.38 | 2.66, 2.37 |
| EGM/EGM | 16.9 | – | 5.55 |
EC50 is de chlorideconcentratie die de helft van het cytosolische GSTZ1 tegen inactivering beschermde na incubatie gedurende 2 uur met Na DCA, 0,5 mM.
Conclusie
Vanwege zijn vermogen om PDH-kinase te remmen heeft DCA toepassingen voor de behandeling van kanker en stofwisselingsziekten. Bij chronische toediening van DCA aan mensen wordt het metabolisme en de eliminatie ervan verminderd. De reden voor deze verminderde klaring na meerdere doses DCA is dat het enige enzym waarvan bekend is dat het DCA metaboliseert, GSTZ1-1, tijdens het DCA-metabolisme wordt geïnactiveerd. Deze remming van GSTZ1-1 door DCA resulteert niet alleen in een vertraagde klaring van DCA, maar ook van de endogene substraten MAA en MA; of accumulatie van DCA en/of reactieve tyrosine katabolieten de oorzaak is van de reversibele perifere neuropathie die bij sommige patiënten optreedt, blijft onopgelost. Een andere onopgeloste mogelijke oorzaak van de neuropathie is de bescheiden toename van ∂-ALA na chronische DCA-behandeling. Van belang voor een goed begrip van de farmacokinetiek van DCA is dat het GSTZ1-gen polymorfe varianten vertoont in alle menselijke populaties die tot nu toe zijn onderzocht. De eigenschappen van de GSTZ1-1 variant enzymeiwitten verschillen wat betreft hun vermogen om DCA en de endogene substraten MAA en MA te metaboliseren, vooral bij chronische toediening. Hoewel alle GSTZ1-1-varianten door DCA worden geïnactiveerd, wordt één variant, met lysine in plaats van glutaminezuur op positie 32 en arginine in plaats van glycine op positie 42 van het eiwit, sneller geïnactiveerd dan andere varianten in aanwezigheid van fysiologische concentraties chloride. Bij blanken, maar niet bij personen van Afrikaanse etniciteit, zijn GSTZ1-varianten met lysine op positie 32 gekoppeld aan een SNP in de promotorregio van het GSTZ1-gen die resulteert in een verminderde expressie van het GSTZ1-1-eiwit; dit kan zich ook voordoen als een traagmetabolisme. Inzicht in de factoren die de farmacokinetiek van DCA bij chronische toediening beïnvloeden, is nodig om de juiste dosis en het juiste doseringsinterval te kiezen om dit geneesmiddel veilig en effectief aan patiënten toe te dienen.
Toekomstperspectief
Uit de studies tot nu toe blijkt duidelijk dat het GSTZ1 haplotype een belangrijke factor is die de klaring van DCA bepaalt. Een beter begrip van de regulatie van het enzym onder fysiologische omstandigheden en in aanwezigheid van DCA zal in de toekomst leiden tot een veiliger en effectiever gebruik van het geneesmiddel. Verschillende vragen moeten nog worden onderzocht. Komt bij heterozygoten één variant van het eiwit bij voorkeur tot expressie? Activiteitsstudies die een hogere activiteit met DCA laten zien voor levercytosolfracties van personen die heterozygoot zijn voor GSTZ1A/GSTZ1C suggereren dat de 1A (KRT) enzymeiwitvariant bij voorkeur tot expressie komt bij heterozygoten, maar dit is niet aangetoond. Deze vraag heeft praktische implicaties, aangezien de 1A-variant sneller wordt geïnactiveerd dan de 1C-variant. Moet een lagere dosis DCA worden toegediend aan personen die DCA waarschijnlijk langzamer dan gemiddeld klaren bij chronische toediening? Zo ja, moeten dit alle personen zijn die niet homozygoot of heterozygoot zijn voor GSTZ1C? Moeten blanken met ten minste één K-bevattende variant (KRT, KGT, KGM) lagere doses DCA krijgen dan mensen van Afrikaanse etniciteit, omdat zij minder GSTZ1-1 tot expressie brengen? Wat is het bewijs voor een lage expressie van K-bevattende varianten in andere populaties? Zijn er populatieverschillen in de distributiepatronen van de belangrijkste haplotypes? Zijn de effecten van farmacogenetische verschillen bij kinderen hetzelfde als bij volwassenen? Kinderen die DCA gebruiken klaren het middel over het algemeen sneller dan volwassenen, maar mogelijke farmacogenetische effecten zijn niet uitgebreid onderzocht. Verder onderzoek is nodig om deze vragen te beantwoorden, zodat DCA veilig en effectief kan worden gedoseerd.
Financiële en concurrerende belangen openbaar gemaakt
Het in dit manuscript besproken werk van de auteurs werd deels gefinancierd door de US Public Health Service 1RO1 GM 099871, deels door de Brain and Tissue Bank for Developmental Disorders, University of Maryland, Baltimore en University of Miami (NO1 HD90011) en deels door de NIH/NCATS Clinical and Translational Science award aan de University of Florida UL1 TR000064. De auteurs hebben geen andere relevante banden of financiële betrokkenheid bij enige organisatie of entiteit met een financieel belang in of een financieel conflict met het onderwerp of de materialen die in het manuscript worden besproken, afgezien van die welke worden bekendgemaakt.
Bij de productie van dit manuscript is geen schrijfhulp gebruikt.
Samenvatting
- Selectie van een effectieve maar niet-toxische dosis dichlooracetaat (DCA) is belangrijk voor het langdurig klinisch gebruik van DCA bij de behandeling van kanker en andere stofwisselingsziekten.
- Het gen voor het enige enzym dat dit geneesmiddel metaboliseert, GSTZ1-1, vertoont polymorfismen die resulteren in langzame en snelle metaboliseringsfenotypes na langdurige behandeling met DCA.
- Coderende regio SNPs in het GSTZ1-gen resulteren in vijf gemeenschappelijke haplotypes, met verschillende frequenties in populaties. Personen die homozygoot zijn voor het meest voorkomende, GSTZ1C, zijn snelle metaboliseerders. Er zijn aanwijzingen dat haplotypes die coderen voor GSTZ1-1 eiwitten met K op positie 32 langzame metaboliseerders zijn, maar andere factoren die bijdragen tot een langzaam metabolisme na meerdere doses DCA zijn niet volledig begrepen.
- Een promotor regio SNP bij mensen met Kaukasische maar niet Afrikaanse etniciteit is gekoppeld aan een coderende regio SNP die resulteert in substitutie van lysine voor glutaminezuur op positie 32 van het GSTZ1 eiwit, en is geassocieerd met verminderde expressie van het enzym eiwit in de lever.
- In aanwezigheid van DCA varieert de stabiliteit van het enzym GSTZ1-1 met de chlorideconcentratie. Het enzym van de GSTZ1A-variant (KRT) wordt sneller geïnactiveerd dan de gewone GSTZ1C-variant (EGT) onder fysiologische chlorideconcentraties in de lever.
REFERENTIES
1 Stacpoole PW. Overzicht van de farmacologische en therapeutische effecten van diisopropylammoniumdichlooracetaat (DIPA). J. Clin. Pharmacol. J. New Drugs 9(5), 282-291 (1969).2 Stacpoole PW. De farmacologie van dichlooracetaat. Metabolism 38(11), 1124-1144 (1989).
3 Stacpoole PW, Felts JM. Diisopropylammonium dichlooracetaat (DIPA) en natriumdichlooracetaat (DCA): effect op glucose- en vetmetabolisme in normaal en diabetisch weefsel. Metabolisme 19(1), 71-78 (1970).
4 Stacpoole PW, Moore GW, Kornhauser DM. Metabolic effects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia. N. Engl. J. Med. 298(10), 526-530 (1978).
5 Stacpoole PW, Harwood HJ Jr, Varnado CE. Regulation of rat liver hydroxymethylglutaryl coenzyme A reductase by a new class of noncompetitive inhibitors. Effecten van dichlooracetaat en verwante carbonzuren op de enzymactiviteit. J. Clin. Invest. 72(5), 1575-1585 (1983).
6 Harwood HJ Jr, Bridge DM, Stacpoole PW. In vivo regulation of human mononuclear leukocyte 3-hydroxy-3-methylglutaryl coenzyme A reductase. Studies bij normale personen. J. Clin. Invest. 79(4), 1125-1132 (1987).
7 Moore GW, Swift LL, Rabinowitz D, Crofford OB, Oates JA, Stacpoole PW. Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate. Atherosclerosis 33(3), 285-293 (1979).
8 Eichner HL, Stacpoole PW, Forsham PH. Treatment of streptozotocin diabetes with di-isopropylammonium dichloroacetate (DIPA). Diabetes 23(3), 179-182 (1974).
9 Backshear PJ, Holloway PA, Alberti KG. Metabolic interactions of dichloroacetate and insulin in experimental diabetic ketoacidosis. Biochem. J. 146(2), 447-456 (1975).
10 Whitehouse S, Randle PJ. Activation of pyruvate dehydrogenase in perfused rat heart by dichloroacetate (korte mededeling). Biochem. J. 134(2), 651-653 (1973).
11 Whitehouse S, Cooper RH, Randle PJ. Mechanism of activation of pyruvate dehydrogenase by dichloroacetate and other halogenated carboxylic acids. Biochem. J. 141(3), 761-774 (1974).
12 Patel MS, Korotchkina LG. Regulation of the pyruvate dehydrogenase complex. Biochem. Soc. Trans. 34(Pt 2), 217-222 (2006).
13 Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM. Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex. Biochem. J. 329(Pt 1), 191-196 (1998).
14 Morten KJ, Caky M, Matthews PM. Stabilization of the pyruvate dehydrogenase E1alpha subunit by dichloroacetate. Neurologie 51(5), 1331-1335 (1998).
15 Han Z, Berendzen K, Zhong L et al. A combined therapeutic approach for pyruvate dehydrogenase deficiency using self-complementary adeno-associated virus serotype-specific vectors and dichloroacetate. Mol. Genet. Metab. 93(4), 381-387 (2008).
16 Evans OB, Stacpoole PW. Prolonged hypolactatemia and increased total pyruvate dehydrogenase activity by dichloroacetate. Biochem. Pharmacol. 31(7), 1295-1300 (1982).
17 Denton RM, Randle PJ, Bridges BJ et al. Regulation of mammalian pyruvate dehydrogenase. Mol. Cell. Biochem. 9(1), 27-53 (1975).
18 Sugden MC, Holness MJ. Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs. Am. J. Physiol. Endocrinol. Metab. 284(5), E855-E862 (2003).
19 Stacpoole PW, Nagaraja NV, Hutson AD. Efficacy of dichloroacetate as a lactate-lowering drug. J. Clin. Pharmacol. 43(7), 683-691 (2003).
20 Kankotia S, Stacpoole PW. Dichloroacetate and cancer: new home for an orphan drug? Biochim. Biophys. Acta 1846(2), 617-629 (2014).
21 Stacpoole PW. The dichloroacetate dilemma: environmental hazard versus therapeutic goldmine-both or neither? Environ. Health Perspect. 119(2), 155-158 (2011).
22 Chu PI. Pharmacokinetics of sodium dichloroacetate. Ph.D. dissertatie, Afdeling Farmacie, Universiteit van Florida, FL, VS (1987).
23 Stacpoole PW, Henderson GN, Yan Z, Cornett R, James MO. Pharmacokinetics, metabolism and toxicology of dichloroacetate. Drug Metab. Rev. 30(3), 499-539 (1998).
24 Curry SH, Chu PI, Baumgartner TG, Stacpoole PW. Plasmaconcentraties en metabolische effecten van intraveneus natriumdichlooracetaat. Clin. Pharmacol. Ther. 37(1), 89-93 (1985).
25 Maisenbacher HW 3rd, Shroads AL 3rd, Zhong G et al. Pharmacokinetics of oral dichloroacetate in dogs. J. Biochem. Mol. Toxicol. 27(12), 522-525 (2013).
26 Wells PG, Moore GW, Rabin D, Wilkinson GR, Oates JA, Stacpoole PW. Metabole effecten en farmacokinetiek van intraveneus toegediend dichlooracetaat bij mensen. Diabetologia 19(2), 109-113 (1980).
27 Stacpoole PW, Harman EM, Curry SH, Baumgartner TG, Misbin RI. Behandeling van lactische acidose met dichlooracetaat. N. Engl. J. Med. 309(7), 390-396 (1983).
28 Henderson GN, Curry SH, Derendorf H, Wright EC, Stacpoole PW. Pharmacokinetics of dichloroacetate in adult patients with lactic acidosis. J. Clin. Pharmacol. 37(5), 416-425 (1997).
29 Stacpoole PW, Kerr DS, Barnes C et al. Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 117(5), 1519-1531 (2006).
30 Stacpoole PW, Gilbert LR, Neiberger RE et al. Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics 121(5), e1223-e1228 (2008).
31 Kaufmann P, Engelstad K, Wei Y et al. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Neurologie 66(3), 324-330 (2006).
32 Stickler DE, Valenstein E, Neiberger RE et al. Peripheral neuropathy in genetic mitochondrial diseases. Pediatr. Neurol. 34(2), 127-131 (2006).r
33 Kaufmann P, Pascual JM, Anziska Y et al. Nerve conduction abnormalities in patients with MELAS and the A3243G mutation. Arch. Neurol. 63(5), 746-748 (2006).
34 Shroads AL, Guo X, Dixit V, Liu HP, James MO, Stacpoole PW. Age-dependent kinetics and metabolism of dichloroacetate: possible relevance to toxicity. J. Pharmacol. Exp. Ther. 324(3), 1163-1171 (2008).
35 James MO, Yan Z, Cornett R et al. Pharmacokinetics and metabolism of [14C]dichloroacetate in male Sprague-Dawley rats. Identificatie van glycineconjugaten, waaronder hippuraat, als urinaire metabolieten van dichlooracetaat. Drug Metab. Dispos. 26(11), 1134-1143 (1998).
36 Rowland A, Miners JO, Mackenzie PI. The UDP-glucuronosyltransferases: their role in drug metabolism and detoxification. Int. J. Biochem. Cell. Biol. 45(6), 1121-1132 (2013).
37 Vessey DA, Kelley M, Warren RS. Characterization of the CoA ligases of human liver mitochondria catalyzing the activation of short- and medium-chain fatty acids and xenobiotic carboxylic acids. Biochim. Biophys. Acta 1428(2-3), 455-462 (1999).
38 James MO, Cornett R, Yan Z, Henderson GN, Stacpoole PW. Glutathione-dependent conversion to glyoxylate, a major pathway of dichloroacetate biotransformation in hepatic cytosol from humans and rats, is reduced in dichloroacetate-treated rats. Drug Metab. Dispos. 25(11), 1223-1227 (1997).
39 Tong Z, Board PG, Anders MW. Glutathione transferase zeta katalyseert de oxygenatie van het carcinogeen dichloorazijnzuur tot glyoxylzuur. Biochem. J. 331(Pt 2), 371-374 (1998).
49 Fernandez-Canon JM, Penalva MA. Characterization of a fungal maleylacetoacetate isomerase gene and identification of its human homologue. J. Biol. Chem. 273(1), 329-337 (1998).
41 Blackburn AC, Woollatt E, Sutherland GR, Board PG. Characterization and chromosome location of the gene GSTZ1 encoding the human Zeta class glutathione transferase and maleylacetoacetate isomerase. Cytogenet. Cell. Genet. 83(1-2), 109-114 (1998).
42 Li W, James MO, Mckenzie SC, Calcutt NA, Liu C, Stacpoole PW. Mitochondrion as a novel site of dichloroacetate biotransformation by glutathione transferase zeta 1. J. Pharmacol. Exp. Ther. 336(1), 87-94 (2011).
43 Lantum HB, Baggs RB, Krenitsky DM, Board PG, Anders MW. Immunohistochemical localization and activity of glutathione transferase zeta (GSTZ1-1) in rat tissues. Drug Metab. Dispos. 30(6), 616-625 (2002).
44 Shangraw RE, Fisher DM. Pharmacokinetics of dichloroacetate in patients undergoing liver transplantation. Anesthesiology 84(4), 851-858 (1996).
45 Cornett R, James MO, Henderson GN, Cheung J, Shroads AL, Stacpoole PW. Inhibition of glutathione S-transferase zeta and tyrosine metabolism by dichloroacetate: a potential unifying mechanism for its altered biotransformation and toxicity. Biochem. Biophys. Res. Commun. 262(3), 752-756 (1999).
46 Guo X, Dixit V, Liu H et al. Inhibition and recovery of rat hepatic glutathione S-transferase zeta and alteration of tyrosine metabolism following dichloroacetate exposure and withdrawal. Drug Metab. Dispos. 34(1), 36-42 (2006).
47 Anderson WB, Board PG, Gargano B, Anders MW. Inactivation of glutathione transferase zeta by dichloroacetic acid and other fluor-lacking alpha-haloalkanoic acids. Chem. Res. Toxicol. 12(12), 1144-1149 (1999).
48 Anderson WB, Liebler DC, Board PG, Anders MW. Mass spectral characterization of dichloroacetic acid-modified human glutathione transferase zeta. Chem. Res. Toxicol. 15(11), 1387-1397 (2002).
49 Dixit V. Inactivation of glutathione transferase zeta by dichloroacetic acid. Doctoraalscriptie, Afdeling Medicinale Chemie, Universiteit van Florida, FL, VS (2005).
50 Stacpoole PW, Wright EC, Baumgartner TG et al. A controlled clinical trial of dichloroacetate for treatment of lactic acidosis in adults. De Dichloroacetate-Lactic Acidosis Study Group. N. Engl. J. Med. 327(22), 1564-1569 (1992).
51 Abdelmalak M, Lew A, Ramezani R et al. Long-term safety of dichloroacetate in congenital lactic acidosis. Mol. Genet. Metab. 109(2), 139-143 (2013).
52 Board PG, Baker RT, Chelvanayagam G, Jermiin LS. Zeta, a novel class of glutathione transferases in a range of species from plants to humans. Biochem. J. 328(Pt 3), 929-935 (1997).
53 Blackburn AC, Tzeng HF, Anders MW, Board PG. Discovery of a functional polymorphism in human glutathione transferase zeta by expressed sequence tag database ana-lysis. Pharmacogenetics 10(1), 49-57 (2000).
54 Blackburn AC, Coggan M, Tzeng HF et al. GSTZ1d: een nieuw allel van glutathione transferase zeta en maleylacetoacetaat isomerase. Farmacogenetica 11(8), 671-678 (2001).
55 Shroads AL, Langaee T, Coats BS et al. Human polymorphisms in the glutathione transferase zeta 1/maleylacetoacetate isomerase gene influence the toxicokinetics of dichloroacetate. J. Clin. Pharmacol. 52(6), 837-849 (2012).
56 Li W, Gu Y, James MO et al. Prenatal and postnatal expression of glutathione transferase zeta 1 in human liver and the roles of haplotype and subject age in determining activity with dichloroacetate. Drug Metab. Dispos. 40(2), 232-239 (2012).Google Scholar
57 Board PG, Anders MW. Glutathione transferase zeta: ontdekking, polymorfe varianten, katalyse, inactivatie, en eigenschappen van Gstz1-/- muizen. Drug Metab. Rev 43(2), 215-225 (2011).
58 Polekhina G, Board PG, Blackburn AC, Parker MW. Crystal structure of maleylacetoacetate isomerase/glutathione transferase zeta reveals the molecular basis for its remarkable catalytic promiscuity. Biochemie 40(6), 1567-1576 (2001).
59 Fang YY, Kashkarov U, Anders MW, Board PG. Polymorfismen in de menselijke glutathione transferase zeta promotor. Pharmacogenet. Genomics 16(5), 307-313 (2006).
60 Langaee TY, Zhong G, Li W et al. The influence of human GSTZ1 gene haplotype variations on GSTZ1 expression. Pharmacogenet Genomics 25(5), 239-245 (2015).
61 Shroads AL, Coats BS, Mcdonough CW, Langaee T, Stacpoole PW. Haplotype variaties in glutathione transferase zeta 1 beïnvloeden de kinetiek en dynamiek van chronisch dichlooracetaat bij kinderen. J. Clin. Pharmacol. 55(1), 50-55 (2015).
62 Zhong G, Li W, Gu Y, Langaee T, Stacpoole PW, James MO. Chloride and other anions inhibit dichloroacetate-induced inactivation of human liver GSTZ1 in a haplotype-dependent manner. Chem. Biol. Interact. 215C, 33-39 (2014).
63 Jahn SC, Rowland-Faux L, Stacpoole PW, James MO. Chlorideconcentraties in menselijk hepatisch cytosol en mitochondriën zijn een functie van leeftijd. Biochem. Biophys. Res. Commun. 459(3), 463-468 (2015).