Allison B. Haugrud, Yongxian Zhuang, Joseph D. Coppock, W. Keith Miskimins..
Cancer Biology Research Center, Sanford Research, 2301 E. 60th St North, Sioux Falls, SD 57104, USA
e-mail: [email protected]
Ontvangen: 24 april 2014
Geaccepteerd: 5 september 2014
Gepubliceerd: 12 september 2014
Abstract
Het unieke metabolisme van borstkankercellen is interessant om dit fenomeen therapeutisch te exploiteren. Metformine, een veelbelovend borstkankertherapeuticum, richt zich op complex I van de elektronentransportketen wat leidt tot een accumulatie van reactieve zuurstofsoorten (ROS) die uiteindelijk leiden tot celdood. Remming van complex I leidt tot lactaatproductie, een metabool bijproduct dat al in hoge mate wordt geproduceerd door geherprogrammeerde kankercellen en in verband wordt gebracht met een slechte prognose. Terwijl metformine een veelbelovend kankertherapeuticum blijft, zochten wij naar een aanvullend middel om de apoptotische bevorderende effecten van metformine te vergroten en tegelijkertijd de lactaatproductie te verminderen, wat mogelijk tot een sterk verbeterde werkzaamheid leidt. Dichlooracetaat (DCA) is een beproefd geneesmiddel voor de behandeling van melkzuur, dat werkt door remming van pyruvaat dehydrogenase kinase (PDK), waardoor het mitochondriaal metabolisme wordt bevorderd. Ons doel was de synergie en de mechanismen te onderzoeken waardoor deze twee geneesmiddelen borstkankercellen doden. De cellijnen werden onderworpen aan de aangegeven behandelingen en geanalyseerd op celdood en verschillende aspecten van het metabolisme. Celdood en ROS-productie werden geanalyseerd met behulp van flowcytometrie, Western blot analyse en celtellingsmethoden. Beelden van cellen werden genomen met fasecontrastmicroscopie of confocale microscopie. Het metabolisme van de cellen werd geanalyseerd met de Seahorse XF24 analyzer, lactaatanalyses en pH-analyses. Wij tonen aan dat wanneer DCA en metformine in combinatie worden gebruikt, synergetische inductie van apoptose van borstkankercellen optreedt. Metformine-geïnduceerde oxidatieve schade wordt versterkt door DCA via PDK1 remming die ook de metformine bevorderde lactaatproductie vermindert. Wij tonen aan dat DCA en metformine samen op synergetische wijze caspase-afhankelijke apoptose induceren waarbij oxidatieve schade optreedt en tegelijkertijd de door metformine bevorderde lactaatproductie vermindert. Innovatieve combinaties zoals metformine en DCA zijn veelbelovend voor de uitbreiding van borstkankertherapieën.
Trefwoorden: Metformine; Dichlooracetaat; Borstkanker; Lactaat; Apoptose
© Springer Science+Business Media New York 2014
INLEIDING
Kankermetabolisme ontwikkelt zich tot een veelbelovend gebied voor de ontwikkeling van nieuwe therapeutische benaderingen. Vergeleken met de normale cellen waaruit ze voortkomen, zijn kankercellen metabolisch geherprogrammeerd, waarbij ze bij voorkeur gebruik maken van glycolyse, zelfs onder omstandigheden van voldoende zuurstof, een fenomeen dat bekend staat als het Warburg-effect [1]. Ter compensatie van het verlies aan ATP als gevolg van de voorkeur voor glycolyse (ten opzichte van progressie door oxidatieve fosforylering), verhogen kankercellen de genen die coderen voor glucosetransporters en glycolytische enzymen zoals pyruvaatdehydrogenase kinase (PDK) en lactaatdehydrogenase (LDH). Deze hoge snelheid van glucose-opname en gewijzigd metabolisme levert niet alleen ATP en laat cellen overleven onder hypoxische omstandigheden; het levert ook biosynthetische bouwstenen zoals tussenproducten en substraten voor de productie van aminozuren, NADPH en ribose-5-fosfaat die essentieel zijn voor de nucleotide-, eiwit- en membraansynthese die nodig is in snel delende cellen. Dit betekent ook dat de mitochondriale TCA-cyclus een lager percentage ATP genereert, waardoor citraat kan worden gebruikt voor de biosynthese van vetzuren en lipiden voor de productie van nieuwe membranen [2]. Veel van het door glycolyse verkregen lactaat wordt opgenomen door de omliggende cellen met wederzijdse recycling om de groei van de tumor en de weerstand tegen apoptotische celdoodmechanismen te ondersteunen [2, 3]. Door tumoren geproduceerd lactaat kan het T-celmetabolisme en de antigenpresentatie van dendritische cellen verstoren, wat leidt tot immuunontwijking voor de tumor [4, 5]. De hoge niveaus van glucosegebruik en glycolyse bieden kankercellen dus talrijke voordelen. Het unieke metabole profiel van kanker kan echter ook therapeutisch worden benut. In deze studie onderzochten wij de activiteit en het samenspel van twee op het metabolisme gerichte geneesmiddelen, metformine en dichlooracetaat (DCA), om hun effecten op de groei en overleving van borstkankercellen te bepalen.
Metformine hydrochloride (1,1-dimethylbiguanide hydrochloride) is een oraal geneesmiddel dat veel gebruikt wordt bij de behandeling van diabetes type twee. Uit studies is gebleken dat bij diabetespatiënten die metformine gebruiken het aantal gevallen van kanker en daarmee samenhangende sterfgevallen lager is dan bij patiënten die geen metformine gebruiken. In een van die studies hadden diabetespatiënten met borstkanker die metformine gebruikten een significant betere respons op neoadjuvante chemotherapie dan patiënten die geen metformine gebruikten [6-8]. Uit in vitro studies is gebleken dat metformine de groei van vele soorten kankercellen remt, waaronder die van borstkanker, darmkanker, prostaatkanker, eierstokkanker en gliomen [9-12]. Van metformine is bekend dat het AMP-geactiveerd proteïnekinase (AMPK) activeert, wat leidt tot remming van de eiwitsynthese en de celgroei [13]. Activering van AMPK alleen is echter niet voldoende om tot apoptotische celdood te leiden [14]. Studies hebben aangetoond dat metformine zich ophoopt in de mitochondriën en complex I van de elektronentransportketen licht remt, een gebeurtenis die plaatsvindt vóór de activering van AMPK [15-18]. Als complex I wordt geremd, leidt een belemmerde elektronenpassage tot superoxideproductie in de mitochondriale matrix, waardoor mitochondriale eiwitten, lipiden en nucleïnezuren worden beschadigd. In studies waarin is aangetoond dat metformine de celdood bevordert, is apoptose de belangrijkste route [10, 12, 19]. Wij hebben eerder aangetoond dat metformine zowel caspase-afhankelijke als poly(ADP-ribose) polymerase (PARP)-afhankelijke celdood induceert in de meeste borstkankercellijnen, terwijl het niet cytotoxisch is voor niet-getransformeerde borstepitheelcellen [20]. Poly(ADP-ribose) polymerase-afhankelijke celdood ging gepaard met belangrijke veranderingen in de mitochondriale vorm en functie, hetgeen leidt tot de conclusie dat mitochondriale schade in kankercellen een belangrijke mediator is van metformine-geïnduceerde celdood. Op grond van deze waarnemingen stelden wij de hypothese dat verbindingen die het mitochondriale oxidatieve metabolisme bevorderen, de door metformine veroorzaakte mitochondriale schade zouden versterken en samen met metformine de kankercellen zouden doden. Aangezien behandeling met metformine ook de productie van lactaat bevordert [21], zou een dergelijke verbinding idealiter ook dit effect tegengaan.
Dichlooracetaat is ook een oraal beschikbaar geneesmiddel met een goed bestudeerde farmacokinetiek en is getest voor de behandeling van melkzuurvorming (een potentiële bijwerking van metformine) en mitochondriale tekorten [27]. Dichlooracetaat is een remmer van PDK die pyruvaatdehydrogenase (PDH) fosforyleert, waardoor het inactief wordt [23]. Pyruvaatdehydrogenase is het enzym dat verantwoordelijk is voor de omzetting van pyruvaat in acetyl-CoA voor opname in de mitochondriale tricarbonzuurcyclus (TCA) en oxidatieve fosforylering. In kankercellen is de PDK-activiteit vaak verhoogd en fungeert als een poortwachter om de flux van pyruvaat uit het cytoplasma naar het mitochondriale metabolisme te beperken. Dit wordt beschouwd als een belangrijke component van de metabole herprogrammering in kankercellen, die leidt tot verminderde glucose-oxidatie en de productie van lactaat [24-26]. Door remming van PDK verhoogt DCA de activiteit van PDH, waardoor pyruvaat in de TCA-cyclus terechtkomt in plaats van te worden omgezet in lactaat en uitgescheiden [27].
In deze studie onderzochten wij de antitumoractiviteit en het samenspel van twee op het metabolisme gerichte geneesmiddelen, metformine en DCA. Wij tonen aan dat DCA de cytotoxiciteit van metformine voor borstkankercellen verhoogt via een mechanisme van oxidatieve schade en tegelijkertijd de lactaatproductie door metformine verlaagt, hetgeen een dubbel therapeutisch voordeel kan opleveren.
Methoden
Chemicaliën en reagentia
De volgende chemicaliën, reagentia en kits werden gekocht via Sigma-Aldrich tenzij anders vermeld: metformine (1,1-dimethylbiguanide), natriumdichlooracetaat, 0.4 % trypanblauwoplossing, Vectashield inbedmiddel voor fluorescentie met 4,6 diamidino-2-fenylindool (DAPI) (Vector Laboratories), Lactaat Assay Kit (Eton Biosciences), caspaseremmer OPH-109 (MP Biomedicals), Coomassie Brilliant Blue R250 (Bio-Rad Laboratories), paraformaldehyde, SYTOX® Green (Life Technologies), Triton X-100 (Eastman) en PARP-remmer II INH2BP (Epigentek).
Celcultuur
MCF7 en T47D menselijke borstkankercellijnen en MCF10A menselijke mamma-epitheelcellen werden gekocht van ATCC. De 66CL4 muis mammacarcinoom cellijn werd ter beschikking gesteld door Dr. Fred Miller (Karmanos Cancer Institute, Detroit, MI). Na ontvangst van de cellijnen werden de cellen onmiddellijk gekweekt en geëxpandeerd om bevroren ampulvoorraden te bereiden. De cellen werden niet langer dan 2-3 maanden gepasseerd alvorens nieuwe culturen te maken van de bevroren ampullen met vroege passage. De cellijnen werden routinematig gecontroleerd op besmetting met mycoplasma en werden door IDEXX RADIL Laboratories mycoplasmavrij bevonden. De cellen werden onderhouden in Dulbecco’s modified Eagle’s medium (DMEM) met 10% foetaal runderserum, 100 U/ml penicilline en 100 µg/ml streptomycine. De cellen werden geïncubeerdineenbevochtigdeCO2-incubator bij 37 °C.
Trypan blue exclusion assay
MCF7 en T47D cellijnen werden uitgezet op 35 mm schaaltjes. De cellen werden behandeld met metformine en DCA in de aangegeven concentraties of met medium. Na de aangegeven periode werd medium verzameld om eventuele drijvende dode cellen te bewaren. Aangesloten cellen werden gewassen met fosfaatgebufferde zoutoplossing (PBS), die werd samengevoegd met de verzamelde media. De cellen werden vervolgens geoogst door trypsinisatie en toegevoegd aan de pool. Trypan blue-oplossing werd vervolgens gebruikt om de dode cellen 1:1 te kleuren, en de cellen werden geteld met een hemacytometer.
Western blotting
De cellenwerdenuitgezetopschaaltjes van 35 mm. Na behandeling gedurende de aangegeven periode werden de cellen in het medium geoogst om levende en dode cellen te verzamelen. De cellen werden gepelleteerd, gewassen met PBS en opnieuw gepelleteerd. De celpellet werd vervolgens gelyseerd door toevoeging van 1× natriumdodecylsulfaat (SDS) monsterbuffer [2,5 mM Tris-HCl (pH 6,8), 2,5% SDS, 100 mM dithiothreitol, 10% glycerol, 0,025% broomfenolblauw]. Gelijke hoeveelheden eiwit werden gescheiden op een 8,5 % SDS-polyacrylamidegel. De eiwitten werden overgebracht op Immobilon P-membranen (Millipore) met een Bio-Rad Trans-blot apparaat met behulp van een transferbuffer [48 mM Tris-HCl, 39 mM glycine]. De membranen werden ondergedompeld in 5 % vetvrije droge melk in Tris-buffered saline met Tween-20 (TBS-T) [10 mM Tris-HCl (pH 7,5), 150 mM NaCl, 0,1 % Tween-20] met het aangegeven antilichaam gedurende 3 uur bij kamertemperatuur of 4 °C ’s nachts. Na grondig wassen met TBS-T werd een geschikt secundair antilichaam geconjugeerd met mierikswortelperoxidase (HRP) aangebracht. Het membraan werd opnieuw gewassen en de eiwitten werden vervolgens gedetecteerd met behulp van Super Signal West Pico chemiluminescent substraat (Pierce Biochemical). Voor de isolatie van mitochondriën, (fig. 3d) werden MCF7-cellen gekweekt tot 95% confluentie op 150 mm schaaltjes. Een Mitochondrial Isolation Kit for Cultured Cells (Pierce) werd gebruikt om mitochondriën te isoleren volgens het protocol van de fabrikant. Alle blots werden afgebeeld met een UVP-beeldvormingssysteem. De volgende antilichamen werden gebruikt: Pyruvaat dehydrogenase kinase1 (Abcam), PARP (Cell Signaling), anti-4-hydroxynonenal (Millipore), Complex I subunit NDUFB8 (Mitosciences), GAPDH (Ambion), PDH (Abcam), en Phospho-PDHE1 alpha (Calbiochem).
Confocale microscopie
Cellenwerdenuitgezetopglazen dekglaasjes in 35 mm-schaaltjes en behandeld zoals aangegeven. De cellen werden gewassen in PBS, gefixeerd met 4% paraformaldehyde gedurende 10 minuten, gemonteerd in Vectashield-medium met DAPI op standaardmicroscoopglaasjes en vervolgens geobserveerd op een Olympus FV1000 confocale microscoop bij 100×. Oprichting van MCF7 stabiel uiten pAcGFP1-Mito (Clontech; een plasmide coderen mitochondriale gerichte fluorescerende eiwitten) cellijnen werden eerder beschreven [20].
Lactaatanalyse en pH-analyse
MCF7- en 66CL4-cellen in 35 mm-schaaltjes werden gekweekt tot 80% confluentie en behandeld zoals aangegeven in fenolroodvrije, carbonaatvrije media. De cellen werden gedurende 4-6 uur behandeld. Het medium uit de schaaltjes werd opgevangen en de lactaatconcentratie werd gemeten met een in de handel verkrijgbaar L-Lactaat Assay Kit (Eton Bioscience). Voor de 66Cl4-cellijn werden de cellen geteld met een hemacytometer om de lactaatniveaus te normaliseren. Er werd een pH-meter gebruikt om de pH van het medium te meten.
Kolonievormingstest
MCF7-cellen werden uitgezet op 500 cellen per 60 mm-schotel. De volgende dag werden de cellen behandeld zoals aangegeven. Na 12 dagen incubatie werden de cellen gewassen met PBS en gedurende 5 minuten gefixeerd met 70% ethanol. Kolonies werden vervolgens gekleurd met Coomassie Blue [40% methanol, 12% ijsazijn, 0,24% Coomassie Blue], gewassen, afgebeeld en gekwantificeerd met een AlphaImager-systeem en bijbehorende beeldanalysesoftware (AlphaInnotech, Santa Clara, CA).
Flowcytometrie
MCF7-cellen werden behandeld zoals aangegeven. De cellen werden vervolgens gedurende 15 minuten geïncubeerd met MitoSOX (5 µM), gewassen, getrypsiniseerd en er werd 1 ml DMEM van 10% FBS aan de cellen toegevoegd. De MitoSOX-niveaus in een gelijk aantal cellen per behandelingsconditie werden bepaald door flowcytometrie met een Accuri C6-cytometer.
Remming van PDK1 met behulp van een siRNA
On-TARGET Plus Smartpool siRNA gericht op PDK1 en niet-doelwit siRNA werden gekocht bij Thermo Scientific. 66CL4 cellen (250.000/schaaltje) werden uitgezet op 35 mm schaaltjes. De volgende dag werden de cellen getransfecteerd met de siRNA’s met behulp van Dharmafect (Thermo Scientific) volgens het protocol van de fabrikant. De transfectie werd de volgende dag herhaald. De volgende dag werden de cellen gewassen en behandeld zoals aangegeven in carbonaatvrij DMEM met 10% FBS. Na 4 uur werden de cellen geteld met de hemacytometer, en de media werden verzameld voor meting van de pH en het lactaatgehalte. De cellen werden verzameld voor analyse van de PDK1-niveaus door middel van western blotting.
Thiobarbituurzuur reactieve stoffen (TBARS) test
MCF7 cellen werden gekweekt tot 100% confluentie op 150 mm schaaltjes. De cellen werden zoals aangegeven gedurende 24 uur behandeld met metformine (8 mM) of DCA (5 mM). De cellen werden geoogst in PBS, gesoneerd en de relatieve eiwitwaarden werden bepaald met de Bradford Assay. Lysaten werden verwerkt met de Quantichrom™ TBARS Assay Kit en afgelezen op een SpectraMax M5-plaatlezer (λ ex/em = 560 nm/585 nm).
SYTOX® green assay
MCF7- en T47D-cellen werden uitgezet in 96-wellsplaten en gekweekt tot 90% confluentie. De cellen werden behandeld zoals aangegeven, gevolgd door de toevoeging van SYTOX® Green nucleic acid stain (10 µM) en incubatie gedurende 20 minuten vóór het aflezen op een fluorescentieplaatlezer bij een λ ex/em = 485/535 nm met een cutoff van 515 nm. De cellen werden vervolgens gedurende 30 minuten met Triton X-100 (0,4%) gepermeabiliseerd en een tweede meting werd verricht om het totale niveau van DNA-kleuring te bepalen, een surrogaat voor het totale aantal cellen. De waarden van de combinatie-index werden bepaald met de CalcuSyn-software.
Zuurstofverbruik
Het zuurstofverbruik (OCR) werd gemeten met een Seahorse XF24 analyzer volgens de instructies van de fabrikant (Seahorse Bioscience, North Billerica, MA, USA). T47D-cellen werden met 40.000 cellen per putje in XF24-wellsplaten geplaatst. De volgende dag werden de cellen gewassen en geëquilibreerd met bufferloze media gedurende 30 minuten bij 37°CineenCO2-vrije incubator voordat ze werden overgebracht naar de XF24-analysator. Een eerste meting van OCR werd verkregen, gevolgd door toevoeging van DCA via injectiepoorten in de putjes tot een eindconcentratie van 5 mM. De OCR werd om de 30 minuten gemeten.
Statistische analyse
Vergelijking van twee groepen geschiedde met een ongepaarde t-test met Welch’s correctie, gegenereerd in Graph Pad Prism software (La Jolla, CA). P-waarden kleiner dan of gelijk aan 0,05 werden beschouwd als significant.
Resultaten
DCA en metformine induceren synergetisch apoptose in borstkankercellen
We hebben eerder aangetoond dat metformine twee verschillende soorten celdood induceert na 3 dagen behandeling in de meeste borstkankercellijnen, terwijl het niet cytotoxisch is voor normale mamma-epitheelcellen [20]. Inductie van celdood in borstkankercellen hing nauw samen met veranderde mitochondriale structuur, wat suggereert dat metformine, een bekende remmer van Complex I van de mitochondriale elektronentransportketen, kankercellen doodt door verandering van de mitochondriale functie. Dit bracht ons tot de hypothese dat verhoging van het mitochondriaal elektronentransport de metformine-geïnduceerde kankerceldood zou versterken. Aangezien DCA de mitochondriale oxidatie van pyruvaat bevordert, onderzochten we eerst of DCA de metformine-geïnduceerde cytotoxiciteit in borstkankercellijnen kon verhogen.
MCF7- en T47D-borstkankercellen werden behandeld met metformine, DCA of een combinatie daarvan. De gebruikte concentratie metformine was 8 mM, wat een fysiologisch relevante dosis metformine is, zoals blijkt uit het werk van Owen e.a. [17]. Wat DCA betreft, kunnen lage millimolaire concentraties worden bereikt in patiëntserum, zodat het bereik van 0,5-5 mM klinisch relevant is [27-29] en in deze experimenten werd gebruikt. Het aantal levende en dode cellen werd bepaald met de trypan blue exclusion assay (fig. 1a). De celdood werd gemeten in MCF7-cellen (fig. 1a links) die gedurende 2 dagen waren behandeld, en T47D-cellen (fig. 1arechts) die gedurende 4 dagen waren behandeld. In beide cellijnen induceerde metformine celdood zoals waargenomen in eerdere experimenten [20]. De celdood nam echter aanzienlijk toe door gelijktijdige behandeling met DCA en metformine, terwijl DCA alleen minimale cytotoxische effecten had (fig. 1a). Toen MCF10A niet-getransformeerde borstepitheelcellen aan dezelfde behandelingen werden onderworpen, werd celdood niet waargenomen, zoals blijkt uit fig. 1b. Om deze waarneming van celdood in kankercellen verder te onderzoeken, werden dosistitraties en SYTOX Green cytotoxiciteitstests uitgevoerd (fig. 1c). De geneesmiddelcombinatie werd getest op synergie volgens de methode van Chou [30] met behulp van CalcuSYN software die een combinatie-index (CI) van de geneesmiddelen genereert, waarvan synergie wordt aangegeven als de CI kleiner is dan 1. MCF7-cellen (Fig. 1c links) hadden een CI van 0,00047 wanneer ze gedurende twee dagen werden behandeld met de combinatie van DCA en metformine. T47D-cellen hadden een CI van 9,762e-006 na 4 dagen behandeling (fig. 1c rechts). Deze waarden wijzen op een sterke synergetische cytotoxiciteit met de combinatie van DCA en metformine in deze borstkankercellijnen.
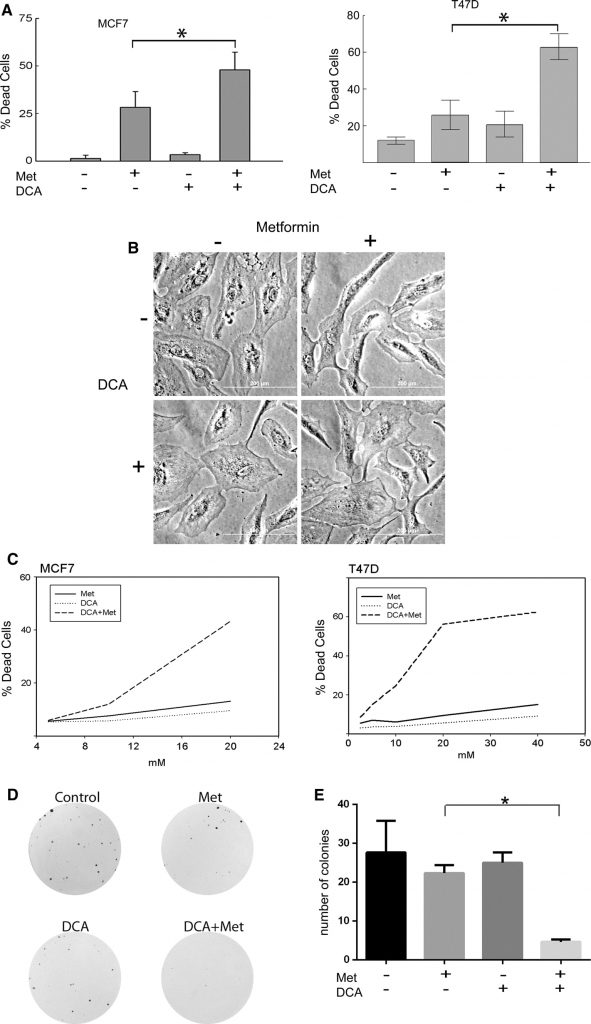
Vervolgens werden de waargenomen cytotoxische effecten van DCA (2,5 mM) en metformine (1 mM) gevalideerd met behulp van kolonievormingstests. Bij deze concentraties verminderden beide geneesmiddelen alleen de koloniegrootte, maar niet significant het aantal kolonies (Fig. 1d, e). Er werd echter een significante afname van het aantal kolonies waargenomen wanneer de twee geneesmiddelen werden gecombineerd (Fig. 1e). Deze waarnemingen tonen aan dat DCA de metformine-geïnduceerde cytotoxiciteit in borstkankercellen versterkt in vergelijking met beide geneesmiddelen alleen.
DCA bevordert oxidatieve fosforylering door remming van PDK1 en vermindert de metformine-geïnduceerde lactaatproductie
Om te bevestigen dat de waargenomen effecten van DCA te wijten zijn aan remming van het verwachte doelwit, PDK1, tonen wij aan dat DCA inderdaad de niveaus van gefosforyleerd PDH vermindert in vergelijking met de controle in MCF7- en MCF10A-cellen door middel van western blot (fig. 2a). Stimulatie van pyruvaatdehydrogenase na DCA-behandeling zal naar verwachting het oxidatieve metabolisme van pyruvaat versterken. Dit effect werd bestudeerd met een Seahorse XF24 analyzer. De OCR’s van controle- versus DCA-behandelde MCF7-cellen werden gemeten (fig. 2b). Met dichlooracetaat behandelde cellen hadden een significant hogere OCR dan controlecellen.
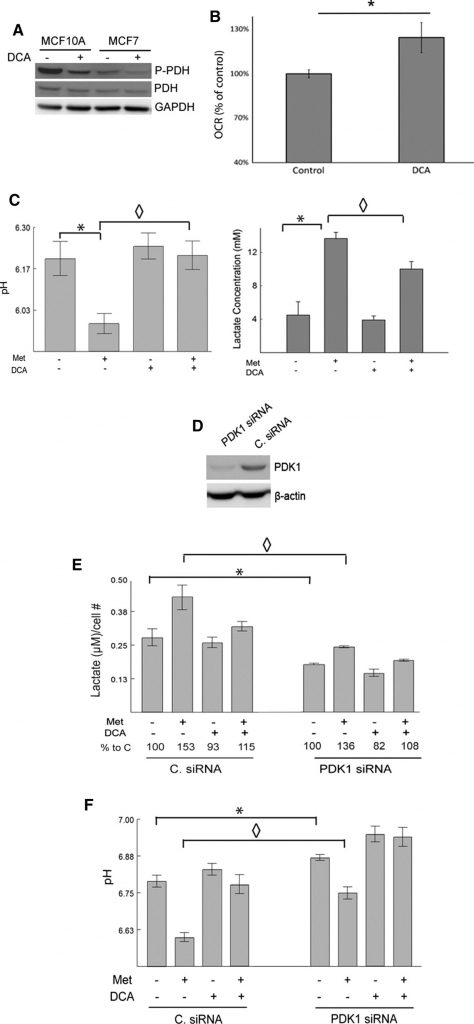
Van metformine, een milde remmer van complex I en een versterker van de AMPK-activiteit, wordt verwacht dat het de glycolytische snelheid stimuleert en de lactaatproductie verhoogt [11,14,15,17]. Daarentegen wordt verwacht dat DCA pyruvaat omleidt naar mitochondriaal metabolisme ten koste van lactaatproductie. Om dit te onderzoeken werden pH en lactaat niveaus in de media van gekweekte MCF7 cellen gemeten na behandeling met metformine, DCA, of beide. Metformine behandelde cellen produceerden significant meer lactaat dan onbehandelde controles. Dichlooracetaat alleen had kleine effecten, maar verminderde de metformine-geïnduceerde lactaatproductie aanzienlijk. De pH van de media kwam overeen met de waargenomen veranderingen in de lactaatniveaus (fig. 2c). Dat wil zeggen, metformine verlaagde de pH van het medium aanzienlijk en dit effect werd grotendeels opgeheven door DCA.
Om de rol van PDK bij de productie van lactaat en het remmen van de opname van pyruvaat in de TCA-cyclus verder te onderbouwen, werd PDK uitgeschakeld met siRNA in 66CL4-cellen. Deze cellijn is afgeleid van een muis mammacarcinoom en kan nuttig zijn voor het vertalen van deze experimenten naar een preklinische setting in toekomstige studies. De cellen werden getransfecteerd met ofwel siRNA dat gericht is tegen PDK1 (PDK1siRNA) of een niet-doelwit controle siRNA (C. siRNA). PDK1 niveaus werden gedetecteerd via western blot, en PDK1 siRNA getransfecteerde cellen hadden merkbaar lagere niveaus van PDK1 in vergelijking met de C. siRNA getransfecteerde cellen (Fig. 2d). SiRNA-gemedieerde onderdrukking van PDK1 verminderde de productie van lactaat en verhoogde de pH van het medium, in overeenstemming met de bekende functies van PDK1 (Fig. 2e, f). PDK1 knockdown verminderde effectief metformine-geïnduceerde veranderingen in lactaat en medium pH. Dichlooracetaat verminderde verder lactaat en verhoogde pH in de PDK1 siRNA getransfecteerde cellen. Het vermogen van DCA om de effecten van metformine op lactaat en pH te keren werd enigszins afgezwakt wanneer PDK1 werd uitgeschakeld, wat opnieuw suggereert dat DCA zijn effecten via PDK1 bewerkstelligt. Samenvattend kan worden geconcludeerd dat verlies van PDK1 door siRNA-transfectie of remming door DCA de metformine-geïnduceerde lactaatproductie voorkomt.
DCA in combinatie met metformine versterkt oxidatieve schade en daaropvolgende caspase-afhankelijke celdood
Metformine remt complex I van de elektronentransportketen, waardoor de elektronenstroom wordt belemmerd en superoxide wordt geproduceerd in de mitochondriale matrix. Aangezien DCA de opname van pyruvaat in de TCA-cyclus bevordert, veronderstelden wij dat DCA de ROS-productie zou kunnen versterken als een mogelijk mechanisme van zijn cytotoxische synergie met metformine. MitoSOX, een specifieke indicator van mitochondriale superoxideproductie, kleurde cellen die werden geanalyseerd met flowcytometrie. Na 1 uur behandeling verhoogden noch metformine (rode lijn Fig. 3a links) noch DCA (niet getoond) de mitochondriale superoxideproductie. Een gecombineerde behandeling met zowel DCA als metformine veroorzaakte echter een verschuiving naar rechts in de fluorescentie-intensiteit, wat duidt op een verhoogde superoxideproductie. Na 3 uur behandeling begonnen met metformine behandelde cellen verhoogde niveaus van mitochondriaal superoxide te produceren (rode lijn Fig. 3a rechterpaneel) in vergelijking met onbehandelde cellen (zwarte lijn). De combinatie van DCA en metformine liet nog grotere niveaus van superoxidekleuring zien. Deze resultaten wijzen erop dat metformine interfereert met het elektronentransport in complex I, wat leidt tot een verhoogde superoxideproductie, en dat DCA het effect van metformine versterkt.
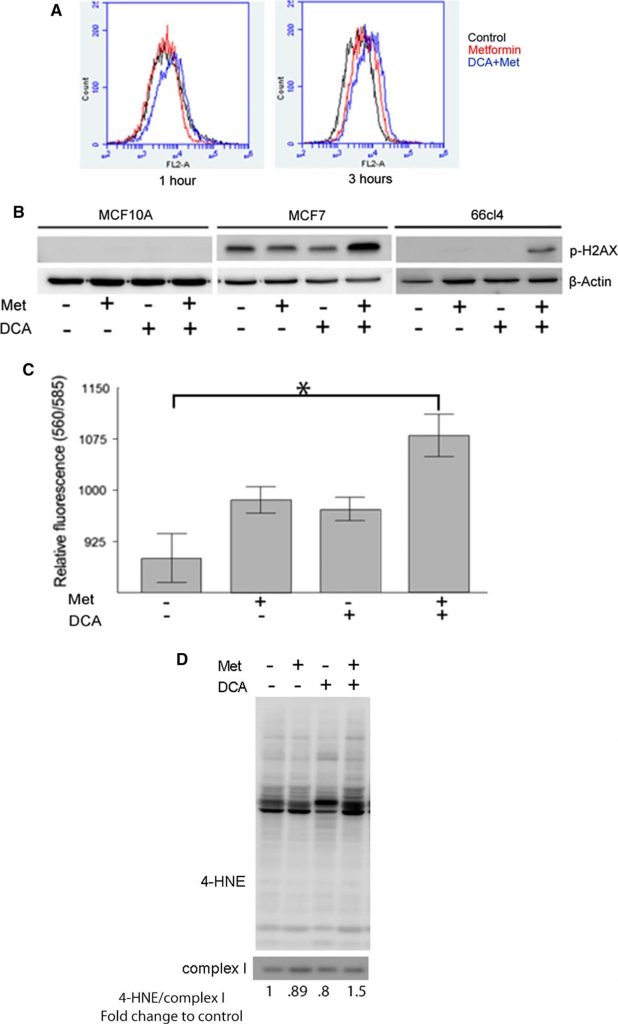
Accumulatie van superoxide en andere ROS kan schade toebrengen aan cellulaire componenten, waaronder eiwitten, membranen en DNA. Oxidatieve schade aan DNA kan leiden tot dubbelstrengsbreuken en fosforylering van histon H2AX (p-H2AX), een nuttige surrogaatmarker van dergelijke DNA-schade [31]. Om de met ROS-productie samenhangende DNA-schade in reactie op behandeling met metformine en DCA te schatten, kunnen de niveaus van gefosforyleerd H2AX worden geanalyseerd. De menselijke mammarepitheelcellen MCF10A en de borstkankercellijnen MCF7 en 66CL4 werden geanalyseerd door middel van western blotting na behandeling met DCA, metformine of een combinatie daarvan gedurende 24 uur (fig. 3b). In MCF10A cellen werden bij geen enkele behandeling detecteerbare hoeveelheden p-H2AX waargenomen. In MCF7 cellen was p-H2AX aanwezig in onbehandelde cellen en werd aanzienlijk verhoogd door de combinatie van metformine en DCA, maar niet door een van beide geneesmiddelen alleen. In 66CL4 cellen werd p-H2AX alleen waargenomen in met DCA en metformine medebehandelde cellen. Deze gegevens suggereren dat DCA en metformine samen de oxidatieve schade aan het DNA vergroten.
Als tweede bewijs hebben we de lipide peroxidatie gemeten, die optreedt wanneer vrije radicalen de lipiden in de celmembranen beschadigen. Er werden twee afzonderlijke methoden gebruikt om de mate van lipide-oxidatie na behandeling met DCA en metformine te schatten. Ten eerste de TBARS-test, die bijproducten van lipide peroxidatie meet en gebruikt wordt om de mate van oxidatieve schade aan celmembranen veroorzaakt door ROS te evalueren. TBARS nam toe in MCF7-cellen die alleen met metformine of DCA werden behandeld, en de grootste toename werd waargenomen wanneer beide geneesmiddelen werden gecombineerd (fig. 3c). De tweede methode die werd gebruikt om lipide-oxidatie te schatten was een western blot van 4-hydroxynonenol (4-HNE) eiwitadducten, die ontstaan door de oxidatie van onverzadigde vetzuren in celmembranen en covalente adducten vormen met eiwitten, hetgeen een indicatie geeft van oxidatieve schade aan celmembranen. MCF7 mitochondriale extracten van cellen behandeld met DCA, metformine of beide gedurende 24 uur werden geanalyseerd op 4-HNE eiwit adduct niveaus (Fig. 3d). Verhoogde niveaus van mitochondriale 4-HNE adducten werden alleen waargenomen in cellen behandeld met de combinatie van metformine en DCA. Dit ondersteunt de eerdere resultaten dat de combinatie van deze geneesmiddelen een verhoogde productie van ROS veroorzaakt.
Uit onze eerdere gegevens blijkt dat metformine-gevoelige cellen grote vacuolen ontwikkelen, waarvan door beeldvorming van GFP-gekoppelde mitochondriën en door elektronenmicroscopie werd vastgesteld dat het structureel veranderde mitochondriën zijn. Deze veranderde mitochondriën lijken specifiek verband te houden met een PARP-afhankelijke celdoodroute die vertraagd is ten opzichte van apoptotische celdood [20]. Aangezien DCA synergetisch werkt met metformine bij celdood, werden de effecten van DCA op de mitochondriale structuur onderzocht. Er werd een stabiele MCF7-cellijn ontwikkeld die een op mitochondriën gericht groen fluorescerend eiwit tot expressie brengt (pAcGFP1-Mito). De cellen werden gedurende één dag behandeld alvorens te worden afgebeeld met fasecontrast- en confocale microscopie (fig. 4). In cellen behandeld met metformine alleen, werden grote mitochondriën waargenomen, zoals eerder gezien [20]. In sterk contrast hiermee bleken de met DCA behandelde cellen kleinere en meer talrijke mitochondriën te hebben. Dichlooracetaat verhinderde ook mitochondriale vergroting veroorzaakt door metformine. In fasecontrast waren vergrote mitochondriën zichtbaar in de metformine behandelde cellen, terwijl ze afwezig waren in de combinatiebehandeling. Een tweede metformine-gevoelige cellijn, T47D, werd eveneens onderzocht. Ook hier werden vergrote mitochondriën waargenomen bij behandeling met metformine, terwijl deze afwezig waren bij de combinatiebehandeling.
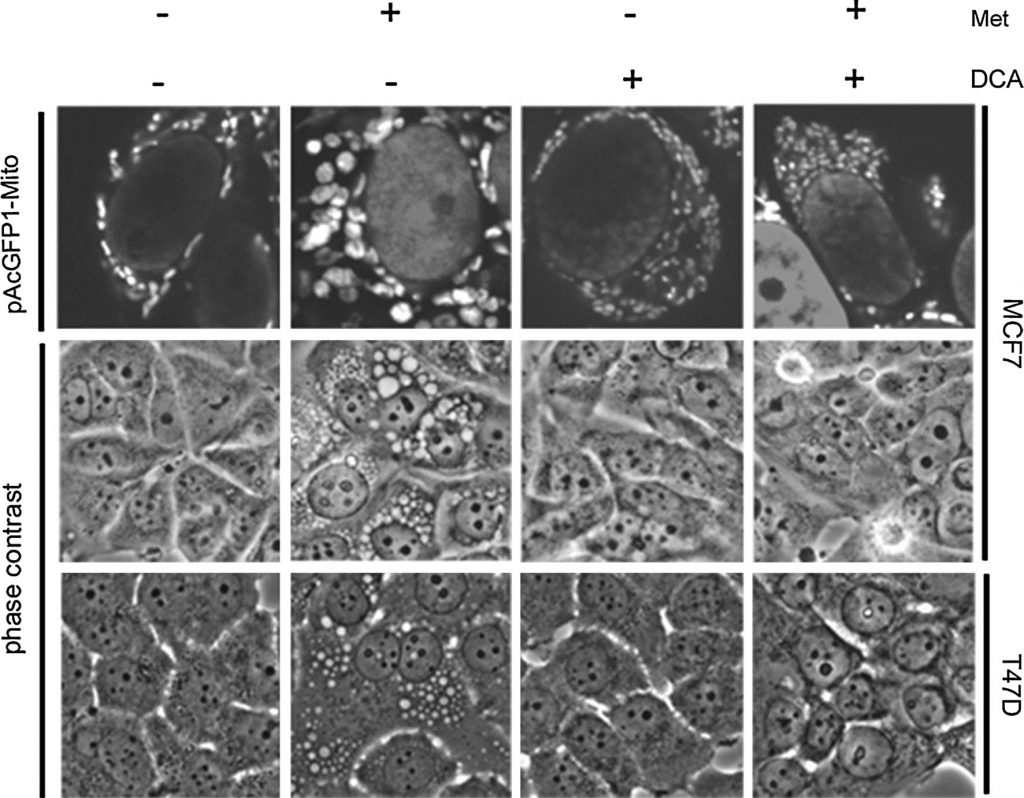
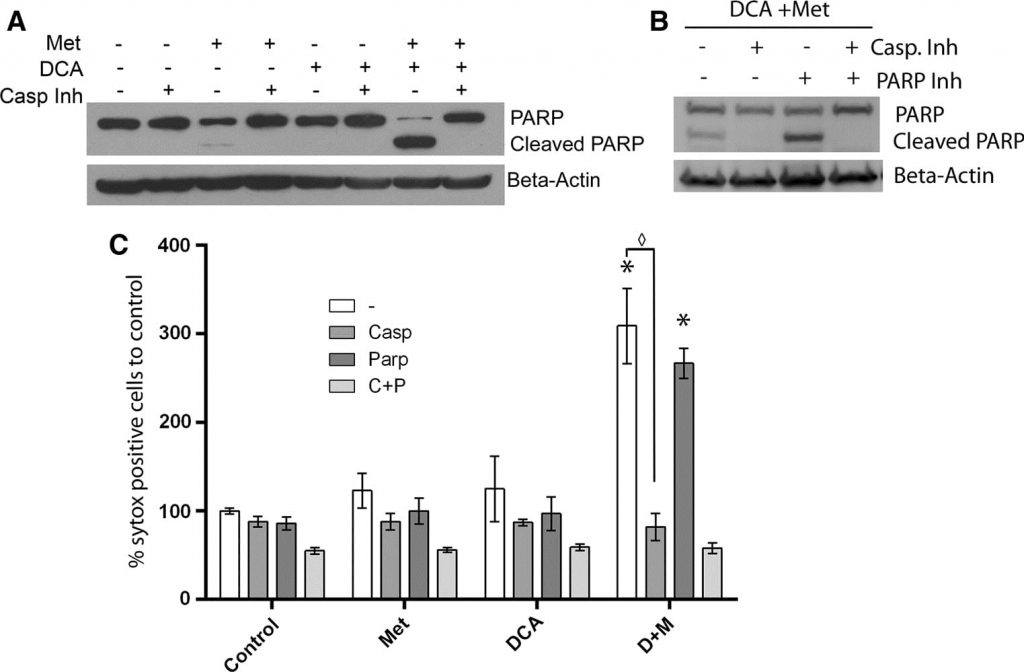
In ons eerdere werk vonden wij dat de vergroting van de mitochondriën gecorreleerd was met PARP-afhankelijke celdood, die vertraagd was ten opzichte van apoptotische celdood. Dit gaf aanleiding tot een onderzoek naar de specifieke kenmerken van het celdoodmechanisme geïnduceerd door DCA in combinatie met metformine [20], aangezien er geen mitochondriale vergroting wordt waargenomen. Om de celdood te karakteriseren in cellen die gelijktijdig met metformine en DCA werden behandeld, werden MCF7-cellen gedurende één dag behandeld met een onomkeerbare breedspectrum-caspaseremmer (Q-Val-Asp-OPh) in combinatie met DCA, metformine of beide. Western blotting (fig. 5a) toonde een grote toename van gekloofd PARP en een afname van intact PARP in de met DCA en metformine behandelde cellen. Toevoeging van de caspaseremmer blokkeerde de splitsing van PARP volledig. Een soortgelijk effect werd eerder gezien in cellen die gedurende 2,5 dag alleen met metformine werden behandeld [20]. Op het tijdstip van één dag induceert metformine alleen echter slechts een geringe toename van gekloofd PARP. Deze gegevens wijzen er dus op dat caspase-afhankelijke apoptose wordt versneld door toevoeging van DCA aan metformine in deze borstkankercellen. Om verder te onderzoeken of PARP-afhankelijke sterfte optreedt bij gelijktijdige behandeling van DCA en metformine, werd ook een PARP-remmer gebruikt. Twee dagen na de behandeling werd een SYTOX Green assay uitgevoerd (fig. 5c) om de celdood te kwantificeren en na te gaan of de PARP-remmer een additief effect had op de caspaseremmer. De PARP-remmer had geen beschermend effect op zichzelf, noch een additief effect samen met de caspaseremmer. Een western blot bevestigde deze bevinding (fig. 5b) en toonde aan dat de PARP-remmer de PARP-splitsing niet verhinderde. Aangezien mitochondriale vergroting gepaard gaat met PARP-afhankelijke celdood in metformine behandelde cellen, suggereert het ontbreken van mitochondriale vergroting bij toevoeging van DCA dat apoptose uitsluitend op een caspase-afhankelijke wijze plaatsvindt.
Bespreking
Metformine is een reeds lang bestaand geneesmiddel voor de behandeling van diabetes type twee. DCA is eveneens onderzocht in klinische proeven voor de behandeling van melkzuur en mitochondriale tekorten. Eerder is aangetoond dat metformine de proliferatie vertraagt en de celdood van vele kankercellijnen bevordert door apoptose [9, 10, 12, 32]. Metformine concentreert zich in de mitochondriën waar het complex I van de elektronentransportketen remt, waardoor een abnormale stroom van elektronen naar zuurstof ontstaat en superoxide in de mitochondriale matrix wordt geproduceerd [22, Fig. 3]. De productie van reactieve zuurstofspecies is problematisch voor borstkankercellen, aangezien veel van die cellen een lagere expressie hebben van mangaan superoxide dismutase (MnSOD), dat normaliter mitochondriaal superoxide elimineert [33]. Hoewel de pro-apoptotische en groeiremmende effecten van metformine op kanker opmerkelijk zijn, kan onze waarneming dat metformine de glycolyse versterkt, zoals blijkt uit de verhoogde lactaatproductie in vitro [21], de doeltreffendheid ervan als solo-middel beperken. Aangezien hoge lactaatniveaus beschreven zijn als tumorbevorderend en geassocieerd zijn met een slecht klinisch resultaat [26, 34-38], hebben wij getracht de metformine-geïnduceerde lactaatproductie te verminderen als een middel om de therapeutische werkzaamheid mogelijk te verbeteren. In deze studie vonden we dat DCA helpt om de lactaatproductie geïnduceerd door metformine te verminderen en dat DCA dit bereikt door remming van PDK1.
Onze gegevens tonen aan dat DCA en metformine synergetisch meer apoptose induceren dan metformine alleen. Onze gegevens tonen ook aan dat DCA pyruvaat omleidt naar gebruik in oxidatieve fosforylering, wat leidt tot accumulatie van ROS in de context van complex I remming door metformine. Wij concluderen dat deze toename van ROS-productie leidt tot de snellere apoptose.
In ons eerdere werk toonden wij aan dat metformine niet alleen caspase-afhankelijke apoptotische celdood induceerde, maar ook een later optredende PARP-afhankelijke celdood die aan het licht kwam wanneer een pan-caspase-remmer werd gebruikt [20]. Deze vorm van celdood ging gepaard met morfologische veranderingen in de mitochondriën. In dit onderzoek voorkwam DCA de mitochondriale morfologische veranderingen die anders door metformine zouden worden geïnduceerd, terwijl de medebehandeling ook leidde tot een snellere celdood. Bovendien voorkwam pan-caspase inhibitie bijna volledig celdood en elimineerde PARP-splitsing in verband met metformine en DCA co-behandeling. Samen wijst dit erop dat het celdoodmechanisme dat door de gelijktijdige behandeling wordt aangedreven, caspase-afhankelijke apoptose is, en dat de apoptose wordt versneld in vergelijking met metformine alleen. Het is mogelijk dat dit apoptoseproces te catastrofaal is en geen tijd nodig heeft of toestaat voor de mitochondriale vergroting die gepaard gaat met de PARP-afhankelijke celdood van metformine alleen.
Tijdens de voorbereiding van dit manuscript werd een studie van Choi en Lim [39] gepubliceerd die de co-behandeling van DCA en metformine in kankercellen onderzocht. Onze resultaten bevestigen en breiden de bevindingen van deze studie aanzienlijk uit. Terwijl de studie van Choi en Lim zich bijna volledig richtte op HeLa-cellen, toont onze studie de effectiviteit aan van de combinatie van DCA en metformine in meerdere borstkankercellijnen. Belangrijk is dat wij ook aantonen dat deze combinatie van geneesmiddelen de niet-getransformeerde borstepitheelcellen, MCF10A, niet doodt onder dezelfde omstandigheden waarin de geneesmiddelen de kankercellen doden. Wij hebben zorgvuldige titraties uitgevoerd die een zeer sterk synergisme aantonen van de geneesmiddelen bij het induceren van celdood in borstkankercellen. Deze resultaten wijzen erop dat DCA effectief zal zijn bij concentraties die therapeutisch kunnen worden bereikt bij mensen [27, 29], en bij veel lagere niveaus dan gebruikt in de experimenten in de studie van Choi en Lim (10-20 mM) [39]. Idealiter is de maximale dosis DCA die gebruikt wordt om kankercellen te behandelen laag genoeg om bijwerkingen zoals neuropathie te voorkomen. In een studie van Michelakis et al. werden DCA-serumniveaus bereikt van 0,5 mM bij glioblastomapatiënten die tweemaal daags 6,25 mg/kg oraal innamen [28]. Hogere doses zoals 25 mg/kg worden in verband gebracht met dosisafhankelijke neuropathie. Bijgevolg liggen de klinisch relevante concentraties waarschijnlijk in het bereik van 0,5-5 mM.
Zowel de hier gepresenteerde resultaten als die van Choi en Lim [39] toonden aan dat celdood door de combinatie van DCA en metformine geassocieerd is met oxidatieve stress. Wij tonen verder aan dat dit samenhangt met door metformine geïnduceerde superoxideproductie door mitochondriën. Dichlooracetaat verhoogt verder de mitochondriale superoxideproductie in aanwezigheid van metformine, wat leidt tot oxidatieve schade aan mitochondriën, cellulaire lipiden en DNA. Nieuwe combinaties zoals metformine en DCA zijn veelbelovend voor de uitbreiding van borstkankertherapieën.
Dankbetuigingen
Dit artikel werd ondersteund door subsidies van Susan G. Komen for the Cure (KG100497) en het National Cancer Institute van de National Institutes of Health (1R01CA180033). Flow Cytometry en Imaging Cores werden ondersteund door COBRE Grants P20GM103548 en P20GM103620 van het National Institute of General Medical Sciences van de National Institutes of Health.
Belangenverstrengeling
De auteurs verklaren dat zij geen belangenconflict hebben.
Ethische normen
De auteurs verklaren dat de experimenten voldoen aan de geldende wetten van het land waarin ze zijn uitgevoerd.
REFERENTIES
1 Warburg O (1956) Over het ontstaan van kankercellen. Science 123(80):309-314. doi:10.1016/S0306-9877(96)90136-X
2 DeBerardinis RJ, Lum JJ, Hatzivassiliou G, Thompson CB (2008) De biologie van kanker: metabole herprogrammering voedt celgroei en proliferatie. Cell Metab 7:11-20. doi:10.1016/j.cmet.2007.10.002
3 Zamzami N, Kroemer G (2001) The mitochondrion in apoptosis : how Pandora’ s box opens. Nat Rev Mol Cell Biol 2:67-71. doi:10.1038/35048073
4 Gottfried E, Kunz-Schughart LA, Ebner S et al (2006) Tumor-derived lactic acid modulates dendritic cell activation and antigen expression. Blood 107:2013-2021. doi:10.1182/blood-2005-05-1795
5 Fischer K, Hoffmann P, Voelkl S et al (2007) Inhibiting effect of tumor cell-derived lactic acid on human T cells. Bloed 109:3812-3819. doi:10.1182/blood-2006-07-035972
6 Jiralerspong S, Palla SL, Giordano SH et al (2009) Metformine en pathologische complete respons op neoadjuvante chemotherapie bij diabetespatiënten met borstkanker. J Clin Oncol 27:3297-3302. doi:10.1200/JCO.2009.19.6410
7 Evans JMM, Donnelly LA, Emslie-Smith AM et al (2005) Metformin and reduced risk of cancer in diabetic patients. BMJ 330:1303-1304. doi:10.1136/bmj.38393.572188.EB
8 Libby G, Donnelly LA, Donnan PT et al (2009) Nieuwe gebruikers van metformine hebben een laag risico op het optreden van kanker. Diabetes Care 32:1620-1625. doi:10.2337/dc08-2175
9 Zakikhani M, Dowling R, Fantus IG et al (2006) Metformine is een AMP kinase-afhankelijke groeiremmer voor borstkankercellen. Cancer Res 66:10269-10273. doi:10.1158/0008-5472.CAN-06-1500
10 Isakovic A, Harhaji L, Stevanovic D et al (2007) Dual antiglioma action of metformin: cell cycle arrest and mitochondria-dependent apoptosis. Cell Mol Life Sci 64:1290-1302. doi:10.1007/s00018-007-7080-4
11 Hadad SM, Appleyard V, Thompson AM (2008) Therapeutische metformine/AMPK activering bevordert het angiogene fenotype in het ERα-negatieve MDA-MB-435 borstkankermodel. Breast Cancer Res Treat 114:391. doi:10.1007/s10549-008-0016-3
12 Buzzai M, Jones RG, Amaravadi RK et al (2007) Systemische behandeling met het antidiabeticum metformine vermindert selectief de groei van p53-deficiënte tumorcellen. Cancer Res 67:6745-6752. doi:10.1158/0008-5472.CAN-06-4447
13 Sarbassov DD, Ali SM, Sabatini DM (2005) Groeiende rollen voor de mTOR pathway. Curr Opin Cell Biol 17:596-603. doi:10.1016/j.ceb.2005.09.009
14 Zhuang Y, Miskimins WK (2008) Cell cycle arrest in Metformin treated breast cancer cells involves activation of AMPK, downregulation of cyclin D1, and requires p27Kip1 or p21Cip1. J Mol Signal 3:1-11. doi:10.1186/1750-2187-3-18
15 Hinke SA, Martens GA, Cai Y et al (2007) Methylsuccinaat antagoneert biguanide-geïnduceerde AMPK-activatie en sterfte van pancreas-bètacellen door herstel van mitochondriale elektronenoverdracht. Br J Pharmacol 150:1031-1043. doi:10.1038/sj.bjp.0707189
16 Zou M-H, Kirkpatrick SS, Davis BJ et al (2004) Activering van het AMP-geactiveerd proteïne kinase door het antidiabeticum metformine in vivo. Rol van mitochondriale reactieve stikstofspecies. J Biol Chem 279:43940-43951. doi:10.1074/jbc.M404421200
17 Owen MR, Doran E, Halestrap AP (2000) Evidence that metformin exert its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain. Biochem J 614:607-614. doi:10.1042/0264-6021:3480607
18 Carvalho C, Correia S, Santos MS et al (2008) Metformine bevordert de aantasting van geïsoleerde mitochondriën van de rattenlever. Mol Cell Biochem 308:75-83. doi:10.1007/s11010-007-9614-3
19d Kefas BA, Cai Y, Kerckhofs K et al (2004) Metformine-geïnduceerde stimulatie van AMP-geactiveerd proteïne kinase in beta-cellen schaadt hun glucose-reactievermogen en kan leiden tot apoptose. Biochem Pharmacol 68:409-416. doi:10.1016/j.bcp.2004.04.003
20 Zhuang Y, Miskimins WK (2012) Metformine induceert zowel caspase-afhankelijke als poly(ADP-ribose) polymerase-afhankelijke celdood in borstkankercellen. Mol Cancer Res 9:603-615. doi:10.1158/1541-7786.MCR-10-0343.Metformine
21 Bailey CJ, Wilcock C, Day C (1992) Effect van metformine op het glucosemetabolisme in het splanchnische bed. Br J Pharmacol 105:1009-1013
22StacpoolePW, Lorenz AC, Thomas RG, Harman EM (1988) Dichloroacetate in the treatment of lactic acidosis. Ann Intern Med 108:58-63. doi:10.1056/NEJM198308183090702
23 Whitehouse BSUE, Cooper RH, Randle PJ (1974) Mechanisme van activering van pyruvaatdehydrogenase door dichlooracetaat en andere gehalogeneerde carbonzuren. Biochem J 141:761-774. doi:10.1056/NEJM198308183090702
24 Hussien R, Brooks GA (2011) Mitochondrial and plasma membrane lactate transporter and lactate dehydrogenase isoform expression in breast cancer cell lines. Physiol Genomics 43:255-264. doi:10.1152/physiolgenomics.00177.2010
25 Kim J, Tchernyshyov I, Semenza GL, Dang CV (2006) HIF-1-gemedieerde expressie van pyruvaat dehydrogenase kinase: een metabole schakelaar die nodig is voor cellulaire aanpassing aan hypoxie. Cell Metab 3:177-185. doi:10.1016/j.cmet.2006.02.002
26 Wigfield SM, Winter SC, Giatromanolaki A et al (2008) PDK-1 regelt de lactaatproductie in hypoxie en is geassocieerd met een slechte prognose in hoofd-hals squameuze kanker. Br J Cancer 98:1975-1984. doi:10.1038/sj.bjc.6604356
27 Stacpoole PW, Kurtz TL, Han Z, Langaee T (2008) Role of dichloroacetate in the treatment of genetic mitochondrial diseases. Adv Drug Deliv Rev 60:1478-1487. doi:10.1016/j.addr.2008.02.014
28 Michelakis ED, Sutendra G, Dromparis P et al (2010) Metabole modulatie van glioblastoom met dichlooracetaat. Sci Transl Med 2:31ra34. doi:10.1126/scitranslmed.3000677
29 Mori M, Yamagata T, Goto T et al (2004) Dichlooracetaatbehandeling voor mitochondriale cytopathie: langetermijneffecten in MELAS. Brain Develop 26:453-458. doi:10.1016/j.braindev.2003.12.009
30 Chou T (2010) drug combination studies and their synergy quantification using the Chou-Talalay Method drug combination studies and their synergy quantification using the Chou-Talalay Method. Cancer Res 70:440-446. doi:10.1158/0008-5472.CAN-09-1947
31 Mah L, Karagiannis TC (2010) γH2AX: een gevoelige moleculaire marker van DNA-schade en -herstel. Leukemie 24:679-686. doi:10.1038/leu.2010.6
32 Alimova IN, Liu B, Fan Z et al (2009) Metformine remt borstkankercelgroei, kolonievorming en induceert celcyclusstilstand in vitro. Cell Cycle 8:909-915. doi:7933 [pii]
33 Soini Y, Vakkala M, Kahlos K et al (2001) MnSOD-expressie komt minder vaak voor in tumorcellen van invasieve borstcarcinomen dan in situ carcinomen of niet-neoplastische borstepitheelcellen. J Pathol 195:156-162. doi:10.1002/path.946
34 Walenta S, Wetterling M, Lehrke M et al (2000) High lactate levels predict likelihood of metastases, tumor recurrence, and restricted patient survival in human cervical cancers high lactate levels predict likelihood of metastases, tumor recurrence, and restricted patient survival in human cervical. Kankeronderzoek 60:916-921
35 Leek R, Harris AL (2009) Lactate dehydrogenase 5 expression in squamous cell head and neck cancer relates to prognosis following radical or postoperative radiotherapy. Oncology 77:285-292. doi:10.1159/000259260
36 Isidoro A, Casado E, Redondo A et al (2005) Borstcarcinomen voldoen aan de Warburg-hypothese en leveren metabole markers voor kankerprognose. Carcinogenesis 26:2095-2104. doi:10.1093/carcin/bgi188
37 Isidoro A, Martínez M, Fernández PL et al (2004) Verandering van het bio-energetisch fenotype van mitochondriën is een kenmerk van borst-, maag-, long- en slokdarmkanker. Biochem J 378:17-20. doi:10.1042/BJ20031541
38 Walenta S, Schroeder T (2004) Lactaat in vaste kwaadaardige tumoren: potentiële basis van een metabole classificatie in de klinische oncologie. Curr Med Chem 11:2195-2204
39 Choi YW, Lim IK (2014) Sensibilisering van metformine-cytotoxiciteit door dichlooracetaat via herprogrammering van het glucosemetabolisme in kankercellen. Cancer Lett 346:300-308. doi:10.1016/j.canlet.2014.01.015
Gerelateerde inhoud: