Jason Y.Y. Wong1, Gordon S. Huggins2, Marcella Debidda4, Nikhil C. Munshi4, en Immaculata De Vivo1,3
1 Channing Laboratorium, Afdeling Geneeskunde, Brigham and Women’s Hospital en Harvard Medical School, Boston Massachusetts.
2 Molecular Cardiology Research Institute, Tufts-New England Medical Center, Boston Massachusetts.
3 Programma voor moleculaire en genetische epidemiologie, Harvard School of Public Health, Boston Massachusetts.
4 Het Jerome Lipper Multiple Myeloma Center, Afdeling Medische Oncologie, Dana-Farber Cancer Institute, Harvard Medical School, Boston Massachusetts.
Correspondentie: Immaculata De Vivo, Brigham and Women’s Hospital, Department of Medicine, Channing Laboratory, 181 Longwood Ave, Boston, MA, 02115, USA. Telefoon: 617-525-2094. Fax: 617-525-2008. [email protected].
Ontvangen: 14 september 2020
Aanvaard: 4 december 2020
Gepubliceerd: 9 december 2020
Abstract
Doel: Een recente baanbrekende studie toonde aan dat behandeling met dichlooracetaat (DCA) apoptose bevorderde in long-, borst- en glioblastoomkankercellijnen door het metabolisme te verschuiven van aerobe glycolyse naar glucoseoxidatie gekoppeld aan hermodellering van de NFAT-Kv1.5-as. Het doel van deze studie was na te gaan of DCA apoptose induceert in endometriumkankercellen en het apoptosemechanisme te beoordelen.
Methoden: Een panel van endometriumkankercellijnen met verschillende mate van differentiatie werd behandeld met DCA en geanalyseerd op apoptose via flowcytometrie. Biologische correlaten zoals genexpressie, intracellulair Ca2+ en mitochondriaal membraanpotentieel werden onderzocht om het apoptosemechanisme te beoordelen.
Resultaten: Apoptose werd waargenomen bij vijf weinig tot matig invasieve kankercellijnen, waaronder Ishikawa, RL95-2, KLE, AN3CA en SKUT1B, terwijl de behandeling geen effect had op niet-kankerachtige 293T-cellen. Twee zeer invasieve endometriumadenocarcinoma-cellijnen, HEC1A en HEC1B, bleken resistent tegen door DCA geïnduceerde apoptose. Apoptotisch reagerende cellijnen hadden een significante toename van vroege en late apoptose, een afname van de mitochondriale membraanpotentiaal en een verminderde overvloed aan Survivin-transcripten, die consistent zijn met een mitochondriaal gereguleerd mechanisme. DCA-behandeling verlaagde de intracellulaire calciumniveaus in de meeste apoptotisch reagerende cellijnen, wat wijst op een bijdrage van de NFAT-Kv1.5-gemedieerde pathway. DCA-behandeling verhoogde p53 upregulated modulator of apoptosis (PUMA) transcripten in cellijnen met een apoptotische respons, hetgeen wijst op betrokkenheid van een p53-PUMA-gemedieerd mechanisme.
Trefwoorden: Dichlooracetaat; Endometrium; Kanker; Apoptose; Mitochondriën
Verklaring inzake belangenverstrengeling: De auteurs verklaren dat er geen belangenconflicten zijn.
Conclusies: Dichlooracetaat sensibiliseert effectief de meeste endometriumkankercellijnen voor apoptose via mitochondriale, NFAT-Kv1.5 en PUMA-gemedieerde mechanismen. Verder onderzoek naar het kankertherapeutisch potentieel van DCA is gerechtvaardigd.
MMP is verder bevestigd via TMRM fluorescerende kleuring in een DCA dosis-respons experiment. Foutbalken vertegenwoordigen de standaardfout van 2 onafhankelijke experimenten uitgevoerd in drievoudige putten.
INLEIDING
Endometriumkanker (EC) is een neoplasie van de epitheliale bekleding van de baarmoeder. Het is de meest voorkomende gynaecologische maligniteit in de Verenigde Staten en de vierde belangrijkste doodsoorzaak door kanker bij vrouwen [1]. Er zijn weinig therapeutische opties zonder ernstige nadelen voor mensen met terugkerende of uitgezaaide endometriumkanker. Chemotherapie voor uitgezaaide ziekte heeft hoge percentages toxiciteit, neuralgie en cardiale complicaties[2, 3]. De impuls voor de toekomstige ontwikkeling van kankertherapieën zal zijn om ernstige bijwerkingen te verminderen en tegelijkertijd een vergelijkbare of betere werkzaamheid aan te tonen dan de bestaande behandelingen.
Aërobe glycolyse, ook bekend als het ‘Warburg-effect’, is een unieke eigenschap van de meeste vormen van kanker. Dit verschijnsel wordt gekenmerkt door een verhoogde glucose-opname en afhankelijkheid van glycolyse voor ATP-productie ondanks een beschikbare zuurstofbron [5]. Aërobe glycolyse wordt verondersteld het resultaat te zijn van mitochondriale disfunctie die apoptotische resistentie in kankercellen tot gevolg heeft [6]. Deze apoptotische weerstand is het gevolg van hyperpolarisatie van het mitochondriale membraan, waardoor pro-apoptotische mediatoren niet kunnen vrijkomen uit de mitochondriën naar het cytoplasma [ 4]. Hypergepolariseerde mitochondriale membranen zijn kenmerkend voor de meeste carcinomen en de omkering ervan gaat gepaard met de initiatie van apoptose [7,8].
Therapeutisch richten op aërobe glycolyse is een nieuw middel om kankercellen aan te pakken. De belangrijkste regulator van het cellulaire metabolisme is pyruvaatdehydrogenase (PDH), dat op zijn beurt wordt geremd door pyruvaatdehydrogenase kinase (PDK). Een recente studie toonde aan dat de activiteit van PDK in kankercellijnen kan worden gedownreguleerd door DCA [4]. Bij metabolische targeting door DCA zijn twee synergetische mechanismen betrokken, de proximale en distale pathways [4]. In de proximale (mitochondriaal-gereguleerde) route bindt DCA aan PDK en vermindert het de remming van de PDH-activiteit. De verhoogde PDH-activiteit verschuift het metabolisme van glycolyse naar glucose-oxidatie en vermindert de hyperpolarisatie van de mitochondriale membraanpotentiaal (MMP), waardoor mitochondriale overgangsporiën (MTP’s) worden geopend. Dit maakt de translocatie van reactieve zuurstofsoorten (ROS) en cytochroom c van de mitochondriën naar het cytoplasma mogelijk, en induceert vervolgens apoptose door de activering van caspases [4]. In de distale (NFAT-Kv1.5) pathway verwijdt getranslokeerde ROS de Kv1.5 kaliumionenkanalen op het plasmamembraan. De uitzetting van kaliumionen hyperpolariseert de cel, waardoor spanningsafhankelijke Ca2+-intrede wordt voorkomen. Het verlaagde intracellulaire Ca2+ niveau remt de activering van NFAT, waardoor de Kv1.5 expressie verder toeneemt; hierdoor ontstaat een positieve feedback loop die uiteindelijk resulteert in verminderde tonische inhibitie van caspases [4].
Er is een aanzienlijke wisselwerking tussen de mitochondriale en de p53-gemedieerde apoptose pathways. p53-upregulatedmodulator of apoptosis (PUMA) is zo’n pro-apoptotisch eiwit dat de interactie overbrugt tussen mitochondriale en p53 tumorsuppressor-gemedieerde mechanismen. PUMA is lid van de BH3-only familie van eiwitten waarvan de expressie transcriptioneel geregeld wordt door p53 [9-11]. Bij activering door verschillende apoptotische prikkels transloceert PUMA naar het mitochondriale membraan, waar het de pro-survival Bcl-2 eiwitten tegenwerkt door binding aan zijn BH3 domein, waardoor cytochroom c vrijkomt en apoptose wordt bevorderd [10,12]. In recente knock-out studies is vastgesteld dat PUMA een kritische mediator is van p53-afhankelijke apoptose in muriene thymocyten en menselijke colorectale kankercellen [13,14].
Van dichlooracetaat is in talrijke studies aangetoond dat het de oxidatie van glucose bevordert bij verschillende mitochondriale aandoeningen [15,16]. Bovendien bleek de behandeling met DCA mildere bijwerkingen te hebben in klinische studies van mitochondriale encefalomyopathieën dan die van de huidige therapieën tegen endometriumkanker [17]. Tot op heden is het effect van DCA bestudeerd in een beperkt aantal kankercellijnen en is ons inzicht in alternatieve apoptotische mechanismen die door DCA worden gereguleerd ontoereikend. Het doel van onze studie was te bepalen of DCA een panel van endometriumkankercellijnen gevoelig maakt voor apoptose en de bijdrage van de mitochondriaal-gereguleerde, NFAT-Kv1.5, en PUMA mechanismen in het apoptoseproces te beoordelen door biologische correlaten te onderzoeken.
Materialen en methoden
Celcultuur
AN3CA, SKUT1B, RL95-2, KLE, HEC1A en HEC1B cellijnen werden gekocht van American Type Culture Collection (Manassas, VA) en de Ishikawa cellijn werd gekocht van Sigma-Aldrich (St. Louis, MO). De 293T nierepitheelcellen die dienden als niet-kankerachtige, gezonde controles werden geleverd door Nikhil Munshi. MCF7 borstepitheliaal adenocarcinoom was een gift van Ramon Parsons (Columbia University). De cellijnen werden vermeerderd volgens de voorwaarden van de distributeur. De cellijnen werden onderhouden in een 37°C, 5%CO2 bevochtigde incubator. DMEM, McCoy’s 5A, MEM, en DMEM-F12 groeimedia samen met penicilline-streptomycine en insuline supplementen werden gekocht van Gibco-Invitrogen (Carlsbad, CA). Dichlooracetaat (Alfa Aesar, Ward Hill, MA) werd opgelost tot een 1M werkoplossing, gefilterd en vervolgens verdund tot behandelingsconcentraties in groeimedia.
Levensvatbaarheid van cellen
De levensvatbaarheid van cellen werd gemeten met het CellTiter-Blue-reagens (Promega), dat het vermogen meet van gezonde, levensvatbare cellen om een resazurinesubstraat te metaboliseren tot een fluorescerend resorufineproduct. Kortom, 3×104 cellen van elke cellijn werden uitgezet in ondoorzichtige 96-wells weefselkweekplaten en geïncubeerd in standaard groeicondities gedurende een nacht tot 60-70% confluentie. De media in elk putje werd vervolgens vervangen door verse groeimedia met toenemende concentraties DCA (0 mM, 1 mM, 5 mM, 10 mM). Elk putje werd in drievoud uitgevoerd in twee of meer onafhankelijke experimenten voor elke cellijn. Na de behandeling werden de platen gedurende 40 uur bij 37 °C geïncubeerd, waarna 20 µL Resazurinesubstraat rechtstreeks aan elk putje werd toegevoegd en nog eens 3 uur werd geïncubeerd. De platen werden vervolgens afgelezen op een Molecular Devices Gemini XPS plate reader (Sunnyvale, CA) bij 560/590 nm.
Apoptosetests
Flowcytometrie met Annexin-V-FITC (BD Bioscience, San Jose, CA) en 7-amino-actinomycine D (7-AAD) kleuring werd gebruikt om te bepalen of de behandeling specifiek vroege apoptose induceert. Kort gezegd werden voor elke cellijn 5×105 cellen uitgezaaid in 6-well weefselkweekplaten en een nacht geïncubeerd tot 60-70% confluentie onder standaard groeiomstandigheden. Media voor elke cellijn werd vervolgens vervangen door verse groeimedia met en zonder een 10 mM dosis DCA. Behandelingsgroepen voor elke cellijn werden driemaal herhaald. De cellen werden vervolgens gedurende 40 uur bij 37 °C geïncubeerd en geoogst met 0,25% trypsine-EDTA (Invitrogen, Carlsbad, CA). De cellen werden gewassen met 1X PBS en vervolgens gekleurd volgens het protocol van de fabrikant. Flowcytometrie werd uitgevoerd op een BD FACSCanto II (BD Bioscience) en de gegevens werden geanalyseerd met FlowJo 7.2.2 (Tree Star, Ashland, OR) en BD FACSDiva 6.0 software (BD Bioscience).
De Apoptag Peroxidase Terminal dUTP Nick-end Labeling (TUNEL) assay kit (Millipore, Billerica, MA) werd gebruikt om apoptotische cellen te visualiseren die caspase-afhankelijke genomische fragmentatie hadden ondergaan. Kort gezegd werden 5×104 cellen van verschillende representatieve endometriumkankercellijnen gezaaid en vermeerderd op 4-wells kamerglaasjes (Nunc, Rochester, NY) gedurende één nacht. De media in elk putje werd vervolgens vervangen door verse groeimedia met of zonder 10 mM DCA. Na 48 uur werden de cellen gefixeerd met 1% paraformaldehyde en gekleurd volgens het protocol van de fabrikant. Kleuring werd uitgevoerd door de Dana Farber – Harvard Cancer Center Pathology Core faciliteit. Beelden werden vastgelegd bij 40X objectief op een Zeiss Axioskop 2 Plus microscoop (Thornwood, NY) met AxioVs40 v.4.4.1.0 software bij 24-bit RGB.
Celproliferatietest
Stroomcytometrie met broomodeoxyuridine (BrdU) (BD Bioscience) en 7-AAD-kleuring werd gebruikt om de celproliferatie te meten. Kort gezegd werden verschillende representatieve endometriumkankercellijnen vermeerderd zoals hierboven beschreven voor de Annexine-V-test. De cellen werden vervolgens gedurende 8 uur van serum ontdaan in groeimedia met 0,5% FBS om de celcyclus terug te zetten naar de G0-fase. De media werden vervolgens veranderd in normale groeimedia met en zonder 10 mM DCA-behandeling. Na 24 uur werden de cellen gedurende 2 uur gepulst met 10 µM BrdU in groeimedia. De cellen werden vervolgens geoogst, gekleurd en geanalyseerd volgens het protocol van de fabrikant.
Mitochondriale membraanpotentiaal testen
Mitochondrialemembraanpotentiaal werd gedetecteerd met de Mitocapture Apoptosis Detection Kit (Calbiochem). Groei, behandeling en experimentele indeling van de cellijnen waren identiek aan de hierboven beschreven Annexine-V-test. Na een incubatieperiode van 24 uur na behandeling met en zonder 10 mM DCA werden de cellen geoogst en gewassen met 1X PBS en gekleurd met Mitocapture-reagens volgens het protocol van de fabrikant en geanalyseerd via flowcytometrie. Een gewijzigde versie van een protocol waarbij mitochondriën worden gekleurd met tetramethyl rhodamine methylester (TMRM) (Invitrogen, Carlsbad, CA), elders beschreven, werd ook gebruikt om MMP te beoordelen [18]. Kortom, de cellen werden vermeerderd en behandeld precies zoals de hierboven beschreven levensvatbaarheidstest. Na een incubatieperiode van 24 uur werden 5×104 cellen geïsoleerd, gewassen in 1X PBS en geresuspendeerd in Hanks gebufferde zoutoplossing (HBSS) (Sigma-Aldrich, St. Louis, MA) met 50 nM TMRM en gedurende 30 minuten bij 37°C geïncubeerd. De cellen werden overgebracht naar een ondoorzichtige 96-wells plaat en de fluorescentie werd gemeten bij 530/620 nm bij 37°C met behulp van een plaatlezer.
Intracellulaire calciumniveaus
Intracellulaire calciumniveaus werden gemeten met behulp van de FLUO-4 NW Calcium Assay (Invitrogen). Kort gezegd werden voor elke cellijn 3×104 cellen uitgezet in afzonderlijke ondoorzichtige 96-wells weefselkweekplaten en gedurende 8 uur geïncubeerd in standaard groeiomstandigheden. De media in elk putje werd vervolgens vervangen door verse groeimedia met toenemende concentraties DCA. Elke behandelingsgroep werd herhaald in 4 putjes in ten minste 2 onafhankelijke experimenten. Na 8 uur incubatie werden de cellen in elk putje behandeld met FLUO-4-reagens volgens het protocol van de fabrikant. De platen werden vervolgens op een fluorescentieplaatlezer afgelezen bij 494/516 nm.
Real Time PCR
Real-time kwantitatieve PCR werd gebruikt om de overvloed aan endogene Survivin- en PUMA-transcripten te detecteren. Een totaal van 1×106 cellen voor elke cellijn werd gezaaid en gekweekt in 10cm weefselkweekplaten gedurende een nacht. Vervolgens werd de media vervangen door verse groeimedia met of zonder 10 mM DCA-behandeling. Na 40 uur incuberen werden 3×106 cellen voor elke plaat geoogst en werd totaal RNA geëxtraheerd met behulp van RNeasy Plus Mini Kit (Qiagen, Valencia, CA) volgens het protocol van de fabrikant. Eerste-streng cDNA werd gesynthetiseerd met 1000 ng totaal RNA en Oligo dT-primers met behulp van Superscript III Reverse Transcriptase (Invitrogen) volgens het protocol van de fabrikant. Het cDNA-product werd vervolgens behandeld met RNase H gedurende 20 minuten bij 37°C en verdund tot 100 ng/µL. De concentraties RNA en cDNA werden nauwkeurig bepaald met een Nanodrop ND-1000 spectrofotometer (Wilmington, DE).
De primer-sequenties voor Survivin waren voorwaarts 5′-AAGAACTGGCCCTTCTTGGA-3′ en achterwaarts 5′- CAACCGGACGAATGCTTTT-3′ (Primerbank). De primer-sequenties voor PUMA en het RPLP0-huishoudgen zijn beschreven in eerdere studies [19, 20]. De reactiemengsels bestonden uit 1X Applied Biosystems SYBR Green PCR mix (Foster City, CA), 1,5 mM MgCl2, 0,42 mM dNTPs, 5U ABI Amplitaq Gold, 200 ng cDNA template, en 333 nM van forward en reverse primers. Reacties werden uitgevoerd in drievoud in twee gerepliceerde experimenten. De fietsomstandigheden waren 1 cyclus bij 95C voor 10:00, 33x cycli van 95C voor 0:30, 55C voor 0:30, en 72C bij 0:30. Een vijfpuntsstandaardcurve voor de reacties had lineaire hellingen van -3,2 +/- 0,1 met correlatiecoëfficiënten (r2) boven 0,985. De test werd uitgevoerd met een ABI 7300 Real-Time PCR-systeem (Foster City, CA). De relatieve kwantificering van de doeltranscripten genormaliseerd naar RPLP0 werd beoordeeld met ABI 7300 Real-Time PCR Systems RQ Study Software met behulp van de vergelijkende Ct-methode.
Statistische analyse
Studententest en eenzijdige ANOVA werden gebruikt om de verschillen tussen de behandelingsarmen te evalueren. Een p-waarde onder 0,05 werd als significant beschouwd. De analyse werd uitgevoerd met Microsoft Excel 2007 (Redmond, WA). Grafieken werden gemaakt met GraphPad Prism 5 (San Diego, CA).
Resultaten
DCA vermindert de levensvatbaarheid van endometriumkankercellen op dosisafhankelijke wijze
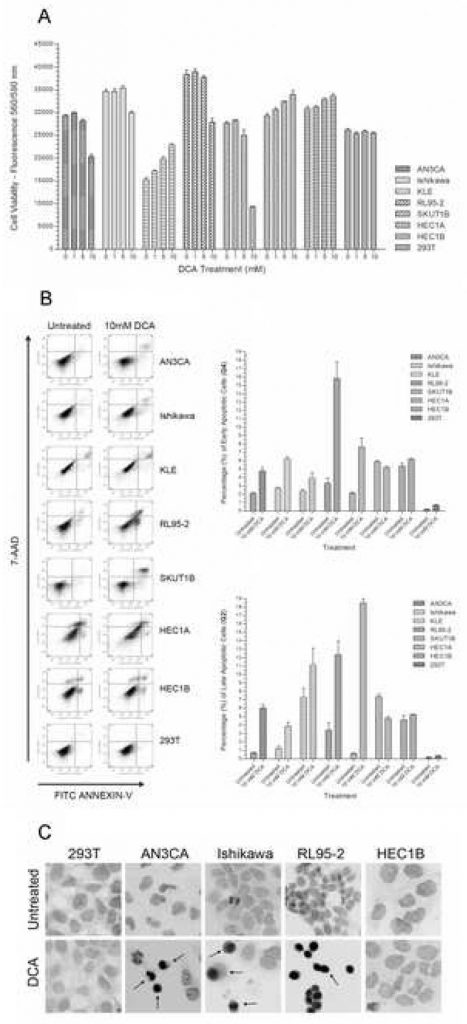
Om het effect van DCA op de levensvatbaarheid van endometriumkankercellen te bepalen, werd elke cellijn gekweekt met toenemende doses DCA. In een panel van zeven endometriumkankercellijnen vertoonden AN3CA, Ishikawa, RL95-2 en SKUT1B een afname van de levensvatbaarheid met 15% – 75% bij toenemende DCA-concentratie (figuur 1A). De vermindering van de levensvatbaarheid voor de meeste van de reagerende cellijnen bereikte significantie bij de dosis van 10 mM. Een vergelijking tussen de onbehandelde groep en de met 10 mM DCA behandelde groep had p-waarden < 0,01 voor AN3CA, Ishikawa, RL95-2 en SKUT1B. Een marginaal significante afname van de levensvatbaarheid werd gezien bij de dosis van 5 mM voor AN3CA en RL95-2. Daarom werd bij benadering een effectieve minimumdosis DCA voor deze endometriale cellijnen tijdens de behandelingsperiode vastgesteld tussen 5mM en 10mM. Deze DCA-dosisconcentratie en behandelingstijd liggen binnen het effectieve bereik van eerder gepubliceerde in-vitro-experimenten [21]. Bij HEC1A, HEC1B en KLE werd een statistisch significante toename van de levensvatbaarheid waargenomen met toenemende DCA-concentraties (p < 0,02). Zoals verwacht werd geen statistisch significant verschil in levensvatbaarheid waargenomen bij de 293T epitheelcellen bij de gegeven DCA-dosisrange en behandelingsperiode (p = 0,27).
Het effect van DCA op de proliferatie van endometriumkankercellen is cellijnafhankelijk
Om te bepalen of de waargenomen afname van de levensvatbaarheid van de cellen met DCA-behandeling het gevolg was van een effect op de celproliferatie, werd een BrdU / 7-AAD-kleuring uitgevoerd op verschillende representatieve cellijnen en geanalyseerd via flowcytometrie. In Ishikawa, HEC1B en 293T epitheelcellen werd met DCA-behandeling geen significant verschil in celcyclusdynamiek of proliferatie waargenomen (tabel 1). In AN3CA verhoogde behandeling met DCA de proliferatie, zoals blijkt uit een significante toename van het aantal cellen in de fasen S en G2/M en minder cellen in G0/G1. In RL95-2 cellen verminderde behandeling met DCA significant het aantal cellen in de S- en G2/M-fase en nam het aantal cellen in de G0/G1-fase toe; dit wijst op verminderde proliferatie en celcyclusstilstand in een senescente of quiescente toestand.
| Cellijn / Behandeling | % S-fase | Stdev S-fase | % G0 / G1-fase | Stdev G0/G1 | % G2 / M-fase | Stdev G2 / M Fase |
|---|---|---|---|---|---|---|
| 293T Onbehandeld | 60.6 | 0.6 | 33.2 | 1.7 | 6.2 | 1.25 |
| 293T DCA | 58.1 | 2.2 | 31.7 | 2.2 | 10.2 | 0.34 |
| p-waarde | 0.15 | 0.14 | 0.03 | |||
| Ishikawa Onbehandeld | 61.3 | 0.4 | 27.4 | 1.8 | 11.3 | 0.96 |
| Ishikawa DCA | 65.9 | 4.5 | 22.9 | 4.9 | 11.2 | 0.68 |
| p-waarde | 0.21 | 0.25 | 0.96 | |||
| HEC1B Onbehandeld | 37.4 | 2.7 | 41.5 | 0.8 | 21.2 | 1.93 |
| HEC1B DCA | 42.4 | 1.5 | 34.8 | 3.6 | 22.8 | 2.15 |
| p-waarde | 0.19 | 0.08 | 0.47 | |||
| AN3CA Onbehandeld | 43.5 | 0.6 | 50.6 | 2.0 | 5.9 | 1.80 |
DCA bevordert apoptose in endometriumkankercellen
Om te bepalen of de vermindering van de levensvatbaarheid van de cellen door DCA-behandeling het gevolg was van apoptose in plaats van necrose, werd een Annexin-V-FITC en 7-AAD celkleuring uitgevoerd en geanalyseerd met flowcytometrie. Bij AN3CA, Ishikawa, KLE, RL95-2 en SKUT1B (figuur 1B) werden significante toenames van 50% tot 325% in vroege apoptotische cellen waargenomen. Ook in late apoptotische cellen van deze cellijnen werden significante toenames waargenomen (figuur 1B). RL95-2 had de grootste toename van vroege apoptotische cellen, terwijl KLE de minst significante toename had. Het verhoogde percentage late apoptotische cellen in KLE was statistisch niet significant. Bij HEC1B-cellen was er geen verschil in het percentage vroege en late apoptotische cellen bij behandeling, terwijl HEC1A-cellen een licht significante afname van apoptotische cellen vertoonden. De 293T-cellijn onderging geen apoptose met DCA-behandeling en de lichte toename van het percentage apoptotische cellen was niet significant (p=0,08).
Aangezien de Annexine-V-test voornamelijk wordt gebruikt om vroege apoptose te detecteren, werd een TUNEL-test uitgevoerd op verschillende representatieve endometriumkankercellijnen om de progressie naar late apoptose kwalitatief te bevestigen door caspase-afhankelijke DNA-fragmentatie te visualiseren. In overeenstemming met de kwantitatieve Annexine-V-test werd bij AN3CA, Ishikawa en RL95-2 een toename van TUNEL-positieve apoptotische cellen waargenomen (figuur 1C). In HEC1B- en 293T-cellen met 10 mM DCA-behandeling werd geen visueel verschil in TUNEL-positieve cellen waargenomen.
Om te bepalen of de groeisnelheid de gevoeligheid van de endometriumkankercellijnen voor DCA-behandeling beïnvloedt, werden een apoptotische responder en een non-responder (respectievelijk Ishikawa en HEC1A) gekweekt in serumarme omstandigheden met 0,5% FBS, waardoor de cellen in de G0-fase worden teruggezet en de proliferatie wordt belemmerd. Serumtekort had geen invloed op het percentage vroege apoptotische cellen in de Ishikawa-cellen met behandeling in vergelijking met normale groeiomstandigheden. Het percentage vroege apoptotische cellen nam toe van 3,17% +/- 0,21% SD in onbehandelde tot 6,20% +/- 1,04% SD p=0,05 in behandelde Ishikawa-cellen, hetgeen vergelijkbaar was met de resultaten onder normale groeiomstandigheden. Het percentage laat-apoptotische Ishikawa-cellen nam toe van 1,07% +/- 0,15% SD in onbehandelde tot 3,57% +/- 0,49% SD p=0,02 in behandelde cellen. De HEC1A-cellijn vertoonde geen significant verschil in vroege en late apoptotische cellen. Het percentage vroege apoptotische cellen van HEC1A was 3,73% +/- 0,51% SD voor onbehandelde en 1,93% +/- 0,60 SD p=0,07 voor behandelde cellen. Het percentage late HEC1A-apoptotische cellen was 3,60% +/- 0,69% SD voor onbehandelde en 4,90% +/- 1,37 SD p=0,25 voor behandelde cellen.
Apoptose wordt bevorderd door verlaagde intracellulaire calciumniveaus
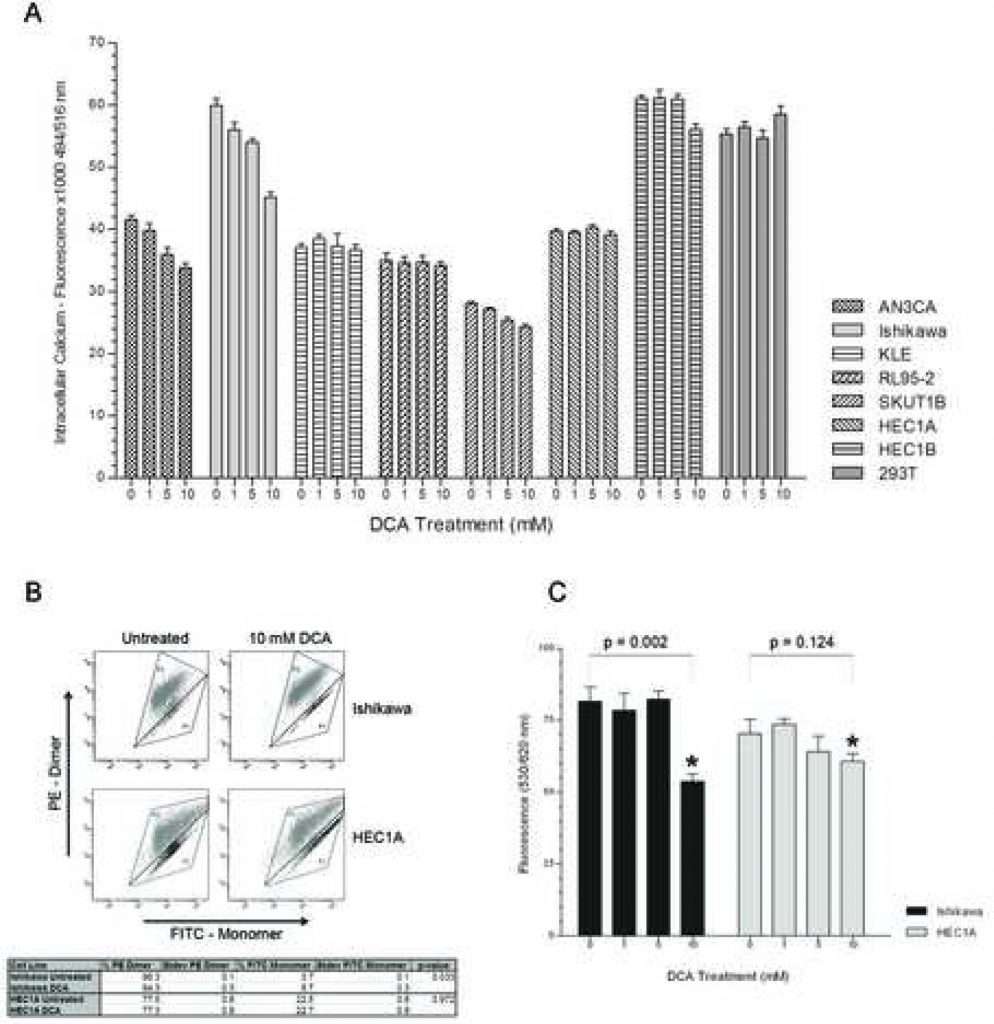
Om te bepalen of de distale NFAT-Kv1.5 pathway bijdraagt tot de bevordering van apoptose door DCA, werd een dosis-respons experiment uitgevoerd om de intracellulaire Ca2+ niveaus te beoordelen. AN3CA, Ishikawa en SKUTB hadden afnemende intracellulaire calciumniveaus bij toenemende DCA-doses (figuur 2A). Het verminderde intracellulaire calcium in deze cellijnen bereikte een significant niveau bij een concentratie van 5mM DCA met p < 0,03 voor AN3CA, Ishikawa en SKUT1B. De KLE-cellijn, die de mildste apoptotische respons vertoonde, had een niet-significante daling van het calciumgehalte bij toenemende DCA-concentratie. Interessant genoeg werd geen verschil in intracellulaire calciumniveaus tussen de doses vastgesteld bij RL95-2, die de grootste apoptotische respons vertoonde. HEC1A, dat eerder geen apoptotische respons vertoonde, had inderdaad geen verschil in intracellulaire calciumniveaus bij welke behandelingsconcentratie dan ook. Ook bij HEC1B was er geen verschil in calciumniveaus tussen de 0, 1 en 5 mM DCA-behandelingsgroepen, en bij de 10 mM behandeling wordt slechts een lichte daling waargenomen. Er was geen verschil in intracellulaire calciumniveaus in 293T met toenemende DCA-concentratie.
DCA behandeling vermindert Mitochondriale membraan hyper-polarisatie in endometriumkankercellen die apoptose ondergaan
Om te beoordelen of DCA heeft bijgedragen aan het initiëren van apoptose via een mitochondriaal gereguleerd mechanisme, werd de MMP van een apoptotische responder en non-responder (respectievelijk Ishikawa en HEC1A) gemeten met en zonder behandeling met behulp van FACS analyse. MitoCapture reagens is een kationische kleurstof die, afhankelijk van de mate van het transmembraan elektrisch potentieel van de mitochondriën, accumuleert als groen uitstralend monomeer in het cytoplasma of als rood uitstralend dimeer in gehyperpolariseerde mitochondriën van kankercellen [22, 23]. DCA-behandeling van de Ishikawa-cellijn verminderde het percentage 575 nm roodgekleurde cellen en verhoogde het percentage 525 nm groengekleurde cellen, wat overeenkomt met de apoptotische respons op de behandeling (figuur 2B). DCA-behandeling van de HEC1A-cellijn had geen invloed op het percentage rood- en groengekleurde cellen. Bovendien hadden onbehandelde HEC1A-cellen een lager percentage roodgekleurde cellen met hypergepolariseerde mitochondriale membranen dan Ishikawa (77,5% +/- 0,6% SD vs. 96,3% +/- 0,1% SD, p < 0,01). Er was geen verschil in MMP van de 293T controle zonder kanker met behandeling (gegevens niet getoond). DCA modulatie van MMP werd verder bevestigd met TMRM kleuring in een dosis-respons experiment. De MMP van Ishikawa cellen nam significant af bij de 10 mM DCA dosering (figuur 2C). Er was geen significant verschil in de MMP van HEC1A-cellen bij elke behandelingsconcentratie.
DCA vermindert de expressie van Survivin
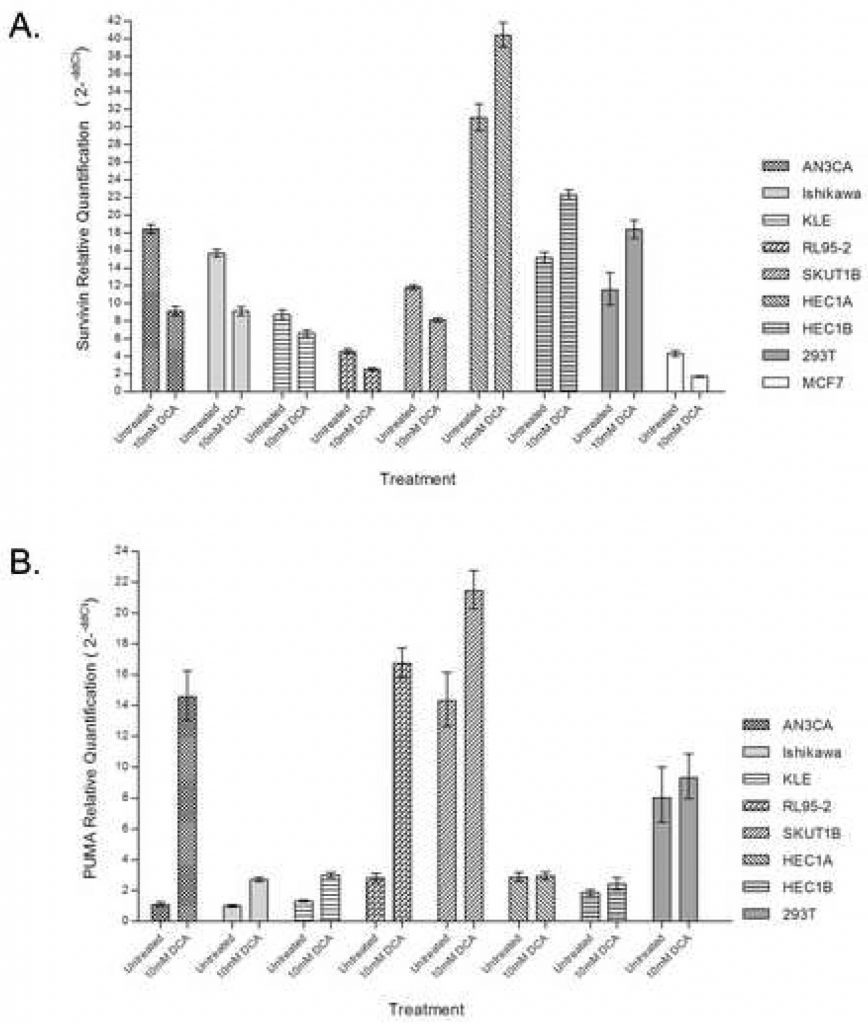
Om de bijdrage van de proximale mitochondriaal-gereguleerde route aan de apoptotische respons verder te bevestigen, werd real-time kwantitatieve PCR gebruikt om de expressie van Survivin met en zonder toediening van DCA te beoordelen. Behandeling van endometriumkankercellijnen met DCA resulteerde in een afname van 25% – 50% van de overvloed van Survivin mRNA in cellen die een apoptotische respons vertoonden, waaronder AN3CA, Ishikawa, KLE, RL95-2 en SKUT1B (figuur 3A). RL95-2, die de grootste toename van vroege apoptotische cellen met behandeling liet zien, had ook de laagste endogene Survivin transcript overvloed. HEC1A en HEC1B, die eerder geen apoptotische reactie op DCA vertoonden, hadden 20 – 30% toename in Survivin-transcripten met behandeling. HEC1A had de grootste overvloed aan endogene Survivin-transcripten. De 293T controle toonde ook een toegenomen transcript overvloed met DCA behandeling.
DCA verhoogt PUMA Expressie
Om de bijdrage van de PUMA pathway in DCA-geïnduceerde apoptose te bepalen, werd real-time kwantitatieve PCR gebruikt om PUMA transcript overvloed te beoordelen met en zonder DCA toediening. Behandeling van endometriumkankercellijnen met DCA verhoogde de overvloed van PUMA mRNA in cellijnen die een apoptotische respons vertoonden, waaronder AN3CA, Ishikawa, KLE, RL95-2 en SKUT1B (figuur 3B). De grootste mate van PUMA-inductie werd waargenomen in AN3CA en RL95-2 cellen, die respectievelijk een 14-voudige en 6-voudige toename vertoonden. HEC1A en HEC1B, die eerder geen apoptotische reactie op DCA vertoonden, vertoonden geen verschil in de hoeveelheid PUMA-transcript bij behandeling. In 293T-cellen werd bij behandeling geen verschil in de hoeveelheid PUMA-transcript waargenomen.
Bespreking
In deze studie tonen wij aan dat de door DCA geïnduceerde endometriumkankerceldood wordt gereguleerd door twee belangrijke mechanismen: de mitochondriaal-gereguleerde en de NFAT-Kv1.5 pathways. Verder hebben wij aangetoond dat DCA de levensvatbaarheid van endometriumkankercellen op dosisafhankelijke wijze vermindert door de bevordering van apoptose, terwijl het geen effect heeft op niet-kankerachtige 293T-cellen. Ten slotte tonen wij aan dat DCA-behandeling de overleving van endometriumkankercellen beïnvloedt via meerdere moleculaire mechanismen, waaronder regulering van het mitochondriaal membraanpotentieel, intracellulaire Ca2+ niveaus, verlies van Survivin expressie, en PUMA inductie.
De pro-apoptotische respons van AN3CA, Ishikawa en SKUT1B op DCA correleerde met een dosis-afhankelijke daling van de intracellulaire Ca2+ niveaus, hetgeen wijst op de betrokkenheid van het NFAT-Kv1.5 mechanisme. Ter vergelijking, RL95-2 (die de grootste apoptotische respons op DCA had) en KLE (die de mildste apoptotische respons had) vertoonden geen verschil in intracellulaire Ca2+ niveaus bij enige behandelingsconcentratie, hetgeen suggereert dat het NFAT-Kv1.5 mechanisme niet betrokken is bij het apoptotische mechanisme van deze cellijnen. In plaats daarvan arresteerde DCA-behandeling RL95-2 cellen in de G0/G1-fase van de celcyclus, een kenmerk van p53-activering, induceerde RL95-2 PUMA-expressie sterk en verlaagde de expressie van Survivin, een eiwit dat een cruciale rol speelt bij de regulering van de celcyclus. [ 29].
Survivin is een transcriptioneel geregelde inhibitor van apoptose die in reactie op een verstoorde MMP wordt afgevoerd van de mitochondriën naar het cytoplasma, waar het caspase-activering voorkomt, apoptose remt en tumorprogressie bevordert [26, 27]. Eerdere studies hebben een positieve correlatie aangetoond tussen verhoogde expressie van Survivin en de tumorgraad van endometriumcarcinoom [27,28]. Wij vonden dat de overvloed van het Survivin-transcript significant afnam in alle endometriumkankercellijnen die een apoptotische reactie op DCA vertoonden. Onze resultaten wijzen erop dat de mitochondriaal-gereguleerde route bijdraagt aan de apoptotische respons in DCA-gevoelige endometriumkanker cellijnen.
Het PUMA-transcript was significant verhoogd in alle endometriumkankercellijnen die een apoptotische respons op DCA vertoonden. Dit resultaat kan wijzen op een bijdrage van de p53-PUMA pathway met de mitochondriale en ionenkanaalmechanismen aan de door DCA geïnduceerde apoptose. De verhoogde PUMA-expressie zou verder het pro-overlevingseffect van Bcl-2 op het mitochondriale membraan in de reagerende cellijnen tegengaan, waardoor een verhoogde translocatie van apoptotische mediatoren van de mitochondriën naar het cytoplasma mogelijk wordt, en aldus een grotere caspase-activering en apoptose wordt bevorderd.
Twee cellijnen, HEC1A en HEC1B, beide zeer invasief met verhoogde geneesmiddelenresistentie en hogere tumorgraad [24] in vergelijking met de andere endometriale cellijnen, waren resistent tegen DCA. Beide cellijnen vertoonden namelijk een verhoogde expressie van Survivin, PUMA-expressie die niet werd beïnvloed door DCA-behandeling, en een lager percentage cellen met gehyperpolariseerde mitochondriale membranen. Deze bevindingen wijzen op een geringere afhankelijkheid van aerobe glycolyse. Wij overwogen of mutaties in het DCA-bindingsdomein van het menselijke PDK2-eiwit verschillen in de behandelingsrespons met HEC1A en HEC1B kunnen verklaren. Bij sequentieanalyse van alle cellijnen werden echter geen mutaties gevonden in de 2 exonen die coderen voor het vermeende DCA-bindingsdomein (gegevens niet getoond).
Samengevat toont onze studie aan dat dichlooracetaat effectief is in het sensibiliseren van de meeste laag- tot matig invasieve endometriumkankercellen voor apoptose. Onze gezamenlijke gegevens suggereren dat apoptose samenhangt met mitochondriale en NFAT-Kv1.5-gemedieerde routes. Bovendien suggereren onze gegevens dat de PUMA-route betrokken kan zijn bij apoptosebevordering door DCA. Toekomstig onderzoek moet zich richten op het onderzoeken van een breder scala aan kankerceltypen, naast het bepalen van de mechanismen die apoptotische resistentie tegen DCA veroorzaken. De meest informatieve weg die overwogen moet worden is het functioneel karakteriseren van de rol van de PUMA pathway in DCA-geïnduceerde apoptose.
Aanvullend materiaal
| Endometriumkanker cellijn | Tumortype | Differentiatiegraad | Invasiviteit | p53 status |
| AN3CA | Epitheliaal adenocarcinoom | Ongedifferentieerd (30, 31) | Gematigd (25, 32) | Mutant (33) |
| KLE | Adenocarcinoom | Slecht gedifferentieerd (31, 34, 35) | Gematigd (36) | Mutant (33) |
| Ishikawa | Epitheliaal adenocarcinoom | Goed gedifferentieerd (25, 37) | Laag (25) | Mutant (33) |
| RL95-2 | Epitheliaal carcinoom | Matig gedifferentieerd (31, 35, 38) | Aantal passages afhankelijk (39) | Mutant (codon deletie) (33) |
| SKUT1B | Mesodermaal Leiomyosarcoom | Goed gedifferentieerd | Matig-hoog (40) | n.v.t |
| HEC1A | Epitheliaal adenocarcinoom | Matig gedifferentieerd (31, 41) | Hoog (25, 42) | Mutant (33) |
| HEC1B | Epitheliaal adenocarcinoom | Matig gedifferentieerd (31, 41) | Hoog (25, 42) | Mutant (33) |
Erkenningen
Wij danken Dr. John Daley van de Dana Farber HemNeo Flow Cytometry core faciliteit voor technische training en Dr. Sabina Signoretti van de Dana Farber – Harvard Cancer Center Pathology Core faciliteit voor immunohistochemische ondersteuning.
Subsidieverlening: Dit project werd ondersteund door National Institutes of Health subsidie nummers CA082838 en CA101501.
VERWIJZINGEN
1 Rose P. Endometriumcarcinoom. New England Journal of Medicine. 1996;335(9):640-649. [PubMed] br>2 Ingram SS, Rosenman J, Heath R, Morgan TM, Moore D, Varia M. The predictive value of progesterone receptor levels in endometrial cancer. Int J Radiat Oncol Biol Phys. 1989;17(1):21-27. [PubMed] br>3 Randall ME, Filiaci VL, Muss H, et al. Randomized phase III trial of whole-abdominal irradiation versus doxorubicin and cisplatin chemotherapy in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol. 2006;24(1):36-44. [PubMed] br>4 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11(1):37-51. [PubMed] br>5 Chen Z, Lu W, Garcia-Prieto C, Huang P. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr. 2007 [PubMed] br>6 Kim JW, Dang CV. Cancer’s molecular sweet tooth and the Warburg effect. Cancer Res. 2006;66(18):8927-8930. [PubMed] br>7 Chen LB. Mitochondriale membraanpotentiaal in levende cellen. Annu Rev Cell Biol. 1988;4:155-181. [PubMed] br>8 Heerdt BG, Houston MA, Augenlicht LH. The intrinsic mitochondrial membrane potential of colonic carcinoma cells is linked to the probability of tumor progression. Cancer Res. 2005;65(21):9861-9867. [PubMed] br>9 Han J, Flemington C, Houghton AB, et al. Expression of bbc3, a pro-apoptotic BH3-only gene, is regulated by various cell death and survival signals. Proc Natl Acad Sci U S A. 2001;98(20):11318-11323. [PMC free article] [PubMed] br>10 Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell. 2001;7(3):683-694. [PubMed] br>11 Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA induceert de snelle apoptose van colorectale kankercellen. Mol Cell. 2001;7(3):673-682. [PubMed] br>12 Willis SN, Adams JM. Life in the balance: how BH3-only proteins induceert apoptosis. Curr Opin Cell Biol. 2005;17(6):617-625. [PMC free article] [PubMed] br>13 Jeffers JR, Parganas E, Lee Y, et al. Puma is an essential mediator of p53-dependent and -independent apoptotic pathways. Cancer Cell. 2003;4(4):321-328. [PubMed] br>14 Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA mediates the apoptotic response to p53 in colorectal cancer cells. Proc Natl Acad Sci U S A. 2003;100(4):1931-1936. [PMC vrij artikel] [PubMed] br>15 Abemayor E, Kovachich GB, Haugaard N. Effects of dichloroacetate on brain pyruvate dehydrogenase. J Neurochem. 1984;42(1):38-42. [PubMed] br>16 Lopaschuk GD, Saddik M. The relative contribution of glucose and fatty acids to ATP production in hearts reperfused following ischemia. Mol Cell Biochem. 1992;116(1–2):111–116. [PubMed] br>17 Stacpoole PW. De farmacologie van dichlooracetaat. Metabolism. 1989;38(11):1124–1144. [PubMed] br>18 Wong A, Cortopassi GA. High-throughput measurement of mitochondrial membrane potential in a neural cell line using a fluorescence plate reader. Biochem Biophys Res Commun. 2002;298(5):750-754. [PubMed] br>19 Yan J, Jiang J, Lim CA, Wu Q, Ng HH, Chin KC. BLIMP1 regelt celgroei door onderdrukking van p53-transcriptie. Proc Natl Acad Sci U S A. 2007;104(6):1841-1846. [PMC free article] [PubMed] br>20 Bieche I, Parfait B, Tozlu S, Lidereau R, Vidaud M. Quantitation of androgen receptor gene expression in sporadic breast tumors by real-time RT-PCR: evidence that MYC is an AR-regulated gene. Carcinogenesis. 2001;22(9):1521–1526. [PubMed] br>21 Hassoun EA, Ray S. The induction of oxidative stress and cellular death by the drinking water disinfection by-products, dichloroacetate and trichloroacetate in J774.A1 cells. Vergelijkende biochemie en fysiologie Toxicologie & farmacologie. 2003;135(2):119-128. [PubMed] br>22 Di Lisa F, Silverman HS, Hansford RG. Mitochondrial function and cell injury in single cardiac myocytes exposed to anoxia and reoxygenation. Transplant Proc. 1995;27(5):2829-2830. [PubMed] br>23 Piccoli C, Scrima R, Boffoli D, Capitanio N. Control by cytochrome c oxidase of the cellular oxidative phosphorylation system depends on the mitochondrial energy state. Biochem J. 2006;396(3):573-583. [PMC free article] [PubMed] br>24 Liang Y, O’Driscoll L, McDonnell S, et al. Enhanced in vitro invasiveness and drug resistance with altered gene expression patterns in a human lung carcinoma cell line after pulse selection with anticancer drugs. Int J Cancer. 2004;111(4):484-493. [PubMed] br>25 Sillem M, Prifti S, Koumouridis A, et al. Invasiveness corresponds to differentiation rather than to proteinase secretion in endometrial cancer cell lines. European Journal of Gynaecologic Oncology. 1999;20(5–6):367–370. [PubMed] br>26 Dohi T, Okada K, Xia F, et al. An IAP-IAP complex inhibits apoptosis. J Biol Chem. 2004;279(33):34087–34090. [PubMed] br>27 Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3(8):917-921. [PubMed] br>28 Erkanli S, Bolat F, Kayaselcuk F, Demirhan B, Kuscu E. COX-2 and survivin are overexpressed and positively correlated in endometrial carcinoma. Gynecol Oncol. 2007;104(2):320-325. [PubMed] br>29 Li F, Ambrosini G, Chu EY, et al. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396(6711):580–584. [PubMed] br>30 Rice LW, Stone RL, Xu M, et al. Biologic targets for therapeutic intervention in endometrioid endometrial adenocarcinoma and malignant mixed mullerian tumors. Am J Obstet Gynecol. 2006;194(4):1119-1126. discussion 26-28. [PubMed] br>31 Nagamani M, Stuart CA. Specific binding and growth-promoting activity of insulin in endometrial cancer cells in culture. Am J Obstet Gynecol. 1998;179(1):6-12. [PubMed] br>32 Zhao Y, Yamashita T, Ishikawa M. Regulation of tumor invasion by HOXB13 gene overexpressed in human endometrial cancer. Oncol Rep. 2005;13(4):721-726. [PubMed] br>33 Yaginuma Y, Westphal H. Analysis of the p53 gene in human uterine carcinoma cell lines. Cancer Res. 1991;51(24):6506-6509. [PubMed] br>34 Richardson GS, Dickersin GR, Atkins L, et al. KLE: a cell line with defective estrogen receptor derived from undifferentiated endometrial cancer. Gynecol Oncol. 1984;17(2):213-230. [PubMed] br>35 Carter CA, Parham GP. State of differentiation affects the response of endometrial adenocarcinoma cells to retinoic acid. Anticancer Research. 1997;17(3C):1973–1983. [PubMed] br>36 Yabushita H, Narumiya H, Hiratake K, et al. The association of transforming growth factor-beta 1 with myometrial invasion of endometrial carcinomas through effects on matrix metalloproteinase. J Obstet Gynaecol Res. 2000;26(3):163-170. [PubMed] br>37 Holinka CF, Hata H, Kuramoto H, et al. Responses to estradiol in a human endometrial adenocarcinoma cell line (Ishikawa) Journal of Steroid Biochemistry. 1986;24(1):85-89. [PubMed] br>38 Way DL, Grosso DS, Davis JR, et al. Characterization of a new human endometrial carcinoma (RL95-2) established in tissue culture. In Vitro. 1983;19(3 part 1):147-158. [PubMed] br>39 Sundareshan P, Hendrix MJ. Growth, morphologic, and invasive characteristics of early and late passages of a human endometrial carcinoma cell line (RL95-2) In Vitro Cell Dev Biol. 1992;28A(7-8):544-552. [PubMed] br>40 Colombatti A, Russo P, Cervi M, et al. Differential Expression of IRS-1 and IRS-2 in Uterine Leiomyosarcomas with Distinct Oncogenic Phenotypes: Lack of Correlation with Downstream Signaling Events. Sarcoma. 2002;6(3):89-96. br>41 Kuramoto H, Tamura S, Notake Y. Establishment of a cell line of human endometrial adenocarcinoma in vitro. Am J Obstet Gynecol. 1972;114(8):1012–1019. br>42 Sieuwerts AM, Klijn JG, Foekens JA. Assessment of the invasive potential of human gynecological tumor cell lines with the in vitro Boyden chamber assay: influences of the ability of cells to migrate through the filter membrane. Clin Exp Metastasis. 1997;15(1):53-62.
Gerelateerde inhoud: