Yu Liang1, Lidan Hou1, Linjing Li1, Lei Li1, Liming Zhu1, Yu Wang1, Xin Huang1, Yichao Hou1, Danxi Zhu1, Huimin Zou1, Yan Gu2, Xiaoling Weng3,4, Yingying Wang5, Yue Li6, Tianqi Wu3, Mengfei Yao3, Isabelle Gross7,8, Christian Gaiddon9,10, Meng Luo2, Jianhua Wang3, Xiangjun Meng1
1 Afdeling gastro-enterologie, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai, China
2 Afdeling algemene chirurgie, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai, China
3 Kankerinstituut, Fudan University Shanghai Cancer Center, Fudan University, Shanghai, China
4 Ningbo Aitagene Technology Co. LTD, Shanghai, China
5 Afdeling Biochemie en Moleculaire & Cell Biology, Shanghai Jiao Tong University School of Medicine, Shanghai, China
6 Pathologiecentrum, Shanghai First People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai, China
7 INSERM UMR_S1113, Straatsburg F-67200, Frankrijk
8 FMTS, Universite de Strasbourg Strasbourg, Straatsburg F-67000, Frankrijk
9UniversitedeStrasbourg, Inserm IRFAC UMR_S1113, Laboratory Stress Response and Innovative Therapy “Streinth”, Strasbourg 67200, Frankrijk
10 CLCC Paul Strauss, Strasbourg, Frankrijk
Meng Luo [email protected]
Jianhua Wang [email protected]
Xiangjun Meng [email protected]
Deze auteurs leverden een gelijkwaardige bijdrage: Yu Liang, Lidan Hou
Ontvangen: 16 maart 2019
Herzien: 17 september 2019
Aanvaard: 19 september 2019
Gepubliceerd: 9 oktober 20199 oktober 2019
Abstract
De ontwikkeling van chemoresistentie blijft een belangrijke uitdaging die de letaliteit van colorectale kanker (CRC) verklaart. Dichlooracetaat (DCA) werd oorspronkelijk gebruikt als een metabole regulator bij de behandeling van stofwisselingsziekten; hier werd DCA getest om de mechanismen te identificeren die ten grondslag liggen aan de chemoresistentie van CRC. Wij vonden dat DCA de chemoresistentie van CRC-cellen tegen fluorouracil (5-FU) duidelijk verhoogde, en de kolonievorming verminderde door hoge niveaus van apoptose. Met behulp van de microarray-assay stelden we vast dat miR-149-3p betrokken was bij de chemoresistentie van CRC, die werd gemoduleerd door wild-type p53 na behandeling met DCA. Bovendien werd PDK2 geïdentificeerd als een direct doelwit van miR-149-3p. Mechanistische analyses toonden aan dat overexpressie van miR-149-3p 5-FU-geïnduceerde apoptose bevorderde en het glucosemetabolisme verminderde, vergelijkbaar met de effecten van PDK2 knockdown. Bovendien maakte overexpressie van PDK2 het remmende effect van miR-149-3p op het glucosemetabolisme gedeeltelijk ongedaan. Ten slotte bleken zowel DCA-behandeling als miR-149-3p-overexpressie in 5-FU-resistente CRC-cellen het chemotherapeutische effect van 5-FU in vivo duidelijk te sensibiliseren, en dit effect werd ook gevalideerd in een klein retrospectief cohort van CRC-patiënten. Al met al stelden wij vast dat de p53/miR-149-3p/PDK2 signaalroute mogelijk kan worden aangepakt met DCA-behandeling om chemoresistent CRC te overwinnen.
Aanvullende informatie: De online versie van dit artikel (https:// doi.org/10.1038/s41388-019-1035-8) bevat aanvullend materiaal, dat beschikbaar is voor geautoriseerde gebruikers.
Inleiding
Colorectale kanker (CRC) is de vierde belangrijkste oorzaak van kanker-gerelateerde sterfte in China [1] en is de tweede belangrijkste oorzaak van kanker-gerelateerde sterfte in de Verenigde Staten [2], die voornamelijk wordt toegeschreven aan uitzaaiingen en falen van chemotherapie als gevolg van resistentie tegen geneesmiddelen, wat leidt tot ~50.000 sterfgevallen per jaar [3].
Hoewel de opkomende ster PD1/PDL1 onlangs grote belangstelling trok, en meer biotherapeutische middelen bemoedigende resultaten lieten zien bij de behandeling van kanker, werd het gebruik ervan in de kliniek beperkt door de beperkte werkzaamheid en de onvermijdelijke bijwerkingen [4,5]. Momenteel is chemotherapie nog steeds een belangrijke keuze in de kliniek, vooral voor patiënten met onherstelbare late stadia en metastatische kankers [6], maar de ontwikkeling van geneesmiddelenresistentie blijft de grootste beperking in chemotherapie [7]. Daarom kan het onderzoeken van de mechanismen van geneesmiddelenresistentie en het zoeken naar nieuwe combinaties van klassieke antikankergeneesmiddelen om de werkzaamheid te optimaliseren, een voordeel opleveren voor de behandeling van CRC. Aangezien fluorouracil (5-FU) het meest gebruikte chemotherapeutische middel is bij CRC, werden in deze studie 5-FU-resistente CRC-cellijnen gebruikt [8,9].
Een afwijking in de glucosestofwisseling is een van de belangrijkste kenmerken van kanker [10]. Het is bekend dat de ontwikkeling van een ongecontroleerde celmassa leidt tot een slechte vascularisatie van de tumor, waardoor de zuurstoftoevoer vermindert. Kankercellen passen zich dus aan de veranderingen in het micro-enviroment aan door hun metabolisme te verschuiven van oxidatief metabolisme naar glycolytisch metabolisme, dat gebaseerd is op een glucosetoevoer en lactaat produceert. Deze verschuiving wordt het “Warburg-effect” genoemd en wordt algemeen waargenomen in verschillende kankercellen als een van de opmerkelijke kenmerken [11- 13]. De recente accumulatie van onderzoeksgegevens leidde tot de eis van verfijning van Warburgs theorie [14]; zo is bijvoorbeeld aangetoond dat metabole verschuiving betrokken is bij chemoresistentie [15]; vandaar dat gerichtheid op de metabolismepatronen van kankercellen mogelijk kan worden benut om chemoresistentie te overwinnen [16,17].
Met name zijn er meerdere mechanismen gemeld om de metabole verschuiving in kankercellen te controleren, waaronder microRNA’s (miRNA’s) [18-20]. miRNA’s vertegenwoordigen een klasse van kleine, endogene niet-coderende RNA’s die de translatie en afbraak van mRNA’s regelen [21] en betrokken zijn bij veel meer biologische processen, waaronder celproliferatie, migratie, apoptose, zelfvernieuwing, initiatie, kankerontwikkeling en chemoresistentie [22-24].
Er zijn aanwijzingen dat het aanpakken van het abnormale metabolisme van kankercellen een intensieve onderzoeksweg is die gericht is op het “verstikken van de tumor”, met als strategieën het remmen van sleutelenzymen die betrokken zijn bij het glycolytisch metabolisme [15]. In dit manuscript werd dichlooracetaat (DCA) oorspronkelijk gebruikt voor de behandeling van melkziekte en erfelijke mitochondriale ziekte [ 25]. DCA remt de enzymatische activiteit van pyruvaatdehydrogenase kinases (PDK1-4), die nodig is om pyruvaat om te zetten in acetyl-CoA, waardoor het glycolytisch metabolisme wordt gekoppeld aan de citroenzuurcyclus [26,27]; DCA heeft volgens recente berichten een kankerbestrijdende werking [28-31]. Het mechanisme dat ten grondslag ligt aan het effect van DCA op de behandeling van CRC blijft echter onduidelijk.
De huidige studie richtte zich op het moleculaire mechanisme dat betrokken is bij de regulering van het glucosemetabolisme en de resistentie tegen chemotherapie in CRC. Met DCA in CRC-cellen onderzochten we de rol van verwante miRNA’s en onthulden zo een signaalroute die verantwoordelijk is voor de resistentie tegen 5-FU-behandeling.
Resultaten
DCA herstelt de chemosensitiviteit van 5-FU-resistente CRC-cellen
Er is gemeld dat DCA een effectief antitumormedicijn is dat zich richt op energiegerelateerde pathways in bepaalde kankers [32]; het effect van DCA in chemoresistente CRC-cellen is echter niet goed onderzocht. Met de CCK8-test vonden we dat vergeleken met hun ouderlijke cellijnen HCT-8 en HCT116 cellen, 5-FU-resistente HCT-8/F en HCT116/F cellen ongevoelig waren voor 5-FU (aanvullende Fig. 1A) en de halfmaximale remmende concentraties (IC50) van DCA in HCT-8/F en HCT116/F cellen respectievelijk ~15 en 20 mM waren, wat overeenkomt met eerdere rapporten [33, 34] (aanvullende Fig. 1B). Vervolgens constateerden wij dat DCA de DNA-synthese aanzienlijk remde (aanvullende Fig. 1C, bovenste paneel) en ROS-generatie induceerde (aanvullende Fig. 1C, onderste paneel) in 5-FU-resistente CRC-cellen. De energiestofwisselingsmarkers, waaronder glucoseverbruik, lactaatproductie en glycolyse, waren duidelijk verhoogd in 5-FU-resistente CRC-cellen vergeleken met die in 5-FU-gevoelige CRC-cellen, terwijl toevoeging van DCA de expressie van die markers duidelijk verminderde (Fig. 1a). Gezien de 6 uur durende serumvrije voorbehandeling bij het meten van de glycolyse, werd een Seahorse XF glycolytic rate assay kit gebruikt om het effect van de voorbehandeling te elimineren en de glycolytische snelheid in real time te meten. De glycolytische protoneffluxsnelheid (glycoPER) geeft de snelheid van de extracellulaire verzuring door glycolyse weer. De toevoeging van DCA verminderde de geïnduceerde glycolyse aanzienlijk in vergelijking met de respectieve controles (fig. 1b en aanvullende fig. 1D).
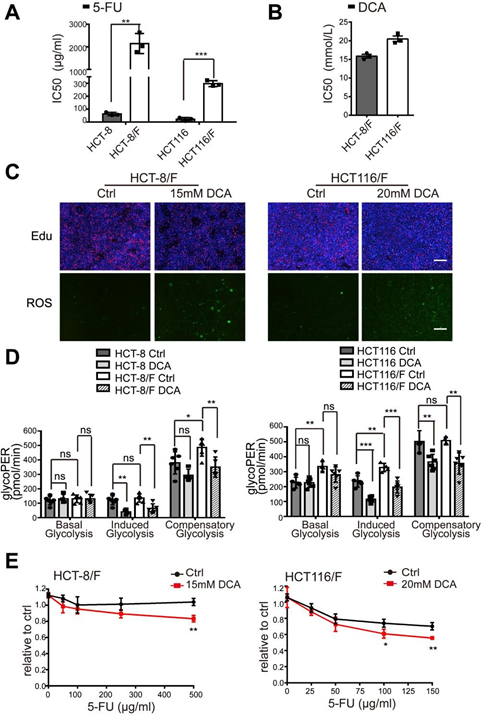
(A) CRC-cellen werden gedurende 24 uur behandeld met verschillende concentraties 5-FU. De IC50 van 5-FU in elke cel werd berekend. (B) HCT-8/F- en HCT116/F-cellen werden gedurende 24 uur behandeld met verschillende concentraties DCA. De IC50 van DCA in elke cel werd berekend. (C) HCT-8/F- en HCT116/F-cellen werden gedurende 24 uur behandeld met respectievelijk 15 mM en 20 mM DCA. Representatieve beelden van Edu-immunofluorescentiekleuring (bovenste paneel) en representatieve beelden van ROS-immunofluorescentiekleuring (onderste paneel), schaalbalk: 200 μm. (D) De bepaling van glycolyse snelheid met inbegrip van basale glycoPER, geïnduceerde glycoPER en compenserende glycoPER werden berekend door Seahorse Glycolytic Rate Assay Report Generator. (E) De celgroei werd bepaald door een CCK8-test na behandeling met 5-FU en DCA. De doseringsbereiken van 5-FU waren 100 ug/ml tot 500 ug/ml voor HCT-8/F-cellen en 25 ug/ml tot 150 ug/ml voor HCT116/F-cellen. De resultaten van drie onafhankelijke experimenten worden weergegeven als gemiddelde ± SEM. Elk experiment werd uitgevoerd in 3-6 biologische herhalingen. *p < 0,05; **, P < 0,01; ***, P < 0,001.
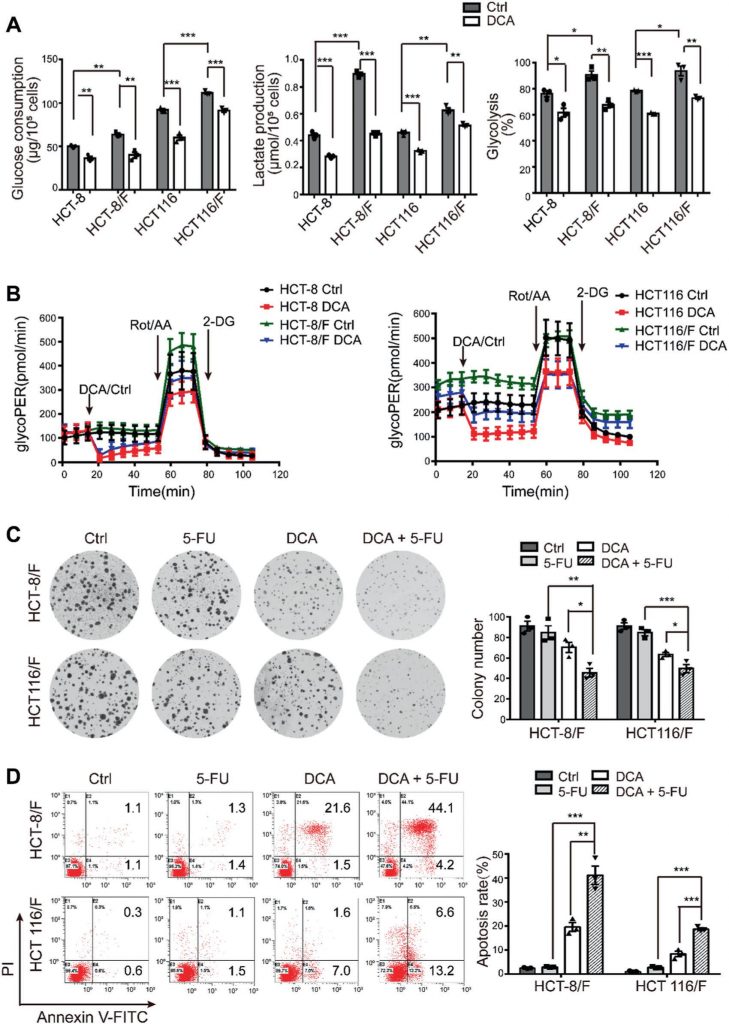
DCA overwon aanzienlijk de 5-FU-resistentie in HCT-8/F- en HCT116/F-cellen, zoals bleek uit de metingen van de celgroei (aanvullende Fig. 1E). De kolonievormingscapaciteit werd aanzienlijk geremd (fig. 1c), en de apoptose werd duidelijk geïnduceerd bij een combinatiebehandeling (fig. 1d). Deze resultaten suggereren dat DCA de chemosensitiviteit in 5-FU-resistente CRC-cellen kan herstellen.
miR-149-3p speelt een cruciale rol bij chemosensitiviteit in CRC-cellen
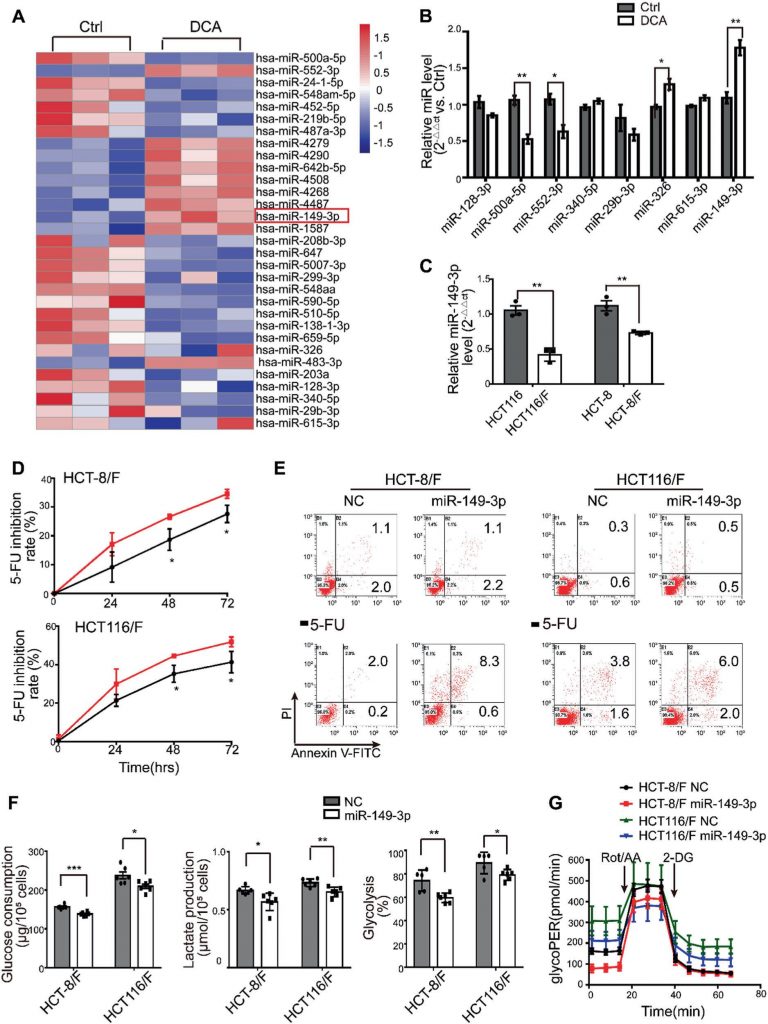
miRNA’s worden beschouwd als een veelbelovend therapeutisch instrument vanwege hun effecten op tumorsuppressie [35]. In dit verband bepaalden wij eerst miRNA-expressieprofielen met behulp van de miRNA-array die 2059 menselijke miRNA’s bevat. In totaal kwamen 119 miRNA’s differentieel tot expressie in reactie op DCA in HCT116-cellen (fig. 2a en aanvullende fig. S2A). Onder hen werden de expressieniveaus van acht miRNA’s verder bevestigd door kwantitatieve real-time PCR (fig. 2b), en miR-149-3p bleek uiteindelijk door DCA op dosisafhankelijke wijze te zijn geüpreguleerd (aanvullende fig. S2B).
Vervolgens bleek dat HCT116-cellen met hogere basale niveaus van miR-149-3p gevoeliger waren voor 5-FU en L-OHP, zoals blijkt uit aanvullende Fig. 2C. Bovendien verminderde anti-miR-149-3p transfectie van HCT116 cellen opmerkelijk het chemotherapeutische effect van 5-FU (aanvullende Fig. 2D-E). Met name de niveaus van miR-149-3p in chemosensitieve CRC-cellen waren significant hoger dan de niveaus in chemoresistente CRC-cellen (Fig. 2c). Daarom verhoogde de transfectie van miR-149-3p mimics aanzienlijk de remmingssnelheid; bevorderde celapoptose geïnduceerd door 5-FU; verminderde glucoseconsumptie, lactaatproductie en glycolyse in HCT-8/F en HCT116/F cellen (Fig. 2d-f). Een Seahorse XF glycolytische snelheidstest toonde aan dat miR-149-3p expressie de basale glycoPER in 5-FU-resistente CRC-cellen verminderde, wat consistent was met bovenstaande resultaten (Fig. 2g en Aanvullende Fig. 2F). Deze resultaten suggereren dat miR-149-3p gunstig is voor het overwinnen van chemoresistentie in CRC-cellen.
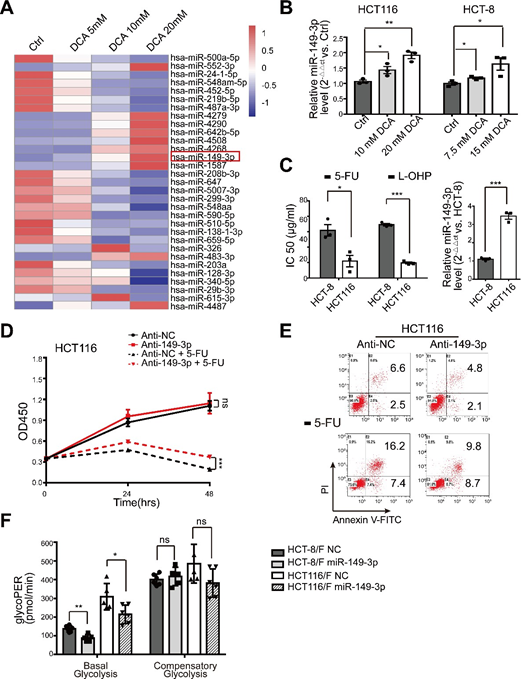
(A) De heatmap van differentieel uitgedrukt microRNA-profiel in HCT116 cellen behandeld met controle, 5 mM, 10 mM, 20 mM DCA gedurende 24 uur. (B) Totaal RNA werd bereid op 24 uur na 10/7,5 mM en 20/15 mM DCA behandeling van HCT116 en HCT-8 cellen. Het miR-149-3p-niveau werd geanalyseerd met kwantitatieve real-time PCR. (C) HCT-8 en HCT116 cellen werden gedurende 24 uur behandeld met verschillende concentraties van respectievelijk 5-FU en oxaliplatine (L-OHP) en de halfmaximale remmende concentratie (IC50) werd berekend (linker paneel). De basale niveaus van miR-149-3p werden bepaald door kwantitatieve real-time PCR in HCT-8-cellen en HCT116-cellen (rechterpaneel). (D-E) HCT116-cellen werden transiënteel getransfecteerd met anti-NC of miR-149-3p-remmer. Na transfectie werden de cellen gedurende 24 uur behandeld met 25 ug/ml 5-FU. De celgroei en apoptose werden bepaald door respectievelijk CCK8 en flowcytometrie. (F) De bepaling van de glycolyse-snelheid inclusief basale glycoPER en compenserende glycoPER in 5-FU-resistente CRC-cellen getransfecteerd met NC of een miR-149-3p mimic werden berekend door Seahorse Glycolytic Rate Assay Report Generator. Gegevens van drie onafhankelijke experimenten worden weergegeven als gemiddelde ± SEM. Elk experiment werd uitgevoerd in 3-6 biologische herhalingen. *p < 0,05; **, P < 0,01; ***, P < 0,001; ns, geen significantie.
DCA induceert miR-149-3p expressie via wild-type (wt) p53
Omdat verschillende recente studies hebben aangetoond dat miR-149-3p wordt gereguleerd door verschillende geneesmiddelen [36,37], hebben we vervolgens bepaald hoe miR-149-3p wordt gereguleerd door DCA. Wij vonden dat DCA de expressie van wt p53 en zijn downstream signalen, waaronder de expressie van p21, PUMA en MDM2, significant verhoogde in CRC cellen (Fig. 3a, b). Bovendien zagen we dat wijzigingen in de expressie van wt p53 de expressie van miR-149-3p aanzienlijk konden moduleren, zoals blijkt uit Fig. 3c, d, wat erop wijst dat miR-149-3p positief werd gereguleerd door wt p53. Met behulp van de p53-null HCT116 cellijn (TP53-/-) vonden wij dat miR-149-3p niet was geüpreguleerd door DCA-behandeling, maar dat ectopische expressie van p53 dit effect omkeerde. Bovendien gebruikten wij nutlin-3, een krachtige remmer die de MDM2-p53 interactie remt, wat leidt tot activering van p53 als positieve controle, waarbij de expressie van miR-149-3p verhoogd was in de wt HCT116 cellijn (TP53+/+) (Fig. 3e-g). Mechanistisch gezien werden vier putatieve p53-bindingsplaatsen aan de miR-149 flankerende genomische DNA-regio voorspeld met behulp van bioinformatica-analysesoftware (IGV). Vervolgens werden in de cellen ChIP-tests uitgevoerd met een antilichaam tegen wt p53. Het pulled-down DNA werd geamplificeerd door gewone PCR met primers die waren ontworpen op basis van deze sites. Onze resultaten toonden aan dat in vergelijking met regio 4, regio 3 duidelijk verrijkt was na DCA-behandeling in wt p53-geïmmunoprecipiteerd HCT116-chromatine (Fig. 3h), wat suggereert dat alleen regio 3 een specifieke bindingsplaats bevat die geactiveerd wordt door DCA. Deze resultaten wijzen erop dat DCA miR-149-3p moduleert via wt p53.
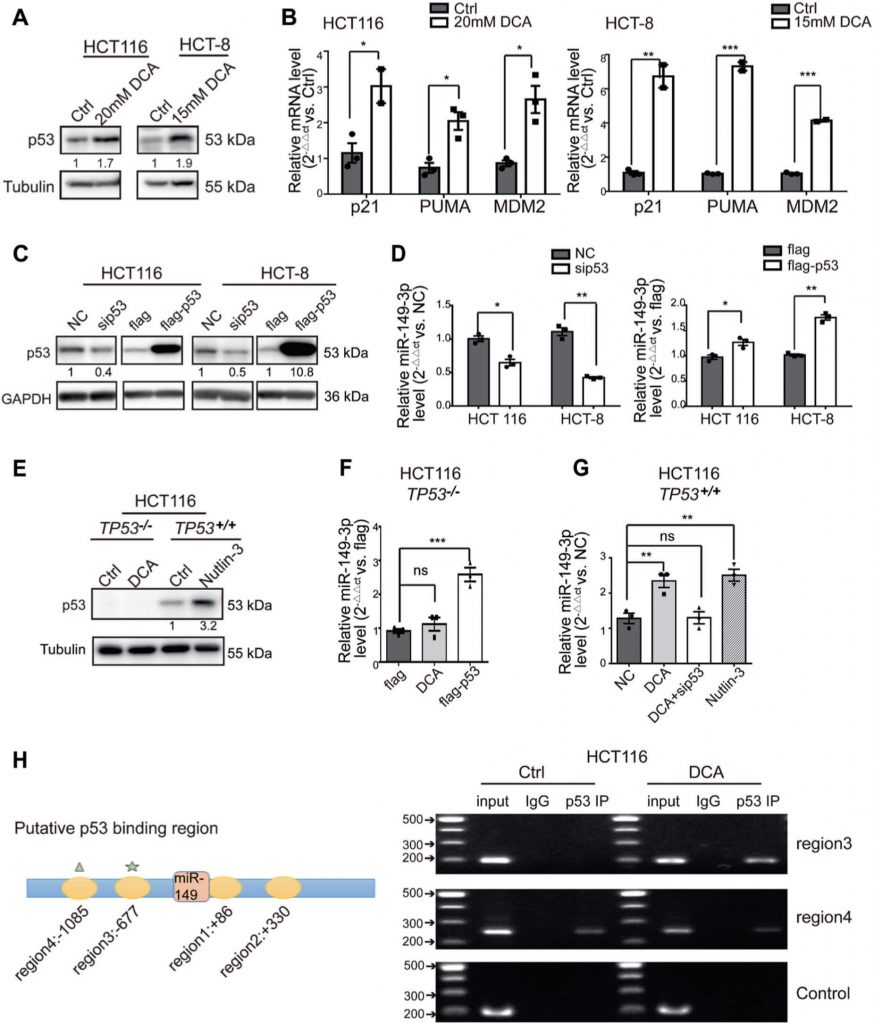
PDK2 is een direct doelwit van miR-149-3p
Om de mechanismen op te helderen waarmee miR-149-3p de chemosensitiviteit in CRC-cellen regelt, onderzochten we genen die verband houden met energiemetabolisme en die door miR-149-3p worden gereguleerd met behulp van twee openbare platforms (TargetScan en miRDB). Uiteindelijk hebben we vastgesteld dat pyruvaat dehydrogenase kinase 2 (PDK2) en hexokinase 1 (HK1) potentiële kandidaten zijn (Fig. 4a). Om deze bevindingen te bevestigen werden miR-149-3p mimic of inhibitor getransfecteerd in CRC-cellen. Wij vonden dat de mRNA-niveaus van PDK2 negatief werden gereguleerd door miR-149-3p, maar niet door HK1 (Fig. 4b en Aanvullende Fig. 3A). Er werden twee mogelijke miR-149-3p bindingsplaatsen in de 3′-UTR van PDK2 gevonden, en de dual-luciferase reporter assay gaf aan dat miR-149-3p bindt aan de voorspelde plaats (686-693) van de PDK2 3′-UTR (Fig. 4c, d). Vervolgens bevestigden we dat de PDK2-eiwitniveaus negatief werden gereguleerd door miR-149-3p (Fig. 4e).
PDK heeft vier isozymes, genaamd PDK1, 2, 3 en 4, die alle door DCA worden gereguleerd [26, 38, 39]. Vervolgens analyseerden we de mRNA-expressie van PDK1-4 in zowel HCT8- als HCT116-cellen na DCA-behandeling. DCA remde significant de mRNA-expressie van PDK2, maar niet van andere PDK-isozymes (aanvullende Fig. S3B). Bovendien keerde de transfectie van anti-149-3p de vermindering van PDK2 door DCA gedeeltelijk om (fig. 4f). Vervolgens bepaalden wij de PDK2 en zijn downstream pyruvaatdehydrogenase E1-alpha-subeenheid (PDHA1) eiwitniveaus in zowel 5-FU-gevoelige als 5-FU-resistente CRC-cellen. De basale niveaus van PDK2 waren verhoogd in chemoresistente CRC-cellen, vergeleken met de niveaus in chemosensitieve cellen. In overeenstemming met deze verhoging was ook de fosforylering van PDHA1 verhoogd (fig. 4g).
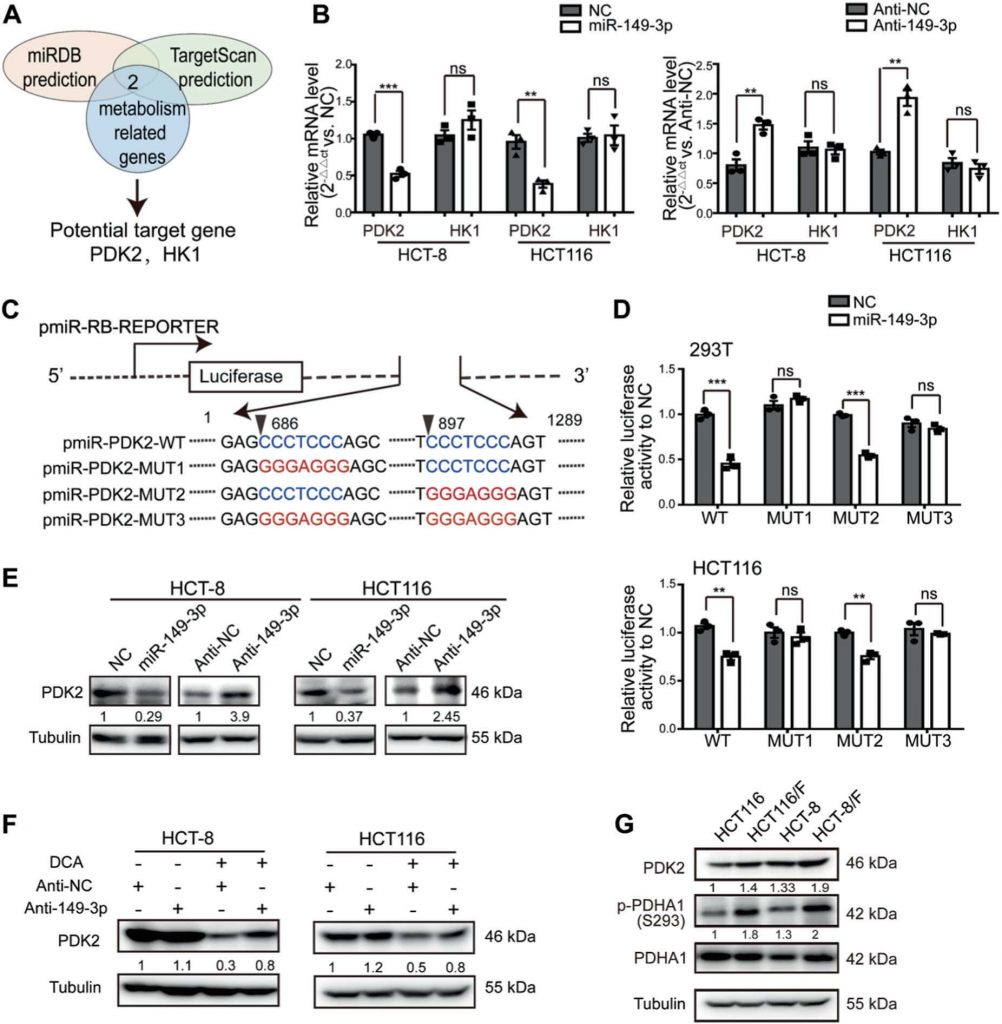
De miR-149-3p/PDK2 pathway regelt chemosensitiviteit
Om te begrijpen hoe de miR-149-3p/PDK2 pathway de respons van CRC-cellen op 5-FU regelt, werd de HCT-8/F-cellijn geselecteerd als representatieve cellijn om te onderzoeken of de expressieniveaus van miR-149-3p en PDK2 de respons van cellen op 5-FU beïnvloedden. Knockdown van PDK2 in HCT-8/F-cellen remde de fosforylering van PDHA1 (fig. 5a) en verminderde energiestofwisselingsmarkers, zoals glucoseverbruik, lactaatproductie en glycolyse (fig. 5b). Bovendien konden verlagingen van PDK2 de effecten van 5-FU op de verhoging van de niveaus van gekloofd PARP (c-PARP) en Bax, beide erkende biomarkers voor celapoptose in HCT-8/F-cellen, versterken (fig. 5c). Bovendien verhoogde PDK2-knockdown de chemosegevoeligheid voor 5-FU in HCT-8/F-cellen, zoals bepaald door CCK8 en kolonievormingstests (fig. 5d, e). Knockdown van PDK2 bevorderde de door 5-FU geïnduceerde apoptose in HCT-8/F- en HCT116/F-cellen en wordt getoond in aanvullende Fig. S4A, terwijl overexpressie van PDK2 de fosforylering van PDHA1 bevorderde en de door 5-FU geïnduceerde celapoptose in HCT-8- en HCT116-cellen verzachtte (aanvullende Fig. S4B-S4C).
Bovendien keerde overexpressie van PDK2 het remmende effect van miR-149-3p op PDK2 om (fig. 5f) en werd het remmende effect van miR-149-3p op glucoseverbruik, lactaatproductie en glycolyse gedeeltelijk opgeheven (fig. 5g). Ectopische expressie van PDK2 schakelde het remmende effect van miR-149-3p op celgroei en kolonievorming in met 5-FU behandelde HCT-8/F-cellen duidelijk uit (fig. 5h, i). Al met al wijzen onze resultaten erop dat de miR-149-3p/PDK2-route de chemosensitiviteit herstelt door zich, althans gedeeltelijk, te richten op het glucosemetabolisme in chemoresistente CRC-cellen.
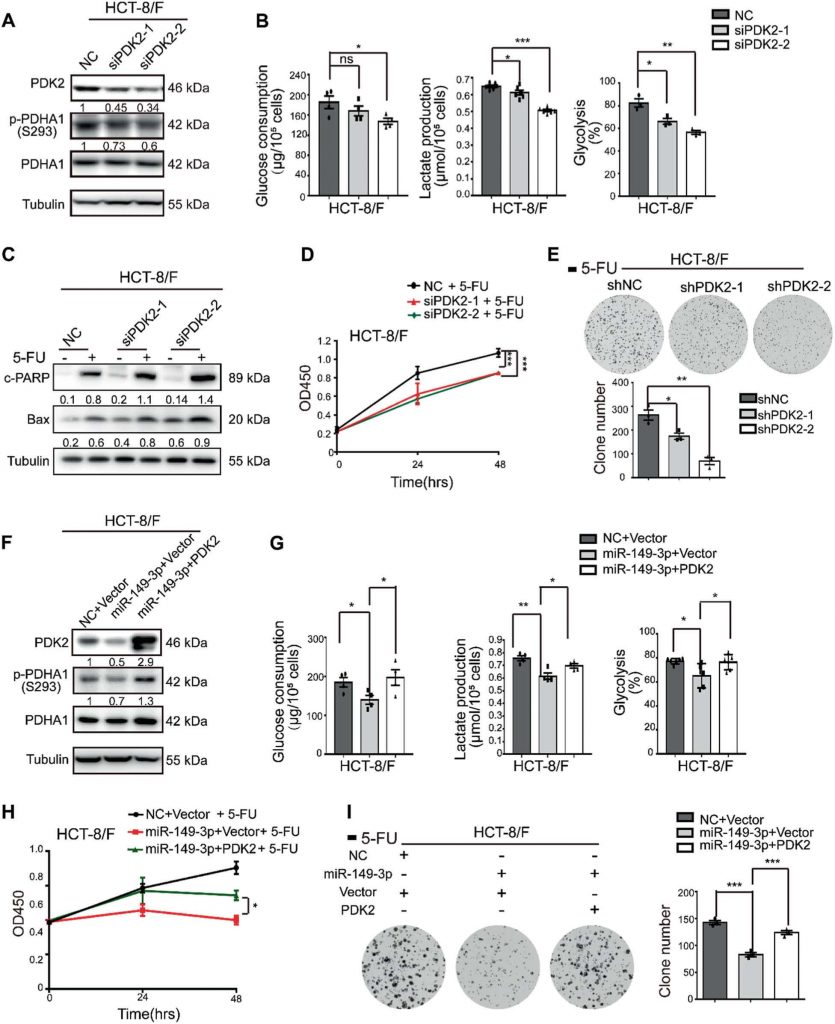
DCA verhoogt de chemosensitiviteit van 5-FU in vivo
Vervolgens werden 5-FU, DCA of een combinatie van 5-FU met DCA intraperitoneaal geïnjecteerd in het subcutane xenograft-model (aangeduid als de intraperitoneale groep). Gezien de onvoldoende bloedtoevoer in het centrale deel van subcutane tumoren, injecteerden we ook DCA of PBS intratumoraal plus een intraperitoneale injectie van 5-FU (aangeduid als de intratumorale groep). De combinaties van DCA met 5-FU vertoonden betere remmende effecten op de tumorgroei dan DCA of 5-FU alleen na vier weken injectie in de intraperitoneale groep (fig. 6a, b). De expressie van Ki-67 werd verminderd na combinatiebehandeling in de intraperitoneale groep (fig. 6c). DCA remde de tumorgroei in de intratumorale groep aanzienlijk in vergelijking met die in de PBS-groep (fig. 6d), en miR-149-3p was geupreguleerd in de DCA intratumorale injectiegroep, hetgeen overeenkomt met de resultaten in vitro (fig. 6e). Intratumorale injectie van DCA bevorderde ook tumorapoptose (fig. 6F).
Om het effect van miR-149-3p op de respons van CRC-cellen op 5-FU in vivo verder te evalueren, werd het subcutane xenograft-model onderworpen aan intratumorale injectie van agomiR-149-3p of agomiR-NC plus een intraperitoneale injectie van 5-FU. miR-149-3p remde de tumorgroei in de intratumorale groep aanzienlijk in vergelijking met die in de controlegroep waarin agomiR-negatieve controle (NC) intratumoraal werd geïnjecteerd (Fig. 6g, h). Overexpressie van miR-149-3p werd gevalideerd door kwantitatieve real-time PCR (fig. 6i), en overexpressie van miR-149-3p bevorderde apoptose (fig. 6j) en verminderde de expressie van PDK2 en p-PDHA1 (fig. 6k, l). Met behulp van 18F-fluorodeoxyglucose (FDG) micro-positron emissie tomografie (PET)-CT scanning werd tumorbeeldvorming uitgevoerd na 3 weken behandeling. de 18F-FDG-opname werd waargenomen op de plaatsen waar de tumor was geïmplanteerd, en de maximale gestandaardiseerde opname (SUVmax) en metabole tumorvolumes (MTV’s) werden gemeten. Er werd geen verschil in SUVmax waargenomen tussen de twee groepen, terwijl MTV significant afnam in de miR-149-3p groep (Fig. 6m).
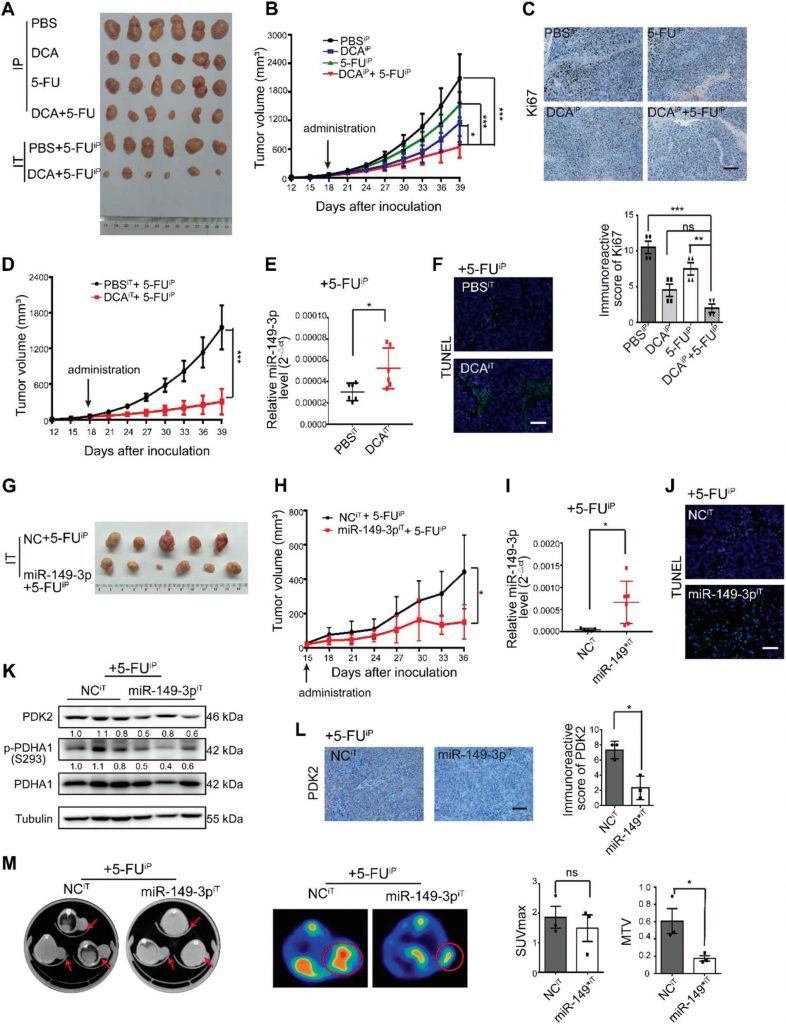
miR-149-3p is omgekeerd gecorreleerd met PDK2 in CRC patiënten
Een significante omgekeerde correlatie tussen de miR-149-3p en PDK2 mRNA niveaus werd waargenomen in menselijk CRC weefsel (Fig. 7a, b). Onder hen drukten acht patiënten in stabiele toestand/ziekte (SD) binnen 3 jaar na chemotherapie een hoger niveau van miR-149-3p uit dan vijf patiënten met progressieve ziekte (PD) (Aanvullende Fig. S5A). Vijf paren van PD- en SD-patiënten met dezelfde pathologie en TNM-stadium werden geanalyseerd, en de PDK2-kleuring varieerde significant in monsters van de PD- en SD-patiënten (Aanvullende Fig. S5B). CRC-patiënten uit de TCGA-database met hoge PDK2-expressie werden ook gekenmerkt door een slechtere algehele overleving (OS) (Fig. 7c). De TCGA-database liet ook zien dat de expressie van PDK2 in de wt p53-groep verminderd was in vergelijking met die in de mutante p53-groep (Fig. 7d). Deze resultaten suggereerden dat PDK2 negatief wordt gereguleerd door miR-149-3p in CRC-patiënten.
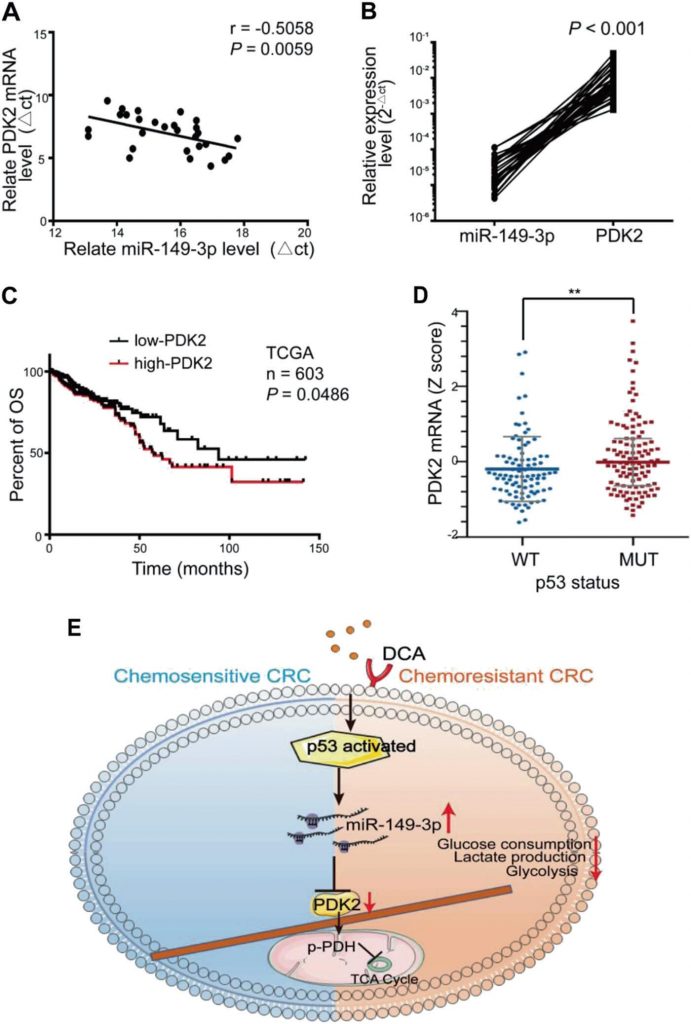
Bespreking
CRC wordt gekenmerkt door tumorigene afwijkingen en veranderde metabolische routes en is een van de belangrijkste doodsoorzaken van kanker [2]. Resistentie tegen chemotherapie is de belangrijkste oorzaak voor het falen van de behandeling [7]. In deze studie vonden we dat DCA het chemotherapeutische effect van 5-FU kon verhogen in chemoresistente CRC-cellen en dat activering van de p53/miR-149-3p/PDK2-route de chemosensitiviteit in vitro en in vivo kon verhogen.
Toenemend bewijs wijst erop dat verhoogde glycolyse nauw samenhangt met resistentie tegen chemotherapie [15, 17, 40]. Hier vonden we ook dat vergeleken met hun ouderlijke cellijnen, chemoresistente CRC-cellen een verhoogd glucoseverbruik, lactaatproductie en glycolyse vertoonden, wat suggereert dat metabole afwijkingen een typisch kenmerk zijn, maar de moleculaire mechanismen blijven nog onduidelijk in CRC-cellen.
Er is waargenomen dat DCA het lactaatgehalte in het bloed in vivo verlaagt bij knaagdieren bij doseringen van ~25-50 mg/kg/24 uur [41] en dat DCA een breed doseringsbereik heeft van 1 tot 50 mM [26]. Met name is het schadelijke effect van DCA bij de mens over het algemeen beperkt tot reversibele sensorische en motorische perifere neuropathie, die wordt beïnvloed door leeftijd en genotype [42]. Onlangs is DCA geïdentificeerd als een nieuwe metabole therapie voor diverse kankerpatiënten [26, 29].
Er is gemeld dat DCA de activiteit van PDK kan remmen en pyruvaat kan omzetten in acetyl-CoA, wat leidt tot een verschuiving in de energieproductie van glycolyse naar mitochondriale oxidatieve fosforylering [43,44]. Van DCA is ook aangetoond dat het de door hypoxie veroorzaakte resistentie tegen 5-FU bij maagkanker vermindert [45], de resistentie tegen sorafenib bij hepatocellulair carcinoom opheft [46], en de resistentie tegen cisplatine bij hoofd-halskanker vermindert [47]. Uit onze studie bleek dat DCA de chemoresistentie van CRC-cellen tegen 5-FU kon verminderen. Bovendien toonden we aan dat DCA het glucoseverbruik en de lactaatproductie in chemoresistente CRC-cellen verminderde tot het basale niveau van chemosensitieve CRC-cellen. Aangezien autofagie het kankermetabolisme kan aanwakkeren [48], werd het effect van DCA en miR-149-3p op autofagie bepaald. Wij vonden dat DCA autofagie activeert en miR-149-3p geen invloed heeft op autofagie. Dit suggereerde dat autofagie niet betrokken was bij het effect van DCA/miR-149-3p op de regulering van het glucosemetabolisme (aanvullende figuur S6).
PDK’s, als de belangrijkste regulatoren in de glycolyse van kanker, hebben grote bezorgdheid gewekt door de resultaten van vele studies [49]. Er zijn vier isovormen van PDK (PDK1-4), en elk van hen komt als volgt weefselspecifiek voor: PDK1 komt in hoge mate tot expressie in het hart, PDK2 komt ubiquitair tot expressie, PDK3 heeft een relatief beperkte weefseldistributie, en PDK4 komt tot expressie in het hart en de skeletspier [27]. PDK2 komt in vergelijking met andere iso-enzymen in hogere mate tot expressie, wat suggereert dat het de belangrijkste isovorm zou kunnen zijn die verantwoordelijk is voor de regulering van de enzymactiviteit van het pyruvaat dehydrogenase complex (PDHC) [50]. Bovendien verschillen PDK-isoenzymen in hun acute regulatie door metabolieten [51]. Hier hebben we ons gericht op PDK2, de meest gevoelige isovormen voor DCA [31]. Hoewel de moleculaire interacties tussen DCA en PDK’s centraal staan, blijft het potentiële mechanisme van de transcriptionele regulatie van PDK onduidelijk. Een recente studie meldde dat miR-182 een regulerende rol speelt in de metabolische routes van longkanker door zich te richten op PDK4 [52]. De huidige studie toonde aan dat PDK2 werd gereguleerd door miR-149-3p in CRC en dat de niveaus van PDK2 in de primaire tumoren van CRC-patiënten omgekeerd gecorreleerd waren met miR-149-3p expressie. Aangezien PDK2 algemeen aanwezig is in de meeste weefsels, kan het richten van PDK2 een belangrijkere en efficiëntere manier zijn om tumorcellen te doden en chemoresistentie te overwinnen.
Er is gemeld dat miR-149-3p een vitale rol speelt bij verschillende vormen van kanker en wordt geïnduceerd door sommige antitumormiddelen [36, 37, 53]. Wij vonden met name dat DCA-behandeling de binding van p53 aan de upstream regio (-677 tot -477) van miR-149 kon induceren en dat miR-149-3p door DCA-behandeling op een p53-afhankelijke manier werd geüpreguleerd. TP53, een klassieke tumorsuppressor, is vaak geïnactiveerd in tumoren [54] en er is onlangs gemeld dat het het glucosemetabolisme in kanker reguleert. Wt p53 bleek het “Warburg-effect” te kunnen remmen door PDK2 te controleren. De frequentie van TP53-mutaties in CRC is echter ~40-50% [55, 56], waardoor de onderdrukkende functie verloren gaat. Er is gemeld dat CRC-patiënten met wt TP53 een overlevingsvoordeel hebben bij chemotherapie op basis van 5-FU, maar die met mutant TP53 niet [57]. Onze resultaten onthullen een nieuw mechanisme tussen p53 en PDK2 dat gemoduleerd wordt door miR-149-3p. Deze bevindingen suggereren dat patiënten met mutant TP53 meer baat hebben bij adjunctiechemotherapie met miR-149-3p dan met DCA. Gezien de hoge frequentie van TP53-mutaties in CRC geloven wij dat miR-149-3p een vitale rol speelt bij het bewaken en moduleren van chemosensitiviteit in CRC.
Kankercellen verbruiken een grote hoeveelheid glucose en vertonen een hoge aërobe glycolysetoestand; daarom is vermindering van de glucose-opname een veelbelovende strategie om de groei van kanker te beperken [58]. Wij zagen dat de verhoging van miR-149-3p de glycolyse in chemoresistente CRC-cellen opmerkelijk remde; maar vergeleken met de controlegroep had de xenograft-groep waarbij het miR-149-3p mimic intratumoraal werd geïnjecteerd een SUVmax die onveranderd bleef. Misschien is dit tegenstrijdige resultaat te wijten aan de ontwikkeling van necrose in het kerngedeelte van het onderhuidse tumorweefsel, hetgeen onderzoek verdient.
Alles bij elkaar genomen, onthullen wij dat de p53/miR-149-3p/PDK2 signaalweg mogelijk kan worden gericht op het overwinnen van chemoresistent CRC na behandeling met DCA, hetgeen een potentiële strategie biedt voor de behandeling van CRC vanuit het oogpunt van ingrijpen in het tumormetabolisme (fig. 7e).
Materialen en methoden
Kankerweefsel
Achtentwintig CRC-patiënten van het Negende Volksziekenhuis verbonden aan de Shanghai Jiao Tong University School of Medicine werden opgenomen tussen 2013 en 2016. Dertien van deze patiënten kregen postoperatieve chemotherapie op basis van 5-FU en werden minstens 3 jaar gevolgd. Alle weefsels werden verzameld na het verkrijgen van geïnformeerde toestemming, en alle procedures waarbij menselijke patiënten betrokken waren, werden uitgevoerd in overeenstemming met de voorschriften van de Ethische Commissie van het Negende Volksziekenhuis verbonden aan het Medical College van de Shanghai Jiao Tong University. De klinische informatie van de CRC-patiënten wordt gepresenteerd in aanvullende tabel 1.
| Kenmerken van CRC-patiënten | |
| Kenmerk | Totaal (n=28) |
| Leeftijd-jaar | 65.4±10.5 |
| Geslacht-no. (%) | |
| Mannelijk | 17(60.7) |
| Vrouwelijk | 11(39.3) |
| Lokalisatie-nr. (%) | |
| Rectum | 10(35.7) |
| Colon | 18(64.3) |
| Staging- aantal (%) | |
| T1 of T2 | 6(21.4) |
| T3 of T4 | 22(78.6) |
| Betrokken lymfeklieren – aantal (%) | |
| N0 | 12(42.9) |
| N1 of N2 | 16(57.1) |
| Metastase- aantal (%) | |
| M0 | 27(96.4) |
| M1 | 1(3.6) |
| Postoperatieve chemotherapie met een op fluorouracil gebaseerd schema | |
| Ja | 21(75) |
| Follow-up gedurende 3 jaar | |
| Ja | 13(61.9) |
| Geen | 8(38.1) |
| Nee | 7(25) |
Celcultuur
De 5-FU-resistente cellijn HCT-8/F en de ouderlijke HCT-8 cellijn werden aangekocht bij iCell Bioscience, Inc. (Shanghai, China). De 5-FU-resistente cellijn HCT116/F en de ouderlijke HCT116-cellijn werden vriendelijk verstrekt door Dr. Gu (Yanhong Gu, Nanjing Medical University, Jiangsu, China). HCT116-/- cellen waren een gift van Dr. Lu (Hua Lu, Fudan University, Shanghai, China). De menselijke embryonale nier 293T-cellijn werd verkregen van American Type Culture Collection (ATCC, Manassas, VA, USA). De 293T, HCT116, HCT-8 cellijnen werden gekweekt in Dulbecco’s Modified Eagle’s medium (HyClone, Utah, VS) of RPMI-1640 medium (HyClone, Utah, VS) met 10% foetaal runderserum (Gemini, Californië, VS), 100 U/mL penicilline en 100 ug/mL streptomycine (HyClone, Utah, VS) in een 37 °C,5%CO2 bevochtigde incubator. De kweekmedia van de cellijnen HCT-8/F en HCT116/F werden aangevuld met respectievelijk 15 μg/ml 5-FU en 5 μg/ml 5-FU. Alle cellijnen werden door Genetic Testing Biotechnology Corporation (Suzhou, Jiangsu, China) geverifieerd door sequencing met korte tandemherhalingen. DCA werd gekocht van Sigma-Aldrich Co. Ltd. (MO, VS).
Immunofluorescentiekleuring van Edu en ROS
HCT-8/F-enHCT116/F-cellen werden met 15.000 cellen per putje in 96-wellsplaten geplaatst. Na incubatie ’s nachts werden de cellen gedurende 24 uur behandeld met respectievelijk 15 mM en 20 mM DCA. Edu-kleuring werd uitgevoerd volgens de instructies van de fabrikant (Ribobio, Guangzhou, China). De niveaus van ROS werden gemeten in cellen die gedurende 30 minuten bij 37 °C werden geïncubeerd met 10 μM 2′,7′-dichloorfluoresceïne-diacetaat (DCF-DA) (Beyotime, Shanghai, China). De platen werden vervolgens tweemaal gewassen en de cellen werden geanalyseerd met een fluorescentiemicroscoop.
Celgroei
Cellenwerden’s nachts in 96-wellsplaten gezaaid bij 5000 cellen/well, gedurende 24 uur behandeld met geneesmiddelen en elk putje werd vervolgens vervangen door mengsels van 10 μl CCK8 (Dojindo, Japan) en 90 μl kweekmedium. De absorptie werd twee uur later gemeten bij een OD-waarde van 450 nm met een enzym-microtiter (BioTeck, Vermont, VS). De inhibitieverhouding van het geneesmiddel werd berekend met de volgende formule: 1-ODdrug/ODctrl. De IC50 van elke cel werd berekend met GraphPad Prism 6 (GraphPad Software, San Diego, CA).
Celapoptosetest
HCT-8/F-enHCT116/F-cellen werden in zes-wellsplaten gezaaid in een concentratie van 2×105 cellen/well. De cellen werden behandeld met respectievelijk DCA (15 mM) / 5-FU (50 μg/ml) en DCA (20 mM) / 5-FU (25 μg/ml) gedurende 48 uur. De cellen werden vervolgens getrypsiniseerd, gewassen en gekleurd met Annexine V-FITC/PI of Annexine V-PE/7-AAD antilichamen volgens het protocol van de fabrikant (BD, CA, USA). Apoptose werd gemeten met flowcytometrie (BD, CA, USA).
Kolonievormingstest
HCT-8/F-enHCT116/F-cellen werden gedurende 24 uur behandeld met respectievelijk DCA (15 mM)/5-FU (50 μg/ml) en DCA (20 mM)/5-FU (25 μg/ml). Vervolgens werden de cellen uitgezaaid in zes-well platen op 1000 cellen per putje en gekweekt in vers medium bij 37 ° C gedurende 1 tot 2 weken, gevolgd door fixatie met 4% paraformaldehyde gedurende 30 minuten; cellen werden vervolgens gekleurd met 1% kristalviolet, en de cel kolonie nummers werden geteld door een teller (Gelcount, Optronix, Oxford).
Transiënte gentransfectie
miR-149-3p mimics, remmers, siPDK2, sip53, en hun overeenkomstige NC oligonucleotide-sequenties werden gesynthetiseerd door GenePharma (Shanghai, China). Flag-p53 plasmide werd vriendelijk verstrekt door Dr Lu (Hua Lu, Fudan University, Shanghai, China). Transfectie werd uitgevoerd met Lipofectamine 3000 (Invitrogen, CA, USA) bij een eindconcentratie van 50 nmol/L (mimics en siRNA’s) of 100 nmol/L (remmers). De cellen werden 24 of 48 uur na transfectie geoogst voor tests. De sequenties van het siRNA, de mimic en de remmers staan vermeld in aanvullende tabel 2.
| sequentie siRNA, mimic en remmer | |
| siPDK2-1 | sense: 5′-GACCGAUGCUGUCAUCUAUU-3′ |
| antisense: 5′-AAUAGAUGACAGCAUCGGUC-3′ | |
| siPDK2-2 | zin: 5′-GACUCUUCAGCUACAUGUA-3′ |
| antisense: 5′-UACAUGUAGCUGAAGUC-3′ | |
| NC | zin: 5′-UUCUCCGAACGUGUCACGUTT-3′ |
| antisense: 5′-ACGUGACGUUCGGAGAATT-3′ | |
| mimic-149-3p | zin: 5′-AGGAGGACGCUGUGC-3′ |
| antisense: 5′-ACAGCCCCCGUCCCUCCCUU-3′ | |
| remmer-NC | 5′-CAGUUUUGUGUAGUACAA-3′ |
| remmer-149-3p | 5′-GCACAGCCCCCGUCCCUCCCU-3′ |
| sip53 | zin: 5′-GUAAUCUACUGGGACGGAAtt-3′ |
| antisense: 5′-UUCCGUCCCAGUAGAUUACca-3′ |
Stabiele gen transfectie
LV-PDK2 en de overeenkomstige NC-virus werden gekocht van GeneChem (Shanghai, China). shPDK2-1, shPDK2-2, en de controle plasmide werden gekocht van GeneChem (Shanghai, China). Het virussupernatant werd geoogst van 293 T-cellen. Vervolgens werden CRC-cellen geïnfecteerd met het virus en gescreend met puromycine. De efficiëntie van de infectie werd gevalideerd met flowcytometrie en fluorescentiemicroscopie. De mRNA- en eiwitexpressie van PDK2 werden verder geanalyseerd door middel van kwantitatieve real-time PCR en Western blot.
3′-UTR reporter luciferase assays
De wt of mutant miR-149-3p bindende sequenties in de menselijke PDK2 3′UTR werden gekloond in downstream van de luciferase pmiR-RB-Reporter (Ribobio, Guangzhou, China), verwijzen naar WT, MUT1, MUT2, en MUT3 in Fig. 3c. 293 T-cellen en HCT116 cellen werden gezaaid in 24-well platen gevolgd door cotransfectie met 500 ng reporter constructen en ofwel 50 nmol / L miR-149-3p mimic of een NC met behulp van Lipofectamine 3000 (Thermo Fisher Scientific, Waltham MA). Luciferase-activiteit werd gemeten na 48 uur incubatie met behulp van het Dual-Luciferase Reporter Assay System (Promega, Madison, USA) volgens het protocol van de fabrikant.
Glucoseverbruik en lactaatproductie
HCT-8/F-enHCT116/F-cellen werden in 24-wellsplaten gezaaid bij 1×105 cellen/well gedurende een nacht, en vervolgens behandeld met respectievelijk 15 mM en 20 mM DCA gedurende 24 uur. Na behandeling werden de cellen gedurende 24 uur gekweekt in fenolroodvrij medium met 10% foetaal runderserum. Het lactaat werd gemeten met een Lactate Assay Kit (Njjcbio, Nanjin, China), en de glucose werd gemeten met een Glucose Assay Kit (Rsbio, Shanghai, China). Alle waarden werden gestandaardiseerd door een gelijk aantal cellen te tellen. Om de glycolysetoestand te evalueren werd 100 ng/mL oligomycine (een ATP-synthaseremmer; Sangon Biotech) toegevoegd aan gekweekte cellen gedurende 6 uur. De verhouding van de lactaatconcentratie in aan- en afwezigheid van oligomycine werd gemeten en bepaald zoals eerder beschreven [46].
Seahorse XF-96 glycolytic rate assay
De cellenwerdenuitgezaaid in een 96-wells kweekplaat bij een dichtheid van 25.000 cellen/well en werden ’s nachts geïncubeerd in groeimedium met 10% foetaal runderserum. De sensor cartridge werd ’s nachts gehydrateerd. De volgende dag, cellen medium werd veranderd in bicarbonaat-vrij low-buffered assay medium aangevuld met glucose, natriumpyruvaat, en glutamine. Na incubatie van de cellen gedurende 1 uur bij 37 °C in een non-CO2 incubator werden het zuurstofverbruik en de extracellulaire verzuring gemeten voor en na de injectie van DCA/ctrl, Rotenone (Rot) + antimycine A (AA) en 2-deoxy-d-glucose (2-DG) met het Seahorse XF instrument (Agilent, Santa Clara, CA) zoals eerder beschreven [59, 60]. Experimenten werden uitgevoerd in real time in vijf tot zes gerepliceerde wells. GlycoPERs omvatten basale glycoPER, geïnduceerde glycoPER, en compenserende glycoPER werden automatisch berekend door de Wave software (Agilent, Santa Clara, CA).
Kwantitatieve real-time PCR en miRNA-microarray
Totaal RNA werd met TRIzol Reagent (Life, CA, USA) uit CRC-weefsels of cellen geëxtraheerd. cDNA werd gesynthetiseerd met de PrimeScript RT Reagent Kit (TaKaRa, Tokyo, Japan). De microarray-assay werd uitgevoerd met drie replicaten HCT116-cellen behandeld met 5 mM, 10 mM of 20 mM DCA gedurende 12, 24 of 48 uur. De originele gegevens werden geüpload naar de GEO-database (GSE125309). Kwantitatieve real-time PCR werd uitgevoerd met premix Ex Taq 420 A (TaKaRa, Tokyo, Japan) op het ABI-7500 platform. Actine en U6 werden gebruikt als interne controles. Primer-sequenties zijn opgenomen in aanvullende tabel 3.
| primer-sequenties voor Reverse-transcription kwantitatieve real-time PCR | |
| Actine | F: 5′-CTCCATCCTGGCCTCGCTGT-3′ |
| R: 5′-GCTGTCACCTTCACCGTTCC-3′ | |
| PDK2 | F: 5′-CGCTGGCTTGGTTATG-3′ |
| R: 5′-ACAGGGCCTTGAGATAGATG-3′ | |
| PDK1 | F: 5′-GCTGTATGGCCTGCAAGATG-3′ |
| R: 5′-GCTGTCCTGGTGATTTTGCA-3′ | |
| PDK3 | F: 5′-GGTTTGCCAATTTCCCGTCTG-3′ |
| R: 5′-CATCGGCTTCAGGCGTGGTC-3′ | |
| PDK4 | F: 5′-GAGAATTATTGACCGCCTCT-3′ |
| R: 5′-CGAGAAATTGGCAAGCCGTAA-3′ | |
| HK1 | F: 5′-CTTACTAAGGGATGCGATAAA-3′ |
| R: 5′-TCCCAACAATGAGTCCAACC-3′ | |
| TP53 | F: 5′-CCCAAGCAATGGATGATTTGA-3′ |
| R: 5′-GGCATTCTGGGAGCTTCATCT-3′ | |
| p21 | F: 5′-CTGGACTGTTTTCTCGGCTC-3′ |
| R: 5′-TGTATATTCAGCATTGTGGGAGGA-3′ | |
| MDM2 | F: 5′-ATGAATCCCCCTTCCAT-3′ |
| R: 5′-CAGGAAGCCAATTCTCACGAA-3′ | |
| PUMA | F: 5′-ACAGTACGAGCGGCGGAGACAA-3′ |
| R: 5′-GGCGGGTGCAGGCACCTAATT-3′ | |
| miR-149-3p | RT: 5′-GTCGTATCCAGTGCAGGGTCGCACTGG ATACGACGCACAG-3′ |
| F: 5′-ACAGGGAGGGGGG-3′ | |
| R: 5′-ATCCAGTGCAGGGTCCGAGG-3′ | |
| miR-128-3p | RT: 5′-TCGTATCCAGTGCAGGGTATTCGCACTGGA TACGACAAAGAG-3′ |
| F: 5′-CGCGTCACAGTGAACCGGT-3′ | |
| R: 5′-AGTGCAGGGTCCGAGGTATT-3′ | |
| miR-500a-5p | RT: 5′-GTCGTATCCAGTGCGTCGTGGAGTCGGCAATTGCAC TGGATACGACTCTCACC-3′ |
Western blots
Dertigmicrogram totale eiwitlysaten werden geladen, en de primaire antilichamen werden toegepast: anti-PDK2 (sc-100534, Santa Cruz, Californië, VS), anti-p-PDHA1 (S293) (ABS204, Merck, Darmstadt, Duitsland), anti-PDHA1 (ab168379, Abcam, Cambridge, VK), anti-p53 (sc-126, Santa Cruz, Californië, VS), anti-c-PARP (D64E10, CST, Massachusetts, VS), anti-Bax (D2E11, CST, Massachusetts, VS), anti-LC3B (L7543, sigma, MO, VS), anti-GAPDH (Proteintech, Wuhan, China), en anti-α-tubuline (Proteintech, Wuhan, China). De secundaire antilichamen werden gekocht bij Sungene (Tianjin, China). De blot assays werden in beeld gebracht door een chemiluminescentie beeldvormingssysteem (Bioshine, Shanghai, China).
Chromatine-immunoprecipitatie (ChIP)
HCT116-cellen, gezaaid in platen van 10 cm, werden gedurende 24 uur behandeld met of zonder 20 mM DCA, waarna celfixatie en chromosoomfragmentatie werden uitgevoerd volgens de instructies van de fabrikant (Pierce Agarose ChIP Kit, Thermo). Het chromatine werd geïncubeerd met IgG en anti-p53 antilichamen (Sigma, MO, USA) bij 4°Cnacht. Na incubatie werd 60 ul proteïne A agarose/zalm sperma DNA toegevoegd. Vervolgens werd het neergeslagen complex gewassen met IP-wasbuffers 1, 2 en 3, en geëlueerd met elutiebuffer. De verknoping werd omgekeerd door toevoeging van 6 μl 5 M NaCl en 2 ul proteinase K bij 65°C gedurende 1,5 uur. Het immunogeprecipiteerde DNA en het DNA van het hele celextract (input) werden gezuiverd en vervolgens gebruikt voor PCR-analyses met de relevante primers. Een controleprimer werd gebruikt om het experiment te controleren. De primer-sequenties voor de PCR zijn weergegeven in aanvullende tabel 3.
Subcutane tumor xenograft in naakte muizen en micro-PET/CT beeldvorming
Eerst werden 1×107 HCT-8/F cellen verdund in 100 ul PBS subcutaan geïmplanteerd in naakte muizen (mannelijk, 6 weken). De muizen werden na 12 dagen willekeurig verdeeld in zes groepen (zes per groep). Muizen uit groep I tot en met groep IV kregen dagelijks een intraperitoneale injectie met respectievelijk PBS, DCA (50 mg/kg)/PBS, 5-FU (10 mg/kg)/PBS, en 5-FU (10 mg/kg)/DCA (50 mg/kg). Muizen uit groep V en groep VI werden om de dag intratumoraal geïnjecteerd met respectievelijk PBS of DCA (50 mg/kg) en om de dag een intraperitoneale injectie met 5-FU (10 mg/kg). Het tumorvolume werd om de 3 dagen blind gemeten. De muizen werden na 3 weken behandeling gedood en de tumoren werden ontleed, gewogen en bij -80 °C ingevroren voor verder onderzoek.
Om te evalueren of miR-149-3p een chemo-sensitisatie effect uitoefent, werden nog eens twee groepen diermodellen opgericht. Muizen werden onderhuids geïmplanteerd met 6×106 HCT-8/F-cellen. Nadat de tumorgrootte ~50 mm3 was, kregen de muizen om de andere dag een intraperitoneale dosis 5-FU (10 mg/kg) alsmede een intratumorale injectie van 5 nmol cholesterol-geconjugeerde miR-149-3p mimics of een NC om de 3 dagen gedurende 3 weken. Later werden drie muizen van elke groep ’s nachts gevast en intraveneus geïnjecteerd met 0,15 mCi 18F-FDG. 18F-FDG micro-PET-CT scanning (Siemens, Berlijn, Duitsland) werd uitgevoerd na 60 min. PET-opnamebeelden werden getoond met een pseudokleurkaart, waarbij de rode kleur een hoge 18F-FDG-opname aangaf. SUVmax en MTV werden gebruikt om de 18F-FDG-PET activiteit te bepalen. Alle experimenten en dierverzorging werden goedgekeurd door de Ethische Commissie van het Negende Volksziekenhuis verbonden aan het Medical College van de Shanghai Jiao Tong University.
Immunohistochemische en immunofluorescerende kleuring
Kort gezegd werden weefselcoupes bij 4 °C geïncubeerd met de primaire antilichamen tegen Ki67 (Servicebio, Wuhan, China) en PDK2 (Proteintech, Wuhan, China) en vervolgens geïncubeerd met het secundaire antilichaam. De chromogene reactie werd uitgevoerd met 3,3-diaminobenzidine en gecontrasteerd met hematoxyline. De immunoreactieve score (IRS) werd berekend door twee onderzoekers die blind waren voor de groepstoewijzing. IRS = SI (kleurintensiteit) × PP (percentage positieve cellen). SI werd als volgt toegekend: 0 × negatief; 1 × zwak; 2 × matig; 3 × sterk. PP wordt gedefinieerd als 0 × 0%; 1 × 0-25%; 2 × 25-50%; 3 × 50-75%; 4 × 75-100%. Zes millimeter diepvriesdoorsneden werden gekleurd met een TUNEL-reactiekit (Roche, Basel, Zwitserland) en gecontrasteerd met DAPI. De beelden werden vastgelegd met een fluorescentiemicroscoop met geschikte excitatie- en emissiefilters.
Statistische analyse
De gegevens werden geanalyseerd met GraphPad Prism 6.0 software. De gegevens worden gepresenteerd als het gemiddelde ± SD/SEM van drie onafhankelijke experimenten. Elk experiment werd ten minste driemaal uitgevoerd. Tweezijdige Student’s t-test werd gebruikt om verschillen tussen de twee groepen te vergelijken. Eenzijdige ANOVA gevolgd door Bonferroni’s post-hoc test werd gebruikt voor meervoudige vergelijkingen. De Kaplan-Meier curven voor overlevingsanalyses werden bepaald met behulp van de log-rank test. De relatie tussen miR-149-3p en PDK2 werd geëvalueerd met behulp van Spearman’s rangcorrelatiecoëfficiëntanalyse. Een P-waarde <0,05 werd als statistisch significant beschouwd.
Dankbetuigingen
Dit werk werd ondersteund door de National Natural Science Foundation van China (81272745, 81872419, en 81272404) en het programma voor hoogleraar speciale aanstelling (Eastern Scholar to JW) aan de Shanghai Institutions of Higher Learning. Wij danken Dr Yanhong Gu voor het verstrekken van de 5-FU-resistente HCT116 cellijnen en Dr Hua Lu voor het verstrekken van de p53 plasmide.
Naleving van ethische normen
Belangenverstrengeling
De auteurs verklaren dat zij geen belangenverstrengeling hebben.
Noot van de uitgever
Springer Nature blijft neutraal met betrekking tot juridische claims in gepubliceerde kaarten en institutionele affiliaties.
Open Access
Dit artikel is gelicenseerd onder een Creative Commons Naamsvermelding 4.0 Internationale Licentie, die gebruik, delen, aanpassen, verspreiden en reproduceren toestaat in elk medium of formaat, zolang je de originele auteur(s) en de bron vermeldt, een link geeft naar de Creative Commons licentie en aangeeft of er wijzigingen zijn aangebracht. De afbeeldingen of ander materiaal van derden in dit artikel zijn opgenomen in de Creative Commons licentie van het artikel, tenzij anders aangegeven in een creditregel bij het materiaal. Als materiaal niet is opgenomen in de Creative Commons licentie van het artikel en je beoogde gebruik niet is toegestaan door wettelijke regelgeving of het toegestane gebruik overschrijdt, dien je rechtstreeks toestemming te verkrijgen van de auteursrechthebbende. Ga voor een kopie van deze licentie naar http://creativecommons. org/licenses/by/4.0/.
REFERENTIES
1 Chen W, Sun K, Zheng R, Zeng H, Zhang S, Xia C, et al. Cancer incidence and mortality in China, 2014. Chin J Cancer Res. 2018;30:1-12.2 Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA: Cancer J Clin. 2018;68:7-30.
3 Allen KT, Chin-Sinex H, DeLuca T, Pomerening JR, Sherer J, Watkins JB 3rd, et al. Dichlooracetaat verandert het Warburg-metabolisme, remt de celgroei en verhoogt de röntgengevoeligheid van menselijke A549 en H1299 NSC longkankercellen. Free Radic Biol Med. 2015;89:263-73.
4 Benci JL, Xu B, Qiu Y, Wu TJ, Dada H, Twyman-Saint Victor C, et al. Tumor-interferonsignalering regelt een multigenetisch resistentieprogramma tegen immuuncheckpointblokkade. Cell. 2016;167: 1540-54 e12.
5 Morgan RA, Yang JC, Kitano M, Dudley ME, Laurencot CM, Rosenberg SA. Case report of a serious adverse event following the administration of T cells transduced with a chimere antigen receptor recognizing ERBB2. Mol Ther: J Am Soc Gene Ther. 2010;18:843-51. Dichlooracetaat herstelt de chemosensitiviteit van colorectale kanker via de p53/miR-149-3p/PDK2-gemedieerde. . . 483
6 Miller KD, Siegel RL, Lin CC, Mariotto AB, Kramer JL, Rowland JH, et al. Cancer treatment and survivorship statistics, 2016. CA: Cancer J Clin. 2016;66:271-89.
7 Hammond WA, Swaika A, Mody K. Pharmacologic resistance in colorectal cancer: a review. Therapeutic Adv Med Oncol. 2016;8:57-84.
8 Douillard JY, Cunningham D, Roth AD, Navarro M, James RD, Karasek P, et al. Irinotecan gecombineerd met fluorouracil vergeleken met fluorouracil alleen als eerstelijnsbehandeling voor uitgezaaide colorectale kanker: een multicentrische gerandomiseerde trial. Lancet. 2000;355:1041-7.
9 Saltz LB, Cox JV, Blanke C, Rosen LS, Fehrenbacher L, Moore MJ, et al. Irinotecan plus fluorouracil en leucovorin voor uitgezaaide colorectale kanker. Irinotecan Studiegroep. New Engl J Med. 2000;343:905-14.
10 Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-74.
11 Matthew G, Vander Heiden LCC, Craig BT. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 2009;324:1029-33.
12 Adekola K, Rosen ST, Shanmugam M. Glucose transporters in cancer metabolism. Curr Opin Oncol. 2012;24:650-4.
13 Shaw RJ. Glucose metabolisme en kanker. Curr Opin Cell Biol. 2006;18:598-608.
14 Van Dang C, Pollak M. Waarom kanker & metabolisme? Waarom nu? Cancer Metab. 2013;1:1.
15 Zhao Y, Butler EB, Tan M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death Dis. 2013;4:e532.
16 Cairns RA, Harris IS, Mak TW. Regeling van het kankercelmetabolisme. Nat Rev Cancer. 2011;11:85-95.
17 Xu RH, Pelicano H, Zhou Y, Carew JS, Feng L, Bhalla KN, et al. Inhibition of glycolysis in cancer cells: a novel strategy to overcome drug resistance associated with mitochondrial respiratory defect and hypoxia. Cancer Res. 2005;65:613-21.
18 Guo WQZ, Wang Z, et al. MiR-199a-5p is negatief geassocieerd met maligniteiten en reguleert glycolyse en lactaatproductie door zich te richten op hexokinase 2 in leverkanker. Hepatology. 2015;62:1132-44.
19 Qiu Z, Guo W, Wang Q, Chen Z, Huang S, Zhao F, et al. MicroRNA-124 vermindert de pentosefosfaatroute en proliferatie door zich te richten op PRPS1 en RPIA mRNA’s in menselijke colorectale kankercellen. Gastroenterology. 2015;149:1587-98 e11.
20 Chen D, Wang H, Chen J, Li Z, Li S, Hu Z, et al. MicroRNA-129- 5p reguleert glycolyse en celproliferatie door zich te richten op de glucosetransporter SLC2A3 in maagkankercellen. Front Pharmacol. 2018;9:502.
21 Bartel DP. MicroRNA’s: genomica, biogenese, mechanisme en functie. Cell. 2004;116:281-97.
22 Garzon R, Calin GA, Croce CM. MicroRNAs in Cancer. Annu Rev Med. 2009;60:167-79.
23 Huang S, He X. microRNA’s: kleine RNA-moleculen, enorme drijvende krachten om de cel in beweging te brengen. Protein Cell. 2010;1:916-26.
24 Zhang Y, Wang J. MicroRNAs are important regulators of drug resistance in colorectal cancer. Biol Chem. 2017;398:929-38.
25 Stacpoole PW, Nagaraja NV, Hutson AD. Werkzaamheid van dichlooracetaat als lactaatverlagend geneesmiddel. J Clin Pharmacol. 2003;43:683-91.
26 Kankotia S, Stacpoole PW. Dichloroacetate and cancer: new home for an orphan drug? Biochim Biophys Acta. 2014;1846:617-29.
27 Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM. Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex. Biochemical J. 1998;329(Pt 1):191-6.
28 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, et al. A mitochondria-K + channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer cell 2007;11:37-51.
29 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med. 2010;2:31ra4.
30 Chu QS, Sangha R, Spratlin J, Vos LJ, Mackey JR, McEwan AJ, et al. A phase I open-labeled, single-arm, dose-escalation, study of dichloroacetate (DCA) in patients with advanced solid tumors. Invest New Drugs. 2015;33:603-10.
31 Papandreou I, Goliasova T, Denko NC. Antikankermedicijnen die het metabolisme aanpakken: is dichlooracetaat het nieuwe paradigma? Int J Cancer. 2011;128:1001-8.
32 Michelakis ED, Webster L, Mackey JR. Dichlooracetaat (DCA) als potentiële metabool-gerichte therapie voor kanker. Br J Cancer. 2008;99:989-94.
33 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG. Dichloroacetate induceert apoptose en celcyclusstilstand in colorectale kankercellen. Br J Cancer. 2010;102:1746-52.
34 Shahrzad S, Lacombe K, Adamcic U, Minhas K, Coomber BL. Natriumdichlooracetaat (DCA) vermindert apoptose in colorectale tumorhypoxie. Cancer Lett. 2010;297:75-83.
35 Bertoli G, Cava C, Castiglioni I. MicroRNAs: new biomarkers for diagnosis, prognosis, therapy prediction and therapeutic tools for breast cancer. Theranostics 2015;5:1122-43.
36 Cao D, Jia Z, You L, Wu Y, Hou Z, Suo Y, et al. 18betaglycyrrhetinic acid suppresses gastric cancer by activation of miR149-3p-Wnt-1 signaling. Oncotarget. 2016;7:71960-73.
37 Si L, Xu L, Yin L, Qi Y, Han X, Xu Y, et al. Potent effects of dioscin against pancreatic cancer via miR-149-3P-mediated inhibition of the Akt1 signalling pathway. Br J Pharm. 2017;174:553-68.
38 Kato M, Li J, Chuang JL, Chuang DT. Distinct structural mechanisms for inhibition of pyruvate dehydrogenase kinase isoforms by AZD7545, dichloroacetate, and radicicol. Structure. 2007;15:992-1004.
39 Abbot EL, McCormack JG, Reynet C, Hassall DG, Buchan KW, Yeaman SJ. Diverging regulation of pyruvate dehydrogenase kinase isoform gene expression in cultured human muscle cells. FEBS J. 2005;272:3004-14.
40 Bhattacharya B, Low SH, Soh C, Kamal Mustapa N, BelouecheBabari M, Koh KX, et al. Increased drug resistance is associated with reduced glucose levels and an enhanced glycolysis phenotype. Br J Pharm. 2014;171:3255-67.
41 Stacpoole PW. De farmacologie van dichlooracetaat. Metab: Clin Exp. 1989;38:1124-44.
42 Shroads AL, Guo X, Dixit V, Liu HP, James MO, Stacpoole PW. Age-dependent kinetics and metabolism of dichloroacetate: possible relevance to toxicity. J Pharmacol Exp Therap. 2008;324:1163-71.
43 Velpula KK, Bhasin A, Asuthkar S, Tsung AJ. Combined targeting of PDK1 and EGFR triggers regression of glioblastoma by reversing the Warburg effect. Cancer Res. 2013;73:7277-89.
44 Kluza J, Corazao-Rozas P, Touil Y, Jendoubi M, Maire C, Guerreschi P, et al. Inactivation of the HIF-1alpha/ PDK3 signaling axis drives melanoma towards mitochondrial oxidative metabolism and potentiates the therapeutic activity of pro-oxidants. Cancer Res. 2012;72:5035-47.
45 Xuan Y, Hur H, Ham IH, Yun J, Lee JY, Shim W, et al. Dichloroacetate attenuates hypoxia-induced resistance to 5- fluorouracil in gastric cancer through the regulation of glucose metabolism. Exp Cell Res. 2014;321:219-30.
46 Shen YC, Ou DL, Hsu C, Lin KL, Chang CY, Lin CY, et al. Activering van oxidatieve fosforylering door een pyruvaat dehydrogenase kinase remmer overwint sorafenib resistentie van hepatocellulair carcinoom. Br J Cancer. 2013;108:72-81. 484 Y. Liang et al.
47 Roh JL, Park JY, Kim EH, Jang HJ, Kwon M. Activation of mitochondrial oxidation by PDK2 inhibition reverses cisplatin resistance in head and neck cancer. Cancer Lett. 2016;371:20-9.
48 Kimmelman AC, White E. Autofagie en tumormetabolisme. Cell Metab 2017;25:1037-43.
49 Sutendra G, Dromparis P, Kinnaird A, Stenson TH, Haromy A, Parker JM, et al. Mitochondriale activering door remming van PDKII onderdrukt HIF1a signalering en angiogenese in kanker. Oncogene. 2013;32:1638-50.
50 Gudi R, Bowker-Kinley MM, Kedishvili NY, Zhao Y, Popov KM. Diversity of the pyruvate dehydrogenase kinase gene family in humans. J Biol Chem. 1995;270:28989-94.
51 Sugden MC, Holness MJ. Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs. Am J Physiol Endocrinol Metab. 2003; 284: E855-62.
52 Li G, Li M, Hu J, Lei R, Xiong H, Ji H, et al. The microRNA-182- PDK4 axis regulates lung tumorigenesis by modulating pyruvate dehydrogenase and lipogenesis. Oncogene. 2017;36:989-98.
53 Bellazzo A, Di Minin G, Valentino E, Sicari D, Torre D, Marchionni L, et al. Cel-autonome en cel niet-autonome downregulatie van tumorsuppressor DAB2IP door microRNA-149- 3p bevordert agressiviteit van kankercellen. Cell Death Differ. 2018;25:1224-38.
54 Vazquez A, Bond EE, Levine AJ, Bond GL. De genetica van de p53 pathway, apoptose en kankertherapie. Nat Rev Drug Discov. 2008;7:979-87.
55 Gnanapradeepan K, Basu S, Barnoud T, Budina-Kolomets A, Kung CP, Murphy ME. De p53 tumorsuppressor in de controle van metabolisme en ferroptose. Front Endocrinol. 2018;9:124.
56 Contractor T, Harris CR. p53 reguleert negatief de transcriptie van het pyruvaat dehydrogenase kinase Pdk2. Cancer Res. 2012;72:560-7.
57 Iacopetta B. TP53-mutatie in colorectale kanker. Hum Mutat. 2003;21:271-6.
58 Kim JW, Dang CV. Cancer’s molecular sweet tooth and the Warburg effect. Cancer Res. 2006;66:8927-30.
59 Hulse M, Caruso LB, Madzo J, Tan Y, Johnson S, Tempera I. Poly(ADP-ribose) polymerase 1 is noodzakelijk voor het coactiveren van hypoxia-inducible factor-1-afhankelijke genexpressie door EpsteinBarr-virus latent membraaneiwit 1. PLoS Pathog. 2018;14: e1007394.
60 Hlouschek J, Ritter V, Wirsdorfer F, Klein D, Jendrossek V, Matschke J. Targeting SLC25A10 alleviates improved antioxidant capacity and associated radioresistance of cancer cells induced by chronic-cycling hypoxia. Cancer Lett. 2018;439:24-38.
Gerelateerde inhoud: