Bo Li1,*, Xinzhe Li1,*, Zhenhong Ni1, Yan Zhang1, Yijun Zeng1, Xiaohuan Yan2, Yan Huang3, Jintao He4, Xilin Lyu1, Yaran Wu1, Yuting Wang1, Yingru Zheng2, Fengtian He1
1 Afdeling Biochemie en Moleculaire Biologie, College of Basic Medical Sciences, Derde Militaire Medische Universiteit,
Chongqing 400038, China
2 Afdeling Verloskunde en Gynaecologie, Daping Ziekenhuis en Onderzoeksinstituut voor Chirurgie, Derde Militaire Medische
Universiteit, Chongqing 400042, China
3 Kankercentrum, Daping Ziekenhuis en Onderzoeksinstituut voor Chirurgie, Derde Militaire Medische Universiteit, Chongqing 400042,
China
4 Bataljon 17 van Studenten, College voor Preventieve Geneeskunde, Derde Militaire Medische Universiteit, Chongqing 400038, China
* Deze auteurs hebben in gelijke mate bijgedragen aan dit werk
Correspondentie:
Yingru Zheng, e-mail: [email protected]
Fengtian He, e-mail: [email protected]
Ontvangen: 24 januari 2016
Geaccepteerd: 09 juli 2016
Gepubliceerd: 19 juli 2016
Abstract
Zowel dichlooracetaat (DCA) en metformine (Met) hebben aangetoond veelbelovende antitumor effectiviteit door het reguleren van kankercel metabolisme. Echter, de DCA-gemedieerde beschermende autofagie en Met-geïnduceerde lactaataccumulatie beperken respectievelijk hun tumordodend potentieel. Dus het overwinnen van de overeenkomstige tekorten zal hun therapeutische effecten verbeteren. In de huidige studie vonden we dat DCA en Met synergetisch de groei remden en de apoptose van eierstokkankercellen verbeterden. Interessant is dat wij voor het eerst onthulden dat Met DCA overgevoelig maakte via dramatische afzwakking van DCA-geïnduceerd Mcl-1 eiwit en beschermende autofagie, terwijl DCA Met overgevoelig maakte via duidelijke verlichting van Met-geïnduceerde overmatige lactaataccumulatie en glucoseverbruik. De in vivo experimenten in naakte muizen toonden ook aan dat DCA en Met synergetisch de groei van xenograft ovariumtumoren onderdrukten. Deze resultaten kunnen de weg vrijmaken voor het ontwikkelen van nieuwe strategieën voor de behandeling van eierstokkanker, gebaseerd op het gecombineerde gebruik van DCA en Met.
Trefwoorden: dichlooracetaat, metformine, Mcl-1, kankermetabolisme, eierstokkanker
INLEIDING
De mortaliteit van eierstokkanker staat bovenaan de lijst van verschillende soorten gynaecologische kanker. Momenteel zijn op platina en taxol gebaseerde chemotherapieën nog steeds het standaardparadigma naast chirurgie, maar hun bijwerkingen zijn ernstig en er is ook chemoresistentie ontstaan [1-2]. Daarom is het dringend noodzakelijk nieuwe strategieën te onderzoeken als alternatief voor de traditionele chemotherapie. De laatste jaren heeft het groeiende bewijsmateriaal aangetoond dat kanker een soort metabole afwijkingen is, waardoor het op de voorgrond treedt door het reguleren van het kankermetabolisme om de tumorgroei te remmen [3]. Door zich te richten op belangrijke metabolische routes worden talrijke kankercellen, waaronder eierstokkankercellen, aanzienlijk gedood [4-5]. Onder verschillende metabole geneesmiddelen hebben dichlooracetaat (DCA) en metformine (Met) charmante vooruitzichten getoond vanwege hun positieve functies in kankertherapie.
Als mitochondriën-gerichte stof kan DCA de activiteit van pyruvaatdehydrogenase kinase (PDK) remmen en vervolgens de activiteit van pyruvaatdehydrogenase (PDH) verhogen, wat de stroom van koolhydraten naar de mitochondriën bevordert en daardoor de aërobe oxidatie van glucose verbetert. Dit effect keert mitochondriale disfunctie om en reactiveert mitochondria-afhankelijke apoptose in verschillende tumorcellen [6-9]. Tegelijkertijd remt DCA de glycolyse en vermindert het de accumulatie van lactaat, waardoor de verzuurde tumormicro-omgeving wordt vernietigd (De verzuurde micro-omgeving is over het algemeen gunstig voor de overleving van de tumor) [10]. Hoewel DCA veelbelovend is gebleken in de strijd tegen kanker, is gemeld dat DCA beschermende autofagie induceert in darmkankercellen, wat op zijn beurt de apoptotische capaciteit belemmert [11]. Tot dusver is het nog onduidelijk of er een andere apoptose-geassocieerde resistente determinant is wanneer DCA de mitochondriale apoptose herstelt.
Met is een traditioneel geneesmiddel van de eerstelijnstherapie voor diabetes type 2. De laatste jaren blijkt uit verschillende epidemiologische studies dat Met ook het risico op kanker kan verminderen [12]. Met onderdrukt tumorgroei door het induceren van cyclusstilstand, het bevorderen van apoptose en het onderdrukken van autofagie [13-15]. Bovendien kan Met sommige chemotherapeutische geneesmiddelen zoals paclitaxel, erlotinib, enz. sensibiliseren. [16-17]. Nog opvallender is dat het anti-tumor effect van Met steeds meer in verband wordt gebracht met het glucosemetabolisme van kanker [18]. Ondanks verschillende voordelen in klinische studies, wordt Met belemmerd voor verdere toepassing omdat het zou kunnen leiden tot lactaat accumulatie [19]. Het is van groot belang of dit nadeel kan worden overwonnen door een combinatie van andere metabole geneesmiddelen, zodat Met op grotere schaal kan worden gebruikt bij chemotherapie.
Gezien hun mogelijke wederzijdse compenserende effecten, zochten wij uit of DCA en Met elkaar kunnen versterken om de cytotoxiciteit in eierstokkankercellen te verhogen. In de huidige studie toonden we aan dat DCA en Met samen apoptose kunnen induceren in eierstokkankercellen. Met sensibiliseerde DCA via dramatische verzwakking van DCA-geïnduceerde Mcl-1 en beschermende autofagie, terwijl DCA Met sensibiliseerde via duidelijke verlichting van Met-geïnduceerde overmatige lactaataccumulatie en glucoseverbruik. De in vivo experimenten in naakte muizen toonden ook aan dat DCA en Met synergetisch de groei van xenograft ovariumtumoren onderdrukten. Deze resultaten suggereren dat deze therapeutische strategie een veelbelovende keuze kan zijn voor toekomstige op het metabolisme gebaseerde gerichte kankertherapie.
RESULTATEN
DCA en Met induceren synergetisch apoptose in ovariumkankercellen
Om te onderzoeken of er een synergetisch effect is tussen DCA en Met bij het onderdrukken van de groei van ovariumkankercellen, werden SKOV3- en OVCAR3-cellen gezamenlijk behandeld met DCA en Met of elk afzonderlijk. Zoals getoond in figuur 1A-1C werd de groei van de eierstokkankercellen efficiënter onderdrukt door gelijktijdige behandeling met DCA en Met dan met elk afzonderlijk, en de combinatie van 40 mM DCA en 10 mM Met kon de levensvatbaarheid van de cellen remmen tot wel 50% in vergelijking met de controle. Daarom kozen wij in de volgende experimenten voor 40mM DCA en 10mM Met. Het synergetische remmende effect werd ook waargenomen bij baarmoederhalskankercellen (HeLa en SiHa), niet-kleincellige longkankercellen (A549 en GLC-82) en menselijke hepatocellulaire carcinoomcellen (HepG2) (figuur S1A-1D), wat suggereert dat het synergisme tussen DCA en Met tot op zekere hoogte universeel kan zijn. Bovendien induceerden DCA en Met synergetisch apoptose in eierstokkankercellen, zoals blijkt uit Flow Cytometrie-analyse van annexine V-FITC (fluoresceïne-isothiocyanaat) en PI (prodiumjodide) dubbele kleuring (figuur 1D), Hoechst-kleuring van apoptotische lichamen (figuur 1E), Western blot-analyse van gekloofd PARP (poly ADP-ribose polymerase, een marker van apoptose) (figuur 1F) en caspase3-activiteitstest (figuur 1G).
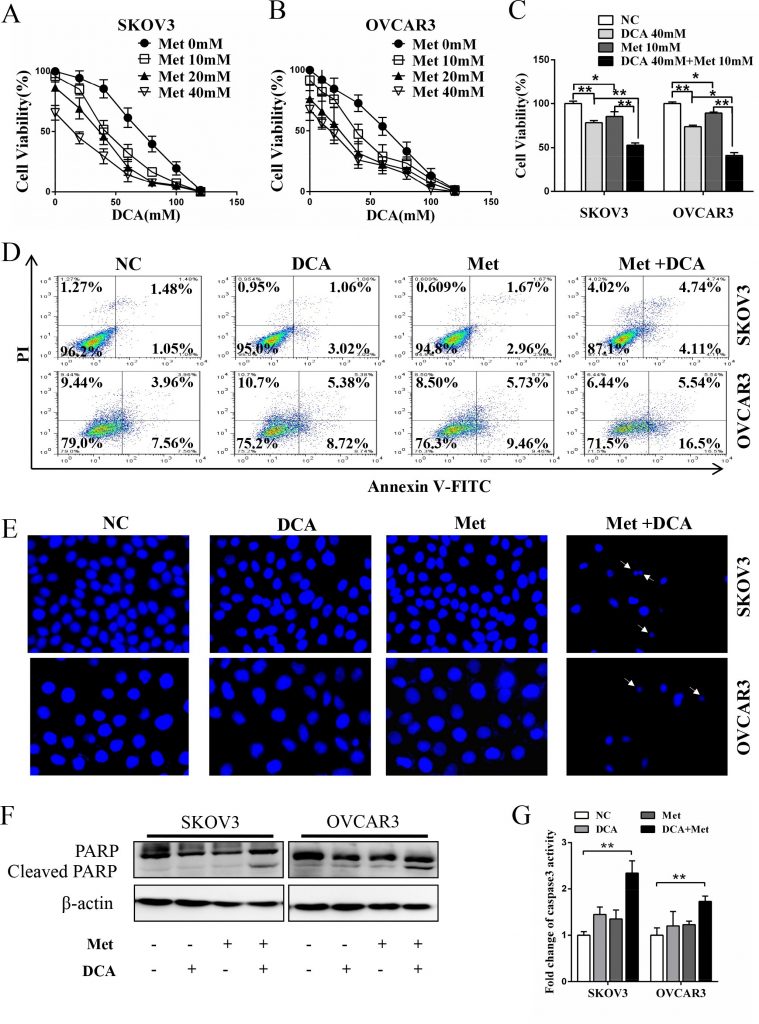
Met sensibiliseert DCA via het afzwakken van DCA-geïnduceerde Mcl-1
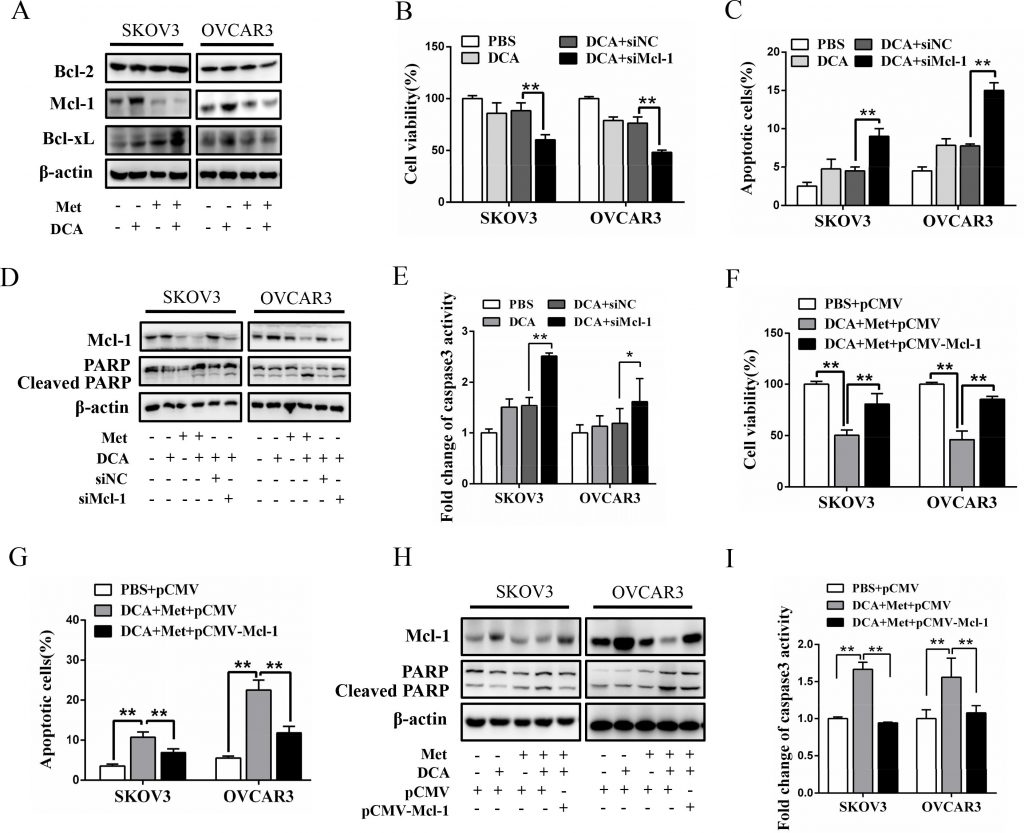
Om het mechanisme te onderzoeken waardoor Met DCA sensibiliseert om apoptose te induceren, onderzochten we de expressie van de cruciale anti-apoptotische Bcl-2 familieleden, waaronder Mcl-1, Bcl-2 en Bcl-xL [20]. Zoals getoond in figuur 2A, verhoogde DCA alleen het niveau van Mcl-1 eiwit (maar niet Bcl-2 en Bcl-xL eiwitten) aanzienlijk in ovariumkankercellen, hetgeen duidelijk werd afgezwakt door Met. Stillegging van Mcl-1 door siRNA verbeterde de door DCA gemedieerde remming van de levensvatbaarheid van de cellen (figuur 2B), en verhoogde de door DCA veroorzaakte apoptose (figuur 2C-2E). Bovendien verminderde ectopische expressie van Mcl-1 drastisch het sensibiliserende effect van Met op DCA op de levensvatbaarheid en apoptose van de cellen (figuur 2F-2I). Deze resultaten gaven aan dat Mcl-1 een nieuwe resistente factor van DCA is, en Met sensibiliseert DCA via downregulering van Mcl-1.
Met verzwakt DCA-geïnduceerde Mcl-1 door remming van Mcl-1 translatie
Om op te helderen op welk niveau DCA Mcl-1 induceert, werd eerst het mRNA van Mcl-1 onderzocht. Zoals getoond in figuur 3A had DCA geen duidelijk effect op de mRNA-expressie van Mcl-1. Vervolgens werd het Mcl-1 eiwit geanalyseerd in aanwezigheid of afwezigheid van de translatieremmer cycloheximide (CHX). Zoals getoond in figuur 3B en 3C, verminderde CHX tijdsafhankelijk het basale (maar niet door DCA geïnduceerde) Mcl-1-eiwit, hetgeen erop wijst dat DCA de stabiliteit van het Mcl-1-eiwit verhoogt. Er is gemeld dat de gefosforyleerde ERK (p-ERK) en p-JNK Mcl-1 kunnen stabiliseren door Mcl-1 te fosforyleren op Thr163 [21-22], dus onderzochten we of p-ERK/p-JNK betrokken is bij de regulering van door DCA geïnduceerd Mcl-1. Zoals getoond in figuur 3D, verhoogde behandeling met DCA significant p-ERK (maar niet p-JNK) en p-Mcl-1Thr163 in ovariumkankercellen. Bovendien kon de MEK1/2-remmer U0126 de door DCA geïnduceerde Mcl-1 en p-Mcl-1Thr163 drastisch afzwakken, en de gekloofde PARP duidelijk versterken (figuur 3E). Deze resultaten wezen erop dat p-ERK (maar niet p-JNK) een mediator is van DCA-geïnduceerd Mcl-1. Eerdere studies hebben aangetoond dat DCA Reactieve Zuurstofspecies (ROS) verhoogt [23], en ROS is een belangrijke inducer van p-ERK [24], dus onderzochten we het niveau van ROS met DCFH-DA. Zoals getoond in figuur S2A, verhoogde DCA de generatie van ROS, wat suggereert dat de inductie van ROS een mechanisme kan zijn waardoor DCA de p-ERK activering versterkt.
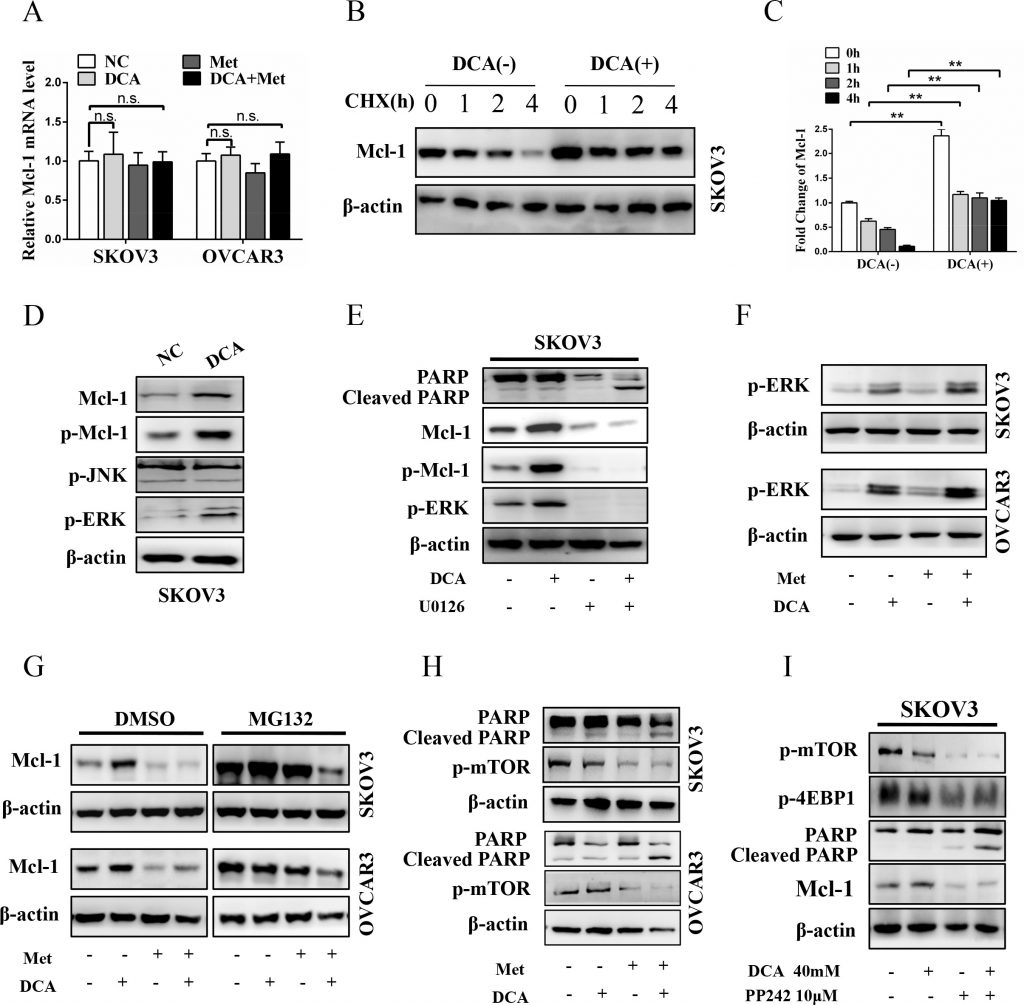
Bovendien is Ser159 ook nauw verbonden met de stabiliteit van Mcl-1 en deze plaats wordt voornamelijk gefosforyleerd door GSK-3β [25], dus we testten of GSK-3β ook betrokken is bij de regulering van DCA-geïnduceerde Mcl-1 stabilisatie. Zoals getoond in figuur S2B verhoogde DCA de fosforylering van GSK-3β, maar had het geen effect op de totale GSK-3β. Bovendien verhoogde DCA de fosforylering van Akt (een upstream signaalmolecuul van GSK-3β), en de Akt-remmer MK-2206 2HCl verminderde DCA-geïnduceerde GSK-3β-fosforylering, Mcl-1-verhoging en apoptose-resistentie dramatisch (figuur S2C). Deze resultaten gaven aan dat p-Akt-gemedieerde fosforylering van GSK-3β de DCA-geïnduceerde Mcl-1 stabilisatie bevordert.
Vervolgens onderzochten we of Met de DCA-geïnduceerde Mcl-1 kan afzwakken door p-ERK/p-Akt te remmen. Zoals getoond in Figuur 3F en Figuur S2D, kon Met de DCA-geïnduceerde p-ERK en p-Akt niet onderdrukken, samen met de resultaten in Figuur 3A, wat aangeeft dat Met de DCA-geïnduceerde Mcl-1 noch op transcriptioneel noch op post-translationeel niveau vermindert. Vervolgens hebben we met de proteasoomremmer MG132 geanalyseerd of Met op translationeel niveau DCA-geïnduceerd Mcl-1 vermindert. Zoals getoond in figuur 3G waren, wanneer cellen werden behandeld met controle, DCA, Met of een combinatie daarvan, de eiwitniveaus van Mcl-1 even hoog in aanwezigheid van MG132 in vergelijking met DMSO, hetgeen erop wijst dat Met de door DCA geïnduceerde Mcl-1 afzwakt via remming van de Mcl-1 translatie. Er is gemeld dat activering van mTOR de translatie van Mcl-1 bevordert [26], dus analyseerden we p-mTOR na co-behandeling met Met en DCA. Zoals verwacht verminderde Met duidelijk het niveau van p-mTOR (figuur 3H), en de mTOR-remmer PP242 had een vergelijkbaar effect als Met op het bevorderen van apoptose (figuur 3I). Volgens de gegevens in figuur 3 en figuur S2 kunnen wij concluderen dat DCA Mcl-1 upreguleert via verhoging van de fosforylering van ERK en GSK-3β, en dat Met de translatie van Mcl-1 onderdrukt via remming van p-mTOR.
Met vermindert DCA-geïnduceerde beschermende autofagie
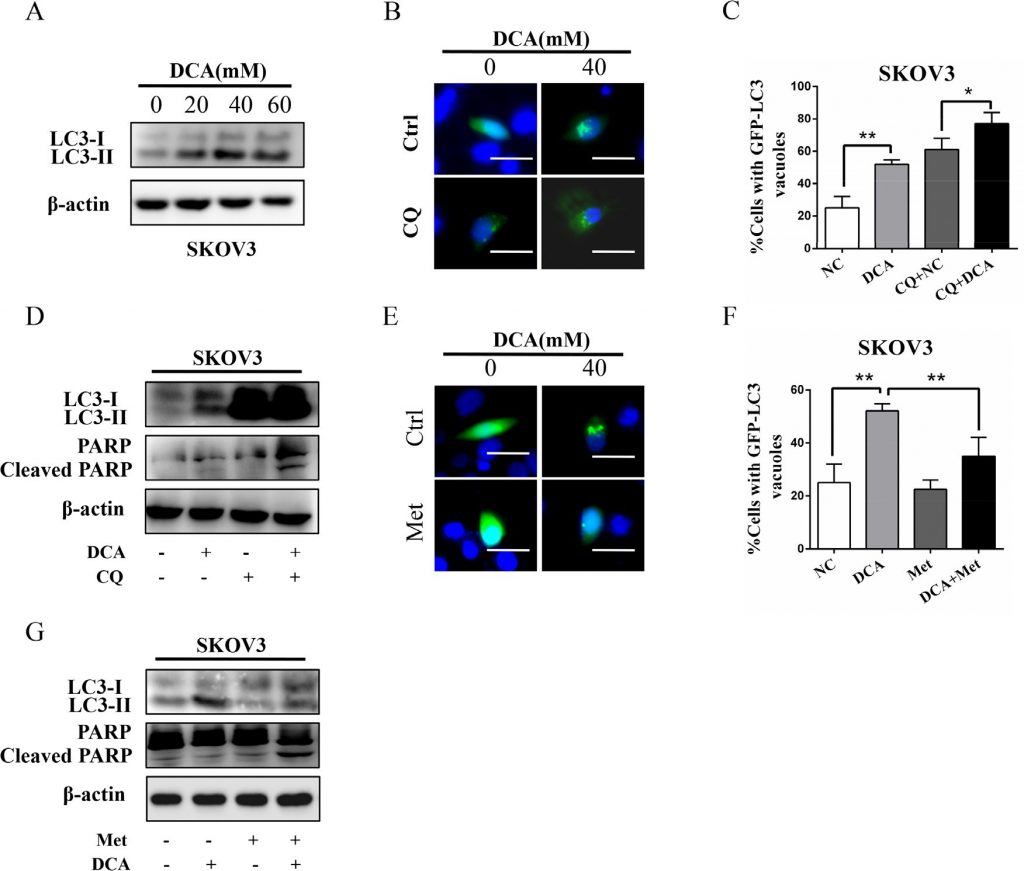
Eerdere studies hebben aangetoond dat autofagie een belangrijke rol speelt in de therapeutische resistentie van DCA in darmkankercellen [11], dus onderzochten we de rol van autofagie in eierstokkankercellen na behandeling met DCA of/en Met. Zoals getoond in figuur 4A, bevorderde DCA dosis-afhankelijk het niveau van MAP1LC3-II (LC3-II), de marker van autofagie. Remming van autofagie door chloroquine (CQ) of uitschakeling van ATG7 versterkte drastisch de door DCA geïnduceerde apoptose en cytotoxiciteit (figuur 4B-4D, figuur S3A-3D), wat erop wijst dat DCA beschermende autofagie in ovariumkankercellen induceert. Om het mechanisme van DCA-geïnduceerde autofagie vooraf te onderzoeken, onderzochten we de mRNA-veranderingen van 7 autofagie-gerelateerde genen in met DCA behandelde cellen. Zoals getoond in figuur S3E, verhoogde DCA dramatisch het mRNA-niveau van ATG7 in eierstokkankercellen, wat suggereert dat ATG7 betrokken kan zijn bij de door DCA geïnduceerde beschermende autofagie. Vervolgens vonden we dat Met opmerkelijk de DCA-geïnduceerde LC3-II verminderde (figuur 4E-4G), wat erop wijst dat Met de DCA-geïnduceerde beschermende autofagie kon afzwakken. Samenvattend kan worden gesteld dat het verzwakken van de door DCA geïnduceerde beschermende autofagie ook belangrijk is voor het sensibiliserende effect van Met op DCA.
DCA verlicht Met-geïnduceerd glucoseverbruik en lactaatproductie
Om te verduidelijken of DCA de tekorten aan Met kan overwinnen, werden de veranderingen van lactaat en glucose geanalyseerd. Zoals getoond in figuur 5A-5C, verhoogde Met de lactaatproductie en het glucoseverbruik, die opmerkelijk werden verlicht door DCA. Bovendien werden de cellulaire zuurstofconsumptiesnelheid (OCR) en de extracellulaire verzuringssnelheid (ECAR) gemeten. Zoals getoond in figuur 5D-5F, verminderde Met de verhouding van OCR/ECAR, die dramatisch werd afgezwakt door DCA, waaruit blijkt dat DCA de Met-geïnduceerde glycolyse kan onderdrukken via herstel van de mitochondriale ademhaling. Omdat DCA een remmer is van PDK’s die de activiteit van PDH fosforyleert en remt [9], onderzochten we het niveau van p-PDH. Zoals getoond in figuur 5G, verhoogde Met het niveau van p-PDHE1α (een subunit van PDH), dat duidelijk werd omgekeerd door DCA. Het uitschakelen van PDH met siRNA verminderde aanzienlijk de Met-geïnduceerde lactaatproductie (figuur 5H, 5I). Ectopische expressie van PDK1 en PDK2 verbeterde de fosfrylering van PDHE1α en verminderde de apoptose geïnduceerd door de co-behandeling met DCA en Met (figuur 5J, 5K), samen met de gegevens in figuur 5G-5I, wat aangeeft dat DCA Met kan sensibiliseren door het remmen van de PDK/PDH-route bij het doden van ovariumkankercellen.
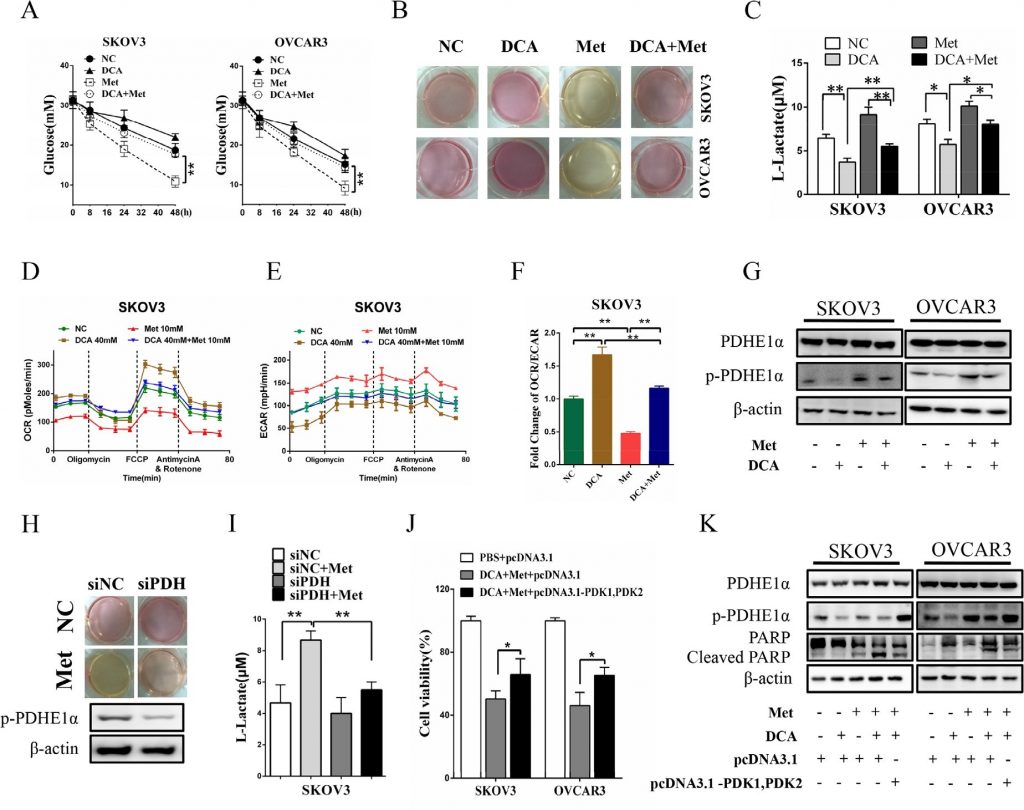
DCA en Met onderdrukken samen de groei van eierstokkankercellen in vivo
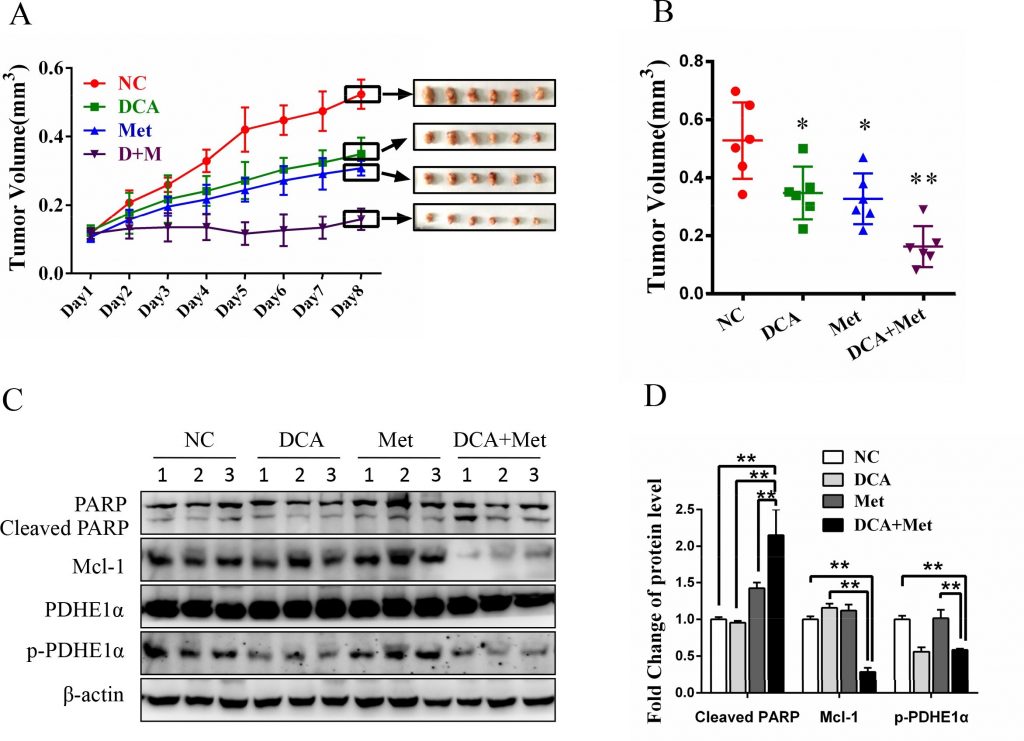
Zoals getoond in figuur 6A en 6B, onderdrukte co-behandeling met DCA en Met efficiënter de groei van xenograften van eierstokkanker in naakte muizen in vergelijking met de behandeling met DCA of Met alleen. Western blot analyse toonde aan dat DCA en Met synergetisch het gespleten PARP verhoogden en Mcl-1 en p-PDHE1α in de xenograften downreguleerden (figuur 6C-6D). Deze resultaten suggereren dat DCA en Met gezamenlijk de groei van eierstokkankercellen in vivo kunnen remmen door de tekorten van elkaar af te zwakken.
DISCUSSIE
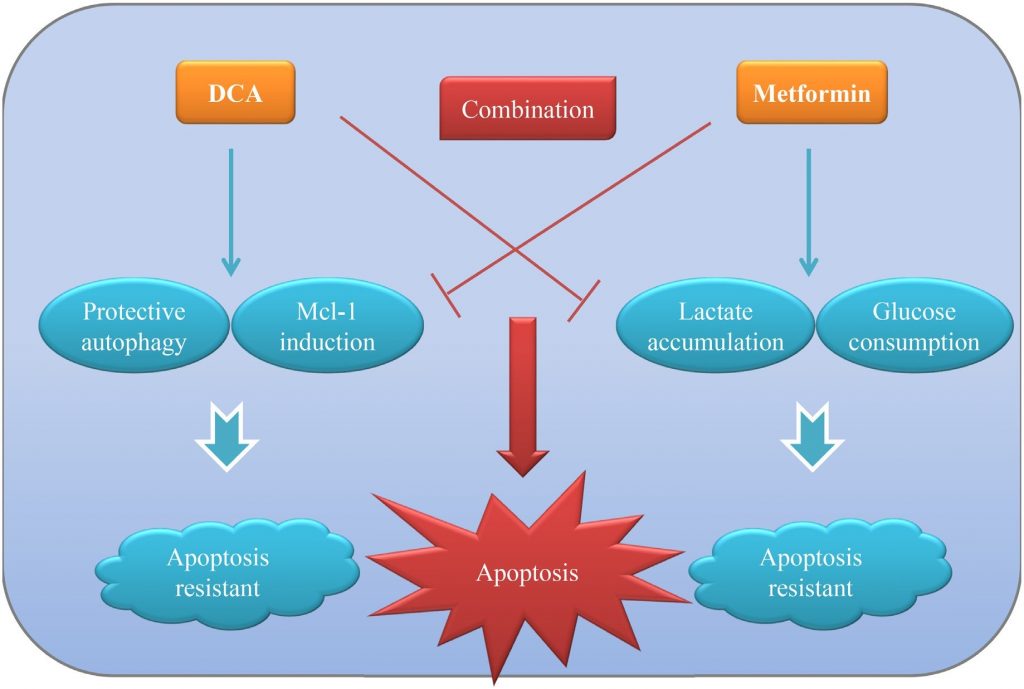
Het is bevestigd dat de meeste vaste tumoren worden gekenmerkt door het “Warburg-effect”, waarbij zij glycolyse gebruiken voor de energieproductie, ook al is er voldoende zuurstof. Door dit abnormale verschijnsel aan te pakken is de weg vrijgemaakt voor de ontwikkeling van nieuwe therapeutische strategieën tegen kanker, naast de traditionele cytotoxische geneesmiddelen. In de huidige studie toonden wij aan dat co-behandeling met DCA en Met (twee metabool-geassocieerde middelen) de groei van eierstokkankercellen efficiënter kan onderdrukken dan elk afzonderlijk in vitro en in vivo. Met vermindert de door DCA geïnduceerde Mcl-1 en beschermende autofagie, terwijl DCA de door Met geïnduceerde overmatige lactaataccumulatie en glucoseconsumptie verlicht. De wederzijdse voordelen van de twee middelen dragen bij tot een intense apoptose om eierstokkankercellen effectiever te doden. Het werkingsmodel van DCA en Met in combinatie werd getoond in figuur 7.
Hoewel er al jaren onderzoek wordt verricht, zijn de sleutelfactoren die het pro-apoptotische effect van DCA kunnen belemmeren nog niet duidelijk. Onze resultaten toonden aan dat Mcl-1 een cruciale weerstandsfactor is tegen DCA-geïnduceerde apoptose in eierstokkankercellen, en cotreatment met Met en DCA verminderde Mcl-1 en versterkte apoptose. De cotreatment leidde echter tot een toename van Bcl-xL (figuur 2A), wat kan dienen als compensatiemechanisme om de cel te laten overleven. Het soortgelijke verschijnsel is ook gerapporteerd in eerdere studie [27] (De studie toont aan dat Bcl-2/xL-remmer ABT-263 kankercelapoptose induceert en tegelijkertijd Mcl-1 verhoogt). Bovendien was de cotreatment-geïnduceerde Bcl-xL verhoging alleen aanwezig in SKOV3 (maar niet in OVCAR3) cellijn, hetgeen suggereert dat dit effect celspecifiek kan zijn. Natuurlijk moet het gedetailleerde mechanisme waardoor de cotreatment met Met en DCA Bcl-xL verhoogt, nog worden vastgesteld. Bij nader onderzoek bleek dat DCA de accumulatie van Mcl-1 induceerde via activering van ERK en Akt, waardoor Mcl-1 werd beschermd tegen proteasoomgemedieerde afbraak. Deze bevindingen suggereren dat remming van ERK en Akt een goede strategie kan zijn om DCA gevoelig te maken voor de behandeling van eierstokkanker. Onlangs is echter een tegenstrijdig resultaat gemeld, namelijk dat DCA het niveau van Mcl-1 verlaagt in AML-cellen [28] en colorectale kankercellen [ 29]. De discrepanties suggereren dat de relatie tussen DCA en Mcl-1 grotendeels verschillend kan zijn in verschillende contexten.
Autofagie is een katabool proces om essentiële metabolieten zoals aminozuren en lipiden te recycleren voor het aanvullen van hun bio-energetische reserve in aanwezigheid van een tekort aan voedingsstoffen of andere dramatische stress [30-31]. In deze studie bleek dat DCA een beschermende autofagie in ovariumkankercellen induceerde, en ATG7 kan een rol spelen in dit proces (figuur S3E), maar het gedetailleerde mechanisme moet verder worden bestudeerd. Bovendien vonden we dat Met DCA gevoelig maakte via onderdrukking van de door DCA geïnduceerde beschermende autofagie. In overeenstemming met onze bevindingen kan Met GRP78-afhankelijke autofagie onderdrukken om het anti-myeloom effect van bortezomib te versterken [15], en 2DG-geïnduceerde autofagie remmen om 2DG in prostaatkankercellen te sensibiliseren [32]. Het (de) gedetailleerde mechanisme(n) waardoor Met de beschermende autofagie onderdrukt, moet echter nog verder worden onderzocht.
Met is goed erkend als een enkelvoudig middel of sensibilisator in kankertherapie, maar een opmerkelijk nadeel is dat Met het glucoseverbruik bevordert en de accumulatie van lactaat versnelt, wat de aan kanker verslaafde aërobe glycolyse vergemakkelijkt. In de huidige studie toonden wij aan dat DCA dit neveneffect drastisch kan verminderen. DCA kan de activiteit van PDK’s en zijn downstream p-PDHE1α sterk remmen, wat leidt tot een metabole hermodellering waarbij oxidatieve fosforylering wordt hergebruikt en de lactaataccumulatie en het glucoseverbruik afnemen. Van de vier soorten PDK-isoenzymen werkt DCA voornamelijk via remming van PDK2 en PDK1 [33]. Zoals verwacht verhoogde gelijktijdige overexpressie van PDK2 en PDK1 de fosforylering van PDHE1α, werd de sensibiliserende functie van DCA opgeheven en werd het dodelijke effect van DCA plus Met in ovariumkankercellen gedeeltelijk tenietgedaan. Al met al wijzen onze resultaten erop dat DCA de anti-tumorfunctie van Met sensibiliseert door de activiteit van PDK’s te remmen. Er moet echter worden opgemerkt dat DCA Met kan sensibiliseren door het versterken van Met-geïnduceerde oxidatieve stress in borstkankercellen [34]. Dit betekent dat het synergetisch mechanisme van DCA voor Met zo ingewikkeld is, dat diepgaande studies nodig zijn.
Samenvattend toonden wij aan dat DCA en Met de groei van eierstokkankercellen synergetisch kunnen onderdrukken, wat de weg kan vrijmaken voor het ontwikkelen van nieuwe strategieën voor de behandeling van eierstokkanker op basis van het gecombineerde gebruik van DCA en Met.
MATERIALEN EN METHODEN
Cellijnen en reagentia
De cellijnen waaronder SKOV3, OVCAR3, HeLa, SiHa, GLC-82, A549 en HepG2 werden gekocht van American Type Culture Collection (ATCC) en werden gekweekt in Dulbecco’s Modified Eagle Medium (DMEM), aangevuld met 10% foetaal runderserum (FBS), streptomycine (100 mg/mL) en penicilline (100 U/mL) bij 37°C in een vochtige incubator met 5%CO2. DCA en Cycloheximide (CHX) werden gekocht van Sigma-Aldrich (Louis, MO, USA). Met, U0126, MG132 en Hoechst 33258 werden gekocht van Beyotime Company (Shanghai, China). MK2206 werd gekocht van Selleck Company (Shanghai, China). Caspase-3 Activity Assay Kit en Reactive Oxygen Species Assay Kit werden gekocht bij Beyotime Company (Shanghai, China). Annexine V-FITC en PI werden gekocht bij BD Bioscience (BD, NJ, USA). siRNA’s tegen Mcl-1, ATG7, PDH en controle siRNA waren afkomstig van GenePharma (Shanghai, China). pCMV en pcDNA3.1, pCMV-Mcl-1, pcDNA3.1-PDK1 en pcDNA3.1-PDK2 expressie plasmiden werden gekocht bij Obio Technology (Shanghai, China).
Western blot
Hele cellysaten werden bereid en Western blot werd uitgevoerd zoals eerder beschreven [35]. De antilichamen voor β-actine en PDHE1α waren van Abcam Company (San Francisco, CA, USA), de antilichamen voor Bcl-2 en Mcl-1 waren van Santa Cruz Biotechnology (Santa Cruz, CA, USA), en de antilichamen voor PARP, BCL-xL, GSK-3β, p-ERK (Thr202/Tyr204), p-JNK (Thr183/Tyr185), p-Mcl-1 (Thr163), p-Akt (Ser473), p-4EBP1, p-mTOR en p-GSK-3β (Ser9) waren afkomstig van Cell Signaling Technology (Boston, MA, VS). Het antilichaam tegen p-PDHE1α (Ser293) was afkomstig van EMD Millipore (Billerica, MA, USA).
Celtransfectie
SKOV3- en OVCAR3-cellen werden gekweekt tot 60% à 70% confluentie in 6-wellsplaten. Het siRNA of expressieplasmide werd gemengd met 10 pi lipofectamine 2000 in Opti-MEM (Invitrogen, Carlsbad, CA, USA) voor elk putje volgens het protocol van de fabrikant. Na incubatie met de mengsels gedurende 6 uur, werden de cellen gekweekt in DMEM met 10% FBS voor nog eens 6 uur.
Levensvatbaarheidstest voor cellen
De levensvatbaarheidstest voor cellen werd uitgevoerd met behulp van CCK-8-kit (Dojindo, Shanghai, China) zoals eerder beschreven [27]. Kortom, cellen werden gezaaid op 96-well platen (2×103 cellen/well) in drievoud en geïncubeerd voor 12 uur. Vervolgens werden de cellen gegeven verschillende behandeling of voertuig controle voor 48 uur, gevolgd door de toevoeging van 10 pi CCK-8 oplossing aan elk putje. Na incubatie bij 37°C gedurende 1,5 uur werd de waarde van OD450nm bepaald met een microplaatlezer.
Flowcytometrie
Eierstokkankercellen werden geïncubeerd met annexine V-FITC en PI volgens de instructies van de fabrikant (BD, 561012). Vervolgens werd de apoptose geanalyseerd met een flowcytometer.
Hoechst-kleuring
Na 24 uur behandeling werden de cellen gekleurd met Hoechst 33258 (Beyotime, Shanghai, China) bij 10μg/mL gedurende 10 minuten in het donker. Vervolgens werden de cellen 3 keer gewassen met PBS en gefotografeerd onder een afluorescentiemicroscoop.
Caspase 3-activiteit assay
Caspase 3-activiteit werd onderzocht met Caspase3 Activity Assay kit (Beyotime, C1115) zoals eerder beschreven [36]. Kortom, de controle en behandelde cellen werden geoogst, gewassen met ijskoude PBS, en geresuspendeerd in 50 ul gekoelde cel lysis buffer voor 15 minuten op ijs. Vervolgens werden de lysaten gecentrifugeerd (20.000 g, 10 min, 4°C), en de supernatanten werden onmiddellijk verzameld voor caspase3-activiteitstest.
Meting van totale intracellulaire ROS
De totale intracellulaire ROS werd getest met ROS Assay Kit (Beyotime, Shanghai, China) zoals eerder beschreven [37].
RNA-isolatie, kwantitatieve real-time PCR (qPCR)
Totaal RNA werd uit de cellen geëxtraheerd met TRIzol-reagens (ComWin Biotechnology, Beijing, China) en het eerste-streng cDNA werd gesynthetiseerd met behulp van M-MLV-transcriptase (Invitrogen, Carlsbad, CA, USA). De qPCR werd uitgevoerd met QuantiFast SYBR Green PCR Kit (Promega, Shanghai, China). De relatieve mRNA-niveaus van de doelgenen werden berekend met de2-ΔΔCt-methode.
Analyse van groen fluorescerend eiwit (GFP)-MAP1LC3
Na transfectie met de GFP-MAP1LC3 (GFP-LC3) expressievector gedurende 12 uur, werden de cellen nog 24 uur voorzien van de aangegeven behandelingen en vervolgens gedurende 10 minuten gefixeerd met 4% formaldehyde. Vervolgens werden de cellen 3 keer gewassen met PBS en bekeken onder een fluorescentiemicroscoop.
Detectie van L-lactaat en glucose
De cellen werden behandeld in 6-wells, en vervolgens werd het medium verzameld en de concentraties van L-lactaat en glucose werden afzonderlijk bepaald met behulp van L-Lactaat Assay Kit (Eton Bioscience, San Diego, CA, USA) en Glucose Colorimetric/Fluorometic Assay Kit (BioVision, Milpitas, CA, USA).
Cellulaire bio-energetische analyse
De cellen werden uitgezet in XF96-platen en lieten een nacht groeien. Vervolgens werden de media 1 uur voor de test vervangen door XF96-media. Rotenone/antimycine A, FCCP en oligomycine werden verdund in XF96-media en in de bijbehorende cartridge geladen om eindconcentraties van respectievelijk 0,5 μM, 0,5 μM en 1,0 μM te bereiken. Injecties van de geneesmiddelen in het medium vonden plaats op de aangegeven tijdstippen. De OCR (pmol/min) en ECAR (mpH/min) werden gecontroleerd met de XF Cell Mito Stress Test Kit (Seahorse Bioscience, North Billerica, MA, USA) met behulp van Seahorse Bioscience XFe en XF Extracellular Flux Analyzers.
Dierstudie
Zes weken oude vrouwelijke naaktmuizen werden gekocht bij Beijing Huafukang Bioscience (Beijing, China), en gehuisvest en verzorgd volgens de richtlijnen van het Animal Care and Ethics Committee van de Third Military Medical University (Chongqing, China). 5 × 106 SKOV3-cellen in 150 pi PBS werden geïmplanteerd in de rechter oksel van elke naakte muis. Wanneer tastbare tumoren werden gevormd, werden de muizen gerandomiseerd in 4 groepen (n = 6 per groep). Vervolgens werden de muizen elke dag intraperitoneaal geïnjecteerd met DCA (50 mg/kg/d) plus Met (100 mg/kg/d) of elk alleen gedurende 8 dagen, met PBS als controle. De xenograft tumorgrootte werd elke dag gecontroleerd met een schuifmaat, en het volume werd geschat met de volgende formule: volume = breedte2×lengte×1/2. Na excisie van de muizen werden de xenografttumoren gefotografeerd, en de overeenkomstige eiwitten werden onderzocht met Western blot.
Statistische analyse
De gegevens werden uitgedrukt als gemiddelde ± SD. Eenzijdige ANOVA en t-toets werden gebruikt om de variantie te analyseren. P< 0,05 werd beschouwd als statistisch significant.
DANKBETUIGINGEN
Dit werk werd ondersteund door de National Natural Science Foundation van China (81472436 en 81272865) en de Natural Science Foundation van Chongqing (cstc2012jjB10025).
BELANGENCONFLICTEN
Er werden geen potentiële belangenconflicten bekendgemaakt.
VERWIJZINGEN
1 Jayson GC, Kohn EC, Kitchener HC, Ledermann JA. Eierstokkanker. Lancet. 2014; 384:1376-1388.2 Patch AM, Christie EL, Etemadmoghadam D, Garsed DW, George J, Fereday S, Nones K, Cowin P, Alsop K, Bailey PJ, Kassahn KS, Newell F, Quinn MC, et al. Whole-genome characterization of chemoresistant ovarian cancer. Nature. 2015; 521:489-494.
3 Ward PS, Thompson CB. Metabolic reprogramming: a cancer hallmark even warburg did not anticipate. Cancer Cell. 2012; 21:297-308.
4 Mandai M, Amano Y, Yamaguchi K, Matsumura N, Baba T, Konishi I. Ovarian clear cell carcinoma meets metabolism; HNF-1beta confers survival benefits through the Warburg effect and ROS reduction. Oncotarget. 2015; 6:30704-30714. doi: 10.18632/oncotarget.5228.
5 Fan JY, Yang Y, Xie JY, Lu YL, Shi K, Huang YQ. MicroRNA-144 mediates metabolic shift in ovarian cancer cells by directly targeting Glut1. Tumour Biol. 2015.
6 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC. Metabole modulatie van glioblastoom met dichlooracetaat. Sci Transl Med. 2010; 2:31ra34.
7 Michelakis ED, Webster L, Mackey JR. Dichlooracetaat (DCA) als een potentiële metabool-gerichte therapie voor kanker. Br J Cancer. 2008; 99:989-994.
8 Papandreou I, Goliasova T, Denko NC. Antikankermedicijnen die het metabolisme aanpakken: is dichlooracetaat het nieuwe paradigma? Int J Cancer. 2011; 128:1001-1008.
9 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Harry G, Hashimoto K, Porter CJ, Andrade MA, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007; 11:37-51.
10 Ohashi T, Akazawa T, Aoki M, Kuze B, Mizuta K, Ito Y, Inoue N. Dichloroacetate improves immune dysfunction caused by tumor-secreted lactic acid and increases antitumor immunoreactivity. Int J Cancer. 2013; 133:1107-1118.
11 Gong F, Peng X, Sang Y, Qiu M, Luo C, He Z, Zhao X, Tong A. Dichloroacetate induceert protective autophagy in LoVo cells: involvement of cathepsin D/thioredoxin-like protein 1 and Akt-mTOR-mediated signaling. Cell Death Dis. 2013; 4:e913.
12 Morales DR, Morris AD. Metformine in de behandeling en preventie van kanker. Annu Rev Med. 2015; 66:17-29.
13 Ben Sahra I, Laurent K, Loubat A, Giorgetti-Peraldi S, Colosetti P, Auberger P, Tanti JF, Le Marchand-Brustel Y, Bost F. The antidiabetic drug metformin exerts an antitumoral effect in vitro and in vivo through a decrease of cyclin D1 level. Oncogene. 2008; 27:3576-3586.
14 Liu B, Fan Z, Edgerton SM, Deng XS, Alimova IN, Lind SE, Thor AD. Metformin induces unique biological and molecular responses in triple negative breast cancer cells. Cell Cycle. 2009; 8:2031-2040.
15 Jagannathan S, Abdel-Malek MA, Malek E, Vad N, Latif T, Anderson KC, Driscoll JJ. Pharmacologic screens reveal metformin that suppresses GRP78-dependent autophagy to enhance the anti-myeloma effect of bortezomib. Leukemia. 2015; 29:2184-2191.
16 Rocha GZ, Dias MM, Ropelle ER, Osorio-Costa F, Rossato FA, Vercesi AE, Saad MJ, Carvalheira JB. Metformine versterkt chemotherapie-geïnduceerde AMPK-activering en antitumorale groei. Clin Cancer Res. 2011; 17:3993-4005.
17 Lau YK, Du X, Rayannavar V, Hopkins B, Shaw J, Bessler E, Thomas T, Pires MM, Keniry M, Parsons RE, Cremers S, Szabolcs M, Maurer MA. Metformin and erlotinib synergize to inhibit basal breast cancer. Oncotarget. 2014; 5:10503-10517. doi: 10.18632/oncotarget.2391.
18 Scotland S, Saland E, Skuli N, de Toni F, Boutzen H, Micklow E, Senegas I, Peyraud R, Peyriga L, Theodoro F, Dumon E, Martineau Y, Danet-Desnoyers G, et al. Mitochondrial energetic and AKT status mediate metabolic effects and apoptosis of metformin in human leukemic cells. Leukemia. 2013; 27:2129-2138.
19 Chaube B, Malvi P, Singh SV, Mohammad N, Meena AS, Bhat MK. Targeting metabolic flexibility by simultaneously inhibiting respiratory complex I and lactate generation retards melanoma progression. Oncotarget. 2015; 6:37281-37299. doi: 10.18632/oncotarget.6134.
20 Lessene G, Czabotar PE, Colman PM. BCL-2 familie antagonisten voor kankertherapie. Nat Rev Drug Discov. 2008; 7:989-1000.
21 Domina AM, Vrana JA, Gregory MA, Hann SR, Craig RW. MCL1 wordt gefosforyleerd in de PEST-regio en gestabiliseerd bij ERK-activering in levensvatbare cellen, en op bijkomende plaatsen bij cytotoxisch okadaïnezuur of taxol. Oncogene. 2004; 23:5301-5315.
22 Kodama Y, Taura K, Miura K, Schnabl B, Osawa Y, Brenner DA. Anti-apoptotisch effect van c-Jun N-terminal Kinase-1 via Mcl-1 stabilisatie in TNF-geïnduceerde hepatocyte apoptose. Gastroenterology. 2009; 136:1423-1434.
23 Roh JL, Park JY, Kim EH, Jang HJ, Kwon M. Activation of mitochondrial oxidation by PDK2 inhibition reverses cisplatin resistance in head and neck cancer. Cancer Lett. 2016; 371:20-29.
24 Li X, Wang K, Ren Y, Zhang L, Tang XJ, Zhang HM, Zhao CQ, Liu PJ, Zhang JM, He JJ. MAPK signaling mediates sinomenine hydrochloride-induced human breast cancer cell death via both reactive oxygen species-dependent and -independent pathways: an in vitro and in vivo study. Cell Death Dis. 2014; 5:e1356.
25 Maurer U, Charvet C, Wagman AS, Dejardin E, Green DR. Glycogeen synthase kinase-3 reguleert mitochondriale buitenmembraan permeabilisatie en apoptose door destabilisatie van MCL-1. Mol Cell. 2006; 21:749-760.
26 Mills JR, Hippo Y, Robert F, Chen SM, Malina A, Lin CJ, Trojahn U, Wendel HG, Charest A, Bronson RT, Kogan SC, Nadon R, Housman DE, et al. mTORC1 bevordert overleving door translationele controle van Mcl-1. Proc Natl Acad Sci U S A. 2008; 105:10853-10858.
27 Wang B, Ni Z, Dai X, Qin L, Li X, Xu L, Lian J, He F. The Bcl-2/xL inhibitor ABT-263 increases the stability of Mcl-1 mRNA and protein in hepatocellular carcinoma cells. Mol Cancer. 2014; 13:98.
28 Emadi A, Sadowska M, Carter-Cooper B, Bhatnagar V, van der Merwe I, Levis MJ, Sausville EA, Lapidus RG. Perturbatie van cellulaire oxidatieve toestand geïnduceerd door dichlooracetaat en arseentrioxide voor behandeling van acute myeloïde leukemie. Leuk Res. 2015; 39:719-729.
29 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD, Coomber BL. Dichloroacetate affects proliferation but not survival of human colorectal cancer cells. Apoptosis. 2015; 20:63-74.
30 Mah LY, Ryan KM. Autofagie en kanker. Cold Spring Harb Perspect Biol. 2012; 4:a008821.
31 Yang ZJ, Chee CE, Huang S, Sinicrope FA. De rol van autofagie bij kanker: therapeutische implicaties. Mol Cancer Ther. 2011; 10:1533-1541.
32 Ben Sahra I, Laurent K, Giuliano S, Larbret F, Ponzio G, Gounon P, Le Marchand-Brustel Y, Giorgetti-Peraldi S, Cormont M, Bertolotto C, Deckert M, Auberger P, Tanti JF, et al. Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells. Cancer Res. 2010; 70:2465-2475.
33 Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM. Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex. Biochem J. 1998; 329:191-196.
34 Haugrud AB, Zhuang Y, Coppock JD, Miskimins WK. Dichloroacetate enhances apoptotic cell death via oxidative damage and attenuates lactate production in metformin-treated breast cancer cells. Breast Cancer Res Treat. 2014; 147:539-550.
35 Lian J, Ni Z, Dai X, Su C, Smith AR, Xu L, He F. Sorafenib sensitizes (-)-gossypol-induced growth suppression in androgen-independent prostate cancer cells via Mcl-1 inhibition and Bak activation. Mol Cancer Ther. 2012; 11:416-426.
36 Ou X, Lu Y, Liao L, Li D, Liu L, Liu H, Xu H. Nitidine chloride induceert apoptose in menselijke hepatocellulaire carcinoomcellen via een route waarbij p53, p21, Bax en Bcl-2 betrokken zijn. Oncol Rep. 2015; 33:1264-1274.
37 Ni Z, Gong Y, Dai X, Ding W, Wang B, Gong H, Qin L, Cheng P, Li S, Lian J, He F. AU4S: a novel synthetic peptide to measure the activity of ATG4 in living cells. Autofagie. 2015; 11:403-415.
Gerelateerde inhoud: