Tiziana Tataranni 1 en Claudia Piccoli 1,2
1Laboratoriumvoor preklinisch en translationeel onderzoek, IRCCS-CROB, Referral Cancer Center of Basilicata, Rionero in Vulture (Pz), 85028, Italië
2Departement klinische en experimentele geneeskunde, Universiteit van Foggia, Foggia 71121, Italië
Correspondentie dient te worden gericht aan Tiziana Tataranni; [email protected]
Gastredacteur: Kanhaiya Singh
Copyright © 2019 Tiziana Tataranni en Claudia Piccoli. Dit is een open access artikel verspreid onder de Creative Commons Naamsvermelding Licentie, die onbeperkt gebruik, distributie en reproductie toestaat in elk medium, mits het originele werk correct wordt geciteerd.
Ontvangen: 24 juli 2019
Herzien: 12 september 2019
Geaccepteerd: 11 oktober 2019
Online gepubliceerd: 14 november 2019
Een uitgebreide hoeveelheid literatuur beschrijft de antikanker eigenschap van dichlooracetaat (DCA), maar de effectieve klinische toepassing ervan in kankertherapie is nog steeds beperkt tot klinische proeven. Het optreden van bijwerkingen zoals neurotoxiciteit en het vermoeden van carcinogeniteit van DCA beperken nog steeds het klinisch gebruik van DCA. In de afgelopen jaren is het aantal rapporten ter ondersteuning van de werking van DCA tegen kanker echter toegenomen, mede vanwege de grote belangstelling voor het aanpakken van het metabolisme van tumorcellen. Het ontleden van het werkingsmechanisme van DCA heeft bijgedragen tot een beter begrip van de grondslagen van de selectieve werkzaamheid tegen kankercellen. Een succesvolle co-toediening van DCA met conventionele chemotherapie, radiotherapie, andere geneesmiddelen of natuurlijke verbindingen is getest in verschillende kankermodellen. Nieuwe systemen voor de toediening van geneesmiddelen en multiactieverbindingen die DCA en andere geneesmiddelen bevatten, lijken de biologische beschikbaarheid te verbeteren en lijken efficiënter dankzij een synergetische werking van meerdere middelen. De verspreiding van rapporten die de efficiëntie van DCA in kankertherapie ondersteunen, heeft geleid tot bijkomende studies die andere potentiële moleculaire doelwitten van DCA willen vinden. Interessant is dat DCA de kankerstamcelfractie aanzienlijk zou kunnen beïnvloeden en zou kunnen bijdragen tot de uitroeiing van kanker. Samen vormen deze bevindingen een sterke motivering voor nieuwe klinische translationele studies van DCA in kankertherapie.
INLEIDING
Kanker is wereldwijd een van de belangrijkste doodsoorzaken. Ondanks de aanzienlijke vooruitgang in diagnostische en therapeutische benaderingen, blijft de uitroeiing ervan een uitdaging. Te veel factoren zijn verantwoordelijk voor het falen of terugvallen van de therapie, zodat er dringend behoefte is aan nieuwe behandelingsmethoden. Naast de bekende typische eigenschappen van kwaadaardige cellen, waaronder abnormale proliferatie, deregulering van apoptose en celcyclus [1, 2], vertonen kankercellen ook een eigenaardig metabolisch apparaat dat een verdere veelbelovende benadering voor kankertherapie biedt [3-5]. Onze groep had reeds gewezen op het belang van een metabole karakterisering van kankercellen om de doeltreffendheid van een metabole behandeling te voorspellen [6]. Geneesmiddelen die het kankermetabolisme kunnen beïnvloeden worden reeds onderzocht en tonen bemoedigende resultaten in termen van doeltreffendheid en verdraagbaarheid [7]. In het laatste decennium is de kleine molecule DCA, die reeds wordt gebruikt voor de behandeling van acute en chronische melkzuursyndroom, aangeboren fouten in het mitochondriaal metabolisme en diabetes [8], in ruime mate bestemd voor de behandeling van kanker. DCA is een in water oplosbare zure molecule van 150 Da, analoog aan azijnzuur waarin twee van de drie waterstofatomen van de methylgroep zijn vervangen door chlooratomen (figuur 1(a)) [9]. Toediening van DCA in doses van 50 tot 200 mg/Kg/die wordt in verband gebracht met een afname van het volume van de tumormassa, de proliferatiesnelheid en de verspreiding van metastasen in verscheidene preklinische modellen [10]. Onze groep had reeds een omgekeerde correlatie waargenomen tussen het vermogen van DCA om kankercellen te doden en hun mitochondriale ademhalingscapaciteit in mondcelcarcinomen [ 11]. Bovendien hebben wij onlangs het vermogen van DCA beschreven om de mitochondriale functie te beïnvloeden en de kankerprogressie te vertragen in een pancreaskankermodel [12]. Tot op heden zijn er consistente gegevens beschikbaar van klinische proeven en casusverslagen die de toediening van DCA bij kankerpatiënten beschrijven [13-16], maar ondanks de groeiende hoeveelheid literatuur die de werkzaamheid van DCA tegen kanker ondersteunt, wordt het nog niet klinisch gebruikt. Dit overzicht is bedoeld als samenvatting van de zeer recente rapporten over het gebruik van DCA bij kankertherapie, in combinatie met chemotherapie, radiotherapie en andere chemische of natuurlijke stoffen met kankerbestrijdende eigenschappen. Bovendien hebben we gegevens beschreven over nieuwe farmacologische formuleringen van DCA die bijwerkingen kunnen voorkomen en de biologische beschikbaarheid en werkzaamheid van het geneesmiddel kunnen verbeteren, wat de mogelijke klinische toepassing ervan verder stimuleert. Ten slotte bespraken wij de laatste bevindingen die wijzen op andere mogelijke werkingsmechanismen van DCA, waaronder nieuwe gegevens over de geschiktheid om de stamcelfractie van kanker te beïnvloeden.
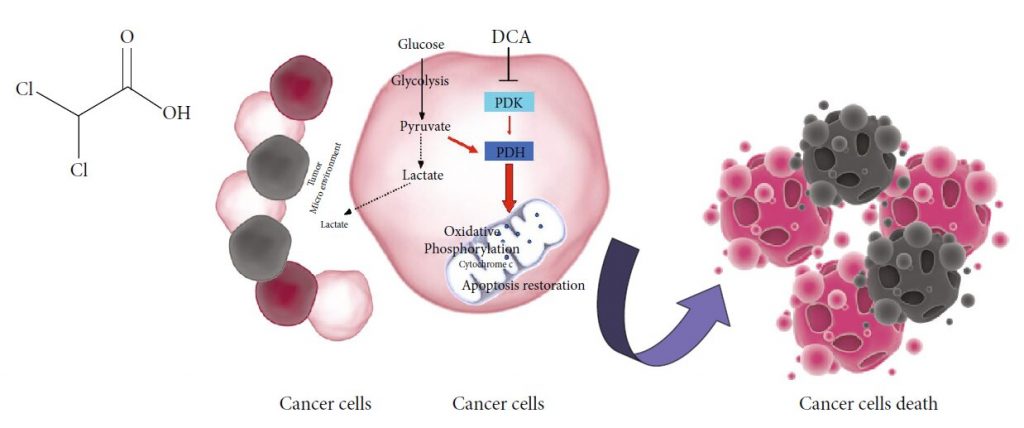
DCA en kanker: Werkingsmechanisme
De potentiële werkzaamheid van DCA bij kankertherapie komt voort uit de metabolische eigenschappen van kankercellen, die typisch gekenmerkt worden door een verhoogde glycolytische activiteit en een verminderde mitochondriale oxidatie, ongeacht de beschikbaarheid van zuurstof, het bekende Warburg-effect [17]. De overmatige glycolyse en de daaruit voortvloeiende overproductie van lactaat veroorzaken een toestand van metabole acidose in het tumormilieu [18]. Het uit de glycolyse afkomstige lactaat wordt opgenomen door de omringende cellen om de groei van de tumor te ondersteunen en remt de apoptotische celdoodmechanismen [19, 20]. Verschillende bij de glycolyse betrokken enzymen reguleren de apoptose, en hun overexpressie in kankercellen draagt bij tot de onderdrukking van apoptose [21]. In deze context zijn zouten van DCA selectief gericht op kankercellen die hun metabolisme verschuiven van glycolyse naar oxidatieve fosforylering door remming van pyruvaat dehydrogenase kinase (PDK), de remmer van pyruvaat dehydrogenase (PDH) [10]. PDH-activering bevordert de mitochondriale oxidatie van pyruvaat en verstoort het metabole voordeel van kankercellen. Mitochondriale DNA-mutaties, die vaak voorkomen bij tumorigenese en resulteren in disfunctie van de ademhalingsketen [22, 23], maken kwaadaardige cellen niet in staat de cellulaire energiebehoefte in stand te houden. Bovendien vermindert DCA de lactaatproductie en gaat het de acidose van het tumormilieu tegen, wat bijdraagt tot de remming van de tumorgroei en -verspreiding [24]. De toevoer van pyruvaat naar de mitochondriën veroorzaakt remodellering van de organellen, wat leidt tot een verhoogde uitstroom van cytochroom c en andere apoptose-inducerende factoren en een verhoging van de ROS-niveaus met als gevolg een vermindering van de levensvatbaarheid van de kankercel [9] (figuur 1(b)).
Bijwerkingen en beperkingen van het gebruik van DCA
Klinische toepassing van DCA is beschikbaar in zowel orale als parenterale formuleringen, en de doses variëren van 10 tot 50 mg/Kg/die [25]. Geen bewijs van ernstige hematologische, lever-, nier- of harttoxiciteit bevestigt de veiligheid van DCA [26]. Veel voorkomende gastro-intestinale bijwerkingen treden vaak op bij een percentage van de patiënten die met DCA worden behandeld [15]. De bekendste beperking van de toediening van DCA, die zowel in preklinische als in klinische studies is waargenomen, is perifere neuropathie [27]. De selectiviteit van de door DCA veroorzaakte schade aan het zenuwstelsel kan te wijten zijn aan het ontbreken van goed uitgeruste machines die een duurzamere oxidatieve fosforylering aankunnen in cellen die ATP vooral via glycolyse produceren [ 28]. De resulterende mitochondriale overbelasting compromitteert de efficiëntie van de antioxidantensystemen, die niet in staat zijn de excessieve hoeveelheid ROS het hoofd te bieden. In deze setting zou de hedendaagse toediening van antioxidanten een verdere strategie moeten zijn om de door DCA veroorzaakte neuropathie te minimaliseren [27]. De expressie en de activiteit van glutathiontransferase zeta1 (GSTZ1), het eerste enzym dat verantwoordelijk is voor de opruiming van DCA, kan de aard van de schade beïnvloeden. Nonsynonieme functionele singlenucleotide polymorfismen (SNPs) in het menselijke GSTZ1-gen leiden tot verschillende haplotypes die verantwoordelijk zijn voor een verschillende DCA-kinetiek en -dynamiek. Er is een duidelijk verband aangetoond tussen GSTZ1 haplotype en DCA klaring. Op basis hiervan kan een gepersonaliseerde DCA dosering, niet alleen gebaseerd op lichaamsgewicht, bijwerkingen minimaliseren of voorkomen bij patiënten die chronisch worden behandeld met dit geneesmiddel [29]. Het optreden van neuropathie wordt in verband gebracht met chronische orale toediening van DCA en is een omkeerbaar effect, beperkt tot de tijd van de behandeling [30]. De intraveneuze route vermindert, OH Cl Cl O (a) Kankercellen Kankercellen dood Lactaat Tumor Micro-omgeving Lactaat Pyruvaat Glycolyse PDK DCA PDH Oxidatieve fosforylering Apoptose herstel Cytochroom c Glucose (b) Figuur 1: (a) Chemische structuur van DCA. (b) Werkingsmechanisme van DCA: PDK: pyruvaatdehydrogenase kinase; PDH: pyruvaatdehydrogenase. Zwarte stippellijnen, biochemische processen geremd door DCA; rode pijlen, metabolische routes geactiveerd door DCA. 2 Oxidative Medicine and Cellular Longevity dus het potentieel voor neurotoxiciteit en laat het bereiken van hogere medicijnconcentraties het spijsverteringsstelsel omzeilen [13].
Aangezien DCA een van de desinfectiebijproducten is die in lage concentraties in drinkwater voorkomen, wordt de potentiële carcinogeniteit ervan geëvalueerd. Studies bij muismodellen brengen blootstelling aan DCA op jonge leeftijd in verband met een verhoogde incidentie van hepatocellulaire tumoren [31]. Het is denkbaar dat door DCA veroorzaakte aanhoudende veranderingen in het celmetabolisme epigenetische effecten teweegbrengen. Langdurige inductie van PDH en andere oxidatieve routes die verband houden met het glucosemetabolisme zouden kunnen bijdragen tot een toename van reactieve zuurstofspecies en mitochondriale stress [27]. In klinische studies zijn echter geen aanwijzingen gevonden voor een carcinogeen effect wanneer DCA wordt toegediend bij kankertherapie.
Synergetisch effect van DCA en chemotherapeutische middelen
Het combineren van verschillende geneesmiddelen is een algemeen aanvaarde strategie om een synergetisch gunstig effect te bereiken bij kankertherapie, waarbij de dosering van de geneesmiddelen wordt verminderd, de risico’s van toxiciteit worden geminimaliseerd en geneesmiddelenresistentie wordt overwonnen. Gelijktijdige toediening van DCA en traditionele chemotherapeutische middelen is nagestreefd en getest in verschillende kankermodellen (tabel 1). DCA-behandeling lijkt de werkzaamheid van chemotherapie te verbeteren door biochemische en metabole veranderingen te induceren, waardoor de energiebalans van kankercellen aanzienlijk verandert. Een onderzoek bij niet-kleincellige longkanker (NSCLC) toonde zowel in vitro als in vivo aan dat gelijktijdige toediening van DCA met paclitaxel de efficiëntie van celdood verhoogde door remming van de autofagie [32]. Een doeltreffende combinatie van DCA en doxorubicine (DOX) werd getest in HepG2-cellen, waarbij het vermogen van DCA werd aangetoond om de cellulaire antioxidantafweer te verstoren, waardoor oxidatieve schade in de hand werd gewerkt die op zijn beurt werd veroorzaakt door de behandeling met DOX [33]. Er is een sterk verband tussen PDK-overexpressie en chemoresistentie; het is dus denkbaar dat remming van PDK kan helpen om kankercellen opnieuw gevoelig te maken voor geneesmiddelen. PDK2 isovormoverexpressie werd in verband gebracht met paclitaxelresistentie in NSCLC. Interessant genoeg was een combinatie van DCA met paclitaxel doeltreffender in het doden van resistente cellen dan een behandeling met paclitaxel of DCA alleen [34]. Net als bij NSCLC toonde een interessant in vivo onderzoek bij gevorderde blaaskanker een verhoogde expressie van de PDK4-isovorm in hooggradige kankers in vergelijking met laaggradige kankers, en de co-behandeling van DCA en cisplatine verminderde de tumorvolumes drastisch in vergelijking met DCA of cisplatine alleen [35]. Een recente studie bevestigde het vermogen van DCA om PDK4-gerelateerde chemoresistentie ook in humaan hepatocellulair carcinoom (HCC) om te keren [ 36].
| Tumor entiteit | Modelsysteem | Chemotherapeutisch geneesmiddel toegediend met DCA | Werkingsmechanisme | Resultaat | Referenties |
| Longkanker | A549-H1975 cellijnen/ xenograft model | Paclitaxel | Autofagieremming | Efficiënte kanker chemotherapie sensitisatie | [32] |
| Hepatocarcinoom | HepG2-cellijn | Doxorubicine | Verstoring van antioxidantafweer | Verhoogde cellulaire schade door inductie van oxidatieve stress | [33] |
| Longkanker | A549-cellijn | Paclitaxel | Verhoogde chemosensitiviteit door remming van PDK2 | Paclitaxel resistentie overwinnen | [34] |
| Blaaskanker | HTB-9, HT-1376, HTB-5, HTB-4 cellijnen/xenografiemodel | Cisplatine | Verhoogde chemosensitiviteit door remming van PDK4 | Verhoogde celdood van kankercellen en potentieel therapeutisch voordeel | [35] |
| Hepatocarcinoom | Bolculturen van HepaRG- en BC2-cellijnen | Cisplatine, sorafenib | Verhoogde chemosensitiviteit door remming van PDK4 | Verbeterd therapeutisch effect van chemotherapie door herstel van mitochondriale activiteit | [36] |
Synergetisch effect van DCA en andere potentiële geneesmiddelen tegen kanker
Een consistente hoeveelheid literatuur suggereert positieve effecten van gelijktijdige toediening van DCA met verbindingen die momenteel worden gebruikt om andere ziekten te behandelen, maar die in verschillende kankermodellen antikankereigenschappen vertonen (tabel 2). Gelijktijdige toediening van DCA en het antibioticum salinomycine, dat onlangs is herontdekt vanwege zijn cytotoxische eigenschappen als potentieel geneesmiddel tegen kanker, is getest in cellijnen voor colorectale kanker. Hun behandeling lijkt een synergetisch cytotoxisch effect uit te oefenen door de expressie van eiwitten die verband houden met multidrugresistentie te remmen [37]. Kankercellen die metabole enzymen missen die betrokken zijn bij het metabolisme van arginine kunnen leiden tot gevoeligheid voor de behandeling met arginase. Interessant is dat een gecombineerde toediening van recombinant arginase en DCA antiproliferatieve effecten heeft bij triple-negatieve borstkanker, als gevolg van de activering van p53 en de inductie van celcyclusstilstand [38]. COX2-remmers, voornamelijk gebruikt als ontstekingsremmers, zijn onlangs voorgesteld als antitumormiddelen vanwege hun antiproliferatieve activiteit. Een intrigerende studie uitgevoerd op baarmoederhalskankercellen toonde het onvermogen van DCA om baarmoederhalskankercellen met overexpressie van COX2 te doden en toonde aan dat COX2-inhibitie door celecoxib baarmoederhalskankercellen gevoeliger maakt voor DCA, zowel in vitro als in vivo [39]. Aangezien DCA de oxidatieve fosforylering bevordert door de glycolytische activiteit te verminderen, kan de combinatie van DCA met andere geneesmiddelen die een toestand van glucose-afhankelijkheid versterken, een veelbelovende strategie zijn. Een dergelijke aanpak is getest bij hoofd-halskanker, waarbij de toediening van propranolol, een niet-selectieve bètablokker die het mitochondriale metabolisme van de tumorcellen kan beïnvloeden, glycolytische afhankelijkheid en energetische stress veroorzaakte, waardoor de cellen kwetsbaarder werden voor behandeling met DCA [40]. Vergelijkbare resultaten werden verkregen bij melanoomcellen, waarbij de toediening van remmers van de retinoïnezuurreceptor β (RARβ) sensibilisering voor DCA teweegbrengt [41]. Een positief effect van gelijktijdige toediening van DCA met metformine, een hypoglykemisch geneesmiddel dat veel wordt gebruikt voor de behandeling van diabetes, werd aangetoond in een preklinisch model van glioom [42] en in een weinig gemetastaseerde variant van Lewis longcarcinoom (LLC) [ 43]. Jiang en collega’s onderzochten de effecten van fenformine, een metformine-analoog, en DCA in glioblastoma, en toonden aan dat eigentijdse remming van complex I en PDK door respectievelijk fenformine en DCA de zelfvernieuwing en levensvatbaarheid van glioma-stamcellen (GSC’s) verminderde, wat suggereert dat ze mogelijk kunnen worden ingezet om de kankerstamcelfractie te beïnvloeden [44].
| Drug | Belangrijkste functie | Tumor-entiteit | Modelsysteem | Resultaat | Referenties |
| Salinomycine | Antibioticum | Colorectale kanker | DLD-1 en HCT116 cellijnen | Remming van multidrug resistentie gerelateerde eiwitten | [37] |
| Arginase | Arginine metabolisme | Borstkanker | MDA-MB231 en MCF-7/ xenograft model | Antiproliferatief effect door p53 activering en celcyclusstilstand | [38] |
| COX2-remmers | Ontsteking | Baarmoederhalskanker | HeLa en SiHa cellijnen/ xenograft model | Onderdrukking kankercelgroei | [39] |
| Propranolol | Bètablokker | Hoofd- en nekkanker | mEERL en MLM3 cellijnen/C57Bl/6 m | Bevordering van glucoseafhankelijkheid en versterking van het chemoradiatie-effect | [40] |
| RARβ-remmers | Vitamine A metabolisme | Melanoom | ED-007, ED-027, ED-117 en ED196 cellijnen | Bevordering van glucoseafhankelijkheid en sensibilisering voor DCA | [41] |
| Metformine | Diabetes | Gliomen, Lewis longcarcinoom | Xenograft model; LLC/R9 cellen | Verlengde levensduur van muizen met glioom; ernstige glucose-afhankelijkheid in tumormicro-omgeving | [42, 43] |
| Fenformine | Diabetes | Glioblastoma | Glioma stamcellen/xenograft model | Zelfvernieuwingsremming van kankerstamcellen | [44] |
Gecombineerd gebruik van DCA en natuurlijke verbindingen
De klinische toepassing van natuurlijke verbindingen is een veelbelovende nieuwe benadering voor de behandeling van verschillende ziekten [45]. In de literatuur wordt steeds vaker melding gemaakt van biologisch actieve stoffen uit planten, paddestoelen, bacteriën en mariene organismen die een gunstige invloed hebben op de menselijke gezondheid [46-48]. De aanname van natuurlijke verbindingen of hun derivaten lijkt een bemoedigende aanpak om het ontstaan of de herhaling van kanker te voorkomen, en wordt algemeen chemopreventie genoemd [49]. Bovendien hebben natuurlijke stoffen gunstige effecten op de kankertherapie wanneer zij samen met andere geneesmiddelen worden toegediend, waarbij zij in staat zijn resistentie tegen geneesmiddelen te overwinnen, het antikankerpotentieel te verhogen en de doses en toxiciteit van geneesmiddelen te verminderen [50, 51]. Interessant is dat de gelijktijdige toediening van DCA en natuurlijke verbindingen onlangs is onderzocht. Een studie onderzocht het gecombineerde effect van DCA met een mengsel van essentiële olie en curcumine, een verbinding met gunstige eigenschappen bij zowel de preventie als de behandeling van kanker [52], en toonde een antikankerpotentieel aan tegen HCC [53]. In het bijzonder verminderde de combinatie van beide verbindingen synergetisch de overleving van de cellen, bevorderde zij celapoptose en induceerde zij intracellulaire ROS-generatie. Betuline, een natuurlijke verbinding geïsoleerd uit berkenschors, is reeds bekend om zijn antiproliferatieve en cytotoxische effecten tegen verscheidene kankercellijnen [54-56]. Een in vitro onderzoek naar de antitumoractiviteit van betulinederivaten in NSCLC bevestigde het vermogen ervan om in vivo en in vitro de groei van longkankercellen te remmen, door de G2/M-fase van de celcyclus te blokkeren en caspase-activering en DNA-fragmentatie te induceren. Interessant is dat het betulinederivaat Bi-L-RhamBet in staat was de mitochondriale elektronentransportketen (ETC) te verstoren, waardoor de productie van ROS werd geïnduceerd. Gezien de eigenschap van DCA om de totale oxidatie van glucose in mitochondria via de Krebs-cyclus en de ETC te verhogen, combineerden de auteurs Bi-L-RhamBet met DCA, en toonden ze aan dat de cytotoxiciteit aanzienlijk werd versterkt [57].
DCA en radiosensibilisatie
Radiotherapie is een andere strategie om kanker te behandelen en biedt een lokale aanpak door de toediening van hoogenergetische stralen [58]. Het belangrijkste effect van straling is de inductie van ROS met als gevolg DNA-schade, chromosomale instabiliteit en celdood door apoptose [59]. Verscheidene tumoren vertonen of ontwikkelen echter radioresistentie die verantwoordelijk is voor het falen van radiotherapie en een hoog risico op tumorrecidief of metastase [60]. Verschillende factoren kunnen verantwoordelijk zijn voor radioresistentie [61]. Een daarvan is hypoxie, een veel voorkomende conditie van het tumormilieu, gekenmerkt door lage zuurstofniveaus en verminderde productie van ROS-soorten, die de werkzaamheid van ioniserende straling kan blokkeren [62]. Het verhogen van de zuurstoftoevoer naar de tumor om een aanzienlijke hoeveelheid ROS te bevorderen [63] of rechtstreeks de productie van ROS te induceren, kan dus een strategie zijn om de radiosensitisatie te verhogen [64, 65]. In deze context zou toediening van DCA, waarvan bekend is dat het de ROS-productie induceert [11, 66], een strategie kunnen zijn om de radioresistentie van de tumor te overwinnen. Bovendien is bekend dat metabole veranderingen tijdens de ontwikkeling van kanker de radiosensitiviteit beïnvloeden [67, 68]. Daarom kan het aanpakken van metabole tussenproducten van kanker een strategie zijn om een selectieve kankerrespons op bestraling te verbeteren [69]. De doeltreffendheid van DCA om de stralingsgevoeligheid te verhogen is reeds aangetoond, zowel bij glioblastoomcellen [70] als bij slokdarmsquarioom [ 71]. Meer recent werd aangetoond dat DCA de radiosensitiviteit verhoogt in een cellulair model van medulloblastoom, een dodelijke hersentumor bij kinderen, door veranderingen van het ROS-metabolisme en de mitochondriale functie te induceren en de DNA-herstelcapaciteit te onderdrukken [72]. Aangezien de rol van immunotherapie in het herstel van de immuunafweer tegen tumorprogressie en metastase de laatste jaren veel aandacht krijgt [73], gaven Gupta en Dwarakanath een stand van zaken van de mogelijke effecten van glycolytische remmers, waaronder DCA, op de radiosensitisatie van tumoren, waarbij hun aandacht uitging naar de wisselwerking tussen metabole modifiers en immuunmodulatie in de radiosensitisatieprocessen [74]. Interessant is dat zij het vermogen van DCA meldden om immuunstimulatie te bevorderen door de remming van lactaataccumulatie, waardoor het gebruik ervan als adjuvans van radiotherapie verder wordt ondersteund.
DCA en nieuwe geneesmiddelformules
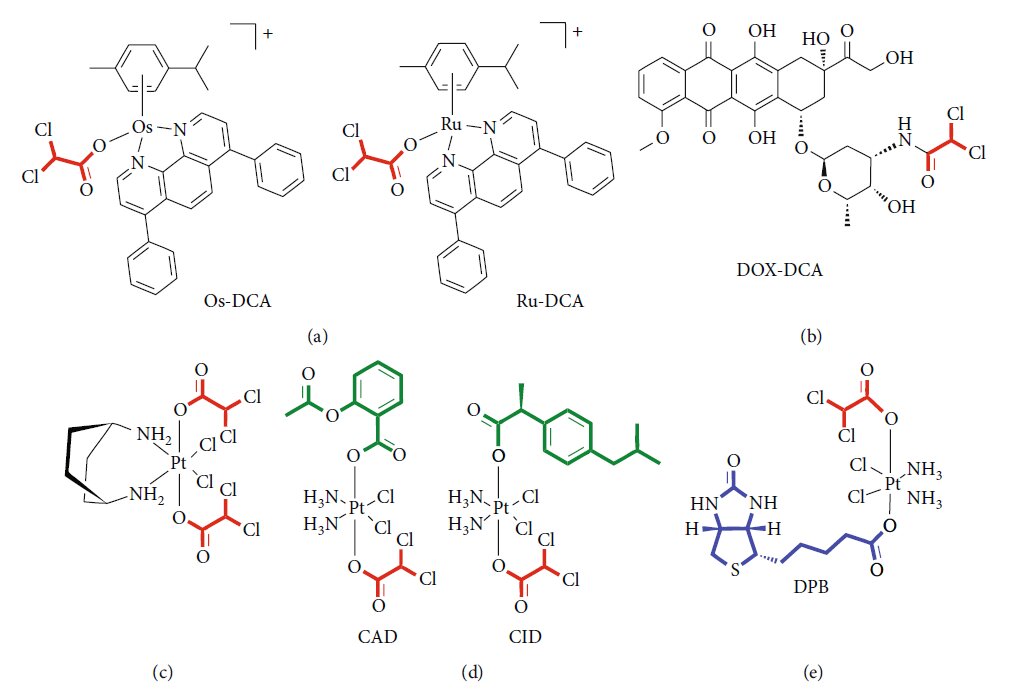
Er is een groeiende belangstelling voor het ontwerpen van nieuwe geneesmiddelformuleringen om de toediening van geneesmiddelen te verbeteren, de werkzaamheid te verhogen en de doses en bijgevolg de ongewenste effecten te verminderen. In deze context vormen drug delivery systemen (DDS) een nieuwe grens in de moderne geneeskunde [75]. DDS’en bieden de mogelijkheid om een hybride van metaal-organische kaders (MOF’s) te creëren, waarbij de biocompatibiliteit van organische systemen wordt gecombineerd met de hoge belasting van de anorganische fractie [76]. Verschillende aanwijzingen duiden op een efficiënte functionalisering van nanodeeltjes met DCA. Lazaro en collega’s [77] onderzochten verschillende protocollen voor DCA-functionalisering van zirkonium (Zr) tereftalaat (UiO-66) nanodeeltjes. Zij toonden de cytotoxiciteit en selectiviteit aan van dezelfde DDS’en tegen verschillende kankercellijnen. Bovendien sloten zij een mogelijke reactie van het immuunsysteem op DCA-MOF in vitro uit. Dezelfde groep toonde later de mogelijkheid om Zr MOF’s te laden met een tweede antikankermedicijn, zoals 5- fluorouracil (5-FU), om zo het synergetisch effect van de twee geneesmiddelen te reproduceren [78]. Zirconium-gebaseerde MOF geladen met DCA werd ook voorgesteld als een aantrekkelijk alternatief voor UiO-66, met een selectieve in vitro cytotoxiciteit voor verschillende kankercel lijnen en een goede tolerantie door het immuunsysteem van verschillende soorten [79]. Onlangs hebben Štarha et al. [80] voor het eerst half-sandwich complexen gesynthetiseerd en gekarakteriseerd die ruthenium of osmium en DCA bevatten (figuur 2(a)). Zowel Ru-dca als Os-DCA complexen werden gescreend in ovariumcarcinoom cellijnen en bleken meer cytotoxisch dan cisplatine alleen. Beide complexen konden het vrijkomen van cytochroom c (Cytc) uit mitochondria induceren, een indirecte index van apoptosoomactivering, en leken minder toxisch voor gezonde primaire menselijke hepatocyten, hetgeen duidt op selectiviteit voor kankercellen ten opzichte van niet-kankercellen. Er werden ook veelbelovende resultaten verkregen in triple-negatieve borstkankercellen [81]. Rhenium (I)-DCA-conjugaat heeft een efficiënte penetratie in kankercellen en een selectieve accumulatie in mitochondriën aangetoond, waarbij mitochondriale disfunctie en stofwisselingsstoornissen werden geïnduceerd [82]. In de afgelopen jaren zijn verscheidene multiactieve geneesmiddelen ontworpen om met één enkele formulering verschillende intracellulaire routes aan te pakken. Een veilige, eenvoudige, reproduceerbare nanovorming van het complex doxorubicine-DCA (figuur 2(b)) werd met succes getest in een murien melanoommodel, waarbij een toename van de geneesmiddelbelasting, minder bijwerkingen en een verbeterd therapeutisch effect werden aangetoond [83]. Dubbelwerkende antitumor Pt (IV) prodrugs van kiteplatine met DCA axiale liganden zijn gesynthetiseerd (figuur 2(c)), gekarakteriseerd en getest in verschillende tumorcellijnen en in vivo [84]. Om kankerresistentie te overwinnen zijn triple action Pt (IV) derivaten van cisplatine voorgesteld als nieuwe krachtige antikankermiddelen, die de werking van cisplatine, cyclo-oxygenaseremmers en DCA kunnen conjugeren (figuur 2(d)) [85]. Een nieuw complex met DCA, platina en biotine (DPB) is met succes getest en vertoont veelzijdige antitumoreigenschappen (figuur 2(e)). De auteurs toonden het vermogen aan van een dergelijke prodrug om het energiemetabolisme te beïnvloeden, apoptose te bevorderen en te interageren met DNA. De hoge selectiviteit van biotine voor kankercellen minimaliseert de schadelijke effecten op normale cellen en verbetert het curatieve effect op tumoren [86]. Kenmerken en experimentele bewijzen van de belangrijkste klassen van verbindingen zijn samengevat in tabel 3.
| Klasse van geneesmiddelformulering | Kenmerken | In vitro proeven | In vivo tests | Experimenteel bewijs | Referenties |
| Metaal-DCA-raamwerken (geen platina) | Metaalionen gekoppeld aan organische liganden in poreuze steigers | MCF-7/MDA-MB-231 (borst) HeLa/LO2 (baarmoederhals) A2780 (eierstok) A549/NCl-H1229 (long) | Modellen voor borstmuizen | Biocompatibiliteit selectieve cytotoxiciteit Immuunsysteemcompatibiliteit Lage mutageniteit | [77-82] |
| Doxorubicine-DCA-conjugaat | Complexen van DCA en chemotherapiemiddelen | B16F10 (melanoom) | Sarcoom en melanoom muismodellen | Selectieve cytotoxiciteit veiligheid In vivo antitumoreffectiviteit | [83] |
| Platina prodrugs met DCA | Platinakern geassocieerd met DCA en andere geneesmiddelen | MCF-7 (borst) LoVo/HCT-15/HCT116 (colon) A549 (long) BxPC3/PSN-1 (pancreas) A375 (melanoom) BCPAP (schildklier) HeLa (baarmoederhals) HepG2 (hepatocarcinoom) | Muismodellen longcarcinoom | Selectieve cytotoxiciteit meervoudige werking Verhoogde cellulaire opname | [84-86] |
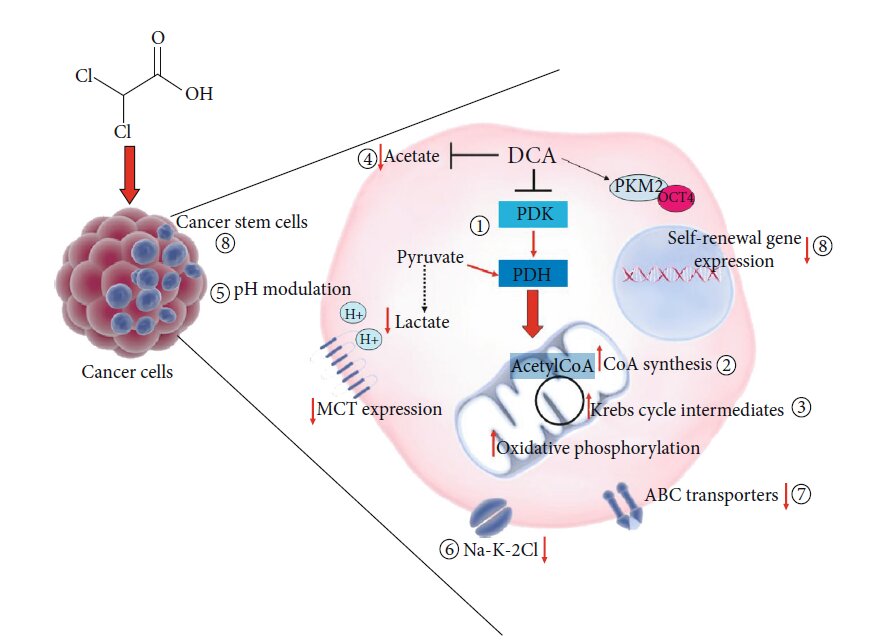
Andere voorgestelde werkingsmechanismen van DCA
De metabole verschuiving van glycolyse naar glucose-oxidatie als gevolg van de remming van PDK en de daaruit voortvloeiende activering van PDH is het bekendste en algemeen aanvaarde moleculaire effect van de toediening van DCA. De biochemische veranderingen die hieruit voortvloeien, waaronder een toename van ROS en variatie in het mitochondriaal membraanpotentieel, kunnen verantwoordelijk zijn voor proliferatiestilstand en de dood van kankercellen, hetgeen het heilzame potentieel van DCA bij de behandeling van kanker verklaart [9]. De moleculaire tussenproducten die worden geactiveerd na toediening van DCA zijn echter nog onbekend. Het is denkbaar dat een dergelijke kleine molecule direct of indirect andere cellulaire en moleculaire doelwitten (figuur 3) beïnvloedt, met andere werkingsmechanismen, om zo zijn werkzaamheid ook te verklaren in cellulaire modellen waar het niet de verwachte metabolische verschuiving teweegbrengt [12]. Een proteomische benadering toegepast op cellen van longkanker toonde het vermogen van DCA om de concentratie van elk TCA-intermediair te verhogen, terwijl het geen invloed had op de glucose-opname of het glycolytisch proces van glucose naar pyruvaat [87]. In een poging om licht te werpen op het werkingsmechanisme van DCA, gebruikten Dubuis en collega’s een metabolomics-gebaseerde benadering op verschillende eierstokkanker cellijnen behandeld met DCA en vonden een gemeenschappelijke duidelijke depletie van intracellulair pantothenaat, een CoA precursor, evenals een gelijktijdige toename van CoA, wat suggereert dat DCA het vermogen heeft om de novo biosynthese van CoA te verhogen. Aangezien hoge concentraties CoA toxisch bleken te zijn voor cellen, zou dit metabolisch effect verantwoordelijk kunnen zijn voor de door DCA gemedieerde toxiciteit voor kankercellen [88]. Een zeer recent werk van El Sayed et al. introduceerde een nieuwe op bewijs gebaseerde hypothese, die suggereert dat de doeltreffendheid van DCA tegen kanker kan voortvloeien uit zijn vermogen om acetaat tegen te gaan [89], waarvan bekend is dat het een energetisch substraat is voor glioblastomen en hersenmetastasen, dat in staat is de DNA-, RNA- en eiwitsynthese en posttranslationele modificaties te versterken, en zo de celproliferatie en de kankerprogressie te bevorderen. Bovendien worden hoge acetaatniveaus in verband gebracht met resistentie tegen geneesmiddelen tegen kanker [90]. Er is aangetoond dat DCA de door acetaat geïnduceerde metabolische veranderingen kan omkeren door de fysiologische serumniveaus van lactaat en vrij vetzuur en de kalium- en fosforconcentratie te herstellen. Volgens de auteurs zou DCA, dankzij een structurele gelijkenis met acetaat, de door acetaat veroorzaakte metabolische effecten, die verantwoordelijk zijn voor de groei van kankercellen en de chemoresistentie, kunnen remmen [89]. Een ander mogelijk bijkomend effect van DCA zou de modulatie van de pH kunnen zijn. Het is bekend dat modulatie van de pH-waarde de proliferatie- en apoptoseprocessen beïnvloedt [91], evenals de gevoeligheid voor chemotherapie [ 92]. DCA behandeling kan zowel de intracellulaire pH verhogen als verlagen. Een secundair effect van de omleiding van pyruvaat naar de mitochondriën door DCA zou lactaatreductie en een daaruit voortvloeiende verhoging van de intracellulaire pH zijn. Aan de andere kant kan DCA de expressie van monocarboxilaattransporters en V-ATPase verminderen, met als gevolg een verlaging van de pH, en dit gebeurt vooral in tumorcellen, die een grotere hoeveelheid van deze dragers tot expressie brengen dan normale cellen [93]. Gezien het vermogen om een snelle intracellulaire verzuring van de tumor te induceren, speculeerden Albatany et al. [94] over een mogelijk gebruik van DCA als een tracker in in vivo beeldvorming van een glioblastoma murine model en ondersteunden een therapeutisch gebruik van DCA, aangezien intracellulaire verzuring bekend staat om het induceren van caspase activering en DNA fragmentatie van kankercellen [95]. Diermodellen maken het mogelijk een mogelijk ander moleculair doelwit van DCA te identificeren. Experimenten bij ratten hebben aangetoond dat DCA de expressie van de renale cotransporter Na-K-2Cl (NKCC) in de nieren van ratten kan remmen [ 96]. Aangezien NKCC een belangrijke biomarker is voor de regulering van de extracellulaire en intracellulaire ionenhomeostase en deelneemt aan de voortgang van de celcyclus, speelt het een belangrijke rol bij de proliferatie, apoptose en invasie van kankercellen. Belkahla et al. [97] onderzochten de wisselwerking tussen metabolisme targeting en de expressie van ABC transporters, verantwoordelijk voor de export van geneesmiddelen uit cellen en een daaruit voortvloeiende multidrug resistentie, en vonden dat DCA behandeling in staat is om gen- en eiwitexpressie van ABC transporters te verminderen in verschillende tumorcellen die wild type p53 tot expressie brengen, zowel in vitro als in vivo [98]. Het vermogen van DCA om differentiatie te induceren door modulatie van de PKM2/Oct4 interactie in glioma cellen is reeds aangetoond [ 99]. De resulterende vermindering van Oct4-transcriptieniveaus werd in verband gebracht met een vermindering van het fenotype van de stamcellen en een aanzienlijk verhoogde gevoeligheid voor celstress. Deze observatie laat een mogelijke rol van DCA tegen kankerstamcellen (CSC’s) veronderstellen.
DCA en kankerstamcellen
Er is een groeiende belangstelling voor het aanpakken van kankerstamcellen (CSC’s), die de hoofdverantwoordelijken lijken te zijn voor het terugvallen van tumoren [100]. CSC’s delen het vermogen tot zelfvernieuwing met normale stamcellen en kunnen aanleiding geven tot differentiërende cellen, die verantwoordelijk zijn voor het ontstaan en de kwaadaardige progressie van tumoren [101]. Een lage proliferatiesnelheid en een specifiek metabolisch profiel dragen ertoe bij dat CSC’s resistent zijn tegen conventionele chemotherapie [102]. Er ontstond een dringende behoefte aan de ontwikkeling van nieuwe therapeutische middelen die de levensvatbaarheid van kankerstamcellen kunnen beïnvloeden [103] om de tumormassa volledig uit te roeien. In de literatuur wordt veel aandacht besteed aan het metabole fenotype van CSC’s, die lijken te verschillen van gedifferentieerde kankercellen en een therapeutisch doelwit zouden kunnen vormen [104-108]. In deze context is de mogelijke gevoeligheid van de CSC-fractie voor DCA verondersteld en getest in verschillende kankermodellen. Embryonale stamcellen van carcinomen vormen een van de meest geschikte modellen voor de studie van de instandhouding en differentiatie van CSC en de identificatie van geneesmiddelen en moleculen die deze processen kunnen moduleren [109]. Studies uitgevoerd op embryonale stamcellen (ESC’s) vormen belangrijke eerste bewijzen die een mogelijke werkzaamheid van DCA ondersteunen [110]. Interessant genoeg bevordert DCA-behandeling van ESC’s het verlies van pluripotentie en verschuift het naar een actiever oxidatiemetabolisme, vergezeld van een aanzienlijke afname van de expressie van HIF1a en p53 [111]. Vega-Naredo et al. [112] beschreven het belang van het mitochondriaal metabolisme bij het sturen van stamheid en differentiatie in een dergelijk model. Zij karakteriseerden het metabole profiel van de stamcelfractie en gokten op de geringere gevoeligheid van het stamfenotype voor mitochondriaal gerichte therapieën. CSC’s dwingen tot een oxidatief metabolisme door behandeling met DCA maakte een overgang van stamcellen naar differentiatie mogelijk. Verschillende rapporten ondersteunen het bestaan van CSC’s in gliomen [113, 114], en de efficiëntie van DCA om CSC’s te treffen is uitgebreid geëvalueerd in een dergelijk kankertype, dat zo moeilijk te behandelen is met conventionele therapieën en gekenmerkt wordt door lage overlevingspercentages. Al in 2010 stelden Michelakis en collega’s, zowel in vitro als in vivo, het vermogen van DCA voor om apoptose van de kankerstamcelfractie te induceren [ 26]. Een rattenmodel van glioom, dat verschillende kenmerken van humane glioblastoma’s recapituleert, bevestigde de doeltreffendheid van DCA om apoptose van glioom-CSC’s, gekenmerkt door een aanzienlijke overstimulatie van de glycolytische route, te versterken in vergelijking met normale stamcellen [115]. Ook Jiang et al. onderzochten het effect van DCA op de kleine populatie glioma stamcellen (GSC’s) geïsoleerd uit glioblastoma, waarbij een vermindering van de zelfvernieuwende eigenschappen en een toename van het percentage celdood werd aangetoond [44]. Bovendien toonde een in vivo test op muizen met DCA-behandelde GSC-afgeleide xenograften een significante toename van de totale overleving. DCA-behandeling werd ook getest in een melanoomstamcelfractie, en de afgeleide bioenergetische modulatie kon de protumorigene werking van een c-Met-remmer tegengaan [ 116]. In een zeer recent onderzoek op menselijk hepatocellulair carcinoom werd PDK4-overexpressie vastgesteld in bolletjes afkomstig van kankercellen met een gedefinieerd stamvormig fenotype. Interessant is dat behandeling met DCA de levensvatbaarheid van zowel kankerdifferentiatiecellen als kankerstamcellen kon verminderen en chemoresistentie tegen conventionele therapie kon omkeren [36]. Onze groep heeft onlangs ervaren dat DCA in staat is de expressie van kankerstamcelmerkers CD24/CD44/EPCAM in een pancreaskankercellijn te verminderen en tevens de sferoïdvorming en levensvatbaarheid in gevaar te brengen [12], hetgeen de gegevens die verkregen zijn in andere kankermodellen verder bevestigt. Samen met chemoresistentie vormt ook radioresistentie een grens voor een efficiënte kankerbehandeling, en CSC’s lijken verantwoordelijk te zijn voor die resistentie [117]. Sun et al. toonden het vermogen aan van DCA om de radiosensitiviteit van medulloblastoomcellen te verhogen door stamcelachtige klonen aan te tasten, het expressiepercentage van CD133-positieve cellen te verminderen en de vorming van bolletjes te beperken [ 72]. Bovendien toonden zij in hetzelfde celmodel een door DCA geïnduceerd veranderd mechanisme van DNA-herstel aan dat de verhoogde doeltreffendheid van radiotherapie kan verklaren.
Conclusies
Het aanpakken van het metabolisme van kankercellen vormt een nieuwe farmacologische benadering voor de behandeling van kanker. Het vermogen van DCA om het metabolisme te verschuiven van glycolyse naar oxidatieve fosforylering heeft de belangstelling voor dit geneesmiddel, dat al bekend staat om zijn antikankereigenschappen, doen toenemen. De in de afgelopen jaren verzamelde gegevens bevestigen het vermogen van DCA om chemo- en radioresistentie in verschillende kankertypes te overwinnen en laten hypotheses toe over bijkomende cellulaire doelwitten die de vaardigheid om kankercellen te doden kunnen verklaren. Er is behoefte aan verder klinisch onderzoek, nu beperkt tot patiënten met een slechte prognose en vergevorderde, terugkerende gezwellen, die reeds refractair zijn voor andere conventionele therapieën. De potentiële werkzaamheid tegen kankerstamcellen en de ontwikkeling van nieuwe medicijnformules brengen ons dichter bij een effectieve klinische toepassing van DCA.
Belangenverstrengeling
De auteurs verklaren geen belangenconflict te hebben.
Erkenningen
Dit werk werd ondersteund door fondsen voor lopend onderzoek, Italiaans ministerie van Volksgezondheid, aan IRCCS-CROB, Rionero in Vulture, Potenza, Italië.
VERWIJZINGEN
1 [1] T. G. Lee, E. H. Jeong, I. J. Min, S. Y. Kim, H. R. Kim, en C. H. Kim, “Altered expression of cellular proliferation, apoptosis and the cell cycle-related genes in lung cancer cells with acquired resistance to Egfr tyrosine kinase inhibitors,” Oncology Letters, vol. 14, no. 2, pp. 2191-2197, 2017.
2 J. Chen, “The cell-cycle arrest and apoptotic functions of P53 in tumor initiation and progression,” Cold Spring Harbor Perspectives in Medicine, vol. 6, no. 3, p. a026104, 2016.
3 C. Thakur en F. Chen, “Connections between metabolism and epigenetics in cancers,” Seminars in Cancer Biology, vol. 57, pp. 52-58, 2019.
4 S. Subramaniam, V. Jeet, J. A. Clements, J. H. Gunter, en J. Batra,”Emergence of micrornas as key players in cancer cell metabolism,” Clinical Chemistry, vol. 65, no. 9, pp. 1090- 1101, 2019.
5 D. Williams en B. Fingleton, “Non-canonical roles for metabolic enzymes and intermediates in malignant progression and metastasis,” Clinical & Experimental Metastasis, vol. 36, no. 3, pp. 211-224, 2019.
6 T. Tataranni, F. Agriesti, V. Ruggieri et al., “Rewiring carbohydrate catabolism differentially affects survival of pancreatic cancer cell lines with diverse metabolic profiles,” Oncotarget, vol. 8, no. 25, pp. 41265-41281, 2017.
7 A. Luengo, D. Y. Gui, en M. G. Vander Heiden, “Targeting metabolism for cancer therapy,” Cell Chemical Biology, vol. 24, no. 9, pp. 1161-1180, 2017.
8 M. O. James, S. C. Jahn, G. Zhong, M. G. Smeltz, Z. Hu, en P. W. Stacpoole, “Therapeutic applications of dichloroacetate and the role of glutathione transferase zeta-1,” Pharmacology & Therapeutics, vol. 170, pp. 166-180, 2017.
9 E. D. Michelakis, L. Webster, en J. R. Mackey, “Dichloroacetate (Dca) as a potential metabolic-targeting therapy for cancer,” British Journal of Cancer, vol. 99, no. 7, pp. 989-994, 2008.
10 S. Kankotia en P. W. Stacpoole, “Dichloroacetate and cancer: new home for an orphan drug?,” Biochimica et Biophysica Acta, vol. 1846, no. 2, pp. 617-629, 2014.
11 V. Ruggieri, F. Agriesti, R. Scrima et al., “Dichloroacetate, a selective mitochondria-targeting drug for oral squamous cell carcinoma: a metabolic perspective of treatment,” Oncotarget, vol. 6, no. 2, pp. 1217-1230, 2015.
12 T. Tataranni, F. Agriesti, C. Pacelli et al., “Dichloroacetate affects mitochondrial function and stemness-associated properties in pancreatic cancer cell lines,” Cells, vol. 8, no. 5, p. 478, 2019.
13 A. Khan, D. Marier, E. Marsden, D. Andrews, en I. Eliaz, “A novel form of dichloroacetate therapy for patients with advanced cancer: a report of 3 cases,” Alternative Therapies in Health and Medicine, vol. 20, Supplement 2, pp. 21-28, 2014.
14 E. M. Dunbar, B. S. Coats, A. L. Shroads et al.,”Phase 1 trial of dichloroacetate (Dca) in adults with recurrent malignant brain tumors,” Investigational New Drugs, vol. 32, no. 3, pp. 452-464, 2014.
15Q. S.-C. Chu, R. Sangha, J. Spratlin et al., “A phase I openlabeled, single-arm, dose-escalation, study of dichloroacetate (DCA) in patients with advanced solid tumors,” Investigational New Drugs, vol. 33, no. 3, pp. 603-610, 2015.
16 A. Khan, D. Andrews, en A. C. Blackburn, “Long-term stabilization of stage 4 colon cancer using sodium dichloroacetate therapy,” World Journal of Clinical Cases, vol. 4, no. 10, pp. 336-343, 2016.
17 G. Sutendra en E. D. Michelakis, “Pyruvate dehydrogenase kinase as a novel therapeutic target in oncology,” Frontiers in Oncology, vol. 3, p. 38, 2013.
18 S. R. Pillai, M. Damaghi, Y. Marunaka, E. P. Spugnini, S. Fais, en R. J. Gillies, “Causes, consequences, and therapy of tumors acidosis,” Cancer Metastasis Reviews, vol. 38, no. 1- 2, pp. 205-222, 2019.
19 R. J. DeBerardinis, J. J. Lum, G. Hatzivassiliou, en C. B. Thompson, “The biology of cancer: metabolic reprogramming fuels cell growth and proliferation,” Cell Metabolism, vol. 7, no. 1, pp. 11-20, 2008.
20 N. Zamzami en G. Kroemer, “The mitochondrion in apoptosis: how Pandora’s box opens,” Nature Reviews Molecular Cell Biology, vol. 2, no. 1, pp. 67-71, 2001.
21 J. W. Kim en C. V. Dang, “Multifaceted roles of glycolytic enzymes,” Trends in Biochemical Sciences, vol. 30, no. 3, pp. 142-150, 2005. P. A. Gammage en C. Frezza,”Mitochondrial DNA: the overlooked oncogenome?,” BMC Biology, vol. 17, no. 1, p. 53, 2019.
22 L. H. Stockwin, S. X. Yu, S. Borgel et al., “Sodium dichloroacetate selectively targets cells with defects in the mitochondrial ETC,” International Journal of Cancer, vol. 127, no. 11, pp. 2510-2519, 2010. [
23 P. W. Stacpoole, N. V. Nagaraja, en A. D. Hutson, “Efficacy of dichloroacetate as a lactate-lowering drug,” Journal of Clinical Pharmacology, vol. 43, no. 7, pp. 683-691, 2003.
24 P. W. Stacpoole, “Therapeutic targeting of the pyruvate dehydrogenase complex/pyruvate dehydrogenase kinase (PDC/PDK) axis in cancer,” JNCI: Journal of the National Cancer Institute, vol. 109, no. 11, 2017.
25 E. D. Michelakis, G. Sutendra, P. Dromparis et al., “Metabolic modulation of glioblastoma with dichloroacetate,” Science Translational Medicine, vol. 2, no. 31, article 31ra34, 2010.
26 P. W. Stacpoole, C. J. Martyniuk, M. O. James, en N. A. Calcutt, “Dichloroacetate-induced peripheral neuropathy,” International Review of Neurobiology, vol. 145, pp. 211-238, 2019.
27 N. Felitsyn, P. W. Stacpoole, en L. Notterpek, “Dichloroacetate causes reversible demyelination in vitro: potential mechanism for its neuropathic effect,” Journal of Neurochemistry, vol. 100, no. 2, pp. 429-436, 2007.
28 T. Langaee, R. Wagner, L. P. Horne et al., “Personalized dosing of dichloroacetate using Gstz1 clinical genotyping assay,” Genetic Testing and Molecular Biomarkers, vol. 22, no. 4, pp. 266-269, 2018.
29 D. Brandsma, T. P. Dorlo, J. H. Haanen, J. H. Beijnen, en W. Boogerd, “Severe encephalopathy and polyneuropathy induced by dichloroacetate,” Journal of Neurology, vol. 257, no. 12, pp. 2099-2100, 2010.
30 United States Environmental Protection Agency, EPA, Toxicological Review of Dichloroacetic Acid, CAS 79-43-6, 2003.
31 X. Lu, D. Zhou, B. Hou et al., “Dichloroacetate enhances the antitumor efficacy of chemotherapeutic agents via inhibiting autophagy in non-small-cell lung cancer,” Cancer Management and Research, vol. 10, pp. 1231-1241, 2018.
32 A. Korga, M. Ostrowska, M. Iwan, M. Herbet, and J. Dudka, “Inhibition of glycolysis disrupts cellular antioxidant defense and sensitizes Hepg2 cells to doxorubicin treatment,” FEBS Open Bio, vol. 9, no. 5, pp. 959-972, 2019.
33 H. Sun, A. Zhu, X. Zhou, and F. Wang, “Suppression of pyruvate dehydrogenase kinase-2 re-sensitizes paclitaxel-resistant human lung cancer cells to paclitaxel,” Oncotarget, vol. 8, no. 32, pp. 52642-52650, 2017.
34 B. L. Woolbright, D. Choudhary, A. Mikhalyuk et al., “The role of pyruvate dehydrogenase kinase-4 (PDK4) in bladder cancer and chemoresistance,” Molecular Cancer Therapeutics, vol. 17, no. 9, pp. 2004-2012, 2018.
35 K. Fekir, H. Dubois-Pot-Schneider, R. Désert et al., “Retrodifferentiatie van menselijke tumorhepatocyten naar stamcellen leidt tot metabole herprogrammering en chemoresistentie,” Cancer Research, vol. 79, no. 8, pp. 1869-1883, 2019.
36A. Skeberdytė, I. Sarapinienė, J. Aleksander-Krasko, V. Stankevičius, K.
37Sužiedėlis, and S. Jarmalaitė, “Dichloroacetate and salinomycin exert a synergistic cytotoxic effect in colorectal cancer cell lines,” Scientific Reports, vol. 8, no. 1, p. 17744, 2018.
38 A. Verma, Y. M. Lam, Y. C. Leung et al., “Combined use of arginase and dichloroacetate exhibits anti-proliferative effects in triple negative breast cancer cells,” The Journal of Pharmacy and Pharmacology, vol. 71, no. 3, pp. 306-315, 2019.
39 B. Li, X. Li, H. Xiong et al., “Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells,” Oncotarget, vol. 8, no. 31, pp. 51748-51757, 2017.
40 C. Lucido, W. Miskimins, en P. Vermeer, “Propranolol bevordert glucoseafhankelijkheid en synergiseert met dichlooracetaat voor antikankeractiviteit in HNSCC,” Cancers, vol. 10, no. 12, p. 476, 2018.
41 C. Abildgaard, C. Dahl, A. Abdul-Al, A. Christensen, en P. Guldberg, “Inhibition of retinoic acid receptor Β signaling confers glycolytic dependence and sensitization to dichloroacetate in melanoma cells,” Oncotarget, vol. 8, no. 48, pp. 84210-84223, 2017.
42 I. V. Prokhorova, O. N. Pyaskovskaya, D. L. Kolesnik, and G. I. Solyanik, “Influence of metformin, sodium dichloroacetate and their combination on the hematological and biochemical blood parameters of rats with gliomas C6,” Experimental Oncology, vol. 40, no. 3, pp. 205-210, 2018.
43 D. L. Kolesnik, O. N. Pyaskovskaya, Y. R. Yakshibaeva, and G. I. Solyanik, “Time-dependent cytotoxicity of dichloroacetate and metformin against Lewis lung carcinoma,” Experimental Oncology, vol. 41, no. 1, pp. 14-19, 2019.
44 W. Jiang, S. Finniss, S. Cazacu et al., “Repurposing phenformin for the targeting of glioma stem cells and the treatment of glioblastoma,” Oncotarget, vol. 7, no. 35, pp. 56456- 56470, 2016.
45 B. Waltenberger, A. Mocan, K. Šmejkal, E. Heiss, A. Atanasov, en A. G. Atanasov, “Natural products to counteract the epidemic of cardiovascular and metabolic disorders,” Molecules, vol. 21, no. 6, p. 807, 2016.
46 M. Zadorozhna, T. Tataranni, and D. Mangieri, “Piperine: role in prevention and progression of cancer,” Molecular Biology Reports, vol. 46, no. 5, pp. 5617-5629, 2019.
47G. Della Sala, F. Agriesti, C. Mazzoccoli, T. Tataranni, V. Costantino, en C. Piccoli, “Clogging the ubiquitinproteasome machinery with marine natural products: last decade update,” Marine Drugs, vol. 16, no. 12, p. 467, 2018.
48 A. G. Atanasov, B. Waltenberger, E. M. Pferschy-Wenzig et al., “Discovery and resupply of pharmacologically active plant-derived natural products: a review,” Biotechnology Advances, vol. 33, no. 8, pp. 1582-1614, 2015.
49 M. B. Sporn en N. Suh, “Chemoprevention: an essential approach to controlling cancer,” Nature Reviews Cancer, vol. 2, no. 7, pp. 537-543, 2002.
50 C. K. Singh, J. George, en N. Ahmad, “Resveratrol-based combinatorial strategies for cancer management,” Annals of the New York Academy of Sciences, vol. 1290, pp. 113-121, 2013.
51 S. Redondo-Blanco, J. Fernández, I. Gutiérrez-del-Río, C. J. Villar, en F. Lombó, “New insights toward colorectal cancer chemotherapy using natural bioactive compounds,” Frontiers in Pharmacology, vol. 8, p. 109, 2017.
52 B. B. Aggarwal, A. Kumar, and A. C. Bharti, “Anticancer potential of curcumin: preclinical and clinical studies,” Anticancer Research, vol. 23, no. 1A, pp. 363-398, 2003.
53P. C. Kan, Y. J. Chang, C. S. Chien, C. Y. Su, and H. W. Fang, “Coupling dichloroacetate treatment with curcumin significantly enhances anticancer potential,” Anticancer Research, vol. 38, no. 11, pp. 6253-6261, 2018.
54 K. Hata, K. Hori, H. Ogasawara, and S. Takahashi, “Antileukemia activities of Lup-28-Al-20(29)-En-3-one, a lupane triterpene,” Toxicology Letters, vol. 143, no. 1, pp. 1-7, 2003.
55C. A. Dehelean, S. Feflea, J. Molnár, I. Zupko, and C. Soica, “Betulin as an antitumor agent tested in vitro on A431, Hela and MCF7, and as an angiogenic inhibitor in vivo in the cam assay,” Natural Product Communications, vol. 7, no. 8, pp. 981-985, 2012.
56 M. Drag, P. Surowiak, M. Drag-Zalesinska, M. Dietel, H. Lage, en J. Oleksyszyn, “Comparision of the cytotoxic effects of birch bark extract, betulin and betulinic acid towards human gastric carcinoma and pancreatic carcinoma drug-sensitive and drug-resistant cell lines,” Molecules, vol. 14, no. 4, pp. 1639-1651, 2009.
57 M. Mihoub, A. Pichette, B. Sylla, C. Gauthier, and J. Legault, “Bidesmosidic betulin saponin bearing L-rhamnopyranoside moieties induces apoptosis and inhibition of lung cancer cells growth in vitro and in vivo,” PLoS One, vol. 13, no. 3, article e0193386, 2018.
58 H. Wang, H. Jiang, M. Van De Gucht, en M. De Ridder, “Hypoxic radioresistance: can ROS be the key to overcome it?,” Cancers, vol. 11, no. 1, p. 112, 2019.
59 J. P. Pouget, S. Frelon, J. L. Ravanat, I. Testard, F. Odin, en J. Cadet, “Formation of modified DNA bases in cells exposed either to gamma radiation or to high-let particles,” Radiation Research, vol. 157, no. 5, pp. 589-595, 2002.
60 K. Rycaj en D. G. Tang, “Cancer stem cells and radioresistance,” International Journal of Radiation Biology, vol. 90, no. 8, pp. 615-621, 2014.
61 L. Tang, F. Wei, Y. Wu et al., “Role of metabolism in cancer cell radioresistance and radiosensitization methods,” Journal of Experimental & Clinical Cancer Research, vol. 37, no. 1, p. 87, 2018.
62 G. Xie, Y. Liu, Q. Yao et al., “Hypoxia-induced angiotensin II by the lactate-chymase-dependent mechanism mediates radioresistance of hypoxic tumor cells,” Scientific Reports, vol. 7, no. 1, article 42396, 2017.
63 J. Overgaard, “Hypoxic radiosensitization: adored and ignored,” Journal of Clinical Oncology, vol. 25, no. 26, pp. 4066-4074, 2007.
64 Y. Zhang en S. G. Martin, “Redox proteins and radiotherapy,” Clinical Oncology, vol. 26, no. 5, pp. 289-300, 2014.
65 H. Jiang, H. Wang, en M. De Ridder, “Targeting antioxidant enzymes as a radiosensitizing strategy,” Cancer Letters, vol. 438, pp. 154-164, 2018.
66 M. R. Niewisch, Z. Kuçi, H. Wolburg et al., “Influence of dichloroacetate (DCA) on lactate production and oxygen consumption in neuroblastoma cells: is DCA a suitable drug for neuroblastoma therapy?,” Cellular Physiology and Biochemistry, vol. 29, no. 3-4, pp. 373-380, 2012.
67 S. P. Pitroda, B. T. Wakim, R. F. Sood et al., “Stat1-dependent expression of energy metabolic pathways links tumor growth and radioresistance to the Warburg effect,” BMC Medicine, vol. 7, no. 1, p. 68, 2009.
68 T. Shimura, N. Noma, Y. Sano et al., “Akt-mediated enhanced aerobic glycolysis
69 V. Bol, A. Bol, C. Bouzin et al., “Reprogramming of tumor metabolism by targeting mitochondria improves tumor response to irradiation,” Acta Oncologica, vol. 54, no. 2, pp. 266-274, 2015.
70 H. Shen, E. Hau, S. Joshi, P. J. Dilda, and K. L. McDonald, “Sensitization of glioblastoma cells to irradiation by modulating the glucose metabolism,” Molecular Cancer Therapeutics, vol. 14, no. 8, pp. 1794-1804, 2015.
71 G. Dong, Q. Chen, F. Jiang et al., “Diisopropylamine dichloroacetate enhances radiosensitization in oesophageal squamous cell carcinoma by increasing mitochondria-derived reactive oxygen species levels,” Oncotarget,
72 L. Sun, T. Moritake, K. Ito et al, “Metabolic analysis of radioresistant medulloblastoma stem-like clones and potential therapeutic targets,” PLoS One, vol. 12, no. 4, article e0176162, 2017.
73 L. Zitvogel, L. Apetoh, F. Ghiringhelli, F. André, A. Tesniere, en G. Kroemer, “The anticancer immune response:indispensable for therapeutic success?,” The Journal of Clinical Investigation, vol. 118, no. 6, pp. 1991-2001, 2008.
74 S. Gupta en B. Dwarakanath, “Modulation of Immunobiome during radio-sensitization of tumors by glycolytic inhibitors,” Current Medicinal Chemistry, vol. 25, 2018.
75 D. Peer, J. M. Karp, S. Hong, O. C. Farokhzad, R. Margalit, en R. Langer, “Nanocarriers as an emerging platform for cancer therapy,” Nature Nanotechnology, vol. 2, no. 12, pp. 751-760, 2007.
76 R. C. Huxford, J. Della Rocca, en W. Lin, “Metal-organic frameworks as potential drug carriers,” Current Opinion in Chemical Biology, vol. 14, no. 2, pp. 262-268, 2010. [
77 I. A. Lázaro, S. A. Lázaro, and R. S. Forgan, “Enhancing anticancer cytotoxicity through bimodal drug delivery from ultrasmall Zr MOF nanoparticles,” Chemical Communications, vol. 54, no. 22, pp. 2792-2795, 2018.
78 I. Abánades Lázaro, S. Haddad, J. M. Rodrigo-Muñoz et al., “Surface-functionalization of Zr-fumarate MOF for selective cytotoxicity and immune system compatibility in nanoscale drug delivery,” ACS Applied Materials & Interfaces, vol. 10, no. 37, pp. 31146-31157, 2018.
79 I. Abánades Lázaro, S. Haddad, J. M. Rodrigo-Muñoz et al., “Mechanistic investigation into the selective anticancer cytotoxicity and immune system response of surface-functionalized, dichloroacetate-loaded, UiO-66 nanoparticles,” ACS Applied Materials & Interfaces, vol. 10, no. 6, pp. 5255- 5268, 2018.
80 P. Štarha, Z. Trávníček, J. Vančo, and Z. Dvořák, “Half-sandwich Ru(II) and Os(II) bathophenanthroline complexen containing a releasable dichloroacetato ligand,” Molecules, vol. 23, no. 2, p. 420, 2018.
81 J. Pracharova, V. Novohradsky, H. Kostrhunova et al., “Halfsandwich Os(ii) en Ru(ii) bathophenanthroline complexen: antikanker drug candidates with unusual potency and a cellular activity profile in highly invasive triple-negative breast cancer cells,” Dalton Transactions, vol. 47, no. 35, pp. 12197-12208, 2018.
82 J. Yang, Q. Cao, H. Zhang et al., “Targeted reversal and phosphorescence lifetime imaging of cancer cell metabolism _via_ a theranostic rhenium(I)-DCA conjugate,” Biomaterials, vol. 176, pp. 94-105, 2018.
83C. Yang, T. Wu, Y. Qin et al., “A facile doxorubicindichloroacetate conjugate nanomedicine with high drug loading for safe drug delivery,” International Journal of Nanomedicine, vol. 13, pp. 1281-1293, 2018.
84 S. Savino, V. Gandin, J. D. Hoeschele, C. Marzano, G. Natile, en N. Margiotta, “Dual-acting antitumor Pt(IV) prodrugs of kiteplatin with dichloroacetate axial ligands,” Dalton Transactions, vol. 47, no. 21, pp. 7144-7158, 2018.
85 E. Petruzzella, R. Sirota, I. Solazzo, V. Gandin, and D. Gibson, “Triple action Pt(iv)-derivaten van cisplatine: een nieuwe klasse krachtige antikankermiddelen die resistentie overwinnen,” Chemical Science, vol. 9, no. 18, pp. 4299-4307, 2018.
86 S. Jin, Y. Guo, D. Song et al., “Targeting energy metabolism by a platinum(IV) prodrug as an alternative pathway for cancer suppression,” Inorganic Chemistry, vol. 58, no. 9, pp. 6507-6516, 2019. [
87W. Zhang, X. Hu, W. Zhou, en K. Y. Tam, “liquid chromatography-tandem mass spectrometry method revealed that lung cancer cells exhibited distinct metabolite profiles upon the treatment with different pyruvate dehydrogenase kinase inhibitors,” Journal of Proteome Research, vol. 17, no. 9, pp. 3012-3021, 2018.
88 S. Dubuis, K. Ortmayr, and M. Zampieri, “A framework for large-scale metabolome drug profiling links coenzyme a metabolism to the toxicity of anti-cancer drug dichloroacetate,” Communications Biology, vol. 1, no. 1, p. 101, 2018.
89S. M. El Sayed, H. Baghdadi, N. S. Ahmed et al., “Dichlooracetaat is een antimetaboliet die acetaat antagoneert en kankercellen de voordelen ervan ontneemt: een nieuwe evidence-based medische hypothese,” Medical Hypotheses, vol. 122, pp. 206-209, 2019.
90 D. M. Jaworski, A. M. Namboodiri, en J. R. Moffett,”Acetaat als een metabole en epigenetische modificator van kankertherapie,” Journal of Cellular Biochemistry, vol. 117, no. 3, pp. 574- 588, 2016.
91 B. A. Webb, M. Chimenti, M. P. Jacobson, en D. L. Barber, “Dysregulated pH: a perfect storm for cancer progression,” Nature Reviews Cancer, vol. 11, no. 9, pp. 671-677, 2011. [
92 D. Neri en C. T. Supuran, “Interfering with pH regulation in tumours as a therapeutic strategy,” Nature Reviews Drug Discovery, vol. 10, no. 10, pp. 767-777, 2011.
93 A. Kumar, S. Kant, en S. M. Singh, “Antitumor- en chemosensitiserende werking van dichlooracetaat impliceert modulatie van tumormilieu: een rol van gereorganiseerd glucosemetabolisme, regulering van celoverleving en macrofaagdifferentiatie,” Toxicology and Applied Pharmacology, vol. 273, no. 1, pp. 196-208, 2013.
94 M. Albatany, A. Li, S. Meakin, and R. Bartha, “Dichloroacetate induced intracellular acidification in glioblastoma: in vivo detection using AACID-CEST MRI at 9.4 Tesla,” Journal of Neuro-Oncology, vol. 136, no. 2, pp. 255-262, 2018.
95 H. J. Park, J. C. Lyons, T. Ohtsubo, and C. W. Song, “Acidic environment causes apoptosis by increasing caspase activity,” British Journal of Cancer, vol. 80, no. 12, pp. 1892-1897, 1999.
96 J. Stanevičiūtė, M. Juknevičienė, J. Palubinskienė et al., “Sodium dichloroacetate pharmacological effect as related to Na-K-2Cl cotransporter inhibition in rats,” Dose Response, vol. 16, no. 4, article 155932581881152, 2018.
97S. Belkahla, A. U. Haq Khan, D. Gitenay et al., “Veranderingen in metabolisme beïnvloeden expressie van ABC-transporters via ERK5 en afhankelijk van p53-status,” Oncotarget, vol. 9, no. 1, pp. 1114-1129, 2018.
98 J. A. Bush en G. Li, “Cancer chemoresistance: the relationship between P53 and multidrug transporters,” International Journal of Cancer, vol. 98, no. 3, pp. 323-330, 2002.
99 M. Morfouace, L. Lalier, L. Oliver et al., “Control of glioma cell death and differentiation by PKM2-Oct4 interaction,” Cell Death & Disease, vol. 5, no. 1, pp. e1036-e1036, 2014.
100 A. Turdo, V. Veschi, M. Gaggianesi et al., “Meeting the challenge of targeting cancer stem cells,” Frontiers in Cell and Development Biology, vol. 7, p. 16, 2019.
101 P. Zhu en Z. Fan, “Cancer stem cells and tumorigenesis,” Biophysics Reports, vol. 4, no. 4, pp. 178-188, 2018.
102 S. Prasad, S. Ramachandran, N. Gupta, I. Kaushik, en S. K. Srivastava, “Cancer cells stemness: a doorstep to targeted therapy,” Biochimica et Biophysica Acta – Molecular Basis of Disease, p. 165424, 2019.
103 M. Yang, P. Liu, en P. Huang, “Cancer stem cells, metabolism, and therapeutic significance,” Tumour Biology, vol. 37, no. 5, pp. 5735-5742, 2016.
104 P. Sancho, D. Barneda, en C. Heeschen, “Hallmarks of cancer stem cell metabolism,” British Journal of Cancer, vol. 114, no. 12, pp. 1305-1312, 2016.
105 F. Sotgia, M. Fiorillo, en M. P. Lisanti, “Hallmarks of the cancer cell of origin: comparisations with “energetic” cancer stem cells (e-CSCs),” Aging, vol. 11, no. 3, pp. 1065-1068, 2019.
106 S. Skvortsov, I. I. Skvortsova, D. G. Tang, and A. Dubrovska, “Concise review: prostate cancer stem cells: current understanding,” Stem Cells, vol. 36, no. 10, pp. 1457-1474, 2018.
107 S. Bordel, “Constraint based modeling of metabolism allows finding metabolic cancer hallmarks and identifying personalized therapeutic windows,” Oncotarget, vol. 9, no. 28, pp. 19716-19729, 2018.
108 Y. Y. Wang, J. Chen, X. M. Liu, R. Zhao, en H. Zhe, “Nrf2-gemedieerde metabole herprogrammering in kanker,” Oxidative Medicine and Cellular Longevity, vol. 2018, Article ID 9304091, 7 pages, 2018.
109 M. W. McBurney, “P19 embryonal carcinoma cells,” The International Journal of Developmental Biology, vol. 37, no. 1, pp. 135-140, 1993.
110 R. Loureiro, S. Magalhães-Novais, K. A. Mesquita et al., “Melatonin antiproliferative effects require active mitochondrial function in embryonal carcinoma cells,” Oncotarget, vol. 6, no. 19, pp. 17081-17096, 2015.
111 A. S. Rodrigues, M. Correia, A. Gomes et al., “Dichloroacetate, the pyruvate dehydrogenase complex and the modulation of mESC pluripotency,” PLoS One, vol. 10, no. 7, article e0131663, 2015.
112 I. Vega-Naredo, R. Loureiro, K. A. Mesquita et al., “Mitochondrial metabolism directs stemness and differentiation in P19 embryonal carcinoma stem cells,” Cell Death and Differentiation, vol. 21, no. 10, pp. 1560-1574, 2014.
113 S. K. Singh, C. Hawkins, I. D. Clarke et al., “Identification of human brain tumour initiating cells,” Nature, vol. 432, no. 7015, pp. 396-401, 2004.
114 X. Yuan, J. Curtin, Y. Xiong et al., “Isolation of cancer stem cells from adult glioblastoma multiforme,” Oncogene, vol. 23, no. 58, pp. 9392-9400, 2004.
115 M. Morfouace, L. Lalier, M. Bahut et al., “Comparison of spheroids formed by rat glioma stem cells and neural stem cells reveals differences in glucose metabolism and promising therapeutic applications,” The Journal of Biological Chemistry, vol. 287, no. 40, pp. 33664-33674, 2012.
116 L. Kucerova, L. Demkova, S. Skolekova, R. Bohovic, and M. Matuskova,”Tyrosine kinase inhibitor SU11274 increased tumorigenicity and enriched for melanoma-initiating cells by bioenergetic modulation,” BMC Cancer, vol. 16, no. 1, p. 308, 2016.
117 Z. Zhao, K. Zhang, Z. Wang et al., “A comprehensive review of available omics data resources and molecular profiling for precision glioma studies,” Biomedical Reports, vol. 10, no. 1, pp. 3-9, 2019.
Gerelateerde inhoud: