Tiziana Tataranni 1, Francesca Agriesti 1, Consiglia Pacelli 2, Vitalba Ruggieri 1, Ilaria Laurenzana 1, Carmela Mazzoccoli 1 , Gerardo Della Sala 1, Concetta Panebianco 3, Valerio Pazienza 3, Nazzareno Capitanio 2 en Claudia Piccoli 1,2,*
1 Laboratorium voor preklinisch en translationeel onderzoek, IRCCS-CROB, Referral Cancer Center of Basilicata, 85028 Rionero in Vulture (Pz), Italië; [email protected] (T.T.); [email protected] (F.A.); [email protected] (V.R.); [email protected] (I.L.); [email protected] (C.M.); [email protected] (G.D.S.).)
2 Departement klinische en experimentele geneeskunde, Universiteit van Foggia, 71100 Foggia, Italië; [email protected] (C.P.); [email protected] (N.C.)
3 Afdeling Gastro-enterologie, IRCCS “Casa Sollievo della Sofferenza” Ziekenhuis, 71013 San Giovanni Rotondo, Italië; [email protected] (C.P.); [email protected] (V.P.
* Correspondentie: [email protected]; Tel: +39-0881-588-060
Ontvangen: 21 februari 2019
Geaccepteerd: 15 mei 2019
Gepubliceerd: 18 mei 2019
Abstract
Targeting metabolisme vertegenwoordigt een mogelijke succesvolle aanpak om kanker te behandelen. Dichlooracetaat (DCA) is een geneesmiddel waarvan bekend is dat het metabolisme omleidt van anaerobe glycolyse naar mitochondriale oxidatieve fosforylering door stimulatie van PDH. In deze studie onderzochten we de respons van twee alvleesklierkanker cellijnen op DCA, zowel in tweedimensionale en driedimensionale celculturen, als in een muismodel. PANC-1 en BXPC-3 behandeld met DCA vertoonden een duidelijke afname van de celproliferatie en -migratie, die niet correleerde met versterkte apoptose, hetgeen wijst op een cytostatisch in plaats van een cytotoxisch effect. Ondanks PDH-activering resulteerde DCA-behandeling in een verminderd mitochondriaal zuurstofverbruik zonder de glycolyse te beïnvloeden. Bovendien veroorzaakte DCA een verhoging van de ROS-productie, van het mtDNA en van de mitofagie-marker LC3B-II in beide cellijnen, maar verminderde de mitochondriale fusiemarkers alleen in BXPC-3. DCA verlaagde met name de expressie van de kankerstamcelmarkers CD24/CD44/EPCAM alleen in PANC-1, maar remde de sferoïdvorming/levensvatbaarheid in beide cellijnen. In een xenograft pancreaskanker-muismodel resulteerde de behandeling met DCA in een vertraging van de kankerprogressie. Tezamen geven onze resultaten duidelijk aan dat de werkzaamheid van DCA bij het remmen van kankergroei mechanistisch afhangt van het celfenotype en van meerdere off-target routes. In deze context is de nieuwigheid dat DCA het kankerstamcelcompartiment zou kunnen beïnvloeden therapeutisch relevant.
Trefwoorden: metabolisme; mitochondriën; kankerstamcellen
© 2019 door de auteurs. Licentiehouder MDPI, Basel, Zwitserland. Dit artikel is een open access artikel verspreid onder de voorwaarden van de Creative Commons Naamsvermelding (CC BY) licentie (http://creativecommons.org/licenses/by/4.0/).
INLEIDING
Pancreas ductaal adenocarcinoom (PDAC) is een zeer agressieve kanker, met een laag percentage getroffen patiënten dat in aanmerking komt voor chirurgische resectie en zeer refractair is voor conventionele therapieën [1,2]. Daarom wordt aangedrongen op effectievere geneesmiddelen om de huidige behandelingsregimes te verbeteren. Naast celgroei, DNA-herstel, invasiviteit en angiogenese worden PDAC-cellen gekenmerkt door mutaties in genen die betrokken zijn bij het metabolisme [1,3]. Nieuwe therapeutische strategieën gericht op het metabolisme zijn in opkomst als veelbelovende benaderingen om chemoresistentie te overwinnen [4]. Inter- en intra-tumor heterogeniteit leiden echter vaak tot verschillende metabole fenotypen, mede als gevolg van meervoudige interacties met de tumormicro-omgeving [5]. Dit levert therapeutische beperkingen op en benadrukt het belang van voorafgaande metabole karakteriseringen van de tumorlijnen, voorafgaand aan de toediening van effectieve geneesmiddelen. Wij hebben onlangs aangetoond dat twee alvleesklierkanker cellijnen, gekenmerkt door een verschillend metabool profiel, een verschillende respons geven op glucose deprivatie/galactose substitutie, een benadering die in staat is om het energiemetabolisme te herbedraden [ 6]. Bovendien had onze groep reeds de doeltreffendheid aangetoond van dichlooracetaat (DCA), een remmer van pyruvaat dehydrogenase kinase (PDK), om gekweekte cellen afkomstig van menselijke mondcarcinomen te doden, een effect dat omgekeerd evenredig is met de mitochondriale ademhalingscapaciteit van de tumorcellen [7]. Verscheidene in vivo en in vitro studies beschrijven het vermogen van DCA om de mitochondriale oxidatieve fosforylering (OxPhos) te verhogen, waardoor het Warburg-effect wordt omgekeerd en tumorcellen selectief worden aangepakt [8,9]. Ook blijkt uit een uitgebreide literatuur dat DCA doeltreffend is om de gevoeligheid voor chemo te verhogen bij verschillende soorten kanker [10,11]. De behandeling met DCA is zowel in vitro als in vivo bestudeerd, ook bij alvleesklierkanker [8,12,13,14]. Toch is verder onderzoek nodig om de werkzaamheid van het geneesmiddel bij dit type kanker beter te definiëren, om mogelijke bijkomende mechanismen die tot celdood leiden te verduidelijken, en om mogelijke verdere manieren te onderzoeken om de bijwerkingen te beperken. In deze studie analyseerden we de effecten van DCA op twee PDAC-cellijnen, PANC-1 en BXPC-3, die onder andere gekozen zijn vanwege hun vergelijkbare groeiomstandigheden en goed gekarakteriseerde genoom-/fenotype [6,15,16]. Een brede profilering van metabolieten en transcriptoom van PDAC-cellijnen identificeerde drie tumorsubtypes, waarbij PANC-1 en BXPC-3 behoren tot een lipogene cluster die gekenmerkt wordt door een duidelijke afhankelijkheid van glucose-oxidatie en mitochondriagerelateerd metabolisme [17]. Door DCA te testen op 2D- en 3D-culturen van de PDAC-cellijnen, toonden wij aan dat het geneesmiddel vitale parameters negatief beïnvloedt door de mitochondriale ademhalingsactiviteit en vooral het kankerstamcelcompartiment te verminderen. Bovendien toonden wij aan dat DCA ook in staat is de tumorgroei in vivo in een model van PDAC xenografted muizen te beperken.
Materialen en methoden
Celcultuur
PANC-1en BXPC-3 cellen werden gekocht van de American Type Culture Collection (ATCC, Manassas, VA, USA) en gekweekt bij 37 ° C in een 5%CO2 bevochtigde atmosfeer in volledige RPMI medium aangevuld met 10% foetaal runderserum, penicilline-streptomycine (100 U / ml), en 2 mM glutamine, en de glucose concentratie was meestal 10 mM of 1 mM wanneer aangegeven. Dichlooracetaat (DCA) werd gekocht bij Sigma-Aldrich (St. Louis, MO, USA). Voor elk in vitro experiment werden de cellen behandeld met DCA 4 mM en 10 mM op de aangegeven tijdstippen.
Celgroeicurves
Celgroeicurves werden uitgevoerd zoals eerder beschreven [18].
Real-Time Cell Proliferation Monitoring by xCELLigence System
De xCELLigence experimenten werden uitgevoerd met het RTCA (real-time cell analyzer) instrument, volgens de instructies van de fabrikant (ACEA Biosciences, San Diego, CA, USA). Het optimale zaaiing aantal werd eerder bepaald door cel titratie en groei experimenten (gegevens niet getoond). De 2500 cellen / putje werden vervolgens gezaaid en hun proliferatie werd automatisch gecontroleerd om de 30 min en 24 uur na het zaaien, werden de cellen behandeld met DCA. De celindex werd gecontroleerd tot 90 uur na het zaaien. De gegevens werden geanalyseerd met behulp van xCELLigence-software (versie 2.0, Acea biosciences, San Diego, CA, USA) en uitgedrukt als gemiddelde ± SD van de celindex genormaliseerd ten opzichte van de laatste celindex geregistreerd vóór het tijdstip van DCA-toevoeging.
Apoptosetest
Na incubatie met DCA werden de cellen gekleurd met Annexin-V-FITC en PI (BD Biosciences). Levende, apoptotische en necrotische cellen werden gedetecteerd met flowcitometrie (Navios, Beckman Coulter, Brea, CA, USA). Er werden drie onafhankelijke experimenten uitgevoerd. Voor elk monster werden in totaal104 events verkregen.
Migratie test
De effecten van DCA op PANC-1 en BXPC-3 migratie capaciteiten werden beoordeeld met behulp van een kras wond assay. Kortom, cellen werden gezaaid in zes-well kweekplaten en gekweekt tot volledige confluentie. Vervolgens werden in elk schaaltje drie parallelle, lineaire wonden gemaakt met een plastic pipetpunt van 200 μL. De cellen werden vervolgens behandeld met DCA en de wondgenezing, gecontroleerd op verschillende tijdstippen, werd gekwantificeerd na 48 uur. Drie representatieve beelden van bekraste gebieden van elke schotel werden gefotografeerd om de migratie van cellen te schatten. De celmigratiesnelheid werd berekend met de volgende formule: [1 – (48 u krasbreedte/0 u krasbreedte)] × 100%.
Lactaatmetingen
Eenlactaat colorimetrische assay kit (Abcam, Cambridge, MA, USA) werd gebruikt volgens het protocol van de fabrikant en de gedetecteerde lactaatconcentratie (intracellulair of vrijgegeven) werd genormaliseerd naar het aantal cellen.
Metabole fluxanalyse en Mitochondriale Respiratoire Complex Enzymatische Activiteit
De zuurstofconsumptiesnelheid (OCR) en extracellulaire verzuringssnelheid (ECAR) werden gemeten in aanhangende PANC-1 en BXPC-3 cellen met een XF96 extracellulaire fluxanalysator (Seahorse Bioscience, Billerica, MA, USA) zoals eerder beschreven [19]. Kortom, voor de OCR-analyse, na het meten van de basale ademhaling, oligomycine (1 uM), FCCP (1 uM), en rotenon + antimycine A (1 uM + 1 uM) werden geïnjecteerd in elk putje achtereenvolgens te beoordelen, respectievelijk de koppeling van de ademhalingsketen, en de maximale en niet-mitochondriale zuurstofverbruik. Voor de ECAR-analyse werd de glycolytische flux (basale glycolyse, glycolytische capaciteit en glycolytische reserve) geanalyseerd door achtereenvolgens 10 mM glucose, 1 μM oligomycine en 100 mM 2-deoxyglucose toe te voegen. De OCR- en ECAR-waarden werden genormaliseerd naar het eiwitgehalte in elk putje, bepaald met behulp van de BCA-test (Thermo Scientific, Waltham, MA, USA).
Mitochondriaal DNA Kwantificering
De meting van het mtDNA-kopiegetal, ten opzichte van het nucleaire DNA-kopiegetal, werd bepaald zoals eerder beschreven [6].
Live Cell Imaging van mtΔΨ en ROS
Cellengekweekt bij lage dichtheid op met fibronectine beklede 35-mm glazen bodemplaten (Eppendorf, Amburgo, Duitsland) werden gedurende 20 minuten bij 37 °C geïncubeerd met 2 uM TMRE, 10 uM DCF (Molecular Probes, Eugene, OR, USA) om respectievelijk mtΔΨ en ROS te controleren. Gevlekte cellen werden gewassen met PBS en onderzocht met een Leica TCS SP8 confocale laser scanning microscoop. Acquisitie, opslag en gegevensanalyse werden uitgevoerd met speciale instrumentele software van Leica (LAS-X, Wetzlar, Duitsland).
Western Blotting Analyse
Aliquots, met 40 μg eiwitten van elk lysaat cel, werden onderworpen aan SDS polyacrylamide gel electroforese en overgebracht naar een polyvinylide difluoride membraan met behulp van een Trans Blot Turbo Transfer System. Membranen (Bio-Rad Laboratories, Hercules, CA, USA) werden geprofileerd met de volgende primaire antilichamen: pyruvaat dehydrogenase E1-alpha (PDH) en pPDHSer293 (1:500, Abcam, Cambridge, UK), LC3B (1:1000 Cell Signaling Technology), TOM20 (1.:1000, Santa Cruz Biotechnology, Santa Cruz, CA, USA), DRP1 (1:1000, BD Bioscences), OPA-1 (1:1000, BD Bioscences), MFN1 (1:1000, Santa Cruz), MFN2 (1:1000, Abnova, Tapei, Taiwan), en CASPASE 3 (1:1000, Cell Signaling Technology, Danvers, MA, USA). Na incubatie met een overeenkomstig geschikt mierikswortelperoxidase-geconjugeerd secundair antilichaam (1:2500; Cell Signaling Technology) werden de signalen ontwikkeld met de versterkte chemiluminescentiekit (ClarityTM Western ECL Substrate, Bio-Rad) en het ChemiDoc beeldvormingssysteem XRS + (BioRad), en vervolgens geanalyseerd met Image Lab software (versie 4.1, Bio-Rad, Hercules, CA, USA). De intensiteit van LC3B-II (overeenkomend met de gekloofde fractie), TOM20, DRP1, OPA-1, MFN1 en MFN2-banden werd genormaliseerd ten opzichte van het β-actinesignaal, terwijl de PDH-fosforylering werd genormaliseerd ten opzichte van het totaal aan eiwitten.
Flow Cytometrische Detectie van Oppervlakte Markers
De expressie van oppervlakte markers CD44, CD24 en EPCAM werd geëvalueerd door citofluorimetrische analyse in PANC-1 en BXPC-3 behandeld met DCA gedurende 24 uur. Kortom, na trypsinisatie werden de cellen gedurende 15 minuten in het donker bij kamertemperatuur geïncubeerd met CD44-APC, EPCAM-FITC en CD24-PE direct geconjugeerde monoklonale antilichamen (BDB). Cytofluorimetrische analyse werd uitgevoerd door Navios (Beckman Coulter). Het uitgezonden fluorescentiesignaal van 10.000 events voor elk monster werd verworven en geanalyseerd met behulp van de Kaluza Analysis software (versie 1.3, Beckman Coulter, Brea, CA, USA).
Omgekeerde transcriptie en real-time PCR-analyse
Eén microgram totaal RNA, geïsoleerd met Trizol-reagens (Life Technologies, Paisley, VK) volgens de instructies van de fabrikant en gekwantificeerd op een Nanodrop-spectrofotometer (Thermo Fisher Scientific, Waltham, MA, VS), werd gebruikt in een omgekeerde transcriptiereactie (RT) met behulp van de Transcriptor first strand cDNA-syntheseset (Roche Diagnostic, Penzberg, Duitsland) volgens de instructies van de fabrikant. De kwantitatieve real-time polymerasekettingreactie (PCR) werd in tweevoud uitgevoerd met de QuantiTect Primer Assay (Qiagen, Basel, Zwitserland) om Lin28-mRNA te detecteren. Kwantificering van de mRNA-niveaus werd uitgevoerd op een LightCycler® 480 real-time PCR-instrument. De relatieve hoeveelheden Lin28 werden genormaliseerd met GAPDH-expressie door Light Cycler® 480 Software versie 1.5 (ROCHE) met behulp van de 2ΔΔCt-methode.
3D-kweek
PANC-1-en BXPC-3-cellen werden losgemaakt met trypsine-EDTA en geteld. Dan, 1000 cellen / putje werden gezaaid in ultra-lage gehechtheid 96-well ronde bodemplaten en gekweekt in RPMI. Om het DCA-effect van voorgevormde sferoïden te evalueren, werden 3D-culturen gedurende 7 dagen onderhouden, waarbij sferoïden werden verkregen. Vervolgens werd medium vervangen door vers medium en sferoïden werden behandeld met DCA 4 mM en 10 mM gedurende 72 uur. Om het effect van DCA op sferoïdevorming te evalueren, werd DCA toegevoegd aan celsuspensie bij het zaaien in ultra-lage hechting platen en de cultuur werd gehandhaafd voor 7 dagen. Sferoïden werden gefotografeerd op een omgekeerde optische microscoop (Axio Vert A1, Zeiss, Oberkochen, Duitsland) en hun diameter werd gemeten met behulp van de ZEISS ZEN imaging software. De levensvatbaarheid van de sferoïden werd beoordeeld met een MTS-test. Een oplossing van cellTiter 96® waterig MTS-reagenspoeder (Promega, Madison, WI, VS) en PMS (Sigma Aldrich, Saint Louis, MO, VS) werd toegevoegd aan elk putje van de 3D-sferoïdekweek. Na 2 uur incubatie bij 37 °C werd de absorptie bij 490 nm gemeten en werd het percentage levensvatbaarheid in elk putje berekend met de onbehandelde sferoïden als 100%.
Dierstudies
De dierproeven werden uitgevoerd in een door de AAALAC (Association for Assessment and Accreditation of Laboratory Animal Care International, Frederick, MD USA) erkende experimentele faciliteit onder goedkeuringsnummer ANM14_002/468862. Een totaal aantal van 5 ×106 BxPC-3-luc-kankercellen werd gekweekt, geresuspendeerd in 0,1 mL PBS/matrigelmengsel (1:1) en vervolgens s.c. geïnjecteerd in de rechterflank van 5-6 weken oude Nu/Nu-naaktmuizen. Wanneer de tumorgrootte een gemiddeld volume van 100 mm3 bereikte, werden BxPC-3-luc tumordragende naaktmuizen willekeurig verdeeld in 2 groepen (6 muizen/groep). Groep 1 (normale zoutoplossing, i.p, qw), groep 2 (DCA, mg/kg, i.p, qw). De dieren hadden vrije toegang tot water. DCA werd opgelost tot een eindconcentratie van 100 mg/kg/dag (s.c: subcutaan; i.p: intraperitoneaal; qw: eenmaal per week).
Statistische analyse
Experimentele gegevens worden uitgedrukt als gemiddelde ± standaardfout (SEM) of gemiddelde ± standaardafwijking (SD). De gegevens werden vergeleken met de ongepaarde Student’s t-test of eenzijdige Anova, gevolgd door de Bonferroni-test. Een p-waarde < 0,05 werd aanvaard als statistisch significant.
Resultaten
DCA heeft een negatieve invloed op celproliferatie, overleving en migratie in PANC-1 en BXPC-3 cellijnen
De twee PDAC-cellijnen die voor dit onderzoek werden geselecteerd, waren PANC-1 en BXPC-3. PANC-1 is een van pancreascarcinoom afgeleide cellijn van ductale celoorsprong. Zij kan uitzaaien maar heeft een slecht differentiatievermogen en herbergt mutaties in KRAS en TP53 en een homozygote deletie in CDKN2A/p16 [16]. BxPC-3 is een primaire adenocarcinoom-afgeleide cellijn met matige differentiatie en epitheliale morfologie. Zij brengt mucine en hoge niveaus van angiogene factoren en kankerstamcelmarkers tot expressie [16,20] en heeft geen KRAS-mutaties, maar wel mutaties in TP53 en homozygote deleties in CDKN2A/p16 en SMAD4/DPC4 [16]. Het effect van DCA op de levensvatbaarheidsparameters in PANC-1 en BXPC-3 cellijnen werd beoordeeld bij de concentraties van 4 mM en 10 mM, die reeds waren getest en effectief bleken te zijn, zoals aangetoond in onze eerdere studie [7]. Eerst voerden wij een celgroeitest uit gedurende 72 uur, waaruit bleek dat beide cellijnen aanzienlijk gevoelig zijn voor de DCA-behandeling, zowel qua dosis als qua tijd (figuur 1A,B). Met name PANC-1 en BXPC-3 vertoonden een vergelijkbare blokkering van de celgroei bij behandeling met 10 mM DCA vanaf de eerste dag van incubatie, en omgekeerd bleek de PANC-1 cellijn bij de geteste lagere dosis van 4 mM aanzienlijk gevoeliger voor het geneesmiddel.
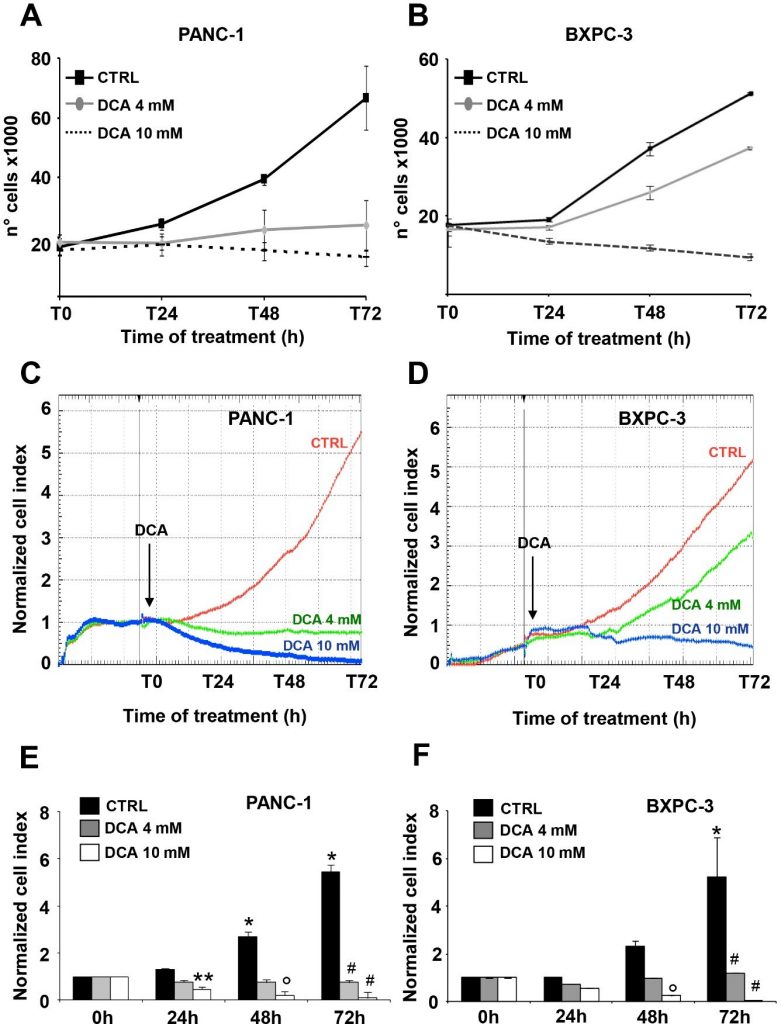
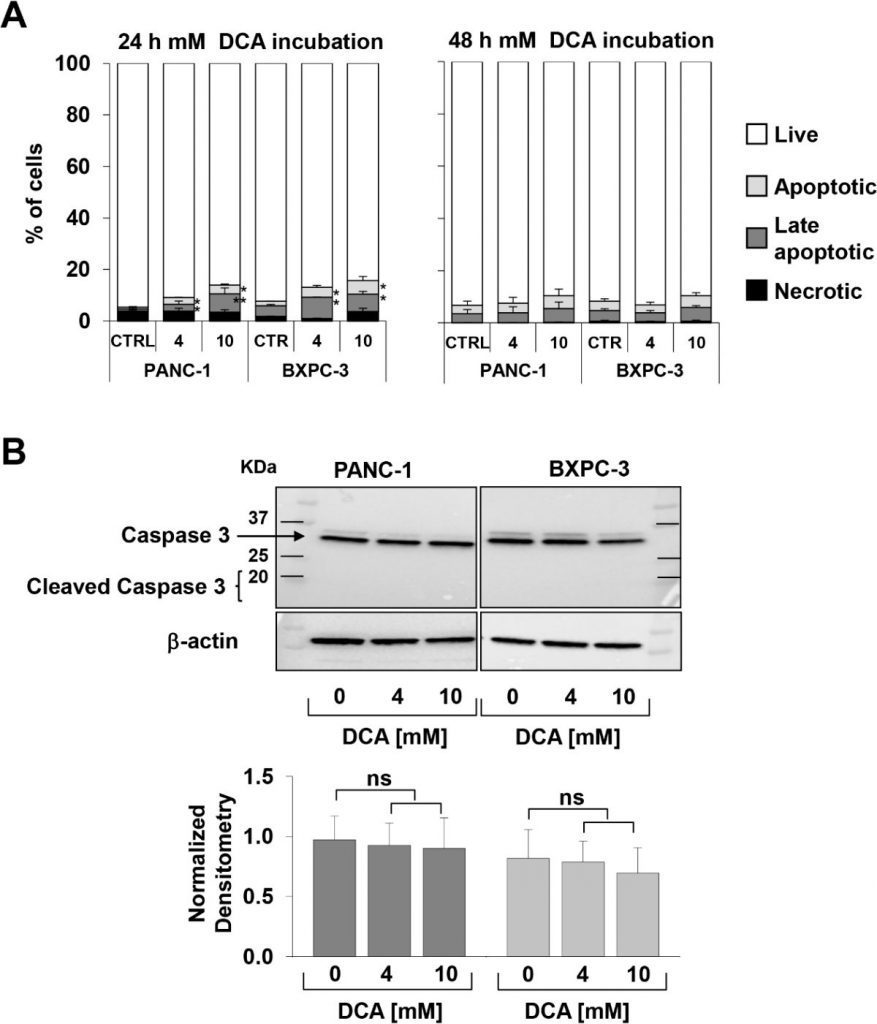
De hierboven vermelde observatie, bijzonder interessant vanwege de bekende chemoresistentie van de PANC-1 cellijn [21,22], bracht ons ertoe de DCA-gemedieerde celgroeiremming te verifiëren via een andere benadering. Daartoe controleerden wij in real time de dynamische veranderingen in celproliferatie en levensvatbaarheid met behulp van impedantietechnologie. Zoals blijkt uit figuur 1C-F, verminderde 10 mM DCA-behandeling drastisch de celproliferatie in beide cellijnen, terwijl 4 mM DCA-behandeling een veel sterker remmend effect had in PANC-1 in vergelijking met de BXPC-3-cellijnen. De effecten van DCA waren duidelijk zichtbaar al na 24 uur incubatie met het geneesmiddel. Real-time analyse van de celgroei werd ook uitgevoerd met lage glucose in het kweekmedium (d.w.z. 1 mM in RPMI). Zoals verwacht werd de groeisnelheid van beide PDAC-cellijnen ernstig gedempt, gezien hun metabolische afhankelijkheid van glucose-oxidatie [17]. De verschillende gevoeligheid met de 4 mM DCA-behandeling werd echter ook bevestigd met een laag glucoseregime (aanvullende figuur S1). Voor de evaluatie van vitale parameters gebruikten wij de annexine V-FITC/PI-test en beoordeelden wij met flowcytometrie de relatieve hoeveelheid necrotische, late en vroege apoptotische cellen. De verkregen resultaten toonden aan dat na 24 uur incubatie met DCA zowel de PANC-1 als de BXPC-3 cellijnen een lichte maar significante dosisafhankelijke toename van apoptose vertoonden in vergelijking met onbehandelde cellen. De hoeveelheden apoptotische cellen waren echter relatief laag (< 10% bij de hoogste geteste DCA-concentratie) en namen niet verder toe bij 48 uur DCA-behandeling (figuur 2A). Dienovereenkomstig veranderde de expressie van niet-omgezette caspase 3 niet na DCA-behandeling en was er geen noemenswaardige hoeveelheid van de gekloofde vorm aantoonbaar (figuur 2B). Dit resultaat suggereert een cytostatische in plaats van een cytotoxische activiteit van het geneesmiddel in beide cellijnen om de duidelijke demping van de groeisnelheid in figuur 1A-D te verklaren.
Vervolgens hebben we het effect van DCA op de celmotiliteit geëvalueerd door de scratch wound-healing assay uit te voeren. De migratiecapaciteit, waargenomen op verschillende tijdstippen, werd gemeten na 48 uur na 4 mM en 10 mM DCA-behandeling. Zowel PANC-1 als BXPC-3 cellen verminderden hun motiliteit bij behandeling met de hogere dosis DCA, terwijl het migratievermogen van BXPC-3 niet werd beïnvloed door een behandeling met 4 mM DCA, die in plaats daarvan een vertraging veroorzaakte in het vermogen tot wondsluiting bij PANC-1 cellen, hetgeen hun grotere gevoeligheid voor het geneesmiddel bevestigt dat bij een lagere concentratie kan worden waargenomen (aanvullende figuur S2).
DCA verandert het energiecelmetabolisme in PDAC-cellijnen
Om het verband te onderzoeken tussen het door DCA geïnduceerde antiproliferatieve effect en veranderingen in het metabolisme van de PDAC-cellijnen, evalueerden we de werkzaamheid van de verbinding om het erkende doelwit pyruvaatdehydrogenase kinase (PDK) te remmen, door de fosforyleringstoestand van de E1α-subeenheid (residu S293) van het pyruvaatdehydrogenasecomplex (PDC) te beoordelen met Western blotting in PANC-1 en BXPC-3. Zoals getoond in figuur 3A,B, was het genormaliseerde niveau van P-PDH-E1 in beide cellijnen significant verlaagd, terwijl het expressieniveau van totaal PDH vergelijkbaar was, en, zoals verwacht, niet gewijzigd door de medicamenteuze behandeling. Onverwacht was de extra- en intracellulaire lactaatproductie blijkbaar niet beïnvloed in beide met DCA behandelde PDAC-cellijnen (aanvullende figuur S3).
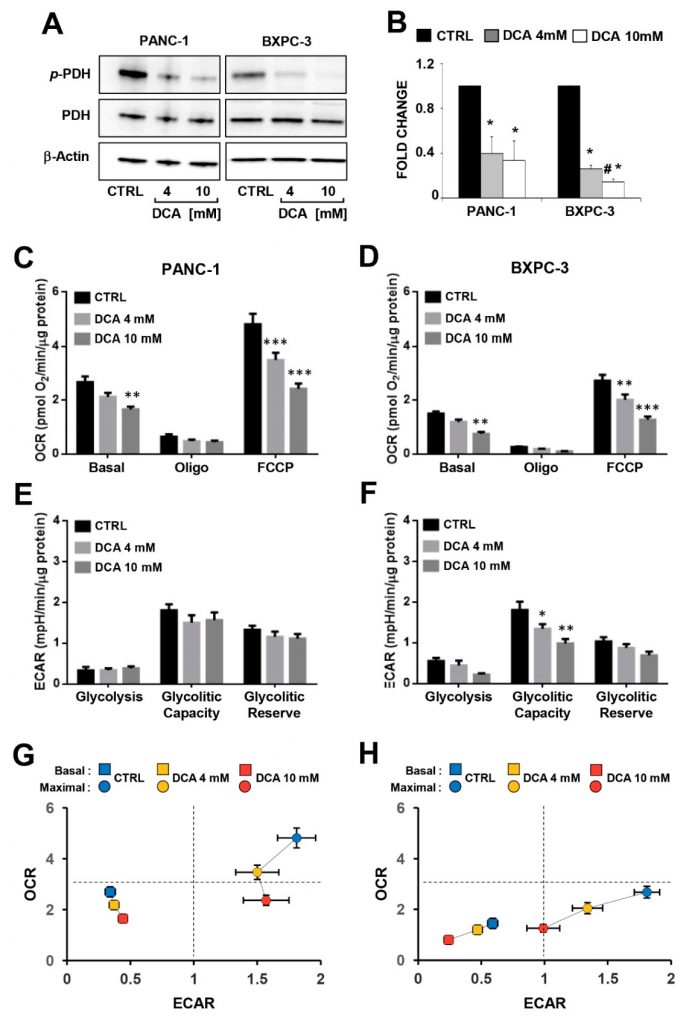
Vervolgens analyseerden wij de belangrijkste metabolische fluxen door de extracellulaire verzuring en het zuurstofverbruik te meten met behulp van de SeaHorse-technologie. Wanneer de metabole fluxen werden beoordeeld na 24 uur incubatie van DCA werden geen significante veranderingen waargenomen in beide PDAC-cellijnen (aanvullende figuur S4). Langere (d.w.z. 48 uur) blootstelling aan DCA veroorzaakte een dosisafhankelijke daling van de mitochondriale zuurstofconsumptiesnelheden (OCR’s) in zowel de PANC-1 als de BXPC-3 cellijnen onder basaal en in aanwezigheid van de ATP-synthaseremmer oligomycine of de ontkoppelaar FCCP (d.w.z. de maximale ademhalingscapaciteit) (figuur 3C,D). Opgemerkt zij dat de mitochondriale ademhalingsactiviteit aanzienlijk hoger was in PANC-1 dan in BXPC-3, hetgeen wijst op een meer OxPhos-afhankelijk metabolisch fenotype. De extracellulaire verzuringssnelheden (ECAR’s), die verband houden met de glycolytische flux, vertoonden geen significante veranderingen na de DCA-behandeling van PANC-1, terwijl remming werd waargenomen voor de basale ECAR in BXPC-3 bij de hogere concentratie DCA en dosisafhankelijk voor de glycolytische capaciteit (figuur 3E,F). Bijgevolg werden de algemene bio-energetische profielen van de basale en gestimuleerde fluxcapaciteiten van beide PDAC-cellen beïnvloed door DCA, waarbij PANC-1 een afname van de OxPhos-capaciteit vertoonde en BXPC-3 een ernstiger aantasting van beide metabole fluxen (figuur 3E,H). Meting van de metabole fluxen onder lage glucosegroeiomstandigheden resulteerde in verminderde OCR in beide cellijnen (consistenter in BXPC-3) en in verbeterde ECAR in BXPC-3. De behandeling met DCA (48 uur) veroorzaakte bij beide cellijnen een significant lager remmend effect op OCR (met name bij 4 mM) bij lage glucose in vergelijking met het regime met hoge glucose. De DCA-behandeling veroorzaakte geen significante verandering in ECAR in PANC-1, terwijl een remming van 40-50% werd waargenomen in BxPC-3, die echter onafhankelijk was van de beschikbaarheid van glucose (figuur S5). Al deze onverwachte waarnemingen wijzen erop dat in PDAC-cellen, hoewel en niettegenstaande DCA kennelijk in staat was PDH te activeren, geen omkering van het Warburg-effect werd bereikt. In plaats daarvan veroorzaakte DCA-behandeling een bio-energetische crisis, die leidde tot demping van de celgroei door een overweldigend off-target mechanisme.
DCA induceert ROS-productie in PDAC-cellijnen en beïnvloedt differentieel de mitochondriale biogenese en dynamiek
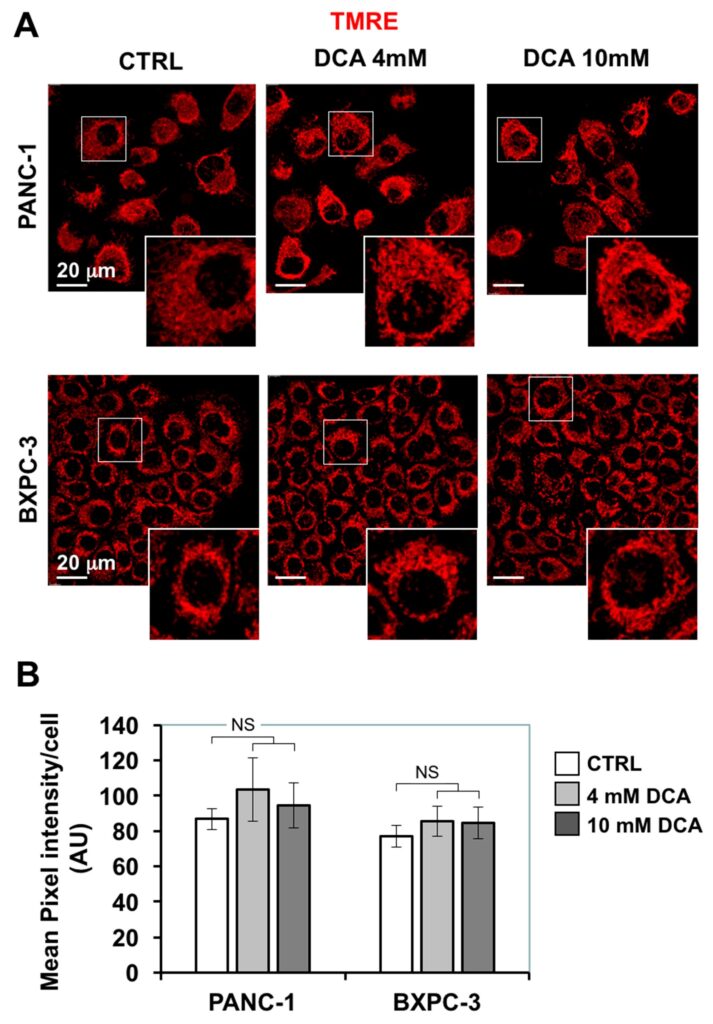
De verminderde mitochondriale ademhaling door DCA bracht ons ertoe verdere mitochondriale functies te onderzoeken. Eerst hebben we de morfo-functionele architectuur van het mitochondriale compartiment beoordeeld door confocale microscopische beeldvorming met behulp van de fluorescerende ΔΨ-probe TMRE, die accumuleert in respirerende mitochondriën. Figuur 4A laat zien dat in PANC-1 het TMRE-gerelateerde signaal een diffuus deeltjeachtig uiterlijk vertoonde dat grotendeels verspreid was in het cytoplasma, wat wijst op een overwegend gefragmenteerde in plaats van onderling verbonden structuur. Een soortgelijk kenmerk ontstond ook in de kleinere BXPC-3 cellen, die echter een ringvormige peri-nucleaire compartimentering vertoonden. De behandeling met DCA gedurende 24 uur veroorzaakte geen grote veranderingen, noch in de intensiteit van het TMRE-fluorescentiesignaal, noch in de morfologie ervan.
Vervolgens hebben we de twee PDAC-cellijnen afgebeeld voor hun redox-toon met behulp van de peroxidesonde DCF. Figuur 5A, B laten zien dat de behandeling met 10 mM DCA gedurende 24 uur een significant grote toename van het DCF-gerelateerde signaal in zowel PANC-1 als BXPC-3 cellijnen veroorzaakte in vergelijking met hun onbehandelde basale niveaus. Dit resultaat wees op een pro-oxidatieve onbalans of de redoxtoestand veroorzaakt door blootstelling aan DCA.
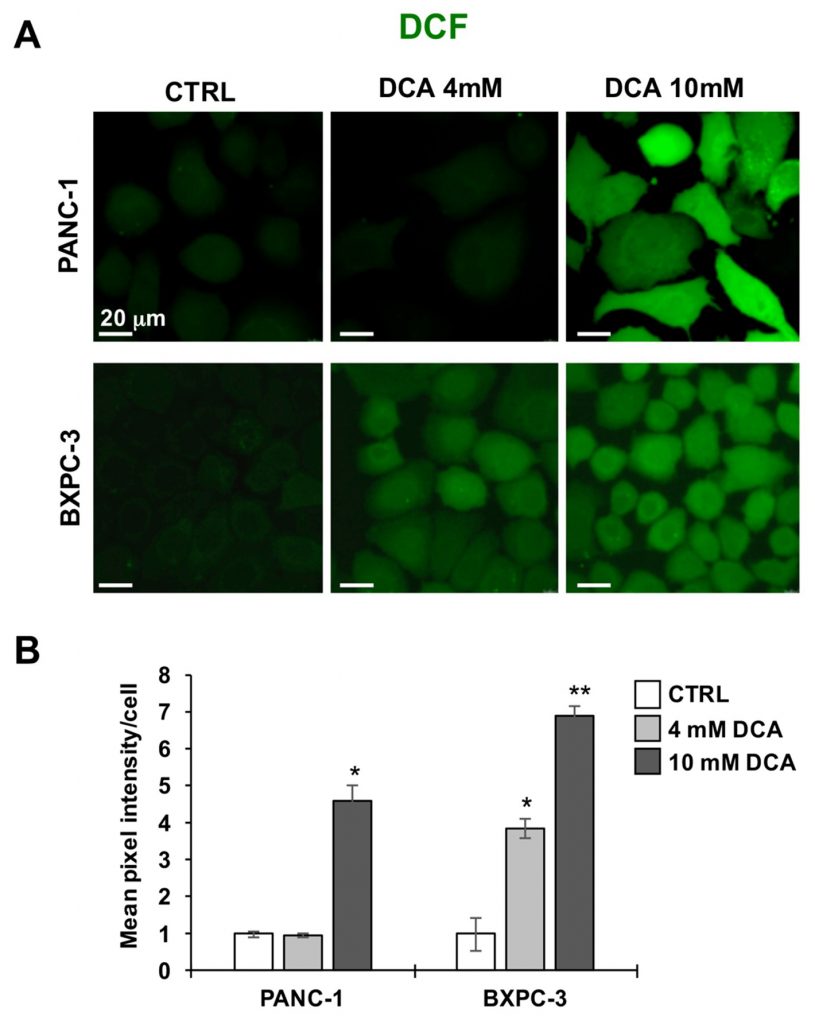
De hierboven beschreven analyse werd aangevuld met de meting van het mitochondriaal DNA (mtDNA). Zoals getoond in figuur 6A was het mtDNA-kopiegetal/cel significant hoger in PANC-1 dan in BXPC-3, consistent met de actievere ademhalingsactiviteit. Na de DCA-behandeling werd een progressieve dosisafhankelijke toename van het mtDNA waargenomen in beide PDAC-cellijnen. Dit was waarschijnlijk het gevolg van een compenserende reactie op de door DCA veroorzaakte OxPhos-disfunctie.
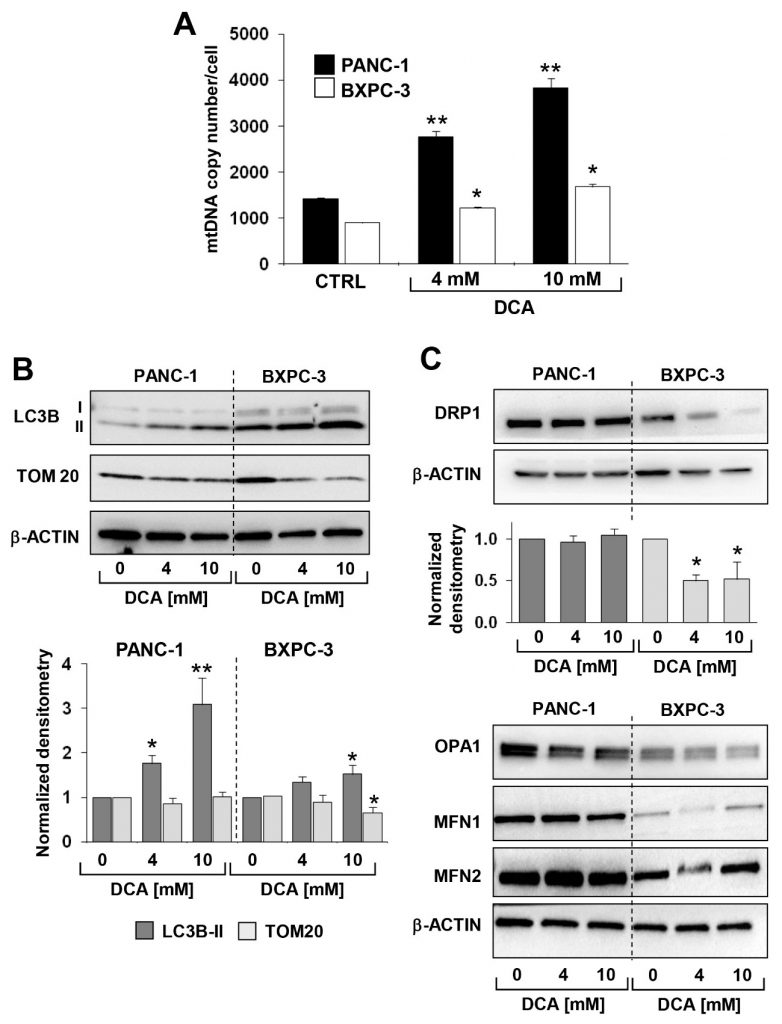
Vervolgens beoordeelden wij met immunoblotting het expressieniveau van eiwitten waarvan bekend is dat zij betrokken zijn bij de mitochondriale klaring (d.w.z. mitofagie) en dynamiek. Figuur 6B,C laten zien dat de expressie van de autofagosoommarker LC3B-II significant hoger was in BXPC-3 dan in PANC-1, en dat DCA een dosisafhankelijke progressieve toename van de marker in beide cellijnen veroorzaakte. Echter, TOM20, een marker van het buitenste mitochondriale membraan, nam alleen in de BXPC-3 cellijn significant af. Analyse van de factoren die betrokken zijn bij de fusie/splitsing verwerking van mitochondriën toonde aan dat zij alle op hogere niveaus tot expressie kwamen in PANC-1 in vergelijking met BXPC-3, maar met een verschillend effect op hen veroorzaakt door de DCA behandeling (figuur 6C). Met name alleen DRP1, een factor die betrokken is bij de mitochondriale splitsing, daalde na de DCA-behandeling in BXPC-3. In PANC-1 en in de mitochondriale fusie-inducerende factoren OPA1, MFN1 en MFN2 in beide cellijnen werd na de DCA-behandeling geen significante verandering in de expressie van DRP1 waargenomen (aanvullende figuur S6). Samen suggereren deze waarnemingen een dynamischer profiel van het mitochondriale compartiment in PANC-1, dat actieve mitochondriale fusie-splitsing ondergaat, met een schijnbaar laag niveau van mitofagieverwerking. BXPC-3 cellen daarentegen lijken fenotypisch meer geneigd om de kwaliteitscontrole van de organellen voort te zetten. Dit zou kunnen samenhangen met het meer gefragmenteerde uiterlijk van het mitochondriale netwerk in BXPC-3 cellen. De DCA-behandeling veroorzaakte een duidelijke toename van de mitofaagmarker LC3B in beide cellijnen, die echter veel groter bleef in BXPC-3.
DCA beïnvloedt differentieel de kankerstamcelafdeling in PDAC-cellijnen
Om mogelijke bijkomende mechanismen van het cytostatische effect van DCA te onderzoeken, besloten we het effect ervan op de kankerstamcelfractie (CSC) van de PDAC-cellijnen te testen. Daartoe evalueerden wij de expressie van de embryonale stamcelfactor Lin28, waarvan is aangetoond dat deze betrokken is bij het celmetabolisme [23] en bekend staat als biomarker voor een slechte prognose van kankerprogressie [24,25]. Figuur 7A laat zien dat 48 uur DCA-behandeling een significante vermindering van de Lin28-expressie in beide cellijnen veroorzaakte, waarbij BXPC-3 gevoeliger bleek dan PANC-1. Een soortgelijk resultaat werd verkregen in 3D-culturen. Een soortgelijk resultaat werd verkregen in 3D-culturen van beide cellijnen (figuur 7B).
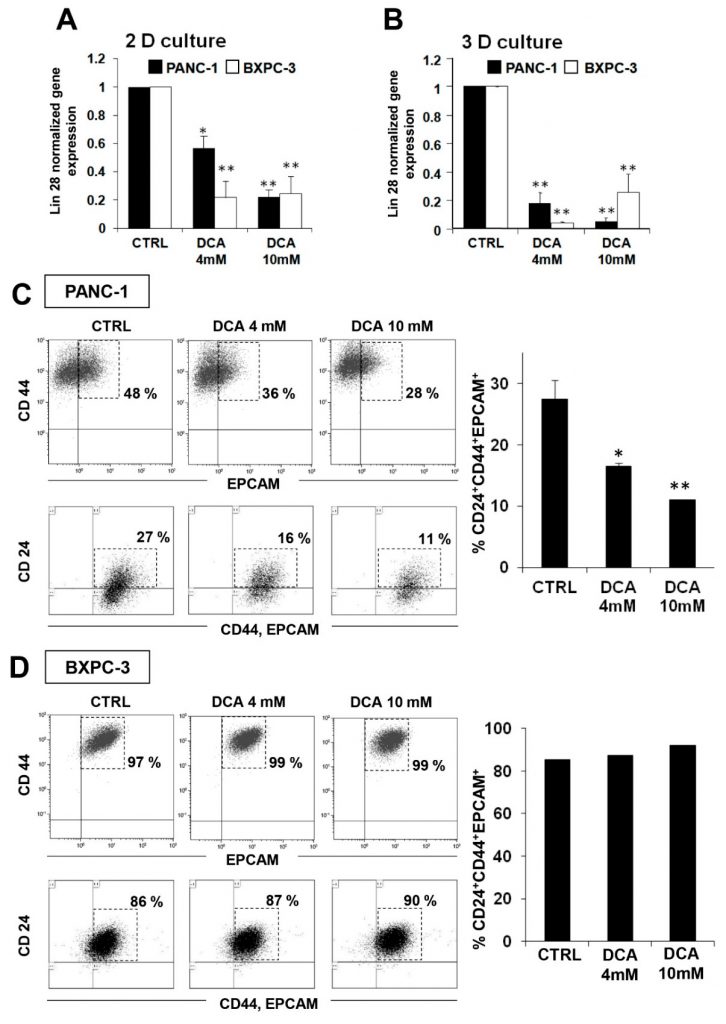
Deze waarneming bracht ons ertoe het effect van DCA op CSC’s te verdiepen door FACS-analyse van de specifieke pancreas CSC-oppervlakte markers CD24, CD44 en EPCAM [26,27]. Figuur 7C toont een significante dosisafhankelijke vermindering van CD24+/CD44+/EPCAM+ cellen in PANC-1 cellen die 48 uur met DCA zijn behandeld. Opmerkelijk is dat de fluorescentie-intensiteit bijna 50% afnam bij een behandeling met 4 mM DCA in PANC-1-cellen, terwijl bij 10 mM reeds na 24 uur behandeling een sterkere afname van de fluorescentie-intensiteit werd waargenomen en na 48 uur behandeling niet veranderde (gegevens niet getoond). Hoewel CSC-markers in ongeveer 90% van de BXPC-3-cellen tot expressie kwamen, leek hun expressie daarentegen niet te worden beïnvloed door de DCA-behandeling (figuur 7D). Onlangs is gemeld dat, meer dan het absolute expressieniveau van bepaalde markers, het hun ratio is om de subpopulatie met meer echte stempelkenmerken te identificeren. Met name de CD44/CD24 ratio blijkt de meest betrouwbare marker van CSC in tumorigenese en metastase [28]. In overeenstemming met dit idee is het relevant dat de CD44/CD24-expressieratio in PANC-1 resulteerde in een 8-voudige toename van die in BXPC-3 (aanvullende figuur S7), hetgeen erop wijst dat het CSC-compartiment, hoewel minder bevolkt, kwalitatief meer op stamcellen lijkt. Omgekeerd zou het lage expressieniveau van de CSC-markers die in de BXPC-3-populatie wijd verspreid zijn, hen als vroege progenitors fenotyperen.
Effect van DCA op 3D-culturen
Om de antitumoreigenschappen van DCA verder te onderzoeken, analyseerden we de biologische effecten ervan op een alternatief testbed dat bestaat uit 3D-culturen van PANC-1 en BXPC-3. Er zijn steeds meer aanwijzingen dat van kankercellen afgeleide sferoïden verrijkt zijn met CSC’s of cellen met stamcelgerelateerde kenmerken [29,30]. Figuur 8A toont microfoto’s van de sferoïden die na 7 dagen kweek zijn verkregen en waaruit duidelijk een verschil in grootte en compactheid van de grenslaag tussen PANC-1 en BXPC-3 cellijnen blijkt. Met name de sferoïden afkomstig van de PANC-1-cellen leken groter en met onregelmatige randen in vergelijking met die van de BXPC-3-cellen. Behandeling met DCA gedurende 72 uur veranderde de morfologie van de sferoïden, die steeds minder gedefinieerd werden. Dit was vooral duidelijk in de PANC-1-afgeleide sferoïden bij een behandeling met 10 mM DCA. In overeenstemming met deze waarneming was een progressieve dosisafhankelijke vermindering van de levensvatbaarheid van de cellen in de sferoïden van PANC-1 en BXPC-3 duidelijk waarneembaar.
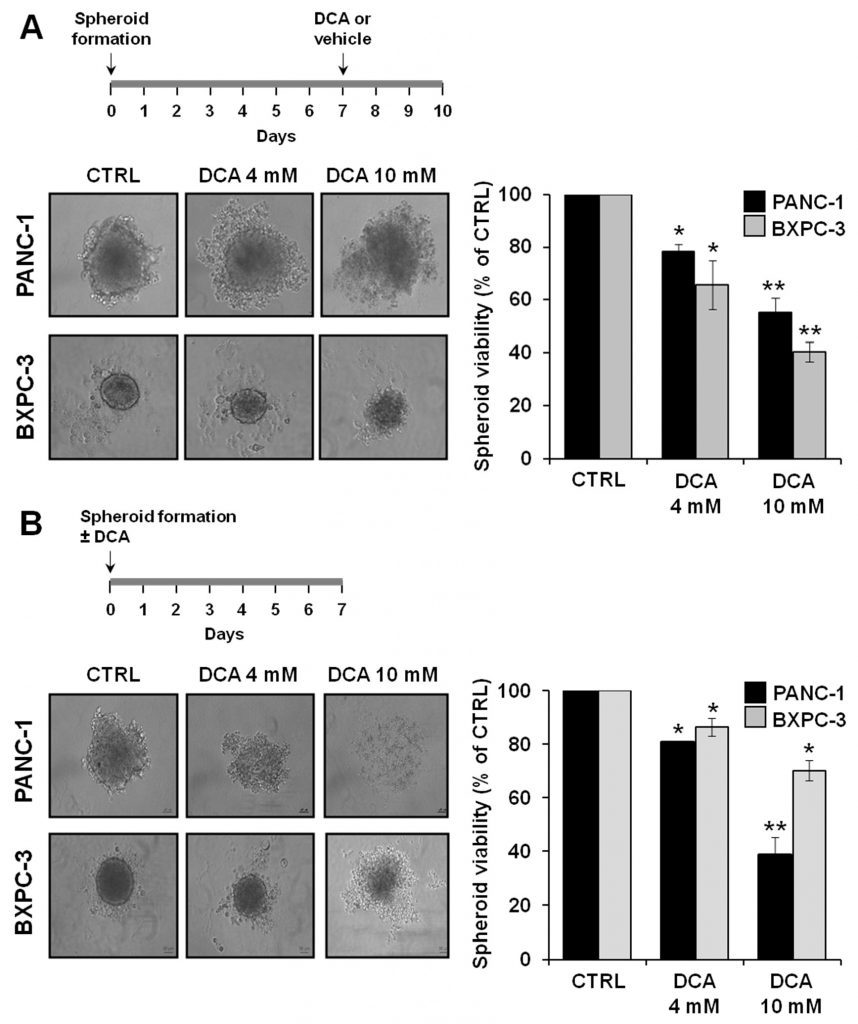
We onderzochten ook het vermogen van DCA om sferoïde vorming te beïnvloeden door het behandelen van celsuspensie bij het zaaien. Zoals getoond in figuur 8B, DCA sterk beïnvloed sferoïde vorming in zowel van de PDAC cellijnen, met PANC-1 resulteert gevoeliger voor het geneesmiddel. Dienovereenkomstig werd de levensvatbaarheid van PANC-1 sferoïden aanzienlijk meer aangetast dan die van BXPC-3 sferoïden.
DCA vermindert de kankerprogressie in een PC Xenograft muismodel
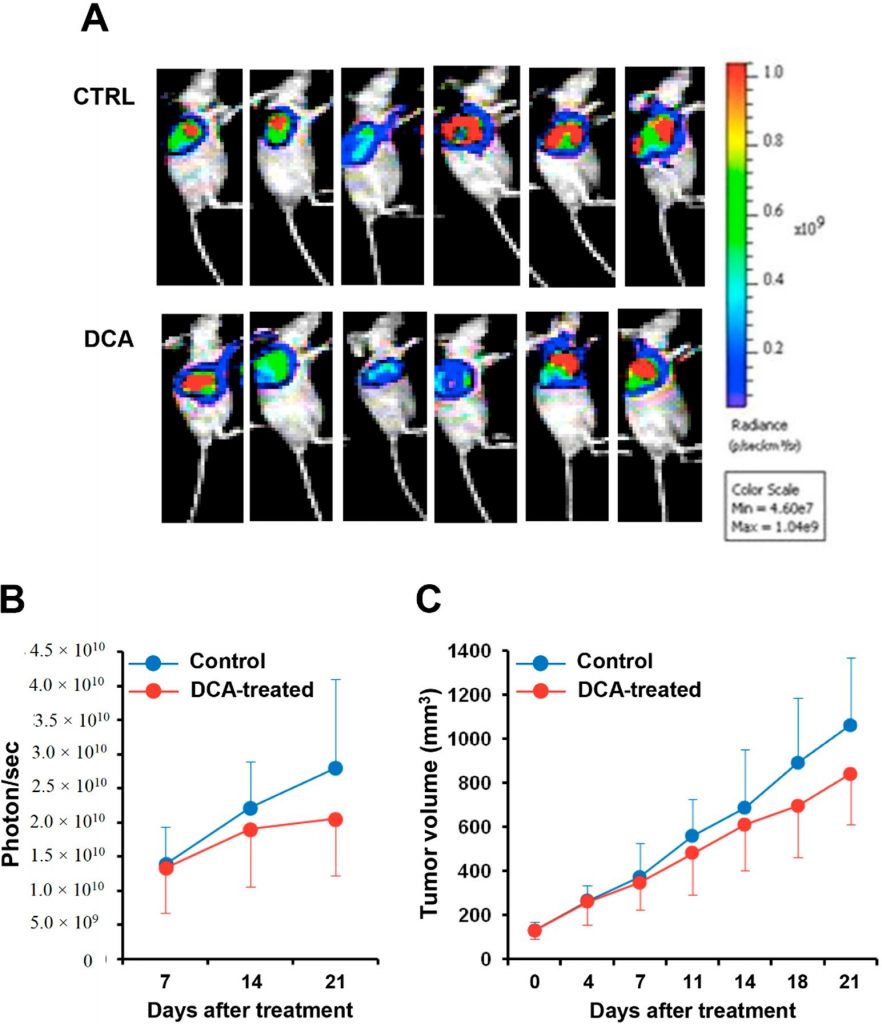
Ten slotte evalueerden we het effect van DCA-toediening in een xenograft pancreaskanker muismodel. Luciferase-expressie BXPC-3 cellijn werd geïnjecteerd in naakte muizen en na het bereiken van een volume van 100 mm3 werden behandeld met DCA of voertuig gedurende drie weken. Figuur 9A toont de bioluminescentie beeldvorming van de tumormassa in DCA behandelde en controle muizen. Kwantificering van het bioluminescentiesignaal toonde een vertraagde progressie van de pancreastumor in de met DCA behandelde muizen, gedocumenteerd door een 25-30% vermindering van zowel de intensiteit van het bioluminescentiesignaal van de tumormassa als van het volume ervan in vergelijking met de met medium behandelde muizen (figuur 9B, C). Wegens de grote interindividuele variabiliteit bereikten de verschillen echter geen statistische significantie.
4. Bespreking
Afwijkende stofwisselingsprocessen komen over het algemeen voor in kankercellen, en daarom is het richten van het metabolisme een opkomende strategie voor de behandeling van tumoren, waaronder alvleesklierkanker [31,32,33]. Tumor heterogeniteit kan resulteren in kwaadaardige cellen met een verschillend metabool fenotype, en bijgevolg een verschillende gevoeligheid voor metabole geneesmiddelen, zoals in het geval van gemcitabine, waartegen de meerderheid van de patiënten met pancreaskanker resistentie ontwikkelt [17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34].
In de huidige studie hebben wij de werkzaamheid van het metabole geneesmiddel DCA getest in 2D en 3D culturen van twee verschillende goed gekarakteriseerde pancreaskanker cellijnen (namelijk PANC-1 en BXPC-3) en in een xenograft model van pancreaskanker. Beide cellijnen, gekweekt in monolayer, toonden een duidelijke gevoeligheid voor DCA bij de hoogste geteste concentratie (10 mM), die de celdeling stopte en de migratiecapaciteit ernstig remde. Het testen van het geneesmiddel bij een lagere concentratie (d.w.z. 4 mM DCA) bracht een hogere gevoeligheid van de PANC-1 cellijn aan het licht. Deze observatie is van belang omdat PANC-1 wordt gerapporteerd als een agressieve en chemo-resistente cellijn [21,22,35].
Analyse van de levensvatbaarheidsparameters in beide met DCA behandelde PDAC-cellijnen bracht een beperkt percentage apoptotische/necrotische cellen aan het licht, wat eerder wijst op een cytostatisch dan op een cytotoxisch effect van het geneesmiddel, hetgeen eerdere rapporten bevestigt [36,37].
Een belangrijk effect van DCA wordt doorgaans toegeschreven aan zijn vermogen om een metabolische omschakeling van glycolyse naar mitochondriale glucose-oxidatie te induceren. Dit wordt bereikt door remming van het PDH-kinase PDK, waardoor PDH verschuift naar zijn actievere, ongefosforyleerde toestand [38,39]. Bijgevolg wordt pyruvaat omgezet in acetyl-CoA, dat in de tricarbonzuurcyclus terechtkomt en de mitochondriale oxidatieve fosforylering voedt.
In deze studie vonden wij echter dat ondanks een aanzienlijke DCA-geïnduceerde defosforylering van PDH geen activering van de mitochondriale ademhalingsactiviteit werd waargenomen in beide met geneesmiddelen behandelde PDAC-cellijnen. Integendeel, DCA veroorzaakte een dosisafhankelijke vermindering van mitochondriaal OxPhos, die gepaard ging met remming van de glycolytische capaciteit in BXPC-3.
Dit resultaat was ook enigszins verrassend, aangezien wij in een eerdere studie met mondkankercellijnen hebben aangetoond dat PE15-cellen, gekenmerkt door een aanhoudend OxPhos, resistent waren tegen de DCA-behandeling, terwijl HSC2/3-cellen, die een glycolytisch profiel vertonen, gevoeliger bleken voor het geneesmiddel, met ook een duidelijk effect op de mitochondriale morfo-functionele parameters [7]. Bovendien toonden wij in een andere studie met PANC-1 en BXPC-3 cellijnen een differentiële gevoeligheid aan voor glucosedeprivatie/galactosevervanging, een toestand die ook het oxidatieve metabolisme bevordert, waarbij de meer glycolytische BXPC-3 cellen kwetsbaarder waren [6]. Dit bracht ons tot de hypothese dat de ongelijke gevoeligheid van verschillende cellijnen voor geneesmiddelen of omstandigheden die een pro-oxidatieve metabolische verschuiving bevorderen, afhankelijk was van hun basale metabolische profiel, waarbij degenen die meer afhankelijk zijn van glycolyse en/of een lage ademhalingscapaciteit kwetsbaarder zijn.
Het onderdrukkende effect van DCA op de mitochondriale ademhaling leidde kennelijk niet tot veranderingen in de mitochondriale morfologie, hoewel in met DCA behandelde BXPC-3 cellen een significante vermindering van de splijtingsbevorderende factor Drp1 werd waargenomen. Waarschijnlijk is het basale gefragmenteerde fenotype van het mitochondriale netwerk in BXPC-3 verborgen om verdere mitochondriale fragmentatie te waarderen. Het mtDNA-kopiegetal/cel was echter aanzienlijk toegenomen in beide PDAC-cellijnen, waarschijnlijk als gevolg van een compensatiemechanisme als gevolg van mitochondriale disfunctie die leidt tot activering van mitofagie, zoals blijkt uit de toegenomen gekloofde vorm van LC3B-II. De waargenomen verhoogde productie van ROS in met DCA behandelde PDAC-cellijnen zou kunnen leiden tot kwaliteitscontrole van de organellen om beschadigde mitochondriën te verwijderen. Onevenwichtige ROS-homeostase wordt gewoonlijk in verband gebracht met disfunctie van de mitochondriale ademhalingsketen, hoewel het verband vaak niet duidelijk is (d.w.z. oorzaak, gevolg, vicieuze cirkel). In het algemeen werd het beschouwd als een pro-overlevingsmechanisme dat cellen beschermt onder stressomstandigheden (oncogene functie) [40], maar meer recent is aangetoond dat ontregeling van mitofagie bijdraagt tot resistentie tegen geneesmiddelen (tumorsuppressieve rol) [41]. Hoe dan ook, de inductie en remming van mitofagie bij kankerprogressie is nog steeds controversieel.
Al deze waarnemingen tezamen stellen ons niet in staat het cytostatische effect van DCA te rationaliseren als eenvoudig gekoppeld aan de metabolische herbedrading van de PDAC-cellen. Er moet rekening mee worden gehouden dat DCA naast PDK ook andere cellulaire pathways kan aanpakken. Er is namelijk gerapporteerd dat DCA de CoA biosynthese route beïnvloedt [42], de AMPK signaalroute activeert [43], antagoneert met acetaat [44], en het tyrosine katabolisme verstoort [45]. Bovendien resulteerde vergelijking van de metabolietprofielen in cellen behandeld met DCA of meer selectieve nieuwe remmers van PDK in verschillende uitkomsten [46]. Dit bracht ons ertoe om aanvullende potentiële off-target effecten van DCA te onderzoeken om de doeltreffendheid ervan om tumorcellen te raken te verklaren.
Kanker stamcellen (CSC’s) vertegenwoordigen een fractie van de hele tumormassa en zijn verantwoordelijk voor refractaire kankertherapie, metastaseverspreiding en terugval van de tumor [47], waardoor ze steeds meer belangstelling krijgen als doelwit voor de ontwikkeling van nieuwe antikankertherapieën [48]. Voor zover wij weten is er geen rapport over het effect van DCA op pancreaskanker stamcellen. Om dit intrigerende aspect te ontleden, evalueerden we eerst het effect van DCA-behandeling op de expressie van Lin28, waarbij een significante dosis-afhankelijke downregulatie in beide cellijnen werd vastgesteld. De expressie van Lin28 is nauw verbonden met het metabolisme, aangezien het in staat is de voortgang van kankercellen te reguleren via PDK1 en een energetische omschakeling te induceren [49]. Lin28 is betrokken bij de vorming van CSC’s [50] en de afwijkende expressie ervan wordt in verband gebracht met vele menselijke neoplastische ziekten, waaronder pancreaskanker [51,52]. FACS-analyse van de oppervlakte-antigeenexpressie CD44, CD24, en EPCAM die typisch zijn voor pancreas-CSC’s [53] onthulde dat DCA-behandeling het percentage van de drievoudig positieve fractie in PANC-1 verminderde. Daarentegen zagen wij geen DCA-geïnduceerde modulatie in BXPC-3, die voornamelijk bestond uit drievoudig positieve cellen. Er moet rekening mee worden gehouden dat, hoewel meer dan 90% van de BXPC-3 positief was voor stamvormmerkers, hun expressieniveau relatief laag was. PANC-1 daarentegen drukte hogere niveaus van stamvormmerkers uit, hoewel slechts in minder dan 30% van de celpopulatie, hetgeen wijst op een jonger CSC-fenotype dat deze celsubset kenmerkt. Consistent met deze observatie is de opvatting dat niet zozeer de absolute expressie van de CSC-merkers als wel hun ratio de stamvormingsneiging van kankercellen “kwalificeert” [28]. Aangezien de CD44/CD24-expressieverhouding in PANC-1 veel hoger is dan in BXPC-3, zou dit erop wijzen dat, hoewel minder bevolkt, het CSC-compartiment in PANC-1 kwalitatief meer op stamcellen lijkt. Omgekeerd zou het lage expressieniveau van de CSC-markers die in de BXPC-3 celpopulatie wijd verspreid zijn, hen als vroege progenitors fenotyperen. Dit verschil in de twee pancreaskankercellijnen zou een verklaring kunnen zijn voor hun verschillende metabolische fenotypes en gevoeligheid voor chemotherapeutische geneesmiddelen en voor DCA.
Driedimensionale (3D) celkweektechnologie is een aandachtspunt geworden in het onderzoek naar tumorcelbiologie. Vergeleken met 2D zijn 3D-culturen van cellijnen verrijkt met CSC’s [30,54] en door de metabole en proliferatieve gradiënten van in vivo tumoren na te bootsen, bieden zij een betrouwbaardere voorspelling van de respons op een eventuele behandeling [55,56]. In dit perspectief hebben wij de werkzaamheid van DCA op 3D-kweek van PANC-1 en BXPC-3 getest en aangetoond dat DCA-behandeling de structuur en de levensvatbaarheid van reeds gevormde sferoïden en de sferoïdevorming van beide cellijnen in gevaar bracht. Met name bij de hogere dosis kon DCA de sferoïdevorming van PANC-1 bijna volledig remmen. In overeenstemming met onze waarnemingen in 2D-culturen waren BXPC-3 sferoïden minder gevoelig voor DCA-behandeling dan PANC-1 sferoïden. Evenzo werd in 2D-culturen een significante downregulatie van Lin28 waargenomen in sferoïden van beide cellijnen. Hoewel de hierboven gemelde veranderingen in het expressieniveau van algemeen erkende CSC-markers in zowel 2D- als 3D-culturen geen sluitend bewijs vormen voor het effect van DCA op het stamcelcompartiment van PDAC, leveren zij niettemin tot dusver ongekende aanwijzingen die nader onderzoek verdienen. Op in vivo niveau veroorzaakte DCA-behandeling een tragere, hoewel niet significante, kankergroei in BxPC-3-luc tumordragende muizen in vergelijking met de controlemuizen, zoals beoordeeld door verminderde fotontelling en afgenomen tumorvolume.
Om de raadselachtige effecten van DCA op de PDAC-cellijnen uit onze studie te rationaliseren, stellen wij de volgende hypothetische volgorde van gebeurtenissen voor, bedoeld om verder onderzoek te stimuleren (figuur 10). Wij suggereren dat als gevolg van een versterkte oxidatie van pyruvaat meer reductie-equivalenten worden overgedragen aan de mitochondriale ademhalingsketen met generatie van ROS. De ademhalingscomplexen zijn zowel producenten als doelwitten van ROS [57], waardoor een vicieuze cirkel ontstaat die leidt tot progressieve remming van de functionele elektronenoverdracht in de gehele ademhalingsketen, waardoor verdere ROS-genetische omleiding van elektronen naar O2 wordt bevorderd. Bovendien kan demping van de ademhalingsactiviteit leiden tot accumulatie van tussenproducten van de tricarbonzuurcyclus en van acetyl-CoA. Het is bekend dat wanneer dit laatste accumuleert, het lysine-acetylering veroorzaakt en de functie van een aantal mitochondriale eiwitten, waaronder ademhalingsketencomplexen, remt [58,59]. De daaruit voortvloeiende progressieve mitochondriale schade/dysfunctie wordt tegengegaan door upregulatie van mitofagie. Hoe en of deze DCA-gemedieerde mitochondriale veranderingen leiden tot groeistilstand en herbedrading van het celfenotype, in het bijzonder van het kankerstamcelcompartiment, moet nog worden vastgesteld. Een aantal meldingen wijst er echter op dat een pro-oxidatieve toestand ervoor zorgt dat stamcellen uit hun ongedifferentieerde toestand komen en commitment induceert/bevordert [60,61]. Bovendien regelen epigenetische modificaties, zoals die welke chromatine remodeling veroorzaken, het evenwicht tussen pluripotentie en differentiatie van stamcellen [62,63]. Mogelijk veroorzaakt de vastgelopen TCA-cyclus de uitstroom van citraat in het cytosol, waar het acetyl-CoA vrijmaakt, waardoor het beschikbaar komt voor histonacetylering. Uiteraard kunnen andere, nog niet gekarakteriseerde DCA-doelen bijdragen tot de waargenomen effecten van het geneesmiddel of deze zelfs overheersen.
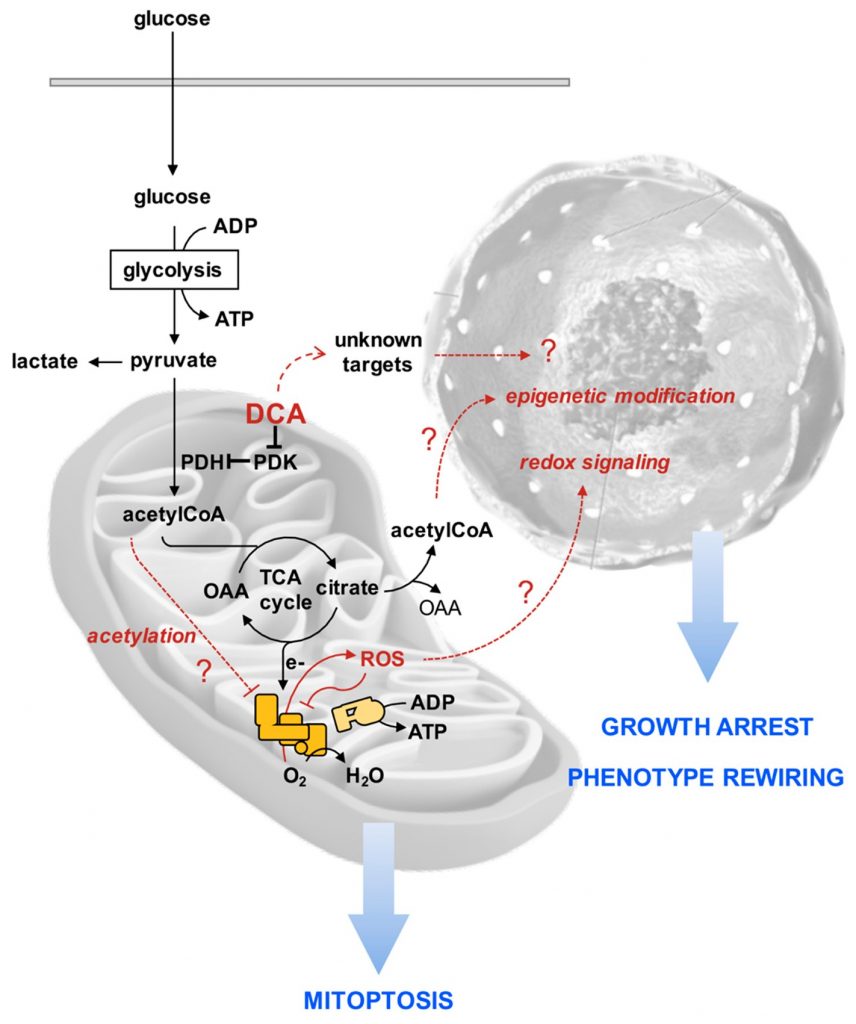
Concluderend tonen onze resultaten duidelijk aan dat de werkzaamheid van DCA bij het remmen van de groei van kankercellen niet altijd causaal verband houdt met het gedocumenteerde stimulerende effect op de PDH-activiteit en bijgevolg het omgekeerde Warburg-effect. Afhankelijk van het fenotype van de cel moeten andere off-targets worden overwogen. In deze context is het bewijs, dat uit deze studie naar voren komt, dat het CSC-compartiment in PDAC-afgeleide cellijnen beïnvloed zou kunnen worden door DCA-behandeling, relevant. Het zou de moeite waard zijn om na te gaan of dit ook in andere kankerceltypes gebeurt en in ons lab wordt hieraan gewerkt. Recente onderzoeksprojecten die oppervlaktegefunctionaliseerde, met dichlooracetaat geladen nanodeeltjes [64], en multifunctionele geneesmiddelen verkregen door chemotherapeutische middelen met DCA als ligand [65] zouden kunnen helpen bij het ontwerpen van de juiste gerichte farmacologische formulering voor het ontwikkelen van nieuwe effectieve therapeutische strategieën voor de bestrijding van zowel alvleesklierkanker als andere soorten kanker.
Aanvullende materialen
Het volgende is online beschikbaar op https://www.mdpi.com/2073-4409/8/5/478/s1: Figuur S1: Effect van DCA op celproliferatie beoordeeld door XCELLigence in medium met lage glucose; Figuur S2: Scratch-healing; Figuur S3: Effect van DCA op lactaatproductie; Figuur S4: Figuur S5: Vergelijkend effect van DCA op de metabole fluxen in PDAC-cellijnen onder omstandigheden van lage glucose (LG) en hoge glucose (HG) kweek; Figuur S6: Eiwit expressie van factoren die betrokken zijn bij mitochondriën fusie-splitsing (OPA1, MFN1/2); Figuur S7: Beoordeling van stamvorming in PDAC-cellijnen.
Auteur Bijdragen
T.T. planning, onderzoek en schrijven; F.A., C.P. (Consiglia Pacelli) en C.M. onderzoek; V.R. en I.L. data curation; G.D.S. visualisatie; C.P. (Concetta Panebianco) en V.P. diermodel; N.C. beoordeling en redactie, en C.P. (Claudia Piccoli) conceptualisering, supervisie.
Financiering
Dit onderzoek werd gefinancierd door lopende onderzoeksfondsen van het Italiaanse ministerie van Volksgezondheid aan het IRCCS CROB en door subsidies van het Italiaanse ministerie van Volksgezondheid via de afdeling Gastro-enterologie (RC1703GA31 en RC1803GA30) IRCCS “Casa Sollievo della Sofferenza” ziekenhuis.
Belangenverstrengeling
De auteurs verklaren geen belangenconflict te hebben.
VERWIJZINGEN
1 Ying, H.; Dey, P.; Yao, W.; Kimmelman, A.C.; Draetta, G.F.; Maitra, A.; DePinho, R.A. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2016, 30, 355-385. [CrossRef]2 Hidalgo, M. Alvleesklierkanker. N. Engl. J. Med. 2010, 362, 1605-1617. [CrossRef] [PubMed]
3 Camelo, F.; Le, A. The Intricate Metabolism of Pancreatic Cancers. Adv. Exp. Med. Biol. 2018, 1063, 73-81. [PubMed]
4 Adamska, A.; Domenichini, A.; Falasca, M. Pancreatic Ductal Adenocarcinoma: Current and Evolving Therapies. Int. J. Mol. Sci. 2017, 18, E1338. [CrossRef] [PubMed]
5 Gentric, G.; Mieulet, V.; Mechta-Grigoriou, F. Heterogenity in Cancer Metabolism: New Concepts in an Old Field. Antioxid. Redox Signal. 2017, 26, 462-485. [CrossRef]
6 Tataranni, T.; Agriesti, F.; Ruggieri, V.; Mazzoccoli, C.; Simeon, V.; Laurenzana, I.; Scrima, R.; Pazienza, V.; Capitanio, N.; Piccoli, C. Rewiring carbohydrate catabolism differentially affects survival of pancreatic cancer cell lines with diverse metabolic profiles. Oncotarget 2017, 8, 41265-41281. [CrossRef]
7 Ruggieri, V.; Agriesti, F.; Scrima, R.; Laurenzana, I.; Perrone, D.; Tataranni, T.; Mazzoccoli, C.; Lo Muzio, L.; Capitanio, N.; Piccoli, C. Dichloroacetate, a selective mitochondria-targeting drug for oral squamous cell carcinoma: A metabolic perspective of treatment. Oncotarget 2015, 6, 1217-1230. [CrossRef]
8 Anderson, K.M.; Jajeh, J.; Guinan, P.; Rubenstein, M. In vitro effecten van dichlooracetaat en CO2 op hypoxische HeLa-cellen. Anticancer Res. 2009, 29, 4579-4588.
9 Chen, Y.; Cairns, R.; Papandreou, I.; Koong, A.; Denko, N.C. Oxygen consumption can regulate the growth of tumors, a new perspective on the Warburg effect. PLoS ONE 2009, 4, e7033. [CrossRef]
10 Lu, X.; Zhou, D.; Hou, B.; Liu, Q.X.; Chen, Q.; Deng, X.F.; Yu, Z.B.; Dai, J.G.; Zheng, H. Dichloroacetate enhances the antitumor efficacy of chemotherapeutic agents via inhibiting autophagy in non-small-cell lung cancer. Cancer Manag. Res. 2018, 10, 1231-1241. [CrossRef]
11 Yang, C.; Wu, T.; Qin, Y.; Qi, Y.; Sun, Y.; Kong, M.; Jiang, X.; Qin, X.; Shen, Y.; Zhang, Z. A facile doxorubicin-dichloroacetate conjugate nanomedicine with high drug loading for safe drug delivery. Int. J. Nanomed. 2018, 13, 1281-1293. [CrossRef]
12 Rajeshkumar, N.V.; Yabuuchi, S.; Pai, S.G.; De Oliveira, E.; Kamphorst, J.J.; Rabinowitz, J.D.; Tejero, H.; Al-Shahrour, F.; Hidalgo, M.; Maitra, A.; et al. Treatment of Pancreatic Cancer Patient-Derived Xenograft Panel with Metabolic Inhibitors Reveals Efficacy of Phenformin. Clin. Cancer Res. 2017, 23, 5639-5647. [CrossRef]
13 Khan, A.; Marier, D.; Marsden, E.; Andrews, D.; Eliaz, I. A novel form of dichloroacetate therapy for patients with advanced cancer: Een verslag van 3 gevallen. Altern. Ther. Health Med. 2014, 20 (Suppl. 2), 21-28.
14 Hanberry, B.S.; Berger, R.; Zastre, J.A. Hooggedoseerde vitamine B1 vermindert proliferatie in kankercellijnen analoog aan dichlooracetaat. Cancer Chemother. Pharm. 2014, 73, 585-594. [CrossRef]
15 Lowe, A.W.; Olsen, M.; Hao, Y.; Lee, S.P.; Taek Lee, K.; Chen, X.; van de Rijn, M.; Brown, P.O. Gene expression patterns in pancreatic tumors, cells and tissues. PLoS ONE 2007, 2, e323. [CrossRef]
16 Herten, E.L.; González-Hernández, J.; Coursen, J.D.; Shea, J.E.; Ngatia, J.; Scaife, C.L.; Firpo, M.A.; Mulvihill, S.J. Fenotype en genotype van pancreaskanker cellijnen. Pancreas 2010, 39, 425-435. [CrossRef]
17 Daemen, A.; Peterson, D.; Sahu, N.; McCord, R.; Du, X.; Liu, B.; Kowanetz, K.; Hong, R.; Moffat, J.; Gao, M.; et al. Metabolite profiling stratifies pancreatic ductal adenocarcinomas into subtypes with distinct sensitivities to metabolic inhibitors. Proc. Natl. Acad. Sci. USA 2015, 112, E4410-E4417. [CrossRef]
18 Mazzoccoli, C.; Ruggieri, V.; Tataranni, T.; Agriesti, F.; Laurenzana, I.; Fratello, A.; Capitanio, N.; Piccoli, C. N-acetylaspartaat (NAA) induceert neuronale differentiatie van SH-SY5Y neuroblastoomcellijn en sensibiliseert deze voor chemotherapeutische middelen. Oncotarget 2016, 7, 26235-26246. [CrossRef]
19 Scrima, R.; Menga, M.; Pacelli, C.; Agriesti, F.; Cela, O.; Piccoli, C.; Cotoia, A.; De Gregorio, A.; Gefter, J.V.; Cinnella, G.; et al. Para-hydroxyfenylpyruvaat remt de pro-inflammatoire stimulatie van macrofagen voorkomt LPS-gemedieerde nitro-oxidatieve onbalans en immunometabole verschuiving. PLoS ONE 2017, 12, e0188683. [CrossRef]
20 Fredebohm, J.; Boettcher, M.; Eisen, C.; Gaida, M.M.; Heller, A.; Keleg, S.; Tost, J.; Greulich-Bode, K.M.; Hotz-Wagenblatt, A.; Lathrop, M.; et al. Establishment and characterization of a highly tumourigenic and cancer stem cell enriched pancreatic cancer cell line as a well defined model system. PLoS ONE 2012, 7, e48503. [CrossRef]
21 Fryer, R.A.; Barlett, B.; Galustian, C.; Dalgleish, A.G. Mechanisms underlying gemcitabine resistance in pancreatic cancer and sensitisation by the iMiD™ lenalidomide. Anticancer Res. 2011, 31, 3747-3756.
22 Yin, T.; Wei, H.; Gou, S.; Shi, P.; Yang, Z.; Zhao, G.; Wang, C. Cancer stem-like cells enriched in Panc-1 spheres possess increased migration ability and resistance to gemcitabine. Int. J. Mol. Sci. 2011, 12, 1595-
23 Jun-Hao, E.T.; Gupta, R.R.; Shyh-Chang, N. Lin28 and let-7 in the Metabolic Physiology of Aging. Trends Endocrinol. Metab. 2016, 27, 132-141. [CrossRef] [PubMed]
24 Zhang, J.; Ratanasirintrawoot, S.; Chandrasekaran, S.; Wu, Z.; Ficarro, S.B.; Yu, C.; Ross, C.A.; Cacchiarelli, D.; Xia, Q.; Seligson, M.; et al. LIN28 Regelt Stamcelmetabolisme en Conversie naar Primed Pluripotentie. Cell Stem Cell 2016, 19, 66-80. [CrossRef] [PubMed]
25 Wang, X.; Weng, M.; Jin, Y.; Yang, W.; Wu, D.; Wang, T.; Li, X. Beyond an oncogene, Lin28 is a master regulator of cancer progression. Histol. Histopathol. 2018, 33, 327-334. [PubMed]
26 Li, C.; Heidt, D.G.; Dalerba, P.; Burant, C.F.; Zhang, L.; Adsay, V.; Wicha, M.; Clarke, M.F.; Simeone, D.M. Identification of pancreatic cancer stem cells. Cancer Res. 2007, 67, 1030-1037. [CrossRef]
27 Ohara, Y.; Oda, T.; Sugano, M.; Hashimoto, S.; Enomoto, T.; Yamada, K.; Akashi, Y.; Miyamoto, R.; Kobayashi, A.; Fukunaga, K.; et al. Histologisch en prognostisch belang van CD44(+)/CD24(+)/EpCAM(+) expressie in klinische pancreaskanker. Cancer Sci. 2013, 104, 1127-1134. [CrossRef]
28 Li, W.; Ma, H.; Zhang, J.; Zhu, L.; Wang, C.; Yang, Y. Auteurscorrectie: Unraveling the roles of CD44/CD24 and ALDH1 as cancer stem cell markers in tumorigenesis and metastasis. Sci. Rep. 2018, 8, 4276. [CrossRef] [PubMed]
29 Melissaridou, S.; Wiechec, E.; Magan, M.; Jain, M.V.; Chung, M.K.; Farnebo, L.; Roberg, K. The effect of 2D and 3D cell cultures on treatment response, EMT profile and stem cell features in head and neck cancer. Cancer Cell Int. 2019, 19, 16. [CrossRef] [PubMed]
30 Ishiguro, T.; Ohata, H.; Sato, A.; Yamawaki, K.; Enomoto, T.; Okamoto, K. Tumor-derived spheroids: Relevantie voor kankerstamcellen en klinische toepassingen. Cancer Sci. 2017, 108, 283-289. [CrossRef]
31 Luo, J.; Solimini, N.L.; Elledge, S.J. Principles of cancer therapy: Oncogene en niet-oncogene verslaving. Cell 2009, 136, 823-837. [CrossRef]
32 Vivanco, I. Targeting molecular addictions in cancer. Br. J. Cancer 2014, 111, 2033-2038. [CrossRef]
33 Belizário, J.E.; Sangiuliano, B.A.; Perez-Sosa, M.; Neyra, J.M.; Moreira, D.F. Using Pharmacogenomic Databases for Discovering Patient-Target Genes and Small Molecule Candidates to Cancer Therapy. Front. Pharmacol. 2016, 7, 312. [CrossRef]
34 Grasso, C.; Jansen, G.; Giovannetti, E. Drug resistance in pancreatic cancer:Impact of altered energy metabolism. Crit. Rev. Oncol. Hematol. 2017, 114, 139-152. [CrossRef]
35 Huanwen, W.; Zhiyong, L.; Xiaohua, S.; Xinyu, R.; Kai, W.; Tonghua, L. Intrinsieke chemoresistentie tegen gemcitabine is geassocieerd met constitutieve en laminine-geïnduceerde fosforylering van FAK in pancreaskanker cellijnen. Mol. Cancer 2009, 8, 125. [CrossRef]
36 Fedorchuk, A.G.; Pyaskovskaya, O.N.; Gorbik, G.V.; Prokhorova, I.V.; Kolesnik, D.L.; Solyanik, G.I. Effectiveness of sodium dichloroacetate against glioma C6 depends on administration schedule and dosage. Exp. Oncol. 2016, 38, 80-83. [CrossRef]
37 Ma, W.; Zhao, X.; Wang, K.; Liu, J.; Huang, G. Dichloorazijnzuur (DCA) synergiseert met de SIRT2-remmer Sirtinol en AGK2 om de anti-tumorwerking in niet-kleincellige longkanker te verbeteren. Cancer Biol. Ther. 2018, 19, 835-846. [CrossRef]
38 Michelakis, E.D.; Sutendra, G.; Dromparis, P.; Webster, L.; Haromy, A.; Niven, E.; Maguire, C.; Gammer, T.L.; Mackey, J.R.; Fulton, D.; et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci. Transl. Med. 2010, 2, 31ra34. [CrossRef]
39 Papandreou, I.; Goliasova, T.; Denko, N.C. Antikankermedicijnen die het metabolisme aanpakken: is dichlooracetaat het nieuwe paradigma? Int. J. Cancer 2011, 128, 1001-1008. [CrossRef]
40 Yan, C.; Li, T.S. Dual Role of Mitophagy in Cancer Drug Resistance. Anticancer Res. 2018, 38, 617-621.
41 Praharaj, P.P.; Naik, P.P.; Panigrahi, D.P.; Bhol, C.S.; Mahapatra, K.K.; Patra, S.; Sethi, G.; Bhutia, S.K. Intricate role of mitochondrial lipid in mitophagy and mitochondrial apoptosis: Its implication in cancer therapeutics. Cell Mol. Life Sci. 2018. [CrossRef]
42 Dubuis, S.; Ortmayr, K.; Zampieri, M. A framework for large-scale metabolome drug profiling links coenzyme A metabolism to the toxicity of anti-cancer drug dichloroacetate. Commun. Biol. 2018, 1, 101. [CrossRef]
43 Li, X.; Liu, J.; Hu, H.; Lu, S.; Lu, Q.; Quan, N.; Rousselle, T.; Patel, M.S.; Li, J. Dichloroacetate Ameliorates Cardiac Dysfunction Caused by Ischemic Insults Through AMPK Signal Pathway-Not Only Shifts Metabolism. Toxicol. Sci. 2019, 167, 604-617. [CrossRef]
44 El Sayed, S.M.; Baghdadi, H.; Ahmed, N.S.; Almaramhy, H.H.; Mahmoud, A.A.; El-Sawy, S.A.; Ayat, M.; Elshazley, M.; Abdel-Aziz, W.; Abdel-Latif, H.M.; et al. Dichlooracetaat is een antimetaboliet die acetaat antagoneert en kankercellen de voordelen ervan ontneemt: Een nieuwe evidence-based medische hypothese. Med. Hypotheses 2019, 122, 206-209. [CrossRef] [PubMed]
45 Guo, X.; Dixit, V.; Liu, H.; Shroads, A.L.; Henderson, G.N.; James, M.O.; Stacpoole, P.W. Inhibition and recovery of rat hepatic glutathione S-transferase zeta and alteration of tyrosine metabolism following dichloroacetate exposure and withdrawal. Drug Metab. Dispos. 2006, 34, 36-42. [CrossRef]
46 Zhang, W.; Hu, X.; Zhou, W.; Tam, K.Y. Liquid Chromatography-Tandem Mass Spectrometry Method Revealed that Lung Cancer Cells Exhibited Distinct Metabolite Profiles upon the Treatment with Different Pyruvate Dehydrogenase Kinase Inhibitors. J. Proteome Res. 2018, 17, 3012-3021. [CrossRef]
47 Prasetyanti, P.R.; Medema, J.P. Intra-tumor heterogeniteit vanuit een kanker stamcel perspectief. Mol. Cancer 2017, 16, 41. [CrossRef] [PubMed]
48 Chen, L.S.; Wang, A.X.; Dong, B.; Pu, K.F.; Yuan, L.H.; Zhu, Y.M. Een nieuw perspectief in kankertherapie: Targeting cancer stem cells to eradicate cancer. Chin. J. Cancer 2012, 31, 564-572. [CrossRef]
49 Ma, X.; Li, C.; Sun, L.; Huang, D.; Li, T.; He, X.; Wu, G.; Yang, Z.; Zhong, X.; Song, L.; et al. Lin28/let-7 axis regulates aerobic glycolysis and cancer progression via PDK1. Nat. Commun. 2014, 5, 5212. [CrossRef]
50 Zhou, J.; Ng, S.B.; Chng, W.J. LIN28/LIN28B: An emerging oncogenic driver in cancer stem cells. Int. J. Biochem. Cell Biol. 2013, 45, 973-978. [CrossRef] [PubMed]
51 Wang, Y.; Li, J.; Guo, S.; Ouyang, Y.; Yin, L.; Liu, S.; Zhao, Z.; Yang, J.; Huang, W.; Qin, H.; et al. Lin28B faciliteert de progressie en metastase van pancreas ductaal adenocarcinoom. Oncotarget 2017, 8, 60414-60428. [CrossRef] [PubMed]
52 Balzeau, J.; Menezes, M.R.; Cao, S.; Hagan, J.P. The LIN28/let-7 Pathway in Cancer. Front. Genet. 2017, 8, 31. [CrossRef] [PubMed]
53 Ishiwata, T.; Matsuda, Y.; Yoshimura, H.; Sasaki, N.; Ishiwata, S.; Ishikawa, N.; Takubo, K.; Arai, T.; Aida, J. Pancreatic cancer stem cells: Kenmerken en detectiemethoden. Pathol. Oncol. Res. 2018, 24, 797-805. [CrossRef]
54 Ravi, M.; Ramesh, A.; Pattabhi, A. Contributions of 3D Cell Cultures for Cancer Research. J. Cell Physiol. 2017, 232, 2679-2697. [CrossRef]
55 Friedrich, J.; Seidel, C.; Ebner, R.; Kunz-Schughart, L.A. Spheroid-based drug screen: Overwegingen en praktische aanpak. Nat. Protoc. 2009, 4, 309-324. [CrossRef]
56 Gutierrez-Barrera, A.M.; Menter, D.G.; Abruzzese, J.L.; Reddy, S.A. Establishment of three-dimensional cultures of human pancreatic duct epithelial cells. Biochem. Biophys. Res. Commun. 2007, 358, 698-703. [CrossRef]
57 Dröse, S.; Brandt, U.; Wittig, I. Mitochondrial respiratory chain complexes as sources and targets of thiol-based redox-regulation. Biochim. Biophys. Acta 2014, 1844, 1344-1354. [CrossRef]
58 Carrico, C.; Meyer, J.G.; He, W.; Gibson, B.W.; Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metab. 2018, 27, 497-512. [CrossRef]
59Cela, O.; Scrima, R.; Pazienza, V.; Merla, G.; Benegiamo, G.; Augello, B.; Fugetto, S.; Menga, M.; Rubino, R.; Fuhr, L.; et al. Clock genes-dependent acetylation of complex I sets rhythmic activity of mitochondrial OxPhos. Biochim. Biophys. Acta 2016, 1863, 596-606. [CrossRef]
60 Chaudhari, P.; Ye, Z.; Jang, Y.Y. Roles of reactive oxygen species in the fate of stem cells. Antioxid. Redox Signal. 2014, 20, 1881-1890. [CrossRef]
61 Ding, S.; Li, C.; Cheng, N.; Cui, X.; Xu, X.; Zhou, G. Redox Regulation in Cancer Stem Cells. Oxid. Med. Cell. Longev. 2015. [CrossRef] [PubMed]
62 Trisciuoglio, D.; Di Martile, M.; Del Bufalo, D. Emerging Role of Histone Acetyltransferase in Stem Cells and Cancer. Stem Cells Int. 2018, 2018, 8908751. [CrossRef]
63 Yadav, T.; Quivy, J.P.; Almouzni, G. Chromatin plasticity: Een veelzijdig landschap dat ten grondslag ligt aan cel lot en identiteit. Science 2018, 361, 1332-1336. [CrossRef]
64 Abánades Lázaro, I.; Haddad, S.; Rodrigo-Muñoz, J.M.; Orellana-Tavra, C.; Del Pozo, V.; Fairen-Jimenez, D.; Forgan, R.S. Mechanistic Investigation into the Selective Anticancer Cytotoxicity and Immune System Response of Surface-Functionalized, Dichloroacetate-Loaded, UiO-66 Nanoparticles. ACS Appl. Mater Interfaces 2018, 10, 5255-5268. [CrossRef] [PubMed]
65 Petruzzella, E.; Sirota, R.; Solazzo, I.; Gandin, V.; Gibson, D. Triple action Pt(iv)-derivaten van cisplatine: A new class of potent anticancer agents that overcome resistance. Chem. Sci. 2018, 9, 4299-4307. [CrossRef]
Gerelateerde inhoud: