A.G. Fedorchuk, O.N. Pyaskovskaya, G.V. Gorbik, I.V. Prokhorova, D.L. Kolesnik, G.I. Solyanik
1R.E. Kavetsky Instituut voor Experimentele Pathologie, Oncologie en Radiobiologie, NAS van Oekraïne, Kiev 03022, Oekraïne.
Correspondentie: [email protected]
Ingezonden: 17 mei 2016
Abstract
Achtergrond: Antikanker werking van natriumdichlooracetaat (DCA) zou gerelateerd kunnen zijn aan zijn vermogen om oxidatieve fosforylering te activeren wat leidt tot verhoogde generatie van reactieve zuurstofspecies en inductie van apoptose. Anderzijds zou activering van oxidatieve fosforylering de overleving van tumorcellen kunnen bevorderen, met name via verhoogde ATP-synthese. Dergelijke dubbelzinnige effecten van DCA zouden de effectiviteit ervan tegen kanker kunnen beïnvloeden, afhankelijk van de biologische eigenschappen van een tumor, het schema van DCA-toediening en de dosering. Het doel van het onderzoek was het analyseren van het antikanker effect van DCA tegen glioma С6 bij ratten onder verschillende toedieningsschema’s en verschillende doseringen.
Materialen en methoden: Het onderzoek werd uitgevoerd bij Wistar ratten met intracerebraal getransplanteerde glioma С6 cellen. De therapie met DCA werd als volgt uitgevoerd: dagelijks gedurende 6 dagen vanaf de tweede dag na de tumorceltransplantatie (schema І) of 7(e) dag (schema ІІ) in een dosis van 1,0 g/kg, of dagelijks gedurende 13 dagen vanaf de tweede dag in doses van 1,0; 1,5 of 4,5 g/kg (schema ІІІ). De invloed van hypoxie op het antikanker effect van DCA werd bestudeerd met hypoxische kamers waar het zuurstofgehalte op een niveau van 12,5-13% werd gehouden gedurende 3 uur na toediening van DCA aan ratten met glioma С6. De toestand van de mitochondriale componenten van de elektronentransportketen in tumorcellen werd bestudeerd met behulp van elektronen paramagnetische resonantie.
Resultaten: Gebleken is dat therapie met DCA volgens schema I resulteerde in 15% vermindering van de levensduur van de dieren (LS; < 0,05), terwijl het gebruik van schema II geen effect had op deze index. Langdurige toediening van DCA (schema ІІІ) resulteerde in een significant antitumor effect en verhoogde de LS van de ratten met 25,5% (p < 0,05). Onder hypoxische omstandigheden resulteerde behandeling met DCA in een significante verhoging van de LS van de dieren met 15-22%. De dosering van DCA had een matig effect op de antikankerwerking. Het maximale effect, een toename van de LS met 34,5% (p < 0,05) werd vastgesteld bij een dosis van 1,5 g/kg. Er is aangetoond dat de antikankerwerking van DCA onder alle bestudeerde omstandigheden geen verband houdt met de invloed ervan op de functionele toestand van de mitochondriën van de tumorcellen.
Conclusie: Het antikankereffect van DCA is sterk afhankelijk van het toedieningsschema; bij een gelijke totale dosis kan DCA, afhankelijk van het schema, dubbelzinnige effecten veroorzaken, variërend van stimulering van de tumorgroei tot significante antikankeractiviteit. Onder hypoxische omstandigheden wordt de antikankerwerking van DCA tegen glioom С6 aanzienlijk versterkt.
Trefwoorden: natriumdichlooracetaat, glioom С6, mitochondriale elektronentransportketen.
Gebruikte afkortingen: DCA – natriumdichlooracetaat; EPR – elektronenparamagnetische resonantie; LS – levensduur; MtETC – mitochondriale elektronentransportketen; PDH – pyruvaatdehydrogenase kinase; ROS – reactieve zuurstofsoorten.
INLEIDING
Volgens de statistieken van de Wereldgezondheidsorganisatie is de gemiddelde incidentie van hersentumoren 10,9-12,8 per 100 000 inwoners [1]. Bijna 60% van alle tumoren van het centrale zenuwstelsel zijn kwaadaardige neoplasma’s, waaronder 50-55% gliomen. Statistisch gezien vormen gliomen slechts 1,4% van alle klinisch gediagnosticeerde tumoren, maar de prognose voor glioompatiënten is het ongunstigst. De gemiddelde overlevingsduur van patiënten met een kwaadaardig glioom na de primaire diagnose is ongeveer 8 maanden in Oekraïne en 14 maanden in de VS [2]. Daarom behoort de therapie van patiënten met gliomen van verschillende graad van kwaadaardigheid tot de belangrijkste problemen van de moderne klinische oncologie.
Ondanks de ontwikkeling van talrijke nieuwe middelen tegen kanker, is de belangrijkste benadering voor de behandeling van glioma-patiënten momenteel nog steeds een “therapie der wanhoop”, d.w.z. chirurgie, maar de doeltreffendheid daarvan is onvoldoende [3, 4]. Aangenomen wordt dat de inefficiëntie van radicale verwijdering van gliomen grotendeels wordt veroorzaakt door de invasie van de tumor in de normale omringende weefsels, waarbij de vorming van indiscrete marges aanzienlijk vermindert.
Moderne protocollen voor radiotherapie van kwaadaardige gliomen bevelen een gefractioneerde bestraling aan met lage dagelijkse doses (> 2 Gy), met een totale dosis van 60-90 Gy [5]. Zelfs de moderne bestralingsmethoden konden echter niet helpen om de uiterst geringe doeltreffendheid van de therapie te overwinnen, als gevolg van de hoge radioresistentie van het glioom door de ontwikkeling van lokale hypoxie [6].
Chemotherapeutica (inclusief target agents) zijn in het geval van gliomen weinig effectief vanwege hun slechte biologische beschikbaarheid [7-10]. Zo blijkt in de meeste gevallen uit analyse van biopten van maligne gliomen dat er een defecte maar functionele hematoencefalische barrière is die de passage van veel doelwitpreparaten (met name antilichamen tegen groeifactoren en receptoren) verhindert. Voor de behandeling van kwaadaardig glioom wordt slechts één alkylerend cytostaticum, temozolomide, gebruikt. Een respons op de behandeling met temozolomide kan slechts bij 5-8% van de patiënten worden waargenomen in het geval van monotherapie, en bij ongeveer 20% van de patiënten in het geval van adjuvante therapie met temozolomide in combinatie met radiotherapie of chirurgische behandeling [11, 12].
Het is bekend dat in een groot deel van de kwaadaardige tumoren ATP wordt gegenereerd via glycolyse, zelfs in aanwezigheid van zuurstof (Warburg-effect). Aërobe glycolyse is een weinig effectieve manier om ATP te genereren, maar het ondersteunt een hoog proliferatiepotentieel van tumorcellen en bevordert hun overleving, waardoor het risico op vorming van apoptotische prikkels afneemt [13, 14]. Daarom wordt tumormetabolisme, dat deze groeivoordelen biedt, de laatste jaren beschouwd als een nieuw doelwit voor antikankertherapie, en verbindingen die in staat zijn de glycolyse in tumorcellen te remmen worden bestudeerd als potentieel effectieve antikankermiddelen [15-17]. Onder de antimetabolische middelen die actief zijn tegen vele soorten kankercellen kan men natriumdichlooracetaat (DCA) noemen [18-20].
DCA remt pyruvaatdehydrogenase kinase (PDH), wat leidt tot indirecte activering van enzymen van het PDH-complex en bijgevolg tot een verschuiving van het celmetabolisme van glycolyse naar oxidatieve fosforylering. In het geval van activering van oxidatieve fosforylering en verminderde intensiteit van glycolyse bij DCA-werking, zou men een remming van de tumorcelproliferatie kunnen verwachten, met name door een aanzienlijke vermindering van het gehalte aan metabolieten van de pentose-fosfaatomleiding en pyruvaat die belangrijk zijn voor de synthese van eiwitten en nucleïnezuren. De door DCA geïnduceerde activering van het mitochondriaal metabolisme kan leiden tot blokkering van de proliferatie van tumorcellen en verhoging van de productie van reactieve zuurstofspecies (ROS) en inductie van apoptose. Echter, ondanks de theoretische schijn van de antikankerwerking van DCA, is de effectiviteit ervan niet gegarandeerd. Zoals is aangetoond [21], oefent DCA bij een breed concentratiebereik een cytostatische maar geen cytotoxische werking uit, wat wordt ondersteund door de gegevens over de afwezigheid van zijn effect op het intracellulaire niveau van ROS, de lactaatproductie en de apoptosegraad in glioma С6-cellen.
Bovendien moet worden opgemerkt dat DCA-geïnduceerde activering van oxidatieve fosforylering niet alleen een antikankereffect kan hebben, maar ook de overleving van tumorcellen kan bevorderen via verhoogde ATP-synthese. Een dergelijke ambivalente invloed op het overleven van tumorcellen predisponeert een variabiliteit van DCA-activiteit [22, 23]. Biologische eigenschappen van een tumor, schema’s van DCA-toediening en de doses kunnen de antikankerwerking aanzienlijk beïnvloeden.
Het doel van het onderzoek was het analyseren van de effectiviteit van DCA tegen glioma С6 bij ratten onder verschillende toedieningsschema’s en doseringen.
MATERIALEN EN METHODEN
Het onderzoek werd uitgevoerd bij vrouwelijke Wistar ratten van 2,5-3 maanden oud met een gewicht van 90-150 g, gefokt in de dierfaciliteit van het R.E. Kavetsky Instituut voor Experimentele Pathologie, Oncologie en Radiobiologie van de Nationale Academie van Wetenschappen van Oekraïne (IEPOR). Het gebruik en de verzorging van de proefdieren zijn uitgevoerd in overeenstemming met de internationale standaardregels voor biologische ethiek en zijn goedgekeurd door de Institutional Animal Care and Use Committee. Glioma С6-cellijn werd verkregen van de National Bank of Cell Lines and Tumor Strains van IEPOR.
Glioma С6 cellen werden in vitro gekweekt in DMEM kweekmedium aangevuld met 10% FBS (Sigma, USA), 2 mM L-glutamine en 40 mg/ml gentamycine bij 37 ° C in een vochtige atmosfeer met 5% СО2. Transplantatie van glioma С6 cellen werd uitgevoerd onder volledige verdoving via intracerebrale inoculatie van 0,6-106 cellen in 0,05 ml fysiologische oplossing in een linker pariëtale gebied (voorste hoorn van de linker laterale ventrikel).
Waterige DCA-oplossing (Sigma-Aldrich, USA) werd dagelijks per os toegediend via een buisje in een volume van 3 ml per dier. De therapie met DCA werd uitgevoerd volgens verschillende schema’s en in verschillende doses, als volgt:
- schema І – DCA werd dagelijks toegediend gedurende 6 dagen vanaf de tweede dag na de tumorceltransplantatie in een totale dosis van 1,0 g/kg;
- schema ІІ – DCA werd dagelijks toegediend gedurende 6 dagen vanaf de7e dag na de tumorceltransplantatie in een totale dosis van 1,0 g/kg;
- schema ІІІ – DCA werd dagelijks toegediend gedurende 13 dagen vanaf de tweede dag in een totale dosis van 1,0; 1,5 of 4,5 g/kg.
Alle dieren van overeenkomstige controlegroepen kregen 3,0 ml water voor injecties volgens de schema’s voor DCA-toediening. Er waren 13-15 ratten per groep.
Op dag 14 na inoculatie van de tumorcellen werden 4-5 ratten van elke groep onder ethernarcose gedood, bloed werd verzameld; hersenweefsel werd genomen voor verder onderzoek.
De veranderingen in overlevingstijd (CST) van de resterende dieren dienden als index van het antikankereffect van de behandeling berekend met een formule:
CST (%) = 100 (ST – STC)/STC,
waarbij ST en STСrespectievelijk de overlevingstijd van ratten uit de experimentele en controlegroepen zijn.
De invloed van hypoxie (remmer van oxidatieve fosforylering) op het antikankereffect van DCA werd bestudeerd met hypoxische kamers waarin het zuurstofgehalte gedurende 3 uur na toediening van DCA aan ratten met glioma С6 op een niveau van 12,5-13% werd gehouden. Het zuurstofgehalte in de hypoxische kamers werd gecontroleerd met behulp van de oxymeter ISO2 (World Precision Instruments, VS). Antikanker effecten van de behandeling werden geëvalueerd door verlenging van de overlevingstijd van dieren met glioom С6.
De veranderingen in de toestand van de mitochondriale elektronentransportketen (MtETC) in tumorcellen werden geanalyseerd met behulp van elektronen paramagnetische resonantie. Elektronen paramagnetische resonantie (EPR)-analyse van de monsters werd uitgevoerd bij 77 К met behulp van spectrofotometer Е-109 Varian (USA). Door de gegevens van EPR spectroscopie, werden de niveaus van gereduceerde non-heme ijzer-sulfur (Fe-S) centra (g = 1,94) van MtETC eiwitten, nitrosyl (NO) complexen van heemijzer (gсер= 2,01) en Fe-S nitrosyl complexen (gсер= 2,03) bepaald.
Statistische analyse van de gegevens werd uitgevoerd door beschrijvende methoden, correlatieanalyse, niet-lineaire regressieanalyse, Student’s t-test en Mann – Whitney U-test, met behulp van Microsoft Excel, Microcal Origin en Statistica. De gegevens worden gepresenteerd als M ± m.
RESULTATEN EN DISCUSSIE
De resultaten van het onderzoek hebben aangetoond dat de effectiviteit van DCA tegen glioom С6 afhangt van het toedieningsschema en aanzienlijk toeneemt als de dieren gedurende 3 uur na toediening van dit middel onder hypoxische omstandigheden worden gehouden.
Zoals men kan zien (Tabel 1), resulteerde therapie met DCA volgens schema I in 15% vermindering van de levensduur van de dieren (LS; р < 0,05). Bij toepassing van schema II, dat van schema I verschilt doordat de behandeling later begint, werd geen effect op de LS van de proefdieren waargenomen. Langdurige toediening van DCA (schema ІІІ) resulteerde in een significant antitumor effect en verhoogde de LS van de ratten met 25,5% (p < 0,05).
Gewoonlijk is in preklinische proeven de effectiviteit van antikankermiddelen waarvan de toediening begint op de achtergrond van een reeds ontwikkelde tumor (dagen 7-10 na inoculatie van tumorcellen), lager dan wanneer dergelijke middelen eerder worden toegediend (dag 2 na inoculatie van tumorcellen). Onze gegevens laten echter een tegengesteld beeld zien: de werkzaamheid van DCA is hoger tegen een ontwikkelde tumor. Het is bekend dat een ontwikkelde tumor wordt gekenmerkt door de ontwikkeling van intratumorale hypoxie. Een toename van de LS van ratten met glioma С6 na langdurige toediening van DCA op de achtergrond van een ontwikkelde tumor zou verband kunnen houden met de ontwikkeling van intratumorale hypoxie voor zover de door DCA geïnduceerde activering van oxidatieve fosforylering onder omstandigheden van zuurstofgebrek de ATP-synthese aanzienlijk vermindert en bijgevolg kan resulteren in tumorceldood. Deze veronderstelling komt overeen met de resultaten van de studie waarin de invloed van hypoxie op de doeltreffendheid van de cytotoxische/cytostatische werking van DCA tegen glioma С6-cellen in vitro werd geanalyseerd. Zoals is aangetoond [21], werd een significante versterking van de cytotoxische werking van DCA tegen glioma С6 cellen onder hypoxische omstandigheden (drievoudige afname van DCA IC50 ten opzichte van die onder normoxische kweekomstandigheden) bepaald door een hoog niveau van door DCA geïnduceerde necrose van de cellen.
Toediening van DCA onder hypoxische omstandigheden leidde tot een aanzienlijke toename van het antikankereffect. Met name in het geval van schema I had de toediening van DCA onder hypoxische omstandigheden geen effect op de LS van de proefdieren, terwijl deze therapie bij afwezigheid van hypoxie het tumorproces stimuleerde en 15% vermindering van de LS veroorzaakte. Bij toediening van schema II onder hypoxische omstandigheden verlengde DCA de LS van ratten aanzienlijk met 22% in vergelijking met de dieren die met DCA werden behandeld onder omstandigheden van normoxie (tabel 1). Er zij echter op gewezen dat de antigliomawerking van DCA bij verschillende toedieningsschema’s zowel onder hypoxische als onder normoxische omstandigheden aanzienlijk varieerde.
| Soort therapie | Toedieningsschema van DCA | Toedieningsschema van DCA | Toedieningsschema van DCA | Verandering van LS, % |
| Aantal | Begin (dag) | Duur van de behandeling (dagen) | ||
| DCA | І | 2e | 6 | -15.0 |
| DCA | ІІ | 7e | 6 | 0 |
| DCA | ІІІ | 2e | 13 | 25.5 |
| DCA + hypoxie | І | 2e | 6 | 0 |
| DCA + hypoxie | ІІ | 7e | 6 | 22 |
Onder de mogelijke mechanismen van antikankerwerking van remmers van het energiemetabolisme van tumorcellen, waaronder DCA, zou men het vermogen van deze middelen kunnen noemen om een schadelijk effect uit te oefenen op de functionele toestand van MtETC in tumorcellen door activering van oxidatieve fosforylering, hypoxie en mogelijke defecten in het mitochondriale systeem. Daarom hebben wij de invloed van DCA op de functionele toestand van MtETC onderzocht met behulp van EPR-spectroscopie.
De grote invasiviteit van glioom bemoeilijkt een nauwkeurige scheiding van tumor en normaal weefsel. Daarom hebben wij voor de voorbereiding van EPR-monsters het weefsel van de hersenhelft met tumor gebruikt, en ter vergelijking het weefsel van de hersenhelft zonder tumor.
Als indexen van de functionele toestand van MtETC hebben wij de niveaus van NO-complexen van mitochondriaal heemijzer gebruikt (dat de schadelijke werking van ROS en stikstof op ETC weerspiegelt), en de inhoud van Fe-S centra, die rechtstreeks de functionele toestand van dit energiesysteem weerspiegelt.
Een analyse van de effecten van DCA onder omstandigheden van normoxie en hypoxie op een functionele toestand van MtETC in glioma С6-cellen toonde aan dat er geen correlatie bestaat tussen de functionaliteit van MtETC en de LS van de proefdieren (tabel 2).
Zoals blijkt uit tabel 2, had toediening van DCA in alle schema’s onder omstandigheden van normoxie en hypoxie geen effect op de niveaus van de Fe-S centra in de hersenhelft met glioom С6, zelfs niet tegen de achtergrond van een significante (meer dan 46,7%) toename van het nitrosyleringsniveau van heemeiwitten, geregistreerd na toediening van DCA onder normoxische omstandigheden. Aangenomen wordt dat een afname van de inhoud van Fe-S centra in tumorweefsel een disfunctie van MtETC kenmerkt, resulterend in tumorceldood. Ongewijzigde inhoud van Fe-S centra gaf aan dat de antikankerwerking van DCA geen verband houdt met de invloed ervan op de functionele toestand van de mitochondriën in glioma С6-cellen.
| Groep dieren | Hersenhelft met glioom | ||
| Schema І | Schema ІІ | Schema ІІІ | |
| Intensiteit van het EPR-signaal voor NO-heemcomplexen (g = 2,01; a.u.) | |||
| Controle | 100.0 ± 2.9 | 100.0 ± 6.5 | 100.0 ± 1.4 |
| DCA | 153.1 ± 21.7* | 146.7 ± 13.0* | 152.4 ± 20.8* |
| DCA + hypoxie | 87.4 ± 14.3 | 148.4 ± 9.8* | 103.6 ± 10.7 |
| Intensiteit van het EPR-signaal voor Fe-S-centra (g=1,94; a.u.) | |||
| Controle | 100.0 ± 40.4 | 100.0 ± 19.1 | 100.0 ± 28.9 |
| DCA | 97.5 ± 17.4 | 112.4 ± 23.0 | 83.3 ± 19.2 |
| DCA + hypoxie | 100.6 ± 37.3 | 115.1 ± 40.0 | 108.3 ± 16.0 |
Opmerking: *p < 0,05, verschillen zijn significant in vergelijking met de waarde voor de controle.
In tegenstelling tot de hersenweefselmonsters met glioom daalde het gehalte aan NO-heemcomplexen in normaal hersenweefsel na toediening van DCA met schema’s І en ІІ aanzienlijk met meer dan 17% onder omstandigheden van normoxie en hypoxie (tabel 3). Het niveau van de Fe-S centra in normaal hersenweefsel bleef echter onveranderd.
| Groep dieren | Hersenhelft zonder glioom | ||
| Schema І | Schema ІІ | Schema ІІІ | |
| Intensiteit van het EPR-signaal voor NO-heemcomplexen (g = 2,01; a.u.) | |||
| Controle | 100.0 ± 3.4 | 100.0 ± 4.3 | 100.0 ± 2.7 |
| DCA | 82.8 ± 3.4* | 119.6 ± 2.9* | 82.9 ± 3.6* |
| DCA + hypoxie | 72.1 ± 9.9* | 123.0 ± 9.1 | 56.8 ± 20.4* |
| Intensiteit van het EPR-signaal voor Fe-S-centra (g = 1,94; a.u.) | |||
| Controle | 100.0 ± 34.0 | 100.0 ± 5.3 | 100.0 ± 20.0 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + hypoxie | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Opmerking: *p < 0,05, verschillen zijn significant in vergelijking met de waarde voor de controle.
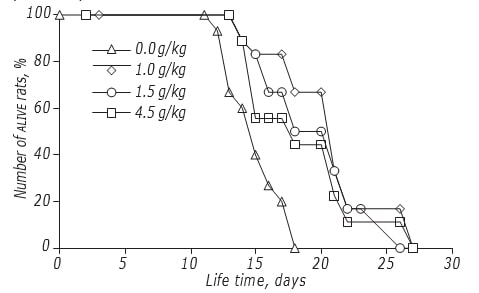
De studie van de effecten van DCA-dosering op LS van ratten werd uitgevoerd volgens het schema met de hoogste antikankerwerking. Gebleken is dat de dosis DCA een matige invloed had op de werkzaamheid tegen kanker (figuur, tabel 4). Het maximale effect werd geregistreerd als DCA werd toegediend in een dosis van 1,5 g/kg: De LS van de proefdieren namen toe met 34,5% (p < 0,05). Een verhoging van de dosis DCA tot 4,5 g/kg leidde niet tot een verdere toename van de werkzaamheid: de LS van de ratten waren significant hoger dan die van de niet met DCA behandelde controledieren, maar verschilden niet van die van de met een dosis van 1,0 g/kg behandelde dieren.
Een analyse van de effecten van DCA bij langdurige toediening in verschillende doses bracht geen significante veranderingen aan het licht in de nitrosyleringsniveaus van heemeiwitten en de inhoud van Fe-S centra in de cellen van hersenhelften met glioom (tabel 5) en normaal hersenweefsel (tabel 6).
| Totale dosis, g/kg | Schema van toediening | Begin (dag) | Duur van de therapie (dagen) | Verandering van LS, % |
|---|---|---|---|---|
| 1.0 | III | 2e | 13 | +25.5 |
| 1.5 | III | 2e | 13 | +34.5 |
.
| Groep dieren | Hersenhelft met glioom | ||
| DІ | D2 | D3 | |
| Intensiteit van het EPR-signaal voor NO-heemcomplexen (g = 2,01; a.u.) | |||
| Controle | 100.0 ± 1.4 | 100.0 ± 3.5 | 100.0 ± 3.5 |
| DCA | 152.4 ± 20.8* | 93.1 ± 13.0 | 103.0 ± 3.1 |
| Intensiteit van het EPR-signaal voor Fe-S-centra (g=1,94; a.u.) | |||
| Controle | 100.0 ± 28.9 | 100.0 ± 5.5 | 100.0 ± 5.5 |
| DCA | 83.3 ± 19.2 | 88.1 ± 12.1 | 101.2 ± 10.6 |
| DCA | 129.0 ± 37.7 | 103.2 ± 23.8 | 101.3 ± 28.1 |
| DCA + hypoxie | 109.9 ± 17.3 | 105.3 ± 21.2 | 104.0 ± 19.0 |
Opmerking: *p < 0,05, verschillen zijn significant in vergelijking met de waarde voor de controle.
.
| Groep dieren | Hersenhelft zonder glioom | ||
| DІ | D2 | D3 | |
| Intensiteit van het EPR-signaal voor NO-heemcomplexen (g = 2,01; a.u.) | |||
| Controle | 100.0 ± 2.7 | 100.0 ± 13.0 | 100.0 ± 13.0 |
| DCA | 82.9 ± 3.6* | 94.2 ± 2.7 | 79.4 ± 5.4 |
| Intensiteit van het EPR-signaal voor Fe-S-centra (g = 1,94; a.u.) | |||
| Controle | 100.0 ± 20.0 | 100.0 ± 15.5 | 100.0 ± 15.5 |
| DCA | 101.3 ± 28.1 | 118.6 ± 3.6 | 102.4 ± 6.9 |
Opmerking: *p < 0,05, verschillen zijn significant in vergelijking met de waarde voor de controle.
.
Het ontbreken van dergelijke veranderingen in combinatie met een hoge antikankerwerking van DCA (vooral bij een dosis van 1,5 g/kg) toonde eens te meer aan dat de effecten van DCA tegen glioom С6 geen verband houden met een functionele toestand van de mitochondriën van de tumorcellen.
Concluderend, de resultaten van onze studie hebben aangetoond dat de effectiviteit van DCA tegen kanker aanzienlijk afhangt van het schema van toediening, waarna het varieert van een significante afname van LS die direct correleert met stimulering van tumorgroei, tot een significant antikankereffect en een toename van LS van ratten met 25,5%. Langdurige metronomische toediening van DCA zorgt voor een betere antikankerwerking met weinig variatie tussen de doses. Ook is aangetoond dat hypoxische omstandigheden bij het houden van dieren de antikankerwerking van DCA aanzienlijk verhogen. Bovendien houdt de antikankeractiviteit van dit middel geen verband met de effecten ervan op de functionele toestand van de mitochondriën van de tumorcellen.
VERWIJZINGEN
1 Weller M, Wick W, Aldape K, et al. Glioma. Nat Rev Dis Primers 2015; 1: 15017. doi: 10.1038/nrdp.2015.17.2 Zozulya YuA, Vasil’ev IG, Glavacky AYa, et al. Hersengliomen. Huidige staat van het probleem en trends van verder onderzoek. Zozulya YuA, ed. Kyiv: ExOb, 2007. 631 p. (in het Russisch).
3 Aghi MK, Nahed BV, Sloan AE, et al. The role of surgery in the management of patients with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125: 503-30.
4 Hervey-Jumper SL, Berger MS. Technische nuances van wakkere hersentumorchirurgie en de rol van maximaal veilige resectie. J Neurosurg Sci 2015; 59: 351-60.
5 Laperriere N, Zuraw L, Cairncross G. Radiotherapy for newly diagnosed malignant glioma in adults: a systematic review. Radiother Oncol 2002; 64: 259-73.
6 Ryken TC, Parney I, Buatti J, et al. The role of radiotherapy in the management of patients with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125: 551-83.
7 Norden AD, Drappatz J, Wen PY. Nieuwe anti-angiogene therapieën voor kwaadaardige gliomen. Lancet Neurol 2008; 7: 1152-60.
8 Huang TT, Sarkaria SM, Cloughesy TF, Mischel PS. Targeted therapy for malignant glioma patients: lessons learned and the road ahead. J Neurother 2009; 6: 500-12.
9 Staedtke V, Bai RY, Laterra J. Investigational new drugs for brain cancer. Expert Opin Investig Drugs 2016; 17: 1-20.
10 Kang JH, Adamson C. Novel chemotherapeutics and other therapies for treating high-grade glioma. Expert Opin Investig Drugs 2015; 24: 1361-79.
11 Baritchii A, Jurj A, Soritau O, et al. Sensitizer drugs voor de behandeling van temozolomide-resistent glioblastoom. J BUON 2016; 21: 199-207.
12 Mallick S, Gandhi AK, Rath GK. Therapeutische aanpak naast conventionele temozolomide voor nieuw gediagnosticeerd glioblastoom: Review of the present evidence and future direction. Indian J Med Paediatr Oncol 2015; 36: 229-37.
13 Gatenby RA, Gillies RJ. Waarom hebben kankers een hoge aerobe glycolyse? Nat Rev Cancer 2004; 4: 891-9.
14 Kim JW, Dang CV. Multifaceted roles of glycolytic enzymes. Trends Biochem Sci 2005; 30: 142-50.
15 Jin S, DiPaola RS, Mathew R, White E. Metabolic catastrophe as a means to cancer cell death. J Cell Sci 2007; 3: 379-83.
16 Seyfried TN, Kiebish MA, Marsh J. Metabolic management of brain cancer. Biochim Biophys Acta 2011; 6: 577-94.
17 Decollogne S, Dilda PJ, Hau E, et al. Dual-targeting of aberrant glucose metabolism in glioblastoma. J Exp Clin Cancer Res 2015; 34: 14.
18 Kankotia S, Stacpoole PW. Dichlooracetaat en kanker: nieuw thuis voor een weesgeneesmiddel? Biochim Biophys Acta 2014; 1846: 617-29.
19 Stacpoole PW. The dichloroacetate dilemma: environmental hazard versus therapeutic goldmine – both or neither? Environ Health Perspect 2011; 119: 155-8.
20 Michelakis ED, Webster L, Mackey JR. Dichlooracetaat (DCA) als een potentiële metabool-gerichte therapie voor kanker. Br J Cancer 2008; 99: 989-94.
21 Kolesnik DL, Pyaskovskaya ON, Boichuk IV, Solyanik GI. Hypoxie verhoogt de antitumoractiviteit van dichlooracetaat. Exp Oncol 2014; 36: 231-5.
22 James MO, Stacpoole PW. Farmacogenetische overwegingen bij de dosering van dichlooracetaat. Pharmacogenomics 2016; doi:10.2217/pgs-2015-0012.
23 Dunbar EM, Coats BS, Shroads AL, et al. Phase 1 trial of dichloroacetate (DCA) in adults with recurrent malignant brain tumors. Invest New Drugs 2014; 32: 452-64.