Cecilie Abildgaard1, Christina Dahl1, Astrid L Basse2, Tao Ma2 en Per Guldberg1*
1 Danish Cancer Society Research Center, Kopenhagen, Denemarken
2 Afdeling Biologie, Universiteit van Kopenhagen, Kopenhagen, Denemarken.
Correspondentie: [email protected]
Ontvangen: 14 september 2020
Geaccepteerd: 4 december 2020
Gepubliceerd: 9 december 2020
Abstract
Achtergrond: Vooruitgang in melanoom behandeling door gerichte remming van oncogene BRAF zijn beperkt vanwege de ontwikkeling van verworven resistentie. De betrokkenheid van BRAFV600E in metabole herprogrammering van melanoom cellen biedt een reden voor co-targeting metabolisme als een therapeutische aanpak.
Methoden: Wij onderzochten de effecten van dichlooracetaat (DCA), een remmer van pyruvaat dehydrogenase kinase, op de groei en metabole activiteit van humane melanoom cellijnen. Het gecombineerde effect van DCA en de BRAF-remmer vemurafenib werd onderzocht in BRAFV600E-gemuteerde melanoomcellijnen. Vemurafenib-resistente cellijnen werden in vitro opgezet en hun gevoeligheid voor DCA werd getest.
Resultaten: DCA induceerde een vermindering van de glycolytische activiteit en de intracellulaire ATP-niveaus, en remde de celgroei. Gelijktijdige behandeling van BRAFV600E-mutante melanoomcellen met DCA en vemurafenib leidde tot een grotere verlaging van de intracellulaire ATP-niveaus en de celgroei dan een van beide verbindingen alleen. Bovendien behielden melanoomcellen met in vitro verworven resistentie tegen vemurafenib hun gevoeligheid voor DCA.
Conclusies: Deze resultaten suggereren dat DCA het effect van vemurafenib versterkt door een coöperatieve verzwakking van de energieproductie. Bovendien zou het aantonen van een behouden gevoeligheid voor DCA in melanoomcellen met verworven resistentie tegen vemurafenib implicaties kunnen hebben voor de behandeling van melanoom.
Trefwoorden: Dichlooracetaat, Melanoom, BRAF, Bio-energetica, Metabolisme, ATP
Afkortingen: (Acetyl-CoA): Acetyl co-enzym A, (AMPK): AMP activated protein kinase, ( DCA): Dichlooracetaat, ( ECAR): Extracellulaire verzuringssnelheid, (HEMn-LP): menselijke epidermale melanocyten, (IC50): halfmaximale remmende concentratie, (LKB1): Lever kinase B1, ( MITF): Microphthalmia-geassocieerde transcriptiefactor, ( OCR): Zuurstofverbruikssnelheid, ( PDH): Pyruvaat dehydrogenase, ( PDK): Pyruvaat dehydrogenase kinase
© 2014 Abildgaard et al.; licentiehouder BioMed Central Ltd.
Achtergrond
Een kenmerk van kanker is de herprogrammering van het cellulaire metabolisme naar aerobe glycolyse. Dit metabole patroon wordt gekenmerkt door een verhoogde glucose-opname en sterk verhoogde glycolytische activiteit met fermentatie van glucose tot melkzuur in plaats van volledige aerobe afbraak in de mitochondriën. Aërobe glycolyse, ook wel het Warburg-effect genoemd, lijkt op het anaërobe metabolisme van normale cellen, maar treedt op in de context van een adequate zuurstoftoevoer [1]. De herprogrammering van het metabolisme in kankercellen is een zeer complex en heterogeen proces, dat wordt aangedreven door een grote verscheidenheid van genetische en niet-genetische strategieën om de energiebeperking te overwinnen [2]-[4].
Het BRAF V600E oncogen, aanwezig in meer dan 50% van de melanomen [5], is rechtstreeks betrokken bij de herprogrammering van het celmetabolisme. De constitutieve activiteit van mutant BRAF vermindert de expressie van oxidatieve enzymen en het aantal mitochondriën, terwijl de expressie van glycolytische enzymen en de melkzuurproductie toenemen [6],[7]. Verder werd een moleculair verband herkend tussen de RAS-RAF-MEK-ERK-MAPK pathway en het energetische-stress check-point gemedieerd door de lever kinase B1 (LKB1)-AMP geactiveerde proteïne kinase (AMPK) pathway, wat een rol van BRAFV600E in het mediëren van weerstand tegen energetische stress suggereert [8],[9]. BRAF beïnvloedt het oxidatieve metabolisme via microphthalmia-associated transcription factor (MITF)-afhankelijke controle van de mitochondriale master regulator PGC1α [7]. Eerdere studies hebben aangetoond dat melanomen die PGC1α tot expressie brengen een meer oxidatief fenotype hebben dan PGC1α-negatieve melanomen [4],[7]. Bovendien werd aangetoond dat BRAFV600E oncogeen-geïnduceerde senescentie medieert via metabole regulering. Dit mechanisme omvat een verhoging van de pyruvaat dehydrogenase (PDH) activiteit door de onderdrukking van pyruvaat dehydrogenase kinase (PDK) [10]. PDH regelt de koppeling tussen glycolyse en mitochondriale respiratie door de instroom van pyruvaat in de mitochondriën te vergemakkelijken, waardoor volledige benutting van glucose wordt bevorderd. De PDK-PDH-as is vaak ontregeld bij kanker, waar PDK-overexpressie de koppeling tussen de twee energiesystemen vermindert en daardoor bijdraagt tot het Warburg-effect [11],[12]. Op basis van deze bevindingen werd gerichte remming van PDK voorgesteld als therapeutische optie voor melanoom, met een mogelijk synergetisch effect van chemische BRAFV600E-remmers, zoals vemurafenib [10],[13].
Dichlooracetaat (DCA) is een remmer van de vier isovormen van PDK en werd eerder gebruikt voor de behandeling van melkziekte [14],[15], met een lage toxiciteit bij effectieve doses [16],[17]. Verschillende studies hebben aangetoond dat DCA het Warburg-effect in kankercellen omkeert en hun groei en overleving negatief beïnvloedt [13],[18]-[21]. Dit effect werd toegeschreven aan een normalisatie van de mitochondriale membraanpotentiaal vanuit de hypergepolariseerde toestand die kankercellen kenmerkt. De veranderingen in membraanpotentiaal resulteren in de heropening van spanningsgevoelige anionkanalen en bleken een hergevoeligheid voor apoptose te introduceren, als gevolg van een herwonnen vermogen om pro-apoptotische mediatoren af te geven [18]. Hier hebben we het effect van DCA op melanoomcellen onderzocht. Specifiek analyseerden wij de cellulaire reacties met betrekking tot metabolisme, bio-energetica, groei, proliferatie en celdood in melanoomcellijnen, primaire menselijke melanocyten en BRAFV600E-mutante melanoomcellen met verworven resistentie tegen vemurafenib.
Methoden
De chemische verbindingen
DCA (natriumdichlooracetaat) en 2-Deoxy-D-glucose (2-DG) werden gekocht bij Sigma-Aldrich en opgelost in dH2Otot een werkvoorraadconcentratie van 1 M. Vemurafenib (PLX4032) werd gekocht bij Selleck Chemicals en opgelost in DMSO tot een werkvoorraadconcentratie van 0,05 M.
Celcultuur
De melanoomcellijnen ED-007, ED-013, ED-024, ED-027, ED-029, ED-034, ED-050, ED-070, ED-071, ED-117, ED-140, ED-179 en ED-196 werden verkregen uit de European Searchable Tumor Line Database (ESTDAB, ED) [22]. De melanoomcellijn SK-MEL-28 werd gekocht van ATCC. Primaire menselijke epidermale melanocyten (neonataal) van licht gepigmenteerd weefsel (HEMn-LP) werden gekocht bij Invitrogen. De melanoom cellijnen werden gekweekt bij 37°C onder 5%CO2 in RPMI-1640 medium aangevuld met 10% foetaal runderserum en 1% penicilline/streptomycine. HEMn-LP cellen werden onder dezelfde omstandigheden gekweekt in 254CF medium aangevuld met 1% human melanocyte growth supplement (HMGS-2) en 12-O-tetradecanoyl-forbol-13-acetaat(TPA; 10 ng/ml). Alle media en supplementen werden gekocht van Invitrogen.
Metabole analyse
Metabole karakterisering werd uitgevoerd op melanoomcellijnen en primaire menselijke melanocyten met behulp van een Seahorse XF96 extracellulaire fluxanalysator (Seahorse Bioscience, Billerica, MA), die real-time metingen verricht van de extracellulaire verzuringssnelheid (ECAR) en het zuurstofverbruik (OCR). Er werd een test ontworpen om de capaciteit van de mitochondriale en glycolytische energiesystemen te bestuderen. De ECAR en OCR werden gemeten onder basale omstandigheden en tijdens de opeenvolgende toevoeging van vijf metabolische modulatoren: De ATP-synthaseremmer oligomycine (1 μM); de mitochondriale membraanpermeabilisator carbonylcyanide-4-(trifluormethoxy)fenylhydrazone (FCCP) (1 μM); de remmers van de mitochondriale ademhaling rotenon (1 μM) en antimycine A (1 μM); en de glycolytische remmer 2-DG (100 mM). De XF Cell Mito Stress Kit, die oligomycine, FCCP, rotenon en antimycine A bevat, werd gekocht bij Seahorse Bioscience.
ATP-metingen
Intracellulaire ATP-niveaus werden gemeten met het ATPlite, 1 step Luminescence Assay System (Perkin Elmer), een methode gebaseerd op de reactie van ATP met luciferase en D-luciferine. De cellen werden in triplo gezaaid met 10.000 cellen per well en gedurende 2 of 24 uur behandeld met de aangegeven verbindingen en voertuigcontrole. Luminescentie werd gemeten met Spectra Max Gemini EM luminescentie microplaat lezer (Molecular Devices) en genormaliseerd naar achtergrond niveaus.
Crystal violet assay
Eencrystal violet assay werd toegepast om het effect van de bestudeerde verbindingen op de celgroei te evalueren. Cellen werden in duplo uitgezaaid bij een geschikte dichtheid en vervolgens behandeld met DCA, vemurafenib, de twee verbindingen gecombineerd en voertuigcontrole. Het medium en de behandelde verbindingen werden om de 48 uur vervangen. Het experiment werd driemaal onafhankelijk herhaald. Om het experiment te beëindigen werden medium en niet-aangesloten cellen verwijderd, en de resterende cellen werden gewassen in PBS en gedurende 15 minuten gefixeerd met glutaaraldehyde. De gefixeerde cellen werden gedurende 1 uur geïncubeerd met kristalvioletoplossing (0,1% kristalviolet, 20% CH3OH). De hoeveelheid kleurstof die door de monolaag werd opgenomen, evenredig met het aantal levensvatbare cellen dat aan de bodem van het putje was gehecht, werd gekwantificeerd door de kleur te extraheren met 10% azijnzuur en de absorptie te meten bij een golflengte van 595 nm. De lineaire correlatie tussen de absorptie en het aantal cellen werd gecontroleerd door een standaardcurve uit te voeren. De relatieve celgroei werd bepaald door normalisatie ten opzichte van de onbehandelde controles na aftrek van de achtergrond (zonder cellen).
Celproliferatietest
Melanoomcellen werden in triplo gezaaid met 500-1.000 cellen per well en gedurende 96 uur behandeld met DCA in de gegeven concentraties en voertuigcontrole. Proliferatie werd vervolgens gemeten door BrdU te detecteren na 12 uur incorporatie in cellulair DNA. De procedure werd uitgevoerd volgens het protocol bij de BrdU Cell Proliferation Assay Kit (Cell Signaling Technology®).
Annexin V-FITC apoptosedetectie
Apoptosedetectie werd uitgevoerd met een Annexin V-FITC apoptosedetectiekit (BD Bioscience), volgens het verstrekte protocol. De cellen werden geoogst en tweemaal gewassen in koude PBS. De cellen werden vervolgens overgebracht naar een andere buis, gesponnen en geresuspendeerd in bindingsbuffer. Van de resuspensie werden 5 ×105 cellen overgebracht naar FACS-buizen en gekleurd met Annexine V-FITC en propidiumjodide (PI). Na 30 minuten incubatie werd flowcytometrie uitgevoerd op een Cytomics FC 500 MPL-instrument (Beckman Coulter). Onbevlekte cellen werden opgenomen als controle.
Inductie van in vitro verworven vemurafenibresistentie
Verworven resistentie tegen vemurafenib werd geïnduceerd in zeven culturen afkomstig van vier BRAFV600E-mutante, vemurafenib-gevoelige melanoomcellijnen (ED-013, ED-071, ED-196 en SK-MEL-28). De cellen werden gekweekt in toenemende concentraties vemurafenib totdat zij gestaag groeiden in een concentratie boven de IC50, en werden vervolgens in medium met vemurafenib gehouden.
Pyrosequencing
Pyrosequencing van mutatiehotspots in BRAF en NRAS werd uitgevoerd op een PyroMark Q24-platform (Qiagen), met gebruikmaking van PyroMark Gold Q24-reagentia (Qiagen). De primer-sequenties staan vermeld in Aanvullend bestand 1: Tabel S1.
| Doelgebied | Primernaam | Primer-sequentie (5′-3′) |
| BRAF V600E | BRAF-F1 | [Btn]-TTCATGAAGACCTCACAGTAAAAA |
| BRAF-R1 | GGCCAAAAATTTAATCAGTGGAA | |
| BRAF-S1 | CCACTCCATCGAGATTT | |
| NRAS Q61K,L,R | NRAS-F1 | [Btn]-ACCCCCAGGATTCTTACAGAAA |
| NRAS-R1 | CGCAAATGACTTGCTATTATTGA | |
| NRAS-S1 | TCATGGCACTGTACTCTCTT |
PGC1α expressieanalyse
Totaal RNA werd geïsoleerd met de RNeasy mini kit (Qiagen) en cDNA werd gesynthetiseerd met de SuperScript™ III Reverse Transcriptase kit (Invitrogen). Oligo dT24 en willekeurige hexameren werden gebruikt als primers voor de cDNA-synthese. De genexpressie van PGC1α werd bepaald met kwantitatieve real-time PCR op Roche LightCycler 2.0 met behulp van LigthCycler FastStart DNA MasterPLUS SYBR Green I kit (Roche). De primer-sequenties waren: PPARGC1A_2241F: 5′-GCTGTACTTTGTGGACGCA-3′ en PPARGC1A_2306R: 5′-GGAAGCAGGGTCAAAGTCAT-3′. De expressie werd genormaliseerd naar de expressie van het huishoudgen RPLP0. De primer-sequenties waren: RPLP0_433F: 5′-ACTAAAATCTCCAGGCACC-3′ en RPLP0_547R: 5′-ATGACCAGCCCAAAGGAGAA-3′. De twee melanoomcellijnen ED-050 en SK-MEL-28 werden opgenomen als respectievelijk positieve en negatieve controles [4].
Statistische analyse
Verschillen tussen onafhankelijke gegevensverzamelingen werden bepaald met de Student’s t-test. One-way matched-samples ANOVA werd gebruikt voor statistische analyse van variantie tussen verschillende behandelingen (voertuigcontrole, DCA, vemurafenib en de combinatie van DCA en vemurafenib). Tukey’s honest significance difference (HSD) multi-vergelijkingstest werd gebruikt om de statistische significantie te bepalen. De correlatiecoëfficiënt van Pearson werd gebruikt om de correlatie tussen de gevoeligheid van DCA en metabolische parameters te bepalen. Een waarde van 1 gaf een positieve correlatie aan, 0 geen correlatie, en -1 een negatieve correlatie.
De in deze studie uitgevoerde experimenten betroffen uitsluitend in de handel verkrijgbare cellijnen en vereisten derhalve geen goedkeuring van een ethische commissie.
Resultaten
Metabole karakterisering van melanoomcellijnen en primaire melanocyten
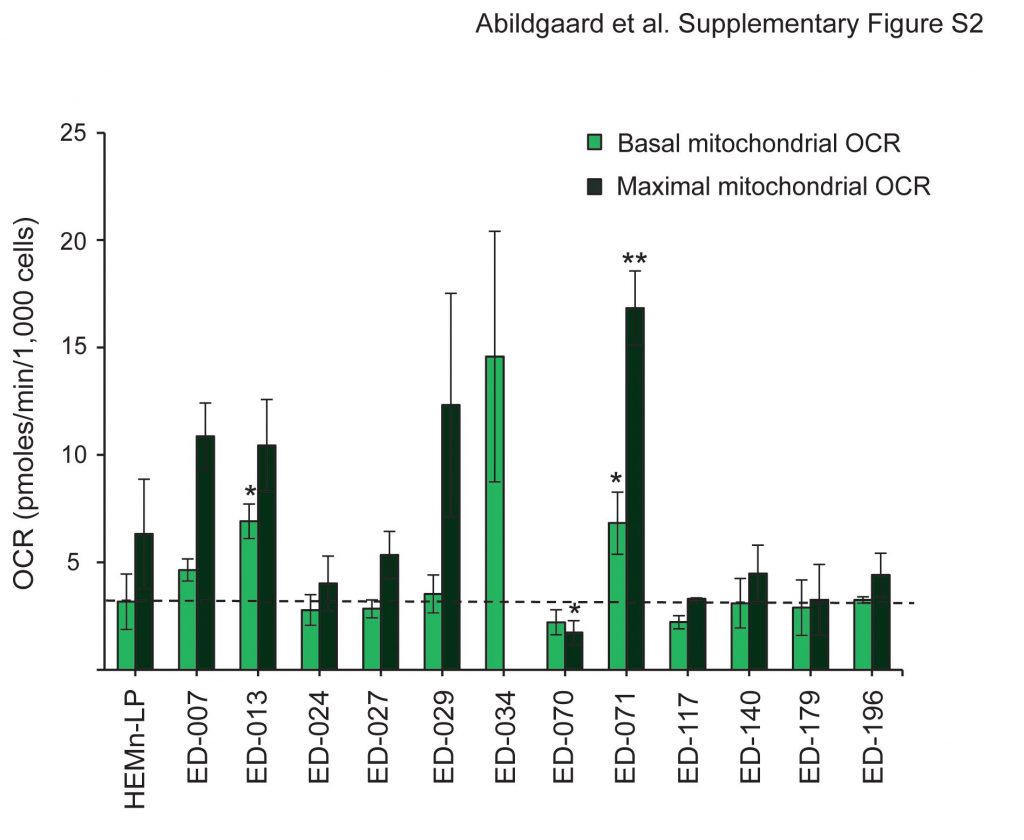
Metabole profilering van 12 melanoomcellijnen en primaire menselijke melanocyten (HEMn-LP) werd uitgevoerd met de Seahorse FX96 analyzer. Dit instrument verricht real-time metingen van de extracellulaire verzuringssnelheid (ECAR) en het zuurstofverbruik (OCR), die indirecte metingen zijn van respectievelijk glycolytische activiteit en mitochondriale ademhaling [23]. De metingen werden uitgevoerd onder basale omstandigheden en tijdens de opeenvolgende toevoeging van vijf metabolische modulatoren (figuur 1A). Vergeleken met normale melanocyten vertoonden 11 van de 12 cellijnen hogere glycolytische snelheden, zoals blijkt uit hogere basale glycolytische ECAR’s, waaruit blijkt dat het Warburg-effect een algemeen kenmerk van melanoomcellen is. Bovendien vertoonden negen van de cellijnen een hogere maximale glycolytische capaciteit in vergelijking met melanocyten (figuur 1B). Op enkele uitzonderingen na waren er geen significante verschillen in basale en maximale mitochondriale ademhaling tussen melanocyten en melanoomcellen (Additioneel bestand 2: figuur S2). Volgens de OCR-to-ECAR-verhoudingen (OCR/ECAR; figuur 1C) was de relatieve bijdrage van de mitochondriale ademhaling aan de ATP-productie in 10 van de melanoomcellijnen lager dan in melanocyten.
.
.
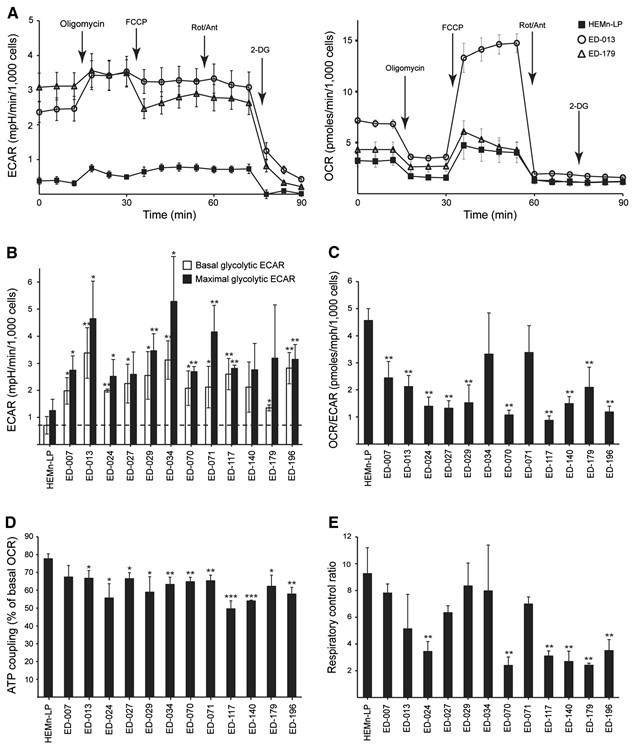
Mitochondriale efficiëntie (ATP koppeling) en prestatie (respiratoire controle ratio) werden geschat op basis van metingen van twee parameters voor mitochondriale functie; protonlek en de maximale mitochondriale OCR [24]. Het protonlek werd bepaald na toevoeging van de ATP-synthaseremmer oligomycine, en de maximale mitochondriale OCR werd bepaald na toevoeging van de mitochondriale ontkoppelaar FCCP. Uit deze analyse bleek een significant lagere ATP-koppeling in melanoomcellen in vergelijking met melanocyten (p < 0,05; ED-007: p = 0,07), hetgeen wijst op een groter protonlek en een minder efficiënte productie van ATP in verhouding tot het niveau van het zuurstofverbruik (figuur 1D). Bovendien hadden zes van de melanoomcellijnen ook significant lagere respiratoire controleverhoudingen dan melanocyten (p?<?0.01, figuur 1E), wat wijst op een slechte mitochondriale prestatie.
DCA verschuift het metabolisme naar mitochondriale ademhaling en vermindert de ATP-niveaus
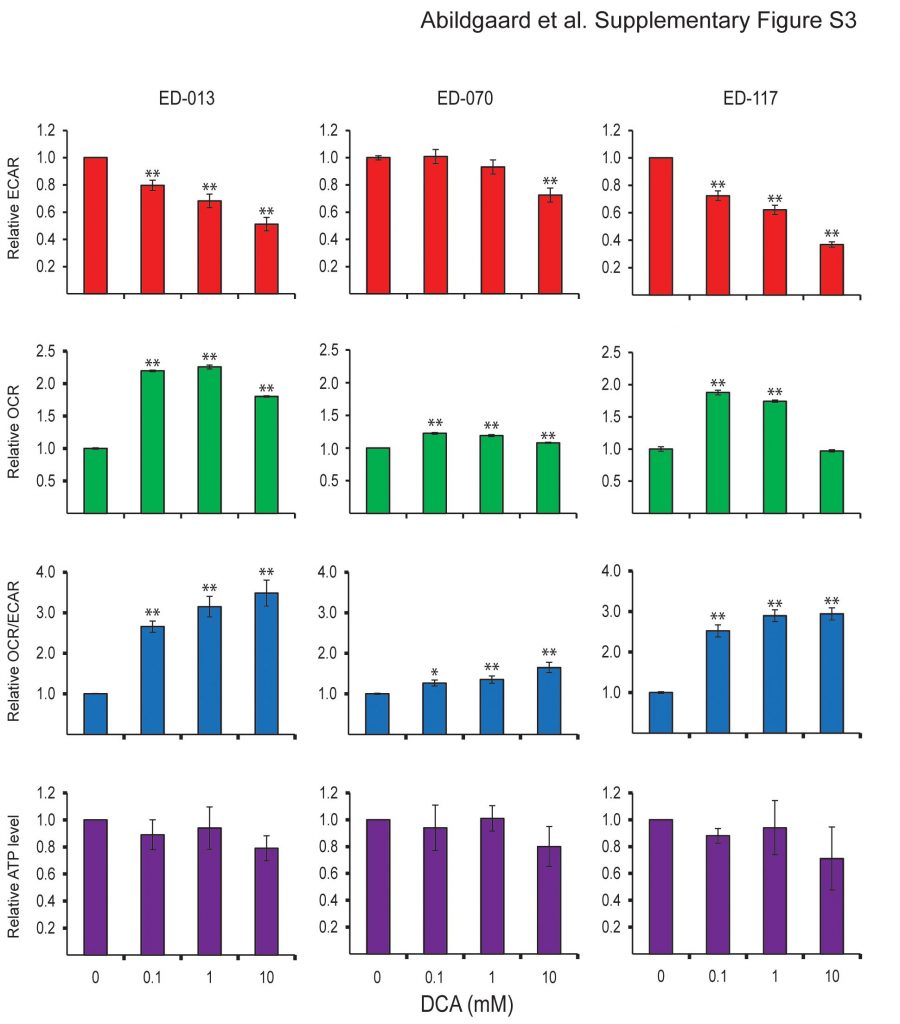
Om het effect van DCA op het metabolisme van melanoomcellen te bepalen, analyseerden we het panel van 12 cellijnen met de Seahorse XF96 analyzer. Na behandeling met 10 mM DCA gedurende 2 uur reageerden alle cellijnen met een verlaging van ECAR en een verhoging van OCR (figuur 2A), wat wijst op een verschuiving naar mitochondriale ademhaling. De ECAR-respons was vergelijkbaar tussen de cellijnen, terwijl er een grote variatie was in de OCR-respons (figuur 2A). De relatieve veranderingen in ECAR, OCR en OCR/ECAR in reactie op DCA waren concentratie-afhankelijk (Additional file 3: Figuur S3).
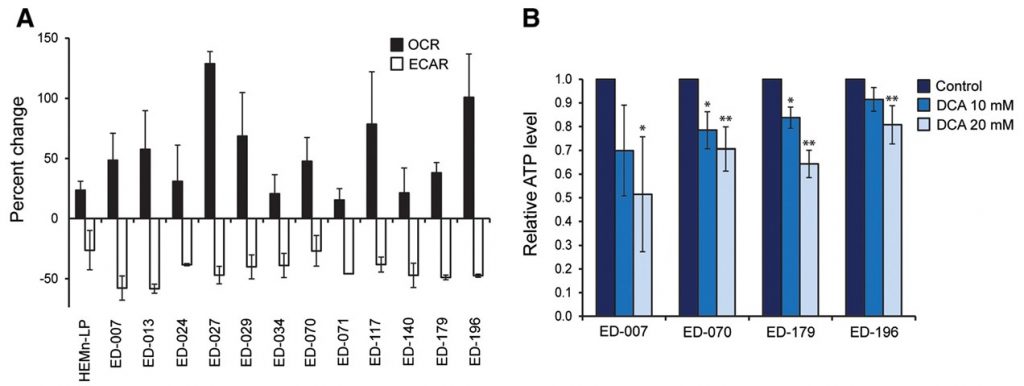
Om te bepalen of de verschuiving in het metabolisme de energetische homeostase verstoorde, maten we de ATP-niveaus in melanoomcellen na behandeling met 0,1, 1 of 10 mM DCA gedurende 2 uur. Alle drie de geteste cellijnen waren in staat de ATP-niveaus op peil te houden na behandeling met lage concentraties DCA (0,1-1 mM), terwijl een trend naar verminderde ATP werd waargenomen in kweken die werden behandeld met 10 mM DCA (Additional file 3: Figuur S3). Wanneer de cellen gedurende 24 uur met DCA (10 of 20 mM) werden behandeld, werd een significante concentratie-afhankelijke afname van ATP waargenomen (figuur 2B), hetgeen wijst op een geleidelijke uitputting van het metabolisch systeem.
DCA vermindert de groei van melanoomcellen onafhankelijk van de genetische driver en PGC1α-expressiestatus
Om een mogelijke klinische toepassing van DCA voor de behandeling van melanoom te beoordelen, bestudeerden we de effecten ervan op verschillende parameters voor cellulaire groei. Het hele panel van cellijnen en primaire melanocyten werd gedurende 96 uur behandeld met een reeks DCA-concentraties (0,5-100 mM) (zie figuur 3A voor representatieve resultaten). Alle cellijnen vertoonden een concentratieafhankelijke vermindering van de groei, met IC50-waarden tussen 9-38 mM (tabel 1), vergeleken met een IC50-waarde van 70 mM voor primaire melanocyten (p < 0,001). Er was geen correlatie tussen de respons op DCA en de BRAF/NRAS-mutatiestatus of de expressieniveaus van PGC1α (tabel 1).
| Cellijn | DCA IC50(mM)4 | BRAF/NRAS-status1 | PGC1α expressie2,4 |
|---|---|---|---|
| ED-070 | 8.9 ± 0.6*** | NRASQ61L | 1.0 ± 0.2 |
| ED-007 | 12.2 ± 2.2*** | WT3 | 0.6 ± 0.0 |
| ED-071 | 12.3 ± 3.6*** | BRAFV600E | 0.0 ± 0.0 |
| ED-034 | 12.7 ± 1.7*** | BRAFL597S | 1.0 ± 0.2 |
| ED-013 | 14.4 ± 2.0*** | BRAFV600E | 1.9 ± 0.3 |
| ED-027 | 17.7 ± 2.1*** | BRAFV600E | 0.5 ± 0.1 |
| SK-MEL-28 | 20.0 ± 4.5*** | BRAFV600E | 0.0 ± 0.0 |
| ED-179 | 20.6 ± 1.8*** | NRASQ61R | 0.3 ± 0.0 |
| ED-024 | 21.9 ± 1.6*** | NRASQ61L | 0.0 ± 0.0 |
| ED-140 | 23.9 ± 2.0*** | WT | 0.4 ± 0.1 |
| ED-050 | 24.1 ± 3.1*** | WT | 2.7 ± 0.5 |
| ED-029 | 29.7 ± 5.1*** | BRAFV600K | 1.3 ± 0.2 |
| ED-196 | 35.8 ± 3.2*** | BRAFV600E | 1.5 ± 0.5 |
| ED-117 | 37.6 ± 2.2*** | BRAFV600E | 1.2 ± 0.1 |
| HEMn-LP | 69.1 ± 6.4 | WT | 1 |
| ED-013-R1 | 12.6 ± 3.0*** | BRAFV600E | |
| ED-013-R2 | 13.6 ± 2.4*** | BRAFV600E | |
| ED-071-R1 | 12.2 ± 0.9*** | BRAFV600E | |
| ED-071-R2 | 13.8 ± 3.7*** | BRAFV600E | |
| SK-MEL-28-R1 | 23.1 ± 4.6*** | BRAFV600E | |
| SK-MEL-28-R2 | 26.2 ± 8.0** | BRAFV600E |
**p < 0,01; ***p < 0,001 in vergelijking met HEMn-LP.
1BRAF/NRASstatus zijn in overeenstemming met gepubliceerde resultaten[25].
2Relativeto PGC1α expression in normal melanocytes.
3wildtype.
4DCAIC50 waarden en PGC1α expressie zijn de gemiddelden van drie onafhankelijke metingen ± standaarddeviatie.
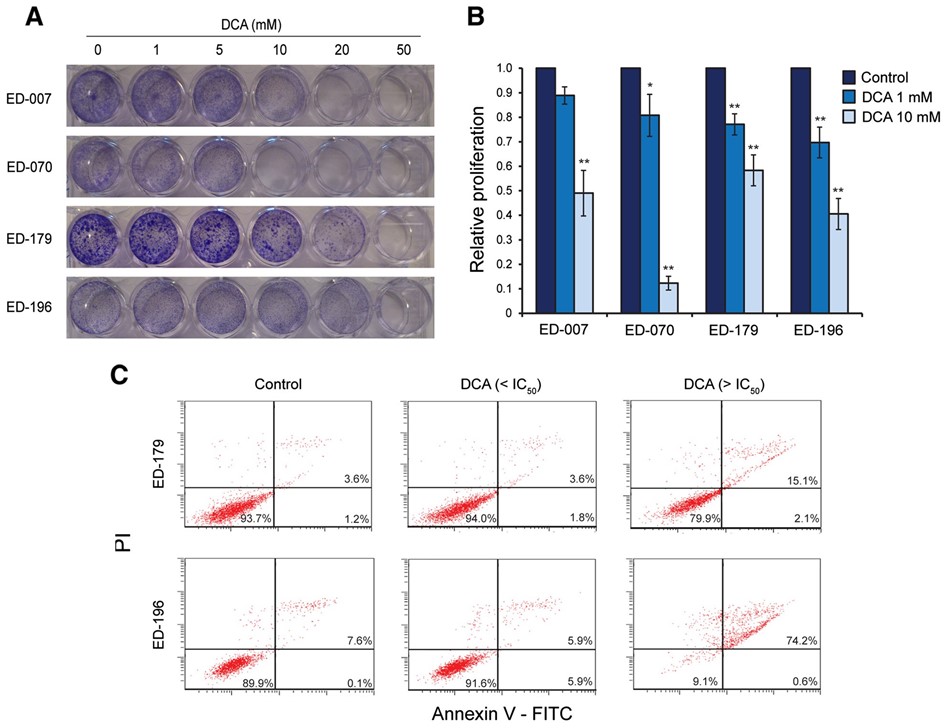
Om de effecten van DCA op de celgroei verder te karakteriseren, hebben we de opname van BrdU gemeten in cellen die gedurende 96 uur met 1 of 10 mM DCA waren behandeld. Zoals getoond in figuur 3B reageerden alle vier geteste cellijnen met verminderde proliferatie, in het bereik van 11-30% bij 1 mM en van 42-88% bij 10 mM. We hebben ook de apoptotische respons op DCA gemeten door flow-cytometrische analyse van de annexine V-niveaus. Bij concentraties DCA onder de IC50 nam het aantal annexine V-positieve cellen na 96 uur en tot 3 weken niet toe. Daarentegen verhoogde behandeling met concentraties boven de IC50 het aantal cellen dat positief was voor zowel annexine V als PI, hetgeen wijst op inductie van celdood reeds na 96 uur (figuur 3C).
DCA versterkt het effect van vemurafenib op BRAFV600E-mutante melanoomcellen
Om te onderzoeken of DCA kan worden gebruikt om de efficiëntie van chemische BRAF-remmers voor de behandeling van melanoom te verbeteren, testten wij verschillende combinaties van DCA en vemurafenib op celgroei. Behandeling van vier BRAFV600E-mutante cellijnen met vemurafenib (0,05-5 μM) gedurende 96 uur toonde IC50-waarden van 0,5 tot 4,5 μM, consistent met gegevens uit eerdere studies [26]. Bij blootstelling van primaire melanocyten aan dezelfde behandeling bereikten we de IC50-waarde voor deze cellen niet, zelfs niet met de hoogste geteste concentratie (5 μM), wat de specificiteit van de verbinding bevestigt.
Wanneer cellen werden behandeld met 1 mM DCA in combinatie met lage concentraties vemurafenib (<IC50), was de vermindering van de celgroei meer uitgesproken dan met DCA of vemurafenib alleen (p < 0,05; figuur 4A, B). DCA versterkte het effect van vemurafenib in ED-117-cellen niet, wat kan worden toegeschreven aan de inherente weerstand van deze cellen tegen DCA (IC50 38 mM; tabel 1). Bij IC50-concentraties veroorzaakten zowel DCA als vemurafenib een verlaging van de intracellulaire ATP-niveaus bij gebruik als afzonderlijk middel en een verdere verlaging bij gecombineerd gebruik, hoewel niet statistisch significant voor alle cellijnen (figuur 4C).
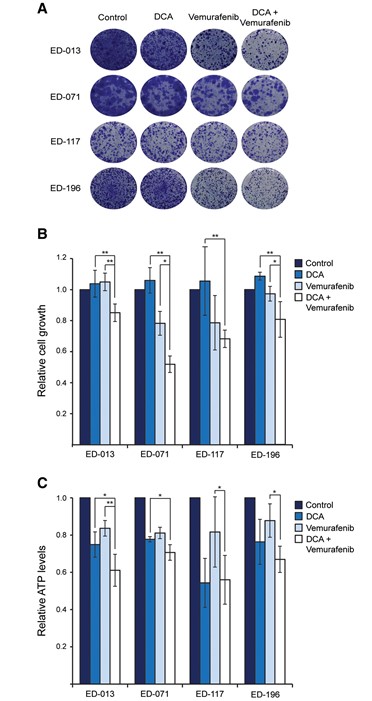
Vemurafenib-resistente cellijnen hebben een verbeterde oxidatieve capaciteit en behouden gevoeligheid voor DCA
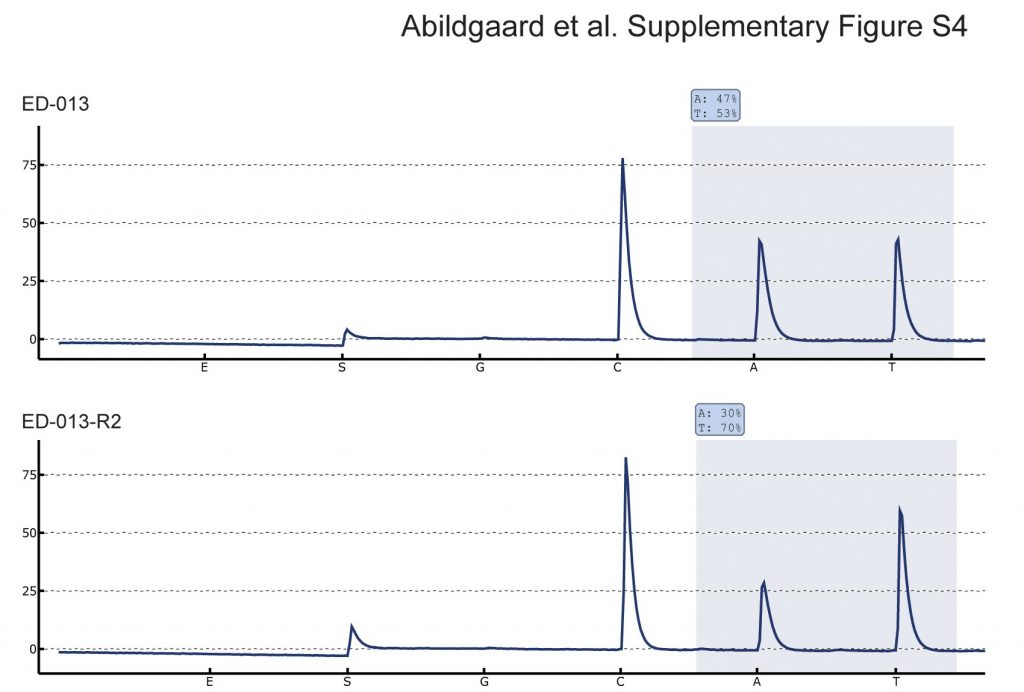
Zeven culturen van vemurafenib-resistente cellen werden gegenereerd uit vier BRAFV600E-mutante cellijnen door de cellen bloot te stellen aan toenemende concentraties vemurafenib. Cellen werden resistent geacht wanneer zij voortdurend konden worden vermeerderd bij een concentratie vemurafenib boven de IC50. Uit alle zeven culturen werd DNA geïsoleerd en getest op BRAF-kopiegetalwinst en secundaire NRAS-mutaties, twee goed beschreven mechanismen van verworven resistentie tegen vemurafenib [27],[28]. Pyrosequencing toonde een toename van de verhouding BRAF V600E tot BRAF WT in een van de resistente cellijnen (ED-013-R2) in vergelijking met de ouderlijke cellijn (Additional file 4: Figuur S4). In de overige resistente cellijnen werden geen BRAF- of NRAS-veranderingen gevonden.
Metabolische karakterisering van twee van de resistente cellijnen (ED-013-R1 en ED-196-R) met behulp van de Seahorse XF96 analyzer toonde aan dat beide resistente cellijnen een getransformeerd metabolisch profiel hadden met een significant verhoogde maximale ademhalingscapaciteit (figuur 5A), maar geen veranderingen in de basale ademhalings OCR, ATP-koppeling of niet-mitochondriale OCR. Interessant genoeg hadden de vemurafenib-resistente cellijnen bij het testen op gevoeligheid voor DCA allemaal IC50-waarden die vergelijkbaar waren met die van de oudercellijnen (tabel 1).
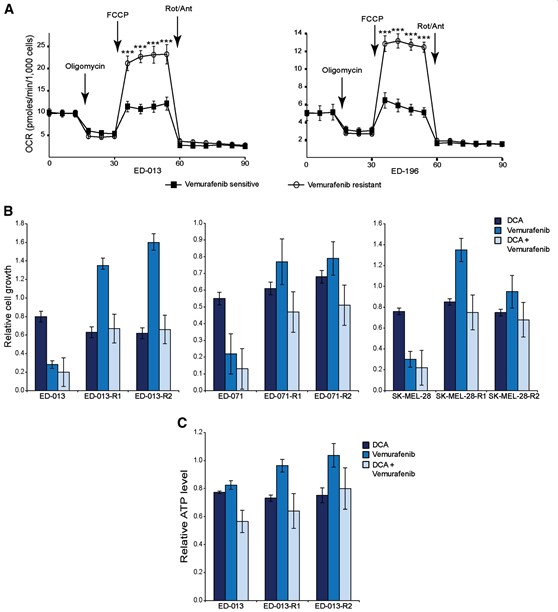
Figuur 5Billustreert de gevoeligheid van vemurafenib-resistente cellijnen voor DCA en vemurafenib, als afzonderlijke middelen of in combinatie, vergeleken met de ouderlijke cellijnen. De groei van de resistente cellijnen was na 96 uur licht afgenomen, niet beïnvloed of zelfs toegenomen in aanwezigheid van vemurafenib, terwijl de gevoeligheid voor DCA vergelijkbaar was met die van de oudercellen, zowel in aanwezigheid als in afwezigheid van vemurafenib (figuur 5B). Soortgelijke resultaten werden verkregen bij het meten van veranderingen in ATP-niveaus na behandeling met dezelfde geneesmiddelen gedurende 24 uur (figuur 5C). Al deze gegevens samen tonen aan dat de vemurafenib-resistente melanoomcellen gevoelig bleven voor DCA, ondanks de verandering in hun metabolisch profiel.
Bespreking
Metabolische gerichte therapie voor kanker is voornamelijk gericht op de energievoorziening door remming van de glycolyse. De erkenning dat mitochondriën actief kunnen bijdragen aan de progressie van melanoom heeft echter de aandacht voor het oxidatieve metabolisme als potentieel therapeutisch doelwit vergroot [10],[13],[29]. DCA bevordert PDK-afhankelijke activering van PDH, waardoor de lactaatproductie wordt omgekeerd ten gunste van de instroom van pyruvaat in de mitochondriën [15],[18]. Via dit mechanisme verbetert DCA de koppeling tussen glycolyse en mitochondriale ademhaling, wat een grotere impact zal hebben op cellen met een gebrekkige koppeling, zoals kankercellen [18]. Alle in onze studie onderzochte melanoomcellijnen reageerden op DCA met een verminderde lactaatproductie en een verhoogde OCR. Deze verschuiving naar mitochondriale ademhaling zou naar verwachting het substraatgebruik optimaliseren en leiden tot een efficiëntere energieopbrengst, maar leidde in plaats daarvan tot een aanzienlijke daling van de ATP-niveaus ondanks een onaangetaste of zelfs toegenomen mitochondriale ATP-koppeling. De waargenomen vermindering van ECAR in reactie op DCA suggereert dat remming van de glycolyse een belangrijke bijdrage zou kunnen leveren aan het energietekort. Een glycolyse-remmend mechanisme van DCA is nog niet eerder beschreven. Wel is aangetoond dat pyruvaat kinase, de laatste ATP-producerende plaats in de glycolytische route, negatief wordt gereguleerd door acetyl co-enzym A (acetyl-CoA) [30]. Aangezien PDH-activering rechtstreeks de vorming van acetyl-CoA verhoogt [31], zou dit de DCA-gemedieerde remming van de glycolyse kunnen verklaren. De structurele overeenkomst tussen DCA en pyruvaat [32] zou ook een directe remming van de glycolyse door DCA kunnen impliceren, mogelijk via een allosterisch terugkoppelingsmechanisme.
De metabole respons op DCA ging gepaard met een verminderde proliferatie van melanoomcellen, onafhankelijk van de genetische driverstatus en de metabole profielen van deze cellen. Verschillende eerdere studies hebben een apoptotisch effect van DCA op kankercellen aangetoond [13],[18],[19],[32]-[34]. In overeenstemming met onze resultaten werd de apoptotische respons echter pas opgewekt bij concentraties die te hoog zijn om klinisch relevant te zijn [32]. Om de klinische relevantie van DCA voor de behandeling van melanoom verder te onderzoeken, hebben wij de werkzaamheid van dit middel onderzocht in combinatie met de BRAF-remmer vemurafenib. Deze experimenten toonden een versterkend effect aan van DCA op de groeiremming van BRAFV600E-mutante melanoomcellen. Bij lage concentraties DCA die op zichzelf geen effect hadden op de celgroei, had de combinatie met lage concentraties vemurafenib een aanzienlijk sterker groeiremmend effect dan vemurafenib alleen. Dit versterkende effect van DCA kwam ook tot uiting in de verlaging van de ATP-niveaus. Biochemische analyse heeft het vermogen van BRAFV600E aangetoond om de LKB1-AMPK-energieweg te ontkoppelen, waardoor weerstand tegen energietekort wordt bevorderd en een apoptotische respons wordt voorkomen [8],[9]. Behandeling met BRAF-remmers herstelt deze route [35] en kan daarom de respons versterken op verbindingen die de aanmaak van ATP verminderen. Zowel DCA als vemurafenib onderdrukken de glycolytische activiteit in melanoomcellen en maken ze dus afhankelijker van mitochondriale ademhaling [6]. Aangezien de glycolyse een groot deel van de totale energieproductie in deze cellen voor haar rekening neemt, zal remming van dit proces een groot beroep doen op het oxidatieve systeem voor de productie van ATP. De lagere prestatie van de mitochondriën in melanoomcellen zou het onvermogen van deze cellen kunnen verklaren om het ATP-niveau op peil te houden in aanwezigheid van DCA en vemurafenib. Het coöperatieve effect van deze verbindingen bij het verlagen van de ATP-niveaus suggereert dat de energetische drempel die groeistilstand of celdood in melanoomcellen bevordert, kan worden bereikt met lagere concentraties vemurafenib in aanwezigheid van DCA.
In eerdere studies is onderzocht of metabole modulatoren het therapeutische effect van BRAF-remmers voor de behandeling van melanoom kunnen verbeteren. De combinatie van PLX4720 (een vemurafenib-analoog) met een van de twee antidiabetische biguaniden, metformine en fenformine, vertoonde synergetische remming van de levensvatbaarheid van melanoomcellen [35],[36]. Beide middelen verminderen de ATP-synthese door remming van de mitochondriale complex I activiteit, wat leidt tot een vermindering van de ATP/ADP verhouding en activering van de LKB1-AMPK route om de groei te onderdrukken [35],[36]. In tegenstelling tot DCA stimuleren metformine en fenformine beide de glycolyse en de melkzuurproductie [37],[38], wat de groeistimulerende effecten van metformine op sommige melanoomcellijnen zou kunnen verklaren wanneer zij als enkelvoudig middel worden gebruikt. Bovendien lagen de concentraties waarbij metformine werkzaam was boven een therapeutisch relevant niveau [35]. Fenformine was aanzienlijk krachtiger dan metformine [36], maar werd in verband gebracht met een hoog risico op melkzuursyndroom [39], en werd in vele landen uit de handel genomen voor de behandeling van diabetes type 2. Van DCA daarentegen werd hier aangetoond dat het het effect van vemurafenib versterkt bij concentraties tot 1 mM, en eerder werd aangetoond dat het weinig nadelige effecten heeft bij toediening aan patiënten [17],[19],[40]. Deze bevindingen wijzen op een therapeutisch potentieel van DCA als co-drug voor de behandeling met vemurafenib van BRAFV600E-mutant melanoom. Dit werd versterkt door de demonstratie dat de gevoeligheid voor DCA behouden bleef in melanoomcellijnen met verworven resistentie tegen vemurafenib. Hoewel resistente cellen een veranderd metabolisch profiel vertoonden met een significant verhoogde maximale mitochondriale ademhaling, zoals ook aangetoond door Corazao-Rozas et al. [41], waren ze even gevoelig voor DCA als de ouderlijke vemurafenib-gevoelige cellen. Daarom zou DCA mogelijk een strategie kunnen bieden om het ontstaan van vemurafenib-tolerante subpopulaties tijdens de initiële behandeling te voorkomen en zo de ontwikkeling van resistentie uit te stellen of te verhinderen.
Conclusies
Wij geven hier een beter inzicht in de effecten van DCA op het metabolisme en de groei van melanoomcellen. Het vermogen van DCA om de ATP-niveaus en de groei van melanomen te verlagen lijkt het effect te versterken van vemurafenib, een geneesmiddel dat reeds in de kliniek wordt gebruikt voor de behandeling van BRAFV600E-mutante metastatische melanomen. Belangrijk is dat melanoomcellen met verworven resistentie tegen vemurafenib hun gevoeligheid voor DCA behielden. Deze bevindingen moeten verder onderzoek van deze geneesmiddelencombinatie en de in vivo toepassing van DCA aanmoedigen.
Extra bestanden
Aanvullend bestand 1: Tabel S1.(33K, doc)
Pyrosequencing primers voor amplificatie en sequencing van BRAF en NRAS mutatie hotspots. Forward, reverse en sequencing primers worden respectievelijk F, R en S genoemd.
Aanvullend bestand 2:Figuur S2.(8.5M, tiff)
Basale en maximale mitochondriale OCR-waarden voor melanoomcellijnen en humane epidermale melanocyten (HEMn-LP). De OCR gemeten na toevoeging van rotenon/antimycine A (niet-mitochondriale OCR) werd van alle waarden afgetrokken. De stippellijn geeft de basale OCR van HEMn-LP aan. De aangegeven waarden zijn gemiddelden van drie onafhankelijke metingen ± standaardafwijking. Students t-test werd gebruikt om verschillen te bepalen tussen HEMn-LP en de melanoomcellijnen (*p < 0,05; **p < 0,01; ***p < 0,001). De maximale mitochondriale OCR voor ED-034 werd niet aangegeven vanwege een zeer grote variatie tussen vier onafhankelijke experimenten, variërend van 6,19 tot 58,36 pmoles/min/1.000 cellen.
Aanvullend bestand 3: Figuur S3.(12M, tiff)
Metabole respons van melanoomcellen op DCA Relatieve respons in ECAR, OCR, OCR/ECAR en ATP-niveaus na behandeling met DCA (0,1, 1 en 10 mM) gedurende 2 uur. De foutbalken in de eerste drie panelen vertegenwoordigen standaardafwijkingen van drie herhaalde metingen van zes parallelle monsters. De foutbalkjes in het onderste paneel geven de standaardafwijking van drie onafhankelijke experimenten weer. Voor de statistische analyse is gebruik gemaakt van one-way matched-samples ANOVA en Tukey’s HSD-test om de statistische significantie te bepalen (*p < 0,05; **p < 0,01).
Aanvullend bestand 4: Figuur S4.(5.6M, tiff)
Allel status van BRAF. Pyrosequencing van de BRAF c.1799 T > A mutatieplaats in ED-013 en het vemurafenib resistente derivaat ED-013-R2. De verhoogde BRAF V600E-to-BRAF WT ratio in ED-013-R2 wijst op een toename van het aantal kopieën, wat de resistentie tegen vemurafenib zou kunnen verklaren.
Concurrerende belangen
De auteurs verklaren geen concurrerende belangen te hebben.
Bijdragen van de auteurs
PG en CA planden en organiseerden de studie. CA voerde het merendeel van de experimenten en de gegevensverwerking uit. CD plande en voerde de celproliferatietest uit en hielp bij de interpretatie van de resultaten. AB en TM hielpen bij het voorbereiden en optimaliseren van het ontwerp voor de metabole analyse op het Seahorse XF instrument. CA, AB en TM bespraken en interpreteerden de resultaten van de metabole analyse. CA en PG schreven het manuscript met bijdragen en bewerkingen van CD, AB en TM. Het definitieve manuscript is door alle auteurs gelezen en goedgekeurd.
Dankbetuigingen
Wij danken professor Karsten Kristiansen (Departement Biologie, Universiteit van Kopenhagen) en geassocieerd professor Jacob B. Hansen (Departement Biomedische Wetenschappen, Universiteit van Kopenhagen) voor het ter beschikking stellen van de apparatuur en de technische expertise met betrekking tot de Seahorse XF-analyse. Deze studie werd gesteund door subsidies van de Deense vereniging voor kankerbestrijding en de Deense stichting voor kankeronderzoek.
VERWIJZINGEN
1 Warburg O, Wind F, Negelein E: The metabolism of tumors in the body. J Gen Physiol. 1927, 8: 519-530. 10.1085/jgp.8.6.519.2 Gatenby RA, Gillies RJ: Why do cancers have high aerobic glycolysis. Nat Rev Cancer. 2004, 4: 891-899. 10.1038/nrc1478.
3 Vander Heiden MG, Cantley LC, Thompson CB: Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 2009, 324: 1029-1033. 10.1126/science.1160809.
4 Vazquez F, Lim JH, Chim H, Bhalla K, Girnun G, Pierce K, Clish CB, Granter SR, Widlund HR, Spiegelman BM, Puigserver P: PGC1alpha expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 2013, 23: 287-301. 10.1016/j.ccr.2012.11.020.
5 vDavies H, Bignell GR, Cox C, Stephens P, Edkins S, Clegg S, Teague J, Woffendin H, Garnett MJ, Bottomley W, Davis N, Dicks E, Ewing R, Floyd Y, Gray K, Hall S, Hawes R, Hughes J, Kosmidou V, Menzies A, Mould C, Parker A, Stevens C, Watt S, Hooper S, Wilson R, Jayatilake H, Gusterson BA, Cooper C, Shipley J: Mutaties van het BRAF-gen in menselijke kanker. Nature. 2002, 417: 949-954. 10.1038/nature00766.
6 Hall A, Meyle KD, Lange MK, Klima M, Sanderhoff M, Dahl C, Abildgaard C, Thorup K, Moghimi SM, Jensen PB, Bartek J, Guldberg P, Christensen C: Dysfunctionele oxidatieve fosforylering maakt kwaadaardige melanoomcellen verslaafd aan glycolyse aangedreven door het (V600E)BRAF oncogen. Oncotarget. 2013, 4: 584-599.
7 Haq R, Shoag J, Andreu-Perez P, Yokoyama S, Edelman H, Rowe GC, Frederick DT, Hurley AD, Nellore A, Kung AL, Wargo JA, Song JS, Fisher DE, Arany Z, Widlund HR: Oncogene BRAF regelt oxidatief metabolisme via PGC1alpha en MITF. Cancer Cell. 2013, 23: 302-315. 10.1016/j.ccr.2013.02.003.
8 Esteve-Puig R, Canals F, Colome N, Merlino G, Recio JA: Uncoupling of the LKB1-AMPKalpha energy sensor pathway by growth factors and oncogenic BRAF.PLoS One 2009, 4:e4771…,
9 Zheng B, Jeong JH, Asara JM, Yuan YY, Granter SR, Chin L, Cantley LC: Oncogenic B-RAF negative regulates the tumor suppressor LKB1 to promote melanoma cell proliferation. Mol Cell. 2009, 33: 237-247. 10.1016/j.molcel.2008.12.026.
10 Kaplon J, Zheng L, Meissl K, Chaneton B, Selivanov VA, Mackay G, van der Burg SH, Verdegaal EM, Cascante M, Shlomi T, Gottlieb E, Peeper DS: A key role for mitochondrial gatekeeper pyruvate dehydrogenase in oncogene-induced senescence. Nature. 2013, 498: 109-112. 10.1038/nature12154.
11 Baumunk D, Reichelt U, Hildebrandt J, Krause H, Ebbing J, Cash H, Miller K, Schostak M, Weikert S: Expressieparameters van de metabolic pathway genen pyruvaat dehydrogenase kinase-1 (PDK-1) en DJ-1/PARK7 in niercelcarcinoom (RCC). World J Urol. 2013, 31: 1191-1196. 10.1007/s00345-012-0874-5.
12 Hur H, Xuan Y, Kim YB, Lee G, Shim W, Yun J, Ham IH, Han SU: Expressie van pyruvaat dehydrogenase kinase-1 in maagkanker als potentieel therapeutisch doelwit. Int J Oncol. 2013, 42: 44-54.
13 Kluza J, Corazao-Rozas P, Touil Y, Jendoubi M, Maire C, Guerreschi P, Jonneaux A, Ballot C, Balayssac S, Valable S, Corroyer-Dulmont A, Bernaudin M, Malet-Martino M, de Lassalle EM, Maboudou P, Formstecher P, Polakowska R, Mortier L, Marchetti P: Inactivation of the HIF-1alpha/PDK3 signaling axis drives melanoma toward mitochondrial oxidative metabolism and potentiates the therapeutic activity of pro-oxidants. Cancer Res. 2012, 72: 5035-5047. 10.1158/0008-5472.CAN-12-0979.
14 Stacpoole PW, Lorenz AC, Thomas RG, Harman EM: Dichloroacetate in the treatment of lactic acidosis. Ann Intern Med. 1988, 108: 58-63. 10.7326/0003-4819-108-1-58.
15 Stacpoole PW: The pharmacology of dichloroacetate. Metabolism. 1989, 38: 1124-1144. 10.1016/0026-0495(89)90051-6.
16 Michelakis ED, Webster L, Mackey JR: Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer. 2008, 99: 989-994. 10.1038/sj.bjc.6604554.
17 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E: Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics. 2006, 117: 1519-1531. 10.1542/peds.2005-1226.
18 Bonnet S, Archer SL, lalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007, 11: 37-51. 10.1016/j.ccr.2006.10.020.
19 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, Abdulkarim B, McMurtry MS, Petruk KC: Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med. 2010, 2: 31-34. 10.1126/scitranslmed.3000677.
20 Wong JY, Huggins GS, Debidda M, Munshi NC, De VI: Dichloroacetate induceert apoptose in endometriumkankercellen. Gynecol Oncol. 2008, 109: 394-402. 10.1016/j.ygyno.2008.01.038.
21 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ: Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate. 2008, 68: 1223-1231. 10.1002/pros.20788.
22 Robinson J, Roberts CH, Dodi IA, Madrigal JA, Pawelec G, Wedel L, Marsh SG: The European searchable tumor line database. Cancer Immunol Immunother. 2009, 58: 1501-1506. 10.1007/s00262-008-0656-5.
23 Wu M, Neilson A, Swift AL, Moran R, Tamagnine J, Parslow D, Armistead S, Lemire K, Orrell J, Teich J, Chomicz S, Ferrick DA: Multiparameter metabole analyse onthult een nauw verband tussen verminderde mitochondriale bio-energetische functie en verhoogde glycolyse afhankelijkheid in menselijke tumorcellen. Am J Physiol Cell Physiol. 2007, 292: C125-C136. 10.1152/ajpcell.00247.2006.
24 Brand MD, Nicholls DG: Assessing mitochondrial dysfunction in cells. Biochem J. 2011, 435: 297-312. 10.1042/BJ20110162.
25 Dahl C, Christensen C, Jonsson G, Lorentzen A, Skjodt ML, Borg A, Pawelec G, Guldberg P: Mutual Exclusivity Analysis of Genetic and Epigenetic Drivers in Melanoma Identifies a Link Between p14ARF and RARbeta Signaling. Mol Cancer Res. 2013, 11: 1166-1178. 10.1158/1541-7786.MCR-13-0006.
26 Sondergaard JN, Nazarian R, Wang Q, Guo D, Hsueh T, Mok S, Sazegar H, MacConaill LE, Barretina JG, Kehoe SM, Attar N, von EE, Zuckerman JE, Chmielowski B, Comin-Anduix B, Koya RC, Mischel PS, Lo RS, Ribas A: Differential sensitivity of melanoma cell lines with BRAFV600E mutation to the specific Raf inhibitor PLX4032.J Transl Med 2010, 8:39.,
27 Nazarian R, Shi H, Wang Q, Kong X, Koya RC, Lee H, Chen Z, Lee MK, Attar N, Sazegar H, Chodon T, Nelson SF, McArthur G, Sosman JA, Ribas A, Lo RS: Melanomen verwerven resistentie tegen B-RAF(V600E) remming door RTK of N-RAS upregulatie. Nature. 2010, 468: 973-977. 10.1038/nature09626.
28 Shi H, Moriceau G, Kong X, Lee MK, Lee H, Koya RC, Ng C, Chodon T, Scolyer RA, Dahlman KB, Sosman JA, Kefford RF, Long GV, Nelson SF, Ribas A, Lo RS: Melanoma whole-exome sequencing identifies (V600E)B-RAF amplification-mediated acquired B-RAF inhibitor resistance.Nat Commun 2012, 3:724…,
29 de Barbi MM, Vincent G, Fayewicz SL, Bateman NW, Hood BL, Sun M, Suhan J, Duensing S, Yin Y, Sander C, Kirkwood JM, Becker D, Conrads TP, Van HB, Moschos SJ: Mitochondrial respiration-an important therapeutic target in melanoma.PLoS One 2012, 7:e40690…,
30 Gilbert RJ, Klein RA:Pyruvaat kinase: een carnitine-gereguleerde plaats van ATP productie in Trypanosoma brucei brucei. Comp Biochem Physiol B. 1984, 78: 595-599.
31 Kobayashi K, Neely JR:Mechanism of pyruvate dehydrogenase activation by increased cardiac work. J Mol Cell Cardiol. 1983, 15: 369-382. 10.1016/0022-2828(83)90321-8.
32 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG, Newton DL:Sodium dichloroacetate selectively targets cells with defects in the mitochondrial ETC. Int J Cancer. 2010, 127: 2510-2519. 10.1002/ijc.25499.
33 Madhok BM, Yeluri S, Perry SL, Hughes TA, Jayne DG:Dichloroacetate induceert apoptose en celcyclusstilstand in colorectale kankercellen. Br J Cancer. 2010, 102: 1746-1752. 10.1038/sj.bjc.6605701.
34 Tong J, Xie G, He J, Li J, Pan F, Liang H: Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer.J Biomed Biotechnol 2011, 2011:740564…,
35 Niehr F, Von EE, Attar N, Guo D, Matsunaga D, Sazegar H, Ng C, Glaspy JA, Recio JA, Lo RS, Mischel PS, Comin-Anduix B, Ribas A: Combinatietherapie met vemurafenib (PLX4032/RG7204) en metformine in melanoomcellijnen met verschillende driver-mutaties.J Transl Med 2011, 9:76.,
36 Yuan P, Ito K, Perez-Lorenzo R, Del GC, Lee JH, Shen CH, Bosenberg MW, McMahon M, Cantley LC, Zheng B:Phenformine vergroot het therapeutisch voordeel van BRAFV600E-remming in melanoom. Proc Natl Acad Sci U S A. 2013, 110: 18226-18231. 10.1073/pnas.1317577110.
37 Buzzai M, Jones RG, Amaravadi RK, Lum JJ, DeBerardinis RJ, Zhao F, Viollet B, Thompson CB:Systemische behandeling met het antidiabeticum metformine vermindert selectief de groei van p53-deficiënte tumorcellen. Cancer Res. 2007, 67: 6745-6752. 10.1158/0008-5472.CAN-06-4447.
38 Choi YW, Lim IK:Sensibilisering van metformine-cytotoxiciteit door dichlooracetaat via herprogrammering van het glucosemetabolisme in kankercellen. Cancer Lett. 2014, 346: 300-8. 10.1016/j.canlet.2014.01.015.
39 Bergman U, Boman G, Wiholm BE:Epidemiologie van bijwerkingen van fenformine en metformine. Br Med J. 1978, 2: 464-466. 10.1136/bmj.2.6135.464.
40DunbarEM, Coats BS, Shroads AL, Langaee T, Lew A, Forder JR, Shuster JJ, Wagner DA, Stacpoole PW:Phase 1 trial of dichloroacetate (DCA) in adults with recurrent malignant brain tumors. Invest New Drugs. 2013, 32: 452-64. 10.1007/s10637-013-0047-4.
41 Corazao-Rozas P, Guerreschi P, Jendoubi M, Andre F, Jonneaux A, Scalbert C, Garcon G, Malet-Martino M, Balayssac S, Rocchi S, Savina A, Formstecher P, Mortier L, Kluza J, Marchetti P:Mitochondriale oxidatieve stress is de achilleshiel van melanoomcellen die resistent zijn tegen Braf-mutantremmer. Oncotarget. 2013, 4: 1986-1998.