Zheng Yang1, Kin Y. Tam1
1 Faculteit Gezondheidswetenschappen, Universiteit van Macau, Taipa, Macau, China.
Correspondentie: Kin Y. Tam
Faculteit Gezondheidswetenschappen, Universiteit van Macau, Taipa, Macau, China
Tel.: +853-88224988
Fax: +853-88222314.
E-mail: [email protected]
Ontvangen: 15 april 2016
Herzien: 27 juli 2016
Aanvaard: 2 augustus 2016
Abstract
Glycolyse is waargenomen als een overheersend proces voor de meeste kankercellen om glucose te gebruiken, wat werd aangeduid als “Warburg Effect”. Targeting kritische enzymen, zoals pyruvaat dehydrogenase kinase (PDK) die omgekeerd het proces van glycolyse regelen zou een veelbelovende aanpak kunnen zijn om alleen of in combinatie met andere behandelingen voor kankertherapie te werken. EGFR-remmers voor de behandeling van niet-kleincellige longkanker (NSCLC) worden al tientallen jaren met groot succes toegepast in de klinische praktijk, maar ook hun klinische voordelen werden enigszins gehinderd door de toenemende verworven resistentie. Combinatiebehandeling is een effectieve strategie om deze uitdaging het hoofd te bieden. In deze studie gebruikten wij Dichlooracetaat (DCA), een alom gewaardeerde PDK-remmer, samen met Erlotinib en Gefitinib, twee bekende EGFR-remmers, en toonden wij aan dat de toepassing van DCA in combinatie met Erlotinib of Gefitinib de levensvatbaarheid van EGFR-mutante NSCLC-cellen (NCI-H1975 en NCI-H1650) op synergetische wijze aanzienlijk verminderde. Dit synergetische resultaat lijkt een combinatie-effect te zijn bij het bevorderen van apoptose, in plaats van co-suppressie van ofwel EGFR ofwel PDK signaalwegen. Bovendien hebben wij aangetoond dat de combinatiebehandeling geen synergetisch effect had in andere NSCLC-cellijnen zonder EGFR-mutaties (A549 of NCI-H460). Samen suggereren deze waarnemingen dat gecombineerde targeting van EGFR en PDK in NSCLC-cellen synergetische effecten heeft op een EGFR-mutatie-afhankelijke wijze.
Trefwoorden: Pyruvaat Dehydrogenase Kinase; Dichlooracetaat; Epidermale Groeifactor Receptor; Erlotinib; Gefitinib; Geneesmiddelencombinatie
Copyright © 2016 Elsevier B.V. Alle rechten voorbehouden.
INLEIDING
Longkanker staat volgens de laatste statistieken (Jemal et al., 2011) wereldwijd op de eerste plaats bij mannen en in de top vijf bij vrouwen van nieuw gediagnosticeerde kankergevallen en de aan kanker gerelateerde sterfgevallen, waarbij meer dan 80% van de patiënten in de categorie niet-kleincellige longkanker of NSCLC valt (Ke et al., 2015). Traditionele strategieën voor de behandeling van NSCLC namen vaak hun toevlucht tot chemotherapieën met monotoediening of combo-toediening van platina-gebaseerde of andere cytotoxische chemicaliën. De objectieve responspercentages van deze strategieën waren echter meestal onbevredigend, met een mediane totale overleving van meestal minder dan 1 jaar (Schiller et al., 2002, Pao en Chmielecki, 2010).
EGFR-mutatie werd gevonden bij ongeveer 30% van de NSCLC-patiënten die vaak goed reageerden op de gerichte therapie (Pao en Chmielecki, 2010). Dit maakte brede toepassing van kleine moleculaire EGFR-tyrosinekinaseremmers (EGFR-TKi’s) mogelijk, die de afgelopen decennia enorm succesvol waren (Hanahan en Weinberg, 2011), zoals bijvoorbeeld Erlotinib en Gefitinib (Duttaen Maity, 2007). Echter, verworven resistentie trad meestal op wanneer patiënten werden behandeld met EGFR-remmers, met verschillende geïdentificeerde mechanismen zoals oorspronkelijke of geïnduceerde T790M hotspot mutatie, geactiveerde secundaire signalering zoals MET amplificatie of PI3K mutatie, of verleende epitheliale naar mesenchymale transitie (EMT) (Maione et al., 2015). Teleurstellend is dat gecombineerde toepassingen van EGFR-remmers met chemotherapieën meer bijwerkingen met zich meebrachten dan het verwachte voordeel van verlenging van de algehele overleving van de behandelde objecten (Yan et al., 2015).
Kankercelmetabolisme is een opkomend gebied gebaseerd op de ontdekking en meer dan een halve eeuw onderzoek naar het “Warburg Effect” (Ngo et al., 2015), dat stelt dat kankercellen de neiging hebben glucose te metaboliseren via glycolyse, in plaats van oxidatieve fosforylering, om energie te genereren (Lu et al., 2015). Dit fenomeen heeft geleid tot veel studies gericht op belangrijke enzymen in het glucosemetabolisme, zoals glucosetransporters (GLUTs), hexokinase2 (HK2), pyruvaat kinase M2 (PKM2), pyruvaat dehydrogenase kinase (PDK), lactaat dehydrogenase-A (LDHA), en glutaminase, wat heeft geleid tot de ontwikkeling van verschillende remmers die zich richten op specifieke enzymen voor anti-kanker therapie (Butler et al., 2013). Als PDK-remmer kan dichlooracetaat (DCA) de kankerprogressie bij veel verschillende soorten kanker afremmen door de fosforylering van pyruvaatdehydrogenase (p-PDH), die door PDK wordt gecontroleerd, te verminderen (Kankotia en Stacpoole, 2014). Hoewel er verschillende combinatiestudies zijn gerapporteerd die betrokken waren bij de toepassing van DCA voor de behandeling van NSCLC, waren de meeste daarvan gericht op de klassieke cytotoxische chemotherapie, namelijk het gecombineerde gebruik van DCA en een op platina gebaseerd geneesmiddel (Garon et al., 2014, Olszewski et al., 2010). Of de combinatie van DCA met EGFR-TKi in EGFR gemuteerde NSCLC’s een synergetisch effect kan hebben op de antikankertherapie blijft onbekend.
In deze studie hebben wij aangetoond dat gecombineerde toepassing van EGFR-remmers (Erlotinib of Gefitinib) met DCA de celgroei van NCI-H1975 en NCI-H1650 synergetisch remde. Bovendien onderzochten wij de mogelijke mechanismen voor de combinatie-effecten van EGFR- en PDK-remmers. Wij vonden dat deze combinaties alleen synergie kunnen vertonen in NCI-H1975 en NCI-H460, de EGFR mutant NSCLC cellijnen, maar niet in A549 of NCI-H460, de EGFR wild type NSCLC cellijnen.
Materialen en methoden
Cellijnen en reagentia
NSCLC-cellijnen, NCI-H1975, NCI-H1650 en A549, werden gekocht van ATCC, terwijl NCI-H460 een welwillende gift was van Prof. Thomas Y.C. Leung (Departement Toegepaste Biologie en Chemische Technologie, Faculteit Toegepaste Wetenschappen en Textiel, The Hong Kong Polytechnic University). A549 cellen werden gekweekt in F-12K/DMEM 1:1 (Gibco), terwijl andere cellijnen werden onderhouden in RPMI 1640 (Gibco), met toevoeging van 10% foetaal runderserum (Gibco), in een vochtige atmosfeer met 5%CO2 bij 37 °C.
DCA werd gekocht bij Sigma en opgelost in 1% DMSO in PBS als voorraadoplossing (1,6 M), die vervolgens werd verdund tot verschillende concentraties om de uiteindelijke werkoplossingen te vormen die 0,1% DMSO bevatten in de gehele media voor celbehandeling. Erlotinib en Gefitinib, beide van SelleckChem, werden aanvankelijk opgelost in DMSO (Sigma) om de voorraadoplossing te vormen met de concentratie van 160 mM, en verdund tot de individuele concentratie van de werkmedia als die van DCA. Primaire antilichamen waaronder p-PDH en PDH (Abcam) waren van Cell Signaling Technology. α-Tubuline werd verkregen van Invitrogen.
Levensvatbaarheid van de cellen:
De levensvatbaarheid van elke individuele behandelde of onbehandelde cel na de aangegeven tijd van behandeling werd beoordeeld door middel van de MTT-test. Kortom, individuele cellen voor elke cellijn werden gezaaid in 96-well platen 24 uur voor verbindingen laden. Na de aangegeven periode (respectievelijk 24, 48 en 72 uur) werden de kweekmedia met verbindingen weggegooid en werd 100 μl verse hele media met 0,5 mg/ml MTT (3-(4,5-dimethyl-2-thiazolyl)-2,5-difenyl-2-H-tetrazoliumbromide, Sigma) toegevoegd. Na 4 uur incubatie bij 37 °C werd het oplosmiddel verwijderd en werd aan elk putje 100 μl DMSO toegevoegd, waarbij voorzichtig werd geschud om de formazankristallen op te lossen. De O.D.-waarde van elk putje werd gemeten bij 570 nm met de SpectraMax M5 Microplate Reader (Molecular Devices).
Berekening van de combinatie-index (CI)
De CI-waarde werd geregistreerd voor de synergetische evaluatie van de levensvatbaarheid van de cellen tussen de combinatie en elk van de afzonderlijke groepen, die werd berekend als functie van de fractie aangetaste kankercellen (Fa) op basis van de vergelijking van Chou-Talalay (Chou en Talalay, 1984): CI=(D)1/(Dx)1+(D)2/(Dx)2, waarbij (D)1 en (D)2 de doses aangeven die worden toegepast om in combinatie een noodzakelijke respons te bereiken, en (Dx) verwijst naar de afzonderlijke geneesmiddeldoses die nodig zijn om een soortgelijke respons te bereiken. Analyses van de CI-waarden werden uitgevoerd met de CalcuSyn-software (Biosoft), waarbij CI<1, CI=1 en CI>1 respectievelijk synergetische, additieve en antagonistische effecten aangeven.
Kolonievormingstest
Alle vier de NSCLC-cellijnen werden uitgezaaid in 6-wellsplaten met elk putje 200-800 cellen in 2 ml media. Media met hetzij afzonderlijke verbindingen, hetzij een combinatie daarvan, werden toegevoegd 24 uur nadat de cellen waren geënt voor een continue behandeling van 3 dagen, en vervolgens om de 3 dagen vervangen door media zonder geneesmiddelen. 15 dagen na het uitzetten van de cellen werden de celkolonies gedurende 15 minuten gefixeerd in 95% ethanol, gekleurd met 0,1% Crystal Violet (Sigma) en gedroogd. Kolonies met meer dan 100 cellen werden als positief geteld.
Western blotting assay
Zowel NCI-H1975 als A549 cellen werden gezaaid in 6-well platen en behandeld met media die mono-compound of combinatie bevatten gedurende bepaalde perioden. Behandelde cellen werden geïncubeerd in cellysaatbuffer (Cell Signaling Technology) onder voorzichtig schudden gedurende 15 min, en vervolgens gecentrifugeerd bij 12.000 rpm/min bij 4 °C gedurende nog eens 15 min. De eiwitconcentratie van elk monster in het supernatant werd beoordeeld met Pierce® BCA Protein Assay Kit (Thermo) en op hetzelfde niveau gebracht, gevolgd door een eiwitdenaturatie van 8 minuten met SDS-laadbuffer bij 100 °C. Eiwitten in het monster werden gescheiden door SDS-PAGE elektroforese, overgebracht op nitrocellulose filtermembraan (Whatman), geblokkeerd in 5% vetvrije melk gedurende 2 uur, ’s nachts gebroeid met de gewenste primaire antilichamen, gevolgd door secundair HRP-gekoppeld anti-rabbit of anti-muis IgG (Cell Signaling Technology) gedurende 2 uur. Membranen werden ten slotte gescand in een Chemidoc® MP Imaging System (Bio-Rad) na 2 minuten incubatie in Clarity Western ECL Substrate (Bio-Rad).
Flowcytometrietest
NCI-H1975en A549 cellen werden gezaaid en behandeld zoals beschreven in het vorige hoofdstuk. Behandelde cellen werden losgemaakt van de bodem van de platen met trypsine-EDTA (Gibco) en twee keer gewassen met PBS. Apoptotische detecties werden uitgevoerd met de FITC Annexin-V Apoptotic Detection Kit (Biolegend). Kortom, geoogste celmonsters werden gesuspendeerd in 500 μl Binding Buffer met 5 μl Annexine V-FITC en 10 μl Propidium Jodide (PI) gedurende 15 min vóór FACS-analyse op een Accuri C6 Flow Cytometer (BD). Celmonsters voor mitochondriale membraanpotentiaalmeting (MMP) werden geïncubeerd in 1 ml gehele media met 2 μM JC-1 (5,5,6,6-tetrachloor-1,1,3,3-tetraethylbenzimidazolycarcocyaninejodide, Sigma) gedurende 15 min, gevolgd door een wasbeurt en resuspensie in PBS voor FACS-analyse.
Statistische analyse
Alle gegevens werden gepresenteerd als het gemiddelde±S.D. IC50 van individuele verbindingen op aangegeven tijdstip werden uitgevoerd door GraphPad 5.1 (Prism). Statistische vergelijkingen tussen verschillende steekproefgroepen werden uitgevoerd door Excel 2010 met behulp van de Student’s t-test. Een P-waarde van minder dan 0,05 werd beschouwd als statistisch significant.
Resultaten
Erlotinib, Gefitinib en DCA verminderden de celproliferatie in NCI-H1975 en A549 NSCLC-cellijnen
Wij trachtten de in vitro anti-celproliferatie-effecten van de drie geselecteerde verbindingen te bepalen in NCI-H1975, NCI-H1650, A549 en NCI-H460 NSCLC-cellijnen. De cellen werden behandeld met een 2-voudige reeks verdunningen van elke verbinding gedurende respectievelijk 24, 48 of 72 uur. De levensvatbaarheid van de cellen werd beoordeeld met een MTT-test. Zoals getoond in Fig. 1, leidden Erlotinib, Gefitinib of DCA tot een significante afname van de levensvatbaarheid van de cellen in alle vier de cellijnen op een dosis- en tijdsafhankelijke wijze. Te zien is dat de variabiliteit van de IC50 voor de meeste cellijnen lager blijkt te zijn bij 72 uur (zie tabel 1). Vanaf hier hebben wij dus 72 uur gekozen als eindpunt voor de combinatiebehandeling.
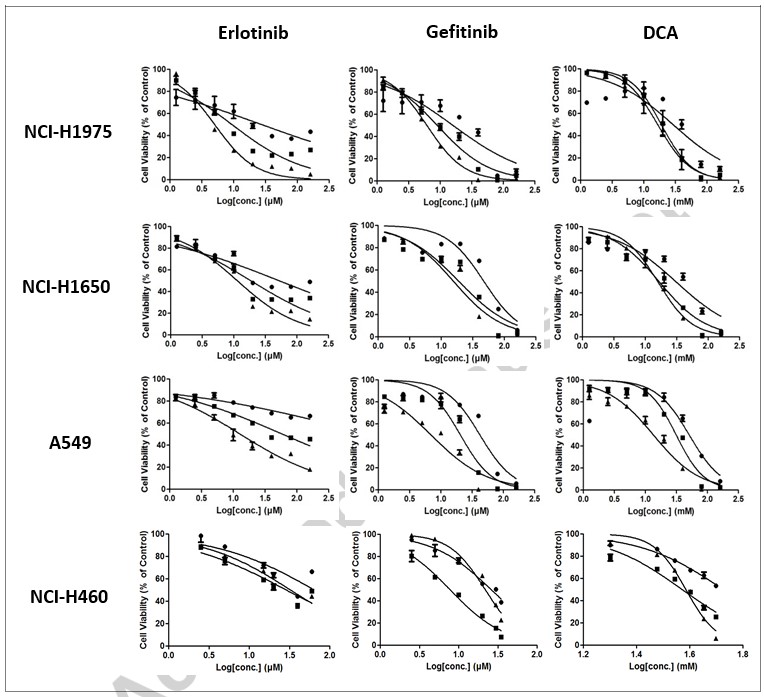
| NCI-H1975 | NCI-H1650 | A549 | NCI-H460 | ||
| Erlotinib (μM) | 24 h | 27.33±15.06 | 52.69±0.80 | N/A | N.V.T |
| 48 h | 9.45±1.48 | 18.67±0.66 | 59.66±3.06 | 28.72±3.29 | |
| 72 h | 5.04±0.01 | 11.42±0.10 | 13.14±3.70 | 32.66±3.32 | |
| Gefitinib (μM) | 24 h | 16.22±8.37 | 47.30±3.98 | 41.96±3.38 | 26.19±1.98 |
| 48 h | 9.09±1.91 | 18.97±0.62 | 20.66±2.95 | 7.74±0.37 | |
| 72 h | 6.15±0.18 | 15.61±1.15 | 6.97±0.22 | 21.86±0.09 | |
| DCA (mM) | 24 h | 29.51±3.25 | 31.09±4.10 | 50.25±6.89 | N.V.T |
| 48 h | 19.56±6.31 | 16.84±4.53 | 31.35±1.00 | 37.26±0.47 | |
| 72 h | 16.60±4.46 | 15.81±0.26 | 13.55±2.32 | 38.47±0.35 |
Gecombineerde strategieën onderdrukten synergetisch de levensvatbaarheid van de cellen en remden de kolonievorming aanzienlijk in NCI-H1975 en NCI-H1650, maar werkten niet zo goed in A549 en NCI-H460
Om de in vitro synergetische respons op de combinatie van EGFR-remmers met DCA te bepalen, gebruikten wij twee combo-strategieën, namelijk Erlotinib met DCA en Gefitinib met DCA, met zes afzonderlijke behandelingsconcentratiepunten voor elke verbinding, die de levensvatbaarheid van de cellen tussen ongeveer IC80 en IC20 in een vaste verhouding afremden. De combinatie-effecten werden geëvalueerd met behulp van de MTT-test. Zoals getoond in Fig. 2, vertoonden beide combinaties, Erlotinib met DCA en Gefitinib met DCA, duidelijk synergie in NCI-H1975 en NCI-H1650 cellijnen, waarbij de CI-waarden in alle gecombineerde groepen lager waren dan 1 (Fig. 2A en B). Voor A549 en NCI-H460 cellijn, hoewel alle combinatiegroepen in twee strategieën een verhoogde Fa-waarde vertoonden in vergelijking met hun monotoepassingen, waren de CI-waarden van sommige combinatiegroepen hoger dan 1 (Fig. 2C en D), hetgeen suggereert dat de combinatiestrategieën in A549 en NCI-H460 niet zo goed werkten als in NCI-H1975 en NCI-H1650.
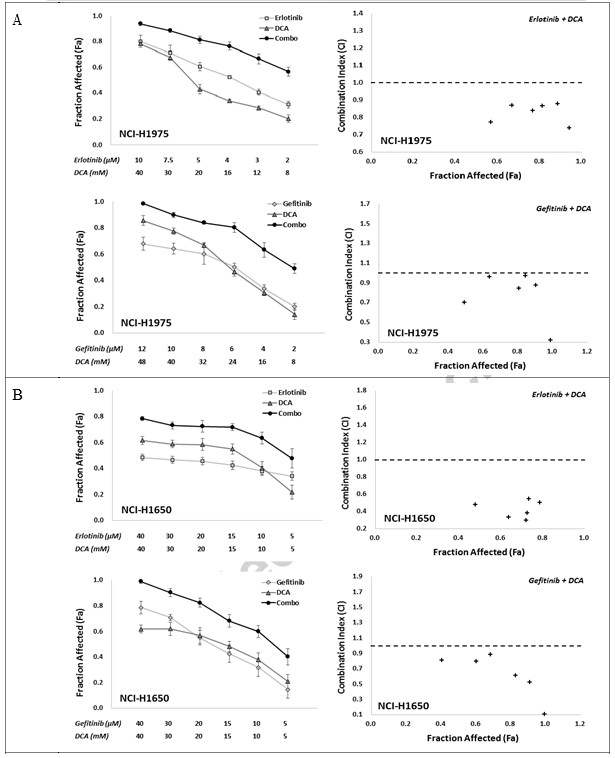
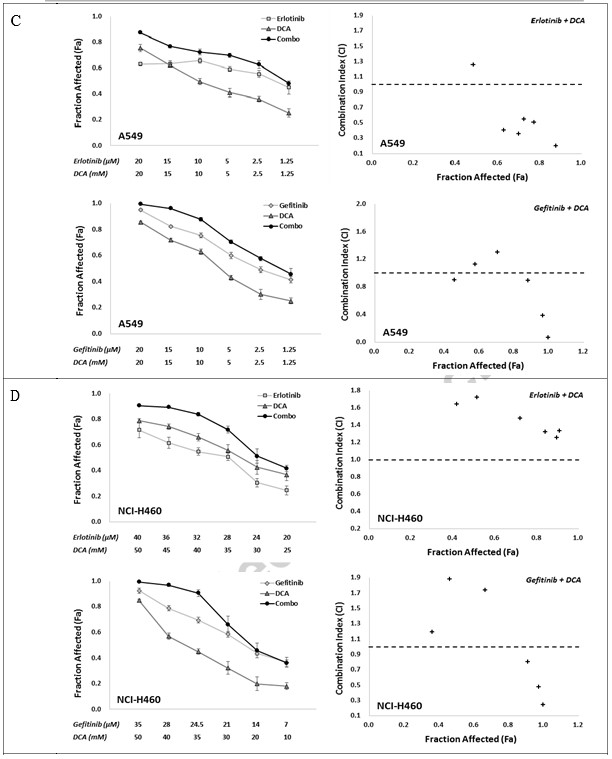
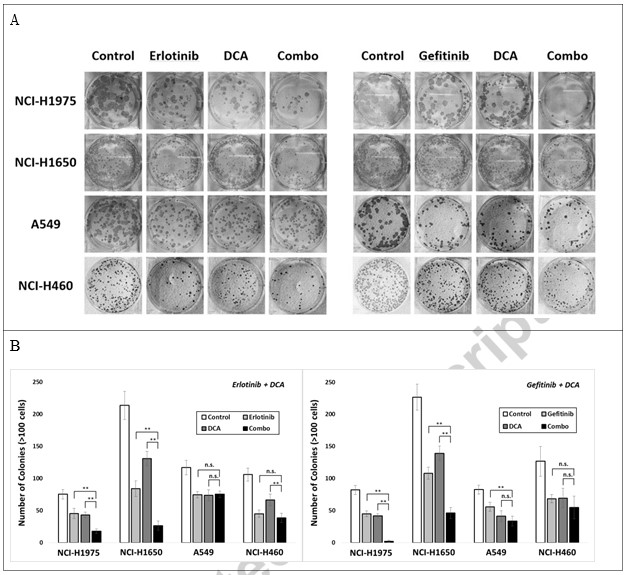
Om verder te onderzoeken of de combinatie de kolonievorming van kankercellen kan afremmen, hebben wij deze vier cellijnen uitgezaaid in 6-wells platen, en behandeld met hetzij Erlotinib, Gefitinib of DCA in concentraties die gedurende 3 dagen ongeveer 40% kolonies remmen, hetzij met hun combinaties. 15 dagen na het uitzetten van de cellen werden kolonies met meer dan 100 cellen geteld; de gegevens zijn weergegeven in Fig. 3. Combinatiebehandeling van Erlotinib met DCA onderdrukte de kolonievorming aanzienlijk in NCI-H1975 en NCI-H1650, maar niet in A549 en NCI-H460, hetgeen erop wijst dat de combinatiestrategie mogelijk alleen werkt in NCI-H1975 en NCI-H1650, de EGFR-mutant NSCLC-cellen.
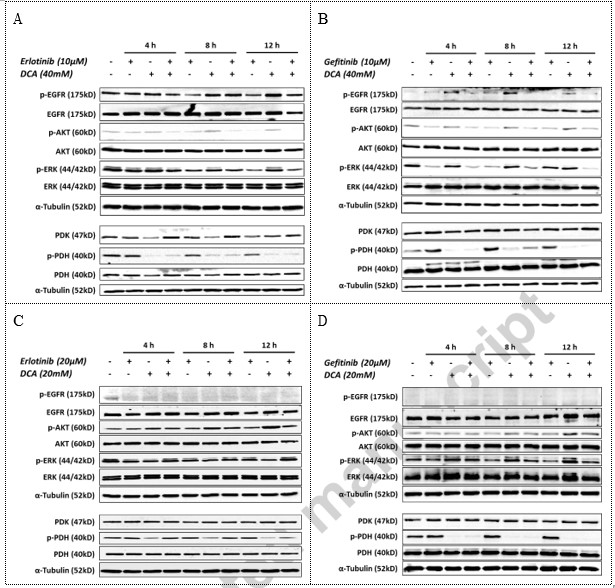
Erlotinib/Gefitinib en DCA werkten onafhankelijk in hun gerichte signaalwegen in NCI-H1975-cellijn
Om het mogelijke effect van de combinatie in signaalwegen te onderzoeken, voerden wij western blotting analyses uit om de relevante fosforyleringsgebeurtenissen in NCI-H1975 en A549 NSCLC-cellen op bepaalde tijdstippen tijdens de behandeling met het combinatiegeneesmiddel te bestuderen. Zoals getoond in Fig. 4, onderdrukten Erlotinib of Gefitinib in de NCI-H1975 EGFR-mutantcellijn het niveau van gefosforyleerd EGFR en gefosforyleerd AKT en gefosforyleerd ERK1/2, twee belangrijke eiwitten die zich in de downstream van EGFR-signalering bevinden, maar verminderden zij het niveau van gefosforyleerd PDH niet. DCA daarentegen remde de PDH-fosforylering aanzienlijk, maar verminderde niet het niveau van gefosforyleerde sleuteleiwitten in EGFR-signalering in NCI-H1975 (Fig. 4A en B). In A549 EGFR wild type NSCLC cellen hadden Erlotinib en Gefitinib echter geen invloed op de downstream signalering van EGFR, bv. de gefosforyleerde AKT en gefosforyleerd ERK, terwijl DCA de gefosforyleerde PDH aanzienlijk verminderde (Fig. 4C en D). Interessant genoeg leek het erop dat DCA AKT kan activeren door verhoging van het fosforyleringsniveau in de tijd in beide onafhankelijke studies (Fig. 4C en D). Deze gegevens suggereerden dat Erlotinib en DCA onafhankelijk werkten op hun respectieve signaalweg.
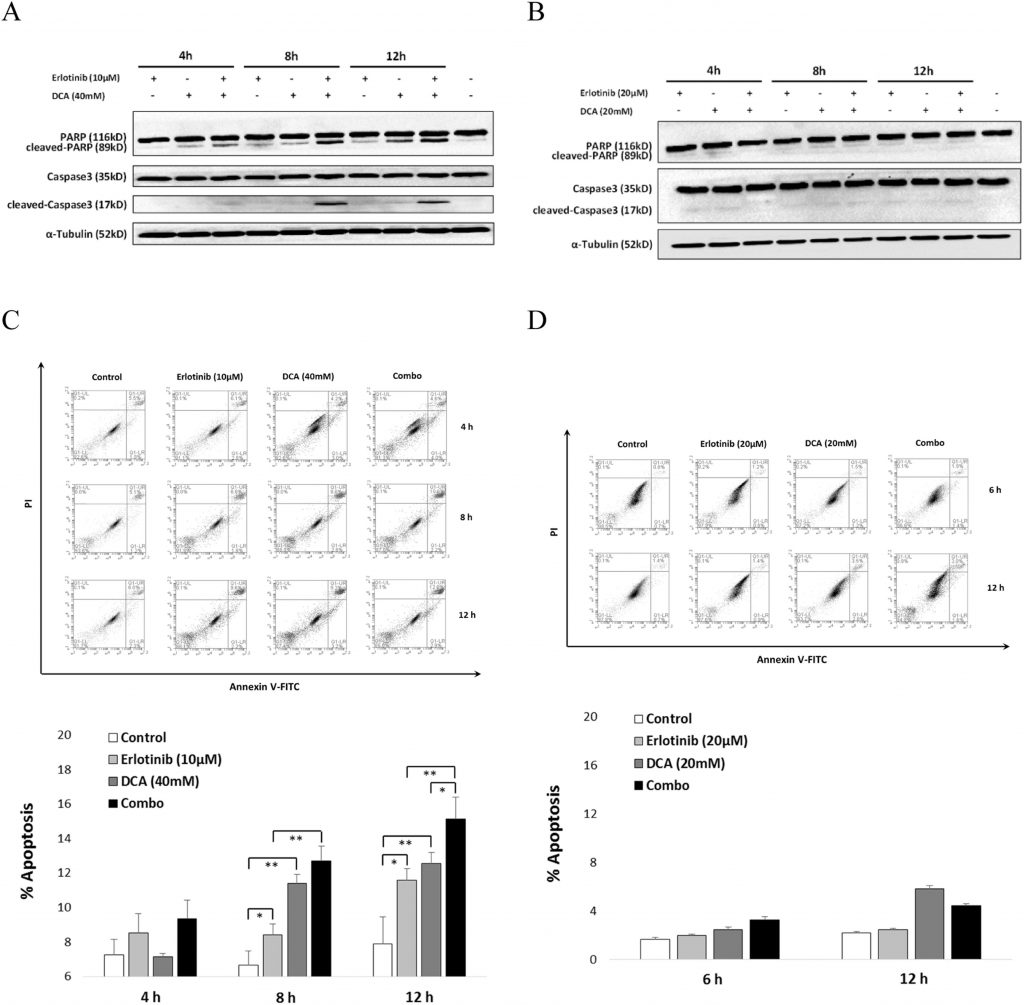
Combinatie van Erlotinib en DCA verbeterde de celapoptose aanzienlijk in NCI-H1975, maar niet in A549
Om het synergetische effect van Erlotinib en DCA op de levensvatbaarheid van de cellen te verklaren, onderzochten we of ze gezamenlijk de celapoptose bevorderden. Zoals getoond in Fig. 5, toonden western blotting resultaten aan dat de combinatie leidde tot significante activering van Caspase3 en zijn substraat, gesplitst PARP, na 8 uur behandeling in NCI-H1975 (Fig. 5A), terwijl geen duidelijke activering van Caspase3 of PARP werd waargenomen in A549 (Fig. 5B). Verdere FACS-analyse toonde aan dat Erlotinib in combinatie met DCA een relevant groter deel van de NCI-H1975-celapoptose aanzienlijk bevorderde dan elke verbinding afzonderlijk nadat de cellen gedurende 12 uur waren behandeld (fig. 5C), terwijl de combinatie er niet in slaagde celapoptose in A549-cel te induceren, hetzij in elk van de mono-gebruiken, hetzij op gecombineerde wijze (fig. 5D). Deze resultaten gaven aan dat de combinatie van Erotinib en DCA de celapoptose-inductie alleen in NCI-H1975, de EGFR-mutantcellen, maar niet in A549, het EGFR-wild-type NSCLC-cellen, kan stimuleren.
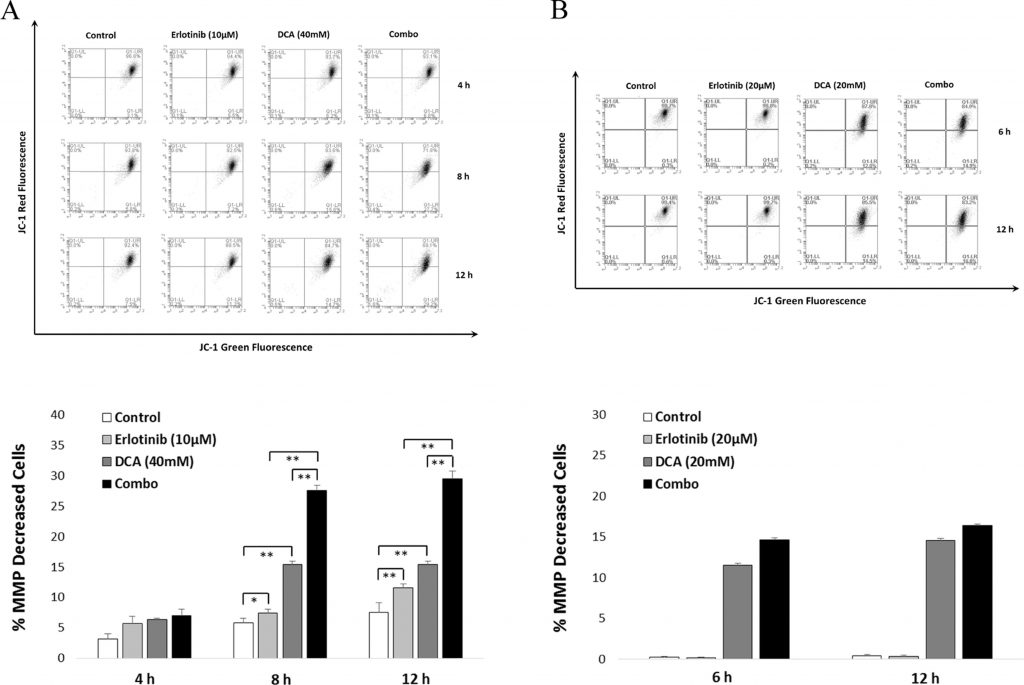
MMP significant afgenomen bij combistrategie dan bij monotherapie in NCI-H1975
Om het significante effect van de combinatiebehandeling op celapoptose verder te bevestigen, gebruikten wij JC-1 assay om te bepalen of de behandeling kan leiden tot een afname van MMP, een van de kenmerken van celapoptose. Zoals blijkt uit fig. 6, waren de FACS-gegevens in overeenstemming met de in punt 3.4 beschreven resultaten van de celapoptose. Te zien is dat de combinatie een significante afname van MMP liet zien na zowel 8 als 12 uur behandeling in vergelijking met de monotoepassing van Erlotinib of DCA in NCI-H1975 cellen (zie fig. 6A). Voor A549 cellen kan de MMP-daling alleen worden vastgesteld wanneer DCA werd toegepast (zie fig. 6B).
Bespreking
Om onze hypothese te testen dat de combinatie van EGFR-remmers met PDK-remmer, DCA, synergetisch kankerbestrijdend zou kunnen werken in NSCLC-cellen, pasten wij de MTT-test toe om de levensvatbaarheid van de cellen te evalueren. De resultaten van dit onderzoek kwamen goed overeen met de hypothese. In het bijzonder hebben wij aangetoond dat EGFR-remmers (Erlotinib of Gefitinib) samen met DCA de levensvatbaarheid van NCI-H1975 en NCI-H1650 cellen synergetisch verminderden met alle CI-waarden <1 bij verschillende dosisniveaus van de samengestelde combinaties, alsmede de vorming van kankercellen aanzienlijk verminderden (Fig. 2, Fig. 3). Ondertussen waren deze synergetische effecten niet zichtbaar in A549 of NCI-H460 cellijnen (EGFR wild type NSCLC cellijnen), hetgeen erop wijst dat de combinatiestrategie waarschijnlijk alleen in NSCLC’s met een EGFR-mutatie de celprogressie op synergetische wijze onderdrukt.
Velpula et al. (2013) rapporteerden dat toediening van Erlotinib of Gefitinib zowel het expressieniveau van p-EGFR als PDK1 in U251 en 5310 verminderde, terwijl toepassing van DCA in deze twee cellen ook de expressie van p-EGFR en PDK1 verminderde. Het is aannemelijk dat het gecombineerde effect van EGFR- en PDK-remmers kan worden toegeschreven aan de co-suppressie van ofwel EGFR ofwel PDK-signalering. Met dit idee in gedachten hebben wij western blotting analyses uitgevoerd om de veranderingen op eiwitniveau in deze twee signaalwegen te evalueren. Gebleken is dat zowel Erlotinib als Gefitinib de fosforylering van EGFR en de fosforylering van twee van zijn klassieke downstream-signaaleiwitten, namelijk AKT en ERK, remden. Ondertussen, hoewel PDK-remmer DCA de PDK1-expressie licht verminderde, werd de fosforylering van PDH, een sleutelenzym dat verantwoordelijk is voor het omzetten van pyruvaat in Acetyl-CoA voor de citroenzuurcyclus in plaats van het opstarten van glycolyse (Kankotia en Stacpoole, 2014), aanzienlijk onderdrukt wanneer DCA werd toegepast (Fig. 4). Blijkbaar werkten Erlotinib/Gefitinib en DCA noch op een crosstalk manier, noch op een additief remmend effect op elkaars signalering in NCI-H1975 cellen. Onze gegevens suggereerden dat het synergetische anti-kanker effect van de combinatiebehandeling van geneesmiddelen in NCI-H1975 niet uitsluitend afhankelijk is van EGFR of PDK signaalwegen.
Om andere mogelijke mechanismen van het combinatie-effect te vinden, hebben wij onze aandacht gericht op de inductie van apoptose. Er werd gemeld dat Erlotinib in staat is om NCI-H1975 celapoptose te induceren (Nie et al., 2015), en DCA zorgde ook voor celapoptose in verschillende kankercellen (Madhok et al., 2010, Wong et al., 2008). Omdat de splitsing van Caspase3 en zijn doelsplitsubstraat PARP twee elementen zijn die betrokken zijn bij celapoptose (Zhang et al., 2015), onderzochten we eerst het activeringsniveau van Caspase3 en PARP in NCI-H1975 bij behandeling met zowel Erlotinib of DCA alleen als de combinatie. Onze resultaten suggereerden dat gekloofd PARP van 89 kDa op een tijdsafhankelijke manier toenam wanneer Erlotinib of DCA alleen werden behandeld. Belangrijk is dat de combinatiebehandeling een significant hogere activiteit van PARP liet zien in vergelijking met alleen toegepaste verbindingen. De expressie van gesplitst Caspase3 op 17 kDa, die een piek bereikte bij 8 uur, vertoonde een sterke toename wanneer de NCI-H1975-cel werd behandeld met de combinatie van Erlotinib en DCA (fig. 5A). Deze resultaten gaven aan dat het combinatie-effect waarschijnlijk het gevolg was van het additieve effect bij de bevordering van celapoptose. Dit wordt verder bevestigd door flowcytometrie-analyse van Annexine-V en PI dubbelgekleurde cel. Deze waarnemingen waren consistent met de analyse van de activering van Caspase3 en PARP, waarbij de combinatiebehandeling leidde tot een matige maar duidelijke inductie van celapoptose wanneer de NCI-H1975-cel gedurende 12 uur werd behandeld in vergelijking met de toepassing van Erlotinib of DCA alleen (fig. 5B). In A549 cellijn werden echter noch geactiveerde Caspase3/PARP noch synergetische inductie van celapoptose waargenomen (Fig. 5A en B), hetgeen suggereert dat de bevordering van apoptose het mogelijke mechanisme zou kunnen zijn voor het gecombineerde effect van Erlotinib en DCA op EGFR-mutant NSCLC-cellen.
Het proces van celapoptose kan worden onderverdeeld in een reeks stadia, zoals de verandering van de celmorfologie, verlies van mitochondriaal membraanpotentieel, wijziging van de permeabiliteit, fragmentatie van het DNA, enzovoort (Fiandalo en Kyprianou, 2012). Afname van MMP werd door verschillende studies gerapporteerd als het gevolg van DCA behandeling in kankercellen (Emadi et al., 2015). Eerdere studies hebben aangetoond dat Erlotinib leidde tot het verlies van MMP in NSCLC’s (Qian et al., 2009). Om te onderzoeken of de combinatie de MMP in NCI-H1975 significant kan beïnvloeden, gebruikten we mitoprobe JC-1 assay om het niveau van MMP na behandeling met Erlotinib, DCA of de combinatie te evalueren. Zoals getoond in fig. 6, leidde de combinatie tot een significante afname van MMP na 8 en 12 uur behandeling in NCI-H1975-cellen (maar niet in A549-cellen), wat suggereert dat het combinatie-effect van geïnduceerde celapoptose samenhangt met de depolarisatie van het mitochondriale membraanpotentieel.
Samenvattend hebben wij aangetoond dat het gecombineerde gebruik van EGFR-remmer, namelijk Erlotinib of Gefitinib, en PDK-remmer, DCA, een synergetisch anti-kanker effect vertoonde in NCI-H1975 en NCI-H1650 cellen. Gezamenlijke bevordering van celapoptose is geïdentificeerd als een van de waarschijnlijke mechanismen van het combinatie-effect. Met name de gecombineerde toepassing van Erlotinib en DCA activeerde niet alleen Caspase3 en PARP, maar verminderde ook MMP aanzienlijk. Bovendien gaven onze resultaten aan dat het combinatie-effect mogelijk alleen optreedt bij NSCLC-cellen met EGFR-mutaties. In ons laboratorium worden verdere evaluaties uitgevoerd om deze waarneming in meer NSCLC-cellijnen te bevestigen.
Belangenverstrengeling
De auteurs verklaren geen belangenconflict te hebben voor dit artikel.
Rol van de financieringsbron
Dit werk werd ondersteund door het Science and Technology Development Fund, Macao S.A.R (FDCT) (Project reference no. 086/2014/A2) en de Universiteit van Macau (Grant no. MRG021-TKY-2015-FHS).
Erkenningen
Wij danken de financiële steun van het Science and Technology Development Fund, Macao S.A.R (FDCT) (Project reference no. 086/2014/A2) en de Universiteit van Macau (Grant no. MRG021-TKY-2015-FHS). Wij danken Prof. Thomas Y.C. Leung (PolyU, HK) voor monsters van NCI-H460 cellen. Dank is verschuldigd aan Dr Xiaohui Hu voor nuttige discussie en proeflezen van het manuscript.
VERWIJZINGEN
1 Butler et al., 2013 E.B. Butler, Y. Zhao, C. Muñoz-Pinedo, J. Lu, M. Tan De motor van resistentie stoppen: gericht op kankermetabolisme om therapeutische resistentie te overwinnen Cancer Res., 73 (2013), pp. 2709-27172 Chou en Talalay, 1984 T.C. Chou, P. Talalay Kwantitatieve analyse van dosis-effect relaties: de gecombineerde effecten van meerdere geneesmiddelen of enzymremmers Adv. Enzym. Regul., 22 (1984), pp. 27-55
3 Dutta en Maity, 2007 P.R. Dutta, A. Maity Cellulaire reacties op EGFR-remmers en hun relevantie voor kankertherapie Cancer Lett., 254 (2007), pp. 165-177
4 Emadi et al., 2015 A. Emadi, M. Sadowska, B. Carter-Cooper, V. Bhatnagar, I. van der Merwe, M.J. Levis, E.A. Sausville, R.G. Lapidus Verstoring van de cellulaire oxidatieve toestand geïnduceerd door dichlooracetaat en arseentrioxide voor de behandeling van acute myeloïde leukemie Leuk. Res., 39 (2015), pp. 719-729
5 Fiandalo en Kyprianou, 2012 M.V. Fiandalo, N. Kyprianou Caspase controle: protagonisten van kankercel apoptose Exp. Oncol., 34 (2012), pp. 165-175
6 Garon et al., 2014 E.B. Garon, H.R. Christofk, W. Hosmer, C.D. Britten, A. Bahng, M.J. Crabtree, C.S. Hong, N. Kamranpour, S. Pitts, F. Kabbinavar, C. Patel, E. von Euw, A. Black, E.D. Michelakis, S.M. Dubinett, D.J. Slamon Dichlooracetaat moet worden overwogen in combinatie met op platina gebaseerde chemotherapie bij hypoxische tumoren in plaats van als afzonderlijk middel bij gevorderde niet-kleincellige longkanker J. Cancer Res. Clin. Oncol., 140 (2014), pp. 443-452
7 Hanahan en Weinberg, 2011 D. Hanahan, R.A. Weinberg Kenmerken van kanker: de volgende generatie Cell, 144 (2011), pp. 646-674
8 Jemal et al., 2011 A. Jemal, F. Bray, M.M. Center, J. Ferlay, E. Ward, D. Forman Wereldwijde statistieken over kanker CA: Cancer J. Clin., 61 (2011), pp. 69-90
9 Kankotia en Stacpoole, 2014 S. Kankotia, P.W. Stacpoole Dichlooracetaat en kanker: nieuw thuis voor een weesgeneesmiddel? Biochim. Biophys. Acta, 1846 (2014), pp. 617-629
10 Ke et al., 2015 E.E. Ke, Q. Zhou, Y.L. Wu Opkomende paradigma’s in gerichte behandelingen voor Aziatische patiënten met NSCLC Expert Opin. Pharmacother, 16 (2015), pp. 1167-1176
11 Lu et al., 2015 J. Lu, M. Tan, Q. Cai Het Warburg-effect in tumorprogressie: mitochondriaal oxidatief metabolisme als anti-metastasemechanisme Cancer Lett., 356 (2015), pp. 156-164
12 Madhok et al., 2010 B.M. Madhok, S. Yeluri, S.L. Perry, T.A. Hughes, D.G. Jayne Dichlooracetaat induceert apoptose en celcyclusstilstand in colorectale kankercellen Br. J. Cancer, 102 (2010), pp. 1746-1752
13 Maione e.a., 2015 P. Maione, P.C. Sacco, A. Sgambato, F. Casaluce, A. Rossi, C. Gridelli Het overwinnen van resistentie tegen gerichte therapieën in NSCLC: huidige benaderingen en klinische toepassing Ther. Adv. Med. Oncol., 7 (2015), pp. 263-273
14 Ngo et al., 2015 H. Ngo, S.M. Tortorella, K. Ververis, T.C. Karagiannis Het Warburg-effect: moleculaire aspecten en therapeutische mogelijkheden Mol. Biol. Rep., 42 (2015), pp. 825-834
15 Nie et al., 2015 P. Nie, W. Hu, T. Zhang, Y. Yang, B. Hou, Z. Zou Synergetische inductie van erlotinib-gemedieerde apoptose door resveratrol in menselijke niet-kleincellige longkankercellen door down-regulatie van survivin en up-regulatie van PUMA Cell Physiol. Biochem., 35 (2015), pp. 2255-2271
16 Olszewski et al., 2010 U. Olszewski, T.T. Poulsen, E. Ulsperger, H.S. Poulsen, K. Geissler, G. Hamilton In vitro cytotoxiciteit van combinaties van dichlooracetaat met platinaverbindingen tegen kanker Clin. Pharmacol., 2 (2010), pp. 177-183
17 Pao en Chmielecki, 2010 W. Pao, J. Chmielecki Rationele, biologisch onderbouwde behandeling van EGFR-mutante niet-kleincellige longkanker Nat. Rev. Cancer, 10 (2010), pp. 760-774
18 Qian e.a., 2009 X. Qian, J. Li, J. Ding, Z. Wang, W. Zhang, G. Hu Erlotinib activeert mitochondriale doodswegen gerelateerd aan de productie van reactieve zuurstofspecies in de menselijke niet-kleincellige longkankercellijn A549 Clin. Exp. Pharmacol. Physiol., 36 (2009), pp. 487-494
19 Schiller et al., 2002 J.H. Schiller, D. Harrington, C.P. Belani, C. Langer, A. Sandler, J. Krook, J. Zhu, D.H. Johnson Vergelijking van vier chemotherapieregimes voor gevorderde niet-kleincellige longkanker N. Engl. J. Med., 346 (2002), blz. 92-98
20 Velpula e.a., 2013 K.K. Velpula, A. Bhasin, S. Asuthkar, A.J. Tsung Gecombineerde targeting van PDK1 en EGFR leidt tot regressie van glioblastoom door omkering van het Warburg-effect Cancer Res., 73 (2013), pp. 7277-7289
21 Wong e.a., 2008 J.Y. Wong, G.S. Huggins, M. Debidda, N.C. Munshi, I. De Vivo Dichlooracetaat induceert apoptose in endometriumkankercellen Gynecol. Oncol., 109 (2008), pp. 394-402
22 Yan et al., 2015 H. Yan, H. Li, Q. Li, P. Zhao, W. Wang, B. Cao De werkzaamheid van synchrone combinatie van chemotherapie en EGFR TKI’s voor de eerstelijns behandeling van NSCLC: een systematische analyse PLoS One, 10 (2015), p. e0135829
23 Zhang e.a., 2015 L. Zhang, F. Dai, P.L. Sheng, Z.Q. Chen, Q.P. Xu, Y.Q. Guo Resveratrol-analoog 3,4,4′-trihydroxy-trans-stilbeen induceert apoptose en autofagie in menselijke niet-kleincellige longkankercellen in vitro Acta Pharmacol. Sin., 36 (2015), pp. 1256-1265
Gerelateerde inhoud: