Zheng Yang1, Kin Y. Tam1
1 Facoltà di Scienze della Salute, Università di Macao, Taipa, Macao, Cina.
Corrispondenza: Kin Y. Tam
Facoltà di Scienze della Salute, Università di Macao, Taipa, Macao, Cina
Tel.: +853-88224988
Fax: +853-88222314.
Email: [email protected]
Ricevuto: 15 aprile 2016
Rivisto: 27 luglio 2016
Accettato: 2 agosto 2016
Abstract
La glicolisi è stata osservata come un processo predominante per la maggior parte delle cellule tumorali per utilizzare il glucosio, che è stato indicato come “Effetto Warburg”. Il targeting di enzimi critici, come la piruvato deidrogenasi chinasi (PDK) che regola inversamente il processo di glicolisi, potrebbe essere un approccio promettente da utilizzare da solo o in combinazione con altri trattamenti per la terapia del cancro. Gli inibitori dell’EGFR per il trattamento del carcinoma polmonare non a piccole cellule (NSCLC) sono stati applicati per decenni nella pratica clinica con grande successo, ma anche i loro benefici clinici sono stati in qualche modo ostacolati dalla crescente resistenza acquisita. La terapia farmacologica di combinazione è una strategia efficace per affrontare questa sfida. In questo studio abbiamo utilizzato il dicloroacetato (DCA), un inibitore PDK ampiamente considerato, insieme a Erlotinib e Gefitinib, due noti inibitori dell’EGFR, e abbiamo dimostrato che l’applicazione di DCA in combinazione con Erlotinib o Gefitinib ha attenuato significativamente la vitalità delle cellule NSCLC mutanti per l’EGFR (NCI-H1975 e NCI-H1650) in modo sinergico. Questo risultato sinergico sembra essere un effetto combinato nella promozione dell’apoptosi, piuttosto che una co-suppressione delle vie di segnalazione di EGFR o PDK. Inoltre, abbiamo dimostrato che il trattamento combinato non ha mostrato un effetto sinergico in altre linee cellulari di NSCLC senza mutazioni dell’EGFR (A549 o NCI-H460). L’insieme di queste osservazioni ha suggerito che il targeting combinato di EGFR e PDK nelle cellule NSCLC ha esercitato effetti sinergici in modo dipendente dalla mutazione di EGFR.
Parole chiave: Piruvato deidrogenasi chinasi; dicloroacetato; recettore del fattore di crescita epidermico; Erlotinib; Gefitinib; combinazione di farmaci
Copyright © 2016 Elsevier B.V. Tutti i diritti riservati.
INTRODUZIONE
Secondo le ultime statistiche, il tumore del polmone è al primo posto tra i maschi e al quinto posto tra le femmine per quanto riguarda i casi di cancro di nuova diagnosi e i decessi correlati al cancro in tutto il mondo (Jemal et al., 2011), con oltre l’80% dei pazienti che rientrano nella categoria del tumore del polmone non a piccole cellule, o NSCLC (Ke et al., 2015). Le strategie tradizionali per il trattamento del NSCLC ricorrevano spesso a chemioterapie con applicazione singola o combinata di sostanze chimiche a base di platino o altre sostanze citotossiche. Tuttavia, i tassi di risposta oggettiva di queste strategie erano solitamente insoddisfacenti, con una sopravvivenza globale mediana solitamente inferiore a 1 anno (Schiller et al., 2002, Pao e Chmielecki, 2010).
La mutazione EGFR è stata riscontrata in circa il 30% dei pazienti affetti da NSCLC, che spesso hanno risposto bene alla terapia mirata (Pao e Chmielecki, 2010). Ciò ha reso possibile un’ampia applicazione di piccoli inibitori molecolari della tirosin-chinasi dell’EGFR (EGFR-TKis), che hanno mostrato un enorme successo negli ultimi decenni (Hanahan e Weinberg, 2011), come esemplificato da Erlotinib e Gefitinib (Duttae Maity, 2007). Tuttavia, la resistenza acquisita si è solitamente verificata quando i pazienti sono stati trattati con inibitori dell’EGFR, con diversi meccanismi identificati, come la mutazione hot spot T790M originaria o indotta, l’attivazione di segnali secondari come l’amplificazione di MET o la mutazione di PI3K, o il conferimento della transizione da epiteliale a mesenchimale (EMT) (Maione et al., 2015). Purtroppo, l’applicazione combinata degli inibitori dell’EGFR con i chemioterapici ha portato a un aumento degli effetti avversi, piuttosto che al beneficio atteso di estendere la sopravvivenza globale degli oggetti trattati (Yan et al., 2015).
Il metabolismo delle cellule tumorali è un campo emergente basato sulla scoperta e sull’indagine di oltre mezzo secolo sull'”Effetto Warburg” (Ngo et al., 2015), secondo cui le cellule tumorali tendono a metabolizzare il glucosio attraverso la glicolisi, invece della fosforilazione ossidativa, per generare energia (Lu et al., 2015). Questo fenomeno ha spinto molti studi a concentrarsi sugli enzimi chiave del metabolismo del glucosio, come i trasportatori del glucosio (GLUT), l’esochinasi2 (HK2), la piruvato chinasi M2 (PKM2), la piruvato deidrogenasi chinasi (PDK), la lattato deidrogenasi-A (LDHA) e la glutaminasi, portando allo sviluppo di diversi inibitori che mirano a enzimi specifici per la terapia antitumorale (Butler et al., 2013). Come inibitore della PDK, il dicloroacetato (DCA) può attenuare la progressione del cancro in molti tipi diversi di tumori attraverso la down-regolazione della fosforilazione della piruvato deidrogenasi (p-PDH), controllata dalla PDK (Kankotia e Stacpoole, 2014). Sebbene siano stati riportati diversi studi di combinazione che hanno riguardato l’applicazione del DCA per il trattamento del NSCLC, la maggior parte di essi si è concentrata sulla chemioterapia citotossica classica, ovvero sull’uso combinato di DCA e farmaci a base di platino (Garon et al., 2014, Olszewski et al., 2010). Non è ancora noto se la combinazione di DCA con EGFR-TKi nei NSCLC mutati in EGFR possa esercitare un effetto sinergico sulla terapia antitumorale.
In questo studio abbiamo dimostrato che l’applicazione combinata di inibitori dell’EGFR (Erlotinib o Gefitinib) con il DCA ha inibito sinergicamente la crescita delle cellule NCI-H1975 e NCI-H1650. Inoltre, abbiamo esplorato i possibili meccanismi degli effetti combinati degli inibitori di EGFR e PDK. Abbiamo scoperto che queste combinazioni possono mostrare sinergia solo in NCI-H1975 e NCI-H460, linee cellulari NSCLC mutanti per EGFR, ma non in A549 o NCI-H460, linee cellulari NSCLC EGFR wild type.
Materiali e metodi
Linee cellulari e reagenti
Le linee cellulariNSCLCNCI-H1975, NCI-H1650 e A549 sono state acquistate dall’ATCC, mentre NCI-H460 è stata gentilmente donata dal Prof. Thomas Y.C. Leung (Dipartimento di Biologia Applicata e Tecnologia Chimica, Facoltà di Scienze Applicate e Tessili, Università Politecnica di Hong Kong). Le cellule A549 sono state coltivate in F-12K/DMEM 1:1 (Gibco), mentre le altre linee cellulari sono state mantenute in RPMI 1640 (Gibco), con un supplemento di 10% di siero fetale bovino (Gibco), in un’atmosfera umidificata con il 5% diCO2 a 37°C.
Il DCA è stato acquistato da Sigma e disciolto nell’1% di DMSO in PBS come soluzione madre (1,6 M), che è stata poi diluita a varie concentrazioni per formare le soluzioni operative finali contenenti lo 0,1% di DMSO in tutto il terreno di coltura per il trattamento delle cellule. Erlotinib e Gefitinib, entrambi di SelleckChem, sono stati inizialmente disciolti in DMSO (Sigma) per formare la soluzione madre con una concentrazione di 160 mM, e diluiti alla singola concentrazione del terreno di lavoro come quella del DCA. Gli anticorpi primari, tra cui p-PDH e PDH (Abcam), sono stati prodotti da Cell Signaling Technology. α-Tubulina è stata ottenuta da Invitrogen.
Saggio di vitalità cellulare
La vitalità cellulare di ogni singola cellula trattata o non trattata dopo il tempo di trattamento indicato è stata valutata mediante il saggio MTT. In breve, le singole cellule di ogni linea cellulare sono state seminate in piastre da 96 pozzetti 24 ore prima del caricamento dei composti. Dopo il periodo di tempo indicato (24 h, 48 h e 72 h, rispettivamente), i terreni di coltura con i composti sono stati scartati e sono stati aggiunti 100 μl di terreno intero fresco contenente 0,5 mg/ml di MTT (3-(4,5-dimetil-2-tiazolil)-2,5-difenil-2-H-tetrazolio bromuro, Sigma). Dopo 4 ore di incubazione a 37 °C, il solvente è stato rimosso e 100 μl di DMSO sono stati aggiunti a ciascun pozzetto, con l’aiuto di una leggera agitazione per dissolvere i cristalli di formazan. Il valore della D.O. di ciascun pozzetto è stato misurato a 570 nm mediante SpectraMax M5 Microplate Reader (Molecular Devices).
Calcolo dell’indice di combinazione (CI)
Il valore CI è stato registrato per la valutazione sinergica della vitalità cellulare tra la combinazione e ciascuno dei singoli gruppi, calcolato in funzione della frazione di cellule tumorali colpite (Fa) sulla base dell’equazione di Chou-Talalay (Chou e Talalay, 1984): CI=(D)1/(Dx)1+(D)2/(Dx)2, dove (D)1 e (D)2 indicano le dosi applicate per ottenere una risposta necessaria in combinazione e (Dx) si riferisce alle dosi di farmaco individuali necessarie per ottenere una risposta simile. Le analisi dei valori di CI sono state eseguite utilizzando il software CalcuSyn (Biosoft), con CI<1, CI=1 e CI>1 che indicano rispettivamente effetti sinergici, additivi e antagonistici.
Saggio di formazione di colonie
Tutte le quattro linee cellulari di NSCLC sono state seminate in piastre a 6 pozzetti, ogni pozzetto conteneva 200-800 cellule in 2 ml di terreno. I terreni con i singoli composti o in combinazione sono stati aggiunti 24 ore dopo l’inoculo delle cellule per un trattamento continuo di 3 giorni, quindi sostituiti da terreni privi di farmaci ogni 3 giorni. 15 giorni dopo l’impianto delle cellule, le colonie cellulari sono state fissate in etanolo al 95% per 15 minuti, colorate con cristalvioletto allo 0,1% (Sigma) e asciugate. Le colonie con più di 100 cellule sono state contate come positive.
Saggio di Western blotting
Entrambe le cellule NCI-H1975 e A549 sono state seminate in piastre a 6 pozzetti e trattate con mezzi contenenti il monocomposto o la combinazione per periodi di tempo definiti. Le cellule trattate sono state incubate in un tampone per lisato cellulare (Cell Signaling Technology) agitando delicatamente per 15 minuti, quindi centrifugate a 12.000 rpm/min a 4 °C per altri 15 minuti. La concentrazione proteica di ciascun campione nel surnatante è stata valutata con Pierce® BCA Protein Assay Kit (Thermo) e bilanciata allo stesso livello, seguita da una denaturazione proteica di 8 minuti con tampone di caricamento SDS a 100 °C. Le proteine del campione sono state separate mediante elettroforesi SDS-PAGE, trasferite su membrana filtrante in nitrocellulosa (Whatman), bloccate in latte senza grassi al 5% per 2 ore, ventilate con gli anticorpi primari desiderati per una notte, seguite da IgG secondarie HRP-linked anti-rabbit o anti-mouse (Cell Signaling Technology) per 2 ore. Le membrane sono state infine scansionate in un Chemidoc® MP Imaging System (Bio-Rad) dopo 2 minuti di incubazione con Clarity Western ECL Substrate (Bio-Rad).
Saggio di citometria a flusso
Le celluleNCI-H1975e A549 sono state seminate e trattate come descritto nella sezione precedente. Le cellule trattate sono state staccate dal fondo delle piastre con Trypsin-EDTA (Gibco) e lavate con PBS per due volte. I rilevamenti apoptotici sono stati eseguiti utilizzando il FITC Annexin-V Apoptotic Detection Kit (Biolegend). In breve, i campioni cellulari raccolti sono stati sospesi in 500 μl di tampone di legame contenente 5 μl di Annexin V-FITC e 10 μl di Ioduro di Propidio (PI) per 15 minuti prima dell’analisi FACS su un citometro a flusso Accuri C6 (BD). I campioni di cellule per la misurazione del potenziale di membrana mitocondriale (MMP) sono stati incubati in 1 ml di terreno intero contenente 2 μM di JC-1 (5,5,6,6-tetracloro-1,1,3,3-tetraetilbenzimidazolecarcocianina ioduro, Sigma) per 15 minuti, seguiti da un lavaggio e una risospensione in PBS per l’analisi FACS.
Analisi statistica
Tutti i dati sono stati presentati come media±S.D. L’IC50 dei singoli composti al punto temporale indicato è stata eseguita con GraphPad 5.1 (Prism). I confronti statistici tra i diversi gruppi di campioni sono stati eseguiti con Excel 2010 utilizzando il test t di Student. Un valore P inferiore a 0,05 è stato considerato statisticamente significativo.
Risultati
Erlotinib, Gefitinib e DCA hanno attenuato la proliferazione cellulare nelle linee cellulari NSCLC NCI-H1975 e A549
Abbiamo cercato di determinare gli effetti anti-proliferazione cellulare in vitro dei tre composti selezionati nelle linee cellulari NSCLC NCI-H1975, NCI-H1650, A549 e NCI-H460. Le cellule sono state trattate con serie decrescenti di 2 volte di ciascun composto per 24 ore, 48 ore o 72 ore, rispettivamente. La vitalità cellulare è stata valutata con il saggio MTT. Come mostrato nella Fig. 1, Erlotinib, Gefitinib o DCA hanno portato a una riduzione significativa della vitalità cellulare in tutte e quattro le linee cellulari in modo dipendente dalla dose e dal tempo. Si può notare che la variabilità dei dati in IC50 sembra essere inferiore a 72 ore per la maggior parte delle linee cellulari (vedi Tabella 1). Di conseguenza, abbiamo scelto 72 ore come punto finale per il trattamento di combinazione.
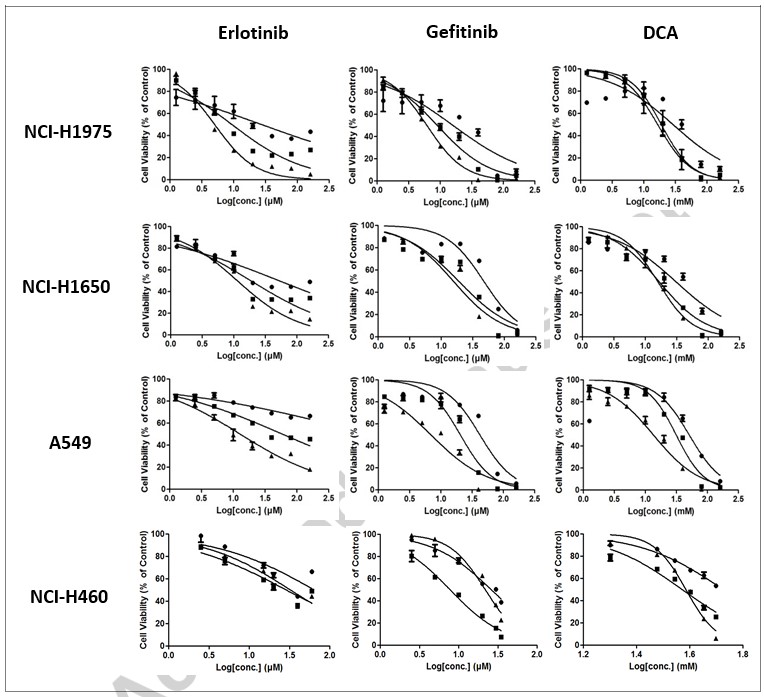
| NCI-H1975 | NCI-H1650 | A549 | NCI-H460 | ||
| Erlotinib (μM) | 24 h | 27.33±15.06 | 52.69±0.80 | N/D | N/D |
| 48 h | 9.45±1.48 | 18.67±0.66 | 59.66±3.06 | 28.72±3.29 | |
| 72 h | 5.04±0.01 | 11.42±0.10 | 13.14±3.70 | 32.66±3.32 | |
| Gefitinib (μM) | 24 h | 16.22±8.37 | 47.30±3.98 | 41.96±3.38 | 26.19±1.98 |
| 48 h | 9.09±1.91 | 18.97±0.62 | 20.66±2.95 | 7.74±0.37 | |
| 72 h | 6.15±0.18 | 15.61±1.15 | 6.97±0.22 | 21.86±0.09 | |
| DCA (mM) | 24 h | 29.51±3.25 | 31.09±4.10 | 50.25±6.89 | N/D |
| 48 h | 19.56±6.31 | 16.84±4.53 | 31.35±1.00 | 37.26±0.47 | |
| 72 h | 16.60±4.46 | 15.81±0.26 | 13.55±2.32 | 38.47±0.35 |
Lestrategie combinate hanno soppresso la vitalità cellulare in modo sinergico e inibito la formazione di colonie in modo significativo in NCI-H1975 e NCI-H1650, ma non hanno funzionato altrettanto bene in A549 e NCI-H460
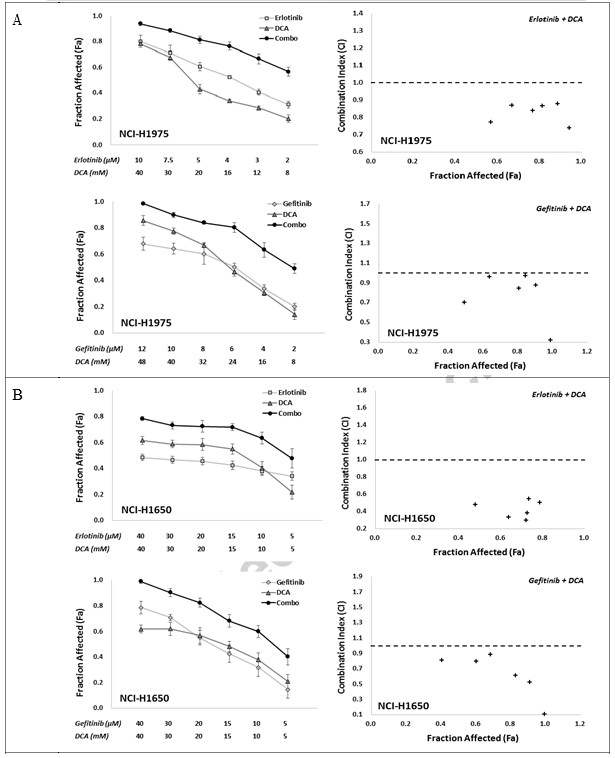
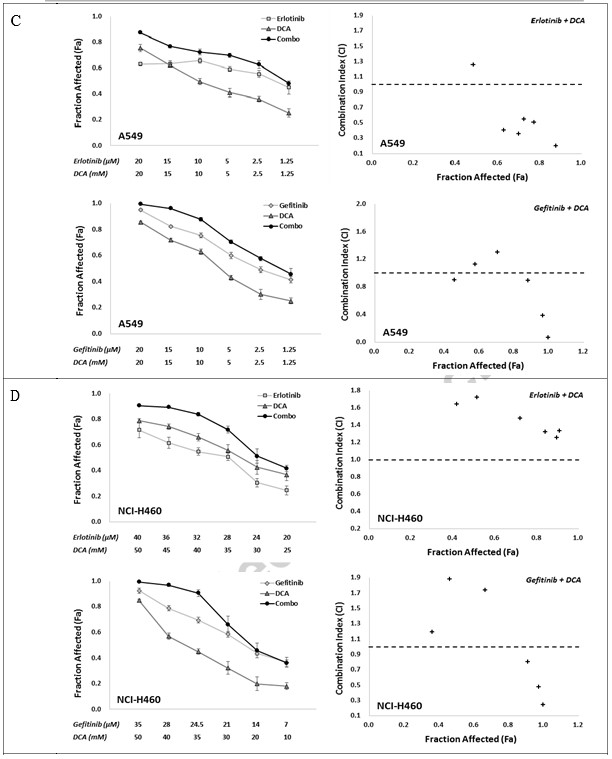
Per determinare la risposta sinergica in vitro alla combinazione di inibitori dell’EGFR con DCA, abbiamo utilizzato due strategie combinate, vale a dire Erlotinib con DCA e Gefitinib con DCA, con sei singoli punti di concentrazione di trattamento per ciascun composto, che hanno conferito una vitalità anticellulare compresa tra circa IC80 e IC20 in un rapporto fisso. Gli effetti della combinazione sono stati valutati utilizzando il saggio MTT. Come mostrato nella Fig. 2, entrambe le combinazioni, Erlotinib con DCA e Gefitinib con DCA, hanno mostrato una chiara sinergia nelle linee cellulari NCI-H1975 e NCI-H1650, dove i valori di IC in tutti i gruppi combinati erano inferiori a 1 (Fig. 2A e B). Per le linee cellulari A549 e NCI-H460, sebbene tutti i gruppi di combinazione in due strategie abbiano mostrato un valore Fa elevato rispetto alle loro applicazioni singole, i valori CI di alcuni gruppi di combinazione erano superiori a 1 (Fig. 2C e D), suggerendo che le strategie di combinazione in A549 e NCI-H460 non hanno funzionato bene come in NCI-H1975 e NCI-H1650.
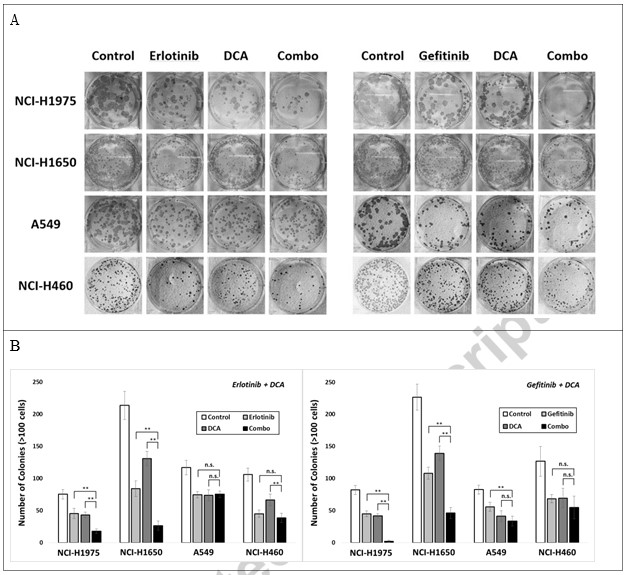
Per verificare se la combinazione può attenuare la formazione di colonie di cellule tumorali, abbiamo seminato le quattro linee cellulari in piastre a 6 pozzetti e le abbiamo trattate con Erlotinib, Gefitinib o DCA a concentrazioni che raggiungono circa il 40% di inibizione delle colonie per 3 giorni, o con le loro combinazioni. 15 giorni dopo l’impianto delle cellule, sono state contate le colonie con più di 100 cellule, i cui dati sono riportati nella Fig. 3. Il trattamento combinato di Erlotinib con DCA ha represso significativamente la formazione di colonie in NCI-H1975 e NCI-H1650, ma non in A549 e NCI-H460, indicando che la strategia di combinazione può funzionare solo in NCI-H1975 e NCI-H1650, le cellule NSCLC mutanti EGFR.
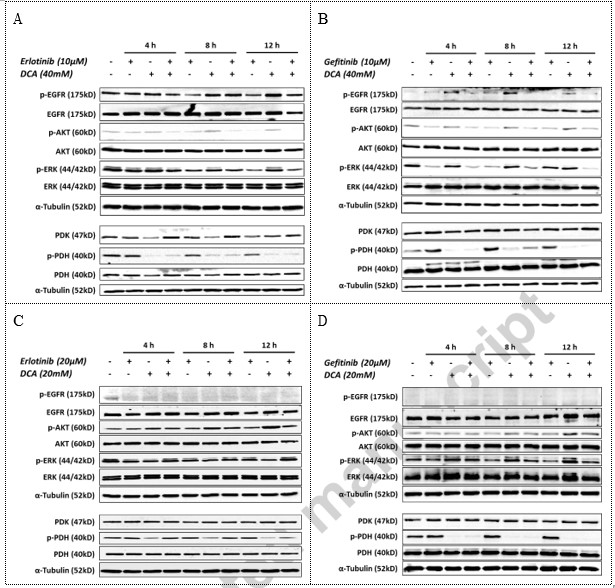
Erlotinib/Gefitinib e DCA hanno agito indipendentemente nelle loro vie di segnalazione mirate nella linea cellulare NCI-H1975
Per indagare il possibile effetto della combinazione nelle vie di segnalazione, abbiamo eseguito un’analisi di western blotting per studiare gli eventi di fosforilazione rilevanti nelle cellule NSCLC NCI-H1975 e A549 in punti temporali definiti durante il trattamento farmacologico combinato. Come mostrato nella Fig. 4, nella linea cellulare NCI-H1975 mutante EGFR, Erlotinib o Gefitinib hanno soppresso il livello di EGFR fosforilato, AKT fosforilato e ERK1/2 fosforilato, due proteine chiave che si trovano a valle della segnalazione di EGFR, ma non hanno diminuito il livello di PDH fosforilato. Il DCA, invece, ha inibito significativamente la fosforilazione della PDH, ma non è riuscito a diminuire il livello di proteine chiave fosforilate nella segnalazione dell’EGFR in NCI-H1975 (Fig. 4A e B). Tuttavia, nelle cellule NSCLC A549 EGFR wild type, Erlotinib e Gefitinib non hanno influenzato la segnalazione a valle dell’EGFR, ad esempio l’AKT fosforilato e l’ERK fosforilato, mentre il DCA ha attenuato significativamente la PDH fosforilata (Fig. 4C e D). È interessante notare che il DCA può attivare AKT attraverso un aumento del suo livello di fosforilazione nel tempo in entrambi gli studi indipendenti (Fig. 4C e D). Questi dati suggeriscono che Erlotinib e DCA agiscono in modo indipendente sulle rispettive vie di segnalazione.
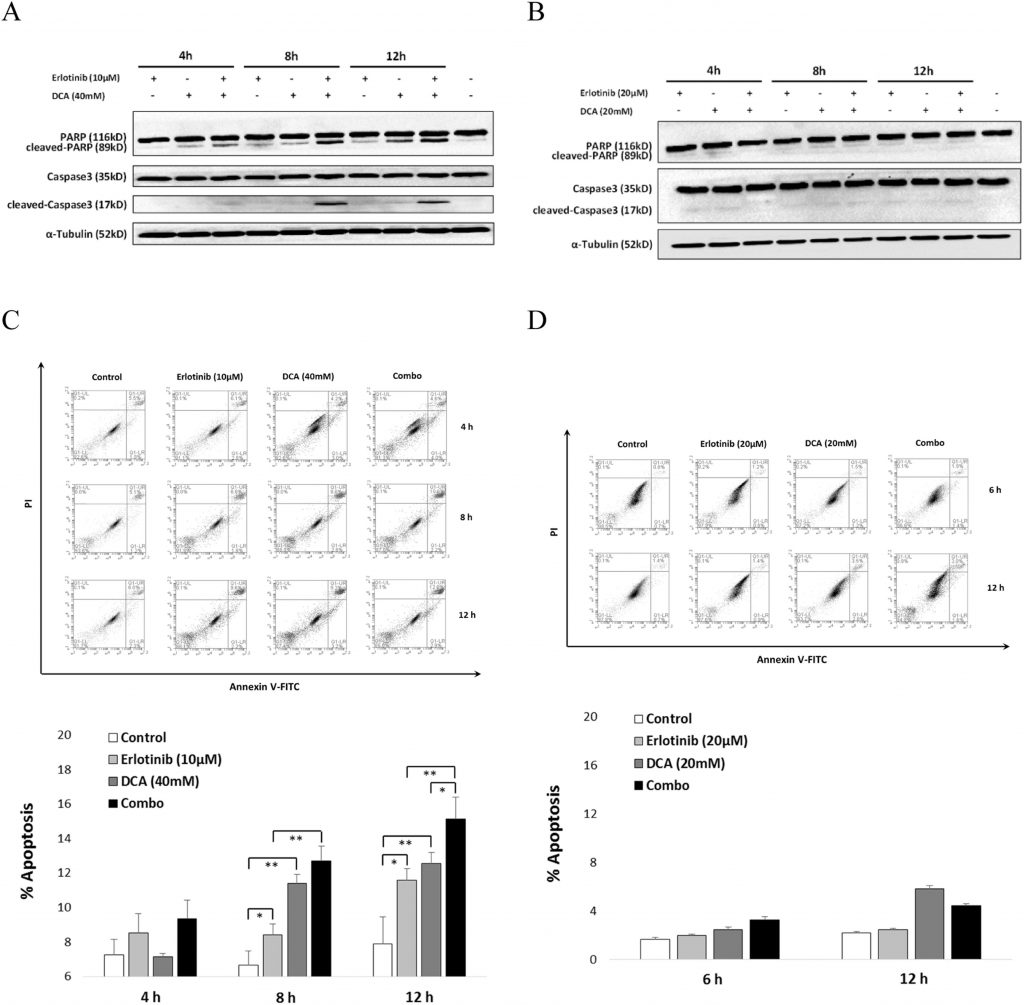
Lacombinazione di Erlotinib e DCA ha aumentato significativamente l’apoptosi cellulare in NCI-H1975, ma non in A549
Per spiegare l’effetto sinergico di Erlotinib e DCA sulla vitalità cellulare, abbiamo esaminato se essi promuovessero congiuntamente l’apoptosi cellulare. Come mostrato nella Fig. 5, i risultati del western blotting hanno dimostrato che la combinazione ha portato a una significativa attivazione della Caspasi3 e del suo substrato, la PARP clivata, dopo 8 ore di trattamento in NCI-H1975 (Fig. 5A), mentre non è stata osservata alcuna evidente attivazione della Caspasi3 o della PARP in A549 (Fig. 5B). Ulteriori analisi FACS hanno mostrato che Erlotinib combinato con DCA ha promosso una porzione significativamente maggiore di apoptosi delle cellule NCI-H1975 rispetto a ciascun composto da solo, dopo che le cellule sono state trattate per 12 ore (Fig. 5C), mentre la combinazione non è riuscita a indurre l’apoptosi cellulare nelle cellule A549 né in ciascun uso singolo né in modo combinato (Fig. 5D). Questi risultati indicano che la combinazione di Erotinib e DCA è in grado di stimolare l’induzione apoptotica delle cellule solo nelle cellule NSCLC NCI-H1975, mutanti dell’EGFR, ma non nelle cellule NSCLC A549, che presentano un EGFR wild type.
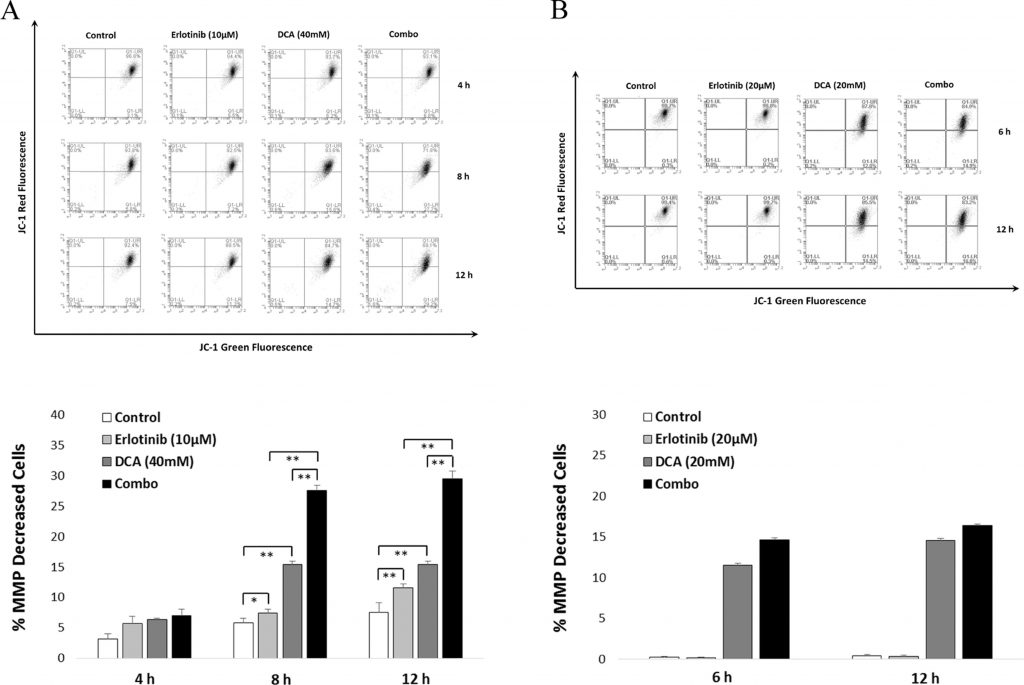
LaMMP è diminuita significativamente con la strategia combinata rispetto alla monoterapia in NCI-H1975
Per confermare ulteriormente l’effetto significativo del trattamento combinato sull’apoptosi cellulare, abbiamo utilizzato il saggio JC-1 per determinare se il trattamento può portare a una diminuzione della MMP, uno dei segni distintivi dell’apoptosi cellulare. Come mostrato nella Fig. 6, i dati FACS sono coerenti con i risultati dell’apoptosi cellulare illustrati nella sezione 3.4. Si può notare che la combinazione ha dimostrato di essere in grado di ridurre la MMP, un segno distintivo dell’apoptosi cellulare. Si può notare che la combinazione ha dimostrato una diminuzione significativa della MMP dopo un trattamento di 8 e 12 ore rispetto alla mono-applicazione di Erlotinib o DCA nelle cellule NCI-H1975 (vedi Fig. 6A). Per le cellule A549, la diminuzione della MMP è stata rilevata solo quando è stato applicato il DCA (vedi Fig. 6B).
Discussione
Per verificare la nostra ipotesi che la combinazione di inibitori dell’EGFR con l’inibitore della PDK, DCA, possa esercitare un effetto antitumorale sinergico nelle cellule di NSCLC, abbiamo applicato il saggio MTT per valutare la vitalità cellulare. I risultati ottenuti da questo studio sono stati in buon accordo con le ipotesi. In particolare, abbiamo dimostrato che gli inibitori dell’EGFR (Erlotinib o Gefitinib) insieme al DCA hanno attenuato in modo sinergico la vitalità delle cellule NCI-H1975 e NCI-H1650 con tutti i valori di IC <1 a diversi livelli di dose delle combinazioni di composti e hanno ridotto significativamente la formazione di colonie di cellule tumorali (Fig. 2, Fig. 3). Nel frattempo, questi effetti sinergici non si sono manifestati nelle linee cellulari A549 o NCI-H460 (linee cellulari NSCLC EGFR wild type), indicando che la strategia di combinazione probabilmente sopprime la progressione cellulare in modo sinergico solo nei NSCLC portatori di mutazioni EGFR.
Velpula et al. (2013) hanno riportato che la somministrazione di Erlotinib o Gefitinib ha attenuato il livello di espressione di p-EGFR e PDK1 in U251 e 5310, mentre l’applicazione di DCA in queste due cellule ha ridotto l’espressione di p-EGFR e PDK1. È plausibile che l’effetto combinato degli inibitori di EGFR e PDK possa essere attribuito alla co-suppressione della segnalazione di EGFR o PDK. Tenendo presente questo concetto, abbiamo effettuato un’analisi di western blotting per valutare le alterazioni a livello proteico di queste due vie di segnalazione. È stato dimostrato che sia Erlotinib che Gefitinib inibiscono la fosforilazione di EGFR e la fosforilazione di due delle sue classiche proteine di segnalazione a valle, ovvero AKT ed ERK. Nel frattempo, sebbene l’inibitore PDK DCA abbia attenuato leggermente l’espressione di PDK1, la fosforilazione di PDH, un enzima chiave responsabile della conversione del piruvato in Acetil-CoA per il ciclo dell’acido citrico invece di avviare la glicolisi (Kankotia e Stacpoole, 2014), è stata significativamente soppressa quando è stato applicato DCA (Fig. 4). Apparentemente, Erlotinib/Gefitinib e DCA non hanno agito né in maniera crosstalk né con un effetto inibitorio additivo sulla segnalazione reciproca nelle cellule NCI-H1975. I nostri dati suggeriscono che l’effetto antitumorale sinergico della combinazione di farmaci in NCI-H1975 non dipende esclusivamente dalle vie di segnalazione di EGFR o PDK.
Per individuare altri possibili meccanismi dell’effetto combinato, abbiamo rivolto la nostra attenzione all’induzione dell’apoptosi. È stato riportato che Erlotinib è in grado di indurre l’apoptosi delle cellule NCI-H1975 (Nie et al., 2015) e anche il DCA ha conferito l’apoptosi cellulare in diverse cellule tumorali (Madhok et al., 2010, Wong et al., 2008). Poiché il clivaggio della Caspasi3 e del suo substrato di clivaggio PARP sono due elementi coinvolti nell’apoptosi cellulare (Zhang et al., 2015), abbiamo innanzitutto esaminato il livello di attivazione della Caspasi3 e del PARP nelle cellule NCI-H1975 trattate con Erlotinib o DCA da soli e in combinazione. I nostri risultati hanno suggerito che la PARP clivata di 89 kDa è aumentata in modo tempo-dipendente quando Erlotinib o DCA sono stati trattati da soli. È importante notare che il trattamento combinato ha mostrato un’attività di PARP significativamente più elevata rispetto ai composti applicati da soli. L’espressione della Caspasi3 clivata a 17 kDa, che ha raggiunto il picco a 8 ore, ha presentato un forte aumento quando le cellule NCI-H1975 sono state trattate con la combinazione di Erlotinib e DCA (Fig. 5A). Questi risultati indicano che l’effetto della combinazione è probabilmente dovuto all’effetto additivo nel promuovere l’apoptosi cellulare. Ciò è stato ulteriormente confermato dall’analisi in citometria a flusso delle cellule colorate con Annexin-V e PI. Queste osservazioni sono coerenti con l’analisi dell’attivazione di Caspasi3 e PARP, in cui il trattamento combinato ha portato a un’induzione moderata ma distinguibile dell’apoptosi cellulare quando le cellule NCI-H1975 sono state trattate per 12 ore rispetto all’applicazione di Erlotinib o DCA da soli (Fig. 5B). Tuttavia, nella linea cellulare A549 non sono state osservate né l’attivazione della Caspasi3/PARP né l’induzione sinergica dell’apoptosi cellulare (Fig. 5A e B), suggerendo che la promozione dell’apoptosi potrebbe essere il possibile meccanismo dell’effetto combinato di Erlotinib e DCA sulle cellule NSCLC mutanti per EGFR.
Il processo di apoptosi cellulare potrebbe essere suddiviso in una serie di fasi, come il cambiamento della morfologia cellulare, la perdita del potenziale di membrana mitocondriale, l’alterazione della permeabilità, la frammentazione del DNA e così via (Fiandalo e Kyprianou, 2012). La diminuzione delle MMP è stata riportata da diversi studi come conseguenza del trattamento con DCA nelle cellule tumorali (Emadi et al., 2015). Studi precedenti hanno dimostrato che Erlotinib ha portato alla perdita di MMP nei NSCLC (Qian et al., 2009). Per verificare se la combinazione può influenzare significativamente la MMP in NCI-H1975, abbiamo sfruttato il saggio mitoprobe JC-1 per valutare il livello di MMP dopo il trattamento con Erlotinib, DCA o la combinazione. Come mostrato nella Fig. 6, la combinazione ha portato a una diminuzione significativa della MMP dopo 8 e 12 ore di trattamento nelle cellule NCI-H1975 (ma non nelle cellule A549), suggerendo che l’effetto della combinazione di apoptosi cellulare indotta è associato alla depolarizzazione del potenziale di membrana mitocondriale.
In sintesi, abbiamo dimostrato che l’uso combinato di un inibitore dell’EGFR, Erlotinib o Gefitinib, e di un inibitore della PDK, DCA, ha mostrato un effetto antitumorale sinergico nelle cellule NCI-H1975 e NCI-H1650. La promozione collaborativa dell’apoptosi cellulare è stata identificata come uno dei probabili meccanismi dell’effetto combinato. In particolare, l’applicazione combinata di Erlotinib e DCA non solo ha attivato la Caspasi3 e la PARP, ma ha anche ridotto significativamente la MMP. Inoltre, i nostri risultati indicano che l’effetto della combinazione potrebbe essere evidente solo nelle cellule NSCLC con mutazioni EGFR. Nel nostro laboratorio sono in corso ulteriori valutazioni per confermare questa osservazione in altre linee cellulari di NSCLC.
Conflitto di interessi
Gli autori non dichiarano alcun conflitto di interessi per questo articolo.
Ruolo della fonte di finanziamento
Questo lavoro è stato sostenuto dal Fondo per lo sviluppo della scienza e della tecnologia, Macao S.A.R (FDCT) (progetto di riferimento n. 086/2014/A2) e dall’Università di Macao (sovvenzione n. MRG021-TKY-2015-FHS).
Ringraziamenti
Si ringrazia il sostegno finanziario del Fondo per lo sviluppo della scienza e della tecnologia, Macao S.A.R (FDCT) (progetto di riferimento n. 086/2014/A2) e dell’Università di Macao (sovvenzione n. MRG021-TKY-2015-FHS). Si ringrazia il Prof. Thomas Y.C. Leung (PolyU, HK) per i campioni di cellule NCI-H460. Si ringrazia il Dr. Xiaohui Hu per l’utile discussione e la revisione del manoscritto.
RIFERIMENTI
1 Butler et al., 2013 E.B. Butler, Y. Zhao, C. Muñoz-Pinedo, J. Lu, M. Tan Bloccare il motore della resistenza: colpire il metabolismo del cancro per superare la resistenza terapeutica Cancer Res., 73 (2013), pp. 2709-27172 Chou e Talalay, 1984 T.C. Chou, P. Talalay Analisi quantitativa delle relazioni dose-effetto: gli effetti combinati di più farmaci o inibitori enzimatici Adv. Enzym. Regul., 22 (1984), pp. 27-55
3 Dutta e Maity, 2007 P.R. Dutta, A. Maity Risposte cellulari agli inibitori dell’EGFR e loro importanza per la terapia del cancro Cancer Lett., 254 (2007), pp. 165-177
4 Emadi et al., 2015 A. Emadi, M. Sadowska, B. Carter-Cooper, V. Bhatnagar, I. van der Merwe, M.J. Levis, E.A. Sausville, R.G. Lapidus Perturbazione dello stato ossidativo cellulare indotta da dicloroacetato e triossido di arsenico per il trattamento della leucemia mieloide acuta Leuk. Res., 39 (2015), pp. 719-729
5 Fiandalo e Kyprianou, 2012 M.V. Fiandalo, N. Kyprianou Il controllo delle caspasi: protagoniste dell’apoptosi delle cellule tumorali Exp. Oncol., 34 (2012), pp. 165-175
6 Garon et al., 2014 E.B. Garon, H.R. Christofk, W. Hosmer, C.D. Britten, A. Bahng, M.J. Crabtree, C.S. Hong, N. Kamranpour, S. Pitts, F. Kabbinavar, C. Patel, E. von Euw, A. Black, E.D. Michelakis, S.M. Dubinett, D.J. Slamon Il dicloroacetato dovrebbe essere considerato con la chemioterapia a base di platino nei tumori ipossici piuttosto che come agente singolo nel carcinoma polmonare non a piccole cellule avanzato J. Cancer Res. Clin. Oncol., 140 (2014), pp. 443-452
7 Hanahan e Weinberg, 2011 D. Hanahan, R.A. Weinberg I segni distintivi del cancro: la prossima generazione Cell, 144 (2011), pp. 646-674
8 Jemal et al., 2011 A. Jemal, F. Bray, M.M. Center, J. Ferlay, E. Ward, D. Forman Statistiche globali sul cancro CA: Cancer J. Clin., 61 (2011), pp. 69-90
9 Kankotia e Stacpoole, 2014 S. Kankotia, P.W. Stacpoole Dicloroacetato e cancro: nuova casa per un farmaco orfano? Biochim. Biophys. Acta, 1846 (2014), pp. 617-629
10 Ke et al., 2015 E.E. Ke, Q. Zhou, Y.L. Wu Paradigmi emergenti nei trattamenti mirati per i pazienti asiatici con NSCLC Expert Opin. Pharmacother., 16 (2015), pp. 1167-1176
11 Lu et al., 2015 J. Lu, M. Tan, Q. Cai L’effetto Warburg nella progressione tumorale: il metabolismo ossidativo mitocondriale come meccanismo anti-metastasi Cancer Lett., 356 (2015), pp. 156-164
12 Madhok et al., 2010 B.M. Madhok, S. Yeluri, S.L. Perry, T.A. Hughes, D.G. Jayne Il dicloroacetato induce apoptosi e arresto del ciclo cellulare in cellule di cancro del colon-retto Br. J. Cancer, 102 (2010), pp. 1746-1752
13 Maione et al., 2015 P. Maione, P.C. Sacco, A. Sgambato, F. Casaluce, A. Rossi, C. Gridelli Superare la resistenza alle terapie mirate nel NSCLC: approcci attuali e applicazioni cliniche Ther. Adv. Med. Oncol., 7 (2015), pp. 263-273
14 Ngo et al., 2015 H. Ngo, S.M. Tortorella, K. Ververis, T.C. Karagiannis L’effetto Warburg: aspetti molecolari e possibilità terapeutiche Mol. Biol. Rep., 42 (2015), pp. 825-834
15 Nie et al., 2015 P. Nie, W. Hu, T. Zhang, Y. Yang, B. Hou, Z. Zou Induzione sinergica dell’apoptosi mediata da erlotinib da parte del resveratrolo in cellule di carcinoma polmonare umano non a piccole cellule attraverso la down-regolazione di survivin e l’up-regolazione di PUMA Cell Physiol. Biochem., 35 (2015), pp. 2255-2271
16 Olszewski et al., 2010 U. Olszewski, T.T. Poulsen, E. Ulsperger, H.S. Poulsen, K. Geissler, G. Hamilton Citotossicità in vitro di combinazioni di dicloroacetato con composti di platino antitumorali Clin. Pharmacol., 2 (2010), pp. 177-183
17 Pao e Chmielecki, 2010 W. Pao, J. Chmielecki Trattamento razionale e biologicamente basato del carcinoma polmonare non a piccole cellule mutante per EGFR Nat. Rev. Cancer, 10 (2010), pp. 760-774
18 Qian et al., 2009 X. Qian, J. Li, J. Ding, Z. Wang, W. Zhang, G. Hu Erlotinib attiva le vie di morte mitocondriale legate alla produzione di specie reattive dell’ossigeno nella linea cellulare di tumore polmonare umano non a piccole cellule A549 Clin. Exp. Pharmacol. Physiol., 36 (2009), pp. 487-494
19 Schiller et al., 2002 J.H. Schiller, D. Harrington, C.P. Belani, C. Langer, A. Sandler, J. Krook, J. Zhu, D.H. Johnson Confronto tra quattro regimi di chemioterapia per il carcinoma polmonare non a piccole cellule in stadio avanzato N. Engl. J. Med., 346 (2002), pp. 92-98
20 Velpula et al., 2013 K.K. Velpula, A. Bhasin, S. Asuthkar, A.J. Tsung Il bersaglio combinato di PDK1 ed EGFR innesca la regressione del glioblastoma invertendo l’effetto Warburg Cancer Res., 73 (2013), pp. 7277-7289
21 Wong et al., 2008 J.Y. Wong, G.S. Huggins, M. Debidda, N.C. Munshi, I. De Vivo Il dicloroacetato induce apoptosi nelle cellule di cancro dell’endometrio Gynecol. Oncol., 109 (2008), pp. 394-402
22 Yan et al., 2015 H. Yan, H. Li, Q. Li, P. Zhao, W. Wang, B. Cao L’efficacia della combinazione sincrona di chemioterapia ed EGFR TKIs per il trattamento di prima linea del NSCLC: un’analisi sistematica PLoS One, 10 (2015), p. e0135829
23 Zhang et al., 2015 L. Zhang, F. Dai, P.L. Sheng, Z.Q. Chen, Q.P. Xu, Y.Q. Guo L’analogo del resveratrolo 3,4,4′-triidrossi-trans-stilbene induce apoptosi e autofagia in cellule di tumore al polmone umano non a piccole cellule in vitro Acta Pharmacol. Sin., 36 (2015), pp. 1256-1265
Contenuti correlati: