Stephen B. Strum & Örn Adalsteinsson & Richard R. Black & Dmitri Segal & Nancy L. Peress & James Waldenfels
S. B. Strum
International Strategic Cancer Alliance, 538 Granite Street, Ashland, OR 97520, USA
e-mail : [email protected]
S
B. Strum
American Society of Clinical Oncology, 538 Granite Street, Ashland, OR 97520, USA
S. B. Strum
American Urological Association, 538 Granite Street, Ashland, OR 97520, USA
Ö. Adalsteinsson
International Strategic Cancer Alliance, 873 E. Baltimore Pike #333, Kennett Square, PA 19348, USA
e-mail : [email protected]
R. R. Black
Nuclear Medicine and PET Imaging, Radisphere Teleradiology Group, Beachwood, OH 44022, USA
e-mail : [email protected]
D. Segal
Valley Radiology Consultants, Poway, CA 92064, USA
e-mail : [email protected]
N. L. Peress
Life Extension Foundation, 5760 S. Scenic Drive, Sault Sainte Marie, MI 49783, USA
e-mail : [email protected]
J. Waldenfels
Life Extension Foundation, 9114 Steeplebush Court, Annandale, VA 22003-4051, USA
e-mail : [email protected]
Mots-clés : Dichloroacétate . DCA . lymphome non hodgkinien . LNH . TEP . TEP/CT . Glycolyse . Métabolomique . Warburg
Abréviations :
DCA (dichloroacétate)
LNH (lymphome non hodgkinien)
TEP (tomographie par émission de positons)
CT (tomographie informatisée)
FDG (fluorodésoxyglucose)
SUV (valeur de captation standardisée)
mg (milligrammes)
kg (kilogrammes)
R-CHOP (rituximab-Cytoxan,
Hydroxydaunomycine, Oncovin, Prednisone)
Reçu : 27 octobre 2012
Accepté : 23 novembre 2012
Springer Science+Business Media New York 2012
Résumé
La prise de fluorodéoxyglucose par tomographie par émission de positons dans les tumeurs de différents types de cancer démontre le rôle clé du glucose dans la prolifération du cancer. Le dichloroacétate est une molécule à 2 carbones ayant une activité biologique cruciale en altérant la dégradation métabolique du glucose en acide lactique. Des études sur des lignées cellulaires humaines montrent que le dichloroacétate modifie le métabolisme de la cellule cancéreuse, qui passe de la glycolyse à la phosphorylation oxydative, et rétablit ainsi les fonctions mitochondriales qui déclenchent l’apoptose de la cellule cancéreuse. Les rapports sur le dichloroacétate chez les sujets humains sont rares. Les auteurs ont contacté des personnes sur des forums Internet qui avaient rapporté des réponses anticancéreuses exceptionnelles à l’automédication avec le dichloroacétate. Avec leur consentement éclairé, ils ont demandé des dossiers médicaux complets pour documenter la réponse au dichloroacétate, en insistant sur le contexte de la monothérapie avec le dichloroacétate. Sur les dix patients ayant accepté une telle évaluation, un seul répondait aux critères de dossiers cliniques complets ainsi qu’aux rapports de pathologie, d’imagerie et de laboratoire, ainsi qu’au traitement par dichloroacétate en monothérapie. Cette personne fait l’objet du présent rapport. Dans ce rapport de cas d’un homme présentant une rechute documentée après une chimiothérapie de pointe pour un lymphome non hodgkinien, une réponse significative au dichloroacétate est documentée avec une rémission complète, qui se poursuit après 4 ans. Le dichloroacétate semble être une nouvelle thérapie qui mérite d’être étudiée plus avant dans le traitement du cancer.
Contexte
Le profil métabolique des tumeurs malignes a été caractérisé comme étant associé à des adaptations métaboliques visant à utiliser de manière préférentielle les voies impliquées dans la glycolyse (Warburg et al. 1927), ce qui a été appelé dans la littérature récente le phénotype glycolytique du cancer. (Bui et Thompson 2006 ; Fang et al. 2008 ; Gatenby et Gawlinski 2003) Par essence, ce phénotype glycolytique est une adaptation darwinienne dans la mesure où la cellule cancéreuse diminue et sape les voies métaboliques d’oxydation du glucose utilisées par les cellules normales pour la production d’énergie, ainsi que pour l’élimination des cellules tumorales (Fang et al. 2008). Une fonction cellulaire normale cruciale compromise dans la lutte contre le cancer implique la mort cellulaire programmée mitochondriale ou apoptose. Sur la base des observations ci-dessus, des agents qui ciblent le métabolisme tumoral, et plus particulièrement les voies de production d’ATP mitochondriales, font actuellement l’objet d’essais cliniques. Le dichloroacétate (DCA) a été utilisé au cours des 30 dernières années pour traiter l’acidose lactique congénitale, une maladie métabolique rare qui survient principalement chez les enfants et les jeunes adultes. (Berendzen et al. 2006 ; Kuroda et al. 1986 ; Stacpoole et al. 1997, 2008, 2006). L’acidose lactique congénitale est associée à diverses erreurs innées de dysfonctionnement mitochondrial, et près d’un millier de publications médicales évaluées par des pairs portent sur l’utilisation clinique du DCA pour ce trouble. De nombreux autres articles sur divers aspects de la pharmacologie, des effets métaboliques et de la toxicologie du DCA ont également été publiés, mais seule une douzaine d’articles sur le DCA ont trait à son activité anticancéreuse (Bonnet et al. 2007 ; Bui et Thompson 2006 ; Cao et al. 2008 ; Chen et al. 2007 ; Christofk et al. 2008 ; Madhok et al. 2010 ; Michelakis et al. 2010, 2008 ; Vander Heiden 2010 ; Wong et al. 2008), dont beaucoup se limitent à l’évaluation du DCA dans des lignées de cellules tumorales ou dans des modèles animaux non humains (Cao et al. 2008 ; Madhok et al. 2010 ; Wong et al. 2008 ; Sun et al. 2010). Seule la publication de Michelakis et al. (2010) a évalué le DCA chez cinq patients humains atteints de glioblastome multiforme et a présenté quelques indications cliniques de réponse au DCA.
Le DCA a été signalé comme étant un agent anticancéreux efficace in vitro, et provoquant une régression in vivo dans le glioblastome multiforme humain (Michelakis et al. 2010). Il s’agit toutefois du premier rapport d’un patient cancéreux soumis à une monothérapie par DCA avec l’induction d’une rémission complète après une chimiothérapie de pointe par rituximab-CHOP.
Méthodes
Population de patients
Les auteurs SS et OA ont sollicité toutes les personnes qui avaient signalé des réponses anticancéreuses favorables au DCA sur des forums Internet, et leur ont demandé si elles accepteraient de mettre gratuitement à disposition leur dossier médical complet pour une analyse détaillée. Ces personnes ont été informées que le but de l’étude était de vérifier si la monothérapie avec le DCA pouvait être confirmée comme une thérapie anticancéreuse active.
Questions médico-légales
Le sujet de ce rapport de cas a donné son consentement écrit en connaissance de cause pour l’utilisation des données médicales détaillées ainsi que des images radiologiques. Une copie du consentement écrit est disponible pour examen par l’éditeur de ce journal.
Critères d’exclusion des patients
Des copies de toutes les consultations et visites au cabinet, des rapports de pathologie, des études d’imagerie et de laboratoire, des rapports chirurgicaux, des données de radiothérapie et des détails de la chimiothérapie ont été demandées. Sur 10 candidats possibles, 5 ont fourni des dossiers médicaux nettement insuffisants pour permettre une quelconque évaluation de l’efficacité du DCA. Chez 3 autres candidats, un autre traitement avait été commencé juste avant ou peu après le début du DCA. Chez 1 candidat, le DCA n’avait jamais été commencé. L’un des cinq individus dont les dossiers sont insuffisants a été diagnostiqué avec un lymphome non hodgkinien et semble avoir eu une réponse importante à la monothérapie par DCA, mais il n’a malheureusement pas répondu à nos demandes de dossiers médicaux complets. Dans le cas de l’individu restant (TM), le sujet de ce rapport, des dossiers médicaux complets ont été obtenus. Cet individu, décrit dans ce rapport, n’a pas été traité par les auteurs.
Charge financière pour les participants
Pour chaque cas où l’examen initial des dossiers médicaux indiquait une réponse à la monothérapie par DCA, les dossiers médicaux complets ont été demandés, examinés et résumés dans un dossier médical électronique par SS et OA. Dans ces cas, les lames de pathologie diagnostique et/ou les blocs de tissu ont été obtenus et envoyés à un expert en hématopathologie pour un deuxième avis. Les données d’imagerie complètes sous forme de fichiers Dicom ont été obtenues et examinées par le co-auteur RB, un radiologue certifié spécialisé uniquement dans les études TEP et TEP/CT. Grâce à cette approche, une évaluation médicale très détaillée a été réalisée – sans aucun coût pour les participants à cette étude.
Présentation du cas
Le sujet de l’étude, TM, est actuellement un homme de 52 ans qui a été diagnostiqué pour la première fois à l’âge de 46 ans avec un lymphome non hodgkinien (LNH) le 6/1/07. Il s’est présenté fin 2006 avec des antécédents d’herpès zoster, de fièvres de bas grade et de sueurs nocturnes abondantes. Une perte de poids de 50 livres s’est produite au cours des 5 mois suivants, et les diagnostics d’infection des sinus et de tuberculose ont entraîné un traitement avec divers médicaments, dont la ciprofloxacine, la clindamycine, l’INH, la rifampicine, la pyrazimide et d’autres antibiotiques. Une masse de 6,0 cm à l’angle inférieur gauche de la mâchoire a été notée lors de l’évaluation de la médecine interne le 5/1/07 en conjonction avec un niveau de protéine C-réactive de 196, une ESR de 99, un hématocrite de 33,9 mais une LDH normale de 138. Le 7 mai 2007, une IRM du cou a montré de multiples masses dans la glande parotide gauche et de multiples ganglions cervicaux gauches atteignant 2,0 cm avec une extension dans la région supraclaviculaire.
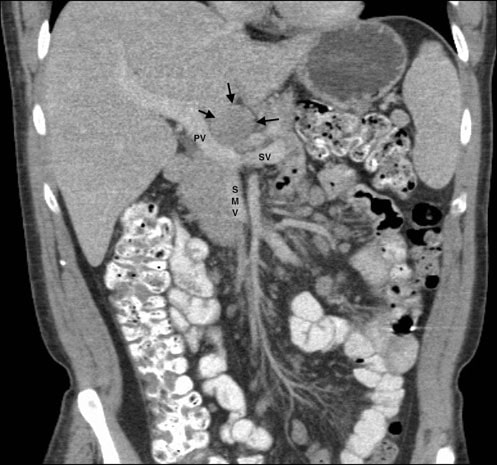
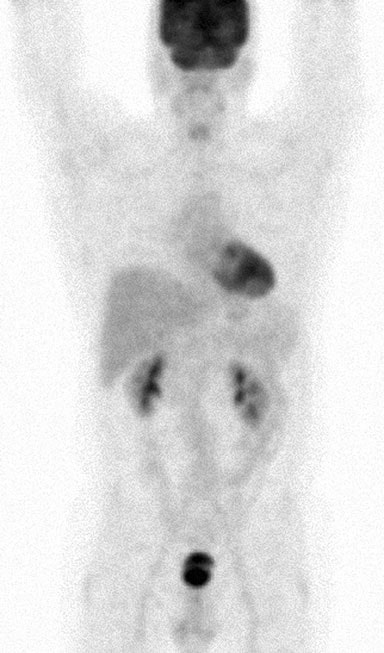
Le 11 mai 2007, une aspiration à l’aiguille fine d’une masse discrète de 3,0 × 3,0 cm dans la glande parotide gauche a été réalisée. Le rapport et les diapositives de cette procédure ont été demandés par les auteurs à plusieurs reprises, mais n’ont jamais été reçus. La tomodensitométrie du thorax, de l’abdomen et du bassin réalisée le 25/5/07 avait révélé une splénomégalie, de multiples masses rénales bilatérales et une lymphadénopathie impliquant des ganglions mésentériques, porta hepatis, rétropéritonéaux et de l’axe cœliaque (Fig. 1). Ces résultats étaient compatibles avec un diagnostic de lymphome de stade IV (> 4 ganglions atteints), avec une anémie et des symptômes systémiques de fièvre, de sueurs nocturnes et de perte de poids, et avec une atteinte extra-nodale d’au moins la glande parotide.
Le 6/1/07, une biopsie excisionnelle de la lésion de la parotide gauche a été réalisée. Le rapport pathologique a indiqué un lymphome non hodgkinien à cellules B, folliculaire et diffus, avec une implication focale de la parotide, et classé comme intermédiaire sur la base de la taille, de la morphologie et de l’indice de prolifération des cellules (CD71). Les études par cytométrie en flux des échantillons de tissus étaient cohérentes avec un lymphome non hodgkinien à cellules B d’origine cellulaire germinale. L’immunohistochimie était positive pour les marqueurs CD3, CD5, CD10, CD20, CD23, CD43, BCL-1 et BCL-2. Les colorations kappa et lambda ont montré une population de cellules B monotypiques lambda exprimant CD10 et représentant 38 % du tissu total.
L’examen physique effectué le 26 juin 2007 par un oncologue médical a révélé une masse parotidienne gauche (6,0 × 5,0 cm), un ganglion jugulodigastrique gauche (4,0 × 4,0 cm), des ganglions cervicaux antérieurs supérieurs gauches (3.0 × 3,0 cm), ganglion jugulodigastrique droit (2,0 × 2,0 cm), ganglions supraclaviculaires droit et gauche (3,0 × 3,0 cm), et ganglions axillaires droit et gauche (2,0 × 3,0 chacun). Il est important de noter que plusieurs médecins examinant TM ont rapporté des mesures nodales significativement différentes de sites anatomiques spécifiques le même jour ou en l’espace de quelques jours.
Une deuxième consultation d’hématopathologie dans un centre médical universitaire le 26 juin 2007 était suspecte d’un lymphome à cellules B de bas grade avec effacement partiel de l’architecture nodale par une infiltration atypique et principalement diffuse de petites cellules lymphoïdes ; une rebiopsie d’un ganglion élargi était recommandée. Une aspiration de la moelle osseuse effectuée le 29 juin 2007 a révélé une moelle normocellulaire avec un grand agrégat lymphoïde non paratrabéculaire, contenant de petits lymphocytes matures. La cytométrie en flux réalisée sur cet échantillon a révélé une population de lymphocytes B clonaux limités à lambda, caractérisée par de petites cellules matures aux contours nucléaires irréguliers. L’expression partielle du CD10 et l’absence d’expression du CD 5 ont permis de poser le diagnostic de lymphome folliculaire à cellules centrales et de lymphome à cellules B de bas grade impliquant la moelle osseuse.
Une TEP au FDG a été réalisée le 7/12/07 et a révélé des anomalies métaboliques dans plusieurs sites ganglionnaires ainsi que dans la zone parotidienne gauche. La valeur de captation normalisée (SUV) a été corrigée par normalisation avec le foie (Wahl et al. 2009) et les résultats sont présentés dans les figures 2 et 3.
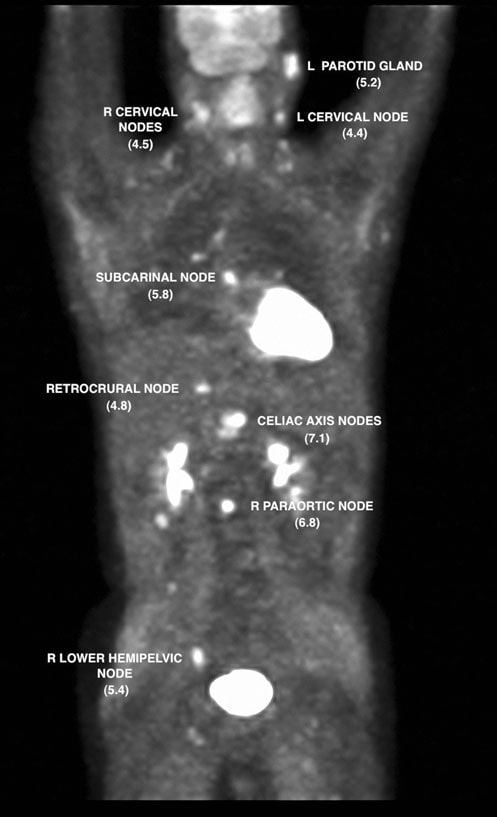
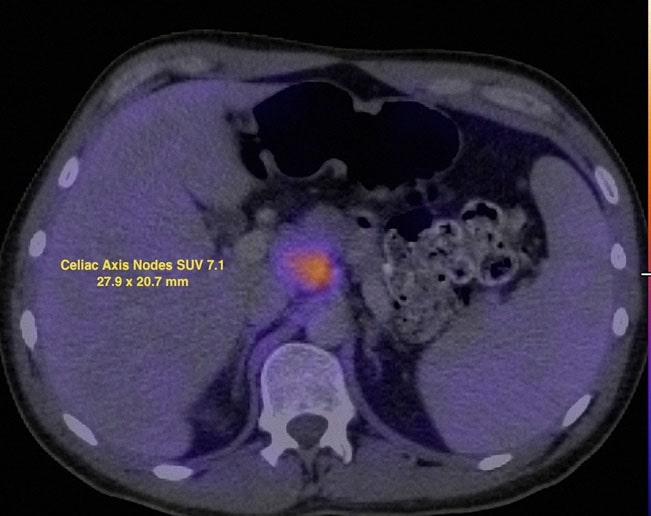
Le 13/07/07, le rituximab-CHOP (R-CHOP) à dose dense a été commencé et répété tous les 14 jours. Les cycles 2 à 6 ont été administrés les 27/7/07, 10/8/07, 24/8/07, 7/9/07 et 21/9/07. Le 10/5/07, un CT du cou, de la poitrine, de l’abdomen et du pelvis a montré une résolution significative de presque toutes les zones d’adénopathie précédentes. Une étude TEP au FDG a été répétée le 8/10/07 et a rapporté une captation focale dans la région suprahilaire R (Fig. 4).
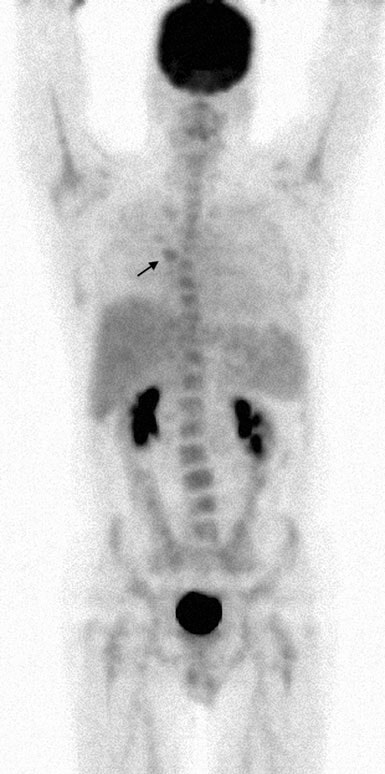
L’examen physique du 9 octobre 2007 a révélé une zone fibrotique résiduelle dans la région cervicale postérieure gauche mesurant 4,0 cm sur 3,0 cm. La TEP au FDG n°3 réalisée le 15/01/08 était tout à fait normale (Fig. 5).
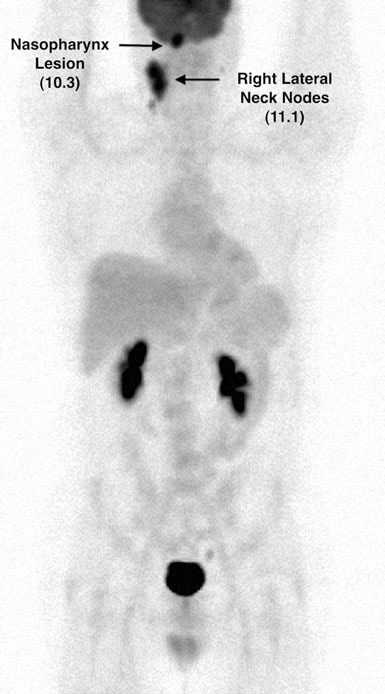
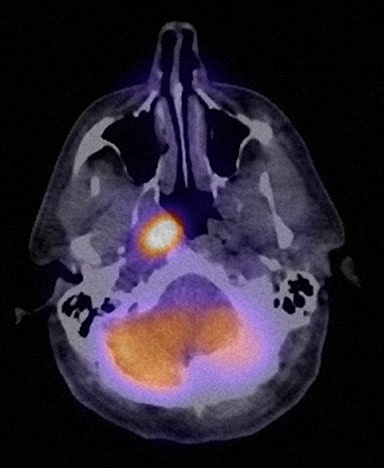
Le patient a été considéré comme étant en rémission complète à partir du 1/08. Une nouvelle TEP au FDG (n° 4) le 4/11/08 est restée normale. Cependant, en 7/08, TM a signalé une perte de poids de 11 livres au cours des deux semaines précédentes, une toux et des sueurs ainsi que des fièvres de faible intensité. Le 7/10/08, un ganglion cervical antérieur droit de 2,0 × 2,0 cm a été découvert à l’examen physique et la TEP-FDG n°5 a été obtenue le 16/08/08. Celle-ci a montré plusieurs nouveaux foyers hypermétaboliques (figures 6 et 7).
Le 9/4/08, TM a été examiné par un chirurgien de la tête et du cou, qui a décrit une grande masse de ganglions matés dans le cou droit aux niveaux I, 2A, 2B et au niveau supérieur 5. Le dossier médical décrit le patient comme étant extrêmement contrarié par les effets secondaires des nausées et des vomissements provoqués par la chimiothérapie antérieure administrée du 13/07 au 21/09/07. À la suite de ses propres recherches, il a décidé de suivre un traitement à base de DCA (dichloroacétate) et de divers suppléments, qu’il a commencé le 10 septembre 2008. Son « protocole DCA » consistait en : DCA 1 000 mg par jour en une seule prise. Le DCA était mélangé à 10 onces de Mountain Dew™ contenant 55 mg de caféine. TM a également utilisé de la vitamine B1 à 500 mg/j (jusqu’au 12/10/08), de l’acide alpha lipoïque 600 mg bid, du thé vert (Jarrow™) 500 mg bid contenant 74 mg d’EGCG et 35 mg de caféine par 500 mg.
Dans les deux semaines suivant le début de ce régime, le patient a signalé une réduction significative des sueurs nocturnes, de la fièvre légère, de l’anorexie et de la fatigue. Un mois après le début du protocole DCA, les ganglions du cou étaient sensiblement plus petits, et à 2 mois, aucun ganglion n’était palpable. Après 71 jours de protocole DCA, tous les symptômes systémiques avaient complètement disparu. TM a signalé un bon niveau d’énergie et un bon appétit, la capacité de bien dormir et aucun effet secondaire.
Une TEP au FDG n°6 a été réalisée le 12/4/08. Toutes les anomalies observées lors de l’examen précédent, le 16 août 2008, avaient disparu. Grâce aux efforts des auteurs SS et OA, une consultation externe d’hématopathologie dans un centre international de cancérologie a été obtenue le 2/11/09. Des coupes colorées à l’hématoxyline et à l’éosine ont montré qu’une glande salivaire était touchée par un infiltrat lymphoïde atypique dense présentant un motif vaguement nodulaire ainsi que diffus. L’infiltrat était composé de petites cellules lymphoïdes B monocytoïdes. Des lésions lymphoépithéliales étaient présentes. D’après la morphologie, le diagnostic différentiel comprenait un lymphome B extra-nodal de la zone marginale (MALToma) ou un lymphome folliculaire à différenciation monocytoïde. Des études d’immunohistochimie (IHC) ont été réalisées sur des lames non colorées et se sont révélées négatives pour BCL-2, CD3, CD43 et la kératine. Une positivité a été observée pour BCL-6 et CD10 dans les zones vaguement nodulaires, CD20, chaînes kappa et lambda dans certains plasmocytes. L’impression finale a été rapportée comme suit : « Bien qu’il n’y ait pas de preuve IHC définitive pour un lymphome, la morphologie, la cytométrie de flux rapportée de cellules B monotypiques lambda, et la découverte moléculaire d’un réarrangement du gène Ig Kappa sont compatibles avec un lymphome à cellules B de bas grade, qui ne peut pas être classé davantage. »
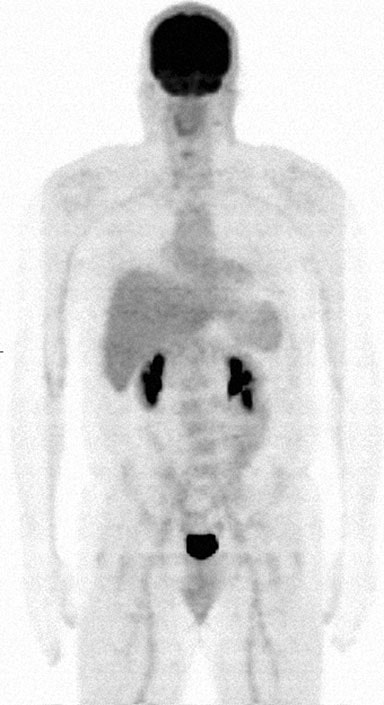
Le 27/04/09, l’étude #7 de TEP/CT au FDG a été réalisée et n’a montré aucune activité hypermétabolique. Les mêmes résultats ont été observés sur l’étude n°8 le 9/8/09. Cependant, une note de la clinique de médecine interne datant du 1/8/10 indiquait que TM avait remarqué une augmentation du nombre de ganglions dans le cou et l’examen physique a confirmé la présence d’un ganglion cervical postérieur gauche de 2 cm de diamètre. Il a également commencé à avoir de légères sueurs nocturnes et de la fatigue. Un traitement conventionnel lui a été proposé mais il l’a refusé, préférant continuer à utiliser le protocole DCA. La TEP/TDM n°9 a été réalisée le 2/1/10, le rapport officiel indiquant une captation oropharyngée droite impliquant une lésion de 3,5- 4,0 cm avec un SUV de 5,5. L’examen d’un expert par RB a indiqué un SUV corrigé de 3,0 et une conclusion que ce résultat était « le plus cohérent avec la distribution physiologique normale du radiopharmaceutique » RB a également indiqué que la mesure anatomique ci-dessus de la lésion oropharyngée était certainement erronée. Les oncologues locaux ont conclu que le lymphome du patient avait récidivé, et les options de traitement local par radiothérapie ainsi que le lénalidomide seul ou avec le rituximab ont été discutées. TM a de nouveau refusé toute chimiothérapie supplémentaire et a poursuivi le traitement par DCA. Le suivi hématologique-oncologique du 15/01/11 a révélé un ganglion cervical gauche de 2,0 cm. De nouveau, les options pour un traitement supplémentaire ont été discutées et comprenaient la bendamustine, la fludarabine, la radio-immunothérapie avec Zevalin mais toutes ont été refusées. Le 4/10/11, une TEP/TDM FDG n°10 a été réalisée et n’a montré aucun signe d’hypermétabolisme (Fig. 8).
En novembre 2012, TM déclare qu’il va bien et ne présente pas de symptômes systémiques. Il note l’apparition et la disparition de petits ganglions dans son cou, de la taille d’un petit pois. Il indique qu’il a continué à utiliser son protocole DCA mais qu’il a diminué la fréquence des doses de DCA à trois fois par semaine. Il affirme que son niveau d’énergie est excellent, qu’il travaille à plein temps, mais que, faute d’assurance, il n’a pas subi d’évaluation médicale plus poussée par examen physique, tests de laboratoire ou études d’imagerie. Les auteurs SS et OA ont facilité la réalisation d’une imagerie TEP/CT au FDG le 11/8/12 et d’une analyse de laboratoire le 11/9/12, sans frais pour TM. L’étude FDG était tout à fait normale. Tous les tests de laboratoire, autres qu’une élévation lipidique des triglycérides et des LDL, sont normaux, y compris les biomarqueurs tels que la β-2 μglobuline, les récepteurs solubles de l’IL-2 et l’ESR.
Discussion
Les cellules tumorales ont un métabolisme remarquablement différent de celui des cellules normales dont elles sont issues. Elles présentent un métabolisme modifié qui leur permet de maintenir des taux de prolifération plus élevés et de résister à divers signaux apoptotiques (Bonnet et al. 2007 ; Bui et Thompson 2006). Ce métabolisme modifié et accru signifie que les cellules cancéreuses ont besoin de grandes quantités de protéines, de lipides et de nucléotides, ainsi que d’énergie sous forme d’ATP. Il y a presque 100 ans, Otto Warburg a publié ses découvertes montrant que les cellules cancéreuses présentent une altération de l’énergie cellulaire impliquant une glycolyse aérobie accrue. (Warburg 1956a, b ; Warburg et al. 1927)
L’un des mécanismes d’action proposés du DCA est de faire passer le métabolisme des cellules tumorales de la voie glycolytique basée sur le cytoplasme, préférée par les cellules tumorales, à une voie d’oxydation du glucose (phosphorylation oxydative) basée sur les mitochondries (Bonnet et al. 2007). Ce faisant, le DCA restaure la fonction apoptotique de la mitochondrie et inverse les altérations métaboliques qui ont permis aux cellules tumorales de survivre, de proliférer et de former des métastases. Cette action supposée du DCA est associée à sa capacité à inverser l’inhibition de la PDH (pyruvate déshydrogénase) – une enzyme cruciale qui permet l’entrée du pyruvate dans le cycle de Krebs via son oxydation en acétyl CoA, un substrat clé. Le DCA agit en inhibant la PDK (pyruvate déshydrogénase kinase) mitochondriale. Par conséquent, le DCA inhibe l’inhibiteur impliqué dans la production de PDH. Le DCA accomplit cela en empêchant la phosphorylation et l’inactivation de la PDH par la PDK. (Constantin-Teodosiu et al. 1999)
L’agressivité des cellules cancéreuses a été associée au degré d’hyperpolarisation du potentiel de la membrane mitochondriale (Heerdt et al. 2005). Bonnet et al. ont défini un ensemble d’effets mitochondriaux du DCA, comme suit. Le DCA a un effet rapide et dose-dépendant conduisant à une dépolarisation de la membrane mitochondriale qui se produit dans les 5 minutes. En raison de cet aspect de l’activité du DCA, l’AIF (facteur inducteur d’apoptose) est transloqué vers le noyau de la cellule et le cytochrome C devient présent de manière diffuse dans le cytoplasme. Le DCA augmente de façon dose-dépendante la production de H2O2 dans le complexe I du CTE. La production de H2O2 active les canaux Kv1.5 qui, à leur tour, inhibent NFAT1, un inhibiteur connu de l’apoptose. D’autres effets biochimiques du DCA incluent l’augmentation de l’expression de l’annexine, l’activation des caspases 3 et 9, la diminution de la survivine et du PCNA (antigène nucléaire des cellules proliférantes) (Bonnet et al. 2007). D’autres études ont montré que l’upregulation des canaux Kv1.5 diminue probablement le potassium cellulaire, ce qui active les caspases et l’apoptose (Remillard et Yuan 2004 ; Wang 2004 ; Pan et Mak 2007).
Peu d’études ont été menées sur l’effet du DCA sur la croissance du cancer humain, et la plupart d’entre elles ont été réalisées in vitro. Tong et al. ont étudié le DCA seul ou en combinaison avec le 5-FU contre quatre lignées cellulaires humaines de cancer colorectal. Ils ont montré que le DCA était synergique avec le 5-FU en induisant l’apoptose, en inhibant la prolifération des cellules cancéreuses, en favorisant l’arrêt du cycle cellulaire en phase G1/S, en diminuant l’expression de Bcl-2, tout en augmentant l’expression de Bax et de la caspase-3 (Tong et al. 2011). L’étude du DCA réalisée par Michelakis et al. (2010) chez cinq patients atteints de glioblastome multiforme décrit une régression radiologique et fournit des images de deux patients présentant une réponse apparente au DCA, bien que le débullage de la tumeur chez le patient numéro 2 semble confondre l’interprétation de l’effet du DCA.
La TEP au fluorodésoxyglucose F-18 (F-18 FDG) est maintenant utilisée par un nombre croissant d’oncologues pour déterminer l’étendue de la malignité, documenter la réponse thérapeutique et fournir des informations pronostiques après une thérapie anti-néoplasique. Le patient présenté avait une TEP-FDG de base correspondant à ses signes et symptômes cliniques d’un processus néoplasique hautement actif. Après un traitement par chimiothérapie de pointe utilisant le R-CHOP, il a obtenu une rémission complète de courte durée ; sa rechute a été à nouveau caractérisée par des anomalies de la TEP-FDG. Cependant, sa réponse à la monothérapie par DCA a conduit à une rémission complète durable, maintenant à 4 ans. La captation du F18 FDG par les néoplasmes est considérée comme un exemple de l’effet Warburg, c’est-à-dire l’utilisation du glucose par les tumeurs en présence d’oxygène (glycolyse aérobie). Cependant, la fonctionnalité singulière de la TEP au FDG observée dans divers cancers résulte de multiples facteurs, dont certains sont les suivants :
- Phosphorylation du F18 FDG en F18 FDG-6 phosphate par l’hexokinase (HK)
- La régulation positive de la HK par les facteurs de transcription inductibles par l’hypoxie, par exemple HIF-1α (Mathupala et al. 1997, 2001)
- Surexpression de la HK, en particulier de l’isomère HKII, dans de nombreuses populations de cellules cancéreuses
- Rôle crucial de la HK dans la bioénergétique des cellules tumorales, c’est-à-dire l’effet Warburg (Bustamante et al. 1981 ; Bustamante et Pedersen 1977)
- Absence de glucose-6-phosphatase (G6Pase) dans les tumeurs hautement malignes à croissance rapide
- Piégeage consécutif du phosphate F18-FDG-6 par les cellules cancéreuses (Higashi et al. 2002)
Chez le sujet de l’étude que nous avons présenté, une rémission complète a été documentée par TEP au FDG le 12/4/08 et s’est poursuivie pendant 4 ans sans aucune intervention thérapeutique autre que la poursuite de l’utilisation du DCA, mais à une fréquence de dosage plus faible de trois fois par semaine. En date du 12/5/12, TM ne rapporte aucun résultat significatif de neuropathie périphérique à la dose de ≤ 10 mg/kg/jour, ce qui est cohérent avec les résultats de Michelakis et al. (2010) qui n’ont rapporté aucune neuropathie périphérique significative avec des doses de DCA inférieures à 6,25 mg/kg deux fois par jour. TM n’a pas non plus présenté d’autres effets secondaires.
Une explication avancée pour la réponse spectaculaire documentée dans ce rapport de cas est celle d’une rémission spontanée d’un LNH de grade faible à intermédiaire. Cela semble improbable à la lumière de la réduction spectaculaire et de la disparition des symptômes systémiques et des adénopathies dans les semaines qui ont suivi le début du DCA. De plus, la rechute relativement rapide après la chimiothérapie initiale par R-CHOP fait de la rémission spontanée un événement peu probable dans la maladie de TM.
Notre étude, présentée ici, devrait susciter une discussion approfondie sur l’utilisation de la thérapie métabolique telle que le DCA chez les patients atteints de cancer. D’autres questions qui semblent pertinentes pour ce rapport comprennent le rôle possible d’un régime à faible teneur en glucose dans la prévention et le traitement du cancer, et la nécessité de se concentrer sur la méthodologie et le format de rapport impliqués dans l’imagerie TEP. L’utilisation des dossiers médicaux de personnes qui explorent une thérapie anticancéreuse sans la surveillance d’un professionnel de la santé est une approche unique dans le travail de détective médical. L’obtention des dossiers médicaux des patients, ainsi que des DVD et des rapports d’imagerie, des rapports de pathologie et des lames, et des rapports de laboratoire est un défi et prend du temps. Toutefois, si une étude plus poussée sur des sujets humains confirme que le DCA a une activité anticancéreuse significative, l’approche utilisée dans cette enquête devrait être envisagée à plus grande échelle.
Conclusion
La réponse exceptionnelle à la monothérapie par DCA du patient TM, dans un contexte de rechute après un traitement par R-CHOP, justifie la poursuite de l’étude clinique du DCA chez des patients humains atteints de diverses tumeurs malignes, compte tenu notamment du coût négligeable et de la toxicité minimale de cette molécule simple à 2 carbones.
Remerciements
Les auteurs souhaitent remercier la Life Extension Foundation de Fort Lauderdale (Floride) pour son aide financière, ainsi que Robert Vergara de Life Extension pour son aide à l’optimisation des fichiers graphiques utilisés dans ce rapport. Jim Tassano a contribué à alerter les auteurs SS et OA sur les rapports de réponses cliniques significatives chez des patients cancéreux recevant du DCA.
Intérêts concurrents
Les auteurs déclarent ne pas avoir d’intérêts financiers ou non financiers concurrents.
Contributions des auteurs
SS, OA, NP, JW ont contribué à la rédaction du manuscrit. SS et OA ont obtenu tous les dossiers médicaux, ont facilité l’examen de la pathologie, ont compilé les dossiers médicaux électroniques et ont assuré le suivi des participants à l’étude. RB a examiné toutes les images TEP et TEP/CT, a fourni les SUV corrigés et les mesures. DS a facilité l’obtention des DVDs clés des études d’imagerie et a rendu l’opinion radiologique.
Informations sur l’auteur
SS est un oncologue médical certifié par le conseil d’administration avec plus de 40 ans de pratique clinique. Il est également l’auteur de nombreux articles évalués par des pairs sur la maladie de Hodgkin, le cancer de la prostate et les soins de soutien aux patients atteints de cancer.
RÉFÉRENCES
1 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW (2006) Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency. Mitochondrion 6:126-135
2BonnetS, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R et al (2007) A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cellule cancéreuse 11:37-51
3BuiT, Thompson CB (2006) Cancer’s sweet tooth. Cancer Cell 9:419- 420
4BustamanteE, Pedersen PL (1977) High aerobic glycolysis of rat hepatoma cells in culture : role of mitochondrial hexokinase. Proc Natl Acad Sci U S A 74:3735-3739
5BustamanteE, Morris HP, Pedersen PL (1981) Le métabolisme d’énergie des cellules tumorales. Exigence pour une forme d’hexokinase avec une propension pour la liaison mitochondriale. J Biol Chem 256:8699-8704
6CaoW, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S et al (2008) Le dichloroacétate (DCA) sensibilise in vitro les cellules cancéreuses de la prostate de type sauvage et sur-exprimant Bcl-2 aux radiations. Prostate 68:1223-1231
7ChenZ, Lu W, Garcia-Prieto C, Huang P (2007) The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr 39:267-274
8ChristofkHR, Vander Heiden MG, Harris MH, Ramanathan A, Gerszten RE, Wei R et al (2008) The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature 452:230-233
9Constantin-TeodosiuD, Simpson EJ, Greenhaff PL (1999) The importance of pyruvate availability to PDC activation and anaplerosis in human skeletal muscle. Am J Physiol 276:E472-E478
10FangJS, Gillies RD, Gatenby RA (2008) Adaptation to hypoxia and acidosis in carcinogenesis and tumor progression. Semin Cancer Biol 18:330-337
11GatenbyRA, Gawlinski ET (2003) The glycolytic phenotype in carcinogenesis and tumor invasion : insights through mathematical models. Cancer Res 63:3847-3854
12HeerdtBG, Houston MA, Augenlicht LH (2005) The intrinsic mitochondrial membrane potential of colonic carcinoma cells is linked to the probability of tumor progression. Cancer Res 65:9861-9867
13HigashiT, Saga T, Nakamoto Y, Ishimori T, Mamede MH, Wada M et al (2002) Relations entre l’indice de rétention dans la TEP au (18)F-FDG à double phase, et l’expression de l’hexokinase-II et du transporteur de glucose-1 dans le cancer du pancréas. J Nucl Med 43:173-180
14KurodaY, Ito M, Toshima K, Takeda E, Naito E, Hwang TJ et al (1986) Treatment of chronic congenital lactic acidosis by oral administration of dichloroacetate. J Inherit Metab Dis 9:244-252
15MadhokBM, Yeluri S, Perry SL, Hughes TA, Jayne DG (2010) Le dichloroacétate induit l’apoptose et l’arrêt du cycle cellulaire dans les cellules cancéreuses colorectales. Br J Cancer 102:1746-1752
16MathupalaSP, Rempel A, Pedersen PL (1997) Aberrant glycolytic metabolism of cancer cells : a remarkable coordination of genetic, transcriptional, post-translational, and mutational events that lead to a critical role for type II hexokinase. J Bioenerg Biomembr 29:339-343
17MathupalaSP, Rempel A, Pedersen PL (2001) Glucose catabolism in cancer cells : identification and characterization of a marked activation response of the type II hexokinase gene to hypoxic conditions. J Biol Chem 276:43407-43412
18MichelakisED, Webster L, Mackey JR (2008) Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 99:989-994
19MichelakisED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E et al (2010) Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2:31ra34
20PanJG, Mak TW (2007) Metabolic targeting as an anticancer strategy : dawn of a new era ? Sci STKE 2007:14
21RemillardCV, Yuan JX (2004) Activation of K+ channels : an essential pathway in programmed cell death. Am J Physiol Lung Cell Mol Physiol 286:L49-L67
22StacpoolePW, Barnes CL, Hurbanis MD, Cannon SL, Kerr DS (1997) Treatment of congenital lactic acidosis with dichloroacetate. Arch Dis Child 77:535-541
23StacpoolePW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM et al (2006) Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 117:1519-1531
24StacpoolePW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW et al (2008) Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pédiatrie 121:e1223-e1228
25SunRC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC (2010) Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 120:253-260
26TongJ, Xie G, He J, Li J, Pan F, Liang H (2011) Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer. J Biomed Biotechnol 2011:740564
27VanderHeiden MG (2010) Targeting cell metabolism in cancer patients. Sci Transl Med 2:31ed31
28WahlRL, Jacene H, Kasamon Y, Lodge MA (2009) From RECIST to PERCIST : evolving considerations for PET response criteria in solid tumors. J Nucl Med 50(Suppl 1):122S-150S
29WangZ (2004) Roles of K+ channels in regulating tumour cell proliferation and apoptosis. Pflugers Arch 448:274-286
30WarburgO (1956a) On respiratory impairment in cancer cells. Science 124:269-270 Warburg O (1956b) Sur l’origine des cellules cancéreuses. Science 123:309-314
31WarburgO, Wind F, Negelein E (1927) Le métabolisme des tumeurs dans le corps. J Gen Physiol 8:519-530
32WongJY, Huggins GS, Debidda M, Munshi NC, De Vivo I (2008) Le dichloroacétate induit l’apoptose dans les cellules cancéreuses de l’endomètre. Gynecol Oncol 109:394-402
Contenu connexe :