Akbar Khan
Directeur médical, Medicor Cancer Centres Inc, Toronto, Canada
Résumé
Le carcinome spinocellulaire rénal est une forme rare de cancer du rein qui est considéré comme incurable une fois que des métastases se développent. Le pronostic est mauvais et la survie moyenne de la maladie à un stade avancé est généralement de l’ordre de quelques mois, malgré toutes les thérapies conventionnelles disponibles.
Nous décrivons le cas d’une femme de 72 ans atteinte d’un carcinome épidermoïde rénal métastatique qui a subi une néphrectomie radicale avec des marges chirurgicales positives, une invasion des veines rénales et des métastases dans plusieurs ganglions lymphatiques abdominaux. Elle a reçu une radiothérapie palliative de l’abdomen de 4500cGy en 25 fractions sur 5 semaines. Après la radiothérapie, elle a été traitée par un régime cyclique de dichloroacétate de sodium oral (« DCA »). Le traitement a été interrompu après 3 mois en raison du développement d’une neuropathie périphérique. L’imagerie de suivi à la fin du traitement au DCA n’a révélé aucun signe de maladie métastatique. La neuropathie s’est progressivement améliorée et, quatre ans plus tard, la tomographie assistée par ordinateur n’a révélé aucune récidive du cancer. Cinq ans après la fin du traitement, la patiente se sent toujours bien, sans signe clinique de récidive, et mène une vie normale et active.
Mots clés : Dichloroacétate, radiothérapie, carcinome épidermoïde rénal, rémission
Copyright © 2012 Akbar Khan. Il s’agit d’un article en accès libre distribué sous la licence Creative Commons Attribution License unported 3.0, qui permet l’utilisation, la distribution et la reproduction sans restriction sur n’importe quel support, à condition que le travail original soit correctement cité. Auteur de contact : Akbar Khan Courriel : [email protected]
INTRODUCTION
Le carcinome épidermoïde rénal ( » RSCC « ) est une forme rare de cancer du rein qui prend naissance dans le bassin rénal. Le CCRS représente environ 0,5 à 0,8 % de toutes les tumeurs rénales malignes (Bhaijee 2012). Bien que la chirurgie soit parfois curative pour les maladies localisées, le carcinome épidermoïde rénal métastatique (« CARR ») est considéré comme incurable (Holmang et al. 2007). De multiples publications de médecins ayant l’expérience du traitement du RSCC ont établi que ce type de cancer est radio-résistant et que la chimiothérapie systémique apporte peu de bénéfices. (Bhandari et al. 2010), (Di Battista et al. 2012), (Kimura et al. 2000), (Li et Cheung 1987). La survie moyenne de la maladie à un stade avancé est extrêmement faible (de l’ordre de plusieurs mois) et la survie à cinq ans serait inférieure à 10% (Holmang et al. 2007). Dans une revue de 15 cas, Lee et al. ont rapporté une survie médiane de 3,5 mois (Lee et al. 1998).
Une recherche sur Medline a été effectuée (Medline RSCC 2012) afin de déterminer si des cas de rémission complète à long terme de CSRM avaient été enregistrés. Cette recherche a révélé plus de 200 citations de RSCC mais un seul cas publié de rémission complète/cure de 5 ans (Carlson 1960). Dans ce cas, le patient a subi une néphro-urétérectomie complète, y compris la résection de la graisse péri-rénale et d’une manchette de la vessie. La pathologie n’a pas démontré d’atteinte des marges chirurgicales et aucune métastase n’a été signalée.
Le dichloroacétate de sodium (« DCA ») est un médicament qui a été largement étudié pour le traitement de l’acidose lactique congénitale, qui fait partie d’un groupe de maladies mitochondriales héréditaires (Stacpoole et al. 2006), (Stacpoole et al. 1992), (Stacpoole et al. 1988). Le profil de sécurité de l’utilisation du DCA chez l’homme a été établi grâce à cet ensemble de travaux. On a constaté qu’il s’agissait d’un médicament relativement sûr, sans toxicité hématologique, cardiaque, pulmonaire ou rénale. La principale toxicité est neurologique (principalement une neuropathie périphérique) et elle est réversible (Kaufmann et al. 2006). Un délire induit par le DCA a été observé, il est également réversible à l’arrêt du traitement (Brandsma et al. 2010). Une élévation mineure et réversible des enzymes hépatiques peut se produire chez un petit pourcentage de patients (Stacpoole et al. 2008).
En janvier 2007, un article de référence a été publié, démontrant que le DCA était efficace dans le traitement des cancers humains du sein, du poumon et du cerveau in vitro et in vivo (rats) par de nouvelles voies métaboliques (Bonnet et al. 2007). Il a été démontré que le DCA inhibe la pyruvate déshydrogénase kinase mitochondriale, ce qui entraîne une inhibition de la glycolyse aérobie, la voie habituelle de production d’énergie dans les cellules cancéreuses humaines (connue sous le nom d’effet Warburg). Étant donné que les cellules cancéreuses ne sont généralement pas en mesure de passer à l’oxydation du glucose lorsque la glycolyse est inhibée, les cellules traitées au DCA seront privées de leur source d’énergie ATP (Xu et al. 2005). Il a également été démontré que le DCA déclenchait l’apoptose de manière sélective dans les cellules cancéreuses par une réduction du potentiel de membrane des mitochondries hyperpolarisées et par l’activation des canaux potassiques dépendant du voltage Kv1.5 (Bonnet et al. 2007).
Depuis 2007, la recherche sur le DCA s’est poursuivie et il a été démontré que le DCA est efficace in vitro contre de multiples lignées cellulaires cancéreuses humaines, notamment les ovaires (Saed et al. 2011), le neuroblastome (Vella et al. 2012), le côlon (Tong et al. 2011), le carcinoïde pulmonaire (Fiebiger et al. 2011), le col de l’utérus (Xie et al. 2011) et l’endomètre (Wong et al. 2008). La synergie avec la radiothérapie a également été démontrée dans des lignées cellulaires de cancer de la prostate (Cao et al. 2008). Un mécanisme pour le synergisme proposé par Cao et al. est une expression accrue de la protéine X associée à BCL-2 (une protéine intracellulaire pro-apoptotique) qui entraîne un taux accru d’apoptose. Le DCA a également montré une efficacité in vivo chez l’homme contre le glioblastome (Michelakis et al. 2010).
L’auteur a commencé à utiliser la thérapie DCA » hors indication » à partir de 2007 pour le traitement de patients atteints de cancer dont le pronostic était mauvais ou qui n’avaient pas répondu aux thérapies conventionnelles contre le cancer. L’observation des patients traités au DCA a révélé qu’un nombre significatif d’entre eux semblait bénéficier de l’utilisation de ce médicament, soit par des critères subjectifs tels que la réduction de la douleur, soit par des critères objectifs tels que la réduction de la tumeur (Medicor DCA Data 2009).
Présentation de cas
Une femme de 72 ans s’est présentée initialement chez son médecin de famille avec une douleur à la hanche droite, une hématurie et une perte de poids. Une masse dans le rein droit a été diagnostiquée par échographie. Une tomodensitométrie (« CT ») a été réalisée et a montré une tumeur impliquant le bassin rénal droit, les pôles supérieur et inférieur du rein, et une extension dans l’uretère proximal droit (Figure 1). Il y avait de multiples ganglions lymphatiques hypertrophiés dans l’abdomen (Figure 2). Une scintigraphie osseuse a été réalisée et s’est révélée négative pour les métastases osseuses.
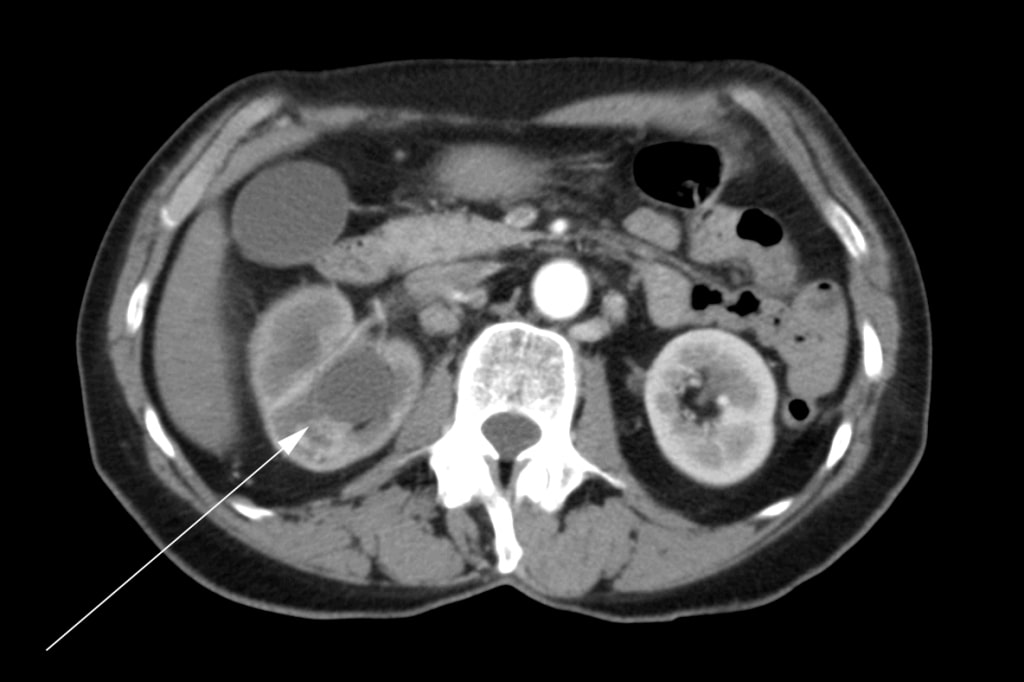
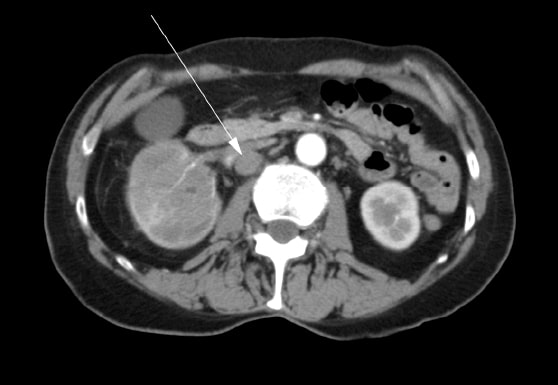
Le patient a subi une néphrectomie radicale droite en mai 2007. Il a été noté dans le rapport opératoire qu’une excision complète n’était pas possible. La veine rénale était impliquée et elle n’a pas pu être complètement débarrassée de la tumeur. De multiples ganglions pathologiques s’étendant jusqu’à la veine cave ont été visualisés au moment de l’opération mais n’ont pas été retirés. Une biopsie peropératoire de l’un des ganglions lymphatiques a été réalisée. L’histopathologie finale a confirmé le diagnostic de carcinome épidermoïde rénal avec marges chirurgicales positives et métastases ganglionnaires. Après l’opération, la patiente a été envoyée en consultation en radio-oncologie. Elle a reçu une radiothérapie externe à visée palliative dans la région para-aortique de l’abdomen avec 4500cGy en 25 fractions sur 5 semaines d’août à septembre 2007. L’oncologie médicale a été consultée et aucun traitement par chimiothérapie ne lui a été proposé.
La patiente a entendu parler de la recherche sur le cancer par DCA dans les médias locaux et a décidé d’étudier l’option DCA comme traitement continu, étant donné son mauvais pronostic. Elle s’est rendue à la clinique de l’auteur pour une consultation sur le traitement par DCA.
Lors de la première visite à la clinique, ses antécédents complets ont été examinés. L’examen a révélé une femme en bonne santé, avec des signes vitaux normaux et aucun signe physique significatif. Les premiers tests sanguins étaient généralement bons. Les seules anomalies étaient une légère élévation du taux d’urée à 7,4 (normal 3,0 – 7,1 mmol/L), et un faible taux de lymphocytes de 0,6 (normal 1,2 – 3,4 x109/L). Cela n’était pas inquiétant car une légère élévation de l’urée ou de la créatinine est normale chez un patient ayant subi une néphrectomie.
Traitement par DCA
Les risques et les avantages du DCA ont été discutés, et le patient a consenti au traitement DCA qui a été initié dans les 3 semaines suivant la dernière fraction de radiothérapie palliative. Le patient a commencé à prendre 500 mg de DCA par voie orale deux fois par jour (18 mg/kg/jour), selon un cycle de 2 semaines avec / 1 semaine sans. Le traitement cyclique a été choisi en raison de l’expérience antérieure de l’auteur avec un niveau inacceptable d’effets secondaires chez les patients adultes utilisant une dose continue de DCA. On lui a prescrit de la benfotiamine (une forme lipidique soluble de la vitamine B1) à raison de 80 mg par voie orale deux fois par jour et de l’acide R-alpha lipoïque à raison de 150 mg par voie orale trois fois par jour pour réduire le risque de neuropathie due au DCA, étant donné que ces deux composés naturels ont prouvé leur efficacité dans le traitement de neuropathies d’autres étiologies (Ziegler et al. 1999), (Winkler et al. 1999). On a également commencé à lui administrer 40 mg de pantoprazole par voie orale une fois par jour pour prévenir les troubles gastriques causés par le DCA. Après le premier cycle de 3 semaines, la dose de DCA a été augmentée à 500mg par voie orale trois fois par jour (27mg/kg/jour). La dose a été augmentée par paliers pour garantir la tolérance en raison de la réduction du métabolisme du DCA avec l’âge avancé du patient (Shroads et al. 2008).
Le patient s’est généralement senti bien pendant le premier mois de traitement par DCA, à l’exception d’une légère fatigue, qui pouvait également être un effet secondaire de la radiothérapie. Même avec l’augmentation de la dose de DCA après 3 semaines, aucun problème n’a été rencontré pendant le deuxième mois de traitement. Le DCA a été arrêté vers la fin du troisième mois en raison de nouveaux symptômes indiquant une neuropathie périphérique.
Au moment de l’arrêt du DCA, la patiente a subi un scanner triphasique qui n’a montré aucun signe de cancer résiduel. Six mois plus tard, la patiente a subi un scanner qui n’a révélé aucune trace de cancer (figure 3).
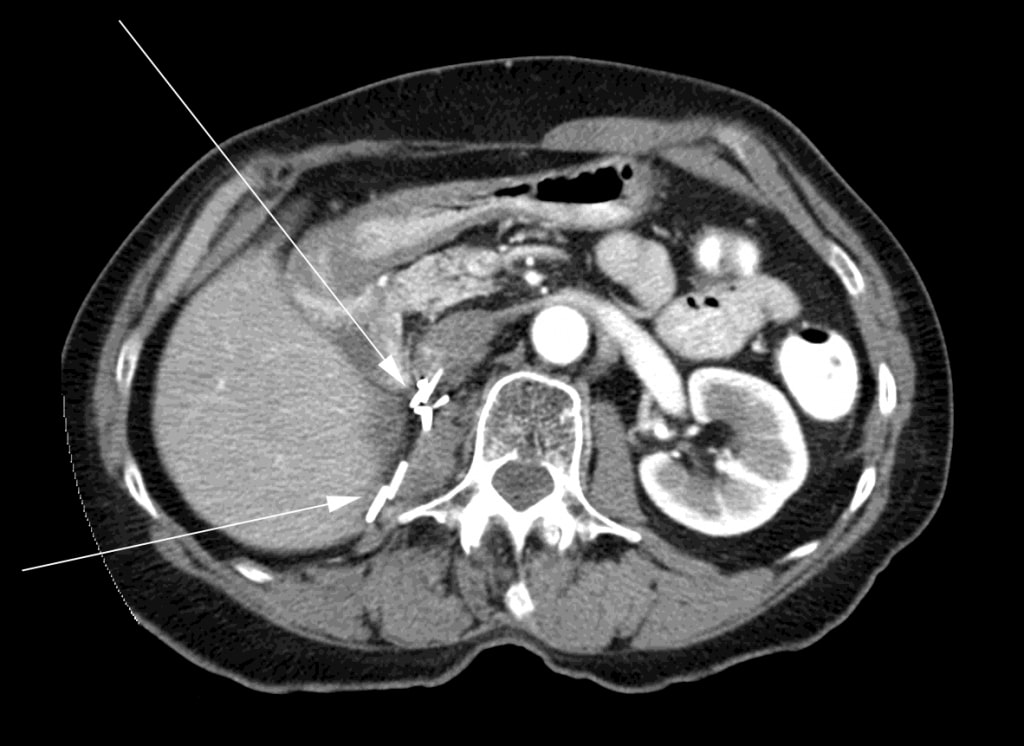
La patiente a continué à être suivie régulièrement à la clinique d’oncologie de son hôpital local avec des tomodensitométries de routine tous les 6 mois environ. La dernière tomodensitométrie d’octobre 2011 n’a montré aucun signe de récidive du CCRSM. Une visite de suivi chez le radio-oncologue en décembre 2011 a confirmé l’absence de récidive. L’examen physique était normal et son statut de performance était le niveau 0 de l’ECOG. Septembre 2011 a marqué le point de 4 ans depuis la radiothérapie et le début du traitement DCA, et décembre 2011 a marqué le point de 4 ans depuis la fin des 3 mois de traitement DCA. En septembre 2012, soit 5 ans après le début du traitement par DCA, la patiente est toujours asymptomatique. Elle n’a reçu aucun autre traitement anticancéreux pendant cette période (y compris le DCA) étant donné qu’il n’y a jamais eu de signe de récidive de la maladie.
Discussion
Nous pensons qu’il s’agit du premier cas publié de rémission complète à long terme (et de guérison probable) d’un CSRM. Il n’existe qu’un seul cas similaire de rémission complète de 5 ans de RSCC dans la littérature indexée par Medline datant de 50 ans, mais ce patient n’avait pas de maladie métastatique. Notre cas mérite qu’on s’y intéresse de près, car le CCSRm est très agressif et sa survie médiane est de l’ordre de quelques mois avec tous les traitements conventionnels disponibles.
La radiothérapie seule n’apporte que peu de bénéfices en termes de survie pour le CCMRS (Holmang et al. 2007). Dans ce cas, la durée de traitement prolongée de 5 semaines de la radiothérapie palliative réduit encore plus les chances de guérison (peu probables au départ compte tenu du type de cancer) en raison de la réduction de la destruction des cellules par un processus appelé « repeuplement accéléré ». La repopulation est définie comme la capacité des cellules d’un tissu à se reconstituer après une dose de rayonnement. La repopulation augmente à mesure que la durée totale du traitement pour délivrer une dose de rayonnement s’allonge au cours d’une radiothérapie fractionnée. Cet effet réduit les dommages causés aux tissus sains mais réduit également la destruction des cellules cancéreuses, ce qui correspond à l’objectif de palliation. Le repeuplement est plus prononcé avec une durée totale de radiothérapie de 4 à 6 semaines et plus, et cette patiente a reçu sa radiothérapie fractionnée sur 5 semaines (Abeloff, 21 mai 2008).
Comme indiqué précédemment, le DCA présente une synergie avec la radiothérapie dans le cancer de la prostate. L’expérience de l’auteur dans le traitement des patients avec le DCA suggère que la synergie avec la radiothérapie peut se produire dans divers types de cancer autres que celui de la prostate. Les exemples incluent : une femme de 53 ans avec une rémission complète de 3 ans d’un carcinome de la glande de Bartholin traité par radiation et DCA adjuvant, et une femme de 32 ans avec une rémission complète de 3 ans d’un astrocytome anaplasique après une chimioradiation avec DCA adjuvant (cas en cours de préparation pour publication).
Dans ce cas de CSRM, l’utilisation adjuvante de DCA après un traitement de radiothérapie a produit une rémission complète surprenante, sans effets secondaires néfastes à part une neuropathie périphérique réversible. Chez ce patient, la benfotiamine prophylactique et l’acide R-alpha lipoïque n’ont pas empêché le développement de la neuropathie périphérique due au DCA. L’auteur ajoute maintenant l’acétyl Lcarnitine au régime de prévention de la neuropathie due à l’ACD, car elle a également des avantages prouvés dans le traitement de la neuropathie d’autres étiologies, comme la neuropathie diabétique, chimio-induite et antirétrovirale (Herzmann et al. 2005), (Quatraro et al. 1995), (De Grandis et Minardi 2002), (Bianchi et al. 2005).
Actuellement, il n’y a pas d’essai clinique actif étudiant le rôle du DCA en combinaison avec la radiothérapie seule. Un essai étudie actuellement le DCA en association avec la chimiothérapie et la radiothérapie pour le carcinome de la tête et du cou (Clinicaltrials.gov 2012). En raison du statut non exclusif du DCA, il a été difficile pour les chercheurs de trouver des fonds pour mener des essais coûteux sur l’homme. Nous espérons que la publication de cas clairs illustrant les avantages du DCA en tant qu’adjuvant aux traitements anticancéreux traditionnels motivera les chercheurs à trouver de nouveaux mécanismes créatifs de collecte de fonds afin que le DCA puisse faire l’objet d’études formelles dans le cadre d’autres essais sur l’homme. Nous espérons que le DCA sera ainsi plus largement accepté par la communauté oncologique et utilisé au bénéfice des patients atteints de tumeurs malignes incurables.
Étant donné que la réalisation d’essais cliniques sur l’homme peut prendre de nombreuses années, nous pensons qu’entre-temps, il est éthique de prescrire avec prudence le DCA « off-label » associé à une radiothérapie palliative, ou après celle-ci, pour les patients qui comprennent et acceptent pleinement les risques et les avantages. Le DCA peut avoir un rôle supplémentaire en tant que nouvelle approche thérapeutique en association avec la radiothérapie pour les cancers non métastatiques radio-résistants, mais cela doit encore être clarifié.
Remerciements
L’auteur souhaite remercier le Dr Humaira Khan et le Dr Isaac Eliaz pour leur aide dans la préparation de ce rapport de cas, ainsi que la patiente pour avoir consenti à publier son cas.
Déclaration de l’auteur
L’auteur prescrit des médicaments pour le traitement du cancer (y compris le dichloroacétate) qui sont fournis par les centres anticancéreux Medicor à titre onéreux. Cette clinique appartient à un membre de la famille de l’auteur.
RÉFÉRENCES
1 Abeloff, M. D., Armitage, J. O., Niederhuber, J. E., Kastan, M. B. & McKenna, W. G. (21 mai 2008). Abeloff’s Clinical Oncology, 4e édition, Chapitre : Biological Effects of Radiation.2 Bhaijee, F. (2012). » Carcinome épidermoïde du bassin rénal « , Ann Diagn Pathol, 16(2), 124-7.
3 Bhandari, A., Alassi, O., Rogers, C. & MacLennan, G. T. (2010). « Squamous Cell Carcinoma of the Renal Pelvis « , J Urol, 183(5), 2023-4.
4 Bianchi, G., Vitali, G., Caraceni, A., Ravaglia, S., Capri, G., Cundari, S., Zanna, C. & Gianni, L. (2005). « Symptomatic and Neurophysiological Responses of Paclitaxel- or Cisplatin-Induced Neuropathy to Oral Acetyl-L-Carnitine », Eur J Cancer, 41(12), 1746-50.
5 Bonnet, S., Archer, S. L., Allalunis-Turner, J., Haromy, A., Beaulieu, C., Thompson, R., Lee, C. T., Lopaschuk, G. D., Puttagunta, L., Bonnet, S., Harry, G., Hashimoto, K., Porter, C. J., Andrade, M. A., Thebaud, B. & Michelakis, E. D. (2007). « A Mitochondria- K+ Channel Axis Is Suppressed in Cancer and Its Normalization Promotes Apoptosis and Inhibits Cancer Growth », Cancer Cell, 11(1), 37-51.
6 Brandsma, D., Dorlo, T. P. C., Haanen, J. H., Beijnen, J. H. & Boogerd, W. (2010). « Severe Encephalopathy and Polyneuropathy Induced by Dichloroacetate », J Neurol, 257(12), 2099-100.
7 Cao, W., Yacoub, S., Shiverick, K. T., Namiki, K., Sakai, Y., Porvasnik, S., Urbanek, C. & Rosser, C. J. (2008). « Dichloroacetate (DCA) Sensitizes Both Wild-Type and Over Expressing Bcl-2 Prostate Cancer Cells in Vitro to Radiation, » Prostate, 68(11), 1223- 31.
8 Carlson, H. E. (1960). « Carcinome spinocellulaire du bassin rénal : A Five Year Cure « , J Urol, 83, 813-4.
9 Clinicaltrials.Gov (2012). [En ligne], Disponible : http://clinicaltrials.gov/ct2/results?term= dichloroacetate+radiothérapie [consulté le 1er septembre 2012].
10 De Grandis, D. & Minardi, C. (2002). » Acetyl-L-Carnitine (Levacecarnine) dans le traitement de la neuropathie diabétique. A LongTerm, Randomised, Double-Blind, PlaceboControlled Study », Drugs R D, 3(4), 223-31.
11 Di Battista, L., Stio, F., Guarino, S., Galani, A., Maturo, A., Dimko, M., Mancini, M. & Gallo, P. (2012). » Carcinome épidermoïde du bassin rénal avec calculs et infiltration de la veine cave inférieure. Case Report », G Chir, 33(5), 182-5.
12 Fiebiger, W., Olszewski, U., Ulsperger, E., Geissler, K. & Hamilton, G. (2011). « In Vitro Cytotoxicity of Novel Platinum-Based Drugs and Dichloroacetate against Lung Carcinoid Cell Lines », Clin Transl Oncol, 13(1), 43-9.
13 Herzmann, C., Johnson, M. A. & Youle, M. (2005). « Long-Term Effect of Acetyl-LCarnitine for Antiretroviral Toxic Neuropathy, » HIV Clin Trials, 6(6), 344-50.
14 Holmang, S., Lele, S. M. & Johansson, S. L. (2007). « Carcinome épidermoïde du bassin rénal et de l’uretère : Incidence, Symptoms, Treatment and Outcome « , J Urol, 178(1), 51-6.
15 Kaufmann, P., Engelstad, K., Wei, Y., Jhung, S., Sano, M. C., Shungu, D. C., Millar, W. S., Hong, X., Gooch, C. L., Mao, X., Pascual, J. M., Hirano, M., Stacpoole, P. W., Dimauro, S. & De Vivo, D. C. (2006). « Dichloroacetate Causes Toxic Neuropathy in MELAS : A Randomized, Controlled Clinical Trial », Neurology, 66(3), 324-30.
16 Kimura, T., Kiyota, H., Asano, K., Madarame, J., Yoshino, Y., Miki, K., Abe, K., Hasegawa, T. & Ohishi, Y. (2000). « Squamous Cell Carcinoma of the Renal Pelvis with Inferior Vena Caval Extension », Int J Urol, 7(8), 316- 9 ; Discussion 320.
17 Lee, T. Y., Ko, S. F., Wan, Y. L., Cheng, Y. F., Yang, B. Y., Huang, D. L., Hsieh, H. H., Yu, T. J. & Chen, W. J. (1998). « Renal Squamous Cell Carcinoma : CT Findings and Clinical Significance », Abdom Imaging, 23(2), 203-8.
18 Li, M. K. & Cheung, W. L. (1987). « Squamous Cell Carcinoma of the Renal Pelvis », J Urol, 138(2), 269-71.
19 Medicor (DCA Data 2009) [en ligne], Disponible : www.medicorcancer.com/DCAdata.html [consulté le 1er octobre 2012]. Medline (RSCC 2012) [en ligne], Disponible : http://www.ncbi.nlm.nih.gov/pubmed, Critères de recherche : Renal [titre] oR kidney [titre] and (« Squamous Cell Carcinoma » [titre]) [consulté le 1er octobre 2012].
20 Michelakis, E. D., Sutendra, G., Dromparis, P., Webster, L., Haromy, A., Niven, E., Maguire, C., Gammer, T. L., Mackey, J. R., Fulton, D., Abdulkarim, B., McMurtry, M. S. & Petruk, K. C. (2010). « Metabolic Modulation of Glioblastoma with Dichloroacetate », Sci Transl Med, 2(31), 31ra34.
21 Quatraro, A., Roca, P., Donzella, C., Acampora, R., Marfella, R. & Giugliano, D. (1995). « Acetyl-L-Carnitine for Symptomatic Diabetic Neuropathy », Diabetologia, 38(1), 123.
22 Saed, G. M., Fletcher, N. M., Jiang, Z. L., AbuSoud, H. M. & Diamond, M. P. (2011). « Dichloroacetate Induces Apoptosis of Epithelial Ovarian Cancer Cells Through a Mechanism Involving Modulation of Oxidative Stress, » Reprod Sci, 18(12), 1253- 61.
23 Shroads, A. L., Guo, X., Dixit, V., Liu, H. P., James, M. O. & Stacpoole, P. W. (2008). « Age-Dependent Kinetics and Metabolism of Dichloroacetate : Possible Relevance to Toxicity « , J Pharmacol Exp Ther, 324(3), 1163-71.
24 Stacpoole, P. W., Gilbert, L. R., Neiberger, R. E., Carney, P. R., Valenstein, E., Theriaque, D. W. & Shuster, J. J. (2008). « Evaluation of Long-Term Treatment of Children with Congenital Lactic Acidosis with Dichloroacetate », Pediatrics, 121(5), E1223-8.
25 Stacpoole, P. W., Kerr, D. S., Barnes, C., Bunch, S. T., Carney, P. R., Fennell, E. M., Felitsyn, N. M., Gilmore, R. L., Greer, M., Henderson, G. N., Hutson, A. D., Neiberger, R. E., O’Brien, R. G., Perkins, L. A., Quisling, R. G., Shroads, A. L., Shuster, J. J., Silverstein, J. H., Theriaque, D. W. & Valenstein, E. (2006). « Controlled Clinical Trial of Dichloroacetate for Treatment of Congenital Lactic Acidosis in Children », Pediatrics, 117(5), 1519-31.
26 Stacpoole, P. W., Lorenz, A. C., Thomas, R. G. & Harman, E. M. (1988). « Dichloroacetate in the Treatment of Lactic Acidosis », Ann Intern Med, 108(1), 58-63.
27 Stacpoole, P. W., Wright, E. C., Baumgartner, T. G., Bersin, R. M., Buchalter, S., Curry, S. H., Duncan, C. A., Harman, E. M., Henderson, G. N., Jenkinson, S. & Et Al. (1992). « Un essai clinique contrôlé du dichloroacétate pour le traitement de l’acidose lactique chez les adultes. The Dichloroacetate-Lactic Acidosis Study Group « , N Engl J Med, 327(22), 1564-9.
28 Tong, J., Xie, G., He, J., Li, J., Pan, F. & Liang, H. (2011). « Synergistic Antitumor Effect of Dichloroacetate in Combination with 5- Fluorouracil in Colorectal Cancer », J Biomed Biotechnol, 2011, 740564.
29 Vella, S., Conti, M., Tasso, R., Cancedda, R. & Pagano, A. (2012). » Le dichloroacétate inhibe la croissance des neuroblastomes en agissant spécifiquement contre les cellules indifférenciées malignes « , Int J Cancer, 130(7), 1484-93.
30 Winkler, G., Pal, B., Nagybeganyi, E., Ory, I., Porochnavec, M. & Kempler, P. (1999). « Effectiveness of Different Benfotiamine Dosage Regimens in the Treatment of Painful Diabetic Neuropathy », Arzneimittelforschung, 49(3), 220-4.
31 Wong, J. Y. Y., Huggins, G. S., Debidda, M., Munshi, N. C. & De Vivo, I. (2008). « Dichloroacetate Induces Apoptosis in Endometrial Cancer Cells, » Gynecol Oncol, 109(3), 394-402.
32 Xie, J., Wang, B. S., Yu, D. H., Lu, Q., Ma, J., Qi, H., Fang, C. et Chen, H. Z. (2011). « Dichloroacetate Shifts the Metabolism from Glycolysis to Glucose Oxidation and Exhibits Synergistic Growth Inhibition with Cisplatin in Hela Cells « , Int J Oncol, 38(2), 409-17.
33 Xu, R. H., Pelicano, H., Zhou, Y., Carew, J. S., Feng, L., Bhalla, K. N., Keating, M. J. & Huang, P. (2005). « Inhibition de la glycolyse dans les cellules cancéreuses : A Novel Strategy to Overcome Drug Resistance Associated with Mitochondrial Respiratory Defect and Hypoxia « , Cancer Res, 65(2), 613-21.
34 Ziegler, D., Hanefeld, M., Ruhnau, K. J., Hasche, H., Lobisch, M., Schutte, K., Kerum, G. & Malessa, R. (1999). » Traitement de la polyneuropathie diabétique symptomatique avec l’antioxydant acide alpha-lipoïque : A 7-Month Multicenter Randomized Controlled Trial (ALADIN III Study). Groupe d’étude ALADIN III. Alpha-Lipoic Acid in Diabetic Neuropathy « , Diabetes Care, 22(8), 1296-301.