Ramon C. Sun, Mitali Fadia, Jane E. Dahlstrom, Christopher R. Parish, Philip G. Board, Anneke C. Blackburn
R.C. Sun, P. G. Board, A. C. Blackburn
MolecularGenetics Group, John Curtin School of Medical Research, Australian National University, P.O. Box 334, Canberra 2601, Australia e-mail : [email protected]
M.Fadia, J. E. Dahlstrom
Département d’anatomie pathologique, Hôpital de Canberra et École de médecine de l’Université nationale australienne, Woden ACT 2606, Australie
C.R. Parish
Cancer and Vascular Biology Group, John Curtin School of Medical Research, Australian National University, Canberra ACT 0200, Australie
Reçu : 17 avril 2009
Accepté : 2 juin 2009
Publié : 19 juin 2009
Résumé
Le phénotype glycolytique est un phénomène répandu dans les formes solides de cancer, y compris le cancer du sein. Le dichloroacétate (DCA) a récemment été proposé comme un nouvel agent anticancéreux relativement non toxique qui peut inverser le phénotype glycolytique des cellules cancéreuses par l’inhibition de la pyruvate déshydrogénase kinase. Nous avons examiné l’effet du DCA sur les cellules cancéreuses du sein, notamment dans un modèle in vivo hautement métastatique. La croissance de plusieurs lignées cellulaires de cancer du sein s’est avérée être inhibée par le DCA in vitro. Un examen plus approfondi des cellules d’adénocarcinome mammaire de rat 13762 MAT a révélé que l’inversion du phénotype glycolytique par le DCA était corrélée à l’inhibition de la prolifération sans augmentation de la mort cellulaire. Et ce, malgré une augmentation faible mais significative de l’activité de la caspase 3/7, qui peut sensibiliser les cellules cancéreuses à d’autres déclencheurs apoptotiques. In vivo, le DCA a provoqué une réduction de 58 % du nombre de métastases pulmonaires observées macroscopiquement après injection de 13762 cellules MAT dans la veine caudale de rats (P = 0,0001, n ≥ 9 par groupe). Ces résultats démontrent que le DCA possède des propriétés anti-prolifératives en plus de propriétés pro-apoptotiques, et qu’il peut être efficace contre les maladies hautement métastatiques in vivo, soulignant son potentiel pour une utilisation clinique.
Mots clés : Dichloroacétate, Cancer du sein, Glycolyse, Métastases, Modèle animal
© Springer Science+Business Media, LLC. 2009
INTRODUCTION
Le phénotype glycolytique, souvent appelé effet Warburg, est un phénomène répandu dans la majorité des formes de cancer où des taux élevés d’absorption de glucose et de glycolyse se produisent alors que la respiration mitochondriale est réprimée, malgré la présence d’oxygène. On pense que cette caractéristique métabolique est acquise pour la production d’ATP au cours de l’évolution anaérobie de la tumeur ; cependant, des preuves de plus en plus nombreuses indiquent que le phénotype glycolytique s’accompagne de modifications de l’expression génétique qui sont intimement liées aux processus tumorigènes, comme la résistance à l’apoptose et l’augmentation du potentiel métastatique [1,2].
L’existence du phénotype glycolytique dans le cancer du sein a été bien décrite. Une altération de l’indice bioénergétique cellulaire (BEC) et un changement profond vers un phénotype glycolytique amélioré ont été signalés dans les cancers du sein par rapport à des biopsies de tissus mammaires normaux appariés, et corrélés avec la survie globale et sans maladie des patients [3,4]. L’invasivité de plusieurs lignées cellulaires de cancer du sein a été corrélée à un niveau constitutif plus élevé du facteur de transcription HIF-1α dans des conditions normoxiques et à une diminution de l’induction de HIF-1α en hypoxie, ainsi qu’à une production plus élevée de lactate [5]. Sur le plan immunohistochimique, une régulation à la hausse de deux marqueurs du phénotype glycolytique (le transporteur de glucose GLUT1 et l’échangeur Na+/H+ NHE-1) a été observée dans les foyers micro-invasifs du carcinome canalaire in situ (DCIS), ce qui indique que l’adaptation à l’hypoxie et à l’acidose peut représenter des événements clés dans la transition du cancer du sein in situ au cancer invasif [6]. Par conséquent, l’inversion du phénotype glycolytique pour la prévention des métastases et des récidives du cancer du sein est une stratégie thérapeutique pertinente.
La pyruvate déshydrogénase (PDH) régit la conversion du pyruvate en acétyl Co-A et peut donc contrôler le flux des métabolites de la glycolyse vers le cycle de l’acide citrique et donc la production d’ATP par les mitochondries. La PDH est régulée par la pyruvate déshydrogénase kinase (PDK) qui phosphoryle et inactive la PDH [7]. Le dichloroacétate (DCA) inhibe la PDK et a récemment été proposé comme un nouvel agent anticancéreux relativement non toxique [8]. Il a été démontré que le DCA inverse le phénotype glycolytique dans un certain nombre de lignées cellulaires cancéreuses, en dépolarisant le potentiel de la membrane mitochondriale interne hyperpolarisée à des niveaux normaux et en augmentant le métabolisme mitochondrial [8,9]. Comme le DCA cible un changement subi au cours de la tumorigenèse, il peut être efficace contre les cellules cancéreuses sans toxicité pour les cellules normales. Le DCA fait actuellement l’objet d’essais cliniques de phase III pour le traitement de l’acidose lactique chronique dans les troubles mitochondriaux congénitaux [10,11], et il a donc le potentiel pour passer rapidement en clinique pour d’autres applications, car il a passé les tests de toxicité de phase I/II chez l’homme [12]. Des essais cliniques évaluant sa toxicité chez des patients cancéreux sont en cours (http://www.clinicaltrials.gov) ; cependant, des expériences contrôlées pour comprendre les activités anticancéreuses du DCA sont nécessaires pour déterminer quelles tumeurs et quels patients sont les plus appropriés à traiter avec le DCA.
Dans cette étude, une lignée cellulaire d’adénocarcinome mammaire de rat a été utilisée pour examiner l’effet du DCA à la fois in vitro et in vivo. Les résultats suggèrent un mécanisme d’action du DCA dans ces cellules comme agent anti-prolifératif plutôt que comme agent induisant l’apoptose, et démontrent que le DCA peut être efficace in vivo pour réduire la croissance des cellules cancéreuses métastatiques, ce qui accroît sa pertinence dans le traitement du cancer du sein.
Matériel et méthodes
Culture cellulaire
13762 MAT cellules d’adénocarcinome mammaire de rat (cellules MAT) ont été maintenues in vitro comme décrit précédemment [13]. Les cellules V14 sont issues d’un adénocarcinome mammaire spontané survenant chez une souris BALB/c-Trp53+/- [14].
Croissance cellulaire
Les cellules ont été exposées à 1-5 mM de DCA (Sigma Chemical Co St. Louis, MO) pendant 1 à 4 jours dans des plaques à 96 puits, avec un renouvellement quotidien du milieu et du DCA, et la viabilité cellulaire a été mesurée par absorption de rouge neutre [15].
Apoptose
Les activités de la caspase 3/7 dans les cellules MAT ont été évaluées à l’aide du test Caspase-Glo 3/7 (Promega Corp., Madison, WI) conformément aux instructions du fabricant. L’apoptose a été quantifiée par cytométrie en flux après coloration des cellules avec de l’Annexin-V marquée au FITC (BD Pharmingen, NJ) et de l’iodure de propidium (PI) (Sigma Chemical Co St. Louis, MO).
Prolifération
Les cellules ont été colorées avec 5 μM d’ester de carboxyfluorescéine succinimidyl (CFSE) et examinées par analyse de tri cellulaire activée par fluorescence [16].
Métabolisme cellulaire
Les niveaux d’ATP interne dans les cellules MAT ont été évalués à l’aide du test CellTiter-Glo (Promega Corp., Madison, WI) conformément aux instructions du fabricant. Les niveaux de lactate extracellulaire ont été déterminés par spectrophotométrie en mesurant la conversion du NAD en NADH à 340 nm par la lactate déshydrogénase dans des extraits de milieux neutralisés à l’acide perchlorique [17].
13762 Métastases des cellules MAT in vivo
Les expériences sur les animaux ont été menées avec l’approbation du comité d’éthique animale de l’Australian National University, conformément aux directives établies par le comité national australien de la santé et de la recherche médicale. Trois groupes de rats femelles Fischer 344 (âgés de 10 à 13 semaines) ont reçu une injection de 2 ×105 cellules 13762 MAT dans la veine latérale de la queue [13]. Les rats du groupe 1 (contrôle) n’ont pas été traités. Avant l’injection, les groupes 2 (faible dose) et 3 (forte dose) ont reçu du DCA administré par voie orale dans l’eau potable à 0,2 g/l (23 mg/kg) pendant 7 jours afin d’épuiser l’activité de GSTZ1 et de maximiser la biodisponibilité du DCA [18]. Le jour de l’injection des cellules, la dose orale a été augmentée à 0,75 g/l (consommation moyenne d’eau 115 ml/kg/jour), ce qui correspond à une dose quotidienne de 86 mg/kg sans modification significative de la consommation d’eau (témoin 120 ml/kg/jour). Les rats du groupe 3 ont subi un traitement supplémentaire au DCA (dose élevée), recevant 200 mg/kg/jour par voie intrapéritonéale (i.p.) dans une solution saline tamponnée au phosphate (neutralisée et stérilisée par filtration), la première injection étant administrée environ 2 h avant l’injection des cellules. En extrapolant à partir des données publiées [18,19], on estime que l’administration par voie orale entraîne des concentrations plasmatiques de DCA de l’ordre de 0,5 à 1 mM, tandis que l’administration supplémentaire de 200 mg/kg par voie i.p. devrait tripler cette concentration pour la porter à 1,5-3,0 mM.
Les rats ont été tués 14 jours après l’injection des cellules tumorales, et les poumons ont été fixés dans une solution de Bouins. Le nombre de métastases pulmonaires a été évalué sous un microscope à dissection. Les deux plus grands lobes de chaque poumon ont ensuite été inclus en paraffine et colorés pour une évaluation microscopique. Le nombre de lésions microscopiques, leur taille et le nombre de mitoses par champ de haute puissance (hpf) ont été évalués. La présence ou l’absence de nécrose tumorale a été signalée et la densité des lymphocytes associés à la tumeur (occasionnel/moyen/modéré/sévère) a été enregistrée.
Activité GSTZ
LeDCAest métabolisé en glyoxylate par la glutathion transférase GSTZ1-1 dans le foie, mais le DCA peut inhiber son propre catabolisme en formant un complexe enzyme-substrat inactif avec GSTZ1 [20]. Afin d’assurer une administration efficace du DCA, l’activité de la GSTZ1 a été mesurée dans le foie de rat selon la méthode décrite précédemment [21].
Analyse statistique
Les données FACS ont été acquises à l’aide du progiciel Cell Quest (BD Bioscience, Rockville, MD) et ont été analysées à l’aide de FlowJo (Tree Star Inc, OR). Les calculs ont été effectués à l’aide du progiciel GraphPad Prism®, et le test t de Student a été appliqué pour évaluer les différences entre les groupes traités au DCA et les groupes témoins. Une valeur P inférieure à 0,05 a été considérée comme statistiquement significative. Les données sont représentées sous forme de moyenne ± l’écart-type.
Résultats
Le DCA inhibe la croissance des cellules du cancer du sein
Afin d’étudier la sensibilité des cellules du cancer du sein au DCA, nous avons traité un panel de lignées cellulaires du cancer du sein avec 5 mM de DCA (Fig. 1a). Les cellules MCF-7, T-47D, 13762 MAT et V14 ont toutes montré une diminution de 60-80% du nombre de cellules au jour 4 du traitement, alors que les cellules 4T1 étaient insensibles. En revanche, le DCA n’a eu aucun effet sur la croissance d’une lignée cellulaire témoin non cancéreuse, MCF-10A.
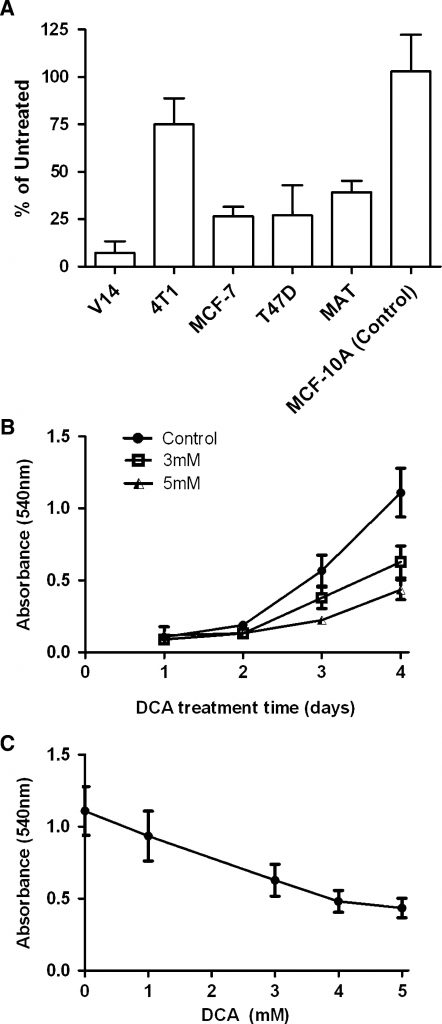
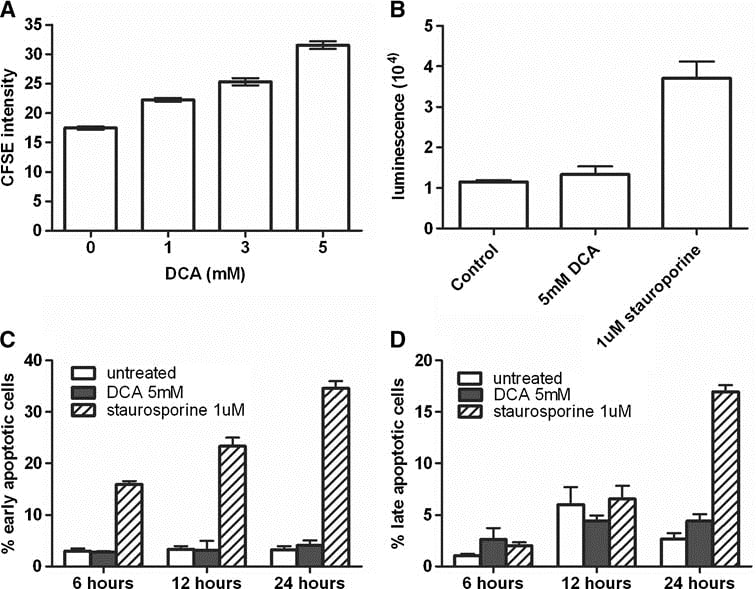
L’effet du DCA sur les cellules MAT a été examiné plus en détail à la fois in vitro et in vivo. La réponse des cellules MAT au DCA était à la fois dépendante du temps et de la dose (Fig. 1b, c). L’effet le plus marqué a été observé au jour 4, lorsque les cellules MAT traitées avec 5 mM de DCA présentaient 68 ± 5 % de cellules en moins que les cultures témoins (n = 3, P < 0,0001). Afin de déterminer la raison de la diminution du nombre de cellules, la prolifération cellulaire et l’apoptose ont été mesurées. En utilisant le test de prolifération cellulaire CFSE, on a constaté qu’après 3 jours, les cellules MAT traitées avec 5 mM de DCA présentaient une fluorescence significativement plus élevée par rapport aux cellules non traitées (P = 0,0009 ; n = 3), ce qui indique une division cellulaire réduite (Fig. 2a). Ce phénomène était évident même à 1 mM de DCA. En revanche, l’apoptose n’a pas été augmentée par le DCA (fig. 2b-d). Le traitement avec 5 mM de DCA a montré une augmentation faible (15 %) mais statistiquement significative de l’activité de la caspase 3/7 après 3 h (fig. 2b) ; toutefois, il s’agissait d’une augmentation minime par rapport au témoin positif staurosporine (2,2 fois). La coloration de l’annexine V et de l’IP a également indiqué que le traitement au DCA 5 mM n’a pas réussi à induire l’apoptose dans les cellules MAT, même après 24 heures d’incubation (Fig. 2c, d).
LeDCA inverse le phénotype glycolytique
Le traitement des cellules MAT avec 5 mM de DCA pendant 30 min a entraîné une augmentation de 18 ± 3 % des niveaux d’ATP total (n = 3, P = 0,009), et cet effet a persisté à 3 h. Après 12 h de traitement au DCA, la concentration de lactate extracellulaire a diminué de 16,3 ± 5,3 % (n = 4, P = 0,01). Ces données confirment l’inversion du phénotype glycolytique des cellules MAT par le DCA.
LeDCA a réduit la croissance tumorale in vivo
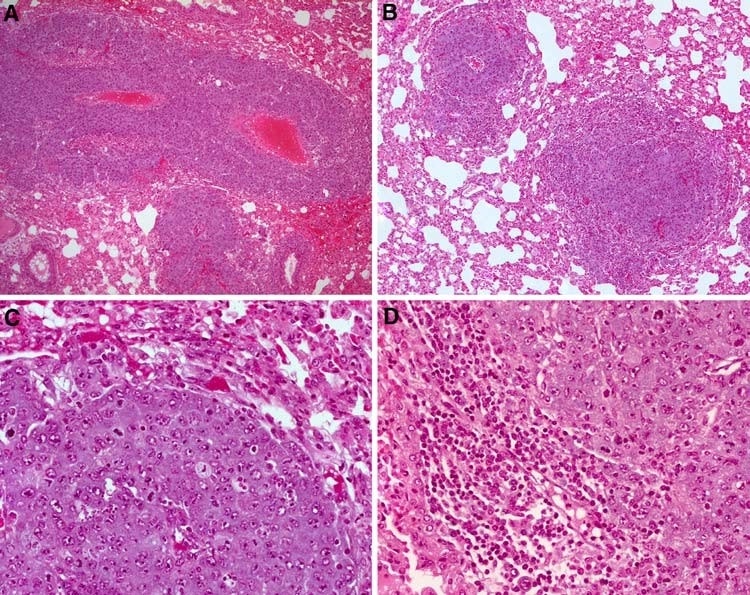
Après injection i.v. de cellules MAT, il n’y a pas eu de changement dans le nombre de métastases chez les rats du groupe recevant une faible dose de DCA (recevant ∼86 mg/kg de DCA par voie orale uniquement). En revanche, les rats du groupe DCA à forte dose (recevant des injections i.p. quotidiennes de 200 mg/kg/jour de DCA en plus du DCA par voie orale) ont présenté une réduction significative de 58 ± 17 % du nombre de tumeurs pulmonaires observées macroscopiquement (P = 0,0001, n ≥ 9 par groupe) (figure 3). Au niveau microscopique, cependant, le nombre de lésions est resté inchangé dans les trois groupes (6,4 ± 2,8, 7,1 ± 3,4 et 6,2 ± 3,2 par 5 champs à haute puissance pour le contrôle, la faible et la forte dose, respectivement). Les lésions des rats traités par la dose élevée de DCA ont développé moins de nécrose tumorale et présentaient un nombre de mitoses plus élevé (9,4 ± 7,0 vs 20,2 ± 9,2 par 5 hpf chez le témoin et la dose élevée de DCA, respectivement, P = 0,03) (Fig. 4). Les corps apoptotiques n’étaient pas une caractéristique dans aucun des groupes. Le traitement au DCA a également entraîné une infiltration lymphocytaire modérée, en particulier sur les bords des tumeurs, alors que le groupe témoin n’était associé qu’à des lymphocytes occasionnels associés à la tumeur (Fig. 4).
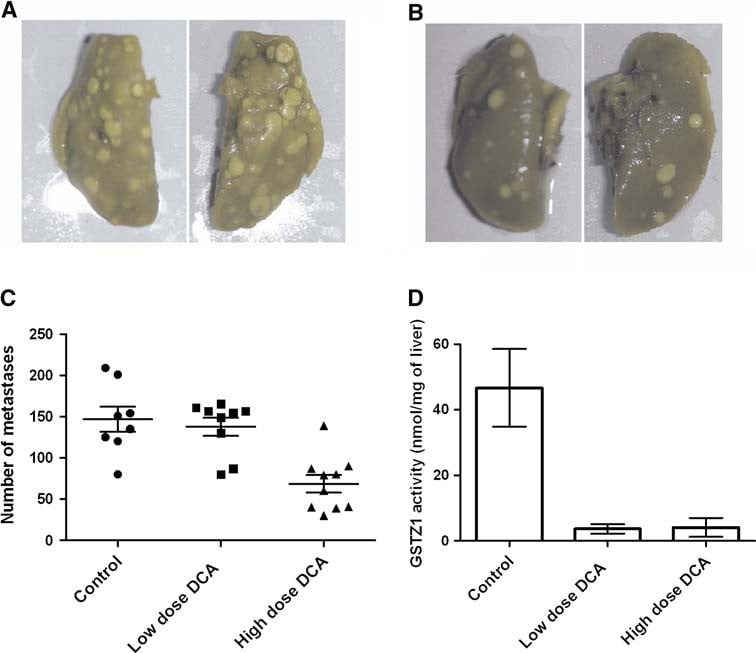
L’activité de la GSTZ1-1 a été mesurée dans le foie de rats porteurs de tumeurs traités au DCA afin de confirmer l’exposition des rats au DCA. Les groupes traités à faible et à forte dose ont présenté une diminution de 93 % et de 95 %, respectivement, de l’activité GSTZ1-1 du foie après le traitement au DCA, ce qui indique une élimination presque complète de l’activité GSTZ1-1 aux deux doses.
Discussion
Le phénotype glycolytique est presque universel dans les carcinomes mammaires et est associé à des foyers micro-invasifs et à des résultats de survie plus faibles [2-5]. Le DCA est un inhibiteur de la PDK et est capable d’inverser le phénotype glycolytique. Dans cette étude, nous rapportons qu’un certain nombre de lignées cellulaires de cancer du sein sont sensibles au DCA, avec une inhibition de la croissance observée sur plusieurs jours de traitement (Fig. 1). Des études in vitro sur les cellules MAT ont clairement démontré que cela était dû à une inhibition de la prolifération, sans aucun signe d’apoptose ou de mort cellulaire (Fig. 2). Cela contraste avec les études publiées à ce jour sur le traitement au DCA de cellules cancéreuses de l’endomètre, de la prostate et du poumon où, dans la plupart des cas, une augmentation de l’apoptose sans effet sur la distribution du cycle cellulaire [9,22], ou une augmentation de l’apoptose accompagnée d’une diminution de la prolifération [8] a été signalée. Seules deux des six lignées cellulaires étudiées ont présenté une modification de la distribution du cycle cellulaire après le traitement au DCA, l’une avec un arrêt G0/G1 et l’autre avec un arrêt S et un arrêt G2/M [9,22]. Bien que le DCA inhibe la croissance cellulaire dans un large éventail de cellules cancéreuses, le mécanisme semble dépendre de la lignée cellulaire. On a également observé une absence d’apoptose dans la lignée cellulaire humaine de cancer du sein T-47D après le traitement au DCA (données non présentées), ce qui indique que cette réponse n’est pas propre aux cellules MAT, mais qu’elle pourrait être une caractéristique des cellules de cancer du sein. Il s’agit d’une possibilité intrigante qui fera l’objet d’une étude plus approfondie. L’absence d’apoptose peut également être due à des niveaux élevés de protéines de survie cellulaire, telles que Bcl-2, survivine et PUMA, dans les lignées cellulaires testées. L’expression de ces facteurs de survie a été réduite par le traitement au DCA dans les cellules cancéreuses de la prostate, du poumon et de l’endomètre [8,22], ce qui pourrait contribuer à la réponse apoptotique observée.
La sensibilité des lignées cellulaires de cancer du sein au DCA variait de 20 à 80 % d’inhibition de la croissance cellulaire sur 4 jours de traitement à 5 mM (figure 1), les cellules 4T1 étant les moins sensibles. La sensibilité au DCA peut être déterminée par de multiples facteurs, notamment la capacité à métaboliser le DCA via la GSTZ1 ou la surexpression de différentes isoformes de PDK. Il existe quatre isoformes de PDK, avec des Kis pour le DCA de 1,0, 0,2, 8,0 et 0,5 mM, respectivement [23]. Alors que les PDK1, 2 et 4 seraient inhibées par les concentrations de DCA utilisées dans cette étude, la PDK3 ne le serait pas. L’expression de PDK3 est normalement limitée aux testicules [23], bien que l’expression et l’induction par l’hypoxie de PDK3 aient été rapportées pour plusieurs lignées cellulaires cancéreuses [24]. Des études visant à corréler l’expression de PDK avec la sensibilité au DCA et à déterminer quelles tumeurs sont le plus efficacement ciblées par le DCA sont en cours.
Une petite augmentation des activités de la caspase 3/7 a également été observée. Cela pourrait être dû à la réactivation de la chaîne de transport d’électrons par le DCA et à l’augmentation de la production d’espèces réactives de l’oxygène et de l’azote dans les mitochondries [25]. Cette augmentation du niveau basal de l’activité des caspases n’est peut-être pas suffisante pour induire l’apoptose ; cependant, elle peut indiquer que le DCA pourrait être utilisé pour sensibiliser les cellules cancéreuses à d’autres déclencheurs apoptotiques, tels que l’hypoxie, les radiations ou d’autres agents chimiothérapeutiques. Ces synergies potentielles nécessitent une analyse plus approfondie.
In vivo, l’inversion du phénotype glycolytique en ciblant le couplage pyruvate-acétyl CoA de la glycolyse et de la respiration mitochondriale a déjà été démontrée comme étant efficace contre la croissance des tumeurs primaires dans deux modèles [1,8]. Nous avons démontré le potentiel du DCA à être efficace contre la maladie métastatique in vivo dans le modèle cellulaire MAT. Alors que le nombre macroscopique de lésions pulmonaires a été réduit par le DCA à haute dose, le nombre de lésions microscopiques n’a pas été modifié, ce qui suggère que l’effet principal du DCA a été sur la taille des tumeurs, plutôt qu’une réduction du nombre de cellules capables de s’établir comme tumeurs dans les poumons. L’observation d’une plus faible incidence de nécrose dans les tumeurs traitées au DCA est également cohérente avec un mécanisme d’inhibition de la croissance comme cela a été observé in vitro. L’augmentation du nombre de mitoses semble initialement être en contradiction avec cela, suggérant des taux de prolifération plus élevés ; cependant, nous suggérons que cela peut être dû à l’arrêt du cycle cellulaire par le DCA avant l’anaphase, conduisant à une accumulation de cellules présentes sous forme de figures mitotiques. Il est intéressant de noter qu’il y a eu une augmentation des lymphocytes associés à la tumeur chez les animaux traités par une dose élevée de DCA. Une réponse immunitaire plus forte contre les tumeurs peut être favorisée par une réduction des niveaux de lactate de la tumeur obtenue par le traitement au DCA, car il a été démontré que des concentrations élevées d’acide lactique réduisent la fonction des cellules T [26]. Les expériences menées avec les cellules V14 in vivo suggèrent que ces dernières sont sensibles au DCA d’une manière similaire aux cellules MAT, avec une réduction de la croissance tumorale primaire et une augmentation de la présence de lymphocytes (données non présentées), ce qui indique que ces effets in vivo ne sont pas propres aux cellules MAT.
L’utilisation d’agents à des concentrations millimolaires est souvent considérée comme intenable. Cependant, des concentrations sériques millimolaires de DCA (0,3-1 mM) ont été maintenues de façon chronique chez des patients par administration orale de DCA à raison de 25 mg/kg/jour [27]. Dans le cadre d’un traitement aigu de patients, on a toléré jusqu’à 80 mg/kg i.v. pendant une transplantation hépatique [28]. Bien que la dose efficace de DCA in vivo dans ce modèle de rat soit élevée, la concentration plasmatique estimée atteinte in vivo (1,5-3 mM, voir Méthodes) est similaire à celle observée chez l’homme recevant 25 mg/kg/jour, et est donc pertinente dans le contexte clinique. Cette gamme de concentrations plasmatiques est également en corrélation avec l’inhibition de la prolifération in vitro (dès 1 mM, Fig. 2a) et avec le Ki d’inhibition des PDK par le DCA [23], ce qui appuie la proposition selon laquelle la PDK est la cible responsable des activités anticancéreuses du DCA.
Bien que le traitement chronique par le DCA chez les patients atteints de MELAS ait entraîné une certaine neurotoxicité périphérique réversible [10], la toxicité du DCA pour les tissus vulnérables aux agents cytotoxiques classiques est minime [8,29], ce qui en fait un bon agent candidat pour une thérapie combinée. Par exemple, bien que le DCA inhibe de manière irréversible la GSTZ1 (Fig. 2d), les souris traitées au DCA n’ont pas présenté la déplétion lymphocytaire observée chez les souris génétiquement déficientes en GSTZ [21,30]. Par conséquent, l’inversion du phénotype glycolytique dans le cancer du sein par l’inhibition de la PDK avec le DCA est une stratégie anticancéreuse prometteuse et démontre également une application potentielle des inhibiteurs alternatifs de la PDK actuellement en cours de développement [31]. Néanmoins, d’autres études mécanistes visant à comprendre la relation de cause à effet entre le phénotype glycolytique et les caractéristiques tumorales sont nécessaires pour permettre un ciblage efficace du métabolisme des cellules cancéreuses à des fins thérapeutiques.
Remerciements
Cette recherche a été soutenue par une subvention de la National Breast Cancer Foundation Australia, et par le NHMRC 366787 R.D. Wright Career Development Award.
RÉFÉRENCES
1 Fantin VR, St-Pierre J, Leder P (2006) Attenuation of LDH-a expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance. Cancer Cell 9:425-4342 Gatenby R, Gillies RJ (2007) Glycolysis in cancer : a potential target for therapy. Int J Biochem Cell Biol 39:1358-1366
3 Isidoro A, Martnez M, Fernndez PL, Ortega AD, Santamara G, Chamorro M, Reed JC, Cuezva JM (2004) Alteration of the bioenergetic phenotype of mitochondria is a hallmark of breast, gastric, lung and oesophageal cancer. Biochem J 378:17-20
4 Isidoro A, Casado E, Redondo A, Acebo P, Espinosa E, Alonso AM, Cejas P, Hardisson D, Fresno Vara JA, Belda-Iniesta C, Gonzlez-Barn M, Cuezva JM (2005) Breast carcinomas fulfill the Warburg hypothesis and provide metabolic markers of cancer prognosis. Carcinogenèse 26:2095-2104
5 Robey IF, Lien AD, Welsh SJ, Baggett BK, Gillies RJ (2005) Hypoxia-inducible factor-1α and the glycolytic phenotype in tumors. Neoplasia 7:324-330
6 Gatenby RA, Smallbone K, Maini PK, Rose F, Averill J, Nagle RB, Worrall L, Gillies RJ (2007) Cellular adaptations to hypoxia and acidosis during somatic evolution of breast cancer. Br J Cancer 97:646-653
7 Gudi R, Bowker-Kinley MM, Kedishvili NY, Zhao Y, Popov KM (1995) Diversity of the pyruvate dehydrogenase kinase gene family in humans. J Biol Chem 270:28989-28994
8 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, Harry G, Hashimoto K, Porter CJ, Andrade MA, Thebaud B, Michelakis ED (2007) A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11:37-51
9 Wong JY, Huggins GS, Debidda M, Munshi NC, Vivo ID (2008) Le dichloroacétate induit l’apoptose dans les cellules cancéreuses de l’endomètre. Gynecol Oncol 109:394-402
10 Kaufmann P, Engelstad K, Wei Y, Jhung S, Sano MC, Shungu DC, Millar WS, Hong X, Gooch CL, Mao X, Pascual JM, Hirano M, Stacpoole PW, DiMauro S, Vivo DCD (2006) Dichloroacetate causes toxic neuropathy in MELAS : a randomized, controlled clinical trial. Neurologie 66:324-330
11 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, Hutson AD, Neiberger RE, O’Brien RG, Perkins LA, Quisling RG, Shroads AL, Shuster JJ, Silverstein JH, Theriaque DW, Valenstein E (2006) Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics 117:1519-1531
12 Pearson H (2007) Cancer patients opt for un médicament non approuvé. Nature 446:474-475
13 Parish CR, Freeman C, Brown KJ, Francis DJ, Cowden WB (1999) Identification of sulfated oligosaccharide-based inhibitors of tumor growth and metastasis using novel in vitro assays for angiogenesis and heparanase activity. Cancer Res 59:3433-3441
14 Blackburn AC, McLary SC, Naeem R, Luszcz J, Stockton DW, Donehower LA, Mohammed M, Mailhes JB, Soferr T, Naber SP, Otis CN, Jerry DJ (2004) La perte d’hétérozygotie se produit par recombinaison mitotique chez les souris Trp53+/- et est associée à la susceptibilité aux tumeurs mammaires de la souche BALB/c. Cancer Res 64:5140-5147
15 Schmuck E, Cappello J, Coggan M, Brew J, Cavanaugh JA, Blackburn AC, Baker RT, Eyre HJ, Sutherland GR, Board PG (2008) La délétion de Glu155 entraîne une déficience de la glutathion transférase Omega 1-1 mais ne modifie pas la sensibilité au trioxyde d’arsenic et à d’autres médicaments cytotoxiques. Int J Biochem Cell Biol 40:2553-2559
16 Quah BJ, Warren HS, Parish CR (2007) Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc 2:2049-2056
17 Beutler E (1975) Red cell metabolism : a manual of biochemical methods, 2nd edn. Grune & Stratton Inc, New York
18 Saghir SA, Schultz IR (2002) Low-dose pharmacokinetics and oral bioavailability of dichloroacetate in naive and GST-zeta-depleted rats. Environ Health Perspect 110:757-763
19 Gonzalez-Leon A, Schultz IR, Xu G, Bull RJ (1997) Pharmacocinétique et métabolisme du dichloroacétate chez le rat F344 après administration préalable dans l’eau potable. Toxicol Appl Pharmacol 146:189-195
20 Board PG, Anders MW (2005) Human glutathione transferase zeta. Methods Enzymol 401:61-77
21 Lim CEL, Matthaei KI, Blackburn AC, Davis RP, Dahlstrom JE, Koina ME, Anders MW, Board PG (2004) Mice deficient in glutathione transferase zeta/maleylacetoacetate isomerase exhibit a range of pathological changes and elevated expression of alpha, mu and pi class glutathione transferases. Am J Pathol 165:679-693
22 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C, Rosser CJ (2008) Le dichloroacétate (DCA) sensibilise in vitro les cellules cancéreuses de la prostate de type sauvage et sur-exprimant Bcl-2 aux radiations. Prostate 68:1223-1231
23 Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM (1998) Evidence for existence of tissue-specific regulation of the mammalian pyruvate dehydrogenase complex. Biochem J 329:191-196
24 Lu CW, Lin SC, Chen KF, Lai YY, Tsai SJ (2008) Induction of pyruvate dehydrogenase kinase-3 by hypoxia-inducible factor-1 promotes metabolic switch and drug resistance. J Biol Chem 283:28106-28114
25 DiPietrantonio AM, Hsieh T, Wu JM (1999) Activation de la caspase 3 dans les cellules HL-60 exposées au peroxyde d’hydrogène. Biochem Biophys Res Commun 255:477-482
26 Fischer K, Hoffmann P, Voelkl S, Meidenbauer N, Ammer J, Edinger M, Gottfried E, Schwarz S, Rothe G, Hoves S, Renner K, Timischl B, Mackensen A, Kunz-Schughart L, Andreesen R, Krause SW, Kreutz M (2007) Inhibitory effect of tumor cell-derived lactic acid on human T cells. Blood 109:3812-3819
26 Mori M, Yamagata T, Goto T, Saito S, Momoi MY (2004) Dichloroacetate treatment for mitochondrial cytopathy : long-term effects in MELAS. Brain Dev 26:453-458
28 Shangraw RE, Lohan-Mannion D, Hayes A, Moriarty RM, Fu R, Robinson ST (2008) Le dichloroacétate stabilise l’équilibre acido-basique peropératoire pendant la transplantation du foie. Liver Transpl 14:989-998
29StacpoolePW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW, Shuster JJ (2008) Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pédiatrie 121:e1223-e1228
30 Theodoratos A, Tu WJ, Cappello J, Blackburn AC, Matthaei K, Board PG (2009) Phenylalanine-induced leucopenia in genetic and dichloroacetic acid generated deficiency of glutathione transferase zeta. Biochem Pharmacol 77:1358-1363
31 Mayers RM, Leighton B, Kilgour E (2005) PDH kinase inhibitors : a novel therapy for Type II diabetes ? Biochem Soc Trans 33:367-370
Contenu connexe :