Jason Y.Y. Wong1, Gordon S. Huggins2, Marcella Debidda4, Nikhil C. Munshi4, et Immaculata De Vivo1,3
1 Laboratoire Channing, Département de médecine, Brigham and Women’s Hospital et Harvard Medical School, Boston Massachusetts.
2 Molecular Cardiology Research Institute, Tufts-New England Medical Center, Boston Massachusetts.
3 Programme d’épidémiologie moléculaire et génétique, Harvard School of Public Health, Boston Massachusetts.
4 The Jerome Lipper Multiple Myeloma Center, Department of Medical Oncology, Dana-Farber Cancer Institute, Harvard Medical School, Boston Massachusetts.
Correspondance : Immaculata De Vivo, Brigham and Women’s Hospital, Département de médecine, Channing Laboratory, 181 Longwood Ave, Boston, MA, 02115, USA. Téléphone : 617-525-2094. Fax : 617-525-2008. [email protected].
Reçu : 14 septembre 2020
Accepté : 4 décembre 2020
Publié : 9 décembre 2020
Résumé
Objectif : Une étude récente a démontré que le traitement au Dichloroacétate (DCA) favorisait l’apoptose dans les lignées cellulaires cancéreuses du poumon, du sein et du glioblastome en déplaçant le métabolisme de la glycolyse aérobie à l’oxydation du glucose, couplé à un remodelage de l’axe NFAT-Kv1.5. L’objectif de cette étude était de déterminer si le DCA induit l’apoptose dans les cellules cancéreuses de l’endomètre et d’évaluer le mécanisme apoptotique.
Méthodes : Un panel de lignées de cellules cancéreuses de l’endomètre présentant divers degrés de différenciation a été traité avec du DCA et analysé pour l’apoptose par cytométrie de flux. Les corrélats biologiques tels que l’expression génétique, le Ca2+ intracellulaire et le potentiel de la membrane mitochondriale ont été examinés pour évaluer le mécanisme apoptotique.
Résultats : Le déclenchement de l’apoptose a été observé dans cinq lignées cellulaires cancéreuses faiblement à modérément invasives, notamment Ishikawa, RL95-2, KLE, AN3CA et SKUT1B, tandis que le traitement n’a eu aucun effet sur les cellules 293T non cancéreuses. Deux lignées cellulaires d’adénocarcinome endométrial très invasives, HEC1A et HEC1B, se sont révélées résistantes à l’apoptose induite par le DCA. Les lignées cellulaires répondant à l’apoptose présentaient une augmentation significative de l’apoptose précoce et tardive, une diminution du potentiel de la membrane mitochondriale et une diminution de l’abondance de la transcription de Survivin, ce qui est cohérent avec un mécanisme régulé par les mitochondries. Le traitement au DCA a diminué les niveaux de calcium intracellulaire dans la plupart des lignées cellulaires répondant à l’apoptose, ce qui suggère une contribution de la voie médiée par NFAT-Kv1.5. Le traitement au DCA a augmenté les transcriptions du modulateur de l’apoptose régulé par p53 (PUMA) dans les lignées cellulaires présentant une réponse apoptotique, ce qui suggère l’implication d’un mécanisme médié par p53-PUMA.
Mots clés : Dichloroacétate ; Endométriale ; Cancer ; Apoptose ; Mitochondries
Déclaration de conflit d’intérêts : Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts.
Conclusions : Le dichloroacétate sensibilise efficacement la plupart des lignées cellulaires du cancer de l’endomètre à l’apoptose via des mécanismes médiés par les mitochondries, NFAT-Kv1.5 et PUMA. Des études supplémentaires sur le potentiel thérapeutique du DCA dans le traitement du cancer sont justifiées.
La présence de MMP est confirmée par la coloration fluorescente du TMRM dans une expérience dose-réponse du DCA. Les barres d’erreur représentent l’erreur standard de 2 expériences indépendantes réalisées dans des puits triples.
INTRODUCTION
Le cancer de l’endomètre (CE) est une néoplasie de la muqueuse épithéliale du corps utérin. Il s’agit de la tumeur maligne gynécologique la plus fréquente aux États-Unis et de la quatrième cause de décès par cancer chez les femmes dans ce pays [1]. Il existe peu d’options thérapeutiques sans inconvénients sérieux pour les personnes atteintes d’un cancer de l’endomètre récurrent ou métastatique. La chimiothérapie pour les maladies métastatiques présente des taux élevés de toxicité, de névralgie et de complications cardiaques[2, 3]. L’élan du développement futur des thérapies anticancéreuses sera de réduire les effets indésirables graves tout en démontrant une efficacité comparable ou améliorée par rapport aux traitements existants.
La glycolyse aérobie, également connue sous le nom d' »effet Warburg », est une propriété unique de la plupart des cancers. Ce phénomène se caractérise par une augmentation de l’absorption du glucose et une dépendance à la glycolyse pour la production d’ATP, malgré la présence d’une source d’oxygène disponible [5]. On pense que la glycolyse aérobie est le résultat d’un dysfonctionnement mitochondrial qui confère une résistance apoptotique aux cellules cancéreuses [6]. Cette résistance apoptotique est due à l’hyperpolarisation de la membrane mitochondriale qui empêche la libération des médiateurs pro-apoptotiques de la mitochondrie vers le cytoplasme [4]. Les membranes mitochondriales hyperpolarisées sont caractéristiques de la plupart des carcinomes et leur inversion est associée à l’initiation de l’apoptose [7,8].
Le ciblage thérapeutique de la glycolyse aérobie est un nouveau moyen de cibler les cellules cancéreuses. Le régulateur clé du métabolisme cellulaire est la pyruvate déshydrogénase (PDH) qui est à son tour inhibée par la pyruvate déshydrogénase kinase (PDK). Une étude récente a montré que l’activité de la PDK dans les lignées cellulaires cancéreuses peut être régulée à la baisse par le DCA [4]. Le ciblage métabolique par le DCA implique deux mécanismes synergiques, les voies proximale et distale [4]. Dans la voie proximale (régulée par les mitochondries), le DCA se lie à la PDK et atténue l’inhibition de l’activité de la PDH. L’augmentation de l’activité de la PDH fait passer le métabolisme de la glycolyse à l’oxydation du glucose et diminue l’hyperpolarisation du potentiel de la membrane mitochondriale (PMM), ce qui ouvre les pores de transition mitochondriaux (PMT). Cela permet la translocation des espèces réactives de l’oxygène (ROS) et du cytochrome c de la mitochondrie vers le cytoplasme, induisant ensuite l’apoptose par l’activation des caspases [4]. Dans la voie distale (NFAT-Kv1.5), les ROS transloqués dilatent les canaux d’ions potassium Kv1.5 sur la membrane plasmique. L’expulsion des ions potassium hyperpolarise la cellule, empêchant l’entrée du Ca2+ dépendant du voltage. La diminution du niveau de Ca2+ intracellulaire inhibe l’activation de NFAT, qui augmente encore l’expression de Kv1.5, créant une boucle de rétroaction positive qui aboutit finalement à une réduction de l’inhibition tonique des caspases [4].
Il existe un dialogue croisé important entre les voies apoptotiques mitochondriales et celles médiées par p53. Le modulateur d’apoptose régulé par p53(PUMA) est l’une de ces protéines pro-apoptotiques qui fait le lien entre les mécanismes mitochondriaux et ceux médiés par le suppresseur de tumeur p53. PUMA est un membre de la famille des protéines BH3 dont l’expression est régulée transcriptionnellement par p53 [9-11]. Lors de l’activation par divers stimuli apoptotiques, PUMA se déplace vers la membrane mitochondriale où elle s’oppose aux protéines Bcl-2 pro-survie en se liant à son domaine BH3, induisant la libération de cytochrome c et favorisant l’apoptose [10,12]. Dans des études récentes de knock-out, il a été déterminé que PUMA est un médiateur critique de l’apoptose dépendante de p53 dans les thymocytes murins et les cellules cancéreuses colorectales humaines [13,14].
De nombreuses études ont montré que le dichloroacétate favorise l’oxydation du glucose dans divers troubles mitochondriaux [15,16]. De plus, il a été constaté que le traitement au DCA avait des effets secondaires plus légers dans les études cliniques sur les encéphalomyopathies mitochondriales que ceux des traitements actuels du cancer de l’endomètre [17]. À ce jour, l’effet du DCA a été étudié sur un nombre limité de lignées cellulaires cancéreuses et notre compréhension des mécanismes apoptotiques alternatifs régulés par le DCA est déficiente. L’objectif de notre étude était de déterminer si le DCA sensibilise un panel de lignées cellulaires cancéreuses de l’endomètre à l’apoptose et d’évaluer la contribution des mécanismes régulés par les mitochondries, NFAT-Kv1.5 et PUMA dans le processus apoptotique en examinant les corrélats biologiques.
Matériel et méthodes
Culture cellulaire
Les lignées cellulaires AN3CA, SKUT1B, RL95-2, KLE, HEC1A et HEC1B ont été achetées auprès de American Type Culture Collection (Manassas, VA) et la lignée cellulaire Ishikawa a été achetée auprès de Sigma-Aldrich (St. Louis, MO). Les cellules épithéliales rénales 293T qui ont servi de témoins sains non cancéreux ont été fournies par Nikhil Munshi. L’adénocarcinome épithélial mammaire MCF7 était un don de Ramon Parsons (Université Columbia). Les lignées cellulaires ont été propagées selon les conditions spécifiées par le distributeur. Les lignées cellulaires ont été maintenues dans un incubateur humidifié à 37°C, 5% deCO2. Les milieux de croissance DMEM, McCoy’s 5A, MEM, et DMEM-F12 ainsi que les suppléments de pénicilline-streptomycine et d’insuline ont été achetés auprès de Gibco-Invitrogen (Carlsbad, CA). Le dichloroacétate (Alfa Aesar, Ward Hill, MA) a été dissous en une solution de travail 1M, stérilisé par filtration, puis dilué aux concentrations de traitement dans les milieux de croissance.
Essai de viabilité cellulaire
La viabilité cellulaire a été mesurée à l’aide du réactif CellTiter-Blue (Promega) qui mesure la capacité des cellules viables saines à métaboliser un substrat de Résazurine en un produit fluorescent de Résorufine. En bref, 3×104 cellules de chaque lignée cellulaire ont été placées dans des plaques de culture tissulaire à 96 puits à parois opaques et incubées dans des conditions de croissance standard pendant une nuit jusqu’à 60-70% de confluence. Le milieu de chaque puits a ensuite été remplacé par un milieu de croissance frais contenant des concentrations croissantes de DCA (0 mM, 1 mM, 5 mM, 10 mM). Chaque puits a été réalisé en triplicat dans deux ou plusieurs expériences indépendantes pour chaque lignée cellulaire. Après le traitement, les plaques ont été incubées pendant 40 heures à 37°C, puis 20 µL de substrat de Résazurine ont été ajoutés directement dans chaque puits et incubés pendant 3 heures supplémentaires. Les plaques ont ensuite été lues sur un lecteur de plaques Gemini XPS de Molecular Devices (Sunnyvale, CA) à 560/590 nm.
Essais d’apoptose
La cytométrie en flux avec coloration Annexin-V-FITC (BD Bioscience, San Jose, CA) et 7-amino-actinomycine D (7-AAD) a été utilisée pour déterminer si le traitement induit spécifiquement une apoptose précoce. En bref, 5×105 cellules pour chaque lignée cellulaire ont été ensemencées dans des plaques de culture de tissus à 6 puits et incubées pendant la nuit jusqu’à 60-70 % de confluence dans des conditions de croissance standard. Le milieu de chaque lignée cellulaire a ensuite été remplacé par un milieu de croissance frais avec et sans une dose de 10 mM de DCA. Les groupes de traitement pour chaque lignée cellulaire ont été répétés trois fois. Les cellules ont ensuite été incubées pendant 40 heures à 37 °C et récoltées avec de la trypsine-EDTA à 0,25 % (Invitrogen, Carlsbad, CA). Les cellules ont été lavées avec du PBS 1X, puis colorées selon le protocole du fabricant. La cytométrie en flux a été réalisée sur un BD FACSCanto II (BD Bioscience) et les données ont été analysées sur les logiciels FlowJo 7.2.2 (Tree Star, Ashland, OR) et BD FACSDiva 6.0 (BD Bioscience).
Le kit de test Apoptag Peroxidase Terminal dUTP Nick-end Labeling (TUNEL) (Millipore, Billerica, MA) a été utilisé pour visualiser les cellules apoptotiques ayant subi une fragmentation génomique dépendante des caspases. En bref, 5×104 cellules de plusieurs lignées cellulaires représentatives du cancer de l’endomètre ont été ensemencées et propagées sur des lames de chambre à 4 puits (Nunc, Rochester, NY) pendant une nuit. Le milieu de chaque puits a ensuite été remplacé par un milieu de croissance frais avec ou sans 10 mM de DCA. Après 48 heures, les cellules ont été fixées avec du paraformaldéhyde à 1% et colorées selon le protocole du fabricant. La coloration a été réalisée par le Dana Farber – Harvard Cancer Center Pathology Core facility. Les images ont été capturées avec un objectif 40X sur un microscope Zeiss Axioskop 2 Plus (Thornwood, NY) en utilisant le logiciel AxioVs40 v.4.4.1.0 à 24-bit RGB.
Essai de prolifération cellulaire
La cytométrie en flux utilisant la bromodésoxyuridine (BrdU) (BD Bioscience) et la coloration 7-AAD a été utilisée pour mesurer la prolifération cellulaire. En bref, plusieurs lignées cellulaires représentatives du cancer de l’endomètre ont été propagées comme indiqué ci-dessus pour le test Annexin-V. Les cellules ont ensuite été privées de sérum. Les cellules ont ensuite été privées de sérum pendant 8 heures dans un milieu de croissance contenant 0,5 % de FBS afin de réinitialiser le cycle cellulaire à la phase G0. Le milieu a ensuite été changé en milieu de croissance normal avec et sans traitement au DCA 10 mM. Après 24 heures, les cellules ont été pulsées pendant 2 heures avec 10 µM de BrdU dans le milieu de croissance. Les cellules ont ensuite été récoltées, colorées et analysées selon le protocole du fabricant.
Tests du potentiel membranaire mitochondrial
Le potentiel membranaire mitochondrial a été détecté à l’aide du kit de détection de l’apoptose Mitocapture (Calbiochem). La croissance, le traitement et la disposition expérimentale des lignées cellulaires étaient identiques à ceux du test Annexin-V décrit ci-dessus. Après une période d’incubation de 24 heures suivant le traitement avec et sans DCA 10 mM, les cellules ont été récoltées et lavées avec du PBS 1X, puis colorées avec le réactif Mitocapture selon le protocole du fabricant et analysées par cytométrie en flux. Une version modifiée d’un protocole impliquant la coloration des mitochondries avec de l’ester méthylique de tétraméthyl rhodamine (TMRM) (Invitrogen, Carlsbad, CA) décrit ailleurs, a également été utilisée pour évaluer la MMP [18]. En bref, les cellules ont été propagées et traitées exactement comme le test de viabilité cellulaire décrit ci-dessus. Après une période d’incubation de 24 heures, 5×104 cellules ont été isolées, lavées dans du PBS 1X, et remises en suspension dans une solution saline tamponnée de Hanks (HBSS) (Sigma-Aldrich, St. Louis, MA) avec 50 nM de MMPT et incubées pendant 30 minutes à 37°C. Les cellules ont été transférées dans une plaque opaque à 96 puits et la fluorescence a été mesurée à 530/620 nm à 37°C à l’aide d’un lecteur de plaques.
Niveaux de calcium intracellulaire
Les niveaux de calcium intracellulaire ont été mesurés à l’aide du test FLUO-4 NW Calcium Assay (Invitrogen). En bref, 3×104 cellules pour chaque lignée cellulaire ont été placées sur des plaques de culture de tissus individuelles à parois opaques de 96 puits et incubées dans des conditions de croissance standard pendant 8 heures. Le milieu de chaque puits a ensuite été remplacé par un milieu de croissance frais contenant des concentrations croissantes de DCA. Chaque groupe de traitement a été répété dans 4 puits dans au moins 2 expériences indépendantes. Après une incubation de 8 heures, les cellules de chaque puits ont été traitées avec le réactif FLUO-4 selon le protocole du fabricant. Les plaques ont ensuite été lues sur un lecteur de plaques fluorescentes à 494/516 nm.
PCR en temps réel
La PCR quantitative en temps réel a été utilisée pour détecter l’abondance des transcrits endogènes de Survivin et PUMA. Un total de 1×106 cellules pour chaque lignée cellulaire a été ensemencé et cultivé dans des plaques de culture de tissus de 10 cm pendant la nuit. Le milieu a ensuite été remplacé par un milieu de croissance frais avec ou sans traitement au DCA 10 mM. Après 40 heures d’incubation, 3×106 cellules pour chaque plaque ont été récoltées et l’ARN total a été extrait à l’aide du mini kit RNeasy Plus (Qiagen, Valencia, CA) selon le protocole du fabricant. L’ADNc premier brin a été synthétisé avec 1000 ng d’ARN total et des amorces Oligo dT en utilisant la transcriptase inverse Superscript III (Invitrogen) selon le protocole du fabricant. Le produit ADNc a ensuite été traité avec la RNase H pendant 20 minutes à 37°C et dilué à 100 ng/µL. Les concentrations d’ARN et d’ADNc ont été déterminées avec précision à l’aide d’un spectrophotomètre Nanodrop ND-1000 (Wilmington, DE).
Les séquences d’amorces pour la Survivine étaient en avant 5′-AAGAACTGGCCCTTCTTGGA-3′ et en arrière 5′- CAACCGGACGAATGCTTTT-3′ (Primerbank). Les séquences d’amorces pour PUMA et le gène de maintien RPLP0 ont été décrites dans des études précédentes [19, 20]. Les mélanges réactionnels étaient composés de 1X mélange Applied Biosystems SYBR Green PCR (Foster City, CA), 1,5 mM MgCl2, 0,42 mM dNTPs, 5U ABI Amplitaq Gold, 200 ng de matrice d’ADNc et 333 nM d’amorces directes et inverses. Les réactions ont été effectuées en triplicat dans deux expériences répétées. Les conditions de cyclage étaient les suivantes : 1 cycle à 95C pendant 10:00, 33x cycles à 95C pendant 0:30, 55C pendant 0:30, et 72C à 0:30. Une courbe standard à cinq points pour les réactions présentait des pentes linéaires de -3,2 +/- 0,1 avec des coefficients de corrélation (r2) supérieurs à 0,985. Le test a été réalisé avec un système PCR en temps réel ABI 7300 (Foster City, CA). La quantification relative des transcrits cibles normalisés par rapport à RPLP0 a été évaluée avec le logiciel d’étude RQ des systèmes de PCR en temps réel ABI 7300 en utilisant la méthode du Ct comparatif.
Analyse statistique
Le test t de Student et l’ANOVA à sens unique ont été utilisés pour évaluer les différences entre les bras de traitement. Une valeur p inférieure à 0,05 a été considérée comme significative. Les analyses ont été réalisées avec Microsoft Excel 2007 (Redmond, WA). Les graphiques ont été créés à l’aide de GraphPad Prism 5 (San Diego, CA).
Résultats
Le DCA réduit la viabilité des cellules cancéreuses de l’endomètre de façon proportionnelle à la dose
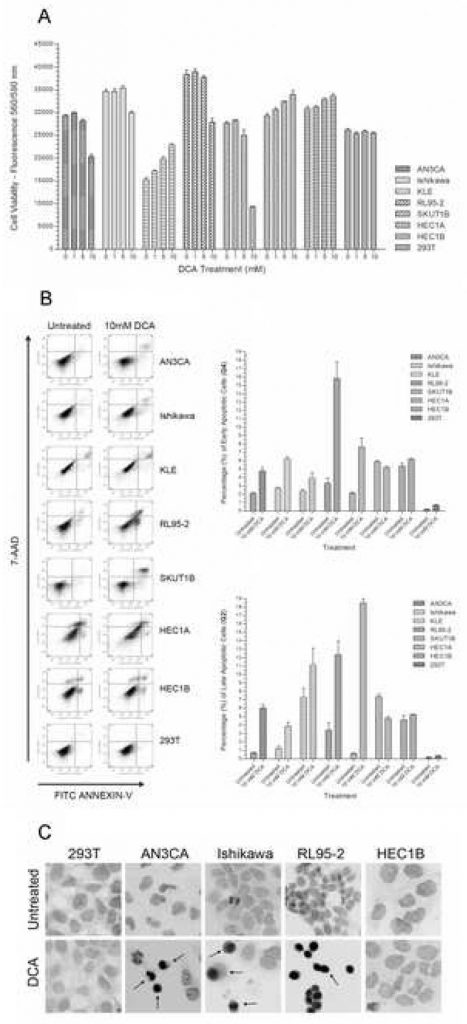
Pour déterminer l’effet du DCA sur la viabilité des cellules cancéreuses de l’endomètre, chaque lignée cellulaire a été cultivée avec des doses croissantes de DCA. Dans un panel de sept lignées de cellules cancéreuses de l’endomètre, AN3CA, Ishikawa, RL95-2 et SKUT1B ont présenté une diminution de 15 % à 75 % de la viabilité avec une concentration croissante de DCA (figure 1A). La réduction de la viabilité de la plupart des lignées cellulaires répondantes est devenue significative à la dose de 10 mM. Une comparaison entre le groupe non traité et le groupe traité au DCA 10 mM a donné des valeurs p < 0,01 pour AN3CA, Ishikawa, RL95-2 et SKUT1B. Une diminution marginalement significative de la viabilité a été observée à la dose de 5 mM pour AN3CA et RL95-2. Par conséquent, on a déterminé qu’une dose minimale efficace approximative de DCA pour ces lignées de cellules endométriales pendant la période de traitement se situait entre 5mM et 10mM. Cette concentration de DCA et cette durée de traitement se situent dans la plage d’efficacité des expériences in vitro publiées précédemment [21]. Une augmentation statistiquement significative de la viabilité a été observée avec HEC1A, HEC1B et KLE avec des concentrations croissantes de DCA (p < 0,02). Comme prévu, aucune différence statistiquement significative de viabilité n’a été observée dans les cellules épithéliales 293T pour la gamme de doses de DCA et la période de traitement données (p = 0,27).
L’effet du DCA sur la prolifération des cellules cancéreuses de l’endomètre est dépendant de la lignée cellulaire
Pour déterminer si la diminution observée de la viabilité cellulaire avec le traitement au DCA était due à un effet de prolifération cellulaire, une coloration BrdU / 7-AAD a été effectuée sur plusieurs lignées cellulaires représentatives et analysée par cytométrie de flux. Aucune différence significative dans la dynamique du cycle cellulaire ou la prolifération n’a été observée dans les cellules épithéliales Ishikawa, HEC1B et 293T avec le traitement au DCA (tableau 1). Dans les cellules AN3CA, le traitement au DCA a augmenté la prolifération, comme l’indiquent les augmentations significatives du nombre de cellules en phases S et G2/M et la diminution du nombre de cellules en G0/G1. Dans les cellules RL95-2, le traitement au DCA a diminué de manière significative la proportion de cellules en phases S et G2/M et augmenté le nombre de cellules en phase G0/G1, ce qui indique une diminution de la prolifération et un arrêt du cycle cellulaire dans un état sénescent ou quiescent.
| Lignée cellulaire / Traitement | phase S (%) | Stdev Phase S | % Phase G0 / G1 | Stdev G0/G1 | % G2 / M Phase | Stdev G2 / M Phase |
|---|---|---|---|---|---|---|
| 293T Non traité | 60.6 | 0.6 | 33.2 | 1.7 | 6.2 | 1.25 |
| 293T DCA | 58.1 | 2.2 | 31.7 | 2.2 | 10.2 | 0.34 |
| p-value | 0.15 | 0.14 | 0.03 | |||
| Ishikawa Non traité | 61.3 | 0.4 | 27.4 | 1.8 | 11.3 | 0.96 |
| Ishikawa DCA | 65.9 | 4.5 | 22.9 | 4.9 | 11.2 | 0.68 |
| p-value | 0.21 | 0.25 | 0.96 | |||
| HEC1B Non traité | 37.4 | 2.7 | 41.5 | 0.8 | 21.2 | 1.93 |
| HEC1B DCA | 42.4 | 1.5 | 34.8 | 3.6 | 22.8 | 2.15 |
| p-value | 0.19 | 0.08 | 0.47 | |||
| AN3CA Non traité | 43.5 | 0.6 | 50.6 | 2.0 | 5.9 | 1.80 |
Le DCA favorise l’apoptose dans les cellules cancéreuses de l’endomètre
Afin de déterminer si la réduction de la viabilité cellulaire due au traitement par le DCA était due à l’apoptose plutôt qu’à la nécrose, une coloration des cellules par l’Annexin-V-FITC et le 7-AAD a été réalisée et analysée par cytométrie de flux. Des augmentations significatives de 50 à 325 % ont été observées dans les cellules apoptotiques précoces chez AN3CA, Ishikawa, KLE, RL95-2 et SKUT1B (figure 1B). Des augmentations significatives ont également été observées dans les cellules apoptotiques tardives de ces lignées cellulaires (Figure 1B). RL95-2 présentait la plus forte augmentation des cellules apoptotiques précoces, tandis que KLE présentait l’augmentation la moins significative. L’augmentation du pourcentage de cellules apoptotiques tardives dans la KLE n’était pas statistiquement significative. Aucune différence n’a été observée dans le pourcentage de cellules apoptotiques précoces et tardives avec le traitement des cellules HEC1B, tandis que les cellules HEC1A ont connu une diminution légèrement significative des cellules apoptotiques. La lignée cellulaire 293T n’a pas subi d’apoptose avec le traitement au DCA et la légère augmentation du pourcentage de cellules apoptotiques n’était pas significative (p=0,08).
Le test Annexin-V étant principalement utilisé pour détecter l’apoptose précoce, un test TUNEL a été réalisé sur plusieurs lignées cellulaires représentatives du cancer de l’endomètre afin de confirmer qualitativement la progression vers l’apoptose tardive en visualisant la fragmentation de l’ADN dépendante des caspases. En concordance avec le dosage quantitatif de l’Annexin-V, une augmentation des cellules apoptotiques TUNEL-positives a été observée dans les lignées AN3CA, Ishikawa et RL95-2 (figure 1C). Aucune différence visuelle dans les cellules TUNEL-positives n’a été observée dans les cellules HEC1B et 293T avec un traitement au DCA 10 mM.
Afin de déterminer si le taux de croissance affecte la sensibilité des lignées cellulaires de cancer de l’endomètre au traitement par DCA, une répondeuse apoptotique et une non-répondeuse, (Ishikawa et HEC1A respectivement), ont été cultivées dans des conditions de privation de sérum avec 0,5 % de FBS, ce qui ramène les cellules en phase G0 et entrave la prolifération. La privation de sérum n’a pas affecté la proportion de cellules apoptotiques précoces dans les cellules Ishikawa traitées par rapport aux conditions de croissance normales. Le pourcentage de cellules apoptotiques précoces a augmenté de 3,17% +/- 0,21% SD dans les cellules d’Ishikawa non traitées à 6,20% +/- 1,04% SD p=0,05 dans les cellules d’Ishikawa traitées, ce qui était similaire aux résultats obtenus dans des conditions de croissance normales. Le pourcentage de cellules d’Ishikawa en apoptose tardive a augmenté de 1,07 % +/- 0,15 % SD dans les cellules non traitées à 3,57 % +/- 0,49 % SD p=0,02 dans les cellules traitées. La lignée cellulaire HEC1A n’a montré aucune différence significative entre les cellules apoptotiques précoces et tardives. Le pourcentage de cellules apoptotiques précoces HEC1A était de 3,73 % +/- 0,51 % SD pour les cellules non traitées et de 1,93 % +/- 0,60 SD p=0,07 pour les cellules traitées. Le pourcentage de cellules apoptotiques tardives HEC1A était de 3,60% +/- 0,69% SD pour les cellules non traitées et de 4,90% +/- 1,37 SD p=0,25 pour les cellules traitées.
L’apoptose est médiée par la diminution des niveaux de calcium intracellulaire
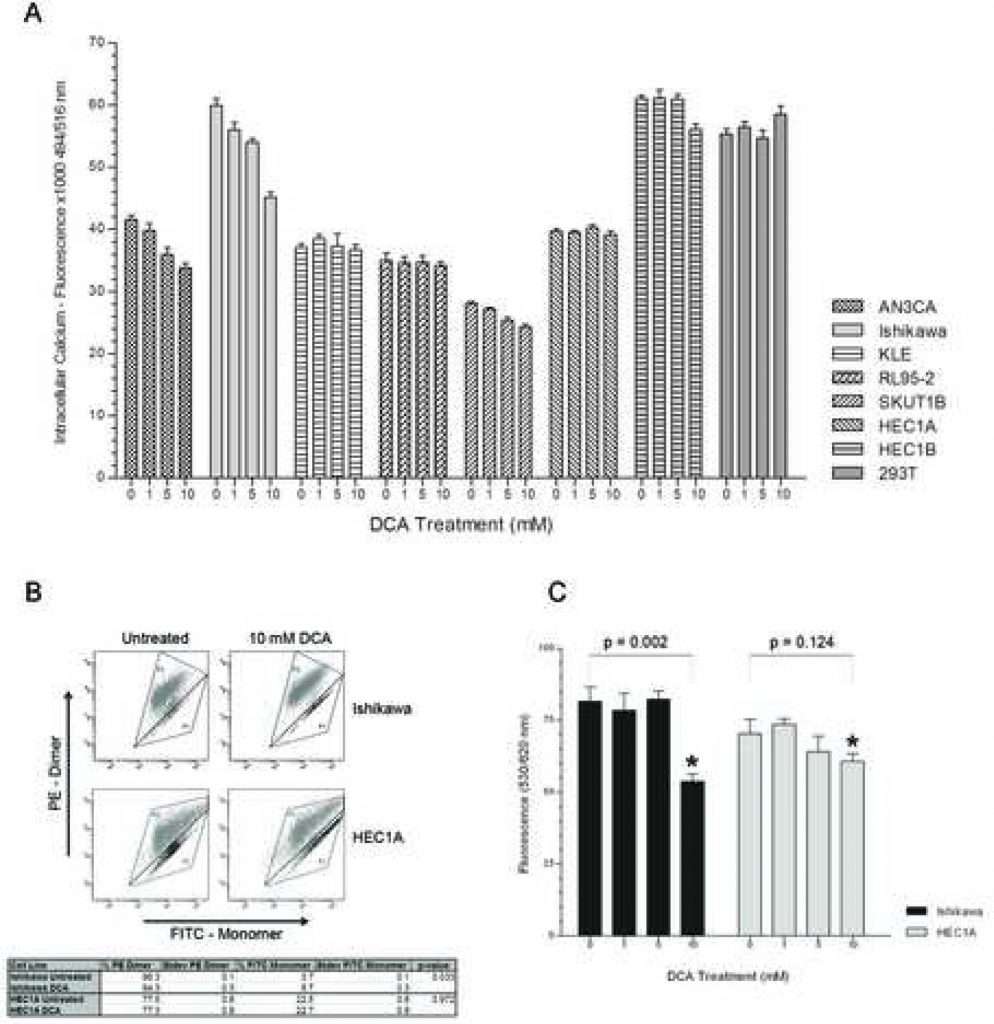
Afin de déterminer si la voie distale NFAT-Kv1.5 contribue à la promotion de l’apoptose par le DCA, une expérience dose-réponse a été réalisée pour évaluer les niveaux de Ca2+ intracellulaire. Les cellules AN3CA, Ishikawa et SKUTB présentaient des niveaux de calcium intracellulaire décroissants avec l’augmentation des doses de DCA (figure 2A). La diminution du calcium intracellulaire dans ces lignées cellulaires a atteint un niveau significatif à une concentration de 5mM de DCA avec p < 0,03 pour AN3CA, Ishikawa et SKUT1B. La lignée cellulaire KLE, qui a montré la réponse apoptotique la plus légère, a présenté une diminution non significative des niveaux de calcium avec une concentration croissante de DCA. Il est intéressant de noter qu’aucune différence dans les niveaux de calcium intracellulaire entre les doses n’a été détectée avec RL95-2, qui a présenté la plus grande réponse apoptotique. La souche HEC1A, qui n’avait auparavant montré aucune réponse apoptotique, n’a en effet présenté aucune différence dans les niveaux de calcium intracellulaire, quelle que soit la concentration du traitement. HEC1B n’a pas non plus présenté de différence dans les niveaux de calcium entre les groupes de traitement au DCA 0, 1 et 5 mM et seule une légère diminution est observée avec le traitement 10 mM. Il n’y avait pas de différence dans les niveaux de calcium intracellulaire chez 293T avec l’augmentation de la concentration de DCA.
Le traitement au DCA réduit l’hyperpolarisation de la membrane mitochondriale dans les cellules cancéreuses de l’endomètre qui subissent l’apoptose
Pour évaluer si le DCA a contribué au déclenchement de l’apoptose par un mécanisme régulé par les mitochondries, la MMP d’un répondeur et d’un non-répondeur à l’apoptose, (Ishikawa et HEC1A respectivement), a été mesurée avec et sans traitement par analyse FACS. Le réactif MitoCapture est un colorant cationique qui, selon l’importance du potentiel électrique transmembranaire mitochondrial, s’accumule sous forme de monomère émettant en vert dans le cytoplasme ou sous forme de dimère émettant en rouge dans les mitochondries hyperpolarisées des cellules cancéreuses [22, 23]. Le traitement au DCA de la lignée cellulaire Ishikawa a réduit le pourcentage de cellules colorées en rouge à 575 nm et augmenté la proportion de cellules colorées en vert à 525 nm, ce qui correspond à sa réponse apoptotique au traitement (figure 2B). Le traitement au DCA de la lignée cellulaire HEC1A n’a pas affecté le pourcentage de cellules colorées en rouge et en vert. De plus, les cellules HEC1A non traitées présentaient une proportion inférieure de cellules colorées en rouge avec des membranes mitochondriales hyperpolarisées par rapport à Ishikawa (77,5 % +/- 0,6 % SD contre 96,3 % +/- 0,1 % SD, p < 0,01). Il n’y avait aucune différence dans la MMP du contrôle non cancéreux 293T avec le traitement (données non présentées). La modulation de la MMP par le DCA a été confirmée par la coloration du TMRM dans une expérience dose-réponse. La MMP des cellules d’Ishikawa a diminué de manière significative à la dose de 10 mM de DCA (figure 2C). Il n’y avait aucune différence significative dans la MMP des cellules HEC1A, quelle que soit la concentration du traitement.
Le DCA diminue l’expression de la Survivine
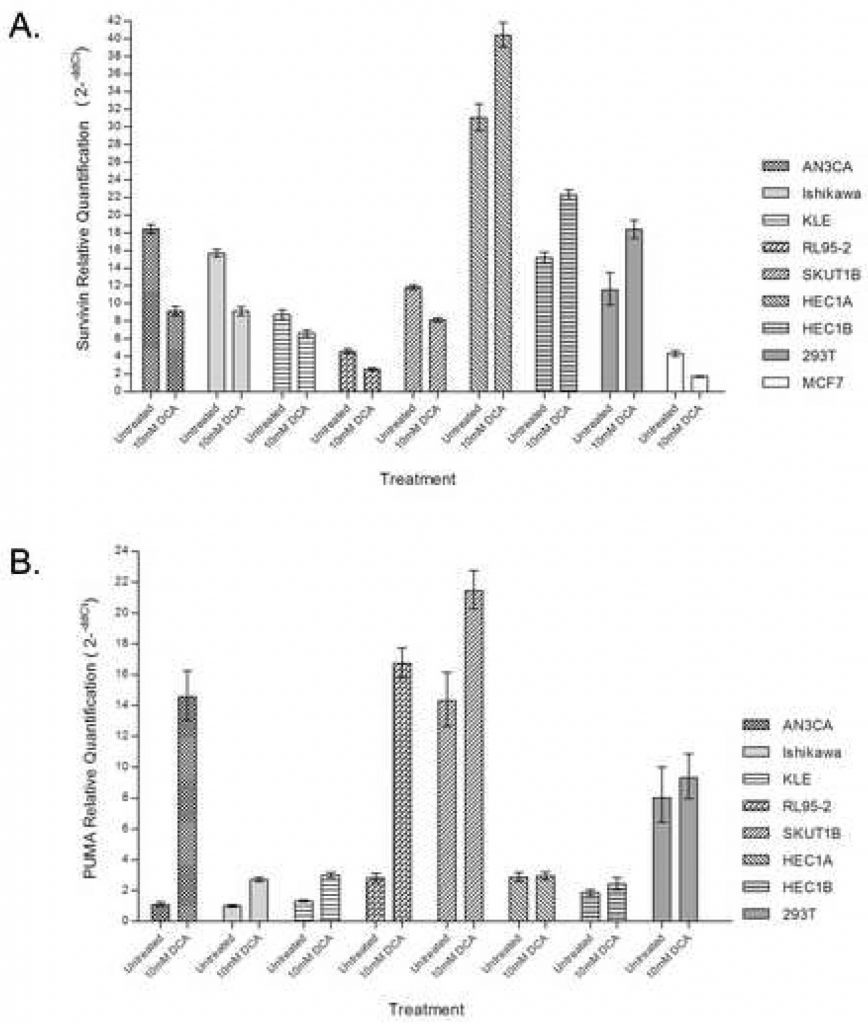
Afin de confirmer davantage la contribution de la voie proximale régulée par les mitochondries à la réponse apoptotique, la PCR quantitative en temps réel a été utilisée pour évaluer l’expression de la Survivine avec et sans administration de DCA. Le traitement des lignées cellulaires cancéreuses de l’endomètre avec du DCA a entraîné une diminution de 25 à 50 % de l’abondance de l’ARNm de Survivin dans les cellules qui présentaient une réponse apoptotique, notamment AN3CA, Ishikawa, KLE, RL95-2 et SKUT1B (figure 3A). RL95-2, qui a montré la plus grande augmentation de cellules apoptotiques précoces avec le traitement, avait également la plus faible abondance de transcription de Survivin endogène. Les cellules HEC1A et HEC1B, qui n’avaient auparavant aucune réponse apoptotique au DCA, présentaient des augmentations de 20 à 30 % des transcrits de Survivin avec le traitement. HEC1A avait la plus grande abondance de transcription de Survivin endogène. Le contrôle 293T a également montré une augmentation de l’abondance des transcriptions avec le traitement au DCA.
Le DCA augmente l’expression de PUMA
Pour déterminer la contribution de la voie PUMA dans l’apoptose induite par le DCA, la PCR quantitative en temps réel a été utilisée pour évaluer l’abondance de la transcription de PUMA avec et sans administration de DCA. Le traitement des lignées cellulaires du cancer de l’endomètre avec du DCA a augmenté de façon spectaculaire l’abondance de l’ARNm PUMA dans les lignées cellulaires qui ont eu une réponse apoptotique, notamment AN3CA, Ishikawa, KLE, RL95-2 et SKUT1B (Figure 3B). Le plus grand degré d’induction de PUMA a été observé dans les cellules AN3CA et RL95-2, qui présentaient des augmentations de 14 et 6 fois respectivement. HEC1A et HEC1B, qui n’avaient auparavant aucune réponse apoptotique au DCA, n’ont montré aucune différence dans la quantité de transcription de PUMA avec le traitement. Aucune différence dans la quantité de transcription de PUMA n’a été observée dans les cellules 293T avec le traitement.
Discussion
Dans cette étude, nous montrons que la mort des cellules cancéreuses de l’endomètre induite par le DCA est régulée par deux mécanismes principaux : la voie régulée par les mitochondries et la voie NFAT-Kv1.5. De plus, nous avons démontré que le DCA réduit la viabilité des cellules cancéreuses de l’endomètre de manière dose-dépendante par la promotion de l’apoptose, tout en n’ayant aucun effet sur les cellules 293T non cancéreuses. Enfin, nous montrons que le traitement au DCA influence la survie des cellules cancéreuses de l’endomètre par de multiples mécanismes moléculaires, notamment la régulation du potentiel de la membrane mitochondriale, les niveaux de Ca2+ intracellulaires, la perte d’expression de Survivin et l’induction de PUMA.
La réponse pro-apoptotique de AN3CA, Ishikawa et SKUT1B au DCA était corrélée à une diminution dose-dépendante des niveaux de Ca2+ intracellulaires, ce qui indique l’implication du mécanisme NFAT-Kv1.5. Par comparaison, RL95-2 (qui a eu la plus grande réponse apoptotique au DCA) et KLE (qui a eu la réponse apoptotique la plus légère) n’ont pas montré de différence dans les niveaux de Ca2+ intracellulaire à n’importe quelle concentration de traitement, ce qui suggère que la voie du mécanisme NFAT-Kv1.5 n’est pas impliquée dans le mécanisme apoptotique de ces lignées cellulaires. Au contraire, le traitement au DCA a arrêté les cellules RL95-2 dans la phase G0/G1 du cycle cellulaire, une caractéristique de l’activation de p53, a fortement induit l’expression de PUMA de RL95-2 et a diminué l’expression de Survivin, une protéine qui joue un rôle critique dans la régulation du cycle cellulaire. [29].
La Survivine est un inhibiteur de l’apoptose régulé par la transcription qui, en réponse à une perturbation de la MMP, est déchargé de la mitochondrie vers le cytoplasme, où il empêche l’activation des caspases, inhibe l’apoptose et favorise la progression tumorale [26, 27]. Des études antérieures ont montré une corrélation positive entre l’augmentation de l’expression de Survivin et le grade des tumeurs du carcinome de l’endomètre [27,28]. Nous avons constaté que l’abondance de la transcription de Survivin a significativement diminué dans toutes les lignées cellulaires de cancer de l’endomètre qui ont eu une réponse apoptotique au DCA. Nos résultats indiquent que la voie régulée par les mitochondries contribue à la réponse apoptotique dans les lignées cellulaires de cancer de l’endomètre sensibilisées au DCA.
Le transcrit PUMA était significativement augmenté dans toutes les lignées cellulaires de cancer de l’endomètre qui ont eu une réponse apoptotique au DCA. Ce résultat peut indiquer une contribution de la voie p53-PUMA avec les mécanismes mitochondriaux et de canaux ioniques dans l’apoptose induite par le DCA. L’expression accrue de PUMA contrecarrerait davantage l’effet pro-survivant de Bcl-2 sur la membrane mitochondriale dans les lignées cellulaires qui ont réagi, permettant une translocation accrue des médiateurs apoptotiques de la mitochondrie au cytoplasme, favorisant ainsi une plus grande activation des caspases et l’apoptose.
Deux lignées cellulaires, HEC1A et HEC1B, toutes deux très invasives et présentant une résistance accrue aux médicaments et un grade tumoral plus élevé [24] par rapport aux autres lignées cellulaires de l’endomètre, étaient résistantes au DCA. En effet, ces deux lignées cellulaires présentaient une expression accrue de Survivin, une expression de PUMA qui n’était pas affectée par le traitement au DCA, et une proportion plus faible de cellules présentant des membranes mitochondriales hyperpolarisées. Ces résultats suggèrent une moindre dépendance à la glycolyse aérobie. Nous avons examiné si des mutations dans le domaine de liaison au DCA de la protéine PDK2 humaine pouvaient expliquer les différences de réponse au traitement par HEC1A et HEC1B. Cependant, aucune mutation n’a été trouvée dans les 2 exons codant pour le domaine de liaison DCA putatif par l’analyse de séquence de toutes les lignées cellulaires (données non présentées).
En résumé, notre étude démontre que le dichloroacétate est efficace pour sensibiliser à l’apoptose la plupart des cellules cancéreuses de l’endomètre faiblement à modérément invasives. Nos données collectives suggèrent que l’apoptose est cohérente avec les voies médiées par les mitochondries et NFAT-Kv1.5. De plus, nos données suggèrent que la voie PUMA pourrait être impliquée dans la promotion de l’apoptose par le DCA. Les recherches futures devraient se concentrer sur l’examen d’un plus large éventail de types de cellules cancéreuses, en plus de déterminer les mécanismes qui confèrent une résistance apoptotique au DCA. La voie la plus potentiellement informative à envisager est la caractérisation fonctionnelle du rôle de la voie PUMA dans l’apoptose induite par le DCA.
Matériel supplémentaire
| Lignée cellulaire de cancer de l’endomètre | Type de tumeur | Degré de différenciation | Invasivité | statut p53 |
| AN3CA | Adénocarcinome épithélial | Indifférencié (30, 31) | Modéré (25, 32) | Mutant (33) |
| KLE | Adénocarcinome | Peu différencié (31, 34, 35) | Modéré (36) | Mutant (33) |
| Ishikawa | Adénocarcinome épithélial | Bien différencié (25, 37) | Faible (25) | Mutant (33) |
| RL95-2 | Carcinome épithélial | Modérément différencié (31, 35, 38) | Dépendant du nombre de passages (39) | Mutant (délétion de codon) (33) |
| SKUT1B | Léiomyosarcome mésodermique | Bien différencié | Moyennement élevé (40) | n.d |
| HEC1A | Adénocarcinome épithélial | Modérément différencié (31, 41) | Élevé (25, 42) | Mutant (33) |
| HEC1B | Adénocarcinome épithélial | Modérément différencié (31, 41) | Elevée (25, 42) | Mutant (33) |
Remerciements
Nous tenons à remercier le Dr John Daley du centre de cytométrie en flux HemNeo de Dana Farber pour sa formation technique et le Dr Sabina Signoretti du centre de pathologie de Dana Farber – Harvard Cancer Center pour son soutien immunohistochimique.
Soutien financier: Ce projet a été soutenu par les numéros de subvention CA082838 et CA101501 du National Institutes of Health.
RÉFÉRENCES
1 Rose P. Carcinome de l’endomètre. New England Journal of Medicine. 1996;335(9):640-649. [PubMed] br>2 Ingram SS, Rosenman J, Heath R, Morgan TM, Moore D, Varia M. The predictive value of progesterone receptor levels in endometrial cancer. Int J Radiat Oncol Biol Phys. 1989;17(1):21-27. [PubMed] br>3 Randall ME, Filiaci VL, Muss H, et al. Randomized phase III trial of whole-abdominal irradiation versus doxorubicin and cisplatin chemotherapy in advanced endometrial carcinoma : a Gynecologic Oncology Group Study. J Clin Oncol. 2006;24(1):36-44. [PubMed] br>4 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11(1):37-51. [PubMed] br>5 Chen Z, Lu W, Garcia-Prieto C, Huang P. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr. 2007 [PubMed] br>6 Kim JW, Dang CV. Cancer’s molecular sweet tooth and the Warburg effect. Cancer Res. 2006;66(18):8927-8930. [PubMed] br>7 Chen LB. Potentiel de la membrane mitochondriale dans les cellules vivantes. Annu Rev Cell Biol. 1988;4:155-181. [PubMed] br>8 Heerdt BG, Houston MA, Augenlicht LH. Le potentiel intrinsèque de la membrane mitochondriale des cellules de carcinome colique est lié à la probabilité de progression de la tumeur. Cancer Res. 2005;65(21):9861-9867. [PubMed] br>9 Han J, Flemington C, Houghton AB, et al. L’expression de bbc3, un gène pro-apoptotique BH3-only, est régulée par divers signaux de mort cellulaire et de survie. Proc Natl Acad Sci U S A. 2001;98(20):11318-11323. [Article libre PMC] [PubMed] br>10 Nakano K, Vousden KH. PUMA, un nouveau gène proapoptotique, est induit par p53. Mol Cell. 2001;7(3):683-694. [PubMed] br>11 Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA induit l’apoptose rapide des cellules cancéreuses colorectales. Mol Cell. 2001;7(3):673-682. [PubMed] br>12 Willis SN, Adams JM. Life in the balance : how BH3-only proteins induce apoptosis. Curr Opin Cell Biol. 2005;17(6):617-625. [article gratuit PMC] [PubMed] br>13 Jeffers JR, Parganas E, Lee Y, et al. Puma est un médiateur essentiel des voies apoptotiques dépendantes et indépendantes de p53. Cancer Cell. 2003;4(4):321-328. [PubMed] br>14 Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA médiateur de la réponse apoptotique à p53 dans les cellules cancéreuses colorectales. Proc Natl Acad Sci U S A. 2003;100(4):1931-1936. [Article libre PMC] [PubMed] br>15 Abemayor E, Kovachich GB, Haugaard N. Effects of dichloroacetate on brain pyruvate dehydrogenase. J Neurochem. 1984;42(1):38-42. [PubMed] br>16 Lopaschuk GD, Saddik M. The relative contribution of glucose and fatty acids to ATP production in hearts reperfused following ischemia. Mol Cell Biochem. 1992;116(1–2):111–116. [PubMed] br>17 Stacpoole PW. La pharmacologie du dichloroacétate. Métabolisme. 1989;38(11):1124–1144. [PubMed] br>18 Wong A, Cortopassi GA. High-throughput measurement of mitochondrial membrane potential in a neural cell line using a fluorescence plate reader. Biochem Biophys Res Commun. 2002;298(5):750-754. [PubMed] br>19 Yan J, Jiang J, Lim CA, Wu Q, Ng HH, Chin KC. BLIMP1 régule la croissance cellulaire par la répression de la transcription de p53. Proc Natl Acad Sci U S A. 2007;104(6):1841-1846. [Article libre PMC] [PubMed] br>20 Bieche I, Parfait B, Tozlu S, Lidereau R, Vidaud M. Quantification de l’expression du gène du récepteur des androgènes dans les tumeurs mammaires sporadiques par RT-PCR en temps réel : preuve que MYC est un gène régulé par l’AR. Carcinogenèse. 2001;22(9):1521–1526. [PubMed] br>21 Hassoun EA, Ray S. The induction of oxidative stress and cellular death by the drinking water disinfection by-products, dichloroacetate and trichloroacetate in J774.A1 cells. Biochimie et physiologie comparatives Toxicologie et pharmacologie. 2003;135(2):119-128. [PubMed] br>22 Di Lisa F, Silverman HS, Hansford RG. Mitochondrial function and cell injury in single cardiac myocytes exposed to anoxia and reoxygenation. Transplant Proc. 1995;27(5):2829-2830. [PubMed] br>23 Piccoli C, Scrima R, Boffoli D, Capitanio N. Le contrôle par la cytochrome c oxydase du système de phosphorylation oxydative cellulaire dépend de l’état énergétique mitochondrial. Biochem J. 2006;396(3):573-583. [article gratuit PMC] [PubMed] br>24 Liang Y, O’Driscoll L, McDonnell S, et al. Enhanced in vitro invasiveness and drug resistance with altered gene expression patterns in a human lung carcinoma cell line after pulse selection with anticancer drugs. Int J Cancer. 2004;111(4):484-493. [PubMed] br>25 Sillem M, Prifti S, Koumouridis A, et al. Invasiveness corresponds to differentiation rather than to proteinase secretion in endometrial cancer cell lines. European Journal of Gynaecologic Oncology. 1999;20(5–6):367–370. [PubMed] br>26 Dohi T, Okada K, Xia F, et al. Un complexe IAP-IAP inhibe l’apoptose. J Biol Chem. 2004;279(33):34087–34090. [PubMed] br>27 Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3(8):917-921. [PubMed] br>28 Erkanli S, Bolat F, Kayaselcuk F, Demirhan B, Kuscu E. COX-2 and survivin are overexpressed and positively correlated in endometrial carcinoma. Gynecol Oncol. 2007;104(2):320-325. [PubMed] br>29 Li F, Ambrosini G, Chu EY, et al. Contrôle de l’apoptose et du point de contrôle du fuseau mitotique par la survivine. Nature. 1998;396(6711):580–584. [PubMed] br>30 Rice LW, Stone RL, Xu M, et al. Biologic targets for therapeutic intervention in endometrioid endometrial adenocarcinoma and malignant mixed mullerian tumors. Am J Obstet Gynecol. 2006;194(4):1119-1126. discussion 26-28. [PubMed] br>31 Nagamani M, Stuart CA. Liaison spécifique et activité de stimulation de la croissance de l’insuline dans les cellules cancéreuses de l’endomètre en culture. Am J Obstet Gynecol. 1998;179(1):6-12. [PubMed] br>32 Zhao Y, Yamashita T, Ishikawa M. Regulation of tumor invasion by HOXB13 gene overexpressed in human endometrial cancer. Oncol Rep. 2005;13(4):721-726. [PubMed] br>33 Yaginuma Y, Westphal H. Analysis of the p53 gene in human uterine carcinoma cell lines. Cancer Res. 1991;51(24):6506-6509. [PubMed] br>34 Richardson GS, Dickersin GR, Atkins L, et al. KLE : une lignée cellulaire avec un récepteur d’œstrogène défectueux dérivée d’un cancer de l’endomètre indifférencié. Gynecol Oncol. 1984;17(2):213-230. [PubMed] br>35 Carter CA, Parham GP. L’état de différenciation affecte la réponse des cellules d’adénocarcinome endométrial à l’acide rétinoïque. Anticancer Research. 1997;17(3C):1973–1983. [PubMed] br>36 Yabushita H, Narumiya H, Hiratake K, et al. The association of transforming growth factor-beta 1 with myometrial invasion of endometrial carcinomas through effects on matrix metalloproteinase. J Obstet Gynaecol Res. 2000;26(3):163-170. [PubMed] br>37 Holinka CF, Hata H, Kuramoto H, et al. Responses to estradiol in a human endometrial adenocarcinoma cell line (Ishikawa) Journal of Steroid Biochemistry. 1986;24(1):85-89. [PubMed] br>38 Way DL, Grosso DS, Davis JR, et al. Characterization of a new human endometrial carcinoma (RL95-2) established in tissue culture. In Vitro. 1983;19(3 partie 1):147-158. [PubMed] br>39 Sundareshan P, Hendrix MJ. Growth, morphologic, and invasive characteristics of early and late passages of a human endometrial carcinoma cell line (RL95-2) In Vitro Cell Dev Biol. 1992;28A(7-8):544-552. [PubMed] br>40 Colombatti A, Russo P, Cervi M, et al. Expression différentielle de IRS-1 et IRS-2 dans les léiomyosarcomes utérins avec des phénotypes oncogènes distincts : Absence de corrélation avec les événements de signalisation en aval. Sarcoma. 2002;6(3):89-96. br>41 Kuramoto H, Tamura S, Notake Y. Establishment of a cell line of human endometrial adenocarcinoma in vitro. Am J Obstet Gynecol. 1972;114(8):1012–1019. br>42 Sieuwerts AM, Klijn JG, Foekens JA. Assessment of the invasive potential of human gynecological tumor cell lines with the in vitro Boyden chamber assay : influences of the ability of cells to migrate through the filter membrane. Clin Exp Metastasis. 1997;15(1):53-62.
Contenu connexe :