Tiziana Tataranni 1, Francesca Agriesti 1, Consiglia Pacelli 2, Vitalba Ruggieri 1, Ilaria Laurenzana 1, Carmela Mazzoccoli 1 , Gerardo Della Sala 1, Concetta Panebianco 3, Valerio Pazienza 3, Nazzareno Capitanio 2 et Claudia Piccoli 1,2,*
1 Laboratoire de recherche préclinique et translationnelle, IRCCS-CROB, Referral Cancer Center of Basilicata, 85028 Rionero in Vulture (Pz), Italie ; [email protected] (T.T.) ; [email protected] (F.A.) ; [email protected] (V.R.) ; [email protected] (I.L.) ; [email protected] (C.M.) ; [email protected] (G.D.S.))
2 Département de médecine clinique et expérimentale, Université de Foggia, 71100 Foggia, Italie ; [email protected] (C.P.) ; [email protected] (N.C.)
3 Division de gastroentérologie, Hôpital IRCCS « Casa Sollievo della Sofferenza », 71013 San Giovanni Rotondo, Italie ; [email protected] (C.P.) ; [email protected] (V.P
* Correspondance : [email protected] ; Tél : +39-0881-588-060
Reçu : 21 février 2019
Accepté : 15 mai 2019
Publié : 18 mai 2019
Résumé
Cibler le métabolisme représente une approche possiblement fructueuse pour traiter le cancer. Le dichloroacétate (DCA) est un médicament connu pour détourner le métabolisme de la glycolyse anaérobie vers la phosphorylation oxydative mitochondriale en stimulant la PDH. Dans cette étude, nous avons examiné la réponse de deux lignées cellulaires de cancer du pancréas au DCA, dans des cultures cellulaires bidimensionnelles et tridimensionnelles, ainsi que dans un modèle de souris. Les PANC-1 et BXPC-3 traitées au DCA ont montré une diminution marquée de la prolifération et de la migration cellulaires qui n’était pas corrélée à une augmentation de l’apoptose, indiquant un effet cytostatique plutôt que cytotoxique. Malgré l’activation de la PDH, le traitement au DCA a entraîné une réduction de la consommation d’oxygène mitochondrial sans affecter la glycolyse. En outre, le DCA a entraîné une augmentation de la production de ROS, de l’ADNmt et du marqueur de mitophagie LC3B-II dans les deux lignées cellulaires, mais a réduit les marqueurs de fusion mitochondriale uniquement dans la lignée BXPC-3. Notamment, le DCA a diminué l’expression des marqueurs CD24/CD44/EPCAM des cellules souches cancéreuses uniquement dans PANC-1 mais a inhibé la formation/viabilité des sphéroïdes dans les deux lignées cellulaires. Dans un modèle de xénogreffe du cancer du pancréas chez la souris, le traitement au DCA a permis de retarder la progression du cancer. Collectivement, nos résultats indiquent clairement que l’efficacité du DCA dans l’inhibition de la croissance du cancer dépend mécaniquement du phénotype cellulaire et de multiples voies hors cible. Dans ce contexte, la nouveauté selon laquelle le DCA pourrait affecter le compartiment des cellules souches cancéreuses est pertinente sur le plan thérapeutique.
Mots clés : métabolisme ; mitochondries ; cellules souches cancéreuses
2019 par les auteurs. Licencié MDPI, Bâle, Suisse. Cet article est un article en accès libre distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/).
INTRODUCTION
L’adénocarcinome du canal pancréatique (PDAC) est un cancer très agressif, avec un faible pourcentage de patients affectés éligibles pour une résection chirurgicale et hautement réfractaire aux thérapies conventionnelles [1,2]. Il est donc urgent de trouver des médicaments plus efficaces pour améliorer les schémas thérapeutiques actuels. Outre la croissance cellulaire, la réparation de l’ADN, le caractère invasif et l’angiogénèse, les cellules du CAOP se caractérisent par des mutations dans les gènes impliqués dans le métabolisme [1,3]. De nouvelles stratégies thérapeutiques ciblant le métabolisme apparaissent comme des approches prometteuses pour surmonter la chimiorésistance [4]. Cependant, l’hétérogénéité inter- et intra-tumorale se traduit souvent par des phénotypes métaboliques différents, notamment en raison des multiples interactions avec le micro-environnement tumoral [5]. Cela pose des limites thérapeutiques et souligne l’importance des caractérisations métaboliques préliminaires des lignées tumorales, avant l’administration de médicaments efficaces. Nous avons récemment démontré que deux lignées cellulaires de cancer du pancréas, caractérisées par un profil métabolique différent, produisent une réponse dissemblable à la privation de glucose/substitution de galactose, une approche capable de reconnecter le métabolisme énergétique [6]. De plus, notre groupe avait déjà démontré l’efficacité du dichloroacétate (DCA), un inhibiteur de la pyruvate déshydrogénase kinase (PDK), pour tuer des cellules cultivées dérivées de carcinomes oraux humains, un effet inversement corrélé à la capacité respiratoire mitochondriale des cellules tumorales [7]. Plusieurs études in vivo et in vitro décrivent la capacité du DCA à augmenter la phosphorylation oxydative mitochondriale (OxPhos), inversant l’effet Warburg et ciblant sélectivement les cellules tumorales [8,9]. De même, de nombreux ouvrages démontrent l’efficacité du DCA pour améliorer la chimiosensibilité de plusieurs types de cancer [10,11]. Le traitement au DCA a été proposé pour des études in vitro et in vivo, également dans le cancer du pancréas [8,12,13,14]. Néanmoins, des investigations supplémentaires sont nécessaires pour mieux définir l’efficacité du médicament dans ce type de cancer, pour clarifier d’éventuels mécanismes supplémentaires conduisant à la mort cellulaire, et pour explorer d’autres moyens possibles de limiter les effets secondaires rencontrés. Dans cette étude, nous avons analysé les effets du DCA sur deux lignées cellulaires de PDAC, PANC-1 et BXPC-3, choisies entre autres pour leurs conditions de croissance similaires et leur géno-phénotype bien caractérisé [6,15,16]. Un vaste profilage des métabolites et du transcriptome des lignées cellulaires de PDAC a permis d’identifier trois sous-types de tumeurs, PANC-1 et BXPC-3 appartenant à un groupe lipogénique caractérisé par une dépendance distincte de l’oxydation du glucose et du métabolisme lié à la mitochondrie [17]. En testant le DCA sur des cultures 2D et 3D des lignées cellulaires PDAC, nous avons démontré que le médicament affecte négativement les paramètres vitaux en réduisant l’activité respiratoire mitochondriale et, plus particulièrement, le compartiment des cellules souches cancéreuses. De plus, nous avons montré que le DCA est également capable d’atténuer la croissance tumorale in vivo dans un modèle de souris xénogreffées de PDAC.
Matériel et méthodes
Culture cellulaire
Les cellules PANC-1 et BXPC-3 ont été achetées auprès de l’American Type Culture Collection (ATCC, Manassas, VA, USA) et cultivées à 37 °C dans une atmosphère humidifiée à 5 % deCO2 dans un milieu RPMI complet complété par 10 % de sérum bovin fœtal, de la pénicilline-streptomycine (100 U/mL) et 2 mM de glutamine, et la concentration en glucose était généralement de 10 mM ou 1 mM lorsque cela était indiqué. Le dichloroacétate (DCA) a été acheté auprès de Sigma-Aldrich (St. Louis, MO, USA). Pour chaque expérience in vitro, les cellules ont été traitées avec du DCA 4 mM et 10 mM aux temps indiqués.
Courbes de croissance cellulaire
Les courbes de croissance cellulaire ont été réalisées comme décrit précédemment [18].
Suivi de la prolifération cellulaire en temps réel par le système xCELLigence
Les expériences xCELLigence ont été réalisées à l’aide de l’instrument RTCA (analyseur cellulaire en temps réel), conformément aux instructions du fabricant (ACEA Biosciences, San Diego, CA, USA). Le nombre optimal d’ensemencement a été préalablement déterminé par des expériences de titrage cellulaire et de croissance (données non présentées). Les 2500 cellules/puits ont ensuite été ensemencées et leur prolifération a été automatiquement surveillée toutes les 30 minutes. 24 h après l’ensemencement, les cellules ont été traitées au DCA. L’indice cellulaire a été suivi jusqu’à 90 heures après l’ensemencement. Les données ont été analysées à l’aide du logiciel xCELLigence (Version 2.0, Acea biosciences, San Diego, CA, USA) et exprimées sous forme de moyenne ± SD de l’indice cellulaire normalisé au dernier indice cellulaire enregistré avant le moment de l’ajout de DCA.
Test d’apoptose
Après incubation avec du DCA, les cellules ont été colorées avec de l’Annexin-V-FITC et du PI (BD Biosciences). Les cellules vivantes, apoptotiques et nécrotiques ont été détectées à l’aide de la citométrie de flux (Navios, Beckman Coulter, Brea, CA, USA). Trois expériences indépendantes ont été réalisées. Un total de104 événements pour chaque échantillon a été acquis.
Essai de migration
Les effets du DCA sur les capacités de migration des PANC-1 et des BXPC-3 ont été évalués à l’aide d’un essai de plaie de grattage. En bref, les cellules ont été ensemencées dans des plaques de culture à six puits et cultivées jusqu’à confluence complète. Par la suite, trois plaies parallèles et linéaires ont été produites dans chaque plat avec une pointe de pipette en plastique de 200 μL. Les cellules ont ensuite été traitées au DCA et la capacité de cicatrisation, surveillée à différents moments, a été quantifiée après 48 h. Trois images représentatives des zones rayées de chaque boîte ont été photographiées pour estimer la migration des cellules. Le taux de migration des cellules a été calculé à l’aide de la formule suivante : [1 – (largeur de la zone grattée 48 h/0 h)] × 100 %.
Mesures du lactate
Unkit de dosage colorimétrique du lactate (Abcam, Cambridge, MA, USA) a été utilisé selon le protocole du fabricant et la concentration de lactate détectée (intracellulaire ou libérée) a été normalisée par rapport au nombre de cellules.
Analyse des flux métaboliques et activité enzymatique du complexe respiratoire mitochondrial
Le taux de consommation d’oxygène (OCR) et le taux d’acidification extracellulaire (ECAR) ont été mesurés dans des cellules PANC-1 et BXPC-3 adhérentes avec un analyseur de flux extracellulaire XF96 (Seahorse Bioscience, Billerica, MA, USA) comme décrit précédemment [19]. Brièvement, pour l’analyse OCR, après avoir mesuré la respiration basale, l’oligomycine (1 μM), le FCCP (1 μM) et la roténone + antimycine A (1 μM + 1 μM) ont été injectés dans chaque puits de manière séquentielle pour évaluer, respectivement, le couplage de la chaîne respiratoire et la consommation maximale et non-mitochondriale d’oxygène. Pour l’analyse ECAR, le flux glycolytique (glycolyse basale, capacité glycolytique et réserve glycolytique) a été analysé par l’ajout séquentiel de 10 mM de glucose, 1 μM d’oligomycine et 100 mM de 2-désoxyglucose. Les valeurs OCR et ECAR ont été normalisées par rapport à la teneur en protéines de chaque puits, déterminée à l’aide du test BCA (Thermo Scientific, Waltham, MA, USA).
Quantification de l’ADN mitochondrial
La mesure du nombre de copies d’ADNmt, par rapport au nombre de copies d’ADN nucléaire, a été déterminée comme décrit précédemment [6].
Imagerie cellulaire vivante de la mtΔΨ et des ROS
Les cellules cultivées à faible densité sur des plats à fond de verre de 35 mm recouverts de fibronectine (Eppendorf, Amburgo, Allemagne) ont été incubées pendant 20 minutes à 37 °C avec 2 μM de TMRE, 10 μM de DCF (Molecular Probes, Eugene, OR, États-Unis) pour surveiller la mtΔΨ et les ROS, respectivement. Les cellules colorées ont été lavées avec du PBS et examinées à l’aide d’un microscope confocal à balayage laser Leica TCS SP8. L’acquisition, le stockage et l’analyse des données ont été réalisés avec un logiciel instrumental dédié de Leica (LAS-X, Wetzlar, Allemagne).
Analyse par Western Blotting
Des aliquotes, contenant 40 μg de protéines de chaque lysat cellulaire, ont été soumis à une électrophorèse sur gel de polyacrylamide SDS et transférés sur une membrane en difluorure de polyvinylidène à l’aide d’un système de transfert Trans Blot Turbo. Les membranes (Laboratoires Bio-Rad, Hercules, CA, USA) ont été sondées avec les anticorps primaires suivants : pyruvate déshydrogénase E1-alpha (PDH) et pPDHSer293 (1:500, Abcam, Cambridge, UK), LC3B (1:1000 Cell Signaling Technology), TOM20 (1 :1000, Santa Cruz Biotechnology, Santa Cruz, CA, USA), DRP1 (1:1000, BD Bioscences), OPA-1 (1:1000, BD Bioscences), MFN1 (1:1000, Santa Cruz), MFN2 (1:1000, Abnova, Tapei, Taiwan), et CASPASE 3 (1:1000, Cell Signaling Technology, Danvers, MA, USA). Après incubation avec un anticorps secondaire conjugué à la peroxydase de raifort (1:2500 ; Cell Signaling Technology), les signaux ont été développés à l’aide du kit de chimioluminescence améliorée (ClarityTM Western ECL Substrate, Bio-Rad) et du système d’imagerie ChemiDoc XRS + (BioRad), puis analysés à l’aide du logiciel Image Lab (version 4.1, Bio-Rad, Hercules, CA, USA). L’intensité des bandes LC3B-II (correspondant à la fraction clivée), TOM20, DRP1, OPA-1, MFN1 et MFN2 a été normalisée par rapport au signal β-actine, tandis que la phosphorylation de la PDH a été normalisée par rapport aux protéines totales.
Détection cytométrique en flux des marqueurs de surface
L’expression des marqueurs de surface CD44, CD24 et EPCAM a été évaluée par analyse cytofluorimétrique dans les PANC-1 et BXPC-3 traités au DCA pendant 24 h. En bref, après trypsinisation, les cellules ont été incubées dans l’obscurité à température ambiante pendant 15 min avec des anticorps monoclonaux directement conjugués CD44-APC, EPCAM-FITC et CD24-PE (BDB). L’analyse cytofluorimétrique a été réalisée par Navios (Beckman Coulter). Le signal fluorescent émis de 10 000 événements pour chaque échantillon a été acquis et analysé à l’aide du logiciel Kaluza Analysis (version 1.3, Beckman Coulter, Brea, CA, USA).
Transcription inverse et analyse PCR en temps réel
Un microgramme d’ARN total, isolé à l’aide du réactif Trizol (Life Technologies, Paisley, UK), conformément aux instructions du fabricant et quantifié sur un spectrophotomètre Nanodrop (Thermo Fisher Scientific, Waltham, MA, USA), a été utilisé dans une réaction de transcription inverse (RT) à l’aide du kit de synthèse d’ADNc de premier brin Transcriptor (Roche Diagnostic, Penzberg, Allemagne) conformément aux instructions du fabricant. Une réaction en chaîne par polymérase quantitative en temps réel (PCR) a été réalisée en double, en utilisant le test d’amorçage QuantiTect (Qiagen, Bâle, Suisse) pour détecter l’ARNm de Lin28. La quantification des niveaux d’ARNm a été effectuée sur un instrument de PCR en temps réel LightCycler® 480. Les quantités relatives de Lin28 ont été normalisées par rapport à l’expression de GAPDH par le logiciel Light Cycler® 480 version 1.5 (ROCHE) en utilisant la méthode 2ΔΔCt.
culture 3D
Les cellules PANC-1 et BXPC-3 ont été détachées avec de la trypsine-EDTA et comptées. Ensuite, 1000 cellules/puits ont été ensemencées dans des plaques 96 puits à fond rond à fixation ultra-faible et cultivées dans du RPMI. Pour évaluer l’effet du DCA sur les sphéroïdes préformés, des cultures 3D ont été maintenues pendant 7 jours, permettant d’obtenir des sphéroïdes. Ensuite, le milieu a été remplacé par du milieu frais et les sphéroïdes ont été traités avec du DCA 4 mM et 10 mM pendant 72 h. Pour évaluer l’effet du DCA sur la formation des sphéroïdes, le DCA a été ajouté à la suspension cellulaire lors de l’ensemencement dans des plaques à fixation ultra-faible et la culture a été maintenue pendant 7 jours. Les sphéroïdes ont été photographiés sur un microscope optique inversé (Axio Vert A1, Zeiss, Oberkochen, Allemagne) et leur diamètre a été mesuré à l’aide du logiciel d’imagerie ZEISS ZEN. La viabilité des sphéroïdes a été évaluée à l’aide d’un test MTS. Une solution de poudre aqueuse de réactif MTS cellTiter 96® (Promega, Madison, WI, USA) et de PMS (Sigma Aldrich, Saint Louis, MO, USA) a été ajoutée à chaque puits de culture de sphéroïdes 3D. Après 2 h d’incubation à 37 °C, l’absorbance à 490 nm a été mesurée et le pourcentage de viabilité dans chaque puits a été calculé en utilisant les sphéroïdes non traités comme 100%.
Études animales
L’expérimentation animale a été réalisée dans une installation expérimentale accréditée par l’AAALAC (Association for Assessment and Accreditation of Laboratory Animal Care International, Frederick, MD USA) sous le numéro d’approbation ANM14_002/468862. Un nombre total de 5 ×106 cellules cancéreuses BxPC-3-luc ont été cultivées, remises en suspension dans 0,1 ml de mélange PBS/matrigel (1:1), puis injectées par voie s.c. dans le flanc droit de souris nude Nu/Nu âgées de 5 à 6 semaines. Lorsque la taille de la tumeur a atteint un volume moyen de 100 mm3, les souris nues porteuses de tumeurs BxPC-3-luc ont été réparties au hasard en 2 groupes (6 souris/groupe). Groupe 1 (solution saline normale, i.p, qw), groupe 2 (DCA, mg/kg, i.p, qw). Les animaux avaient un accès libre à l’eau. Le DCA a été dissous pour obtenir une concentration finale de 100 mg/kg/jour (s.c : sous-cutané ; i.p : intrapéritonéal ; qw : une fois par semaine).
Analyse statistique
Les données expérimentales sont exprimées en tant que moyenne ± erreur standard (SEM) ou moyenne ± écart standard (SD). Les données ont été comparées à l’aide du test t de Student non apparié ou de l’Anova à sens unique, suivi du test de Bonferroni. Une valeur p < 0,05 a été acceptée comme statistiquement significative.
Résultats
Le DCA affecte négativement la prolifération, la survie et la migration des cellules dans les lignées cellulaires PANC-1 et BXPC-3
Les deux lignées cellulaires PDAC sélectionnées pour cette étude étaient PANC-1 et BXPC-3. PANC-1 est une lignée cellulaire dérivée d’un carcinome pancréatique d’origine canalaire. Elle peut former des métastases mais a une faible capacité de différenciation et présente des mutations dans KRAS et TP53 et une délétion homozygote dans CDKN2A/p16 [16]. La BxPC-3 est une lignée cellulaire primaire dérivée d’un adénocarcinome à différenciation modérée et à morphologie épithéliale. Elle exprime la mucine et des niveaux élevés de facteurs angiogéniques et de marqueurs de cellules souches cancéreuses [16,20] et ne présente pas de mutations de KRAS mais des mutations de TP53 et des délétions homozygotes de CDKN2A/p16 et SMAD4/DPC4 [16]. L’effet du DCA sur les paramètres de viabilité des lignées cellulaires PANC-1 et BXPC-3 a été évalué aux concentrations de 4 mM et 10 mM, déjà testées et prouvées efficaces comme le montre notre étude précédente [7]. Tout d’abord, nous avons effectué un test de croissance cellulaire pendant 72 heures, qui a révélé une sensibilité significative, dépendante de la dose et du temps, des deux lignées cellulaires au traitement par le DCA (Figure 1A,B). En particulier, PANC-1 et BXPC-3 ont montré un blocage similaire de la croissance cellulaire lorsqu’elles ont été traitées avec 10 mM de DCA dès le premier jour d’incubation, et inversement, à la dose inférieure de 4 mM testée, la lignée cellulaire PANC-1 est apparue significativement plus sensible au médicament.
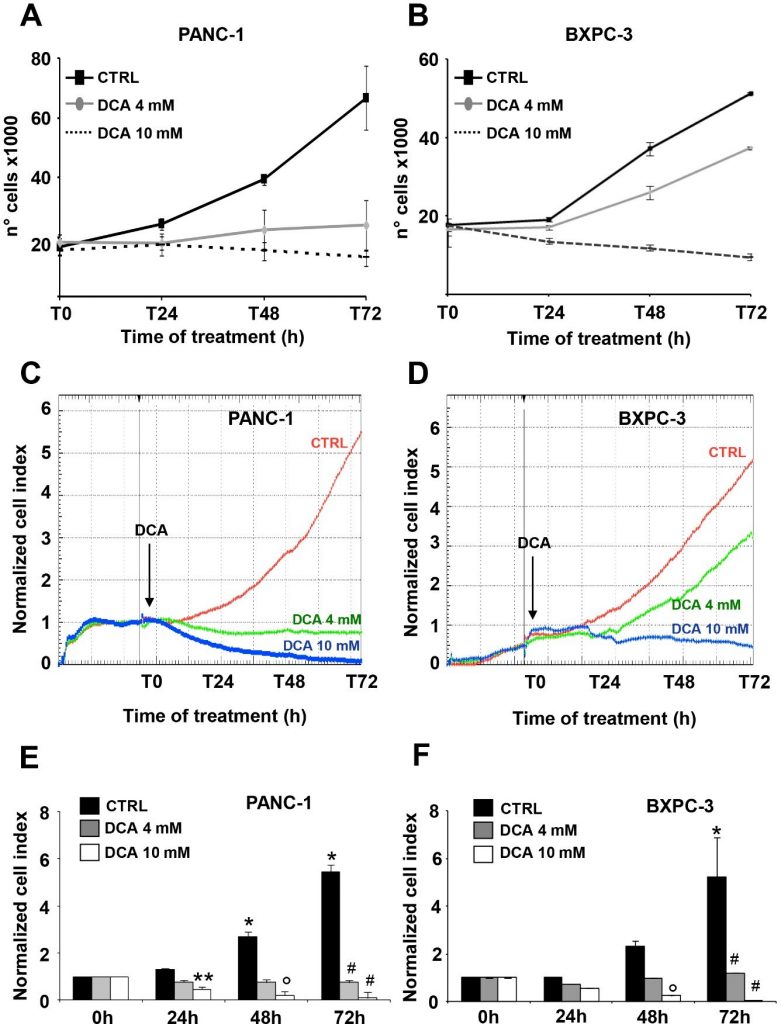
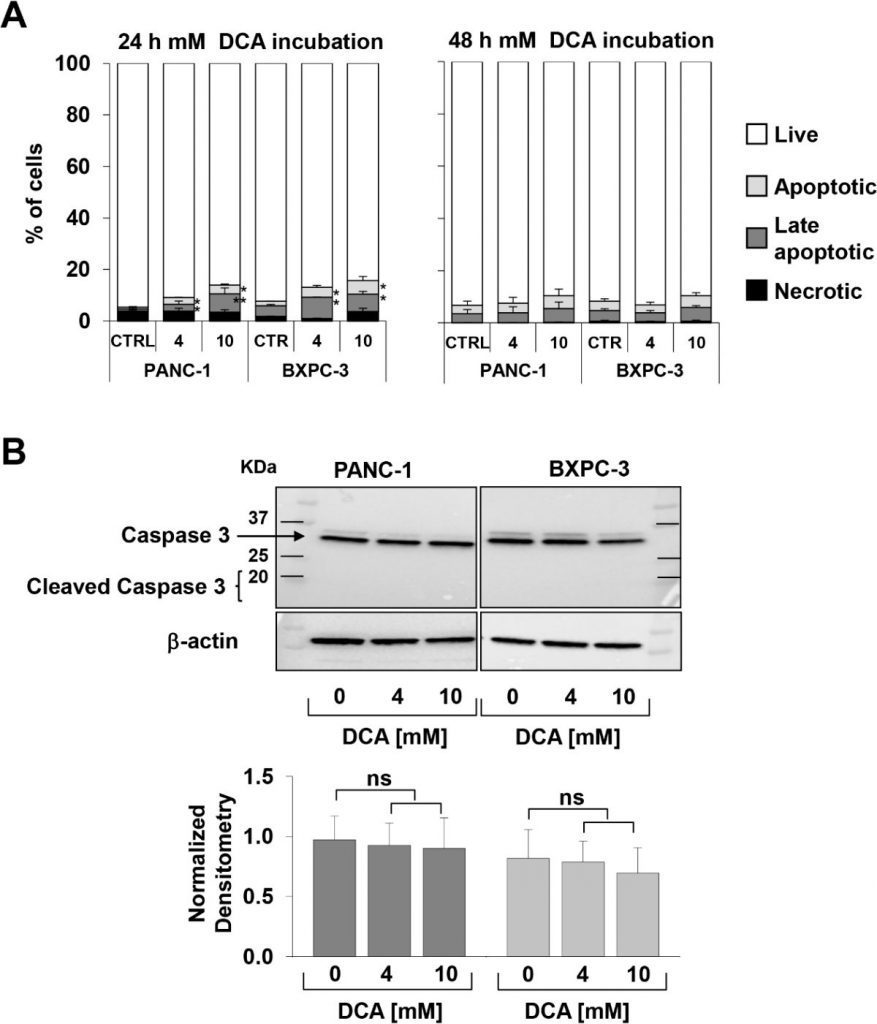
L’observation ci-dessus, particulièrement intéressante en raison de la chimiorésistance bien connue de la lignée cellulaire PANC-1 [21,22], nous a incités à vérifier l’inhibition de la croissance cellulaire médiée par le DCA par une approche différente. Dans ce but, nous avons suivi en temps réel les changements dynamiques de la prolifération et de la viabilité des cellules par une technologie basée sur l’impédance. Comme le montrent les figures 1C-F, le traitement par 10 mM de DCA a considérablement réduit la prolifération cellulaire dans les deux lignées cellulaires, tandis que le traitement par 4 mM de DCA a eu un effet inhibiteur beaucoup plus fort dans la lignée PANC-1 que dans la lignée BXPC-3. À noter que les effets du DCA étaient clairement visibles dès 24 heures d’incubation avec le médicament. L’analyse de la croissance cellulaire en temps réel a également été réalisée avec un faible taux de glucose dans le milieu de culture (c’est-à-dire 1 mM dans RPMI). Comme prévu, le taux de croissance des deux lignées cellulaires PDAC a été sévèrement ralenti étant donné leur dépendance métabolique à l’oxydation du glucose [17]. Pour évaluer les paramètres vitaux, nous avons utilisé le test annexin V-FITC/PI et évalué par cytométrie de flux la quantité relative de cellules nécrotiques, apoptotiques tardives et précoces. Les résultats obtenus ont montré qu’après 24 heures d’incubation avec le DCA, les deux lignées cellulaires PANC-1 et BXPC-3 ont présenté une augmentation dose-dépendante légère mais significative de l’apoptose par rapport aux cellules non traitées. Cependant, les quantités de cellules apoptotiques étaient relativement faibles (c’est-à-dire < 10 % à la concentration la plus élevée de DCA testée) et n’ont pas augmenté davantage après 48 heures de traitement au DCA (figure 2A). Par conséquent, l’expression de la caspase 3 non clivée n’a pas changé après le traitement au DCA et aucune quantité appréciable de sa forme clivée n’était détectable (figure 2B). Ce résultat suggère que le médicament exerce une activité cytostatique plutôt que cytotoxique dans les deux lignées cellulaires, ce qui expliquerait le ralentissement marqué du taux de croissance illustré dans les figures 1A-D.
Ensuite, nous avons évalué l’effet du DCA sur la motilité des cellules en effectuant le test de cicatrisation par grattage. La capacité de migration, observée à différents moments, a été mesurée après 48 heures de traitement par 4 mM et 10 mM de DCA. La motilité des cellules PANC-1 et BXPC-3 a diminué lorsqu’elles ont été traitées avec la dose la plus élevée de DCA, tandis que la capacité de migration des cellules BXPC-3 n’a pas été affectée par le traitement au DCA 4 mM, qui a au contraire provoqué un retard dans la capacité de fermeture de la plaie dans les cellules PANC-1, confirmant leur plus grande sensibilité au médicament détectable à une concentration plus faible (figure supplémentaire S2).
Le DCA altère le métabolisme énergétique des lignées cellulaires de PDAC
Afin d’étudier le lien entre l’effet antiprolifératif induit par le DCA et les altérations du métabolisme des lignées cellulaires de PDAC, nous avons évalué l’efficacité du composé à inhiber sa cible reconnue, la pyruvate déshydrogénase kinase (PDK), en évaluant l’état de phosphorylation de la sous-unité E1α (résidu S293) du complexe pyruvate déshydrogénase (PDC) par Western blotting dans PANC-1 et BXPC-3. Comme le montre la Figure 3A,B, le niveau normalisé de P-PDH-E1 a été significativement diminué dans les deux lignées cellulaires alors que le niveau d’expression de la PDH totale était comparable et, comme prévu, non modifié par le traitement médicamenteux. De manière inattendue, la production de lactate extra- et intracellulaire n’a apparemment pas été affectée dans les deux lignées cellulaires PDAC traitées par le DCA (figure supplémentaire S3).
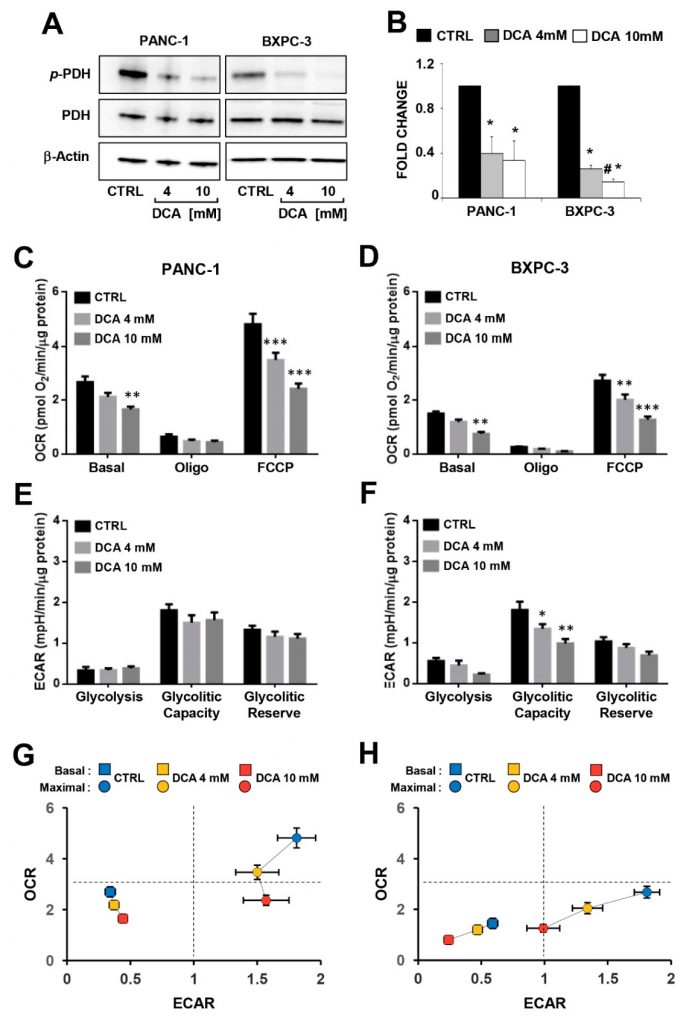
Nous avons ensuite analysé les principaux flux métaboliques en mesurant l’acidification extracellulaire et la consommation d’oxygène à l’aide de la technologie SeaHorse. Lorsque les flux métaboliques ont été évalués après une incubation de 24 heures de DCA, aucun changement significatif n’a été observé dans les deux lignées cellulaires de PDAC (figure supplémentaire S4). Une exposition plus longue (c.-à-d. 48 heures) au DCA a entraîné une diminution dose-dépendante des taux de consommation d’oxygène mitochondrial (OCR) dans les deux lignées cellulaires PANC-1 et BXPC-3 en conditions basales ainsi qu’en présence de l’inhibiteur d’ATP-synthase oligomycine ou du découpleur FCCP (c.-à-d. la capacité respiratoire maximale) (Figure 3C,D). Il convient de noter que l’activité respiratoire mitochondriale était significativement plus élevée dans le PANC-1 que dans le BXPC-3, ce qui indique un phénotype métabolique plus dépendant de l’OxPhos. Les taux d’acidification extracellulaire (ECAR), qui sont liés au flux glycolytique, n’ont pas donné lieu à des changements significatifs après le traitement au DCA des PANC-1, tandis qu’une inhibition a été observée pour l’ECAR basal dans les BXPC-3 à la concentration la plus élevée de DCA et de manière dose-dépendante pour la capacité glycolytique (Figure 3E,F). Par conséquent, les profils bioénergétiques globaux des capacités de flux basales et stimulées des deux cellules PDAC ont été affectés par le DCA, PANC-1 présentant une diminution de la capacité OxPhos et BXPC-3 présentant une déficience plus sévère des deux flux métaboliques (Figure 3G,H). La mesure des flux métaboliques dans des conditions de croissance à faible teneur en glucose a entraîné une réduction de l’OCR dans les deux lignées cellulaires (de manière plus cohérente dans BXPC-3) et une augmentation de l’ECAR dans BXPC-3. Le traitement au DCA (48 h) a provoqué dans les deux lignées cellulaires un effet inhibiteur significativement plus faible sur l’OCR (en particulier à 4 mM) à faible taux de glucose par rapport au régime de glucose élevé. Aucun changement significatif n’a été causé par le traitement au DCA sur l’ECAR dans les PANC-1 alors qu’une inhibition de 40-50% a été observée dans les BxPC-3, cependant, elle était indépendante de la disponibilité du glucose (Figure S5). Dans l’ensemble, ces observations inattendues indiquent que dans les cellules de PDAC, bien que le DCA soit apparemment capable d’activer la PDH, aucune inversion de l’effet Warburg n’a été atteinte. Au contraire, le traitement par le DCA a provoqué une crise bioénergétique, entraînant un ralentissement de la croissance cellulaire par un mécanisme hors cible écrasant.
LeDCA induit la production de ROS dans les lignées cellulaires de PDAC et affecte de manière différentielle la biogenèse et la dynamique des mitochondries
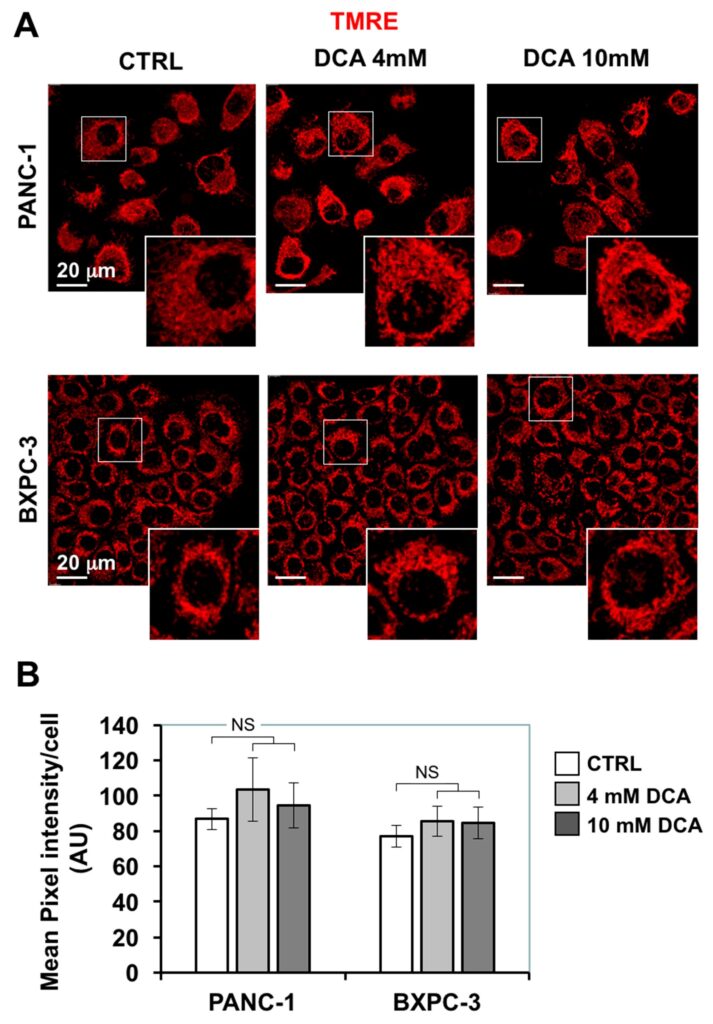
La dépression de la respiration mitochondriale provoquée par le DCA nous a conduits à étudier d’autres fonctions mitochondriales. Tout d’abord, nous avons évalué l’architecture morpho-fonctionnelle du compartiment mitochondrial par imagerie par microscopie confocale en utilisant la sonde fluorescente ΔΨ TMRE qui s’accumule dans les mitochondries en respiration. La figure 4A montre que dans le PANC-1, le signal lié au TMRE présentait un aspect particulaire diffus largement répandu dans le cytoplasme, ce qui indique une structure prévalente fragmentée plutôt qu’interconnectée. Une caractéristique similaire a également été observée dans les cellules BXPC-3, plus petites, qui présentaient toutefois une compartimentation péri-nucléaire annulaire. Le traitement de 24 heures au DCA n’a pas provoqué de changements majeurs ni dans l’intensité du signal fluorescent du TMRE ni dans son aspect morphologique.
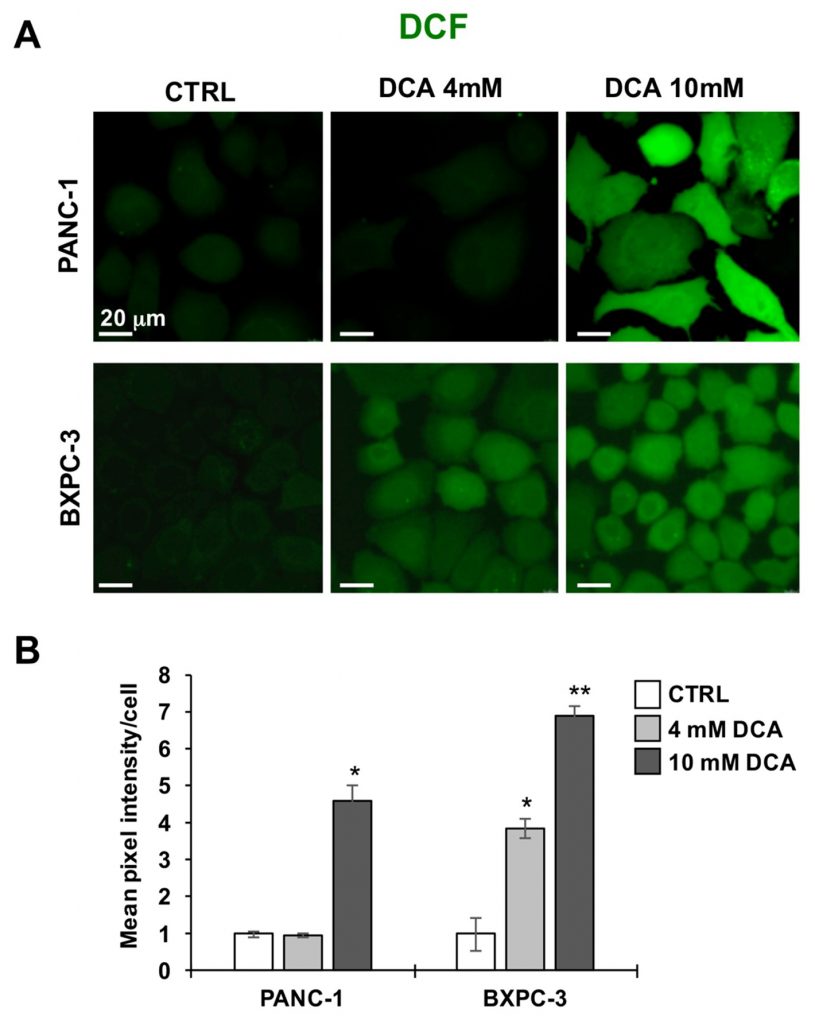
Ensuite, nous avons imagé les deux lignées cellulaires PDAC pour leur tonalité redox en utilisant la sonde de peroxyde DCF. Les figures 5A et B montrent que le traitement au DCA 10 mM pendant 24 heures a provoqué une augmentation significative du signal lié au DCF dans les lignées cellulaires PANC-1 et BXPC-3 par rapport à leurs niveaux de base non traités. Ce résultat indique un déséquilibre pro-oxydatif ou l’état redox causé par l’exposition au DCA.
L’analyse susmentionnée a été complétée par la mesure de l’ADN mitochondrial (ADNmt). Comme le montre la Figure 6A, le nombre de copies d’ADNmt par cellule était significativement plus élevé dans les PANC-1 que dans les BXPC-3, ce qui correspond à une activité respiratoire plus active. Après le traitement au DCA, une augmentation progressive et dose-dépendante de l’ADNmt a été observée dans les deux lignées cellulaires de PDAC. Ceci était probablement dû à une réponse compensatoire au dysfonctionnement de l’OxPhos causé par le DCA.
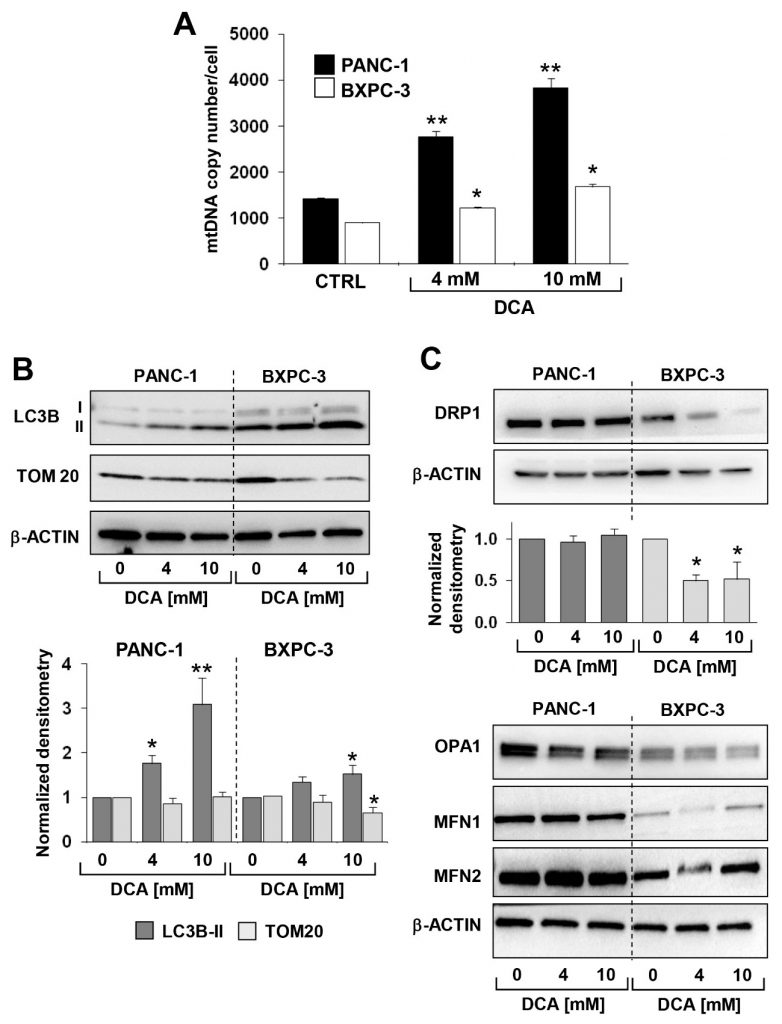
Ensuite, nous avons évalué par immunoblotting le niveau d’expression des protéines connues pour être impliquées dans la clairance mitochondriale (i.e., mitophagie) et la dynamique. Les figures 6B,C montrent que l’expression du marqueur d’autophagosome LC3B-II était significativement plus élevée dans BXPC-3 que dans PANC-1, et que le DCA a provoqué une augmentation progressive dose-dépendante du marqueur dans les deux lignées cellulaires. Cependant, TOM20, un marqueur de la membrane mitochondriale externe, n’a diminué de manière significative que dans la lignée cellulaire BXPC-3. L’analyse des facteurs impliqués dans le traitement de fusion/fission des mitochondries a révélé que tous étaient exprimés à des niveaux plus élevés dans PANC-1 par rapport à BXPC-3, mais avec un effet différentiel sur eux causé par le traitement au DCA (Figure 6C). En particulier, seul DRP1, un facteur impliqué dans la fission mitochondriale, a diminué après le traitement au DCA dans BXPC-3. Aucun changement significatif de l’expression de DRP1 n’a été détecté dans les PANC-1 ainsi que dans les facteurs induisant la fusion mitochondriale OPA1, MFN1 et MFN2 dans les deux lignées cellulaires après le traitement au DCA (figure supplémentaire S6).Ensemble, ces observations suggèrent un profil plus dynamique du compartiment mitochondrial dans les PANC-1, qui subissent une fusion-fission mitochondriale active, avec un niveau apparemment faible de traitement par mitophagie. À l’inverse, les cellules BXPC-3 semblent phénotypiquement plus enclines à poursuivre le contrôle de la qualité de l’organite. Cela pourrait être cohérent avec l’aspect plus fragmenté du réseau mitochondrial dans les cellules BXPC-3. Le traitement au DCA a provoqué une augmentation évidente du marqueur mitophagique LC3B dans les deux lignées cellulaires, qui est toutefois resté beaucoup plus important dans les BXPC-3.
Le DCA affecte de manière différentielle le compartiment des cellules souches cancéreuses dans les lignées cellulaires de PDAC
Pour étudier les mécanismes supplémentaires possibles de l’effet cytostatique du DCA, nous avons décidé de tester son impact sur la fraction des cellules souches cancéreuses (CSC) des lignées cellulaires de PDAC. Dans ce but, nous avons évalué l’expression du facteur Lin28 des cellules souches embryonnaires, dont il est prouvé qu’il est impliqué dans le métabolisme cellulaire [23] et connu pour être un biomarqueur de mauvais pronostic de la progression du cancer [24,25]. La figure 7A montre que 48 heures de traitement au DCA ont provoqué une réduction significative de l’expression de Lin28 dans les deux lignées cellulaires, BXPC-3 apparaissant plus sensible que PANC-1. Un résultat similaire a été obtenu dans les cultures 3D obtenues à partir des deux lignées cellulaires (Figure 7B).
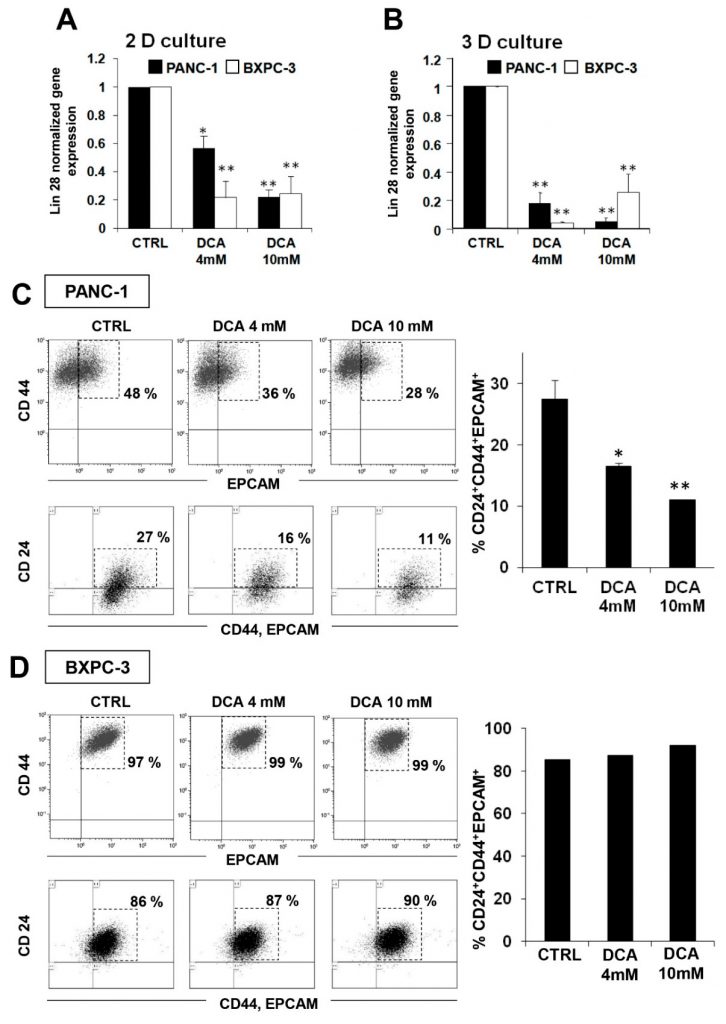
Cette observation nous a incités à approfondir l’effet du DCA sur les CSC par une analyse FACS des marqueurs de surface spécifiques des CSC pancréatiques CD24, CD44 et EPCAM [26,27]. La figure 7C montre une réduction significative et dose-dépendante des cellules CD24+/CD44+/EPCAM+ dans les cellules PANC-1 traitées pendant 48 h avec du DCA. Il convient de noter que l’intensité de la fluorescence a été réduite de près de 50 % après un traitement au DCA à 4 mM dans les cellules PANC-1, tandis qu’à 10 mM, une plus forte réduction de l’intensité de la fluorescence a déjà été observée après 24 h de traitement et n’a pas changé après 48 h de traitement (données non présentées). Au contraire, bien que les marqueurs CSC aient été exprimés dans environ 90 % des cellules BXPC-3, leur expression ne semble pas avoir été affectée par le traitement au DCA (figure 7D). Il a été récemment signalé que, plus que le niveau d’expression absolu de marqueurs donnés, c’est leur rapport qui permet d’identifier la sous-population présentant des caractéristiques de souche plus authentiques. En particulier, le rapport CD44/CD24 semble être le marqueur le plus fiable des CSC dans la tumorigenèse et les métastases [28]. En accord avec cette notion, il est pertinent de noter que le rapport d’expression CD44/CD24 dans PANC-1 est 8 fois plus élevé que dans BXPC-3 (figure supplémentaire S7), indiquant ainsi que, bien que moins peuplé, le compartiment des CSC est qualitativement plus proche des cellules souches. À l’inverse, le faible niveau d’expression des marqueurs de CSC largement répandus dans la population de BXPC-3 les phénotype comme des progéniteurs précoces.
Effet du DCA sur les cultures 3D
Pour approfondir les propriétés antitumorales du DCA, nous avons analysé ses effets biologiques sur un autre banc d’essai constitué par des cultures 3D de PANC-1 et de BXPC-3. Un nombre croissant de preuves suggère que les sphéroïdes dérivés de cellules cancéreuses sont enrichis en CSC ou en cellules présentant des caractéristiques liées aux cellules souches [29,30]. La figure 8A montre des micrographies des sphéroïdes obtenues après 7 jours de culture, à partir desquelles on peut clairement noter une différence de taille et de compacité de la couche limite entre les lignées cellulaires PANC-1 et BXPC-3. En particulier, les sphéroïdes dérivés des cellules PANC-1 sont apparus plus grands et avec des bords irréguliers par rapport à ceux dérivés des cellules BXPC-3. Le traitement au DCA pendant 72 heures a modifié la morphologie des sphéroïdes qui sont devenus progressivement moins définis. Cela était particulièrement évident dans les sphéroïdes dérivés de PANC-1 après un traitement au DCA à 10 mM. Conformément à cette observation, une réduction progressive et dose-dépendante de la viabilité cellulaire dans les sphéroïdes de PANC-1 et de BXPC-3 était clairement détectable.
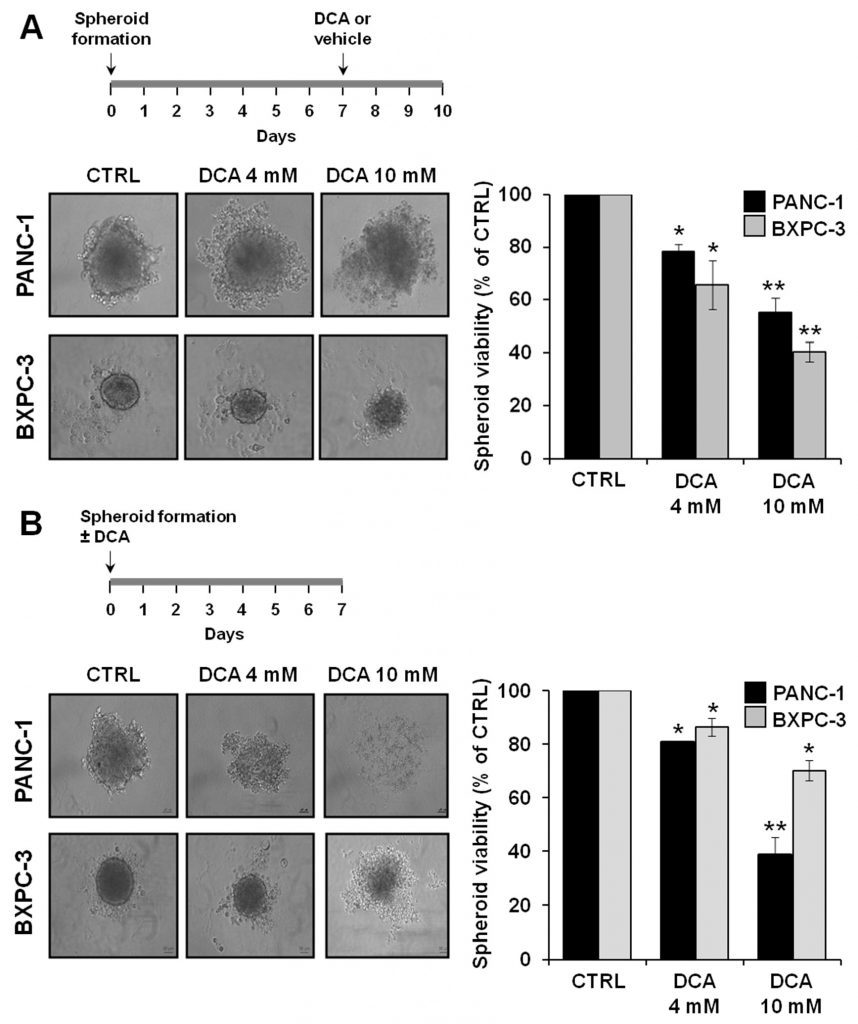
Nous avons également étudié la capacité du DCA à affecter la formation des sphéroïdes en traitant la suspension cellulaire au moment de l’ensemencement. Comme le montre la figure 8B, le DCA a fortement affecté la formation de sphéroïdes dans les deux lignées cellulaires de PDAC, PANC-1 étant plus sensible au médicament. En conséquence, la viabilité cellulaire des sphéroïdes de PANC-1 était significativement plus affectée que celle des sphéroïdes de BXPC-3.
Le DCA atténue la progression du cancer dans un modèle de souris xénogreffe de PC
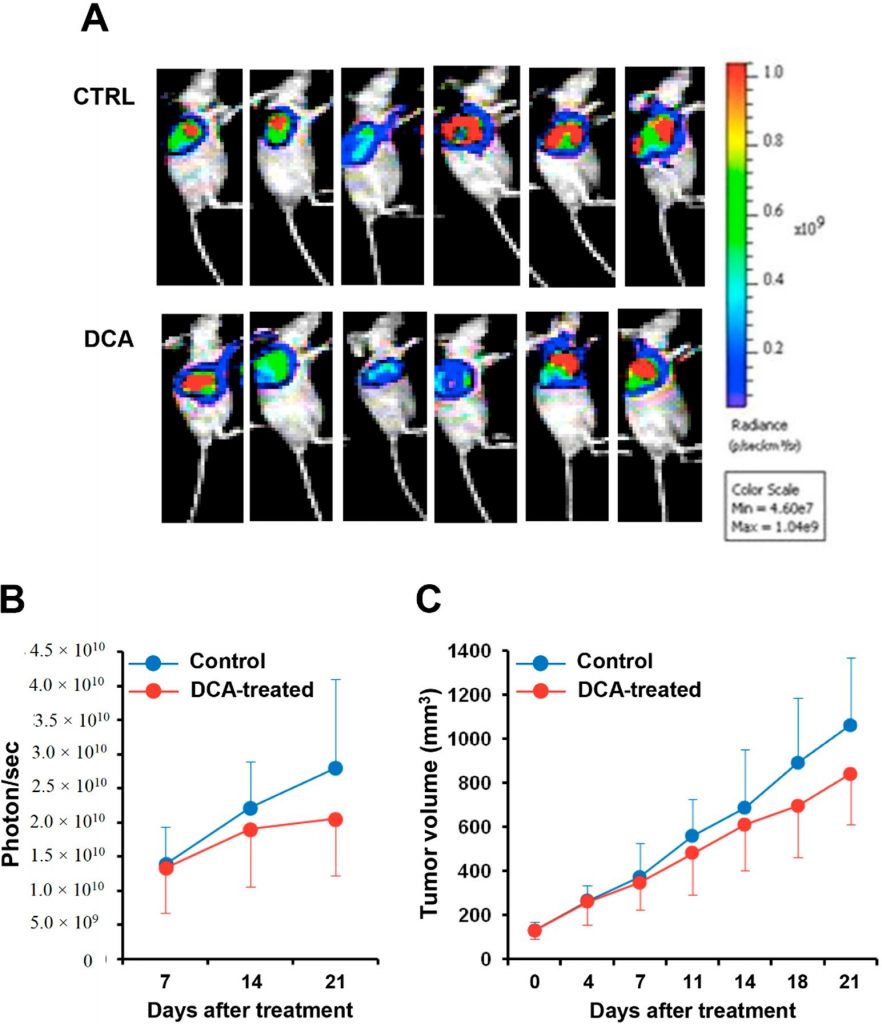
Nous avons enfin évalué l’effet de l’administration de DCA dans un modèle de souris xénogreffe de cancer du pancréas. La lignée cellulaire BXPC-3 exprimant la luciférase a été injectée dans des souris nude et, après avoir atteint un volume de 100 mm3, a été traitée avec du DCA ou un véhicule pendant trois semaines. La figure 9A montre l’imagerie par bioluminescence de la masse tumorale chez les souris traitées au DCA et les souris témoins. La quantification du signal de bioluminescence a révélé un retard dans la progression de la tumeur pancréatique chez les souris traitées au DCA, comme en témoigne la réduction de 25 à 30 % de l’intensité du signal de bioluminescence de la masse tumorale et de son volume par rapport aux souris traitées par le véhicule (Figure 9B,C). Cependant, en raison de la grande variabilité interindividuelle, les différences n’ont pas atteint la signification statistique.
4. Discussion
Les processus métaboliques aberrants se produisent généralement dans les cellules cancéreuses, et par conséquent, cibler le métabolisme représente une stratégie émergente pour traiter les tumeurs, y compris le cancer du pancréas [31,32,33]. L’hétérogénéité de la tumeur peut entraîner des cellules malignes avec un phénotype métabolique distinct, et par conséquent, une sensibilité différente aux médicaments métaboliques comme dans le cas de la gemcitabine vers laquelle la majorité des patients atteints de cancer du pancréas développent une résistance [17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34].
Dans la présente étude, nous avons testé l’efficacité du médicament métabolique DCA dans des cultures 2D et 3D de deux différentes lignées cellulaires bien caractérisées de cancer du pancréas (c’est-à-dire PANC-1 et BXPC-3) ainsi que dans un modèle de xénogreffe de cancer du pancréas. Les deux lignées cellulaires, cultivées en monocouche, ont montré une sensibilité marquée au DCA à la plus forte concentration testée (c.-à-d. 10 mM), qui a stoppé la prolifération cellulaire et a sévèrement inhibé leur capacité de migration. L’essai du médicament à une concentration plus faible (c’est-à-dire 4 mM de DCA) a mis en évidence une plus grande sensibilité de la lignée cellulaire PANC-1. Cette observation est intéressante car le PANC-1 est considéré comme une lignée cellulaire agressive et chimiorésistante [21,22,35].
L’analyse des paramètres de viabilité dans les deux lignées cellulaires PDAC traitées au DCA a révélé un pourcentage limité de cellules apoptotiques/nécrotiques, suggérant ainsi un effet cytostatique plutôt que cytotoxique exercé par le médicament, confirmant des rapports précédents [36,37].
Un effet majeur du DCA est généralement attribué à sa capacité à induire un changement métabolique de la glycolyse à l’oxydation mitochondriale du glucose. Ceci est obtenu par l’inhibition de la PDH kinase PDK, déplaçant ainsi la PDH vers son état non phosphorylé plus actif [38,39]. Par conséquent, le pyruvate est converti en acétyl-CoA qui entre dans le cycle des acides tricarboxyliques et alimente la phosphorylation oxydative mitochondriale.
Cependant, dans cette étude, nous avons constaté que malgré une déphosphorylation importante de la PDH induite par le DCA, aucune activation de l’activité respiratoire mitochondriale n’a été observée dans les deux lignées cellulaires de PDAC traitées par le médicament. Au contraire, le DCA a provoqué une réduction dose-dépendante de l’OxPhos mitochondrial qui était couplée à une inhibition de la capacité glycolytique dans BXPC-3.
Ce résultat était également quelque peu surprenant si l’on considère que, dans une étude précédente sur des lignées cellulaires de cancer de la bouche, nous avons démontré que les cellules PE15, caractérisées par un OxPhos soutenu, étaient résistantes au traitement par le DCA, tandis que les cellules HSC2/3, présentant un profil glycolytique, semblaient plus sensibles au médicament, avec un effet marqué également sur les paramètres morpho-fonctionnels mitochondriaux [7]. En outre, dans une autre étude portant sur les lignées cellulaires PANC-1 et BXPC-3, nous avons démontré une sensibilité différentielle à la privation de glucose/substitution au galactose, une condition qui favorise également le métabolisme oxydatif, les cellules BXPC-3, plus glycolytiques, étant plus vulnérables [6]. Cela nous a conduit à émettre l’hypothèse que la sensibilité différente des différentes lignées cellulaires aux médicaments ou aux conditions favorisant un changement de métabolisme pro-oxydatif dépendait de leur profil métabolique de base, les cellules les plus dépendantes de la glycolyse et/ou ayant une faible capacité respiratoire étant plus vulnérables.
L’effet dépressif du DCA sur la respiration mitochondriale n’a apparemment pas entraîné de modifications de la morphologie mitochondriale, bien qu’une réduction significative du facteur Drp1 favorisant la fission ait été observée dans les cellules BXPC-3 traitées au DCA. Il est probable que le phénotype fragmenté basal du réseau mitochondrial dans les BXPC-3 caché pour apprécier une fragmentation mitochondriale supplémentaire. Cependant, le nombre de copies d’ADNmt par cellule a augmenté de manière significative dans les deux lignées cellulaires PDAC, probablement en raison d’un mécanisme compensatoire à la suite d’un dysfonctionnement mitochondrial conduisant à l’activation de la mitophagie, comme le démontre l’augmentation de la forme clivée de LC3B-II. La production accrue de ROS observée dans les lignées cellulaires PDAC traitées au DCA pourrait déclencher le contrôle de la qualité des organites pour éliminer les mitochondries endommagées. Le déséquilibre de l’homéostasie des ROS est généralement lié au dysfonctionnement de la chaîne respiratoire mitochondriale, bien que la relation ne soit souvent pas claire (cause, effet, cercle vicieux). Généralement considérée comme un mécanisme pro-survie protégeant les cellules dans des conditions de stress (fonction oncogène) [40], il a été démontré plus récemment que la dérégulation de la mitophagie contribue à la résistance aux médicaments (rôle de suppression des tumeurs) [41]. Quoi qu’il en soit, l’induction et l’inhibition de la mitophagie dans la progression du cancer restent controversées.
L’ensemble des observations susmentionnées ne nous permet pas de rationaliser l’effet cytostatique du DCA comme étant simplement lié au remaniement métabolique des cellules du PDAC. Il faut tenir compte du fait que le DCA peut cibler d’autres voies cellulaires en plus de la PDK. En effet, il a été signalé que le DCA affecte la voie de biosynthèse du CoA [42], active la voie de signalisation AMPK [43], s’oppose à l’acétate [44] et perturbe le catabolisme de la tyrosine [45]. En outre, la comparaison des profils des métabolites dans les cellules traitées par le DCA ou par de nouveaux inhibiteurs plus sélectifs de la PDK a donné des résultats différents [46]. Cela nous a conduits à rechercher d’autres effets hors cible potentiels du DCA pour expliquer son efficacité à frapper les cellules tumorales.
Les cellules souches cancéreuses (CSC) représentent une fraction de la masse tumorale totale et sont responsables de la réfraction aux traitements anticancéreux, de la dissémination des métastases et des rechutes tumorales [47], ce qui suscite un intérêt croissant en tant que cibles pour le développement de nouvelles thérapies anticancéreuses [48]. À notre connaissance, il n’existe aucun rapport sur l’effet du DCA sur les cellules souches du cancer du pancréas. Pour disséquer cet aspect intriguant, nous avons d’abord évalué l’effet du traitement au DCA sur l’expression de Lin 28, révélant une baisse significative, dose-dépendante, détectable dans les deux lignées cellulaires. Il convient de noter que l’expression de Lin28 est strictement liée au métabolisme puisqu’elle est capable de réguler la progression des cellules cancéreuses via PDK1 et d’induire un changement énergétique [49]. Lin28 est impliquée dans la formation de CSCs [50] et son expression aberrante est associée à de nombreuses maladies néoplasiques humaines, y compris le cancer du pancréas [51,52]. L’analyse FACS de l’expression des antigènes de surface CD44, CD24 et EPCAM, typiquement caractéristiques des CSC pancréatiques [53], a révélé que le traitement au DCA réduisait le pourcentage de la fraction triple positive dans le PANC-1. En revanche, nous n’avons constaté aucune modulation induite par le DCA dans les BXPC-3, qui étaient principalement constitués de cellules triple positives. Il faut tenir compte du fait que, même si plus de 90 % des BXPC-3 étaient positifs pour les marqueurs de souche, leur niveau d’expression était relativement faible. À l’inverse, les PANC-1 exprimaient des niveaux plus élevés de marqueurs de la souche, même si ce n’était que dans moins de 30% de la population cellulaire, ce qui suggère un phénotype de CSCs plus jeunes caractérisant ce sous-ensemble cellulaire. Cette observation est cohérente avec l’idée que, plutôt que l’expression absolue des marqueurs de CSC, c’est leur ratio qui permet de « qualifier » la propension à la souche des cellules cancéreuses [28]. Le rapport d’expression CD44/CD24 dans le PANC-1 est beaucoup plus élevé que dans le BXPC-3, ce qui indiquerait que, bien que moins peuplé, le compartiment des CSC dans le PANC-1 est qualitativement plus proche des cellules souches. À l’inverse, le faible niveau d’expression des marqueurs de CSC largement répandus dans la population de cellules BXPC-3 les phénotyperait comme des progéniteurs précoces. Cette différence entre les deux lignées cellulaires de cancer du pancréas pourrait expliquer leurs phénotypes métaboliques distincts et leur sensibilité aux médicaments chimiothérapeutiques ainsi qu’au DCA.
La technologie de culture cellulaire tridimensionnelle (3D) est devenue un point central de la recherche en biologie des cellules tumorales. Comparées aux cultures en 2D, les cultures en 3D de lignées cellulaires impliquent un enrichissement en CSCs [30,54] et, en imitant les gradients métaboliques et prolifératifs des tumeurs in vivo, permettent une prédiction plus fiable de la réponse à un éventuel traitement [55,56]. Dans cette perspective, nous avons testé l’efficacité du DCA sur des cultures 3D obtenues à partir de PANC-1 et de BXPC-3 et avons montré que le traitement au DCA compromettait la structure et la viabilité des sphéroïdes déjà formés et compromettait la formation de sphéroïdes à partir des deux lignées cellulaires. En particulier, à la dose la plus élevée, le DCA était capable d’inhiber presque complètement la formation de sphéroïdes à partir de PANC-1. Conformément à nos observations dans les cultures 2D, les sphéroïdes BXPC-3 étaient moins sensibles que les sphéroïdes PANC-1 au traitement par le DCA. De même, dans les cultures en 2D, une régulation négative significative de Lin28 a également été observée dans les sphéroïdes des deux lignées cellulaires. Bien que les changements signalés ci-dessus dans le niveau d’expression de marqueurs de CSC largement reconnus dans les cultures 2D et 3D n’impliquent pas de preuve concluante de l’effet du DCA sur le compartiment de la souche de PDAC, ils fournissent néanmoins des indices jusqu’ici non appréciés qui méritent des investigations supplémentaires. Au niveau in vivo, le traitement au DCA a entraîné une croissance cancéreuse plus lente, bien que non significative, chez les souris porteuses de tumeurs BxPC-3-luc par rapport aux souris témoins, comme l’indiquent la réduction du nombre de photons et la diminution du volume tumoral.
Afin de rationaliser les effets déroutants du DCA sur les lignées cellulaires PDAC rapportés dans notre étude, nous avons proposé la séquence hypothétique d’événements suivante dans le but de stimuler des recherches supplémentaires (Figure 10). Nous suggérons qu’en raison d’une oxydation accrue du pyruvate, davantage d’équivalents réducteurs sont transférés à la chaîne respiratoire mitochondriale avec génération de ROS. Les complexes respiratoires sont à la fois des producteurs et des cibles de ROS [57], favorisant ainsi un cercle vicieux menant à l’inhibition progressive du transfert fonctionnel d’électrons tout au long de la chaîne respiratoire, ce qui favorise le détournement des électrons vers O2. En outre, l’amortissement de l’activité respiratoire peut entraîner l’accumulation d’intermédiaires du cycle de l’acide tricarboxylique ainsi que d’acétyl-CoA. Lorsque ce dernier s’accumule, il est connu pour provoquer la lysine-acétylation et l’inhibition de la fonction d’un certain nombre de protéines mitochondriales, y compris les complexes de la chaîne respiratoire [58,59]. Les dommages/dysfonctionnements mitochondriaux progressifs qui s’ensuivent sont contrecarrés par une régulation à la hausse de la mitophagie. Il reste à établir si et comment ces altérations mitochondriales médiées par le DCA provoquent un arrêt de la croissance et un recâblage du phénotype cellulaire, en particulier du compartiment des cellules souches cancéreuses. Cependant, un certain nombre de données indiquent qu’un état pro-oxydatif fait sortir les cellules souches de leur état indifférencié et induit/favorise leur engagement [60,61]. De plus, les modifications épigénétiques, telles que celles provoquant un remodelage de la chromatine, régulent l’équilibre entre la pluripotence et la différenciation des cellules souches [62,63]. Il est possible que l’arrêt du cycle TCA provoque l’efflux du citrate dans le cytosol où il libère de l’acétyl-CoA, augmentant ainsi sa disponibilité pour l’acétylation des histones. Évidemment, d’autres cibles non caractérisées du DCA peuvent contribuer aux effets observés du médicament, voire les dominer.
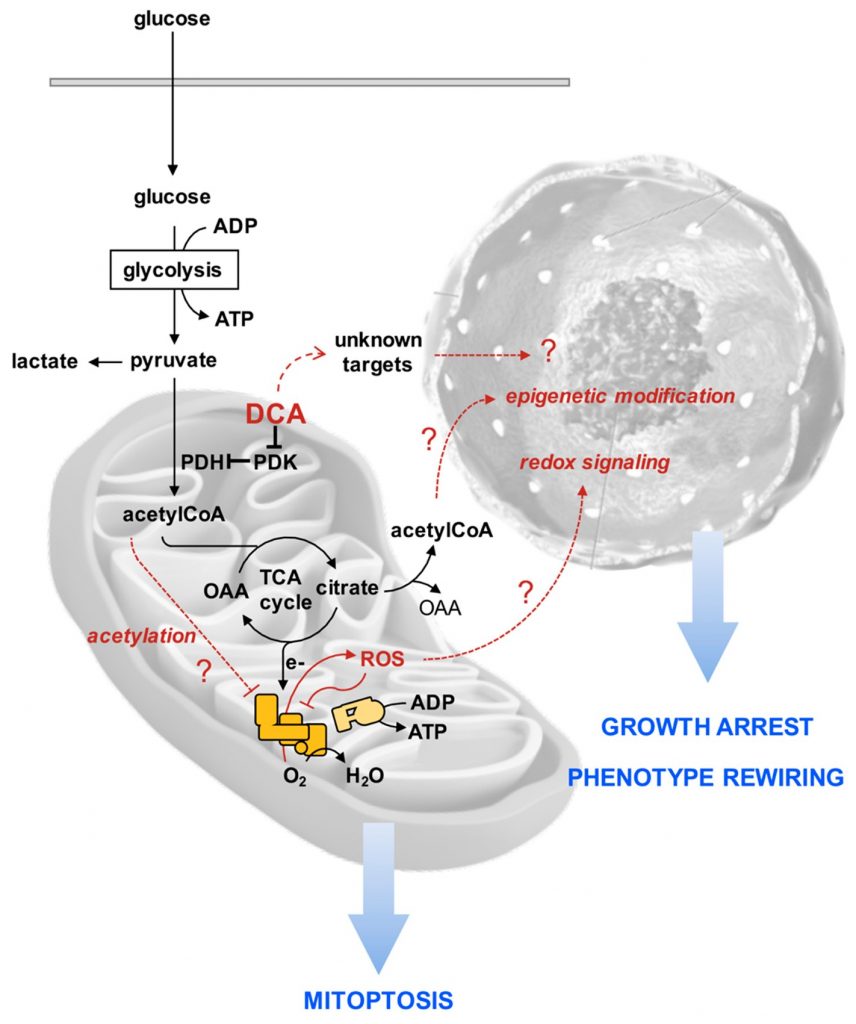
En conclusion, nos résultats indiquent clairement que l’efficacité du DCA dans l’inhibition de la croissance des cellules cancéreuses n’est pas toujours liée de manière causale à son effet stimulant documenté sur l’activité de la PDH et par conséquent à l’effet Warburg inverse. D’autres cibles secondaires doivent être envisagées d’un point de vue mécanique en fonction du phénotype cellulaire. Dans ce contexte, la preuve, émergeant de cette étude, que le compartiment CSC dans les lignées cellulaires dérivées du PDAC pourrait être affecté par le traitement DCA est pertinente. Il serait intéressant de vérifier si cela se produit dans d’autres types de cellules cancéreuses et des travaux sont en cours dans notre laboratoire dans ce sens. De récents projets de recherche visant à développer des nanoparticules chargées de dichloroacétate et fonctionnalisées en surface [64], et des médicaments multifonctionnels obtenus par des agents chimiothérapeutiques avec du DCA comme ligand [65] pourraient aider à concevoir la bonne formulation pharmacologique ciblée pour développer de nouvelles stratégies thérapeutiques efficaces pour combattre le cancer du pancréas ainsi que d’autres types de cancer.
Matériaux supplémentaires
Les documents suivants sont disponibles en ligne à l’adresse https://www.mdpi.com/2073-4409/8/5/478/s1 : Figure S1 : Effet du DCA sur la prolifération cellulaire évaluée par XCELLigence dans un milieu contenant peu de glucose ; Figure S2 : Guérison par grattage ; Figure S3 : Effet du DCA sur la production de lactate ; Figure S4 : Effet d’un traitement de 24 h au DCA sur les flux métaboliques ; Figure S5 : Effet comparatif du DCA sur les flux métaboliques des lignées cellulaires PDAC dans des conditions de culture à faible teneur en glucose (LG) et à forte teneur en glucose (HG) ; Figure S6 : Expression protéique des facteurs impliqués dans la fusion-fission des mitochondries (OPA1, MFN1/2) ; Figure S7 : Évaluation de la souche dans les lignées cellulaires PDAC.
Contributions des auteurs
T.T. planification, recherche et rédaction ; F.A., C.P. (Consiglia Pacelli) et C.M. recherche ; V.R. et I.L. conservation des données ; G.D.S. visualisation ; C.P. (Concetta Panebianco) et V.P. modèle animal ; N.C. révision et édition, et C.P. (Claudia Piccoli) conceptualisation, supervision.
Financement
Cette recherche a été financée par des fonds de recherche actuels du Ministère de la Santé italien à l’IRCCS CROB et par des subventions du Ministère de la Santé italien à travers la Division de Gastroentérologie (RC1703GA31 et RC1803GA30) de l’Hôpital IRCCS « Casa Sollievo della Sofferenza ».
Conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêt.
RÉFÉRENCES
1 Ying, H. ; Dey, P. ; Yao, W. ; Kimmelman, A.C. ; Draetta, G.F. ; Maitra, A. ; DePinho, R.A. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2016, 30, 355-385. [CrossRef]2 Hidalgo, M. Cancer du pancréas. N. Engl. J. Med. 2010, 362, 1605-1617. [CrossRef] [PubMed]
3 Camelo, F. ; Le, A. The Intricate Metabolism of Pancreatic Cancers. Adv. Exp. Med. Biol. 2018, 1063, 73-81. [PubMed]
4 Adamska, A. ; Domenichini, A. ; Falasca, M. Adénocarcinome canalaire pancréatique : thérapies actuelles et en évolution. Int. J. Mol. Sci. 2017, 18, E1338. [CrossRef] [PubMed]
5 Gentric, G. ; Mieulet, V. ; Mechta-Grigoriou, F. Hétérogénéité dans le métabolisme du cancer : New Concepts in an Old Field. Antioxid. Redox Signal. 2017, 26, 462-485. [CrossRef]
6 Tataranni, T. ; Agriesti, F. ; Ruggieri, V. ; Mazzoccoli, C. ; Simeon, V. ; Laurenzana, I. ; Scrima, R. ; Pazienza, V. ; Capitanio, N. ; Piccoli, C. Le recâblage du catabolisme des glucides affecte différentiellement la survie des lignées cellulaires du cancer du pancréas avec des profils métaboliques divers. Oncotarget 2017, 8, 41265-41281. [CrossRef]
7 Ruggieri, V. ; Agriesti, F. ; Scrima, R. ; Laurenzana, I. ; Perrone, D. ; Tataranni, T. ; Mazzoccoli, C. ; Lo Muzio, L. ; Capitanio, N. ; Piccoli, C. Le dichloroacétate, un médicament sélectif ciblant les mitochondries pour le carcinome épidermoïde oral : une perspective métabolique du traitement. Oncotarget 2015, 6, 1217-1230. [CrossRef]
8 Anderson, K.M. ; Jajeh, J. ; Guinan, P. ; Rubenstein, M. Effets in vitro du dichloroacétate et du CO2 sur les cellules HeLa hypoxiques. Anticancer Res. 2009, 29, 4579-4588.
9 Chen, Y. ; Cairns, R. ; Papandreou, I. ; Koong, A. ; Denko, N.C. Oxygen consumption can regulate the growth of tumors, a new perspective on the Warburg effect. PLoS ONE 2009, 4, e7033. [CrossRef]
10 Lu, X. ; Zhou, D. ; Hou, B. ; Liu, Q.X. ; Chen, Q. ; Deng, X.F. ; Yu, Z.B. ; Dai, J.G. ; Zheng, H. Le dichloroacétate améliore l’efficacité antitumorale des agents chimiothérapeutiques en inhibant l’autophagie dans le cancer du poumon non à petites cellules. Cancer Manag. Res. 2018, 10, 1231-1241. [CrossRef]
11 Yang, C. ; Wu, T. ; Qin, Y. ; Qi, Y. ; Sun, Y. ; Kong, M. ; Jiang, X. ; Qin, X. ; Shen, Y. ; Zhang, Z. Un nanomédicament conjugué doxorubicine-dichloroacétate facile avec une charge médicamenteuse élevée pour une administration sûre de médicaments. Int. J. Nanomed. 2018, 13, 1281-1293. [CrossRef]
12 Rajeshkumar, N.V. ; Yabuuchi, S. ; Pai, S.G. ; De Oliveira, E. ; Kamphorst, J.J. ; Rabinowitz, J.D. ; Tejero, H. ; Al-Shahrour, F. ; Hidalgo, M. ; Maitra, A. ; et al. Le traitement du panel de xénogreffes dérivées de patients atteints de cancer du pancréas avec des inhibiteurs métaboliques révèle l’efficacité de la phenformine. Clin. Cancer Res. 2017, 23, 5639-5647. [CrossRef]
13 Khan, A. ; Marier, D. ; Marsden, E. ; Andrews, D. ; Eliaz, I. Une nouvelle forme de thérapie par dichloroacétate pour les patients atteints de cancer avancé : A report of 3 cases. Altern. Ther. Santé Méd. 2014, 20 (Suppl. 2), 21-28.
14 Hanberry, B.S. ; Berger, R. ; Zastre, J.A. La vitamine B1 à forte dose réduit la prolifération dans les lignées cellulaires cancéreuses analogues au dichloroacétate. Cancer Chemother. Pharm. 2014, 73, 585-594. [CrossRef]
15 Lowe, A.W. ; Olsen, M. ; Hao, Y. ; Lee, S.P. ; Taek Lee, K. ; Chen, X. ; van de Rijn, M. ; Brown, P.O. Modèles d’expression génétique dans les tumeurs, les cellules et les tissus du pancréas. PLoS ONE 2007, 2, e323. [CrossRef]
16 Deer, E.L. ; González-Hernández, J. ; Coursen, J.D. ; Shea, J.E. ; Ngatia, J. ; Scaife, C.L. ; Firpo, M.A. ; Mulvihill, S.J. Phénotype et génotype des lignées cellulaires du cancer du pancréas. Pancreas 2010, 39, 425-435. [CrossRef]
17 Daemen, A. ; Peterson, D. ; Sahu, N. ; McCord, R. ; Du, X. ; Liu, B. ; Kowanetz, K. ; Hong, R. ; Moffat, J. ; Gao, M. ; et al. Metabolite profiling stratifies pancreatic ductal adenocarcinomas into subtypes with distinct sensitivities to metabolic inhibitors. Proc. Natl. Acad. Sci. USA 2015, 112, E4410-E4417. [CrossRef]
18 Mazzoccoli, C. ; Ruggieri, V. ; Tataranni, T. ; Agriesti, F. ; Laurenzana, I. ; Fratello, A. ; Capitanio, N. ; Piccoli, C. Le N-acétylaspartate (NAA) induit la différenciation neuronale de la lignée cellulaire de neuroblastome SH-SY5Y et la sensibilise aux agents chimiothérapeutiques. Oncotarget 2016, 7, 26235-26246. [CrossRef]
19 Scrima, R. ; Menga, M. ; Pacelli, C. ; Agriesti, F. ; Cela, O. ; Piccoli, C. ; Cotoia, A. ; De Gregorio, A. ; Gefter, J.V. ; Cinnella, G. ; et al. Le para-hydroxyphénylpyruvate inhibe la stimulation pro-inflammatoire du macrophage en prévenant le déséquilibre nitro-oxydatif et le décalage immunométabolique médiés par le LPS. PLoS ONE 2017, 12, e0188683. [CrossRef]
20 Fredebohm, J. ; Boettcher, M. ; Eisen, C. ; Gaida, M.M. ; Heller, A. ; Keleg, S. ; Tost, J. ; Greulich-Bode, K.M. ; Hotz-Wagenblatt, A. ; Lathrop, M. ; et al. Établissement et caractérisation d’une lignée cellulaire de cancer du pancréas hautement tumorigène et enrichie en cellules souches cancéreuses comme système modèle bien défini. PLoS ONE 2012, 7, e48503. [CrossRef]
21 Fryer, R.A. ; Barlett, B. ; Galustian, C. ; Dalgleish, A.G. Mécanismes sous-jacents à la résistance à la gemcitabine dans le cancer du pancréas et sensibilisation par le lénalidomide iMiD™. Anticancer Res. 2011, 31, 3747-3756.
22 Yin, T. ; Wei, H. ; Gou, S. ; Shi, P. ; Yang, Z. ; Zhao, G. ; Wang, C. Les cellules semblables à des souches cancéreuses enrichies dans les sphères Panc-1 possèdent une capacité de migration accrue et une résistance à la gemcitabine. Int. J. Mol. Sci. 2011, 12, 1595-
23 Jun-Hao, E.T. ; Gupta, R.R. ; Shyh-Chang, N. Lin28 and let-7 in the Metabolic Physiology of Aging. Trends Endocrinol. Metab. 2016, 27, 132-141. [CrossRef] [PubMed]
24 Zhang, J. ; Ratanasirintrawoot, S. ; Chandrasekaran, S. ; Wu, Z. ; Ficarro, S.B. ; Yu, C. ; Ross, C.A. ; Cacchiarelli, D. ; Xia, Q. ; Seligson, M. ; et al. LIN28 régule le métabolisme des cellules souches et la conversion à la pluripotence amorcée. Cell Stem Cell 2016, 19, 66-80. [CrossRef] [PubMed]
25 Wang, X. ; Weng, M. ; Jin, Y. ; Yang, W. ; Wu, D. ; Wang, T. ; Li, X. Au-delà d’un oncogène, Lin28 est un régulateur principal de la progression du cancer. Histol. Histopathol. 2018, 33, 327-334. [PubMed]
26 Li, C. ; Heidt, D.G. ; Dalerba, P. ; Burant, C.F. ; Zhang, L. ; Adsay, V. ; Wicha, M. ; Clarke, M.F. ; Simeone, D.M. Identification of pancreatic cancer stem cells. Cancer Res. 2007, 67, 1030-1037. [CrossRef]
27 Ohara, Y. ; Oda, T. ; Sugano, M. ; Hashimoto, S. ; Enomoto, T. ; Yamada, K. ; Akashi, Y. ; Miyamoto, R. ; Kobayashi, A. ; Fukunaga, K. ; et al. Importance histologique et pronostique de l’expression de CD44(+)/CD24(+)/EpCAM(+) dans le cancer du pancréas clinique. Cancer Sci. 2013, 104, 1127-1134. [CrossRef]
28 Li, W. ; Ma, H. ; Zhang, J. ; Zhu, L. ; Wang, C. ; Yang, Y. Correction d’auteur : Démêler les rôles de CD44/CD24 et ALDH1 comme marqueurs de cellules souches cancéreuses dans la tumorigenèse et les métastases. Sci. Rep. 2018, 8, 4276. [CrossRef] [PubMed]
29 Melissaridou, S. ; Wiechec, E. ; Magan, M. ; Jain, M.V. ; Chung, M.K. ; Farnebo, L. ; Roberg, K. L’effet des cultures cellulaires 2D et 3D sur la réponse au traitement, le profil EMT et les caractéristiques des cellules souches dans le cancer de la tête et du cou. Cancer Cell Int. 2019, 19, 16. [CrossRef] [PubMed]
30 Ishiguro, T. ; Ohata, H. ; Sato, A. ; Yamawaki, K. ; Enomoto, T. ; Okamoto, K. Sphéroïdes dérivés de tumeurs : Pertinence pour les cellules souches cancéreuses et les applications cliniques. Cancer Sci. 2017, 108, 283-289. [CrossRef]
31 Luo, J. ; Solimini, N.L. ; Elledge, S.J. Principes de la thérapie du cancer : Oncogène et dépendance non-oncogène. Cell 2009, 136, 823-837. [CrossRef]
32 Vivanco, I. Targeting molecular addictions in cancer. Br. J. Cancer 2014, 111, 2033-2038. [CrossRef]
33 Belizário, J.E. ; Sangiuliano, B.A. ; Perez-Sosa, M. ; Neyra, J.M. ; Moreira, D.F. Using Pharmacogenomic Databases for Discovering Patient-Target Genes and Small Molecule Candidates to Cancer Therapy. Front. Pharmacol. 2016, 7, 312. [CrossRef]
34 Grasso, C. ; Jansen, G. ; Giovannetti, E. Résistance aux médicaments dans le cancer du pancréas:impact de l’altération du métabolisme énergétique. Crit. Rev. Oncol. Hematol. 2017, 114, 139-152. [CrossRef]
35 Huanwen, W. ; Zhiyong, L. ; Xiaohua, S. ; Xinyu, R. ; Kai, W. ; Tonghua, L. La chimiorésistance intrinsèque à la gemcitabine est associée à la phosphorylation constitutive et induite par la laminine de FAK dans les lignées cellulaires du cancer du pancréas. Mol. Cancer 2009, 8, 125. [CrossRef]
36 Fedorchuk, A.G. ; Pyaskovskaya, O.N. ; Gorbik, G.V. ; Prokhorova, I.V. ; Kolesnik, D.L. ; Solyanik, G.I. Effectiveness of sodium dichloroacetate against glioma C6 depends on administration schedule and dosage. Exp. Oncol. 2016, 38, 80-83. [CrossRef]
37 Ma, W. ; Zhao, X. ; Wang, K. ; Liu, J. ; Huang, G. L’acide dichloroacétique (DCA) entre en synergie avec l’inhibiteur SIRT2 Sirtinol et AGK2 pour améliorer l’efficacité antitumorale dans le cancer du poumon non à petites cellules. Cancer Biol. Ther. 2018, 19, 835-846. [CrossRef]
38 Michelakis, E.D. ; Sutendra, G. ; Dromparis, P. ; Webster, L. ; Haromy, A. ; Niven, E. ; Maguire, C. ; Gammer, T.L. ; Mackey, J.R. ; Fulton, D. ; et al. Modulation métabolique du glioblastome avec le dichloroacétate. Sci. Transl. Med. 2010, 2, 31ra34. [CrossRef]
39 Papandreou, I. ; Goliasova, T. ; Denko, N.C. Anticancer drugs that target metabolism : Is dichloroacetate the new paradigm ? Int. J. Cancer 2011, 128, 1001-1008. [CrossRef]
40 Yan, C. ; Li, T.S. Double rôle de la mitophagie dans la résistance aux médicaments anticancéreux. Anticancer Res. 2018, 38, 617-621.
41 Praharaj, P.P. ; Naik, P.P. ; Panigrahi, D.P. ; Bhol, C.S. ; Mahapatra, K.K. ; Patra, S. ; Sethi, G. ; Bhutia, S.K. Rôle complexe des lipides mitochondriaux dans la mitophagie et l’apoptose mitochondriale : son implication dans la thérapeutique du cancer. Cell Mol. Life Sci. 2018. [CrossRef]
42 Dubuis, S. ; Ortmayr, K. ; Zampieri, M. A framework for large-scale metabolome drug profiling links coenzyme A metabolism to the toxicity of anti-cancer drug dichloroacetate. Commun. Biol. 2018, 1, 101. [CrossRef]
43 Li, X. ; Liu, J. ; Hu, H. ; Lu, S. ; Lu, Q. ; Quan, N. ; Rousselle, T. ; Patel, M.S. ; Li, J. Le dichloroacétate améliore la dysfonction cardiaque causée par les insultes ischémiques par la voie du signal AMPK – et non seulement les changements de métabolisme. Toxicol. Sci. 2019, 167, 604-617. [CrossRef]
44 El Sayed, S.M. ; Baghdadi, H. ; Ahmed, N.S. ; Almaramhy, H.H. ; Mahmoud, A.A. ; El-Sawy, S.A. ; Ayat, M. ; Elshazley, M. ; Abdel-Aziz, W. ; Abdel-Latif, H.M. ; et al. Le dichloroacétate est un antimétabolite qui antagonise l’acétate et prive les cellules cancéreuses de ses avantages : Une nouvelle hypothèse médicale fondée sur des preuves. Méd. Hypothèses 2019, 122, 206-209. [CrossRef] [PubMed]
45 Guo, X. ; Dixit, V. ; Liu, H. ; Shroads, A.L. ; Henderson, G.N. ; James, M.O. ; Stacpoole, P.W. Inhibition et récupération de la glutathione S-transférase zeta hépatique du rat et altération du métabolisme de la tyrosine après exposition au dichloroacétate et sevrage. Drug Metab. Dispos. 2006, 34, 36-42. [CrossRef]
46 Zhang, W. ; Hu, X. ; Zhou, W. ; Tam, K.Y. La méthode de chromatographie liquide-spectrométrie de masse en tandem a révélé que les cellules cancéreuses du poumon présentaient des profils de métabolites distincts lors du traitement avec différents inhibiteurs de la pyruvate déshydrogénase kinase. J. Proteome Res. 2018, 17, 3012-3021. [CrossRef]
47 Prasetyanti, P.R. ; Medema, J.P. L’hétérogénéité intra-tumorale du point de vue des cellules souches cancéreuses. Mol. Cancer 2017, 16, 41. [CrossRef] [PubMed]
48 Chen, L.S. ; Wang, A.X. ; Dong, B. ; Pu, K.F. ; Yuan, L.H. ; Zhu, Y.M. Une nouvelle perspective dans la thérapie du cancer : Cibler les cellules souches du cancer pour éradiquer le cancer. Chin. J. Cancer 2012, 31, 564-572. [CrossRef]
49 Ma, X. ; Li, C. ; Sun, L. ; Huang, D. ; Li, T. ; He, X. ; Wu, G. ; Yang, Z. ; Zhong, X. ; Song, L. ; et al. Lin28/let-7 axis regulates aerobic glycolysis and cancer progression via PDK1. Nat. Commun. 2014, 5, 5212. [CrossRef]
50 Zhou, J. ; Ng, S.B. ; Chng, W.J. LIN28/LIN28B : un driver oncogène émergent dans les cellules souches cancéreuses. Int. J. Biochem. Cell Biol. 2013, 45, 973-978. [CrossRef] [PubMed]
51 Wang, Y. ; Li, J. ; Guo, S. ; Ouyang, Y. ; Yin, L. ; Liu, S. ; Zhao, Z. ; Yang, J. ; Huang, W. ; Qin, H. ; et al. Lin28B facilite la progression et les métastases de l’adénocarcinome canalaire pancréatique. Oncotarget 2017, 8, 60414-60428. [CrossRef] [PubMed]
52 Balzeau, J. ; Menezes, M.R. ; Cao, S. ; Hagan, J.P. The LIN28/let-7 Pathway in Cancer. Front. Genet. 2017, 8, 31. [CrossRef] [PubMed]
53 Ishiwata, T. ; Matsuda, Y. ; Yoshimura, H. ; Sasaki, N. ; Ishiwata, S. ; Ishikawa, N. ; Takubo, K. ; Arai, T. ; Aida, J. Cellules souches du cancer du pancréas : Caractéristiques et méthodes de détection. Pathol. Oncol. Res. 2018, 24, 797-805. [CrossRef]
54 Ravi, M. ; Ramesh, A. ; Pattabhi, A. Contributions des cultures cellulaires 3D pour la recherche sur le cancer. J. Cell Physiol. 2017, 232, 2679-2697. [CrossRef]
55 Friedrich, J. ; Seidel, C. ; Ebner, R. ; Kunz-Schughart, L.A. Spheroid-based drug screen : Considérations et approche pratique. Nat. Protoc. 2009, 4, 309-324. [CrossRef]
56 Gutierrez-Barrera, A.M. ; Menter, D.G. ; Abruzzese, J.L. ; Reddy, S.A. Establishment of three-dimensional cultures of human pancreatic duct epithelial cells. Biochem. Biophys. Res. Commun. 2007, 358, 698-703. [CrossRef]
57 Dröse, S. ; Brandt, U. ; Wittig, I. Mitochondrial respiratory chain complexes as sources and targets of thiol-based redox-regulation. Biochim. Biophys. Acta 2014, 1844, 1344-1354. [CrossRef]
58 Carrico, C. ; Meyer, J.G. ; He, W. ; Gibson, B.W. ; Verdin, E. The Mitochondrial Acylome Emerges : Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metab. 2018, 27, 497-512. [CrossRef]
59Cela, O. ; Scrima, R. ; Pazienza, V. ; Merla, G. ; Benegiamo, G. ; Augello, B. ; Fugetto, S. ; Menga, M. ; Rubino, R. ; Fuhr, L. ; et al. Clock genes-dependent acetylation of complex I sets rhythmic activity of mitochondrial OxPhos. Biochim. Biophys. Acta 2016, 1863, 596-606. [CrossRef]
60 Chaudhari, P. ; Ye, Z. ; Jang, Y.Y. Rôles des espèces réactives de l’oxygène dans le destin des cellules souches. Antioxid. Redox Signal. 2014, 20, 1881-1890. [CrossRef]
61 Ding, S. ; Li, C. ; Cheng, N. ; Cui, X. ; Xu, X. ; Zhou, G. Redox Regulation in Cancer Stem Cells. Oxid. Med. Cell. Longev. 2015. [CrossRef] [PubMed]
62 Trisciuoglio, D. ; Di Martile, M. ; Del Bufalo, D. Rôle émergent de l’histone acétyltransférase dans les cellules souches et le cancer. Stem Cells Int. 2018, 2018, 8908751. [CrossRef]
63 Yadav, T. ; Quivy, J.P. ; Almouzni, G. Chromatin plasticity : Un paysage polyvalent qui sous-tend le destin et l’identité cellulaires. Science 2018, 361, 1332-1336. [CrossRef]
64 Abánades Lázaro, I. ; Haddad, S. ; Rodrigo-Muñoz, J.M. ; Orellana-Tavra, C. ; Del Pozo, V. ; Fairen-Jimenez, D. ; Forgan, R.S. Mechanistic Investigation into the Selective Anticancer Cytotoxicity and Immune System Response of Surface-Functionalized, Dichloroacetate-Loaded, UiO-66 Nanoparticles. ACS Appl. Mater Interfaces 2018, 10, 5255-5268. [CrossRef] [PubMed]
65 Petruzzella, E. ; Sirota, R. ; Solazzo, I. ; Gandin, V. ; Gibson, D. Dérivés Pt(iv) à triple action du cisplatine : une nouvelle classe d’agents anticancéreux puissants qui surmontent la résistance. Chem. Sci. 2018, 9, 4299-4307. [CrossRef]
Contenu connexe :