Stephen B. Strum & Örn Adalsteinsson & Richard R. Black & Dmitri Segal & Nancy L. Peress & James Waldenfels
S. B. Strum
International Strategic Cancer Alliance, 538 Granite Street, Ashland, OR 97520, EE.UU.
e-mail: [email protected]
S. B. Strum
American Society of Clinical Oncology, 538 Granite Street, Ashland, OR 97520, EE.UU.
S. B. Strum
American Urological Association, 538 Granite Street, Ashland, OR 97520, EE.UU.
Ö. Adalsteinsson
International Strategic Cancer Alliance, 873 E. Baltimore Pike #333, Kennett Square, PA 19348, USA
e-mail: [email protected]
R. R. Black
Nuclear Medicine and PET Imaging, Radisphere Teleradiology Group, Beachwood, OH 44022, EE.UU.
e-mail: [email protected]
D. Segal
Valley Radiology Consultants, Poway, CA 92064, EE.UU.
e-mail: [email protected]
N. L. Peress
Life Extension Foundation, 5760 S. Scenic Drive, Sault Sainte Marie, MI 49783, EE.UU.
e-mail: [email protected]
J. Waldenfels
Life Extension Foundation, 9114 Steeplebush Court, Annandale, VA 22003-4051, EE.UU.
e-mail: [email protected]
Palabras clave: Dicloroacetato . DCA . linfoma no Hodgkin . LNH . PET . PET/TC . Glucólisis . Metabolómica . Warburg
Abreviaturas:
DCA (dicloroacetato)
LNH (linfoma no hodgkiniano)
PET (tomografía por emisión de positrones)
TC (tomografía computarizada)
FDG (fluorodesoxiglucosa)
SUV (valor de captación normalizado)
mg (miligramos)
kg (kilogramos)
R-CHOP (rituximab-Cytoxan,
Hidroxidaunomicina, oncovin, prednisona)
Recibido: 27 de octubre de 2012
Aceptado: 23 de noviembre de 2012
Springer Science+Business Media Nueva York 2012
Resumen
La captación de la Tomografía por Emisión de Positrones con fluorodesoxiglucosa en los tumores de varios tipos de cáncer demuestra el papel clave de la glucosa en la proliferación del cáncer. El dicloroacetato es una molécula de 2 carbonos que tiene una actividad biológica crucial en la alteración de la descomposición metabólica de la glucosa en ácido láctico. Los estudios en líneas celulares humanas demuestran que los interruptores de dicloroacetato alteran la metabolómica de la célula cancerosa de una de glucólisis a una de fosforilación oxidativa, y al hacerlo restauran las funciones mitocondriales que desencadenan la apoptosis de la célula cancerosa. Los informes sobre el dicloroacetato en seres humanos son escasos. Los autores se pusieron en contacto con personas de foros de Internet que habían informado de respuestas anticancerígenas extraordinarias a la automedicación con dicloroacetato. Con el consentimiento informado, se solicitaron historiales médicos completos para documentar la respuesta al dicloroacetato, haciendo hincapié en el contexto de la monoterapia con dicloroacetato. De los diez pacientes que accedieron a dicha evaluación, sólo uno cumplía los criterios de tener un historial clínico completo, así como informes de patología, diagnóstico por imagen y laboratorio, junto con una terapia de agente único con dicloroacetato. Ese individuo es el objeto de este informe. En este caso clínico de un hombre con recaída documentada tras la quimioterapia de última generación para el linfoma no Hodgkin, se documenta una respuesta significativa al dicloroacetato con una remisión completa, que sigue en curso después de 4 años. El dicloroacetato parece ser una terapia novedosa que justifica una mayor investigación en el tratamiento del cáncer.
Antecedentes
El perfil metabólico del cáncer se ha caracterizado por estar asociado a adaptaciones metabólicas dirigidas a utilizar preferentemente vías relacionadas con la glucólisis (Warburg et al. 1927), lo que en la literatura reciente se ha denominado fenotipo glucolítico del cáncer. (Bui y Thompson 2006; Fang et al. 2008; Gatenby y Gawlinski 2003) En esencia, este fenotipo glucolítico es una adaptación darwiniana en la que la célula cancerosa disminuye y socava las vías metabólicas de oxidación de la glucosa utilizadas por las células normales para la producción de energía, y también para la eliminación de las células tumorales (Fang et al. 2008). Una función celular normal crucial que se ve comprometida en la batalla contra el cáncer es la muerte celular programada mitocondrial o apoptosis. Sobre la base de las observaciones anteriores, actualmente se están realizando ensayos clínicos con agentes dirigidos al metabolismo tumoral y, en concreto, a las vías mitocondriales de producción de ATP. El dicloroacetato (DCA) se ha utilizado durante los últimos 30 años para tratar la acidosis láctica congénita, una enfermedad metabólica rara que se da sobre todo en niños y adultos jóvenes. (Berendzen et al. 2006; Kuroda et al. 1986; Stacpoole et al. 1997, 2008, 2006). La acidosis láctica congénita está asociada a varios errores congénitos de disfunción mitocondrial, y casi mil publicaciones médicas revisadas por pares se centran en el uso clínico del DCA para este trastorno. También se han publicado numerosos artículos adicionales sobre diversos aspectos de la farmacología, los efectos metabólicos y la toxicología del DCA, pero sólo una docena de trabajos sobre el DCA están relacionados con su actividad anticancerígena (Bonnet et al. 2007; Bui y Thompson 2006; Cao et al. 2008; Chen et al. 2007; Christofk et al. 2008; Madhok et al. 2010; Michelakis et al. 2010, 2008; Vander Heiden 2010; Wong et al. 2008), y muchos de ellos se limitan a la evaluación del DCA en líneas celulares tumorales o en modelos animales no humanos (Cao et al. 2008; Madhok et al. 2010; Wong et al. 2008; Sun et al. 2010). Sólo la publicación de Michelakis et al. (2010) evaluó el DCA en cinco pacientes humanos con glioblastoma multiforme y presentó alguna indicación clínica de respuesta al DCA.
Se ha informado de que el DCA es un agente anticancerígeno eficaz in vitro y que causa regresión in vivo en el glioblastoma multiforme humano (Michelakis et al. 2010). Este, sin embargo, es el primer informe de un paciente de cáncer sometido a monoterapia con DCA con la inducción de una remisión completa post-recaída después de la quimioterapia de última generación con rituximab-CHOP.
Métodos
Población de pacientes
Los autores SS y OA solicitaron a todas las personas que habían informado de respuestas favorables contra el cáncer al DCA en foros de Internet, y les preguntaron si estarían de acuerdo en facilitar sus historiales médicos completos para un análisis detallado, sin coste alguno. Se informó a dichas personas de que el objetivo del estudio era determinar si la monoterapia con DCA podía confirmarse como una terapia activa contra el cáncer.
Cuestiones médico-legales
Se obtuvo el consentimiento informado por escrito del sujeto de este caso clínico para utilizar datos médicos detallados, así como imágenes radiológicas. Una copia del consentimiento escrito está disponible para su revisión por el editor de esta revista.
Criterios de exclusión de pacientes
Se solicitaron copias de todas las consultas y visitas al consultorio, informes patológicos, estudios de imagen y de laboratorio, informes quirúrgicos, datos de radioterapia y detalles de la quimioterapia. De 10 posibles candidatos, 5 proporcionaron historias clínicas manifiestamente insuficientes para permitir cualquier evaluación de la eficacia del DCA. En otros 3 candidatos, se inició otro tratamiento justo antes o poco después del inicio del DCA. En 1 candidato, el DCA nunca se había iniciado. A uno de los cinco individuos con registros insuficientes se le diagnosticó un linfoma no Hodgkin y parecía haber tenido una respuesta importante a la monoterapia con DCA, pero desafortunadamente no respondió a nuestras comunicaciones para obtener registros médicos completos. En el individuo restante (TM), objeto de este informe, se obtuvieron historiales médicos completos. Este individuo, descrito en este informe, no fue tratado por los autores.
Carga financiera para los participantes
En todos los casos en los que las revisiones iniciales de las historias clínicas indicaron una respuesta a la monoterapia con DCA, SS y OA solicitaron, revisaron y resumieron las historias clínicas completas en una historia clínica electrónica. En tales casos, se obtuvieron los cortes patológicos de diagnóstico y/o los bloques de tejido y se enviaron a un experto en hematopatología para obtener una segunda opinión. Los datos de imagen completos en forma de archivos Dicom fueron obtenidos y revisados por el coautor RB, un radiólogo certificado especializado únicamente en estudios PET y PET/CT. Con este enfoque, se consiguió una evaluación médica muy detallada, sin coste alguno para ninguno de los participantes en este estudio.
Presentación de casos
El sujeto del estudio TM es un varón de 52 años al que se le diagnosticó linfoma no hodgkiniano (LNH) por primera vez a los 46 años, el 1 de junio de 2007. Se presentó a finales de 2006 con antecedentes de herpes zóster, fiebres de bajo grado y sudores nocturnos abundantes. En los 5 meses siguientes sufrió una pérdida de peso de 15 kilos, y los diagnósticos de infección sinusal y tuberculosis dieron lugar a un tratamiento con diversos fármacos que incluían ciprofloxacina, clindamicina, INH, rifampicina, pirazimida y otros antibióticos. Una masa de 6,0 cm en el ángulo inferior izquierdo de la mandíbula fue observada en la evaluación de medicina interna el 1/5/07 junto con un nivel de proteína C reactiva de 196, ESR 99, hematocrito 33,9 pero una LDH normal de 138. El 7/5/07, una resonancia magnética del cuello mostró múltiples masas dentro de la glándula parótida izquierda y múltiples ganglios cervicales izquierdos de hasta 2,0 cm con extensión a la región supraclavicular.
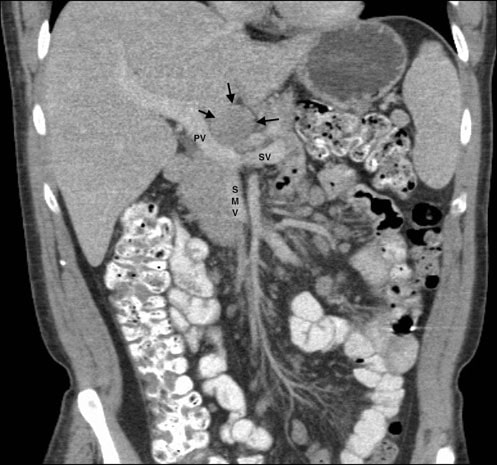
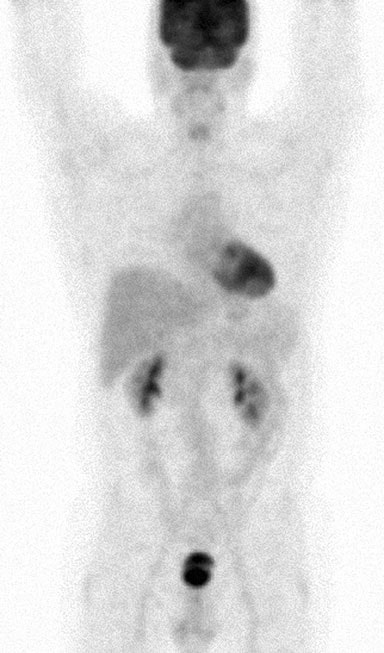
El 11/05/07 se realizó una aspiración con aguja fina de una masa discreta de 3,0 × 3,0 cm en la glándula parótida izquierda. Los autores solicitaron en numerosas ocasiones el informe y las diapositivas de este procedimiento, pero nunca los recibieron. Las tomografías computarizadas de tórax, abdomen y pelvis del 25/5/07 habían revelado esplenomegalia, múltiples masas renales bilaterales y linfadenopatía que afectaba a los ganglios mesentéricos, porta hepatis, retroperitoneales y del tronco celíaco (Fig. 1). Estos hallazgos eran compatibles con un diagnóstico de linfoma en estadio IV (> 4 ganglios afectados), con anemia y síntomas sistémicos de fiebre, sudoración nocturna y pérdida de peso, y con afectación extraganglionar de al menos la glándula parótida.
El 1/6/07 se realizó una biopsia excisional de la lesión parotídea izquierda. El informe patológico indicaba un linfoma no Hodgkin de células B, folicular y difuso, con afectación focal de la parótida, y clasificado como intermedio en base al tamaño celular, morfología e índice proliferativo (CD71). Los estudios de citometría de flujo de las muestras de tejido fueron compatibles con un linfoma no Hodgkin de células B de origen celular de centro germinal. La inmunohistoquímica fue positiva para los marcadores CD3, CD5, CD10, CD20, CD23, CD43, BCL-1 y BCL-2. Las tinciones Kappa y Lambda fueron positivas. Las tinciones kappa y lambda mostraron una población de células B monotípicas lambda que expresaban CD10 y constituían el 38% del tejido total.
La exploración física realizada el 26 de junio de 2007 por un oncólogo médico reveló una masa parotídea izquierda (6,0 × 5,0 cm), un ganglio yugulodigástrico izquierdo (4,0 × 4,0 cm), ganglios cervicales anterosuperiores izquierdos (3 .0 × 3,0 cm), ganglio yugulodigástrico derecho (2,0 × 2,0 cm), ganglios supraclaviculares derecho e izquierdo (3,0 × 3,0 cm) y ganglios axilares derecho e izquierdo (2,0 × 3,0 cada uno). Es importante señalar que varios médicos que examinaron el TM informaron de mediciones ganglionares significativamente diferentes de lugares anatómicos específicos el mismo día o en cuestión de pocos días.
Una consulta de hematopatología de segunda opinión en un centro médico universitario el 26/6/07 fue sospechosa de linfoma de células B de bajo grado con borramiento parcial de la arquitectura ganglionar por una infiltración atípica y predominantemente difusa de células linfoides pequeñas; se recomendó la rebiopsia de un ganglio agrandado. Un aspirado de médula ósea realizado el 29/06/07 indicó una médula normocelular con 1 gran agregado linfoide no paratrabecular, que contenía linfocitos pequeños maduros. La citometría de flujo de esa muestra mostró una población clonal de células B con restricción lambda, caracterizada por células pequeñas y maduras con contornos nucleares irregulares. Junto con la expresión parcial de CD10, y la falta de expresión de CD 5, se hizo un diagnóstico de linfoma folicular de células centrales junto con un linfoma de células B de bajo grado que afectaba a la médula ósea.
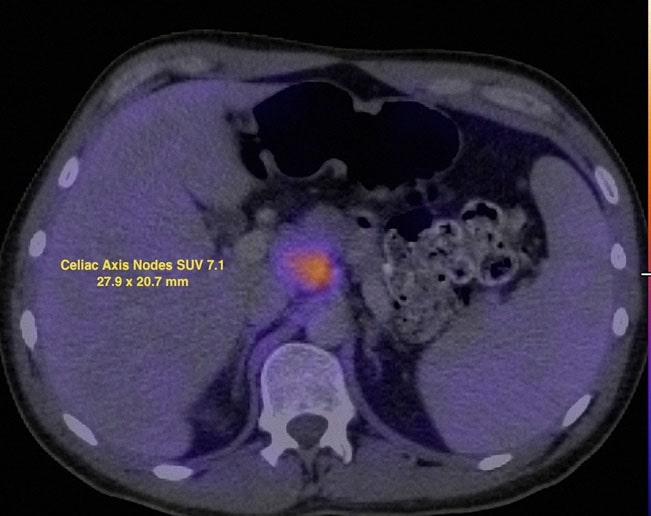
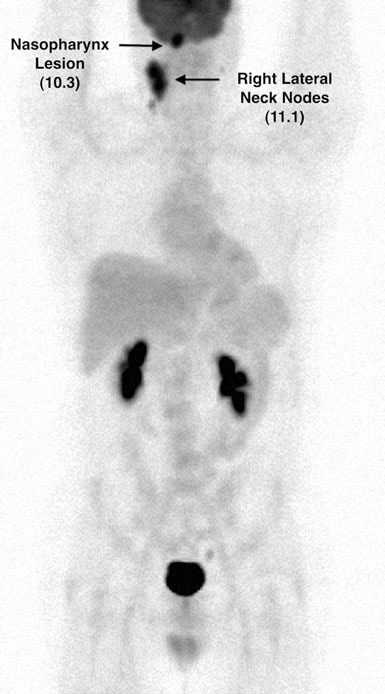
El 7/12/07 se realizó una PET con FDG que reveló anomalías metabólicas en múltiples localizaciones ganglionares, así como en la zona parotídea izquierda. El valor de captación estandarizado (SUV) se corrigió mediante estandarización con el hígado (Wahl et al. 2009) y los hallazgos se muestran en las Figs. 2 y 3.
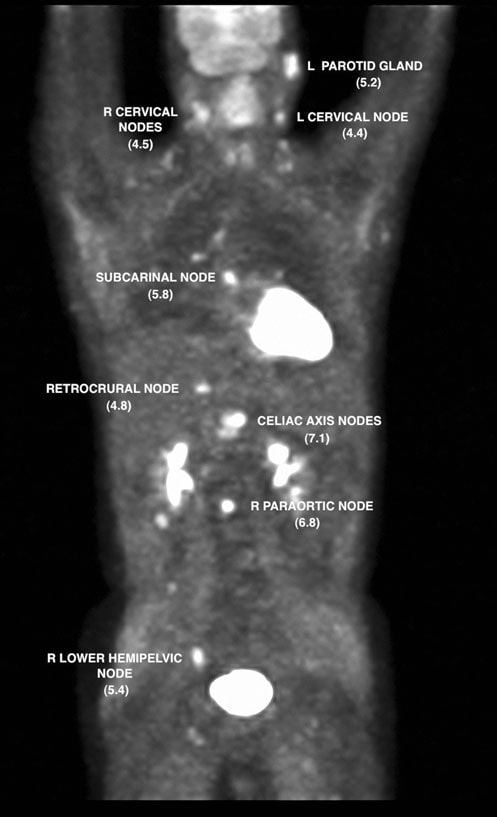
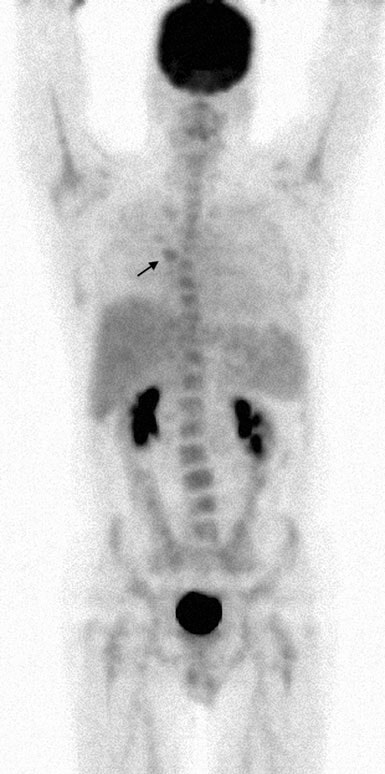
El 13/7/07 se inició el tratamiento con rituximab-CHOP (R-CHOP) en dosis densas y se repitió cada 14 días. Los ciclos 2-6 se administraron el 27/7/07, 10/8/07, 24/8/07, 7/9/07 y 21/9/07. El 10/5/07, un TAC de cuello, tórax, abdomen y pelvis mostró una resolución significativa de casi todas las áreas previas de adenopatías. El 8/10/07 se repitió un estudio PET con FDG que mostró captación focal en la región suprahiliar R (Fig. 4).
La exploración física del 9/10/07 indicó un área fibrótica residual en la región cervical posterior izquierda que medía 4,0 por 3,0 cm. La PET con FDG nº 3 del 1/25/08 fue completamente normal (Fig. 5).
Se consideró que la paciente estaba en remisión completa a partir del 1/08. Una repetición de FDG PET (#4) el 4/11/08 permaneció normal. Sin embargo, en 7/08 TM informó de una pérdida de peso de 11 libras durante las 2 semanas anteriores, tos y sudores, así como fiebres de bajo grado. El 10 de julio de 2008 se detectó un nódulo cervical anterior derecho de 2,0 × 2,0 cm en la exploración física y el 16 de agosto de 2008 se realizó la PET con FDG nº 5. En ella se observaron varios hipermetabolitos nuevos. Este mostró varios focos hipermetabólicos nuevos (Figs. 6 y 7).
El 9/4/08, TM fue examinada por un cirujano de cabeza y cuello, que describió una gran masa de ganglios mate en el cuello derecho en los niveles I, 2A, 2B y nivel superior 5. En la historia clínica se describía que el paciente estaba muy molesto por los efectos secundarios de náuseas y vómitos de la quimioterapia previa administrada entre el 13/7/07 y el 21/9/07. Según sus propias investigaciones, decidió embarcarse en un régimen de tratamiento que incluía DCA (dicloroacetato) y diversos suplementos, que comenzó el 10/09/08. Su «protocolo DCA» consistía en: DCA 1.000 mg al día en una dosis diaria. El DCA se mezclaba con 10 onzas de Mountain Dew™ que contenían 55 mg de cafeína. TM también utilizó vitamina B1 a 500 mg/día (hasta el 10/12/08), ácido alfa lipoico 600 mg bid, té verde (Jarrow™) 500 mg bid que contenía 74 mg de EGCG y 35 mg de cafeína por 500 mg.
A las 2 semanas de iniciar este régimen, el paciente informó de una reducción significativa de los sudores nocturnos, la fiebre de bajo grado, la anorexia y la fatiga. Un mes después del inicio del protocolo DCA, los ganglios del cuello eran notablemente más pequeños, y a los 2 meses no se palpaban ganglios. A los 71 días del protocolo DCA, se había producido la resolución completa de todos los síntomas sistémicos. TM informó de un buen nivel de energía y apetito, la capacidad de dormir bien y sin efectos secundarios.
FDG PET #6 se realizó el 12/4/08. Todas las anomalías observadas en el examen anterior del 16/8/08 habían desaparecido. Gracias a los esfuerzos de los autores SS y OA, se obtuvo una consulta externa de hematopatología experta en un centro oncológico internacional el 11/02/09. Las secciones teñidas con hematoxilina y eosina mostraron una glándula salival afectada por un denso infiltrado linfoide atípico que mostraba un patrón vagamente nodular y difuso. El infiltrado estaba compuesto por pequeñas células linfoides B monocitoides. Había lesiones linfoepiteliales. Por la morfología, el diagnóstico diferencial incluía el linfoma extraganglionar de células B de la zona marginal (MALToma) o el linfoma folicular con diferenciación monocitoide. Los estudios inmunohistoquímicos (IHC) se realizaron en portaobjetos sin teñir y fueron negativos para BCL-2, CD3, CD43 y queratina. Se observó positividad para BCL-6 y CD10 en las áreas vagamente nodulares, CD20, cadenas kappa y lambda en algunas células plasmáticas. La impresión final se comunicó como: «Aunque no hay pruebas definitivas de linfoma en la IHC, la morfología, el hallazgo en la citometría de flujo de células linfoides B monotípicas lambda y el hallazgo molecular de reordenamiento del gen Ig Kappa son consistentes con un linfoma de células B de bajo grado, que no puede clasificarse mejor.»
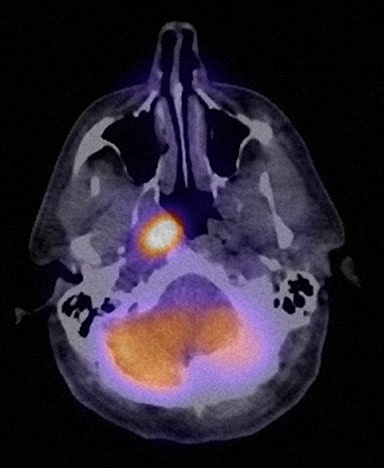
El 27/4/09 se realizó el estudio #7 de FDG PET/CT que no mostró actividad hipermetabólica. Los mismos hallazgos se observaron en el estudio #8 el 9/8/09. Sin embargo, una nota clínica de medicina interna del 1/8/10 indicaba que TM había notado un ganglio del cuello agrandado y el examen físico confirmó un ganglio cervical posterior izquierdo de 2 cm de diámetro. Además, empezó a tener sudores nocturnos leves y fatiga. Se le ofreció tratamiento convencional, pero TM lo rechazó y prefirió seguir con el protocolo DCA. El 1/2/10 se realizó el PET/TC nº 9, cuyo informe oficial indicaba una captación orofaríngea derecha que afectaba a una lesión de 3,5-4,0 cm con un SUV de 5,5. La revisión pericial realizada por RB indicó un SUV corregido de 3,5-4,0 cm. La revisión pericial de RB indicó un SUV corregido de 3,0 y una conclusión de que este hallazgo era «más consistente con la distribución fisiológica normal del radiofármaco» RB también indicó que la medición anatómica anterior de la lesión orofaríngea era definitivamente errónea. Los oncólogos locales concluyeron que el linfoma del paciente había recidivado, y se discutieron las opciones de tratamiento local con radioterapia, así como lenalidomida sola o con rituximab. TM volvió a rechazar más quimioterapia y continuó con DCA. El seguimiento hematológico-oncológico del 25 de febrero de 2011 indicó un ganglio linfático cervical izquierdo de 2,0 cm. Una vez más, se discutieron las opciones para el tratamiento adicional e incluyeron bendamustina, fludarabina, radioinmunoterapia con Zevalin, pero todos fueron rechazados. El 4/10/11 se realizó FDG PET/CT nº 10 que no mostró evidencia de actividad hipermetabólica (Fig. 8).
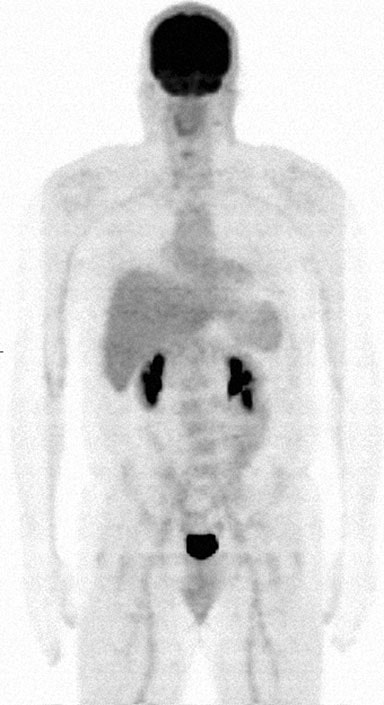
A partir de noviembre de 2012, TM informa que se encuentra bien y sin síntomas sistémicos. Nota aumento y disminución de pequeños nódulos en el cuello que dice que son del tamaño de un guisante. Informa de que sigue utilizando su protocolo de DCA, pero afirma que ha disminuido la frecuencia de dosificación de DCA a tres veces por semana. Afirma que su nivel de energía es excelente, que está trabajando a tiempo completo, pero como no tiene seguro no se ha sometido a más evaluaciones médicas mediante examen físico, pruebas de laboratorio o estudios de imagen. Los autores SS y OA han facilitado un estudio de imagen FDG PET/CT reciente el 8/11/12 y pruebas de laboratorio el 9/11/12, sin coste alguno para TM. El estudio FDG fue completamente normal. Todas las pruebas de laboratorio, salvo una elevación lipídica de triglicéridos y LDL, son normales, incluidos biomarcadores como β-2 μglobulina, receptores solubles de IL-2 y VSG.
Discusión
Las células tumorales tienen un metabolismo notablemente diferente en comparación con las células normales de las que derivan. Presentan un metabolismo alterado que les permite mantener tasas proliferativas más elevadas y resistir diversas señales apoptóticas (Bonnet et al. 2007; Bui y Thompson 2006). Este metabolismo alterado y aumentado implica que las células cancerosas necesitan grandes cantidades de proteínas, lípidos y nucleótidos, así como energía en forma de ATP. Hace casi 100 años, Otto Warburg publicó sus hallazgos que demostraban que las células cancerosas presentan una alteración de la energía celular que implica un aumento de la glucólisis aeróbica. (Warburg 1956a, b; Warburg et al. 1927)
Uno de los mecanismos de acción propuestos del DCA es cambiar el metabolismo de las células tumorales de la vía citoplasmática glucolítica, preferida por las células tumorales, a una vía oxidativa de la glucosa (fosforilación oxidativa) basada en las mitocondrias (Bonnet et al. 2007). Al hacerlo, el DCA restaura la función apoptótica de la mitocondria e invierte las alteraciones metabólicas que han permitido a las células tumorales sobrevivir, proliferar y metastatizar. Esta supuesta acción del DCA está asociada a su capacidad para revertir la inhibición de la PDH (piruvato deshidrogenasa), una enzima crucial que permite la entrada del piruvato en el Ciclo de Krebs a través de su oxidación al sustrato clave acetil CoA. El DCA hace esto inhibiendo la PDK mitocondrial (piruvato deshidrogenasa quinasa). Por lo tanto, el DCA inhibe el inhibidor implicado en la producción de PDH. El DCA lo consigue impidiendo la fosforilación e inactivación de la PDH por la PDK. (Constantin-Teodosiu et al. 1999)
La agresividad de las células cancerosas se ha asociado con el grado de hiperpolarización del potencial de membrana mitocondrial (Heerdt et al. 2005). Bonnet et al. han definido una serie de efectos mitocondriales del DCA, como se indica a continuación. El DCA tiene un efecto rápido y dependiente de la dosis que conduce a una despolarización de la membrana mitocondrial que se produce en 5 min. Debido a este aspecto de la actividad del DCA, el AIF (factor inductor de la apoptosis) se transloca al núcleo de la célula y el citocromo C se vuelve difusamente presente en el citoplasma. El DCA aumenta de forma dosis-dependiente la producción de H2O2 dentro del Complejo I del ETC. La generación de H2O2 activa los canales Kv1.5, que a su vez inhiben el NFAT1, un conocido inhibidor de la apoptosis. Otros efectos bioquímicos del DCA incluyen el aumento de la expresión de anexina, la activación de las caspasas 3 y 9, la disminución de la survivina y del PCNA (antígeno nuclear de células proliferantes) (Bonnet et al. 2007). Otros estudios han demostrado que la regulación al alza de los canales Kv1.5 probablemente disminuye el potasio celular, lo que activa las caspasas y la apoptosis (Remillard y Yuan 2004; Wang 2004; Pan y Mak 2007).
Se han realizado pocos estudios sobre el efecto del DCA en el crecimiento del cáncer humano, y la mayoría de ellos han sido in vitro. Tong et al. estudiaron el DCA solo o en combinación con 5-FU contra cuatro líneas celulares de cáncer colorrectal humano. Demostraron que el DCA es sinérgico con el 5-FU en la inducción de la apoptosis, la inhibición de la proliferación de células cancerosas, la mejora de la detención del ciclo celular en la fase G1/S, la disminución de la expresión de Bcl-2, mientras que aumenta la expresión de Bax y caspasa-3 (Tong et al. 2011). El estudio del DCA realizado por Michelakis et al. (2010) en cinco pacientes con glioblastoma multiforme describe la regresión radiológica y proporciona imágenes de dos pacientes con una aparente respuesta al DCA, aunque la citorreducción del tumor en el paciente número 2 parece confundir la interpretación del efecto del DCA.
La PET con fluorodesoxiglucosa F-18 (F-18 FDG) es utilizada actualmente por un número cada vez mayor de oncólogos para determinar la extensión de la malignidad y para documentar la respuesta terapéutica y proporcionar información pronóstica tras la terapia antineoplásica. El paciente presentado tenía una PET FDG basal coherente con sus signos y síntomas clínicos de un proceso neoplásico muy activo. Tras el tratamiento con quimioterapia de última generación mediante R-CHOP, alcanzó una remisión completa de corta duración; su recaída se caracterizó de nuevo por anomalías en la FDG PET. Sin embargo, su respuesta a la monoterapia con DCA condujo a una remisión completa duradera, ahora a los 4 años. La captación de F18 FDG por las neoplasias se considera un ejemplo del efecto Warburg, es decir, la utilización de glucosa por los tumores en presencia de oxígeno (glucólisis aeróbica). Sin embargo, la singular funcionalidad de la FDG PET observada en diversos tipos de cáncer es el resultado de múltiples factores, algunos de los cuales son:
- Fosforilación de F18 FDG a F18 FDG-6 fosfato por la Hexoquinasa (HK)
- Regulación al alza de la HK por factores de transcripción inducibles por hipoxia, por ejemplo, HIF-1α (Mathupala et al. 1997, 2001)
- Sobreexpresión de HK, especialmente del isómero HKII, en muchas poblaciones de células cancerosas
- Papel crucial de la HK en la bioenergética de las células tumorales, es decir, el efecto Warburg (Bustamante et al. 1981; Bustamante y Pedersen 1977)
- Ausencia de glucosa-6-fosfatasa (G6Pasa) en tumores muy malignos y de crecimiento rápido
- Atrapamiento resultante de F18-FDG-6 fosfato por las células cancerosas (Higashi et al. 2002)
En el sujeto de estudio que hemos presentado, una remisión completa fue documentada por FDG PET el 12/4/08 y ha continuado 4 años sin ninguna intervención terapéutica aparte del uso continuado de DCA, pero a una frecuencia de dosificación más baja de tres veces por semana. A partir del 12/5/12, TM informa que no hay hallazgos significativos de neuropatía periférica a la dosis de ≤ 10 mg/kg/día, lo cual es consistente con los hallazgos de Michelakis et al. (2010) que no informaron de neuropatía periférica significativa con dosis de DCA de menos de 6,25 mg/kg dos veces al día. La TM tampoco ha tenido otros efectos secundarios.
Una explicación postulada para la dramática respuesta documentada en este informe de caso es la de la remisión espontánea de un LNH de grado bajo a intermedio. Esto parece improbable a la luz de la drástica reducción y desaparición de los síntomas sistémicos y las adenopatías a las pocas semanas de iniciar el DCA. Además, la recaída relativamente rápida tras la quimioterapia inicial con R-CHOP hace que la remisión espontánea sea un hecho improbable en la enfermedad de TM.
Nuestro estudio, presentado aquí, debería provocar un debate en profundidad sobre el uso de la terapia metabólica como el DCA en pacientes con cáncer. Otras cuestiones que parecen pertinentes a este informe incluyen el posible papel de una dieta de bajo índice glucémico en la prevención y el tratamiento del cáncer, y la necesidad de centrarse en la metodología y el formato de presentación de informes relacionados con las imágenes PET. La utilización de historiales médicos de personas que exploran terapias contra el cáncer sin la supervisión de un profesional sanitario es un enfoque único en el trabajo de detectives médicos. Obtener los historiales médicos de los pacientes, así como los DVD y los informes de las imágenes, los informes patológicos y las diapositivas, y los informes de laboratorio supone un reto y requiere mucho tiempo. Sin embargo, si nuevos estudios en seres humanos confirman que el DCA tiene una actividad anticancerígena significativa, el enfoque utilizado en esta investigación debería considerarse a mayor escala.
Conclusión
La extraordinaria respuesta a la monoterapia con DCA del paciente TM, en un contexto de recaída tras la terapia R-CHOP, justifica la realización de más estudios clínicos con DCA en pacientes humanos con diversas neoplasias malignas, especialmente dado el coste insignificante y la toxicidad mínima de esta sencilla molécula de 2 carbonos.
Agradecimientos
Los autores desean dar las gracias a la Fundación Life Extension de Fort Lauderdale, Florida, por su ayuda financiera, y también a Robert Vergara, de Life Extension, por su ayuda en la optimización de los archivos gráficos utilizados en este informe. Jim Tassano fue fundamental para alertar a los autores SS y OA sobre los informes de respuestas clínicas significativas en pacientes con cáncer que reciben DCA.
Intereses contrapuestos
Los autores declaran no tener intereses financieros o no financieros en competencia.
Contribuciones de los autores
SS, OA, NP, JW contribuido en la redacción del manuscrito. SS y OA obtenido todos los registros médicos, facilitó la revisión de patología, compilado los registros electrónicos de salud, y el seguimiento de los participantes en el estudio. RB revisado todos los PET y PET / TAC imágenes, proporcionado corregido SUVs y mediciones. DS facilitó la obtención de los DVD clave de los estudios de imagen y emitió el dictamen radiológico.
Información del autor
SS es un oncólogo médico certificado con más de 40 años de práctica clínica, así como autor de numerosos artículos revisados por pares sobre la enfermedad de Hodgkin, el cáncer de próstata y los cuidados de apoyo al paciente con cáncer.
REFERENCIAS
1 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW (2006) Therapeutic potential of dichloroacetate for pyruvate dehydrogenase complex deficiency. Mitochondrion 6:126-135
2BonnetS, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R et al (2007) A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 11:37-51
3BuiT, Thompson CB (2006) Cancer’s sweet tooth. Cancer Cell 9:419- 420
4BustamanteE, Pedersen PL (1977) High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase. Proc Natl Acad Sci U S A 74:3735-3739
5BustamanteE, Morris HP, Pedersen PL (1981) Energy metabolism of tumor cells. Requerimiento de una forma de hexoquinasa con propensión a la unión mitocondrial. J Biol Chem 256:8699-8704
6CaoW, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S et al (2008) Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Próstata 68:1223-1231
7ChenZ, Lu W, Garcia-Prieto C, Huang P (2007) The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr 39:267-274
8ChristofkHR, Vander Heiden MG, Harris MH, Ramanathan A, Gerszten RE, Wei R et al (2008) The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature 452:230-233
9Constantin-TeodosiuD, Simpson EJ, Greenhaff PL (1999) The importance of pyruvate availability to PDC activation and anaplerosis in human skeletal muscle. Am J Physiol 276:E472-E478
10FangJS, Gillies RD, Gatenby RA (2008) Adaptation to hypoxia and acidosis in carcinogenesis and tumor progression. Semin Cancer Biol 18:330-337
11GatenbyRA, Gawlinski ET (2003) The glycolytic phenotype in carcinogenesis and tumor invasion: insights through mathematical models. Cancer Res 63:3847-3854
12HeerdtBG, Houston MA, Augenlicht LH (2005) The intrinsic mitochondrial membrane potential of colonic carcinoma cells is linked to the probability of tumor progression. Cancer Res 65:9861-9867
13HigashiT, Saga T, Nakamoto Y, Ishimori T, Mamede MH, Wada M et al (2002) Relationship between retention index in dualphase (18)F-FDG PET, and hexokinase-II and glucose transporter-1 expression in pancreatic cancer. J Nucl Med 43:173-180
14KurodaY, Ito M, Toshima K, Takeda E, Naito E, Hwang TJ et al (1986) Treatment of chronic congenital lactic acidosis by oral administration of dichloroacetate. J Inherit Metab Dis 9:244-252
15MadhokBM, Yeluri S, Perry SL, Hughes TA, Jayne DG (2010) Dichloroacetate induces apoptosis and cell-cycle arrest in colorectal cancer cells. Br J Cancer 102:1746-1752
16MathupalaSP, Rempel A, Pedersen PL (1997) Aberrant glycolytic metabolism of cancer cells: a remarkable coordination of genetic, transcriptional, post-translational, and mutational events that lead to a critical role for type II hexokinase. J Bioenerg Biomembr 29:339-343
17MathupalaSP, Rempel A, Pedersen PL (2001) Glucose catabolism in cancer cells: identification and characterization of a marked activation response of the type II hexokinase gene to hypoxic conditions. J Biol Chem 276:43407-43412
18MichelakisED, Webster L, Mackey JR (2008) Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 99:989-994
19MichelakisED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E et al (2010) Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2:31ra34
20PanJG, Mak TW (2007) Metabolic targeting as an anticancer strategy: dawn of a new era? Sci STKE 2007:14
21RemillardCV, Yuan JX (2004) Activation of K+ channels: an essential pathway in programmed cell death. Am J Physiol Lung Cell Mol Physiol 286:L49-L67
22StacpoolePW, Barnes CL, Hurbanis MD, Cannon SL, Kerr DS (1997) Treatment of congenital lactic acidosis with dichloroacetate. Arch Dis Child 77:535-541
23StacpoolePW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM et al (2006) Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatría 117:1519-1531
24StacpoolePW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW et al (2008) Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatría 121:e1223-e1228
25SunRC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC (2010) Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 120:253-260
26TongJ, Xie G, He J, Li J, Pan F, Liang H (2011) Efecto antitumoral sinérgico del dicloroacetato en combinación con 5-fluorouracilo en el cáncer colorrectal. J Biomed Biotechnol 2011:740564
27VanderHeiden MG (2010) Targeting cell metabolism in cancer patients. Sci Transl Med 2:31ed31
28WahlRL, Jacene H, Kasamon Y, Lodge MA (2009) From RECIST to PERCIST: evolving considerations for PET response criteria in solid tumors. J Nucl Med 50(Suppl 1):122S-150S
29WangZ (2004) Roles of K+ channels in regulating tumour cell proliferation and apoptosis. Pflugers Arch 448:274-286
30WarburgO (1956a) On respiratory impairment in cancer cells. Science 124:269-270 Warburg O (1956b) Sobre el origen de las células cancerosas. Science 123:309-314
31WarburgO, Wind F, Negelein E (1927) The metabolism of tumors in the body. J Gen Physiol 8:519-530
32WongJY, Huggins GS, Debidda M, Munshi NC, De Vivo I (2008) Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 109:394-402
Contenido relacionado: