Jason Y.Y. Wong1, Gordon S. Huggins2, Marcella Debidda4, Nikhil C. Munshi4 e Immaculata De Vivo1,3
1 Laboratorio Channing, Departamento de Medicina, Brigham and Women’s Hospital y Harvard Medical School, Boston Massachusetts.
2 Instituto de Investigación en Cardiología Molecular, Centro Médico Tufts-New England, Boston Massachusetts.
3 Programa de Epidemiología Molecular y Genética, Escuela de Salud Pública de Harvard, Boston Massachusetts.
4 The Jerome Lipper Multiple Myeloma Center, Department of Medical Oncology, Dana-Farber Cancer Institute, Harvard Medical School, Boston Massachusetts.
Correspondencia: Immaculata De Vivo, Brigham and Women’s Hospital, Department of Medicine, Channing Laboratory, 181 Longwood Ave, Boston, MA, 02115, USA. Teléfono: 617-525-2094. Fax: 617-525-2008. [email protected].
Recibido: 14 de septiembre de 2020
Aceptado: 4 de diciembre de 2020
Publicado: 9 de diciembre de 2020
Resumen
Propósito: Un reciente estudio de referencia demostró que el tratamiento con dicloroacetato (DCA) promovía la apoptosis en líneas celulares de cáncer de pulmón, mama y glioblastoma al cambiar el metabolismo de la glucólisis aeróbica a la oxidación de la glucosa junto con la remodelación del eje NFAT-Kv1.5. El objetivo de este estudio era determinar si el DCA induce la apoptosis en células de cáncer de endometrio y evaluar el mecanismo apoptótico.
Métodos: Un panel de líneas celulares de cáncer de endometrio con diversos grados de diferenciación se trató con DCA y se analizó la apoptosis mediante citometría de flujo. Se examinaron correlatos biológicos como la expresión génica, el Ca2+ intracelular y el potencial de membrana mitocondrial para evaluar el mecanismo apoptótico.
Resultados: Se observó el inicio de la apoptosis en cinco líneas celulares cancerosas de baja a moderadamente invasivas, incluyendo Ishikawa, RL95-2, KLE, AN3CA y SKUT1B, mientras que el tratamiento no tuvo efecto en las células 293T no cancerosas. Dos líneas celulares de adenocarcinoma endometrial altamente invasivas, HEC1A y HEC1B, resultaron ser resistentes a la apoptosis inducida por el DCA. Las líneas celulares que respondieron a la apoptosis presentaron un aumento significativo de la apoptosis temprana y tardía, una disminución del potencial de membrana mitocondrial y una disminución de la abundancia del transcrito de Survivina, lo que concuerda con un mecanismo regulado por la mitocondria. El tratamiento con DCA disminuyó los niveles de calcio intracelular en la mayoría de las líneas celulares que respondieron a la apoptosis, lo que sugiere una contribución de la vía mediada por NFAT-Kv1.5. El tratamiento con DCA aumentó los transcritos del modulador de la apoptosis p53 (PUMA) en las líneas celulares con respuesta apoptótica, lo que sugiere la participación de un mecanismo mediado por p53-PUMA.
Palabras clave: Dicloroacetato; Endometrio; Cáncer; Apoptosis; Mitocondrias
Declaración de conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
Conclusiones: El dicloroacetato sensibiliza eficazmente a la mayoría de las líneas celulares de cáncer de endometrio a la apoptosis a través de mecanismos mediados por mitocondrias, NFAT-Kv1.5 y PUMA. Se justifica una mayor investigación del potencial terapéutico del DCA para el cáncer.
MMP se confirma además mediante tinción fluorescente TMRM en un experimento dosis-respuesta de DCA. Las barras de error representan el error estándar de 2 experimentos independientes realizados en pocillos por triplicado.
INTRODUCCIÓN
El cáncer de endometrio (CE) es una neoplasia del revestimiento epitelial del cuerpo uterino. Es la neoplasia ginecológica maligna más frecuente en Estados Unidos y la cuarta causa de muerte por cáncer en el país entre las mujeres [1]. Existen pocas opciones terapéuticas sin graves inconvenientes para las pacientes con cáncer de endometrio recidivante o metastásico. La quimioterapia para la enfermedad metastásica presenta altas tasas de toxicidad, neuralgia y complicaciones cardiacas[2, 3]. El impulso en el desarrollo de futuras terapias contra el cáncer consistirá en reducir los efectos adversos graves y, al mismo tiempo, demostrar una eficacia comparable o superior a la de los tratamientos existentes.
La glucólisis aeróbica, también conocida como «efecto Warburg», es una propiedad única de la mayoría de los cánceres. Este fenómeno se caracteriza por un aumento de la captación de glucosa y la dependencia de la glucólisis para la producción de ATP a pesar de la disponibilidad de una fuente de oxígeno [5]. Se cree que la glucólisis aeróbica es el resultado de una disfunción mitocondrial que confiere resistencia apoptótica a las células cancerosas [6]. Esta resistencia apoptótica se debe a la hiperpolarización de la membrana mitocondrial, que impide la liberación de mediadores proapoptóticos de la mitocondria al citoplasma [4]. La hiperpolarización de las membranas mitocondriales es característica de la mayoría de los carcinomas y su reversión se asocia con el inicio de la apoptosis [7,8].
La orientación terapéutica de la glucólisis aeróbica es un medio novedoso para atacar las células cancerosas. El regulador clave del metabolismo celular es la piruvato deshidrogenasa (PDH), que a su vez es inhibida por la piruvato deshidrogenasa cinasa (PDK). Un estudio reciente demostró que la actividad de la PDK en líneas celulares cancerosas puede ser regulada a la baja por el DCA [4]. La acción metabólica del DCA implica dos mecanismos sinérgicos, las vías proximal y distal [4]. En la vía proximal (regulada por la mitocondria), el DCA se une a la PDK y atenúa la inhibición de la actividad de la PDH. El aumento de la actividad de la PDH desplaza el metabolismo de la glucólisis a la oxidación de la glucosa y disminuye la hiperpolarización del potencial de membrana mitocondrial (PMM), lo que abre los poros de transición mitocondrial (PTM). Esto permite la translocación de especies reactivas de oxígeno (ROS) y citocromo c desde la mitocondria al citoplasma, induciendo posteriormente la apoptosis mediante la activación de caspasas [4]. En la vía distal (NFAT-Kv1.5), las ROS translocadas dilatan los canales iónicos de potasio Kv1.5 en la membrana plasmática. La expulsión de iones de potasio hiperpolariza la célula, impidiendo la entrada de Ca2+ dependiente de voltaje. La disminución del nivel de Ca2+ intracelular inhibe la activación de NFAT, que aumenta aún más la expresión de Kv1.5; creando un bucle de retroalimentación positiva que, en última instancia, resulta en la reducción de la inhibición tónica de las caspasas [4].
El modulador de la apoptosis regulado por p53(PUMA) es una proteína proapoptótica que sirve de puente entre los mecanismos mitocondriales y los mediados por el supresor tumoral p53. PUMA es un miembro de la familia de proteínas BH3-only cuya expresión está regulada transcripcionalmente por p53 [9-11]. Tras su activación por diversos estímulos apoptóticos, PUMA se transloca a la membrana mitocondrial, donde antagoniza las proteínas Bcl-2 pro-supervivencia uniéndose a su dominio BH3, induciendo la liberación de citocromo c y promoviendo la apoptosis [10,12]. En estudios recientes de knock-out, se ha determinado que PUMA es un mediador crítico de la apoptosis dependiente de p53 en timocitos murinos y células humanas de cáncer colorrectal [13,14].
En numerosos estudios se ha demostrado que el dicloroacetato promueve la oxidación de la glucosa en diversos trastornos mitocondriales [15,16]. Además, en estudios clínicos de encefalomiopatías mitocondriales se observó que el tratamiento con DCA tenía efectos secundarios más leves que los de las terapias actuales contra el cáncer de endometrio [17]. Hasta la fecha, el efecto del DCA se ha estudiado en un número limitado de líneas celulares de cáncer y nuestra comprensión de los mecanismos apoptóticos alternativos regulados por el DCA es deficiente. El objetivo de nuestro estudio era determinar si el DCA sensibiliza a un panel de líneas celulares de cáncer de endometrio a la apoptosis y evaluar la contribución de los mecanismos regulados por mitocondrias, NFAT-Kv1.5 y PUMA en el proceso apoptótico examinando los correlatos biológicos.
Materiales y métodos
Cultivo celular
Las líneas celulares AN3CA, SKUT1B, RL95-2, KLE, HEC1A y HEC1B se adquirieron de American Type Culture Collection (Manassas, VA) y la línea celular Ishikawa se adquirió de Sigma-Aldrich (St. Louis, MO). Las células epiteliales renales 293T que sirvieron como controles sanos no cancerosos fueron proporcionadas por Nikhil Munshi. El adenocarcinoma epitelial de mama MCF7 fue un regalo de Ramon Parsons (Universidad de Columbia). Las líneas celulares se propagaron según las condiciones especificadas por el distribuidor. Las líneas celulares se mantuvieron en un incubador humidificado a 37 °C y 5% deCO2. Los medios de crecimiento DMEM, McCoy’s 5A, MEM y DMEM-F12 junto con los suplementos de penicilina-estreptomicina e insulina se adquirieron a Gibco-Invitrogen (Carlsbad, CA). El dicloroacetato (Alfa Aesar, Ward Hill, MA) se disolvió hasta obtener una solución de trabajo 1M, se esterilizó por filtración y se diluyó posteriormente en los medios de crecimiento hasta alcanzar las concentraciones de tratamiento.
Ensayo de viabilidad celular
La viabilidad celular se midió utilizando el reactivo CellTiter-Blue (Promega), que mide la capacidad de las células sanas viables para metabolizar un sustrato de Resazurina en un producto fluorescente de Resorufina. Brevemente, se sembraron 3×104 células de cada línea celular en placas de cultivo tisular de 96 pocillos de paredes opacas y se incubaron en condiciones de crecimiento estándar durante la noche hasta alcanzar una confluencia del 60-70%. A continuación, el medio de cada pocillo se sustituyó por medio de crecimiento fresco que contenía concentraciones crecientes de DCA (0 mM, 1 mM, 5 mM, 10 mM). Cada pocillo se realizó por triplicado en dos o más experimentos independientes para cada línea celular. Tras el tratamiento, las placas se incubaron durante 40 horas a 37°C, después de lo cual se añadieron 20 µl de sustrato de resazurina directamente a cada pocillo y se incubaron durante 3 horas más. A continuación, se leyeron las placas en un lector de placas Molecular Devices Gemini XPS (Sunnyvale, CA) a 560/590 nm.
Ensayos de apoptosis
Se utilizó citometría de flujo con tinción de Annexin-V-FITC (BD Bioscience, San Jose, CA) y 7-amino-actinomicina D (7-AAD) para determinar si el tratamiento induce específicamente la apoptosis temprana. Brevemente, se sembraron 5×105 células de cada línea celular en placas de cultivo tisular de 6 pocillos y se incubaron durante la noche hasta alcanzar una confluencia del 60-70% en condiciones de crecimiento estándar. A continuación, los medios de cada línea celular se sustituyeron por medios de crecimiento frescos con y sin una dosis de 10 mM de DCA. Los grupos de tratamiento de cada línea celular se repitieron tres veces. A continuación, las células se incubaron durante 40 horas a 37°C y se cosecharon con tripsina-EDTA al 0,25% (Invitrogen, Carlsbad, CA). Las células se lavaron con 1X PBS y posteriormente se tiñeron según el protocolo del fabricante. La citometría de flujo se realizó en un BD FACSCanto II (BD Bioscience) y los datos se analizaron en FlowJo 7.2.2 (Tree Star, Ashland, OR) y el software BD FACSDiva 6.0 (BD Bioscience).
Se utilizó el kit de ensayo Apoptag Peroxidase Terminal dUTP Nick-end Labeling (TUNEL) (Millipore, Billerica, MA) para visualizar las células apoptóticas que habían sufrido una fragmentación genómica dependiente de caspasas. Brevemente, se sembraron 5×104 células de varias líneas celulares representativas de cáncer de endometrio y se propagaron en portaobjetos de cámara de 4 pocillos (Nunc, Rochester, NY) durante la noche. A continuación, el medio de cada pocillo se sustituyó por medio de crecimiento fresco con o sin 10 mM de DCA. Transcurridas 48 horas, las células se fijaron con paraformaldehído al 1% y se tiñeron según el protocolo del fabricante. La tinción fue realizada por el Dana Farber – Harvard Cancer Center Pathology Core facility. Las imágenes se capturaron con un objetivo de 40X en un microscopio Zeiss Axioskop 2 Plus (Thornwood, NY) utilizando el software AxioVs40 v.4.4.1.0 a 24 bits RGB.
Ensayo de proliferación celular
Para medir la proliferación celular se utilizó la citometría de flujo con bromodesoxiuridina (BrdU) (BD Bioscience) y tinción con 7-AAD. Brevemente, se propagaron varias líneas celulares representativas de cáncer de endometrio tal como se ha descrito anteriormente para el ensayo de Annexin-V. A continuación, las células se privaron de suero y se sometieron al ensayo de Annexin-V. A continuación, se privó a las células de suero durante 8 horas en un medio de crecimiento que contenía un 0,5% de FBS para restablecer el ciclo celular a la fase G0. Posteriormente, se cambiaron los medios a medios de crecimiento normales con y sin tratamiento con 10 mM de DCA. Transcurridas 24 horas, se administró a las células un impulso de 10 µM de BrdU en medio de crecimiento durante 2 horas. A continuación, se recogieron las células, se tiñeron y se analizaron según el protocolo del fabricante.
Ensayos de potencial de membrana mitocondrial
El potencial de membranamitocondrialse detectó utilizando el Mitocapture Apoptosis Detection Kit (Calbiochem). El crecimiento, el tratamiento y la disposición experimental de las líneas celulares fueron idénticos a los del ensayo de Annexin-V descrito anteriormente. Después de un período de incubación de 24 horas tras el tratamiento con y sin 10 mM de DCA, las células se cosecharon y lavaron con 1X PBS y se tiñeron con el reactivo Mitocapture según el protocolo del fabricante y se analizaron mediante citometría de flujo. También se utilizó una versión modificada de un protocolo de tinción de mitocondrias con éster metílico de tetrametil rodamina (TMRM) (Invitrogen, Carlsbad, CA) descrito en otro lugar, para evaluar la MMP [18]. Brevemente, las células se propagaron y trataron exactamente igual que el ensayo de viabilidad celular descrito anteriormente. Tras un periodo de incubación de 24 horas, se aislaron 5×104 células, se lavaron en 1X PBS y se resuspendieron en solución salina tamponada de Hanks (HBSS) (Sigma-Aldrich, St. Louis, MA) con 50 nM de TMRM y se incubaron durante 30 min a 37°C. Las células se transfirieron a una placa opaca de 96 pocillos y la fluorescencia se midió a 530/620 nm a 37°C utilizando un lector de placas.
Niveles de calcio intracelular
Los niveles de calcio intracelular se midieron utilizando el ensayo de calcio FLUO-4 NW (Invitrogen). Brevemente, se sembraron 3×104 células de cada línea celular en placas individuales de cultivo tisular de 96 pocillos de paredes opacas y se incubaron en condiciones de crecimiento estándar durante 8 horas. A continuación, el medio de cada pocillo se sustituyó por medio de crecimiento fresco con concentraciones crecientes de DCA. Cada grupo de tratamiento se repitió en 4 pocillos en al menos 2 experimentos independientes. Tras 8 horas de incubación, las células de cada pocillo se trataron con el reactivo FLUO-4 según el protocolo del fabricante. A continuación, se leyeron las placas en un lector de placas fluorescentes a 494/516 nm.
PCR en tiempo real
Se utilizó la PCR cuantitativa en tiempo real para detectar la abundancia de los transcritos endógenos de Survivina y PUMA. Se sembró un total de 1×106 células de cada línea celular y se cultivaron en placas de cultivo tisular de 10 cm durante toda la noche. A continuación, el medio se sustituyó por medio de crecimiento fresco con o sin tratamiento con 10 mM de DCA. Tras 40 horas de incubación, se cosecharon 3×106 células de cada placa y se extrajo el ARN total con el RNeasy Plus Mini Kit (Qiagen, Valencia, CA) siguiendo el protocolo del fabricante. El ADNc de primera cadena se sintetizó con 1000 ng de ARN total y cebadores Oligo dT utilizando la transcriptasa inversa Superscript III (Invitrogen) según el protocolo del fabricante. A continuación, el producto de ADNc se trató con RNasa H durante 20 minutos a 37 °C y se diluyó a 100 ng/µL. Las concentraciones de ARN y ADNc se determinaron con precisión utilizando un espectrofotómetro Nanodrop ND-1000 (Wilmington, DE).
Las secuencias de cebadores para Survivin fueron hacia delante 5′-AAGAACTGGCCCTTCTTGGA-3′ y hacia atrás 5′- CAACCGGACGAATGCTTTT-3′ (Primerbank). Las secuencias de los cebadores para PUMA y el gen housekeeping RPLP0 se describieron en estudios anteriores [19, 20]. Las mezclas de reacción consistían en 1X Applied Biosystems SYBR Green PCR mix (Foster City, CA), 1,5 mM MgCl2, 0,42 mM dNTPs, 5U ABI Amplitaq Gold, 200 ng de ADNc molde y 333 nM de cebadores directo e inverso. Las reacciones se realizaron por triplicado en dos experimentos repetidos. Las condiciones de ciclado fueron 1 ciclo a 95C durante 10:00, 33x ciclos de 95C durante 0:30, 55C durante 0:30 y 72C a 0:30. Se calculó una curva estándar de cinco puntos para el ADNc. Una curva estándar de cinco puntos para las reacciones tuvo pendientes lineales de -3,2 +/- 0,1 con coeficientes de correlación (r2) por encima de 0,985. El ensayo se realizó con un sistema de PCR en tiempo real ABI 7300 (Foster City, CA). La cuantificación relativa de los transcritos diana normalizados con respecto a RPLP0 se evaluó con el software RQ Study del sistema de PCR en tiempo real ABI 7300 utilizando el método Ct comparativo.
Análisis estadístico
Se utilizó la prueba t de Student y el ANOVA unidireccional para evaluar las diferencias entre los brazos de tratamiento. Un valor p inferior a 0,05 se consideró significativo. Los análisis se realizaron con Microsoft Excel 2007 (Redmond, WA). Los gráficos se crearon con GraphPad Prism 5 (San Diego, CA).
Resultados
El DCA reduce la viabilidad de las células de cáncer de endometrio de forma dependiente de la dosis
Para determinar el efecto del DCA sobre la viabilidad de las células de cáncer de endometrio, se cultivó cada línea celular con dosis crecientes de DCA. En un panel de siete líneas celulares de cáncer de endometrio, AN3CA, Ishikawa, RL95-2 y SKUT1B presentaron una disminución de la viabilidad del 15% al 75% con el aumento de la concentración de DCA (Figura 1A). La reducción de la viabilidad para la mayoría de las líneas celulares que respondieron alcanzó significación a la dosis de 10 mM. Una comparación entre el grupo no tratado y el grupo tratado con DCA 10 mM tuvo valores p < 0,01 para AN3CA, Ishikawa, RL95-2 y SKUT1B. Se observó una disminución marginalmente significativa de la viabilidad con la dosis de 5 mM para AN3CA y RL95-2. Por lo tanto, se determinó que una dosis mínima efectiva aproximada de DCA para estas líneas celulares endometriales en el periodo de tratamiento se situaba entre 5mM y 10mM. Esta concentración de dosis de DCA y el tiempo de tratamiento están dentro del rango efectivo de experimentos in vitro publicados previamente [21]. Se observó un aumento estadísticamente significativo de la viabilidad en HEC1A, HEC1B y KLE con el aumento de las concentraciones de DCA (p < 0,02). Como era de esperar, no se observó ninguna diferencia estadísticamente significativa en la viabilidad de las células epiteliales 293T en el intervalo de dosis de DCA y el periodo de tratamiento dados (p = 0,27).
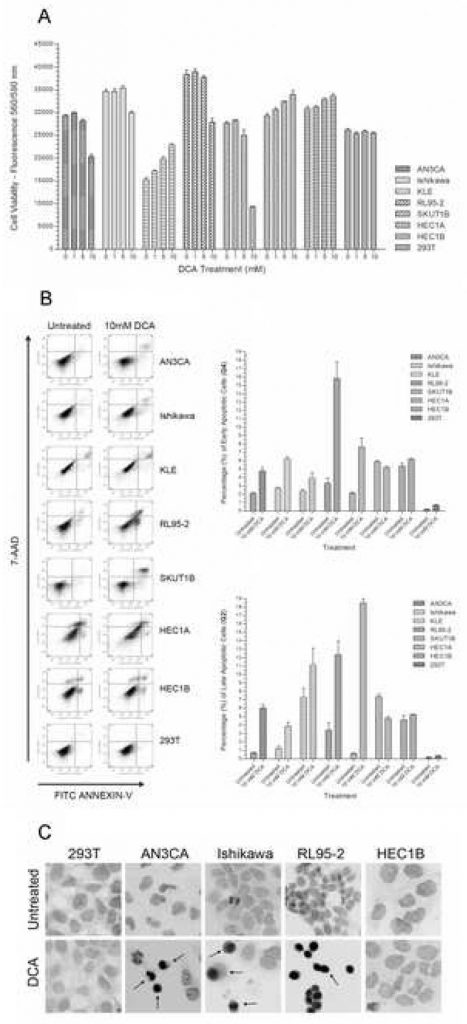
The Effect of DCA on Endometrial Cancer Cell Proliferation is Cell Line-Dependent
Para determinar si la disminución observada en la viabilidad celular con el tratamiento con DCA se debía a un efecto sobre la proliferación celular, se realizó una tinción con BrdU / 7-AAD en varias líneas celulares representativas y se analizó mediante citometría de flujo. No se observaron diferencias significativas en la dinámica del ciclo celular ni en la proliferación en las células epiteliales Ishikawa, HEC1B y 293T con el tratamiento con DCA (Tabla 1). En AN3CA, el tratamiento con DCA aumentó la proliferación, como indican los aumentos significativos del número de células en las fases S y G2/M y el menor número de células en G0/G1. En las células RL95-2, el tratamiento con DCA disminuyó significativamente la proporción de células en las fases S y G2/M y aumentó las células en la fase G0/G1; lo que indica una disminución de la proliferación y una detención del ciclo celular en un estado senescente o quiescente.
| Línea celular / Tratamiento | % Fase S | Desviación estándar Fase S | % Fase G0 / G1 | Stdev G0/G1 | % G2 / M Fase | Stdev G2 / M Fase |
|---|---|---|---|---|---|---|
| 293T Sin tratar | 60.6 | 0.6 | 33.2 | 1.7 | 6.2 | 1.25 |
| 293T DCA | 58.1 | 2.2 | 31.7 | 2.2 | 10.2 | 0.34 |
| p-valor | 0.15 | 0.14 | 0.03 | |||
| Ishikawa Sin tratar | 61.3 | 0.4 | 27.4 | 1.8 | 11.3 | 0.96 |
| Ishikawa DCA | 65.9 | 4.5 | 22.9 | 4.9 | 11.2 | 0.68 |
| p-valor | 0.21 | 0.25 | 0.96 | |||
| HEC1B Sin tratar | 37.4 | 2.7 | 41.5 | 0.8 | 21.2 | 1.93 |
| HEC1B DCA | 42.4 | 1.5 | 34.8 | 3.6 | 22.8 | 2.15 |
| p-valor | 0.19 | 0.08 | 0.47 | |||
| AN3CA Sin tratar | 43.5 | 0.6 | 50.6 | 2.0 | 5.9 | 1.80 |
ElDCA promueve la apoptosis en células de cáncer de endometrio
Para determinar si la reducción de la viabilidad celular debida al tratamiento con DCA se debía a la apoptosis y no a la necrosis, se realizó una tinción celular con Annexin-V-FITC y 7-AAD y se analizó mediante citometría de flujo. Se observaron aumentos significativos del 50% al 325% en las células apoptóticas tempranas en AN3CA, Ishikawa, KLE, RL95-2 y SKUT1B (Figura 1B). También se observaron aumentos significativos en las células apoptóticas tardías de estas líneas celulares (Figura 1B). RL95-2 presentó el mayor aumento de células apoptóticas tempranas, mientras que KLE presentó el aumento menos significativo. El aumento del porcentaje de células apoptóticas tardías en KLE no fue estadísticamente significativo. No se observaron diferencias en el porcentaje de células apoptóticas tempranas y tardías con el tratamiento en las células HEC1B, mientras que las células HEC1A tuvieron una disminución ligeramente significativa de células apoptóticas. La línea celular 293T no sufrió apoptosis con el tratamiento con DCA y el ligero aumento del porcentaje de células apoptóticas no fue significativo (p=0,08).
Dado que el ensayo Annexin-V se utiliza principalmente para detectar la apoptosis temprana, se realizó un ensayo TUNEL en varias líneas celulares de cáncer de endometrio representativas para confirmar cualitativamente la progresión a la apoptosis tardía mediante la visualización de la fragmentación del ADN dependiente de caspasas. En concordancia con el ensayo cuantitativo Annexin-V, se observaron aumentos de células apoptóticas TUNEL-positivas en AN3CA, Ishikawa y RL95-2 (Figura 1C). No se observó ninguna diferencia visual en las células TUNEL-positivas en las células HEC1B y 293T con un tratamiento de 10 mM de DCA.
Para determinar si la velocidad de crecimiento afecta a la sensibilidad de las líneas celulares de cáncer de endometrio al tratamiento con DCA, se cultivaron en condiciones de privación de suero con 0,5% de FBS, lo que restablece las células a la fase G0 y dificulta la proliferación, una célula que responde a la apoptosis y otra que no responde (Ishikawa y HEC1A, respectivamente). La privación de suero no afectó a la proporción de células apoptóticas tempranas en las células Ishikawa con tratamiento en comparación con las condiciones normales de crecimiento. El porcentaje de células apoptóticas tempranas aumentó del 3,17% +/- 0,21% SD en las células Ishikawa no tratadas al 6,20% +/- 1,04% SD p=0,05 en las células Ishikawa tratadas, lo que fue similar a los resultados en condiciones normales de crecimiento. El porcentaje de células Ishikawa apoptóticas tardías aumentó del 1,07% +/- 0,15% DS en las no tratadas al 3,57% +/- 0,49% DS p=0,02 en las tratadas. La línea celular HEC1A no mostró diferencias significativas en las células apoptóticas tempranas y tardías. El porcentaje de células apoptóticas tempranas HEC1A fue del 3,73% +/- 0,51% SD para las células no tratadas y del 1,93% +/- 0,60 SD p=0,07 para las células tratadas. El porcentaje de células apoptóticas tardías HEC1A fue del 3,60% +/- 0,69% SD para las no tratadas y del 4,90% +/- 1,37 SD p=0,25 para las tratadas.
Laapoptosis está mediada por la disminución de los niveles de calcio intracelular
Para determinar si la vía distal NFAT-Kv1.5 contribuye a la promoción de la apoptosis por DCA, se realizó un experimento dosis-respuesta para evaluar los niveles de Ca2+ intracelular. AN3CA, Ishikawa y SKUTB presentaron niveles decrecientes de calcio intracelular con dosis crecientes de DCA (Figura 2A). La disminución del calcio intracelular en estas líneas celulares alcanzó un nivel significativo a una concentración de 5mM de DCA con p < 0,03 para AN3CA, Ishikawa y SKUT1B. La línea celular KLE, que mostró la respuesta apoptótica más leve, tuvo una disminución insignificante de los niveles de calcio con el aumento de la concentración de DCA. Curiosamente, no se detectó ninguna diferencia en los niveles de calcio intracelular entre las dosis con RL95-2, que tuvo la mayor respuesta apoptótica. HEC1A, que anteriormente no mostró ninguna respuesta apoptótica, tampoco presentó diferencias en los niveles de calcio intracelular en ninguna concentración de tratamiento. HEC1B tampoco presentó diferencias en los niveles de calcio entre los grupos de tratamiento con 0, 1 y 5 mM de DCA y sólo se observa una ligera disminución con el tratamiento de 10 mM. No hubo diferencias en los niveles de calcio intracelular en 293T con el aumento de la concentración de DCA.
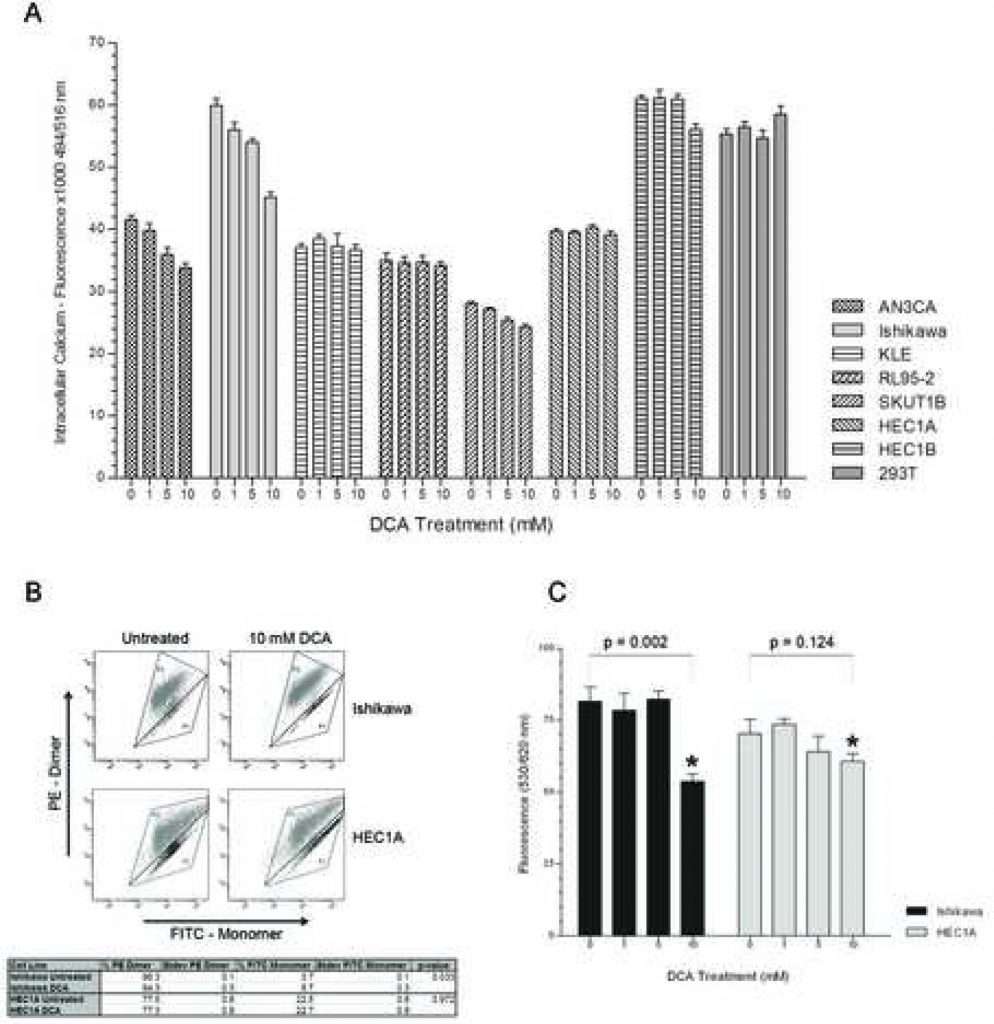
El tratamiento con DCA reduce la hiperpolarización de la membrana mitocondrial en células de cáncer de endometrio sometidas a apoptosis
Para evaluar si el DCA contribuía al inicio de la apoptosis a través de un mecanismo regulado por la mitocondria, se midieron las MMP de una célula apoptótica respondedora y otra no respondedora (Ishikawa y HEC1A respectivamente), con y sin tratamiento, mediante análisis FACS. El reactivo MitoCapture es un colorante catiónico que, dependiendo del grado de potencial eléctrico transmembrana mitocondrial, se acumula como monómero emisor de color verde en el citoplasma o como dímero emisor de color rojo en mitocondrias hiperpolarizadas de células cancerosas [22, 23]. El tratamiento con DCA de la línea celular Ishikawa redujo el porcentaje de células teñidas de rojo con 575 nm y aumentó la proporción de células teñidas de verde con 525 nm, lo que se corresponde con su respuesta apoptótica al tratamiento (Figura 2B). El tratamiento con DCA de la línea celular HEC1A no afectó al porcentaje de células teñidas de rojo y verde. Además, las células HEC1A no tratadas presentaban una menor proporción de células teñidas de rojo con membranas mitocondriales hiperpolarizadas en comparación con Ishikawa (77,5% +/- 0,6% DE frente a 96,3% +/- 0,1% DE, p < 0,01). No hubo diferencias en las MMP del control no canceroso 293T con el tratamiento (datos no mostrados). La modulación de las MMP por DCA se confirmó además mediante tinción TMRM en un experimento dosis-respuesta. Las MMP de las células Ishikawa disminuyeron significativamente a la dosis de 10 mM de DCA (Figura 2C). No hubo diferencias significativas en las MMP de las células HEC1A en ninguna de las concentraciones de tratamiento.
El DCAdisminuye la expresión de Survivina
Para confirmar aún más la contribución de la vía proximal regulada por las mitocondrias a la respuesta apoptótica, se utilizó PCR cuantitativa en tiempo real para evaluar la expresión de Survivina con y sin administración de DCA. El tratamiento de las líneas celulares de cáncer de endometrio con DCA produjo una disminución del 25% – 50% en la abundancia de ARNm de Survivin en las células que presentaron una respuesta apoptótica, incluidas AN3CA, Ishikawa, KLE, RL95-2 y SKUT1B (Figura 3A). RL95-2, que demostró el mayor aumento de células apoptóticas tempranas con el tratamiento, también tuvo la menor abundancia endógena de transcrito de Survivin. HEC1A y HEC1B, que anteriormente no presentaban respuesta apoptótica al DCA, presentaron aumentos del 20 al 30% en los transcritos de Survivin con el tratamiento. HEC1A presentó la mayor abundancia endógena de transcritos de Survivin. El control 293T también mostró un aumento de la abundancia de transcritos con el tratamiento con DCA.
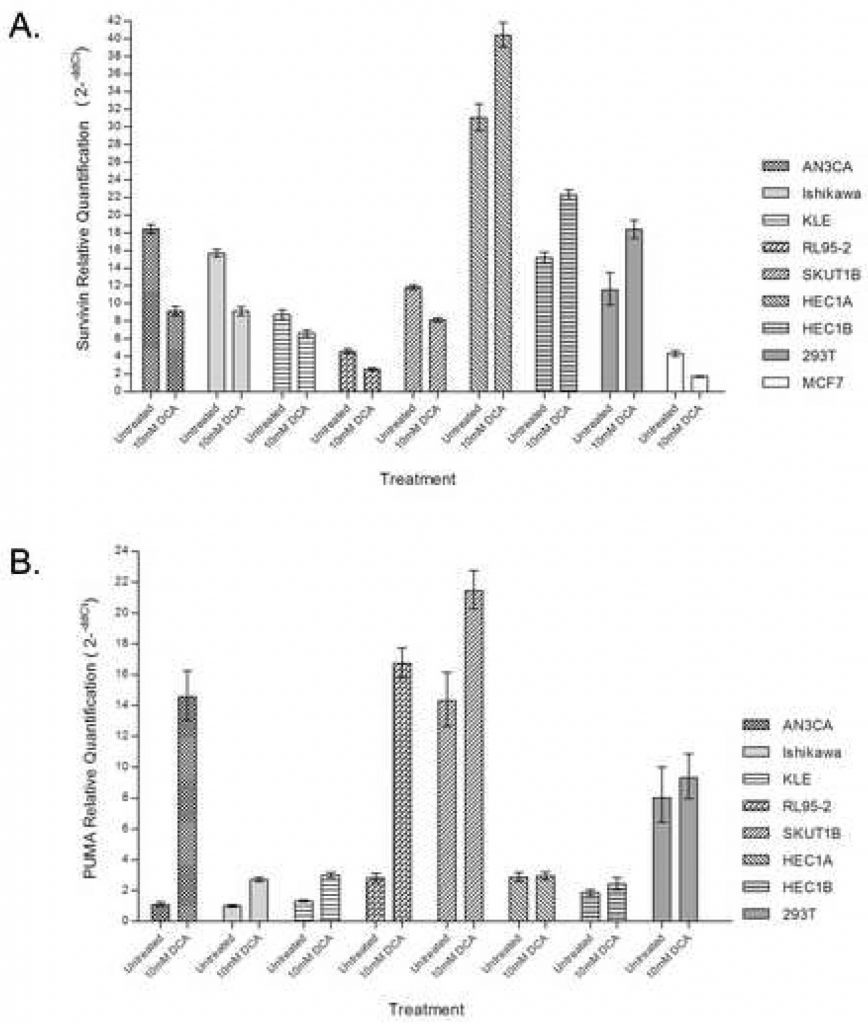
ElDCA aumenta la expresión de PUMA
Para determinar la contribución de la vía PUMA en la apoptosis inducida por el DCA, se utilizó la PCR cuantitativa en tiempo real para evaluar la abundancia de transcritos PUMA con y sin administración de DCA. El tratamiento de las líneas celulares de cáncer de endometrio con DCA aumentó drásticamente la abundancia de ARNm PUMA en las líneas celulares que presentaban una respuesta apoptótica, incluidas AN3CA, Ishikawa, KLE, RL95-2 y SKUT1B (Figura 3B). El mayor grado de inducción de PUMA se observó en las células AN3CA y RL95-2, que presentaron aumentos de 14 y 6 veces respectivamente. Las células HEC1A y HEC1B, que anteriormente no presentaban respuesta apoptótica al DCA, no mostraron diferencias en la cantidad del transcrito PUMA con el tratamiento. En las células 293T no se observaron diferencias en la cantidad de transcrito PUMA con el tratamiento.
Discusión
En este estudio, demostramos que la muerte celular del cáncer de endometrio inducida por el DCA está regulada por dos mecanismos principales: la vía regulada por la mitocondria y la vía NFAT-Kv1.5. Además, demostramos que el DCA reduce el riesgo de muerte celular. Además, demostramos que el DCA reduce la viabilidad de las células de cáncer de endometrio de forma dependiente de la dosis a través de la promoción de la apoptosis, mientras que no tiene ningún efecto sobre las células 293T no cancerosas. Por último, demostramos que el tratamiento con DCA influye en la supervivencia de las células de cáncer de endometrio a través de múltiples mecanismos moleculares, incluyendo la regulación del potencial de membrana mitocondrial, los niveles intracelulares de Ca2+, la pérdida de expresión de Survivin y la inducción de PUMA.
La respuesta pro-apoptótica de AN3CA, Ishikawa, y SKUT1B al DCA se correlacionó con una disminución dosis-dependiente de los niveles intracelulares de Ca2+, indicando la implicación del mecanismo NFAT-Kv1.5. En comparación, RL95-2 (que tuvo la mayor respuesta apoptótica al DCA) y KLE (que tuvo la respuesta apoptótica más leve) no mostraron una diferencia en los niveles de Ca2+ intracelular en ninguna concentración de tratamiento, lo que sugiere que la vía del mecanismo NFAT-Kv1.5 no está implicada en el mecanismo apoptótico de estas líneas celulares. En cambio, el tratamiento con DCA detuvo a las células RL95-2 en la fase G0/G1 del ciclo celular, un sello distintivo de la activación de p53, indujo fuertemente la expresión de PUMA en RL95-2 y disminuyó la expresión de Survivina, una proteína que desempeña un papel crítico en la regulación del ciclo celular. [ 29].
La Survivina es un inhibidor de la apoptosis regulado transcripcionalmente que, en respuesta a la alteración de la PGMA, se descarga desde la mitocondria al citoplasma, donde impide la activación de las caspasas, inhibe la apoptosis y promueve la progresión tumoral [26, 27]. Estudios previos han mostrado una correlación positiva entre el aumento de la expresión de Survivin y el grado tumoral del carcinoma endometrial [27,28]. Encontramos que la abundancia del transcrito de Survivin disminuyó significativamente en todas las líneas celulares de cáncer de endometrio que tuvieron una respuesta apoptótica al DCA. Nuestros resultados indican que la vía regulada por la mitocondria contribuye a la respuesta apoptótica en las líneas celulares de cáncer de endometrio sensibilizadas al DCA.
El transcrito PUMA aumentó significativamente en todas las líneas celulares de cáncer de endometrio que presentaron una respuesta apoptótica al DCA. El resultado puede ser indicativo de la contribución de la vía p53-PUMA con los mecanismos mitocondriales y de canales iónicos en la apoptosis inducida por el DCA. El aumento de la expresión de PUMA contrarrestaría aún más el efecto pro-supervivencia de Bcl-2 en la membrana mitocondrial en las líneas celulares que respondieron, permitiendo una mayor translocación de mediadores apoptóticos de la mitocondria al citoplasma, promoviendo así una mayor activación de las caspasas y la apoptosis.
Dos líneas celulares, HEC1A y HEC1B, ambas altamente invasivas con mayor resistencia a fármacos y mayor grado tumoral [24] en comparación con las otras líneas celulares endometriales, fueron resistentes al DCA. De hecho, ambas líneas celulares mostraron una mayor expresión de Survivin, una expresión de PUMA que no se vio afectada por el tratamiento con DCA y una menor proporción de células con membranas mitocondriales hiperpolarizadas. Estos hallazgos sugieren una menor dependencia de la glucólisis aeróbica. Nos planteamos si las mutaciones en el dominio de unión al DCA de la proteína PDK2 humana podrían explicar las diferencias en la respuesta al tratamiento con HEC1A y HEC1B. Sin embargo, no se encontraron mutaciones en los 2 exones que codifican el dominio putativo de unión al DCA mediante análisis de secuencia de todas las líneas celulares (datos no mostrados).
En resumen, nuestro estudio demuestra que el dicloroacetato es eficaz para sensibilizar a la apoptosis a la mayoría de las células de cáncer de endometrio de invasión baja a moderada. Nuestros datos colectivos sugieren que la apoptosis es coherente con las vías mitocondrial y NFAT-Kv1.5-mediada. Además, nuestros datos sugieren que la vía PUMA puede estar implicada en la promoción apoptótica por el DCA. Las investigaciones futuras deberían centrarse en examinar una gama más amplia de tipos de células cancerosas, además de determinar los mecanismos que confieren resistencia apoptótica al DCA. La vía potencialmente más informativa a considerar es la caracterización funcional del papel de la vía PUMA en la apoptosis inducida por el DCA.
Material suplementario
| Línea celular de cáncer de endometrio | Tipo de tumor | Grado de diferenciación | Invasividad | estado p53 |
| AN3CA | Adenocarcinoma epitelial | Indiferenciado (30, 31) | Moderado (25, 32) | Mutante (33) |
| KLE | Adenocarcinoma | Poco diferenciado (31, 34, 35) | Moderado (36) | Mutante (33) |
| Ishikawa | Adenocarcinoma epitelial | Bien diferenciado (25, 37) | Bajo (25) | Mutante (33) |
| RL95-2 | Carcinoma epitelial | Moderadamente diferenciado (31, 35, 38) | Dependiente del número de pasajes (39) | Mutante (deleción de codón) (33) |
| SKUT1B | Leiomiosarcoma mesodérmico | Bien diferenciado | Moderado-Alto (40) | n/a |
| HEC1A | Adenocarcinoma epitelial | Moderadamente diferenciado (31, 41) | Alto (25, 42) | Mutante (33) |
| HEC1B | Adenocarcinoma epitelial | Moderadamente diferenciado (31, 41) | Alto (25, 42) | Mutante (33) |
Agradecimientos
Nos gustaría dar las gracias al Dr. John Daley del centro de citometría de flujo HemNeo de Dana Farber por su formación técnica y a la Dra. Sabina Signoretti del centro de patología de Dana Farber – Harvard Cancer Center por su apoyo inmunohistoquímico.
Subvenciones: Este proyecto fue financiado por los Institutos Nacionales de Salud con las subvenciones CA082838 y CA101501.
REFERENCIAS
1 Rose P. Endometrial Carcinoma. New England Journal of Medicine. 1996;335(9):640-649. [PubMed] br>2 Ingram SS, Rosenman J, Heath R, Morgan TM, Moore D, Varia M. The predictive value of progesterone receptor levels in endometrial cancer. Int J Radiat Oncol Biol Phys. 1989;17(1):21-27. [PubMed] br>3 Randall ME, Filiaci VL, Muss H, et al. Randomized phase III trial of whole-abdominal irradiation versus doxorubicin and cisplatin chemotherapy in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol. 2006;24(1):36-44. [PubMed] br>4 Bonnet S, Archer SL, Allalunis-Turner J, et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell. 2007;11(1):37-51. [PubMed] br>5 Chen Z, Lu W, Garcia-Prieto C, Huang P. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr. 2007 [PubMed] br>6 Kim JW, Dang CV. Cancer’s molecular sweet tooth and the Warburg effect. Cancer Res. 2006;66(18):8927-8930. [PubMed] br>7 Chen LB. Mitochondrial membrane potential in living cells. Annu Rev Cell Biol. 1988;4:155-181. [PubMed] br>8 Heerdt BG, Houston MA, Augenlicht LH. The intrinsic mitochondrial membrane potential of colonic carcinoma cells is linked to the probability of tumor progression. Cancer Res. 2005;65(21):9861-9867. [PubMed] br>9 Han J, Flemington C, Houghton AB, et al. Expression of bbc3, a pro-apoptotic BH3-only gene, is regulated by diverse cell death and survival signals. Proc Natl Acad Sci U S A. 2001;98(20):11318-11323. [Artículo libre PMC] [PubMed] br>10 Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell. 2001;7(3):683-694. [PubMed] br>11 Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA induce la apoptosis rápida de células de cáncer colorrectal. Mol Cell. 2001;7(3):673-682. [PubMed] br>12 Willis SN, Adams JM. Life in the balance: how BH3-only proteins induce apoptosis. Curr Opin Cell Biol. 2005;17(6):617-625. [Artículo libre de PMC]. [Artículo libre PMC] [PubMed] br>13 Jeffers JR, Parganas E, Lee Y, et al. Puma is an essential mediator of p53-dependent and -independent apoptotic pathways. Cancer Cell. 2003;4(4):321-328. [PubMed] br>14 Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA media la respuesta apoptótica a p53 en células de cáncer colorrectal. Proc Natl Acad Sci U S A. 2003;100(4):1931-1936. [Artículo libre PMC] [PubMed] br>15 Abemayor E, Kovachich GB, Haugaard N. Effects of dichloroacetate on brain pyruvate dehydrogenase. J Neurochem. 1984;42(1):38-42. [PubMed] br>16 Lopaschuk GD, Saddik M. The relative contribution of glucose and fatty acids to ATP production in hearts reperfused following ischemia. Mol Cell Biochem. 1992;116(1–2):111–116. [PubMed] br>17 Stacpoole PW. The pharmacology of dichloroacetate. Metabolism. 1989;38(11):1124–1144. [PubMed] br>18 Wong A, Cortopassi GA. High-throughput measurement of mitochondrial membrane potential in a neural cell line using a fluorescence plate reader. Biochem Biophys Res Commun. 2002;298(5):750-754. [PubMed] br>19 Yan J, Jiang J, Lim CA, Wu Q, Ng HH, Chin KC. BLIMP1 regula el crecimiento celular mediante la represión de la transcripción de p53. Proc Natl Acad Sci U S A. 2007;104(6):1841-1846. [Artículo libre PMC] [PubMed] br>20 Bieche I, Parfait B, Tozlu S, Lidereau R, Vidaud M. Quantitation of androgen receptor gene expression in sporadic breast tumors by real-time RT-PCR: evidence that MYC is an AR-regulated gene. Carcinogenesis. 2001;22(9):1521–1526. [PubMed] br>21 Hassoun EA, Ray S. The induction of oxidative stress and cellular death by the drinking water disinfection by-products, dichloroacetate and trichloroacetate in J774.A1 cells. Comparative biochemistry and physiology Toxicology & pharmacology. 2003;135(2):119-128. [PubMed] br>22 Di Lisa F, Silverman HS, Hansford RG. Mitochondrial function and cell injury in single cardiac myocytes exposed to anoxia and reoxygenation. Transplant Proc. 1995;27(5):2829-2830. [PubMed] br>23 Piccoli C, Scrima R, Boffoli D, Capitanio N. Control by cytochrome c oxidase of the cellular oxidative phosphorylation system depends on the mitochondrial energy state. Biochem J. 2006;396(3):573-583. [Artículo libre PMC] [PubMed] br>24 Liang Y, O’Driscoll L, McDonnell S, et al. Aumento de la invasividad in vitro y de la resistencia a fármacos con patrones alterados de expresión génica en una línea celular de carcinoma de pulmón humano tras la selección por pulsos con fármacos anticancerígenos. Int J Cancer. 2004;111(4):484-493. [PubMed] br>25 Sillem M, Prifti S, Koumouridis A, et al. Invasiveness corresponds to differentiation rather than to proteinase secretion in endometrial cancer cell lines. Revista Europea de Oncología Ginecológica. 1999;20(5–6):367–370. [PubMed] br>26 Dohi T, Okada K, Xia F, et al. An IAP-IAP complex inhibits apoptosis. J Biol Chem. 2004;279(33):34087–34090. [PubMed] br>27 Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3(8):917-921. [PubMed] br>28 Erkanli S, Bolat F, Kayaselcuk F, Demirhan B, Kuscu E. COX-2 and survivin are overexpressed and positively correlated in endometrial carcinoma. Gynecol Oncol. 2007;104(2):320-325. [PubMed] br>29 Li F, Ambrosini G, Chu EY, et al. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396(6711):580–584. [PubMed] br>30 Rice LW, Stone RL, Xu M, et al. Biologic targets for therapeutic intervention in endometrioid endometrial adenocarcinoma and malignant mixed mullerian tumors. Am J Obstet Gynecol. 2006;194(4):1119-1126. discusión 26-28. [PubMed] br>31 Nagamani M, Stuart CA. Specific binding and growth-promoting activity of insulin in endometrial cancer cells in culture. Am J Obstet Gynecol. 1998;179(1):6-12. [PubMed] br>32 Zhao Y, Yamashita T, Ishikawa M. Regulation of tumor invasion by HOXB13 gene overexpressed in human endometrial cancer. Oncol Rep. 2005;13(4):721-726. [PubMed] br>33 Yaginuma Y, Westphal H. Analysis of the p53 gene in human uterine carcinoma cell lines. Cancer Res. 1991;51(24):6506-6509. [PubMed] br>34 Richardson GS, Dickersin GR, Atkins L, et al. KLE: a cell line with defective estrogen receptor derived from undifferentiated endometrial cancer. Gynecol Oncol. 1984;17(2):213-230. [PubMed] br>35 Carter CA, Parham GP. State of differentiation affects the response of endometrial adenocarcinoma cells to retinoic acid. Anticancer Research. 1997;17(3C):1973–1983. [PubMed] br>36 Yabushita H, Narumiya H, Hiratake K, et al. The association of transforming growth factor-beta 1 with myometrial invasion of endometrial carcinomas through effects on matrix metalloproteinase. J Obstet Gynaecol Res. 2000;26(3):163-170. [PubMed] br>37 Holinka CF, Hata H, Kuramoto H, et al. Respuestas al estradiol en una línea celular de adenocarcinoma endometrial humano (Ishikawa) Journal of Steroid Biochemistry. 1986;24(1):85-89. [PubMed] br>38 Way DL, Grosso DS, Davis JR, et al. Caracterización de un nuevo carcinoma endometrial humano (RL95-2) establecido en cultivo tisular. In Vitro. 1983;19(3 parte 1):147-158. [PubMed] br>39 Sundareshan P, Hendrix MJ. Growth, morphologic, and invasive characteristics of early and late passages of a human endometrial carcinoma cell line (RL95-2) In Vitro Cell Dev Biol. 1992;28A(7-8):544-552. [PubMed] br>40 Colombatti A, Russo P, Cervi M, et al. Differential Expression of IRS-1 and IRS-2 in Uterine Leiomyosarcomas with Distinct Oncogenic Phenotypes: Lack of Correlation with Downstream Signaling Events. Sarcoma. 2002;6(3):89-96. br>41 Kuramoto H, Tamura S, Notake Y. Establecimiento de una línea celular de adenocarcinoma endometrial humano in vitro. Am J Obstet Gynecol. 1972;114(8):1012–1019. br>42 Sieuwerts AM, Klijn JG, Foekens JA. Assessment of the invasive potential of human gynecological tumor cell lines with the in vitro Boyden chamber assay: influences of the ability of cells to migrate through the filter membrane. Clin Exp Metastasis. 1997;15(1):53-62.
Contenido relacionado: