Akbar Khan
Medizinischer Direktor, Medicor Cancer Centres Inc., Toronto, Kanada
Zusammenfassung
Das Plattenepithelkarzinom der Niere ist eine seltene Form von Nierenkrebs, die als unheilbar gilt, sobald sich Metastasen gebildet haben. Die Prognose ist schlecht, und die durchschnittliche Überlebenszeit im fortgeschrittenen Stadium liegt trotz aller verfügbaren konventionellen Therapien in der Regel bei einigen Monaten.
Wir beschreiben den Fall einer 72-jährigen Frau mit metastasiertem Plattenepithelkarzinom der Niere, bei der eine radikale Nephrektomie mit positiven Operationsrändern, Nierenveneninvasion und Metastasen in mehreren abdominalen Lymphknoten durchgeführt wurde. Sie erhielt eine palliative Strahlentherapie des Abdomens mit 4500cGy in 25 Fraktionen über 5 Wochen. Im Anschluss an die Strahlentherapie wurde sie mit einer zyklischen Behandlung mit oralem Natriumdichloracetat („DCA“) behandelt. Die Behandlung wurde nach 3 Monaten aufgrund der Entwicklung einer peripheren Neuropathie abgesetzt. Bei der Nachuntersuchung nach Abschluss der DCA-Behandlung wurden keine Anzeichen einer metastatischen Erkrankung festgestellt. Die Neuropathie besserte sich allmählich, und die Computertomographie zeigte vier Jahre später kein Wiederauftreten des Krebses. Die Patientin fühlt sich auch fünf Jahre nach Beendigung der Therapie ohne klinische Anzeichen eines Rezidivs gut und führt ein normales und aktives Leben.
Schlüsselworte: Dichloroacetat, Strahlentherapie, Plattenepithelkarzinom der Niere, Remission
Copyright © 2012 Akbar Khan. Dies ist ein frei zugänglicher Artikel, der unter der Creative Commons Attribution License unported 3.0 verbreitet wird, die die uneingeschränkte Nutzung, Verbreitung und Vervielfältigung in jedem Medium erlaubt, sofern die Originalarbeit ordnungsgemäß zitiert wird. Kontakt zum Autor: Akbar Khan E-Mail: [email protected]
EINLEITUNG
Das renale Plattenepithelkarzinom („RSCC“) ist eine seltene Form von Nierenkrebs, die vom Nierenbecken ausgeht. RSCC machen etwa 0,5 – 0,8 % aller bösartigen Nierentumoren aus (Bhaijee 2012). Obwohl eine Operation bei einer lokalisierten Erkrankung manchmal heilend wirkt, gilt das metastasierte Plattenepithelkarzinom der Niere („mRSCC“) als unheilbar (Holmang et al. 2007). In mehreren Veröffentlichungen von Ärzten mit Erfahrung in der Behandlung von RSCC wurde festgestellt, dass dieser Krebstyp strahlenresistent ist und dass eine systemische Chemotherapie wenig Nutzen bringt. (Bhandari et al. 2010), (Di Battista et al. 2012), (Kimura et al. 2000), (Li und Cheung 1987). Die durchschnittliche Überlebensrate im fortgeschrittenen Stadium der Erkrankung ist extrem schlecht (im Bereich von mehreren Monaten), und die Fünfjahresüberlebensrate wird mit weniger als 10 % angegeben (Holmang et al. 2007). In einer Untersuchung von 15 Fällen berichteten Lee et al. über ein medianes Überleben von 3,5 Monaten (Lee et al. 1998).
Es wurde eine Medline-Suche durchgeführt (Medline RSCC 2012), um festzustellen, ob Fälle von langfristiger kompletter Remission von mRSCC aufgezeichnet worden waren. Dabei wurden über 200 Zitate zu RSCC gefunden, aber nur ein veröffentlichter Fall einer fünfjährigen vollständigen Remission/Heilung (Carlson 1960). In diesem Fall wurde der Patient einer vollständigen Nephrourektomie unterzogen, einschließlich der Resektion von peri-renalem Fett und einer Blasenmanschette. Die Pathologie zeigte keine Beteiligung der Operationsränder, und es wurden keine Metastasen festgestellt.
Natriumdichloracetat („DCA“) ist ein Arzneimittel, das ausgiebig für die Behandlung der kongenitalen Laktatazidose untersucht wurde, die eine Gruppe von vererbten mitochondrialen Erkrankungen umfasst (Stacpoole et al. 2006), (Stacpoole et al. 1992), (Stacpoole et al. 1988). Das Sicherheitsprofil der Verwendung von DCA beim Menschen wurde durch diese Arbeiten ermittelt. Es hat sich als ein relativ sicheres Medikament erwiesen, das keine hämatologische, kardiale, pulmonale oder renale Toxizität aufweist. Die Haupttoxizität ist neurologischer Natur (hauptsächlich periphere Neuropathie), die reversibel ist (Kaufmann et al. 2006). Es wurde ein DCA-induziertes Delirium beobachtet, das nach Absetzen des Medikaments ebenfalls reversibel ist (Brandsma et al. 2010). Bei einem kleinen Prozentsatz der Patienten kann eine geringfügige reversible Erhöhung der Leberenzyme auftreten (Stacpoole et al. 2008).
Im Januar 2007 wurde eine bahnbrechende Arbeit veröffentlicht, in der nachgewiesen wurde, dass DCA bei der Behandlung von menschlichem Brust-, Lungen- und Gehirnkrebs in vitro und in vivo (Ratten) über neue Stoffwechselwege wirksam ist (Bonnet et al. 2007). Es wurde gezeigt, dass DCA die mitochondriale Pyruvatdehydrogenase-Kinase hemmt, was zu einer Hemmung der aeroben Glykolyse führt, dem üblichen Weg der Energiegewinnung in menschlichen Krebszellen (bekannt als Warburg-Effekt). Da Krebszellen in der Regel nicht in der Lage sind, auf Glukoseoxidation umzuschalten, wenn die Glykolyse gehemmt ist, wird den mit DCA behandelten Zellen die ATP-Energieversorgung entzogen (Xu et al. 2005). Es wurde auch nachgewiesen, dass DCA in Krebszellen selektiv Apoptose auslöst, und zwar durch eine Verringerung des Membranpotenzials hyperpolarisierter Mitochondrien und durch Aktivierung der spannungsgesteuerten Kaliumkanäle Kv1.5 (Bonnet et al. 2007).
Seit 2007 wurde die DCA-Forschung fortgesetzt, und es wurde gezeigt, dass DCA in vitro gegen mehrere menschliche Krebszelllinien wirksam ist, darunter Eierstockkrebs (Saed et al. 2011), Neuroblastom (Vella et al. 2012), Dickdarmkrebs (Tong et al. 2011), Lungenkarzinom (Fiebiger et al. 2011), Gebärmutterhalskrebs (Xie et al. 2011) und Gebärmutterschleimhautkrebs (Wong et al. 2008). Ein Synergismus mit der Strahlentherapie wurde auch bei Zelllinien von Prostatakrebs nachgewiesen (Cao et al. 2008). Ein von Cao et al. vorgeschlagener Mechanismus für den Synergismus ist eine erhöhte Expression des BCL-2-assoziierten X-Proteins (ein pro-apoptotisches intrazelluläres Protein), was zu einer erhöhten Apoptoserate führt. DCA hat sich beim Menschen auch in vivo als wirksam gegen Glioblastome erwiesen (Michelakis et al. 2010).
Der Autor begann 2007 mit der Off-Label“-Therapie mit DCA zur Behandlung von Krebspatienten, die eine schlechte Prognose hatten oder auf herkömmliche Krebstherapien nicht angesprochen hatten. Die Beobachtung der mit DCA behandelten Patienten ergab, dass eine beträchtliche Anzahl von ihnen von der Anwendung dieses Medikaments zu profitieren schien, sei es durch subjektive Kriterien wie Schmerzlinderung oder objektive Kriterien wie die Schrumpfung des Tumors (Medicor DCA Data 2009).
Falldarstellung
Eine 72 Jahre alte Frau stellte sich zunächst bei ihrem Hausarzt mit Schmerzen in der rechten Hüfte, Hämaturie und Gewichtsverlust vor. Per Ultraschall wurde eine Masse in der rechten Niere diagnostiziert. Es wurde eine Computertomographie („CT“) durchgeführt, die einen Tumor zeigte, der das rechte Nierenbecken, den oberen und unteren Nierenpol sowie den proximalen rechten Harnleiter befallen hatte (Abbildung 1). Im Bauchraum befanden sich mehrere vergrößerte Lymphknoten (Abbildung 2). Es wurde ein Knochenscan durchgeführt, der keine Knochenmetastasen ergab.
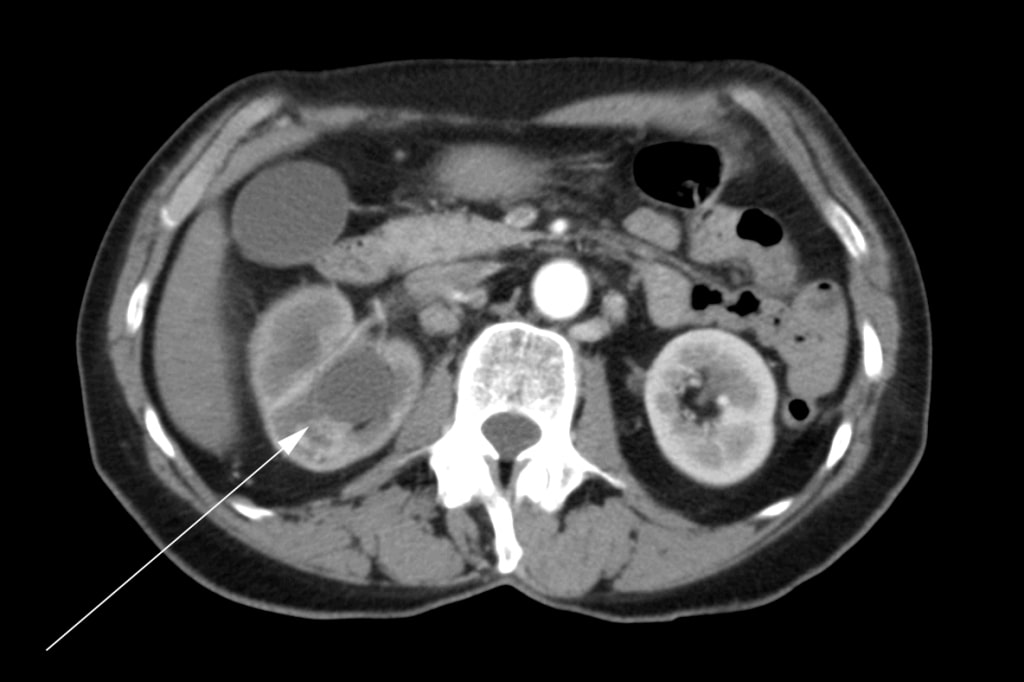
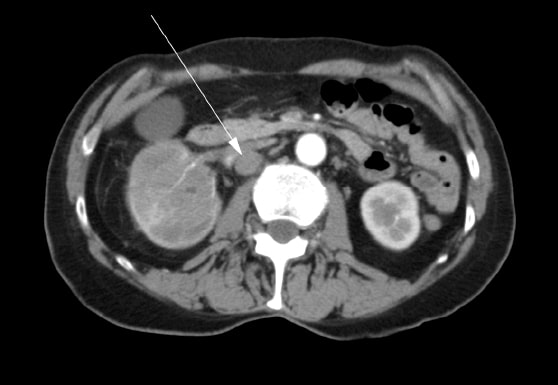
Der Patient unterzog sich im Mai 2007 einer rechtsradikalen Nephrektomie. Im Operationsbericht wurde vermerkt, dass eine vollständige Exzision nicht möglich war. Die Nierenvene war betroffen und konnte nicht vollständig vom Tumor befreit werden. Mehrere pathologische Lymphknoten, die sich die Hohlvene hinaufzogen, wurden zum Zeitpunkt der Operation sichtbar gemacht, aber nicht entfernt. Es wurde eine intraoperative Biopsie eines der Lymphknoten durchgeführt. Die abschließende Histopathologie bestätigte die Diagnose eines Plattenepithelkarzinoms der Niere mit positiven Operationsrändern und Lymphknotenmetastasen. Postoperativ wurde die Patientin zu einer strahlenonkologischen Beratung überwiesen. Von August bis September 2007 erhielt sie eine externe Strahlentherapie mit palliativer Absicht im para-aortalen Bereich des Abdomens mit 4500cGy in 25 Fraktionen über 5 Wochen. Die medizinische Onkologie wurde konsultiert, und ihr wurde keine Chemotherapie angeboten.
Die Patientin erfuhr aus den lokalen Medien von der DCA-Krebsforschung und beschloss, angesichts ihrer schlechten Prognose die Option der DCA-Behandlung als fortlaufende Behandlung zu prüfen. Sie suchte die Klinik des Autors auf, um sich zur DCA-Therapie beraten zu lassen.
Beim ersten Besuch in der Klinik wurde ihre komplette Anamnese erhoben. Die Untersuchung ergab eine gesund aussehende Frau mit normalen Vitalwerten und ohne besondere körperliche Auffälligkeiten. Die ersten Blutuntersuchungen waren im Allgemeinen gut. Die einzigen Auffälligkeiten waren ein leicht erhöhter Harnstoffwert von 7,4 (normal 3,0 – 7,1 mmol/L) und eine niedrige Lymphozytenzahl von 0,6 (normal 1,2 – 3,4 x109/L). Dies war nicht besorgniserregend, da eine leichte Erhöhung von Harnstoff oder Kreatinin bei einem Patienten nach einer Nierenentfernung zu erwarten war.
DCA-Behandlung
Die Risiken und Vorteile von DCA wurden besprochen, und der Patient stimmte einer DCA-Behandlung zu, die innerhalb von drei Wochen nach der letzten Fraktion der palliativen Strahlentherapie eingeleitet wurde. Die Patientin wurde mit DCA 500 mg oral zweimal täglich (18 mg/kg/Tag) in einem Zyklus von 2 Wochen an / 1 Woche aus begonnen. Die zyklische Behandlung wurde gewählt, da der Autor bei erwachsenen Patienten mit einer kontinuierlichen DCA-Dosierung ein inakzeptables Maß an Nebenwirkungen festgestellt hatte. Um das Risiko einer DCA-Neuropathie zu verringern, wurden ihr Benfotiamin (eine fettlösliche Form von Vitamin B1) in einer Dosierung von 80 mg zweimal täglich und R-Alpha-Liponsäure in einer Dosierung von 150 mg dreimal täglich oral verordnet, da diese beiden natürlichen Substanzen nachweislich bei der Behandlung von Neuropathien anderer Ursachen helfen (Ziegler et al. 1999), (Winkler et al. 1999). Außerdem wurde sie einmal täglich mit Pantoprazol 40 mg oral behandelt, um Magenverstimmungen durch DCA zu vermeiden. Nach dem ersten dreiwöchigen Zyklus wurde die DCA-Dosis auf 500 mg oral dreimal täglich (27 mg/kg/Tag) erhöht. Die Dosis wurde schrittweise erhöht, um die Verträglichkeit zu gewährleisten, da der Stoffwechsel von DCA mit zunehmendem Alter der Patienten abnimmt (Shroads et al. 2008).
Die Patientin fühlte sich im ersten Monat der DCA-Behandlung im Allgemeinen gut, abgesehen von leichter Müdigkeit, die auch eine Nebenwirkung der Strahlentherapie gewesen sein könnte. Auch mit der erhöhten DCA-Dosis nach 3 Wochen traten im zweiten Monat der Therapie keine Probleme auf. DCA wurde gegen Ende des dritten Monats abgesetzt, da neue Symptome auftraten, die auf eine periphere Neuropathie hindeuteten.
Zum Zeitpunkt des Absetzens von DCA wurde bei der Patientin eine dreiphasige CT-Untersuchung durchgeführt, die keine Anzeichen von Restkrebs zeigte. Nach weiteren 6 Monaten wurde die Patientin erneut einem CT-Scan unterzogen, der wiederum keine Anzeichen von Krebs zeigte (Abbildung 3).
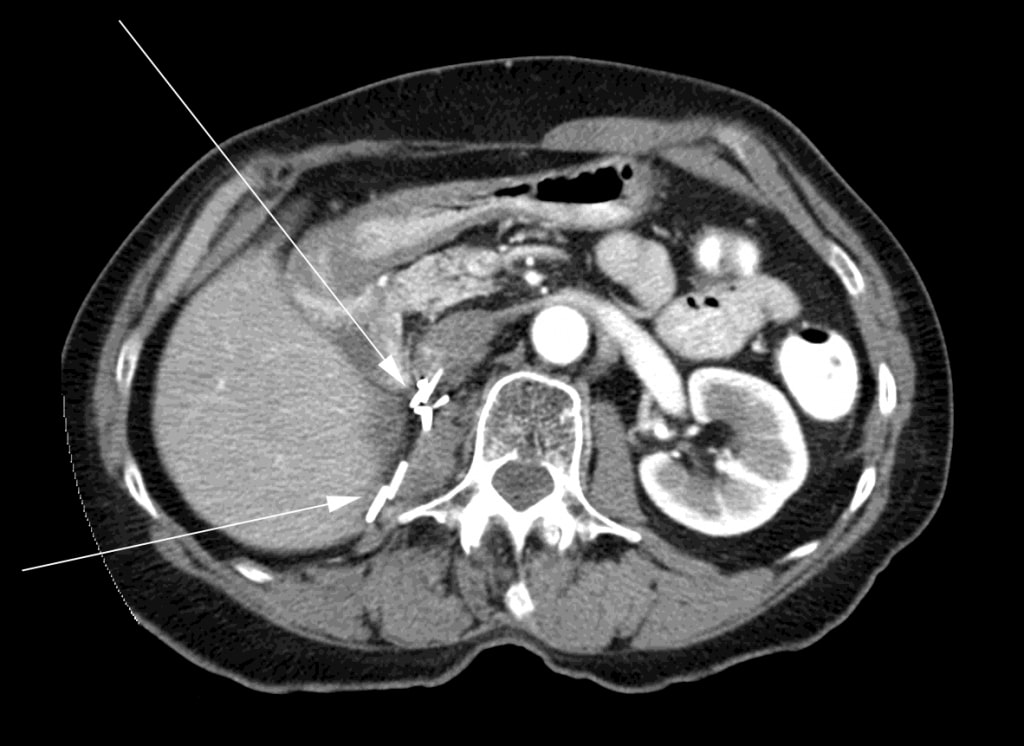
Die Patientin wurde weiterhin regelmäßig in der onkologischen Klinik ihres örtlichen Krankenhauses mit Routine-CT-Scans etwa alle 6 Monate überwacht. Die letzte CT-Untersuchung im Oktober 2011 zeigte keine Anzeichen eines mRSCC-Rezidivs. Eine Nachuntersuchung durch den Strahlenonkologen im Dezember 2011 bestätigte, dass kein Rezidiv aufgetreten war. Die körperliche Untersuchung war normal und ihr Leistungsstatus lag bei ECOG-Stufe 0. Im September 2011 waren vier Jahre seit der Strahlentherapie und dem Beginn der DCA-Behandlung vergangen, und im Dezember 2011 waren vier Jahre seit Abschluss der dreimonatigen DCA-Therapie vergangen. Im September 2012, 5 Jahre nach Beginn der DCA-Therapie, ist die Patientin weiterhin symptomfrei. In dieser Zeit erhielt sie keine weitere Krebsbehandlung (einschließlich DCA), da es nie Anzeichen für ein Wiederauftreten der Krankheit gab.
Diskussion
Wir glauben, dass dies der erste veröffentlichte Fall einer langfristigen vollständigen Remission (und wahrscheinlichen Heilung) eines mRSCC ist. In der Medline-indizierten Literatur aus den letzten 50 Jahren gibt es nur einen vergleichbaren Fall einer 5-Jahres-Vollremission von RSCC, allerdings hatte dieser Patient keine metastatische Erkrankung. Unser Fall verdient besondere Aufmerksamkeit, da mRSCC sehr aggressiv ist und die mediane Überlebenszeit mit allen verfügbaren konventionellen Therapien im Bereich von einigen Monaten liegt.
Die Strahlentherapie allein bietet nur einen geringen Überlebensvorteil für mRSCC (Holmang et al. 2007). Die verlängerte 5-wöchige Behandlungszeit der palliativen Strahlentherapie verringert in diesem Fall die Heilungschancen (die aufgrund des Krebstyps von vornherein unwahrscheinlich sind) noch weiter, da die Zellabtötung durch einen Prozess namens „beschleunigte Repopulation“ verringert wird. Unter Repopulation versteht man die Fähigkeit von Zellen in einem Gewebe, sich nach einer Strahlendosis zu erneuern. Die Wiederbesiedlung nimmt zu, wenn sich die Gesamtbehandlungszeit für die Verabreichung einer Strahlendosis während einer fraktionierten Strahlentherapie verlängert. Dieser Effekt verringert die Schädigung des gesunden Gewebes, aber auch die Abtötung von Krebszellen – was dem Ziel der Palliation entspricht. Die Wiederbesiedlung ist bei einer Gesamtbestrahlungsdauer von 4-6 Wochen und darüber hinaus am stärksten ausgeprägt, und diese Patientin erhielt ihre fraktionierte Strahlentherapie über 5 Wochen (Abeloff May 21, 2008) .
Wie bereits erwähnt, hat DCA einen Synergismus mit der Strahlentherapie bei Prostatakrebs. Die Erfahrungen des Autors bei der Behandlung von Patienten mit DCA deuten darauf hin, dass der Synergismus mit der Strahlentherapie bei verschiedenen anderen Krebsarten als Prostatakrebs auftreten kann. Beispiele hierfür sind: eine 53-jährige Frau mit einer dreijährigen vollständigen Remission eines Bartholin-Drüsenkarzinoms, das mit Bestrahlung und adjuvantem DCA behandelt wurde, und eine 32-jährige Frau mit einer dreijährigen vollständigen Remission eines anaplastischen Astrozytoms nach Chemobestrahlung mit adjuvantem DCA (die Fälle werden zur Veröffentlichung vorbereitet).
In diesem Fall von mRSCC führte der adjuvante Einsatz von DCA im Anschluss an eine Strahlentherapie zu einer überraschenden vollständigen Remission, die abgesehen von einer reversiblen peripheren Neuropathie keine schädlichen Nebenwirkungen aufwies. Bei diesem Patienten konnte die prophylaktische Gabe von Benfotiamin und R-Alpha-Liponsäure die Entwicklung einer peripheren Neuropathie durch DCA nicht verhindern. Der Autor fügt nun Acetyl-Lcarnitin in das Präventionsprogramm für DCA-Neuropathie ein, da es auch bei der Behandlung von Neuropathie anderer Ätiologien, wie diabetischer, chemoinduzierter und antiretroviral induzierter Neuropathie, nachweislich von Nutzen ist (Herzmann et al. 2005), (Quatraro et al. 1995), (De Grandis und Minardi 2002), (Bianchi et al. 2005).
Derzeit gibt es keine aktiven klinischen Studien, die die Rolle von DCA in Kombination mit einer alleinigen Strahlentherapie untersuchen. Eine Studie untersucht derzeit DCA in Kombination mit Chemotherapie und Bestrahlung bei Kopf-Hals-Karzinomen (Clinicaltrials.gov 2012). Da DCA nicht urheberrechtlich geschützt ist, war es für Forscher schwierig, Mittel für die Durchführung teurer Studien am Menschen aufzubringen. Wir hoffen, dass die Veröffentlichung eindeutiger Fälle, die den Nutzen von DCA als Ergänzung zu herkömmlichen Krebstherapien veranschaulichen, Forscher dazu motivieren wird, kreative neue Finanzierungsmechanismen zu finden, damit DCA in weiteren Humanstudien formell untersucht werden kann. Wir hoffen, dass DCA auf diese Weise in der Onkologie eine breitere Akzeptanz findet und zum Nutzen von Patienten mit unheilbaren bösartigen Erkrankungen eingesetzt wird.
Da der Abschluss klinischer Studien am Menschen viele Jahre dauern kann, halten wir es in der Zwischenzeit für ethisch vertretbar, DCA in Kombination mit oder im Anschluss an eine palliative Strahlentherapie für Patienten, die die Risiken und den Nutzen vollständig verstehen und akzeptieren, vorsichtig zu verschreiben. DCA könnte eine weitere Rolle als neuartiger therapeutischer Ansatz in Kombination mit einer Strahlentherapie für strahlenresistente, nicht metastasierende Krebserkrankungen spielen, aber das muss noch geklärt werden.
Danksagung
Die Autorin dankt Dr. Humaira Khan und Dr. Isaac Eliaz für ihre Unterstützung bei der Erstellung dieses Fallberichts sowie der Patientin für ihr Einverständnis, ihren Fall zu veröffentlichen.
Offenlegungserklärung des Autors
Der Autor verschreibt Krebsbehandlungsmedikamente (einschließlich Dichloracetat), die von Medicor Cancer Centres gegen eine Gebühr zur Verfügung gestellt werden. Diese Klinik ist im Besitz eines Familienmitglieds des Autors.
REFERENZEN
1 Abeloff, M. D., Armitage, J. O., Niederhuber, J. E., Kastan, M. B. & McKenna, W. G. (Mai 21, 2008). Abeloff’s Clinical Oncology, 4. Auflage, Kapitel: Biologische Auswirkungen von Strahlung.2 Bhaijee, F. (2012). „Plattenepithelkarzinom des Nierenbeckens“, Ann Diagn Pathol, 16(2), 124-7.
3 Bhandari, A., Alassi, O., Rogers, C. & MacLennan, G. T. (2010). „Plattenepithelkarzinom des Nierenbeckens“, J Urol, 183(5), 2023-4.
4 Bianchi, G., Vitali, G., Caraceni, A., Ravaglia, S., Capri, G., Cundari, S., Zanna, C. & Gianni, L. (2005). „Symptomatische und neurophysiologische Reaktionen von Paclitaxel- oder Cisplatin-induzierter Neuropathie auf orales Acetyl-L-Carnitin“, Eur J Cancer, 41(12), 1746-50.
5 Bonnet, S., Archer, S. L., Allalunis-Turner, J., Haromy, A., Beaulieu, C., Thompson, R., Lee, C. T., Lopaschuk, G. D., Puttagunta, L., Bonnet, S., Harry, G., Hashimoto, K., Porter, C. J., Andrade, M. A., Thebaud, B. & Michelakis, E. D. (2007). „A Mitochondria- K+ Channel Axis Is Suppressed in Cancer and Its Normalization Promotes Apoptosis and Inhibits Cancer Growth,“ Cancer Cell, 11(1), 37-51.
6 Brandsma, D., Dorlo, T. P. C., Haanen, J. H., Beijnen, J. H. & Boogerd, W. (2010). „Schwere Enzephalopathie und Polyneuropathie induziert durch Dichloracetat“, J Neurol, 257(12), 2099-100.
7 Cao, W., Yacoub, S., Shiverick, K. T., Namiki, K., Sakai, Y., Porvasnik, S., Urbanek, C. & Rosser, C. J. (2008). „Dichloracetat (DCA) sensibilisiert sowohl Wildtyp- als auch überexprimierende Bcl-2-Prostatakrebszellen in vitro für Strahlung,“ Prostate, 68(11), 1223- 31.
8 Carlson, H. E. (1960). „Plattenepithelkarzinom des Nierenbeckens: Eine fünfjährige Heilung“, J Urol, 83, 813-4.
9 Clinicaltrials.Gov (2012). [Online], Verfügbar: http://clinicaltrials.gov/ct2/results?term= dichloroacetate+radiotherapy [Zugriff am 1. September 2012].
10 De Grandis, D. & Minardi, C. (2002). „Acetyl-L-Carnitin (Levacecarnin) in der Behandlung der diabetischen Neuropathie. A LongTerm, Randomised, Double-Blind, PlaceboControlled Study,“ Drugs R D, 3(4), 223-31.
11 Di Battista, L., Stio, F., Guarino, S., Galani, A., Maturo, A., Dimko, M., Mancini, M. & Gallo, P. (2012). „Plattenepithelkarzinom des Nierenbeckens mit Steinen und Infiltration der Vena Cava Inferior. Case Report,“ G Chir, 33(5), 182-5.
12 Fiebiger, W., Olszewski, U., Ulsperger, E., Geissler, K. & Hamilton, G. (2011). „In Vitro Cytotoxicity of Novel Platinum-Based Drugs and Dichloroacetate against Lung Carcinoid Cell Lines“, Clin Transl Oncol, 13(1), 43-9.
13 Herzmann, C., Johnson, M. A. & Youle, M. (2005). „Langfristige Wirkung von Acetyl-LCarnitin bei antiretroviraler toxischer Neuropathie“, HIV Clin Trials, 6(6), 344-50.
14 Holmang, S., Lele, S. M. & Johansson, S. L. (2007). „Plattenepithelkarzinom des Nierenbeckens und des Harnleiters: Incidence, Symptoms, Treatment and Outcome“, J Urol, 178(1), 51-6.
15 Kaufmann, P., Engelstad, K., Wei, Y., Jhung, S., Sano, M. C., Shungu, D. C., Millar, W. S., Hong, X., Gooch, C. L., Mao, X., Pascual, J. M., Hirano, M., Stacpoole, P. W., Dimauro, S. & De Vivo, D. C. (2006). „Dichloracetat verursacht toxische Neuropathie bei MELAS: Eine randomisierte, kontrollierte klinische Studie“, Neurology, 66(3), 324-30.
16 Kimura, T., Kiyota, H., Asano, K., Madarame, J., Yoshino, Y., Miki, K., Abe, K., Hasegawa, T. & Ohishi, Y. (2000). „Plattenepithelkarzinom des Nierenbeckens mit Ausdehnung in die untere Hohlvene“, Int J Urol, 7(8), 316- 9; Diskussion 320.
17 Lee, T. Y., Ko, S. F., Wan, Y. L., Cheng, Y. F., Yang, B. Y., Huang, D. L., Hsieh, H. H., Yu, T. J. & Chen, W. J. (1998). „Nieren-Plattenepithelkarzinom: CT-Befunde und klinische Bedeutung“, Abdom Imaging, 23(2), 203-8.
18 Li, M. K. & Cheung, W. L. (1987). „Plattenepithelkarzinom des Nierenbeckens“, J Urol, 138(2), 269-71.
19 Medicor (DCA Data 2009) [online], Verfügbar: www.medicorcancer.com/DCAdata.html [Zugriff am 1. Oktober 2012]. Medline (RSCC 2012) [online], Available: http://www.ncbi.nlm.nih.gov/pubmed, Search Criteria: Renal [title] oR kidney [Title] and („Squamous Cell Carcinoma“[Title]) [Accessed Oct 1, 2012].
20 Michelakis, E. D., Sutendra, G., Dromparis, P., Webster, L., Haromy, A., Niven, E., Maguire, C., Gammer, T. L., Mackey, J. R., Fulton, D., Abdulkarim, B., McMurtry, M. S. & Petruk, K. C. (2010). „Metabolische Modulation von Glioblastomen mit Dichloracetat“, Sci Transl Med, 2(31), 31ra34.
21 Quatraro, A., Roca, P., Donzella, C., Acampora, R., Marfella, R. & Giugliano, D. (1995). „Acetyl-L-Carnitin bei symptomatischer diabetischer Neuropathie“, Diabetologia, 38(1), 123.
22 Saed, G. M., Fletcher, N. M., Jiang, Z. L., AbuSoud, H. M. & Diamond, M. P. (2011). „Dichloracetat induziert Apoptose von epithelialen Eierstockkrebszellen durch einen Mechanismus, der die Modulation von oxidativem Stress einbezieht“, Reprod Sci, 18(12), 1253- 61.
23 Shroads, A. L., Guo, X., Dixit, V., Liu, H. P., James, M. O. & Stacpoole, P. W. (2008). „Altersabhängige Kinetik und Metabolismus von Dichloracetat: Possible Relevance to Toxicity“, J Pharmacol Exp Ther, 324(3), 1163-71.
24 Stacpoole, P. W., Gilbert, L. R., Neiberger, R. E., Carney, P. R., Valenstein, E., Theriaque, D. W. & Shuster, J. J. (2008). „Bewertung der Langzeitbehandlung von Kindern mit kongenitaler Laktatazidose mit Dichloracetat“, Pediatrics, 121(5), E1223-8.
25 Stacpoole, P. W., Kerr, D. S., Barnes, C., Bunch, S. T., Carney, P. R., Fennell, E. M., Felitsyn, N. M., Gilmore, R. L., Greer, M., Henderson, G. N., Hutson, A. D., Neiberger, R. E., O’Brien, R. G., Perkins, L. A., Quisling, R. G., Shroads, A. L., Shuster, J. J., Silverstein, J. H., Theriaque, D. W. & Valenstein, E. (2006). „Kontrollierter klinischer Versuch mit Dichloracetat zur Behandlung der kongenitalen Laktatazidose bei Kindern“, Pediatrics, 117(5), 1519-31.
26 Stacpoole, P. W., Lorenz, A. C., Thomas, R. G. & Harman, E. M. (1988). „Dichloracetat in der Behandlung der Milchsäurevergiftung“, Ann Intern Med, 108(1), 58-63.
27 Stacpoole, P. W., Wright, E. C., Baumgartner, T. G., Bersin, R. M., Buchalter, S., Curry, S. H., Duncan, C. A., Harman, E. M., Henderson, G. N., Jenkinson, S. & Et Al. (1992). „A Controlled Clinical Trial of Dichloroacetate for Treatment of Lactic Acidosis in Adults. The Dichloroacetate-Lactic Acidosis Study Group,“ N Engl J Med, 327(22), 1564-9.
28 Tong, J., Xie, G., He, J., Li, J., Pan, F. & Liang, H. (2011). „Synergistic Antitumor Effect of Dichloroacetate in Combination with 5- Fluorouracil in Colorectal Cancer“, J Biomed Biotechnol, 2011, 740564.
29 Vella, S., Conti, M., Tasso, R., Cancedda, R. & Pagano, A. (2012). „Dichloroacetate Inhibits Neuroblastoma Growth by Specifically Acting Against Malignant Undifferentiated Cells“, Int J Cancer, 130(7), 1484-93.
30 Winkler, G., Pal, B., Nagybeganyi, E., Ory, I., Porochnavec, M. & Kempler, P. (1999). „Wirksamkeit verschiedener Benfotiamin-Dosierungen bei der Behandlung der schmerzhaften diabetischen Neuropathie“, Arzneimittelforschung, 49(3), 220-4.
31 Wong, J. Y. Y., Huggins, G. S., Debidda, M., Munshi, N. C. & De Vivo, I. (2008). „Dichloracetat induziert Apoptose in Endometriumkrebszellen“, Gynecol Oncol, 109(3), 394-402.
32 Xie, J., Wang, B. S., Yu, D. H., Lu, Q., Ma, J., Qi, H., Fang, C. & Chen, H. Z. (2011). „Dichloracetat verschiebt den Stoffwechsel von der Glykolyse zur Glukoseoxidation und zeigt eine synergistische Wachstumshemmung mit Cisplatin in Hela-Zellen“, Int J Oncol, 38(2), 409-17.
33 Xu, R. H., Pelicano, H., Zhou, Y., Carew, J. S., Feng, L., Bhalla, K. N., Keating, M. J. & Huang, P. (2005). „Hemmung der Glykolyse in Krebszellen: A Novel Strategy to Overcome Drug Resistance Associated with Mitochondrial Respiratory Defect and Hypoxia,“ Cancer Res, 65(2), 613-21.
34 Ziegler, D., Hanefeld, M., Ruhnau, K. J., Hasche, H., Lobisch, M., Schutte, K., Kerum, G. & Malessa, R. (1999). „Behandlung der symptomatischen diabetischen Polyneuropathie mit dem Antioxidans Alpha-Liponsäure: Eine 7-monatige multizentrische, randomisierte, kontrollierte Studie (ALADIN III-Studie). ALADIN-III-Studiengruppe. Alpha-Liponsäure bei diabetischer Neuropathie“, Diabetes Care, 22(8), 1296-301.