Stephen B. Strum & Örn Adalsteinsson & Richard R. Black & Dmitri Segal & Nancy L. Peress & James Waldenfels
S. B. StrumInternational
Strategic Cancer Alliance, 538 Granite Street, Ashland, OR 97520, USAe-mail
:
[email protected]. B. StrumAmerikanische
Gesellschaft für klinische Onkologie, 538 Granite Street, Ashland, OR 97520, USAS
. B. StrumAmerican
Urological Association, 538 Granite Street, Ashland, OR 97520, USAÖ
. AdalsteinssonInternational
Strategic Cancer Alliance, 873 E. Baltimore Pike #333, Kennett Square, PA 19348, USAe-mail
:
[email protected]. R. BlackNuclear
Medicine and PET Imaging, Radisphere Teleradiology Group, Beachwood, OH 44022, USA
e-mail
:
[email protected]. SegalValley
Radiology Consultants, Poway, CA 92064, USA
e-mail
:
[email protected]. L. PeressLife
Extension Foundation, 5760 S. Scenic Drive, Sault Sainte Marie, MI 49783
, USAe-mail
:
[email protected]. WaldenfelsLife
Extension Foundation, 9114 Steeplebush Court, Annandale, VA 22003-4051, USA
e-mail:
[email protected]
Schlüsselwörter: Dichloroacetat . DCA . Non-Hodgkin-Lymphom . NHL . PET . PET/CT . Glykolyse . Metabolomik . Warburg
Abkürzungen:
DCA (Dichloracetat
)NHL (Non-Hodgkin-Lymphom)
PET (Positronen-Emissions-Tomographie)
CT (Computertomographie)
FDG (Fluordesoxyglucose)
SUV (standardisierter Aufnahmewert)
mg (Milligramm)
kg (Kilogramm)
R-CHOP (Rituximab-Cytoxan,
Hydroxydaunomycin, Oncovin, Prednison)
Received: 27. Oktober 2012
Akzeptiert: 23. November 2012Springer
Science+Business Media New York 2012
Abstract
Die Aufnahme von Fluordesoxyglucose-Positronen-Emissions-Tomographie in den Tumoren verschiedener Krebsarten zeigt die Schlüsselrolle von Glucose bei der Proliferation von Krebs. Dichloracetat ist ein 2-Kohlenstoff-Molekül mit entscheidender biologischer Aktivität bei der Veränderung des metabolischen Abbaus von Glukose zu Milchsäure. Studien an menschlichen Zelllinien zeigen, dass Dichloracetat den Metabolismus der Krebszelle von der Glykolyse auf die oxidative Phosphorylierung umstellt und damit die Mitochondrienfunktionen wiederherstellt, die die Apoptose der Krebszelle auslösen. Berichte über Dichloracetat beim Menschen sind selten. Die Autoren nahmen Kontakt zu Personen aus Internetforen auf, die über herausragende Reaktionen auf die Selbstmedikation mit Dichloracetat berichtet hatten. Mit informierter Zustimmung wurden vollständige Krankenakten angefordert, um das Ansprechen auf Dichloracetat zu dokumentieren, wobei der Kontext der Monotherapie mit Dichloracetat betont wurde. Von zehn Patienten, die einer solchen Bewertung zustimmten, erfüllte nur ein Patient die Kriterien, da er neben einer Monotherapie mit Dichloracetat über umfassende Klinikunterlagen sowie Pathologie-, Bildgebungs- und Laborberichte verfügte. Dieser Patient steht im Mittelpunkt des vorliegenden Berichts. In diesem Fallbericht über einen Mann mit einem dokumentierten Rückfall nach einer modernen Chemotherapie für das Non-Hodgkin-Lymphom wird ein signifikantes Ansprechen auf Dichloracetat mit einer kompletten Remission dokumentiert, die auch nach 4 Jahren noch anhält. Dichloracetat scheint eine neuartige Therapie zu sein, die weitere Untersuchungen in der Krebsbehandlung rechtfertigt.
Hintergrund
Das metabolische Profil bösartiger Erkrankungen wurde als eines charakterisiert, das mit metabolischen Anpassungen verbunden ist, die darauf abzielen, bevorzugt die an der Glykolyse beteiligten Stoffwechselwege zu nutzen (Warburg et al. 1927), was in der neueren Literatur als glykolytischer Phänotyp von Krebs bezeichnet wird. (Bui und Thompson 2006; Fang et al. 2008; Gatenby und Gawlinski 2003) Im Wesentlichen handelt es sich bei diesem glykolytischen Phänotyp um eine darwinistische Anpassung, bei der die Krebszelle die Stoffwechselwege der Glukoseoxidation, die von normalen Zellen zur Energiegewinnung und auch zur Beseitigung von Tumorzellen genutzt werden, verringert und untergräbt (Fang et al. 2008). Eine entscheidende normale Zellfunktion, die im Kampf gegen Krebs beeinträchtigt wird, ist der programmierte Zelltod in den Mitochondrien (Apoptose). Auf der Grundlage der oben genannten Beobachtungen befinden sich derzeit Wirkstoffe in der klinischen Erprobung, die auf den Tumorstoffwechsel und insbesondere auf die mitochondrialen ATP-produzierenden Wege abzielen. Dichloracetat (DCA) wurde in den letzten 30 Jahren zur Behandlung der kongenitalen Laktatazidose eingesetzt – einer seltenen Stoffwechselerkrankung, die vor allem bei Kindern und jungen Erwachsenen auftritt. (Berendzen et al. 2006; Kuroda et al. 1986; Stacpoole et al. 1997, 2008, 2006). Die angeborene Laktatazidose wird mit verschiedenen angeborenen Fehlern der mitochondrialen Dysfunktion in Verbindung gebracht, und fast tausend von Fachleuten begutachtete medizinische Veröffentlichungen befassen sich mit dem klinischen Einsatz von DCA bei dieser Störung. Darüber hinaus wurden zahlreiche weitere Artikel zu verschiedenen Aspekten der Pharmakologie, der metabolischen Wirkungen und der Toxikologie von DCA veröffentlicht, aber nur etwa ein Dutzend Arbeiten über DCA beziehen sich auf seine Anti-Krebs-Aktivität (Bonnet et al. 2007; Bui und Thompson 2006; Cao et al. 2008; Chen et al. 2007; Christofk et al. 2008; Madhok et al. 2010; Michelakis et al. 2010, 2008; Vander Heiden 2010; Wong et al. 2008), wobei sich viele von ihnen auf die Bewertung von DCA in Tumorzelllinien oder in nicht-menschlichen Tiermodellen beschränken (Cao et al. 2008; Madhok et al. 2010; Wong et al. 2008; Sun et al. 2010). Lediglich die Veröffentlichung von Michelakis et al. (2010) bewertete DCA bei fünf menschlichen Patienten mit Glioblastoma multiforme und präsentierte einige klinische Hinweise auf ein Ansprechen auf DCA.
DCA hat sich in vitro als wirksames Anti-Krebsmittel erwiesen und in vivo beim menschlichen Glioblastoma multiforme eine Rückbildung bewirkt (Michelakis et al. 2010). Dies ist jedoch der erste Bericht über einen Krebspatienten, der sich einer Monotherapie mit DCA unterzog und nach einer hochmodernen Chemotherapie mit Rituximab-CHOP eine komplette Remission erreichte.
Methoden
Patientenpopulation
Die Autoren SS und OA haben alle Personen angeschrieben, die in Internetforen über positive Reaktionen auf DCA berichtet hatten, und sie gefragt, ob sie bereit wären, ihre vollständigen medizinischen Daten für eine detaillierte Analyse kostenlos zur Verfügung zu stellen. Die Betroffenen wurden darüber informiert, dass der Zweck der Studie darin bestand, festzustellen, ob die Monotherapie mit DCA als aktive Krebstherapie bestätigt werden konnte.
Medizinisch-rechtliche Fragen
Von der Person, die Gegenstand dieses Fallberichts ist, wurde eine schriftliche Einverständniserklärung zur Verwendung detaillierter medizinischer Daten sowie radiologischer Bilder eingeholt. Eine Kopie der schriftlichen Zustimmung liegt dem Herausgeber dieser Zeitschrift zur Einsichtnahme vor.
Ausschlusskriterien für Patienten
Es wurden Kopien aller Konsultationen und Arztbesuche, Pathologieberichte, Bildgebungs- und Laboruntersuchungen, chirurgische Berichte, Daten zur Strahlentherapie und Einzelheiten zur Chemotherapie angefordert. Von 10 möglichen Kandidaten legten 5 völlig unzureichende medizinische Unterlagen vor, um eine Bewertung der Wirksamkeit von DCA zu ermöglichen. Bei 3 weiteren Kandidaten wurde unmittelbar vor oder kurz nach Beginn der DCA-Behandlung eine andere Behandlung eingeleitet. Bei einem Kandidaten war DCA nie begonnen worden. Bei einer der fünf Personen mit unzureichenden Unterlagen wurde ein Non-Hodgkin-Lymphom diagnostiziert, das offenbar sehr gut auf die DCA-Monotherapie ansprach, aber leider reagierte er nicht auf unsere Mitteilungen zur Anforderung vollständiger medizinischer Unterlagen. Bei der verbleibenden Person (TM), die Gegenstand dieses Berichts ist, wurden vollständige medizinische Unterlagen eingeholt. Diese Person, die in diesem Bericht beschrieben wird, wurde von den Autoren nicht behandelt.
Finanzielle Belastung der Teilnehmer
Für jeden Fall, bei dem die erste Überprüfung der Krankenakten ein Ansprechen auf eine Monotherapie mit DCA ergab, wurden die vollständigen Krankenakten angefordert, überprüft und von SS und OA in einer elektronischen Gesundheitsakte zusammengefasst. In solchen Fällen wurden die diagnostischen Pathologie-Objektträger und/oder Gewebeblöcke angefordert und an einen Experten für Hämatopathologie geschickt, um eine zweite Meinung einzuholen. Die vollständigen Bildgebungsdaten in Form von Dicom-Dateien wurden von Mitautor RB, einem Facharzt für Radiologie, der ausschließlich auf PET- und PET/CT-Untersuchungen spezialisiert ist, eingeholt und geprüft. Auf diese Weise wurde eine sehr detaillierte medizinische Beurteilung erreicht – und das ohne jegliche Kosten für die Teilnehmer dieser Studie.
Falldarstellung
Studienteilnehmer TM ist derzeit ein 52-jähriger Mann, bei dem am 1.6.2007 im Alter von 46 Jahren erstmals ein Non-Hodgkin-Lymphom (NHL) diagnostiziert wurde. Er stellte sich Ende 2006 mit einer Vorgeschichte von Herpes zoster, niedrigem Fieber und nächtlichen Schweißausbrüchen vor. In den folgenden fünf Monaten verlor er 50 Pfund an Gewicht, und die Diagnose einer Nasennebenhöhlenentzündung und einer Tuberkulose führte zu einer Behandlung mit verschiedenen Medikamenten, darunter Ciprofloxacin, Clindamycin, INH, Rifampin, Pyrazimid und andere Antibiotika. Bei der internistischen Untersuchung am 1.5.07 wurde eine 6,0 cm große Masse im linken Unterkieferwinkel festgestellt, zusammen mit einem C-reaktiven Proteinwert von 196, einem ESR-Wert von 99, einem Hämatokrit von 33,9, aber einer normalen LDH von 138. Am 7.5.07 zeigte eine Kernspintomographie des Halses multiple Massen in der linken Ohrspeicheldrüse und multiple linke zervikale Knoten bis zu 2,0 cm mit Ausdehnung in die supraklavikuläre Region.
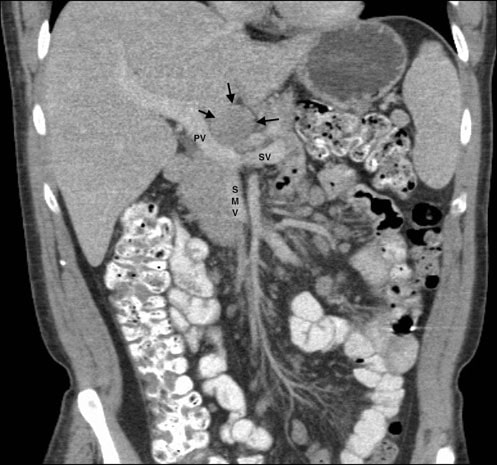
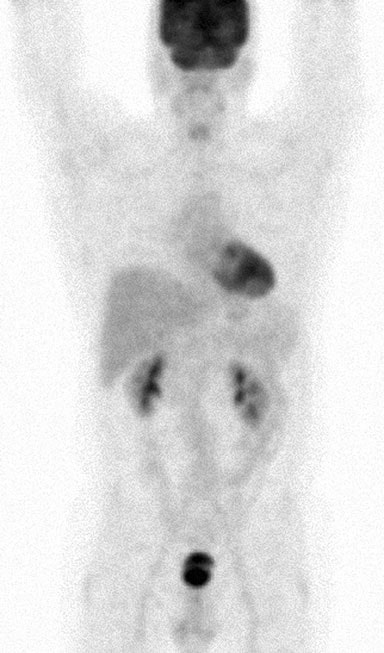
Am 5/11/07 wurde eine Feinnadelaspiration einer 3,0 × 3,0 cm großen diskreten Masse in der linken Ohrspeicheldrüse durchgeführt. Der Bericht und die Objektträger dieses Verfahrens wurden von den Autoren mehrfach angefordert, aber nie erhalten. CT-Scans des Brustkorbs, des Abdomens und des Beckens am 25.5.07 hatten eine Splenomegalie, multiple bilaterale Nierenmassen und eine Lymphadenopathie mit Beteiligung von Mesenterial-, Porta-Hepatis-, Retroperitoneal- und Zöliakieknoten ergeben (Abb. 1). Diese Befunde standen im Einklang mit der Diagnose eines Lymphoms im Stadium IV (> 4 befallene Knoten), mit Anämie und systemischen Symptomen wie Fieber, Nachtschweiß und Gewichtsverlust sowie mit einer extra-nodalen Beteiligung mindestens der Ohrspeicheldrüse.
Am 6.1.07 wurde eine Exzisionsbiopsie der linken Ohrspeicheldrüse durchgeführt. Der Pathologiebericht wies auf ein follikuläres und diffuses B-Zell-Non-Hodgkin-Lymphom mit fokalem Befall der Ohrspeicheldrüse hin, das anhand der Zellgröße, der Morphologie und des Proliferationsindex (CD71) als intermediär eingestuft wurde. Durchflusszytometrische Untersuchungen der Gewebeproben ergaben, dass es sich um ein B-Zell-Non-Hodgkin-Lymphom mit Keimzentrumszellen handelte. Die immunhistochemischen Untersuchungen waren positiv für die Marker CD3, CD5, CD10, CD20, CD23, CD43, BCL-1 und BCL-2. Die Kappa- und Lambda-Färbung zeigte eine monotypische Lambda-B-Zellpopulation, die CD10 exprimierte und 38 % des gesamten Gewebes ausmachte.
Bei der körperlichen Untersuchung am 26. Juni 2007 durch einen medizinischen Onkologen wurden eine linke Ohrspeichelmasse (6,0 × 5,0 cm), ein linker jugulodigastrischer Knoten (4,0 × 4,0 cm), ein linker oberer anteriorer Halsknoten (3.0 × 3,0 cm), rechter jugulodigastrischer Knoten (2,0 × 2,0 cm), rechter und linker supraklavikulärer Knoten (3,0 × 3,0 cm) sowie rechter und linker axillärer Knoten (jeweils 2,0 × 3,0). Wichtig war, dass mehrere Ärzte, die den TM untersuchten, am selben Tag oder innerhalb weniger Tage signifikant abweichende Knotenmessungen an bestimmten anatomischen Stellen meldeten.
Eine hämatopathologische Zweitmeinung in einem Universitätsklinikum am 26.6.07 ergab den Verdacht auf ein niedriggradiges B-Zell-Lymphom mit teilweiser Auslöschung der Knotenarchitektur durch eine atypische und überwiegend diffuse Infiltration kleiner lymphatischer Zellen; eine Rebiopsie eines vergrößerten Knotens wurde empfohlen. Eine am 29.6.07 durchgeführte Knochenmarkspunktion ergab ein normozelluläres Knochenmark mit einem großen, nicht-paratrabekulären lymphoiden Aggregat, das kleine, reife Lymphozyten enthielt. Die Durchflusszytometrie dieser Probe zeigte eine klonale, auf Lambda beschränkte B-Zell-Population, die durch kleine, reife Zellen mit unregelmäßigen Kernumrissen gekennzeichnet war. Zusammen mit der partiellen Expression von CD10 und der fehlenden Expression von CD5 wurde die Diagnose eines follikulären Zentrumszell-Lymphoms zusammen mit einem niedriggradigen B-Zell-Lymphom mit Beteiligung des Knochenmarks gestellt.
Am 7.12.07 wurde eine FDG-PET-Untersuchung durchgeführt, die Stoffwechselanomalien in mehreren Knoten sowie in der linken Ohrspeicheldrüse ergab. Der standardisierte Uptake-Wert (SUV) wurde durch Standardisierung mit der Leber korrigiert (Wahl et al. 2009) und die Befunde in Abb. 2 und 3 dargestellt.
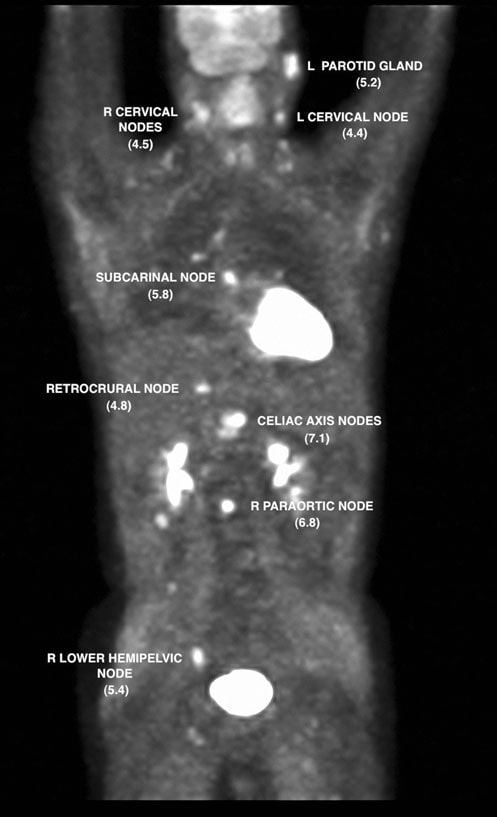
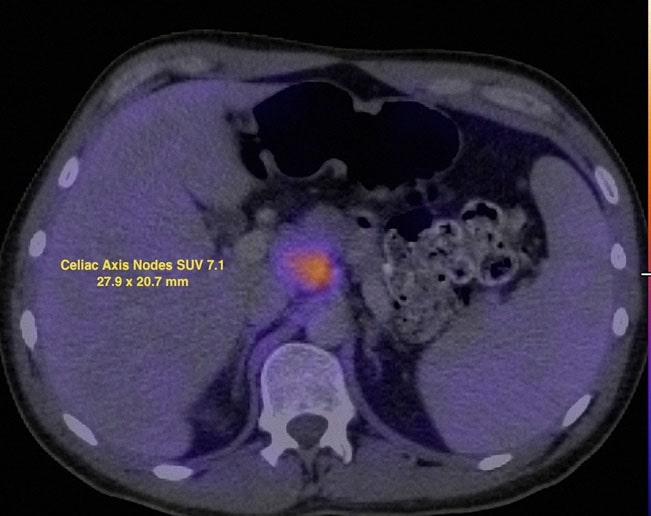
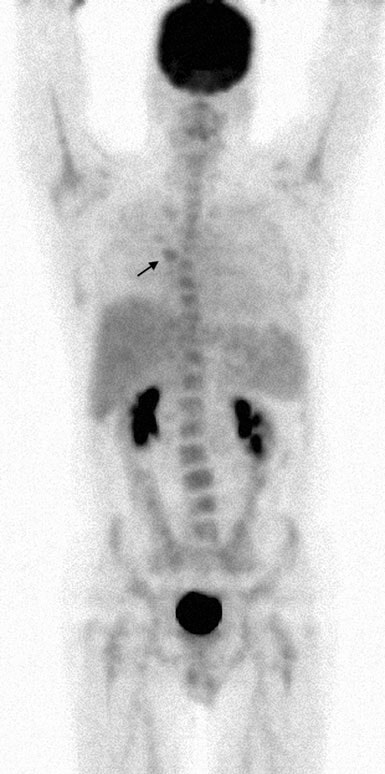
Am 13.7.07 wurde eine dosisdichte Rituximab-CHOP (R-CHOP) begonnen und alle 14 Tage wiederholt. Die Zyklen 2-6 wurden am 27.7.07, 10.8.07, 24.8.07, 7.9.07 und 21.9.07 verabreicht. Am 5.10.07 zeigte ein CT des Halses, des Brustkorbs, des Abdomens und des Beckens eine deutliche Rückbildung fast aller früheren Adenopathiebereiche. Am 8.10.07 wurde eine FDG-PET-Untersuchung wiederholt, bei der eine fokale Aufnahme im Bereich des rechten Suprahilitars festgestellt wurde (Abb. 4).
Die körperliche Untersuchung am 10.9.07 ergab einen 4,0 x 3,0 cm großen fibrotischen Restbereich in der linken hinteren Halsregion. FDG-PET #3 am 25.1.08 war völlig normal (Abb. 5).
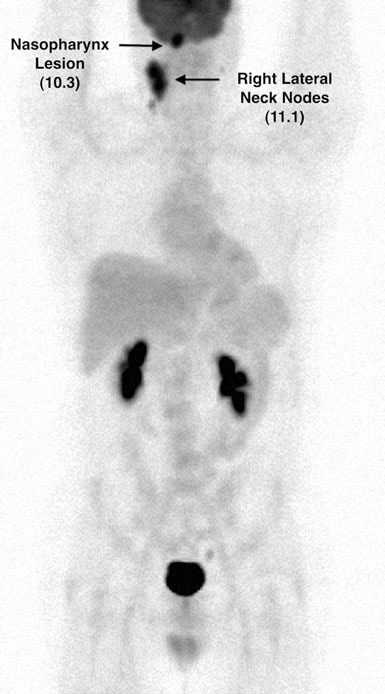
Der Patient galt ab 1/08 als vollständig geheilt. Eine erneute FDG-PET-Untersuchung (#4) am 4.11.08 blieb normal. In 7/08 berichtete TM jedoch über einen Gewichtsverlust von 11 Pfund in den vorangegangenen 2 Wochen, Husten und Schweißausbrüche sowie leichtes Fieber. Am 10.7.08 wurde bei der körperlichen Untersuchung ein 2,0 × 2,0 cm großer Knoten an der rechten vorderen Halswirbelsäule entdeckt und am 16.8.08 wurde FDG-PET Nr. 5 durchgeführt. Dabei zeigten sich mehrere neue hypermetabolische Herde (Abb. 6 und 7).
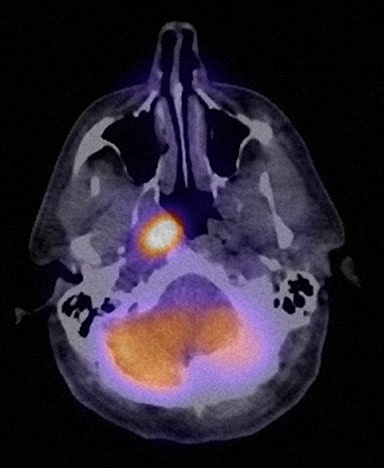
Am 4.9.08 wurde TM von einem Kopf- und Halschirurgen untersucht, der eine große Masse verfilzter Knoten im rechten Hals auf den Ebenen I, 2A, 2B und der oberen Ebene 5 beschrieb. In der Krankenakte wurde beschrieben, dass der Patient durch die Nebenwirkungen der vom 13.7.07 bis zum 21.9.07 verabreichten Chemotherapie, nämlich Übelkeit und Erbrechen, extrem gestört war. Nach eigenen Recherchen entschied er sich für eine Behandlung mit DCA (Dichloracetat) und verschiedenen Ergänzungsmitteln, die er am 10.9.08 begann. Sein „DCA-Protokoll“ bestand aus: DCA 1.000 mg pro Tag in einer Tagesdosis. Das DCA wurde mit 10 Unzen Mountain Dew™ gemischt, das 55 mg Koffein enthält. TM nahm außerdem Vitamin B1 in einer Dosierung von 500 mg pro Tag (bis zum 10.12.08), Alpha-Liponsäure in einer Dosierung von 600 mg pro Tag, grünen Tee (Jarrow™) in einer Dosierung von 500 mg mit 74 mg EGCG und 35 mg Koffein pro 500 mg.
Innerhalb von 2 Wochen nach Beginn dieser Behandlung berichtete der Patient über einen deutlichen Rückgang von Nachtschweiß, niedrigem Fieber, Anorexie und Müdigkeit. Einen Monat nach Beginn des DCA-Protokolls waren die Nackenknoten merklich kleiner, und nach 2 Monaten waren keine Knoten mehr tastbar. Nach 71 Tagen des DCA-Protokolls waren alle systemischen Symptome vollständig verschwunden. TM berichtete über ein gutes Energieniveau und guten Appetit, die Fähigkeit, gut zu schlafen und keine Nebenwirkungen.
FDG-PET #6 wurde am 4.12.08 durchgeführt. Alle Anomalien, die bei der vorherigen Untersuchung am 16.8.08 festgestellt wurden, waren verschwunden. Durch die Bemühungen der Autoren SS und OA wurde am 11.2.09 eine externe hämatopathologische Beratung durch einen Experten in einem internationalen Krebszentrum eingeholt. Hämatoxylin- und Eosin-gefärbte Schnitte zeigten, dass eine Speicheldrüse von einem dichten atypischen lymphoiden Infiltrat betroffen war, das sowohl ein vage knotiges als auch ein diffuses Muster aufwies. Das Infiltrat bestand aus kleinen monozytoiden B-Lymphoidzellen. Lymphoepitheliale Läsionen waren vorhanden. Aufgrund der Morphologie wurde als Differentialdiagnose ein extra-nodales Marginalzonen-B-Zell-Lymphom (MALToma) oder ein follikuläres Lymphom mit monozytoider Differenzierung gestellt. Die immunhistochemischen Untersuchungen (IHC) wurden an ungefärbten Objektträgern durchgeführt und waren negativ für BCL-2, CD3, CD43 und Keratin. Positiv waren BCL-6 und CD10 in den unscharfen knotigen Bereichen sowie CD20, Kappa- und Lambda-Ketten in einigen Plasmazellen. Der endgültige Befund lautete: „Obwohl es keinen eindeutigen IHC-Beweis für ein Lymphom gibt, deuten die Morphologie, der gemeldete durchflusszytometrische Befund von monotypischen Lambda-B-Lymphzellen und der molekulare Befund eines Ig-Kappa-Gen-Rearrangements auf ein niedriggradiges B-Zell-Lymphom hin, das nicht weiter klassifiziert werden kann.“
Am 27.4.09 wurde die FDG-PET/CT-Untersuchung Nr. 7 durchgeführt und zeigte keine hypermetabolische Aktivität. Derselbe Befund wurde bei Untersuchung Nr. 8 am 8.9.09 festgestellt. In einer internistischen Kliniknotiz vom 1.8.10 hieß es jedoch, TM habe einen vergrößerten Halsknoten bemerkt, und die körperliche Untersuchung bestätigte einen linken hinteren Halsknoten mit einem Durchmesser von 2 cm. In diesem Zusammenhang begann er auch, leichte nächtliche Schweißausbrüche und Müdigkeit zu haben. Eine konventionelle Therapie wurde angeboten, aber von TM abgelehnt, der es vorzog, weiterhin das DCA-Protokoll anzuwenden. Am 2.1.10 wurde ein PET/CT #9 durchgeführt, wobei der offizielle Bericht eine Aufnahme im rechten Oropharynx mit einer 3,5 bis 4,0 cm großen Läsion und einem SUV von 5,5 anzeigte. Die Expertenprüfung durch RB ergab einen korrigierten SUV von 3,0 und die Schlussfolgerung, dass dieser Befund „am ehesten mit einer normalen physiologischen Verteilung des Radiopharmakons übereinstimmt“ RB wies auch darauf hin, dass die oben genannte anatomische Messung der oropharyngealen Läsion definitiv fehlerhaft war. Die örtlichen Onkologen kamen zu dem Schluss, dass das Lymphom des Patienten wieder aufgetreten war, und es wurden Optionen für eine lokale Behandlung mit Strahlentherapie sowie Lenalidomid allein oder mit Rituximab erörtert. TM lehnte erneut eine weitere Chemotherapie ab und setzte die Behandlung mit DCA fort. Die hämatologisch-onkologische Nachuntersuchung am 25.1.11 ergab einen 2,0 cm großen linken Halslymphknoten. Auch hier wurden Optionen für die weitere Behandlung erörtert, darunter Bendamustin, Fludarabin und eine Radioimmuntherapie mit Zevalin, die jedoch alle abgelehnt wurden. Am 4.10.11 wurde ein FDG-PET/CT #10 durchgeführt, das keine Hinweise auf eine hypermetabolische Aktivität zeigte (Abb. 8).
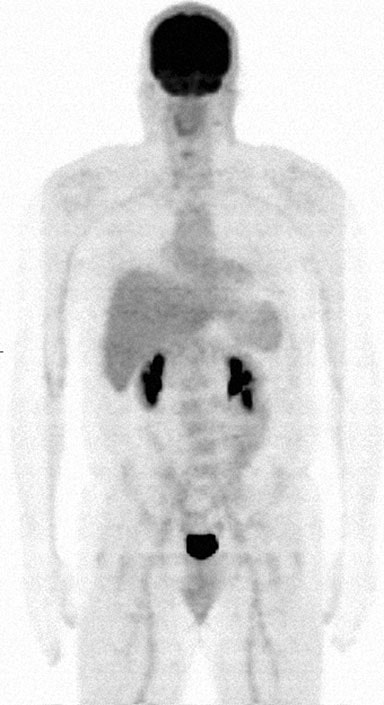
Im November 2012 berichtet TM, dass es ihm gut geht und er keine systemischen Symptome hat. Er bemerkt ein Zu- und Abnehmen von kleinen Knoten in seinem Nacken, die seiner Meinung nach erbsengroß sind. Er berichtet, dass er sein DCA-Protokoll weiterhin anwendet, gibt aber an, dass er die Häufigkeit der DCA-Dosierung auf dreimal pro Woche reduziert hat. Er gibt an, dass sein Energielevel ausgezeichnet ist, dass er Vollzeit arbeitet, aber weil er keine Versicherung bekommt, hat er keine weitere medizinische Untersuchung durch körperliche Untersuchung, Labortests oder irgendwelche bildgebenden Studien erhalten. Die Autoren SS und OA haben am 8.11.12 eine FDG-PET/CT-Untersuchung und am 9.11.12 eine Laboruntersuchung veranlasst, die für TM kostenlos waren. Die FDG-Untersuchung war völlig normal. Alle Labortests, abgesehen von einer Erhöhung der Triglyceride und des LDL, sind normal, einschließlich Biomarker wie β-2 μglobulin, lösliche IL-2-Rezeptoren und ESR.
Diskussion
Tumorzellen haben einen bemerkenswert unterschiedlichen Stoffwechsel im Vergleich zu den normalen Zellen, von denen sie abstammen. Sie weisen einen veränderten Stoffwechsel auf, der es ihnen ermöglicht, höhere Proliferationsraten aufrechtzuerhalten und verschiedenen apoptotischen Signalen zu widerstehen (Bonnet et al. 2007; Bui und Thompson 2006). Dieser veränderte und erhöhte Stoffwechsel bedeutet, dass Krebszellen große Mengen an Proteinen, Lipiden und Nukleotiden sowie Energie in Form von ATP benötigen. Vor fast 100 Jahren veröffentlichte Otto Warburg seine Erkenntnisse, die zeigen, dass Krebszellen eine Veränderung der zellulären Energie aufweisen, die eine erhöhte aerobe Glykolyse beinhaltet. (Warburg 1956a, b; Warburg et al. 1927)
Einer der vorgeschlagenen Wirkmechanismen von DCA besteht darin, den Stoffwechsel der Tumorzellen vom glykolytischen, zytoplasmatischen Weg, der von den Tumorzellen bevorzugt wird, auf einen mitochondrialen, glukoseoxidativen Weg (oxidative Phosphorylierung) umzustellen (Bonnet et al. 2007). Auf diese Weise stellt DCA die apoptotische Funktion der Mitochondrien wieder her und kehrt die metabolischen Veränderungen um, die es den Tumorzellen ermöglicht haben, zu überleben, sich zu vermehren und zu metastasieren. Diese vermutete Wirkung von DCA steht in Zusammenhang mit seiner Fähigkeit, die Hemmung der PDH (Pyruvat-Dehydrogenase) umzukehren – ein entscheidendes Enzym, das den Eintritt von Pyruvat in den Krebs-Zyklus durch seine Oxidation zum Schlüsselsubstrat Acetyl-CoA ermöglicht. DCA bewirkt dies durch Hemmung der mitochondrialen PDK (Pyruvatdehydrogenase-Kinase). DCA hemmt also den an der PDH-Produktion beteiligten Inhibitor. DCA erreicht dies, indem es die Phosphorylierung und Inaktivierung von PDH durch PDK verhindert. (Constantin-Teodosiu et al. 1999) Die
Aggressivität von Krebszellen wurde mit dem Grad der Hyperpolarisierung des mitochondrialen Membranpotenzials in Verbindung gebracht (Heerdt et al. 2005). Bonnet et al. haben eine Reihe von mitochondrialen Wirkungen von DCA wie folgt definiert. DCA hat eine schnelle und dosisabhängige Wirkung, die zu einer Depolarisierung der mitochondrialen Membran führt, die innerhalb von 5 Minuten auftritt. Aufgrund dieses Aspekts der DCA-Wirkung wird AIF (apoptoseinduzierender Faktor) in den Zellkern verlagert und Cytochrom C wird diffus im Zytoplasma vorhanden. DCA erhöht dosisabhängig dieH2O2-Produktionim Komplex I der ETC. DieH2O2-Produktionaktiviert die Kv1.5-Kanäle, die wiederum NFAT1, einen bekannten Apoptose-Inhibitor, hemmen. Zu den weiteren biochemischen Wirkungen von DCA gehören die Erhöhung der Expression von Annexin, die Aktivierung der Caspasen 3 und 9 sowie die Verringerung von Survivin und PCNA (proliferating cell nuclear antigen) (Bonnet et al. 2007). Weitere Studien haben gezeigt, dass die Hochregulierung von Kv1.5-Kanälen wahrscheinlich zu einer Verringerung des zellulären Kaliums führt, wodurch Caspasen und Apoptose aktiviert werden (Remillard und Yuan 2004; Wang 2004; Pan und Mak 2007).
Es gibt nur wenige Studien über die Wirkung von DCA auf das menschliche Krebswachstum, und die meisten davon wurden in vitro durchgeführt. Tong et al. untersuchten DCA allein oder in Kombination mit 5-FU gegen vier menschliche Kolorektalkrebs-Zelllinien. Sie zeigten, dass DCA synergistisch mit 5-FU wirkt, indem es Apoptose auslöst, die Proliferation von Krebszellen hemmt, den Zellzyklusstillstand in der G1/S-Phase verstärkt, die Expression von Bcl-2 verringert und gleichzeitig die Expression von Bax und Caspase-3 erhöht (Tong et al. 2011). Die Studie von Michelakis et al. (2010) über DCA bei fünf Patienten mit Glioblastoma multiforme beschreibt eine radiologische Rückbildung und liefert Bilder von zwei Patienten mit einem offensichtlichen Ansprechen auf DCA, obwohl das Ablösen des Tumors bei Patient Nummer 2 die Interpretation der DCA-Wirkung zu erschweren scheint.
Die F-18-Fluordesoxyglukose (F-18-FDG)-PET wird inzwischen von immer mehr Onkologen eingesetzt, um das Ausmaß der Bösartigkeit festzustellen, das therapeutische Ansprechen zu dokumentieren und prognostische Informationen nach einer antineoplastischen Therapie zu liefern. Der vorgestellte Patient wies ein FDG-PET auf, das mit seinen klinischen Anzeichen und Symptomen eines hochaktiven neoplastischen Prozesses übereinstimmte. Nach der Behandlung mit einer modernen Chemotherapie unter Verwendung von R-CHOP erreichte er eine komplette Remission von kurzer Dauer; sein Rückfall war erneut durch abnorme FDG-PET-Anomalien gekennzeichnet. Sein Ansprechen auf die DCA-Monotherapie führte jedoch zu einer dauerhaften vollständigen Remission, die nun 4 Jahre anhält. Die Aufnahme von F18-FDG durch Neoplasmen wird als Beispiel für den Warburg-Effekt angesehen, d. h. die Verwertung von Glukose durch Tumoren in Gegenwart von Sauerstoff (aerobe Glykolyse). Die einzigartige Funktionalität von FDG-PET, wie sie bei verschiedenen Krebsarten zu beobachten ist, resultiert jedoch aus mehreren Faktoren, von denen einige zu nennen sind:
- Phosphorylierung von F18 FDG zu F18 FDG-6-Phosphat durch Hexokinase (HK)
- Hochregulierung von HK durch Hypoxie-induzierbare Transkriptionsfaktoren, z. B. HIF-1α (Mathupala et al. 1997, 2001)
- Überexpression von HK, insbesondere des Isomers HKII, in vielen Krebszellpopulationen
- Entscheidende Rolle von HK für die Bioenergetik von Tumorzellen, d.h. Warburg-Effekt (Bustamante et al. 1981; Bustamante und Pedersen 1977)
- Fehlen von Glukose-6-Phosphatase (G6Pase) in hochgradig bösartigen, schnell wachsenden Tumoren
- Daraus resultierender Einschluss von F18-FDG-6-Phosphat durch Krebszellen (Higashi et al. 2002)
Bei der von uns vorgestellten Studienteilnehmerin wurde am 4.12.08 mittels FDG-PET eine vollständige Remission dokumentiert, die vier Jahre lang ohne jegliche therapeutische Intervention anhielt, abgesehen von der fortgesetzten Einnahme von DCA, allerdings mit einer geringeren Dosierungsfrequenz von dreimal pro Woche. Mit Stand vom 12.5.12 berichtet TM über keine signifikanten Befunde einer peripheren Neuropathie bei einer Dosis von ≤ 10 mg/kg/Tag, was mit den Ergebnissen von Michelakis et al. (2010) übereinstimmt, die über keine signifikanten peripheren Neuropathien bei DCA-Dosen von weniger als 6,25 mg/kg zweimal täglich berichteten. TM hatte auch keine anderen Nebenwirkungen.
Eine Erklärung für das dramatische Ansprechen, das in diesem Fallbericht dokumentiert wurde, ist die einer Spontanremission eines niedrig- bis mittelgradigen NHL. Dies erscheint unwahrscheinlich angesichts der dramatischen Verringerung und des Verschwindens der systemischen Symptome und der Adenopathie innerhalb weniger Wochen nach Beginn der DCA-Behandlung. Darüber hinaus macht der relativ schnelle Rückfall nach der ersten Chemotherapie mit R-CHOP eine Spontanremission bei TM unwahrscheinlich.
Unsere hier vorgestellte Studie sollte zu einer eingehenden Diskussion über den Einsatz von Stoffwechseltherapien wie DCA bei Krebspatienten führen. Weitere Themen, die für diesen Bericht relevant erscheinen, sind die mögliche Rolle einer niedrig glykämischen Diät bei der Vorbeugung und Behandlung von Krebs und die Notwendigkeit, sich auf die Methodik und das Berichtsformat bei der PET-Bildgebung zu konzentrieren. Die Verwendung von Krankenakten von Personen, die eine Krebstherapie ohne die Aufsicht eines Arztes ausprobieren, ist ein einzigartiger Ansatz in der medizinischen Detektivarbeit. Die Beschaffung von Patientenakten, DVDs und Berichten über bildgebende Verfahren, pathologischen Berichten und Objektträgern sowie Laborberichten ist schwierig und zeitaufwendig. Wenn jedoch weitere Studien an Menschen bestätigen, dass DCA eine signifikante krebshemmende Wirkung hat, sollte der in dieser Untersuchung verwendete Ansatz in größerem Maßstab in Betracht gezogen werden.
Schlussfolgerung
Das hervorragende Ansprechen des Patienten TM auf die DCA-Monotherapie im Zusammenhang mit einem Rückfall nach einer R-CHOP-Therapie rechtfertigt weitere klinische Studien mit DCA bei menschlichen Patienten mit verschiedenen bösartigen Erkrankungen, insbesondere angesichts der vernachlässigbaren Kosten und der minimalen Toxizität dieses einfachen 2-Kohlenstoff-Moleküls.
Danksagungen
Die Autoren bedanken sich bei der Life Extension Foundation in Fort Lauderdale, Florida, für die finanzielle Unterstützung und bei Robert Vergara von Life Extension für die Hilfe bei der Optimierung der in diesem Bericht verwendeten Grafikdateien. Jim Tassano war maßgeblich daran beteiligt, die Autoren SS und OA auf Berichte über signifikante klinische Reaktionen bei Krebspatienten aufmerksam zu machen, die DCA erhielten.
Konkurrierende Interessen
Die Autoren erklären, dass sie keine finanziellen oder nicht-finanziellen konkurrierenden Interessen haben.
Beiträge der Autoren
SS, OA, NP und JW haben an der Erstellung des Manuskripts mitgewirkt. SS und OA beschafften alle medizinischen Unterlagen, erleichterten die Überprüfung durch die Pathologie, stellten die elektronischen Gesundheitsakten zusammen und führten die Nachuntersuchungen mit den Studienteilnehmern durch. RB überprüfte alle PET- und PET/CT-Bilder und stellte korrigierte SUVs und Messungen zur Verfügung. DS erleichterte die Beschaffung von Schlüssel-DVDs von Bildgebungsstudien und die Erstellung von radiologischen Gutachten.
Informationen des Autors
SS ist ein zertifizierter medizinischer Onkologe mit mehr als 40 Jahren klinischer Erfahrung und Autor zahlreicher von Experten begutachteter Artikel über Morbus Hodgkin, Prostatakrebs und die unterstützende Behandlung von Krebspatienten.
REFERENZEN
1 Berendzen K, Theriaque DW, Shuster J, Stacpoole PW (2006) Therapeutisches Potenzial von Dichloracetat bei Pyruvatdehydrogenase-Komplex-Mangel. Mitochondrion 6:126-135
2BonnetS, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R et al (2007) Eine Mitochondrien-K+-Kanal-Achse ist bei Krebs unterdrückt und ihre Normalisierung fördert die Apoptose und hemmt das Krebswachstum. Krebszelle 11:37-51
3BuiT, Thompson CB (2006) Der süße Zahn des Krebses. Cancer Cell 9:419- 420
4BustamanteE, Pedersen PL (1977) Hohe aerobe Glykolyse von Rattenhepatomazellen in Kultur: Rolle der mitochondrialen Hexokinase. Proc Natl Acad Sci U S A 74:3735-3739
5BustamanteE, Morris HP, Pedersen PL (1981) Energy metabolism of tumor cells. Erfordernis einer Form von Hexokinase mit einer Neigung zur mitochondrialen Bindung. J Biol Chem 256:8699-8704
6CaoW, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S et al (2008) Dichloracetat (DCA) sensibilisiert sowohl Wildtyp- als auch überexprimierende Bcl-2-Prostatakrebszellen in vitro für Strahlung. Prostata 68:1223-1231
7ChenZ, Lu W, Garcia-Prieto C, Huang P (2007) The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr 39:267-274
8ChristofkHR, Vander Heiden MG, Harris MH, Ramanathan A, Gerszten RE, Wei R et al (2008) The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Natur 452:230-233
9Constantin-TeodosiuD, Simpson EJ, Greenhaff PL (1999) Die Bedeutung der Pyruvatverfügbarkeit für die PDC-Aktivierung und Anaplerose im menschlichen Skelettmuskel. Am J Physiol 276:E472-E478
10FangJS, Gillies RD, Gatenby RA (2008) Adaptation to hypoxia and acidosis in carcinogenesis and tumor progression. Semin Cancer Biol 18:330-337
11GatenbyRA, Gawlinski ET (2003) The glycolytic phenotype in carcinogenesis and tumor invasion: insights through mathematical models. Cancer Res 63:3847-3854
12HeerdtBG, Houston MA, Augenlicht LH (2005) Das intrinsische mitochondriale Membranpotenzial von Kolonkarzinomzellen ist mit der Wahrscheinlichkeit der Tumorprogression verbunden. Krebsforschung 65:9861-9867
13HigashiT, Saga T, Nakamoto Y, Ishimori T, Mamede MH, Wada M et al (2002) Relationship between retention index in dualphase (18)F-FDG PET, and hexokinase-II and glucose transporter-1 expression in pancreatic cancer. J Nucl Med 43:173-180
14KurodaY, Ito M, Toshima K, Takeda E, Naito E, Hwang TJ et al (1986) Treatment of chronic congenital lactic acidosis by oral administration of dichloroacetate. J Inherit Metab Dis 9:244-252
15MadhokBM, Yeluri S, Perry SL, Hughes TA, Jayne DG (2010) Dichloracetat induziert Apoptose und Zellzyklus-Stillstand in kolorektalen Krebszellen. Br J Cancer 102:1746-1752
16MathupalaSP, Rempel A, Pedersen PL (1997) Aberranter glykolytischer Stoffwechsel von Krebszellen: eine bemerkenswerte Koordination von genetischen, transkriptionellen, posttranslationalen und mutationellen Ereignissen, die zu einer kritischen Rolle für Typ-II-Hexokinase führen. J Bioenerg Biomembr 29:339-343
17MathupalaSP, Rempel A, Pedersen PL (2001) Glucose catabolism in cancer cells: identification and characterization of a marked activation response of the type II hexokinase gene to hypoxic conditions. J Biol Chem 276:43407-43412
18MichelakisED, Webster L, Mackey JR (2008) Dichloracetat (DCA) als potenzielle metabolische Zieltherapie für Krebs. Br J Cancer 99:989-994
19MichelakisED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E et al (2010) Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2:31ra34
20PanJG, Mak TW (2007) Metabolic targeting as an anticancer strategy: dawn of a new era? Sci STKE 2007:14
21RemillardCV, Yuan JX (2004) Aktivierung von K+-Kanälen: ein wesentlicher Weg beim programmierten Zelltod. Am J Physiol Lung Cell Mol Physiol 286:L49-L67
22StacpoolePW, Barnes CL, Hurbanis MD, Cannon SL, Kerr DS (1997) Treatment of congenital lactic acidosis with dichloroacetate. Arch Dis Child 77:535-541
23StacpoolePW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM et al (2006) Kontrollierte klinische Studie von Dichloracetat zur Behandlung der kongenitalen Laktatazidose bei Kindern. Pädiatrie 117:1519-1531
24StacpoolePW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW et al (2008) Evaluation der Langzeitbehandlung von Kindern mit kongenitaler Laktatazidose mit Dichloracetat. Pädiatrie 121:e1223-e1228
25SunRC, Fadia M, Dahlstrom JE, Parish CR, Board PG, Blackburn AC (2010) Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 120:253-260
26TongJ, Xie G, He J, Li J, Pan F, Liang H (2011) Synergistic antitumor effect of dichloroacetate in combination with 5-fluorouracil in colorectal cancer. J Biomed Biotechnol 2011:740564
27VanderHeiden MG (2010) Targeting cell metabolism in cancer patients. Sci Transl Med 2:31ed31
28WahlRL, Jacene H, Kasamon Y, Lodge MA (2009) From RECIST to PERCIST: evolving considerations for PET response criteria in solid tumors. J Nucl Med 50(Suppl 1):122S-150S
29WangZ (2004) Die Rolle von K+-Kanälen bei der Regulierung von Tumorzellproliferation und Apoptose. Pflugers Arch 448:274-286
30WarburgO (1956a) Über die Beeinträchtigung der Atmung in Krebszellen. Science 124:269-270 Warburg O (1956b) On the origin of cancer cells. Wissenschaft 123:309-314
31WarburgO, Wind F, Negelein E (1927) Der Stoffwechsel von Tumoren im Körper. J Gen Physiol 8:519-530
32WongJY, Huggins GS, Debidda M, Munshi NC, De Vivo I (2008) Dichloracetat induziert Apoptose in Endometriumkrebszellen. Gynecol Oncol 109:394-402
Verwandte Inhalte: