Tatjana Harting1, Mandy Stubbendorff2, Saskia Willenbrock1, Siegfried Wagner1, Patrik Schadzek3, Anaclet Ngezahayo3, Hugo Murua Escobar1, Ingo Nolte1
1 Kleintierklinik, Stiftung Tierärztliche Hochschule Hannover, D-30559 Hannover2
Abteilung Medizinische Klinik III, Hämatologie, Onkologie und Palliativmedizin, Universität Rostock, D-18057 Rostock3
Evotec AG, D-22419 Hamburg4
Institut für Biophysik, Leibniz Universität, D-30419 Hannover
Korrespondenz: Professor Ingo Nolte, Kleintierklinik, Stiftung Tierärztliche Hochschule Hannover, Bünteweg 9, D-30559 Hannover, Deutschland; E-Mail: [email protected]
Received: 12 July 2016Accepted
: 5. September
2016Online-Veröffentlichung: 5. Oktober 2016
Zusammenfassung
Der Warburg-Effekt beschreibt die Fähigkeit von Krebszellen, Energie durch aerobe Glykolyse anstelle der oxidativen Phosphorylierung von Pyruvat zu erzeugen. Diese Abweichung im mitochondrialen Stoffwechsel hemmt die Apoptose und ermöglicht eine verstärkte Proliferation unter Bedingungen mit reduziertem Sauerstoffgehalt. Dichloracetat (DCA) wurde bei mehreren menschlichen Krebszelllinien erfolgreich zur Reaktivierung der oxidativen Phosphorylierung in den Mitochondrien eingesetzt. Das Ziel dieser Studie war die Charakterisierung und Reaktion von Krebszelllinien des Hundes nach DCA-Exposition. Die Wirkung von 10 mM DCA wurde in vitro auf eine Reihe von sechs aus Prostata-Adenokarzinom und Übergangszellkarzinom (TCC) abgeleiteten Zelllinien charakterisiert. Analysiert wurden Zellzahl, Laktatspiegel, Apoptose, Expression von apoptotischen Proteinen, Überlebensfaktoren und verschiedene miRNAs. Darüber hinaus wurden Stoffwechselaktivität, mitochondriale Aktivität und Proliferation untersucht. DCA verringerte die Zellzahl aller verwendeten Zelllinien mit einer Ausnahme signifikant und führte zu einer signifikanten Verringerung der Laktatfreisetzung. Bei allen Zelllinien wurde ein verminderter Survivin-Spiegel festgestellt, bei zwei davon eine signifikante Verringerung der Stoffwechselaktivität. Erhöhte miR-375-Spiegel wurden in allen TCC-Zelllinien gemessen. Die Reaktivierung der Pyruvatdehydrogenase und eine erhöhte mitochondriale Aktivität scheinen den Übergang von der aeroben Glykolyse zurück zur oxidativen Phosphorylierung einzuleiten. Darüber hinaus zeigen diese Ergebnisse, dass die DCA-Behandlung eine unterdrückende Wirkung auf die Proliferation von Krebszellen bei Hunden hat.
Schlagworte: Dichloracetat, canines Prostataadenokarzinom, canines Übergangszellkarzinom, Warburg-EffektDOI
: 10.3892/ijo.2016.3720
EINLEITUNG
In den letzten Jahren haben Krebsbehandlungen wie Chemotherapie, Strahlentherapie und Chirurgie, wie sie in der menschlichen Krebsbehandlung eingesetzt werden, in der Veterinärmedizin an Bedeutung gewonnen. Herkömmliche Chemotherapeutika zielen auf sich teilende Zellen ab, sowohl auf Krebszellen als auch auf nicht-neoplastische Zellen, und verursachen verschiedene Nebenwirkungen wie Myelosuppression, Durchfall, Erbrechen und Anorexie [1]. Aufgrund des fortgeschrittenen Krankheitsstadiums und der Resistenz von Prostata- und Blasenkrebs ist die Behandlung schwierig und oft mit einer schlechten Prognose verbunden [2,3]. Daher muss nach neuen, wirksameren Alternativen gesucht werden.
Dichloracetat (DCA), ein kleines und kostengünstiges Molekül, wirkt auf verschiedene Stoffwechselwege, indem es die Pyruvat-Dehydrogenase-Kinase (PDK) hemmt [4,5]. Dies bedeutet, dass die Pyruvat-Dehydrogenase (PDH) möglicherweise indirekt durch DCA aktiviert wird, was zu einer metabolischen Verschiebung zugunsten der Oxidation von Pyruvat zu Acetyl-Co-Enzym-A in den Mitochondrien führt [5]. Trotz dieser Tatsache wurde DCA in den letzten Jahrzehnten bei der Behandlung einer Vielzahl von Erkrankungen wie angeborener Laktatazidose [6,7], Hypercholesterinämie [8], Hyperglykämie [9], kongestiver Herzinsuffizienz [10] und erst kürzlich in der Krebsforschung [11-16] eingesetzt. DCA wurde in verschiedenen In-vitro-Ansätzen im Bereich der Humanonkologie getestet, unter anderem bei Darmkrebs [17,18], Endometriumkrebs [14], Plattenepithelkarzinomen der Mundhöhle [19] und Brustkrebs [20]. In einer klinischen Studie, in der Patienten mit Glioblastom und anderen soliden Tumoren untersucht wurden, verringerte DCA das Tumorwachstum und die Angiogenese [15]. Mit Ausnahme mehrerer Studien, die die pharmakokinetischen Wirkungen von DCA bei Hunden untersuchten [21-23], gibt es derzeit keine Veröffentlichungen über die Wirkung von DCA bei Krebserkrankungen von Hunden. DCA wurde jedoch erfolgreich bei Hunden mit Laktatazidose eingesetzt [24] und wird Berichten zufolge von Hunden gut vertragen [22]. Schwere Nebenwirkungen wie Tod und Lähmungen wurden nur in einer hochdosierten Langzeitstudie beobachtet [21].
Unter aeroben Bedingungen greifen nicht-neoplastische Zellen auf die Glukoseoxidation über Mitochondrien zurück, die Pyruvat zu Acetyl-Co-Enzym-A oxidieren [25]. Die PDH ermöglicht den Eintritt von Pyruvat in die Mitochondrien. Die Energieproduktion von Krebszellen wird in erster Linie von der Glukoseoxidation auf die aerobe Glykolyse verlagert, was zu einer erhöhten zytosolischen Laktatproduktion führt, obwohl genügend Sauerstoff vorhanden ist [26]. Dieses Verhalten wird als Warburg-Effekt bezeichnet. Der Biochemiker Otto Warburg berichtete erstmals 1926 über diese Eigenschaften und stellte die Hypothese auf, dass ein Versagen der Mitochondrien die Ursache sein könnte [26]. Die Karzinogenese setzt vorzugsweise in hypoxischen Geweben ein, in denen der Glukoseverbrauch gering ist. Dementsprechend wird der Hypoxie-induzierbare Faktor 1α aktiviert und führt zu einer Hochregulierung von Glukosetransportern und PDK. Die Aktivierung von PDK führt zur Hemmung von PDH und damit zur Glykolyse [27,28]. Aufgrund dieser metabolischen Veränderung und der Verringerung der mitochondrialen Depolarisation haben Krebszellen einen Überlebensvorteil und werden nicht von intrinsischen Apoptosewegen beeinflusst [29,30].
Für die präklinische Bewertung von Krebsmedikamenten sind In-vitro-Experimente mit Zelllinien sowohl in der Human- als auch in der Veterinärforschung wichtige Ansätze. In-vitro-Untersuchungen bieten die Möglichkeit, mehr Informationen über die Wirksamkeit und Empfindlichkeit verschiedener Tumorentitäten zu erhalten [31-33]. In dieser Studie wurden verschiedene etablierte [34] und neue Zelllinien verwendet.
Nach unserer Kenntnis ist dies die erste Studie, in der die Wirkung von DCA auf Zellen des Prostata-Adenokarzinoms und des Übergangszellkarzinoms (TCC) beim Hund untersucht wurde. Es wurde der Einfluss von DCA auf die Zellzahl, den Laktatspiegel, die mitochondriale Aktivität, die Apoptose und die Stoffwechselaktivität bestimmt. Darüber hinaus wurde die Wirkung von DCA auf die PDH und auf an der Apoptose beteiligte Proteine bewertet. Die Wirkung von DCA auf verschiedene microRNAs (miR) wurde bisher nicht untersucht. Außerdem gibt es keine Literatur über den Einfluss von DCA auf Blasenkrebs beim Menschen oder in der Tiermedizin.
Materialien und Methoden
Zelllinien und Zellkultur
Für die Experimente wurden drei Prostata-Adenokarzinome (DT08/46, CT1258, DT15/08) und drei TCC-Zelllinien (DT08/40, DT15/06, DT15/09) von Hunden verwendet. Zwei TCC-Zelllinien (DT08/40 und DT15/09) stammten aus Prostatagewebe und eine TCC (DT15/06) aus weiblichem Blasengewebe. Die Zelllinien wurden nach pathohistologischer Untersuchung des Ausgangsgewebes als Prostata-Adenokarzinom oder TCC klassifiziert. Alle Zelllinien wurden in der Kleintierklinik der Tierärztlichen Hochschule Hannover, Deutschland, hergestellt. Die Zelllinien wurden in 75 cm2-Kolben (TPP, Faust Lab Science, Klettgau, Deutschland) mit 10 ml Medium 199 (Gibco™, Thermo Fisher Scientific, Darmstadt, Deutschland), 10 % fetalem Kälberserum (Hyclone®, Thermo Fisher Scientific), 2 % Penicillin-Streptomycin (Biochrom, Berlin, Deutschland) kultiviert, wobei alle 48 Stunden ein Mediumwechsel stattfand. Die Zellen wurden bei 37°C und 5%CO2 in befeuchteter Luft inkubiert. Für die Experimente wurden die Zellen 48 Stunden lang mit 10 mM DCA (Sigma-Aldrich GmbH, Taufkirchen, Deutschland) behandelt. Für die Zellteilung oder nach der Behandlung wurden die Zellen mit TrypLE™ Express (Gibco™, Thermo Fisher Scientific) trypsiniert und die Zellzahl wurde mit einem automatischen Cellometer™ Auto T4 (Nexcelom Bioscience, Lawrence, MA, USA) gezählt und mit der Negativkontrolle verglichen. Die Zellen wurden mit PBS (Biochrom) gewaschen und bei -80°C für weitere Untersuchungen (quantitative RT-PCR und Proteinanalyse) gelagert. DCA wurde in deionisiertem Wasser aufgelöst, filtriert und der pH-Wert mit NaOH auf 7,4 eingestellt. Die Dosis von 10 mM wurde in Anlehnung an frühere Studien mit menschlichen HeLa-Zellen gewählt [14]. Auch wenn diese Konzentration in vivo möglicherweise nicht sicher erreicht werden kann, wurde diese Konzentration gewählt, um eine Vergleichbarkeit mit anderen In-vitro-Studien am Menschen zu ermöglichen.
Laktatspiegel
Zur Messung des Laktatspiegels wurde der Überstand aus der Zellkultur 10 Minuten lang bei 1.000 U/min zentrifugiert, um schwimmende Zellen und Trümmer zu entfernen, und 1,3 ml wurden in ein Natriumfluoridgefäß (Sarstedt, Nümbrecht, Deutschland) überführt. Um Veränderungen durch Phenolrot und Laktat aus fötalem Kälberserum auszuschließen, wurde das Medium als Negativkontrolle verwendet und von den Messungen abgezogen. Die kolorimetrische Bestimmung von Laktat wurde mit Cobas® C311 (Hitachi, Tokio, Japan) durchgeführt. Um die ermittelten Laktatwerte mit der Zellzahl und dem Zellvolumen in Beziehung zu setzen, wurde der Gesamtlaktatgehalt auf die intrazelluläre Proteinkonzentration normiert, die mit dem Pierce™ BCA-Assay (Thermo Fisher Scientific) gemäß den Anweisungen des Herstellers bestimmt wurde.
Metabolische Aktivität
Die Zellen wurden in einer 96-Well-Platte (Falcon, Corning, Amsterdam, Niederlande) mit 200 μl Medium 199, 10 % fetalem Kälberserum und 2 % Penicillin-Streptomycin ausgesät und bei 37 °C und 5 % befeuchtetemCO2 inkubiert. Das Medium wurde alle 24 Stunden gewechselt und zur Messung wurden 20 μl MTT (CellTiter96® Aqueous One Solution assay, Promega, Mannheim, Deutschland) in jede Vertiefung gegeben. Die Absorption wurde nach 2 Stunden mit einem Synergy2-Plattenlesegerät (BioTek, Bad Friedrichshall, Deutschland) bestimmt. Die Messungen wurden alle 24 Stunden über einen Zeitraum von vier Tagen durchgeführt. Die Daten wurden mit der Gen5™ 1.11 Software (BioTek) analysiert und auf die Negativkontrolle des Mediums normiert.
Durchflusszytometrie
Zur Bestimmung der Apoptose wurden105 Zellen in einer 6-Well-Platte (TPP, Faust Lab Science) mit 4 ml Medium kultiviert und wie oben beschrieben 48 h lang mit 10 mM DCA behandelt. Danach wurden die Zellen trypsiniert und zusammen mit dem Medium, das nicht-adhärente und tote Zellen enthielt, 6 min lang bei 1.000 U/min zentrifugiert. Der Überstand wurde verworfen und die Zellen wurden in 500 μl Assay-Puffer resuspendiert. Die Färbung erfolgte mit 5 μl Annexin-FITC und 1 μl Sytox (Annexin V-FITC Detection Kit Plus, PromoCell, Heidelberg, Deutschland). Nach 5-minütiger Inkubation bei Raumtemperatur wurden104 Zellen mit BD FACScalibur™ (BD Biosciences, Heidelberg, Deutschland) und CellQuest™ Pro 6.0 Software (BD Biosciences) analysiert. Annexin und Sytox wurden in FL-1 nachgewiesen. Die Datenanalyse wurde mit FlowJo Version 10.0.8r1 (FlowJo, Ashland, OR, USA) durchgeführt. Die Gates wurden durch den Mittelwert der Positivkontrollen (mit Saponin permeabilisierte Zellen) und der Negativkontrollen jeder Zelllinie (nicht behandelte lebensfähige Zellen) bestimmt.
RNA-Isolierung und quantitative RT-PCR
Die Gesamt-RNA wurde aus106 Zellen mit dem NucleoSpin Small RNA Kit (Macherey Nagel, Düren, Deutschland) wie im Herstellerprotokoll beschrieben isoliert. cDNA wurde aus 35 ng Gesamt-RNA durch reverse Transkription mit dem TaqMan® MicroRNA Reverse Transkription Kit (Applied Biosystems™, Thermo Fisher Scientific) nach den Anweisungen des Herstellers hergestellt. Die relative Quantifizierung der microRNA-Expression der behandelten Zellen im Vergleich zur Negativkontrolle erfolgte mit dem Eppendorf realplex4 Cycler (Eppendorf, Wesseling-Berzdorf, Deutschland) unter Verwendung von 1.33 μl cDNA in einem Gesamtvolumen von 20 μl mit TaqMan® Universal Master Mix NoAmpErase® UNG (Applied Biosystems, Thermo Fisher Scientific) und TaqMan® MicroRNA Assays für Mir-141 (ID 245445_mat), Mir-145 (ID 002278), Mir-375 (ID 000564), die von Thermo Fisher Scientific erworben wurden. Das Verfahren wurde wie im Protokoll des Herstellers beschrieben durchgeführt. Die Daten wurden auf das Hauskeeping-Gen RNU6B (ID 001093) normalisiert und die Analyse wurde mit Rest2009 (Qiagen, Hilden, Deutschland) durchgeführt.
Luminex-Magnetbead-Analyse
Die Proteinexpressionsanalyse wurde mit der xMAP® Luminex Bead Technology unter Verwendung eines Luminex 200™ Instruments (Luminex Corp., Hertogenbosch, Niederlande) durchgeführt. Die Daten werden als Gesamtmenge (Survivin pg/ml) oder Netto-MFI (andere Targets) angegeben und wurden mit der Software xPONENT 3.1 (Luminex Corp.) dargestellt. Probenergebnisse mit niedrigeren Werten als MFI < Hintergrund-MFI + 2× Standardabweichung wurden von der Analyse ausgeschlossen. Die Quantifizierung von Survivin erfolgte mit dem ProcartaPlex Human Survivin Simplex Kit (eBioscience, Frankfurt am Main, Deutschland) unter Verwendung von Zellkulturüberständen wie im Protokoll des Herstellers beschrieben. Die Survivin-Menge wurde auf die Proteinkonzentration normalisiert, die mit dem Pierce BCA-Assay (Thermo Fisher Scientific) bestimmt wurde. PDH und apoptotische Proteine (BAD und JNK) wurden mit Multiplex-Assays von Merck Millipore (Multi-Species PDH Complex Magnetic Bead Panel und 7-Plex Early Apoptosis Magnetic Bead Kit, Darmstadt, Deutschland) nachgewiesen. Die Proben wurden wie in den Anweisungen des Herstellers beschrieben verarbeitet. Zusätzlich wurden die Proben für die PDH-Messungen mit zentrifugalen Ultrafree-Filtereinheiten mit einer Porengröße von 0,65 μm (Merck Millipore) bei 7.000 U/min für 4 Minuten filtriert.
Mitochondriale Aktivität
Zellen, die auf 8-Well-μ-Schalen (Ibidi, Martinsried, Deutschland) gezüchtet und mit und ohne 10 mM DCA behandelt wurden, wurden mit 4 % Paraformaldehyd fixiert, dreimal mit calcium- und magnesiumhaltigem HBSS gewaschen und 15 Minuten lang mit 4 μM MitoSox (Invitrogen, Thermo Fisher Scientific) gefärbt. Nach der Färbung wurden die Zellen dreimal mit HBSS (Gibco, Thermo Fisher Scientific) gewaschen und die Zellkerne 5 Minuten lang mit DAPI (Verdünnung 1:1.000, Sigma-Aldrich GmbH) gegengefärbt. Die Fluoreszenzaufnahmen wurden mit einem invertierten konfokalen Laser-Scanning-Mikroskop (Eclipse TE2000-E, Nikon, Düsseldorf, Deutschland) mit einem 60×-Wasserimmersionsobjektiv (Nikon) durchgeführt. Die Bilder wurden mit der Software EZ-C1 1.80 (Nikon) aufgenommen. Die Anregung erfolgte mit einem Diodenlaser bei 408 nm (DAPI) und mit einem Helium/Neon-Laser bei 543 nm (MitoSox). Die Gesamtzellfluoreszenz von MitoSox unter Abzug des Hintergrunds wurde mit ImageJ analysiert und auf die Zellzahl normiert.
Immunofluoreszenzfärbung von Ki67 und TUNEL
Die Zellen wurden wie oben beschrieben ausgesät, fixiert und gewaschen. Nach dem Waschen mit HBSS wurden die Zellen 20 Minuten lang mit 0,2 % Triton X-100 permeabilisiert, gewaschen und über Nacht mit einem kaninchenspezifischen, polyklonalen Ki67-Antikörper mit einer Verdünnung von 1:150 (Life Technologies, Thermo Fisher Scientific) inkubiert. Für die Färbung wurde ein monoklonaler Anti-Kaninchen-Antikörper Alexa Fluor® 555 (Cell Signaling Technology, Leiden, Niederlande) in einer Verdünnung von 1:250 für 1 Stunde inkubiert und die Zellen wurden 5 Minuten lang mit DAPI (1:1.000) gegengefärbt. Das Protokoll für das Fluoreszenz-Imaging war dasselbe wie oben beschrieben. Die Gesamtzellfluoreszenz wurde wie oben beschrieben ermittelt. Für die TUNEL-Färbung wurde das Apoptag-Fluorescein-Direkt-Kit (Merck Millipore) gemäß den Anweisungen des Herstellers verwendet. Die Anregung erfolgte mit einem Argonlaser bei 488 nm, und die Bildgebung wurde wie oben beschrieben durchgeführt. Der Prozentsatz der TUNEL-positiven Zellen wurde ausgewertet.
Statistische Auswertung
Die statistische Analyse der Daten wurde mit der SAS-Software 7.1 (SAS Institute Inc., Cary, NC, USA) durchgeführt. Für den Vergleich von zwei Mittelwerten wurde ein zweiseitiger t-Test verwendet. Der Konfidenzwert wurde auf 5 % (P<0,05) festgelegt und galt als statistisch signifikant.
Ergebnisse
Zellzahlen nach DCA-Behandlung
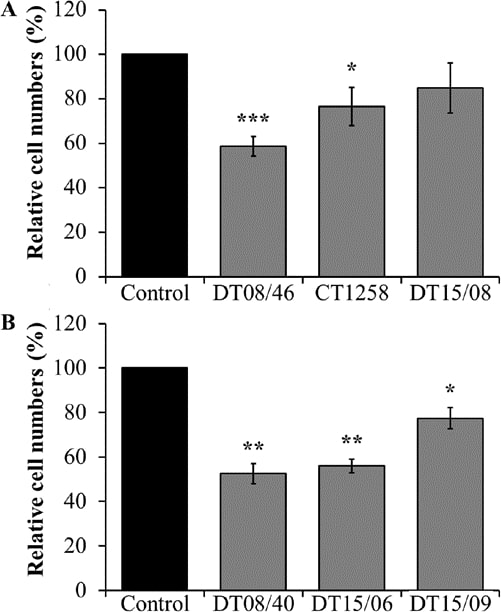
Im Vergleich zu unbehandelten Negativkontrollen zeigten die Prostata-Adenokarzinom-Zelllinien DT08/46 (P<0,0001) und CT1258 (P=0,0122) signifikant niedrigere Zellzahlen nach Behandlung mit 10 mM DCA über 48 h (Abb. 1A). Die dritte Prostatazelllinie DT15/08 DCA zeigte keine signifikante Reduktion (P=0,0748), aber eine Tendenz zu einer geringeren Zellmenge bzw. einer geringeren Proliferationsrate in der nativen Zellkultur (Abb. 1A). Wie in Abb. 1B zu sehen ist, wurde die gleiche abnehmende Wirkung von DCA bei allen untersuchten TCC-Zelllinien DT08/40 (P=0,0031), DT15/06 (P=0,0016) und DT15/09 (P=0,0143) festgestellt.
Laktatspiegel im Überstand der Zellkultur nach DCA-Exposition
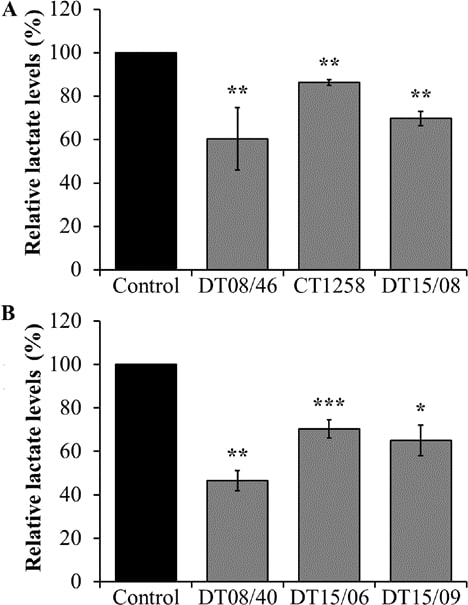
Um den die Laktatfreisetzung senkenden Effekt der DCA-Behandlung nach 48 Stunden zu bewerten, wurde die Laktatmenge im Überstand der Zellkultur gemessen. Bei allen Zelllinien der beiden Krebsarten hatte 10 mM DCA eine signifikante laktatsenkende Wirkung (Abb. 2).
Stoffwechselaktivität nach Behandlung mit DCA über einen Zeitraum von 96 Stunden
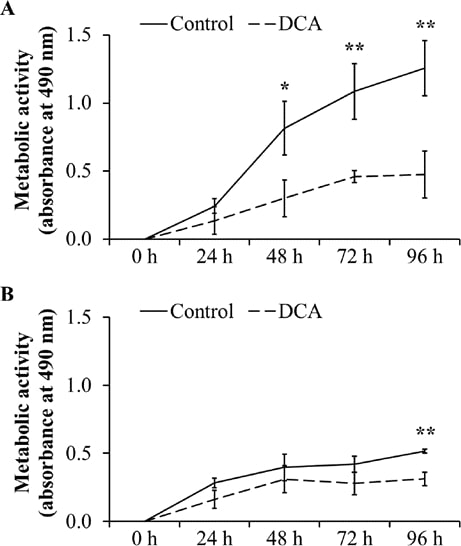
Um die negativen Auswirkungen auf die Zellproliferation zu bestätigen, wurde die Stoffwechselaktivität als Indikator für die Proliferation und die Lebensfähigkeit der Zellen mit Hilfe von MTT-Tests analysiert. Wie in Abb. 3A gezeigt, war die Stoffwechselaktivität in DT15/08 im Vergleich zur entsprechenden Negativkontrolle nach 48 Stunden DCA-Behandlung signifikant reduziert (P=0,0202). Nach 96 Stunden kontinuierlicher DCA-Behandlung war die Stoffwechselaktivität signifikant (P=0,007). Ein ähnlicher Effekt wurde bei DT08/40 (Abb. 3B) nach 96 Stunden (P=0,0025) und bei DT15/06 (P=0,0419) nach 96 Stunden DCA-Behandlung beobachtet (Daten nicht gezeigt). Die Zelllinien DT08/46, CT1258 und DT15/09 zeigten keine statistisch signifikante Wirkung von DCA auf die Stoffwechselaktivität (Daten nicht gezeigt).
Proliferation nach DCA-Behandlung über 48 h
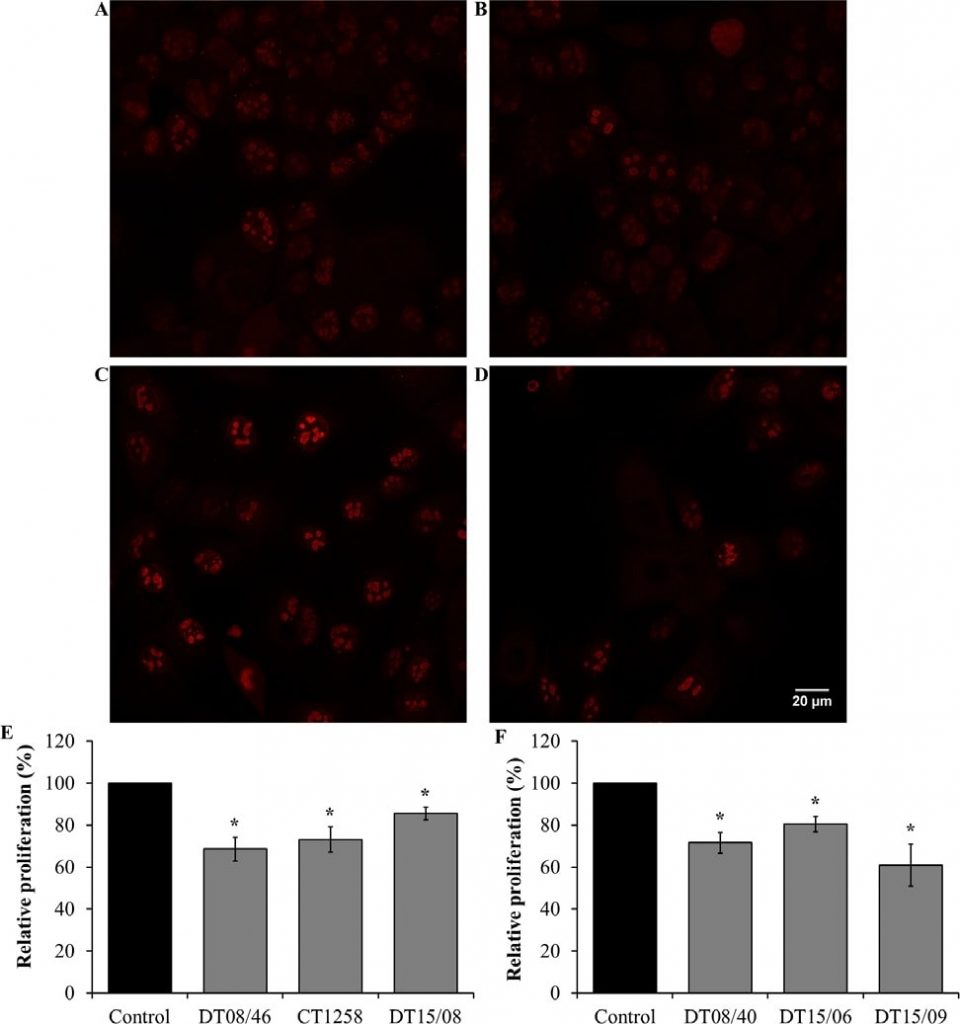
Die Zellproliferation in 10 mM DCA-exponierten Zelllinien wurde durch Ki67-Färbung analysiert und durch konfokale Fluoreszenzmikroskopie sichtbar gemacht. DCA verringerte die Menge an Ki67, was auf eine verringerte Zellproliferation nach 48 Stunden in allen untersuchten Zelllinien mit Signifikanz (P<0,05) hinweist (Abb. 4).
Wirkung von DCA auf die Apoptose
Die Wirkung von 10 mM DCA auf Apoptose und Lebensfähigkeit wurde mit Annexin und Sytox unter Verwendung der Durchflusszytometrie bewertet. In Bezug auf Apoptose und tote Zellen wurden bei keiner der Zelllinien statistisch signifikante Auswirkungen festgestellt (Daten nicht gezeigt). Die Bestätigung der FACS-Apoptoseraten erfolgte durch TUNEL-Färbung, um negative Auswirkungen der Trypsinierung auf kultivierte Zellen auszuschließen. Die Bildgebung erfolgte mit konfokaler Fluoreszenzmikroskopie. Die Ergebnisse bestätigen das Apoptose-Verhältnis in allen mit DCA behandelten Zelllinien außer DT15/06. Signifikant verringerte Apoptosewerte wurden bei DT15/08 (P=0,022) und DT15/09 (P=0,0265) beobachtet. DT15/06 zeigte signifikant erhöhte (P=0,041) Apoptosewerte (Daten nicht gezeigt). Die anderen Zelllinien zeigten keine signifikanten Apoptosewerte.
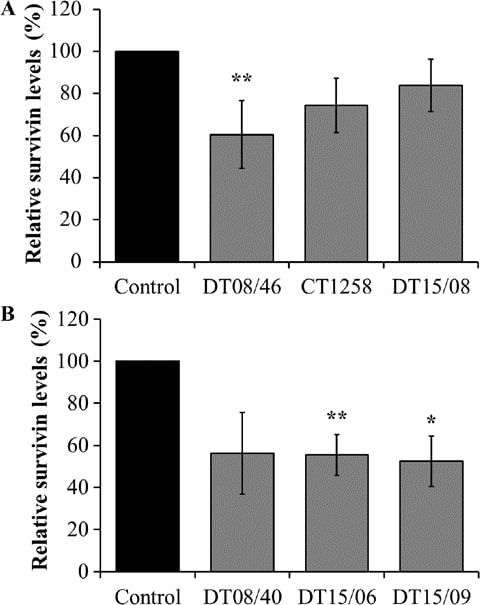
Die Survivin-Expression wurde mit der xMAP® Magnetic Bead Technology analysiert
DCA verringerte signifikant die Survivin-Produktion in der Prostata-Adenokarzinom-Zelllinie DT08/46 (P=0,0053) und in den TCC-Zelllinien DT15/06 (P=0,0027) und DT15/09 (P=0,0206). Die Zelllinien CT1258 (P=0,0761), DT15/08 (P=0,1551) und DT08/40 (P=0,0598) zeigten keine signifikanten Auswirkungen auf die Survivin-Produktion (Abb. 5).
Expression von Bcl-2-Antagonisten des Zelltods (BAD) und c-jun N-terminalen Kinasen (JNK) analysiert mit xMAP Magnetic Bead Technology
Nach 48-stündiger DCA-Inkubation stieg die phosphorylierte und damit inaktive Form von BAD nur in DT08/46 (P=0,0285), CT1258 (P=0,0039) und DT15/06 (P=0,0235) signifikant an. Des Weiteren konnte kein Effekt von DCA auf die aktive phosphorylierte JNK beobachtet werden, mit Ausnahme von DT08/46 (P=0,0044), das verringerte Werte zeigte (Daten nicht gezeigt).
Analyse der Pyruvat-Dehydrogenase (PDH)-Expression mit der xMAP-Magnetic-Bead-Technologie
Zur Bestätigung des verminderten Laktatspiegels als Folge der verminderten Glykolyse wurde die Menge an phosphorylierter PDH (PDH-P) (Ser232, Ser293, Ser300) mit der Luminex Magnetic Bead Technology gemessen. Verminderte PDH-P-Werte und damit erhöhte aktive Enzyme sind mit einer erhöhten Pyruvat-Oxidation und einem Acetyl-Coenzym-A-Stoffwechsel verbunden, was zu einer erhöhten TCA-Zyklus-Aktivität führt [35]. Bei PDH-P (Ser232) wurde bei allen Zelllinien außer DT08/46 ein statistisch signifikanter Rückgang im Vergleich zu unbehandelten Kontrollen beobachtet. Diese Zelllinie zeigte einen höheren, aber nicht signifikanten PDH-P (Ser232)-Wert. Das PDH-P am Rest Ser293 wurde durch DCA nur in den Zelllinien DT15/08 (P=0,0082) und DT15/06 (P=0,0122) signifikant beeinflusst. Bei allen anderen Zelllinien konnte nach DCA-Behandlung kein Effekt beobachtet werden. PDH-P an Ser300 wurde durch DCA signifikant in DT08/46 (P=0,0060), CT1258 (P=0,0215), DT15/08 (P=0,0002) und DT15/06 (P=0,0097) beeinträchtigt (Tabelle I).
Tabelle I
PDH-P-Expression nach DCA-Exposition mit relativen Mittelwerten ± SD (%).
| Zelllinie | PDH-P Ser232 | P-Wert | PDH-P Ser293 | P-Wert | PDH-P Ser300 | P-Wert |
|---|---|---|---|---|---|---|
| Kontrolle | 100 | 100 | 100 | |||
| Prostata-Adenokarzinom | ||||||
| dT08/46 | 121.2±31.5 | 0.2715 | 127.7±27.8 | 0.0900 | 47.7±28.0 | 0.0060b |
| cT1258 | 11.0±5.1 | 0.0011b | 73.7±30.5 | 0.2740 | 24.3±19.5 | 0.0215a |
| dT15/08 | 18.0±17.6 | 0.0026b | 39.7±19.2 | 0.0082b | 18.4±6.8 | 0.0002c |
| Transitionales Zellkarzinom | ||||||
| dT08/40 | 14.3±10.2 | 0.0047b | 84.5±22.8 | 0.3594 | 48.6±32.1 | 0.1090 |
| dT15/06 | 28.2±17.7 | 0.0039b | 72.3±5.4 | 0.0122a | 39.1±10.4 | 0.0097b |
| dT15/09 | 20.5±24.8 | 0.0308a | 99.8±71.3 | 0.9967 | 34.1±41.0 | 0.1085 |
PDH-P, phosphorylierte Pyruvat-Dehydrogenase; Ser, Serin; DCA, Dichloracetat; ±, plus minus.
a P<0,05;
b P<0,01;
c P<0,001;
SD, Standardabweichung; %, Prozent.
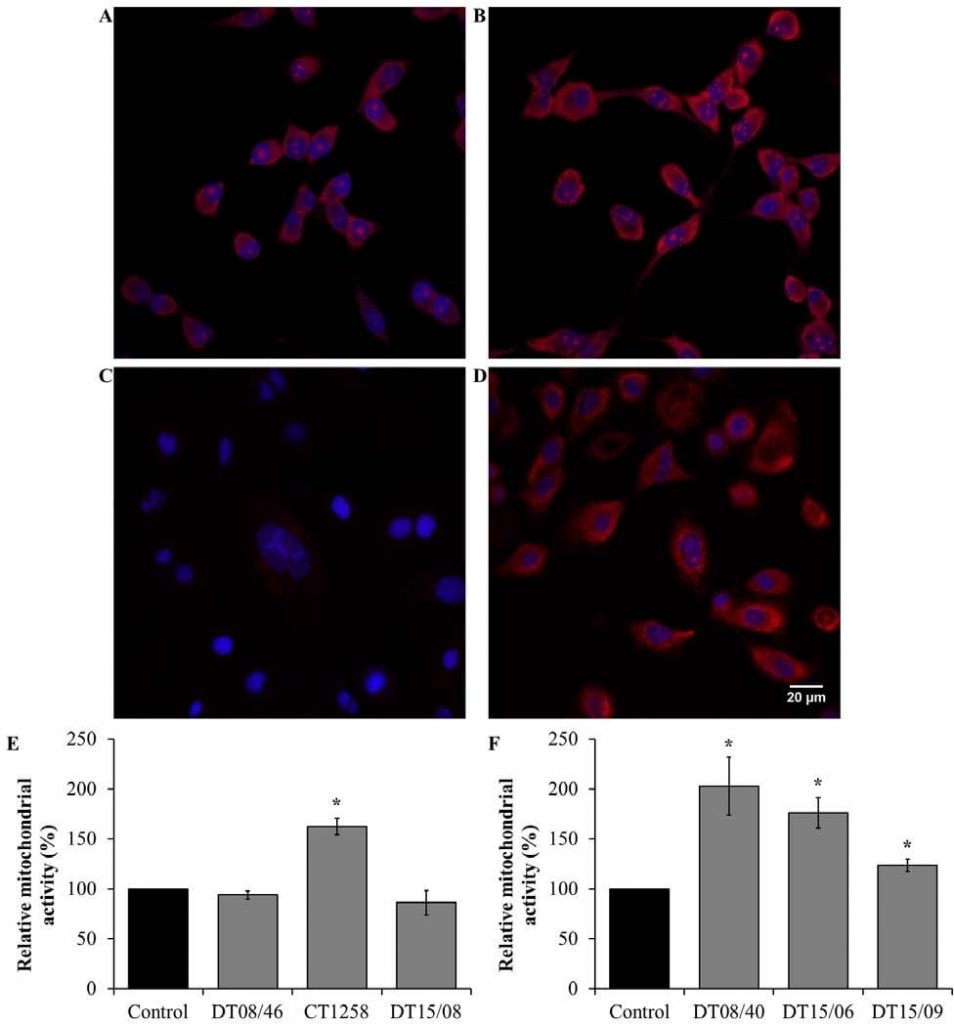
Mitochondriale Aktivität nach DCA-Behandlung
Die metabolische Veränderung der mitochondrialen Aktivität bei der Glukoseoxidation wurde durch den Nachweis von reaktiven Sauerstoffspezies (ROS) aus den Mitochondrien überprüft. In den Prostata-Adenokarzinom-Zelllinien (Abb. 6E) wurde eine signifikant erhöhte mitochondriale Aktivität in CT1258 (P=0,0153) beobachtet. Die Zelllinien DT08/46 (P=0,2829) und DT15/08 (P=0,3082) zeigten nach DCA-Behandlung keine abnehmende Wirkung. Im Gegensatz dazu konnte DCA die mitochondriale Aktivität in allen TCC-Zelllinien signifikant erhöhen (P<0,05) (Abb. 6F).
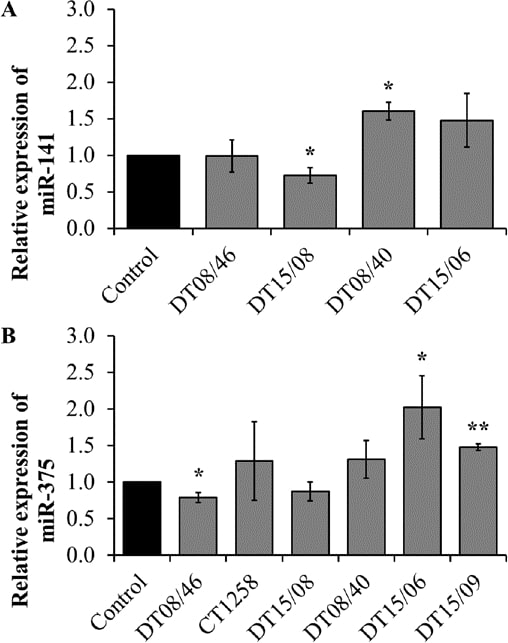
Quantitative miRNA RT-PCR
Um festzustellen, ob die beobachteten niedrigeren Proliferationsraten mit Veränderungen der Mikro-RNAs korrelieren, wurden drei miR, die an der Proliferation oder Apoptose beteiligt sind, untersucht. Die Expression von miR-141 zeigte signifikante Veränderungen mit verringerten Werten in DT15/08 (P=0,0451) und erhöhten Werten in DT08/40 (P=0,0135) im Vergleich zu unbehandelten Kontrollen, während DT08/46 (P=0,9285) und DT15/06 (P=0,1520) keinen Unterschied zu den Kontrollen aufwiesen. Bei CT1258 und DT15/09 wurde miR-141 herunterreguliert und von der Analyse ausgeschlossen. DT08/46 (P=0,0322) zeigte eine geringere und DT15/06 (P=0,0267) sowie DT15/09 (P=0,0031) eine höhere Expression von miR-375. Die Prostata-Adenokarzinom-Zelllinie CT1258 zeigte keine signifikanten Veränderungen bei allen untersuchten microRNAs. Die Expression von miR-145 wurde durch die DCA-Behandlung in keiner der Zelllinien beeinflusst (aufgrund von Ct-Werten >30 von der Analyse ausgeschlossen). Zusammenfassend lässt sich sagen, dass die Prostata-Adenokarzinom-Zelllinien tendenziell eine Herabregulierung von miR-141 (DT15/08) und miR-375 (DT08/46, DT15/08) zeigen, während die TCC-Zelllinien eine Hochregulierung von beiden aufweisen (Abb. 7).
Diskussion
DCA reduzierte die Zellzahl in Prostata-Adenokarzinomen und in TCC-Zelllinien. Dies kann auf der Grundlage einer verringerten Proliferation oder einer erhöhten Apoptose geschehen. In dieser Studie wurde eine proliferationsverringernde Wirkung beobachtet, die sich in einem verringerten Ki67-Wert bei allen Zelllinien und einer geringeren Stoffwechselaktivität bei DT15/08 und DT08/40 zeigte. Dieser Befund steht im Einklang mit früheren Ergebnissen von Bonnet et al. bei verschiedenen menschlichen Zelllinien [35] und Sun et al. bei Brustkrebs [12]. Darüber hinaus wurde eine verringerte Zellproliferation nach DCA-Exposition auch bei menschlichem Prostatakarzinom [36], kolorektalem [37], Dickdarm- [11] und Lungenkrebs [38] beobachtet. Eine Induktion der mitochondrienabhängigen Apoptose durch DCA, wie sie zuvor von mehreren Forschungsgruppen [14,35,39] berichtet wurde, konnte in dieser Studie jedoch nicht beobachtet werden. Dieses Phänomen wurde jedoch auch von Feuerecker et al. in murinen und menschlichen Neuroblastomzellen beobachtet (40). Stockwin et al. berichteten, dass hohe DCA-Konzentrationen für die Apoptoseinduktion erforderlich sind [38]. Die widersprüchlichen Ergebnisse bei einer Zelllinie (DT15/06) zwischen Durchflusszytometrie und TUNEL-Färbung lassen keine Bewertung zu, ob DCA die Apoptose beeinflusst. Die Ergebnisse der apoptotischen Proteinexpression JNK und BAD stimmen mit den in allen anderen Zelllinien beobachteten Effekten überein und stützen die Hypothese, dass DCA keinen Einfluss auf die Apoptose in Prostata- und TCC-Krebszellen von Hunden hat.
Survivin, ein Apoptoseinhibitor und Tumorpromotor [41,42], war in allen Zelllinien, die eine erhöhte mitochondriale Aktivität aufwiesen (DT15/06, DT15/09), signifikant verringert. Es wird berichtet, dass verringerte Survivin-Spiegel Apoptose über intrinsische Wege durch Aktivierung von Caspase-3 induzieren [41] und in Endometriumkrebs-Zelllinien nach DCA-Exposition beobachtet wurden [14]. Unerwarteterweise konnte in diesen Zelllinien keine erhöhte Apoptose beobachtet werden, mit Ausnahme von DT15/06 (P=0,041), das einen leichten, aber inkonsistenten Anstieg des Zelltods zeigte. Dies lässt den Schluss zu, dass verringerte Survivin-Spiegel möglicherweise eine verringerte Proliferation zur Folge haben. Darüber hinaus ist eine Deregulierung weiterer Gene, die an der Apoptoseinduktion beteiligt sind, denkbar und würde erklären, warum verringerte Survivinspiegel nicht zu Apoptose führten.
DCA ist ein PDK-Inhibitor, der indirekt die PDH aktiviert. Aufgrund der verringerten PDH-P-Werte kann Pyruvat in den Mitochondrien oxidiert werden [4,5]. Eine verringerte PDH-Phosphorylierung wurde bei mehreren menschlichen Krebszelllinien beobachtet [16,37,43]. In Übereinstimmung mit den veröffentlichten Ergebnissen bei menschlichen Zelllinien bestätigte diese Studie eine verringerte PDH-Phosphorylierung in allen DCA-behandelten Zellen, was durch eine verringerte Laktatfreisetzung in allen Zelllinien bestätigt wird. Dies deutet darauf hin, dass DCA die Glukoseoxidation sowohl in Krebszellen von Hunden als auch in menschlichen Krebszellen fördert. Außerdem wurden in dieser Studie erhöhte ROS-Werte in den Mitochondrien aller Zelllinien mit Ausnahme von zwei Prostata-Adenokarzinom-Zelllinien nachgewiesen. Erhöhte ROS-Spezies in den Mitochondrien, die durch die Zellatmung entstehen, bestätigen die verringerten PDH-P-Werte und die Laktatreduktion. Möglicherweise führt die erhöhte Mitochondrienaktivität nicht zur Apoptose, sondern zu einer erhöhten Zellatmung, die das Überleben der Krebszellen mit einem veränderten Stoffwechsel erschwert. Dies könnte eine Erklärung für die erhöhte Lebensfähigkeit der Zellen nach DCA-Exposition sein. Eine erhöhte Lebensfähigkeit nach DCA-Exposition wurde auch von McPherson et al. beobachtet, die über eine erhöhte Pyruvat-Oxidation und Lebensfähigkeit von Embryonen in einem gealterten Mausmodell berichteten [44].
die Hochregulierung von miR-375 hat Berichten zufolge in vielen Zellen wie Magenkrebs [45], Bauchspeicheldrüsenkrebs [46], fötalen kardiomyozytenähnlichen Zellen [47] und Dickdarmkrebs [48] eine proliferationshemmende Wirkung. Bei der Prostatakarzinogenese hat microRNA-375 je nach Tumorphänotyp unterschiedliche Auswirkungen. Costa-Pinheiro et al. wiesen eine antiproliferative Wirkung in PC-3-Zellen durch Hochregulierung sowie eine erhöhte Apoptose in 22Rv1-Zellen nach Knockdown der miR-375 nach [49]. Unsere Ergebnisse zeigen, dass die Hoch- oder Herunterregulierung von miR-375 nach DCA-Behandlung in Prostata-Adenokarzinom-Zelllinien nicht konsistent ist, was mit den oben beschriebenen Ergebnissen übereinstimmt. Im Vergleich zu Prostatakrebszellen zeigten alle TCC-Zelllinien erhöhte miR-375-Werte. Es gibt keine Literatur, die die Wirkung von miR-375 bei Blasenkrebs beschreibt. Es ist möglich, dass diese Ergebnisse mit den antiproliferativen Wirkungen übereinstimmen, die bei vielen anderen Zellen beschrieben wurden. Die gleichen Ergebnisse wurden bei der microRNA-141 beobachtet. Eine Hochregulierung von miR-141 hemmte die Krebsproliferation und Zellzyklusprogression in Neuroblastomzellen [50]. Außerdem wird miR-141 bei Blasenkrebs mit Muskelinvasion herunterreguliert [51]. In unserer Studie wurden miR-141 und miR-375 in allen TCC-Zelllinien nach DCA-Behandlung hochreguliert, was darauf hindeutet, dass diese Veränderungen zu einer geringeren Proliferationsrate führen. Bei Prostatakrebs wird eine Hochregulierung von miR-141 berichtet [52]. In dieser Studie gingen die miR-141-Werte leicht zurück, aber wir vermuten, dass dieser Effekt zu gering ist, um Krebszellen zu beeinflussen. Eine Analyse, die es ermöglicht, festzustellen, ob ein direkter Zusammenhang zwischen DCA und Veränderungen in verschiedenen microRNAs für die beobachteten biologischen Reaktionen ursächlich ist, würde jedoch einen umfassenden transkriptomischen Ansatz erfordern.
Zusammenfassend zeigt diese Studie, dass Krebszelllinien bei Hunden auf eine DCA-Behandlung ansprechen und die Wirkung auf eine verringerte Proliferationsrate, eine erhöhte Pyruvat-Oxidation und mitochondriale Aktivität zurückgeführt werden kann. Die Ergebnisse zeigen auch Unterschiede zwischen den untersuchten Krebsarten. So scheinen TCC-Zelllinien durchgängig auf die DCA-Behandlung zu reagieren und empfindlicher zu sein als Prostata-Adenokarzinom-Zelllinien. Im Vergleich zu den meisten menschlichen Zelllinien wirkte sich DCA nicht auf die Apoptose aus, was darauf hindeuten könnte, dass DCA bei Hundekrebs zwar zur Beschränkung des Tumorwachstums, nicht aber zur Verkleinerung des Tumors nützlich sein könnte.
Darüber hinaus kann DCA bei der Sensibilisierung von Hundekrebszellen für andere Krebsmedikamente von Vorteil sein und eignet sich daher möglicherweise für Kombinationstherapien [53]. Um höhere DCA-Konzentrationen im Krebsgewebe zu gewährleisten und schwere generalisierte Nebenwirkungen zu vermeiden, könnte eine intraläsionale Therapie, vergleichbar mit der intravesikalen Chemotherapie beim Menschen [54] und bei Hunden mit TCC [55,56], eine weitere Möglichkeit darstellen. Die Konzentration von 10 mM DCA wurde gewählt, um die Vergleichbarkeit mit anderen In-vitro-Studien am Menschen zu gewährleisten [14,18,37]. Für klinische Studien muss die DCA-Konzentration im Hinblick auf die Verträglichkeit und negative Nebenwirkungen neu bewertet werden. Daher sollten weitere Studien mit DCA-Konzentrationen in niedrigeren Konzentrationen geprüft werden.
Abkürzungen:
| DCA | dichloracetat |
| PDH | pyruvat-Dehydrogenase |
| PDK | pyruvat-Dehydrogenase-Kinase |
| TCC | übergangszellkarzinom |
| RNA | ribonukleinsäure |
| PCR | polymerase-Kettenreaktion |
| JNK | c-jun N-terminale Kinasen |
| BAD | Bcl-2-Antagonist des Zelltods |
| ROS | reaktive Sauerstoffspezies |
| PBS | phosphat-gepufferte Kochsalzlösung |
REFERENZEN
1 Vail DM: Unterstützung von Krebspatienten unter Chemotherapie in der Tiermedizin: Neutropenie und gastrointestinale Toxizität. Top Companion Anim Med. 24:122-129. 2009.2 Cornell KK, Bostwick DG, Cooley DM, Hall G, Harvey HJ, Hendrick MJ, Pauli BU, Render JA, Stoica G, Sweet DC, et al: Clinical and pathologic aspects of spontaneous canine prostate carcinoma: A retrospective analysis of 76 cases. Prostate. 45:173-183. 2000.
3 Mutsaers AJ, Widmer WR und Knapp DW: Canine transitional cell carcinoma. J Vet Intern Med. 17:136-144. 2003.
4 Sutendra G und Michelakis ED: Pyruvat-Dehydrogenase-Kinase als neues therapeutisches Ziel in der Onkologie. Front Oncol. 3:382013.
5 Stacpoole PW: The pharmacology of dichloroacetate. Metabolism. 38:1124-1144. 1989.
6 Stacpoole PW, Gilbert LR, Neiberger RE, Carney PR, Valenstein E, Theriaque DW und Shuster JJ: Evaluation of long-term treatment of children with congenital lactic acidosis with dichloroacetate. Pediatrics. 121:e1223-e1228. 2008.
7 Stacpoole PW, Kerr DS, Barnes C, Bunch ST, Carney PR, Fennell EM, Felitsyn NM, Gilmore RL, Greer M, Henderson GN, et al: Controlled clinical trial of dichloroacetate for treatment of congenital lactic acidosis in children. Pediatrics. 117:1519-1531. 2006.
8 Moore GW, Swift LL, Rabinowitz D, Crofford OB, Oates JA und Stacpoole PW: Reduction of serum cholesterol in two patients with homozygous familial hypercholesterolemia by dichloroacetate. Atherosclerosis. 33:285-293. 1979.
9 Stacpoole PW, Moore GW und Kornhauser DM: Metabolic effects of dichloroacetate in patients with diabetes mellitus and hyperlipoproteinemia. N Engl J Med. 298:526-530. 1978.
10 Kato T, Niizuma S, Inuzuka Y, Kawashima T, Okuda J, Tamaki Y, Iwanaga Y, Narazaki M, Matsuda T, Soga T, et al: Analysis of metabolic remodeling in compensated left ventricular hypertrophy and heart failure. Circ Heart Fail. 3:420-430. 2010.
11 Sánchez-Aragó M, Chamorro M und Cuezva JM: Die Selektion von Krebszellen mit unterdrückten Mitochondrien löst das Fortschreiten von Dickdarmkrebs aus. Carcinogenesis. 31:567-576. 2010.
12 Sun RC, Fadia M, Dahlstrom JE, Parish CR, Board PG und Blackburn AC: Reversal of the glycolytic phenotype by dichloroacetate inhibits metastatic breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat. 120:253-260. 2010.
13 Saed GM, Fletcher NM, Jiang ZL, Abu-Soud HM und Diamond MP: Dichloracetat induziert die Apoptose epithelialer Eierstockkrebszellen durch einen Mechanismus, der die Modulation von oxidativem Stress einschließt. Reprod Sci. 18:1253-1261. 2011.
14 Wong JY, Huggins GS, Debidda M, Munshi NC und De Vivo I: Dichloracetat induziert Apoptose in Endometriumkrebszellen. Gynecol Oncol. 109:394-402. 2008.
15 Michelakis ED, Sutendra G, Dromparis P, Webster L, Haromy A, Niven E, Maguire C, Gammer TL, Mackey JR, Fulton D, et al: Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med. 2:31ra342010.
16 Kinnaird A, Dromparis P, Saleme B, Gurtu V, Watson K, Paulin R, Zervopoulos S, Stenson T, Sutendra G, Pink DB, et al: Metabolic modulation of clear-cell renal cell carcinoma with dichloroacetate, an inhibitor of pyruvate dehydrogenase kinase. Eur Urol. 69:734-744. 2016.
17 Delaney LM, Ho N, Morrison J, Farias NR, Mosser DD und Coomber BL: Dichloracetat beeinflusst die Proliferation, aber nicht das Überleben von menschlichen Darmkrebszellen. Apoptosis. 20:63-74. 2015.
18 Madhok BM, Yeluri S, Perry SL, Hughes TA und Jayne DG: Dichloracetat induziert Apoptose und Zellzyklus-Stillstand in Darmkrebszellen. Br J Cancer. 102:1746-1752. 2010.
19RuggieriV, Agriesti F, Scrima R, Laurenzana I, Perrone D, Tataranni T, Mazzoccoli C, Lo Muzio L, Capitanio N und Piccoli C: Dichloroacetate, a selective mitochondria-targeting drug for oral squamous cell carcinoma: A metabolic perspective of treatment. Oncotarget. 6:1217-1230. 2015.
20 Xintaropoulou C, Ward C, Wise A, Marston H, Turnbull A und Langdon SP: A comparative analysis of inhibitors of the glycolysis pathway in breast and ovarian cancer cell line models. Oncotarget. 6:25677-25695. 2015.
21 Cicmanec JL, Condie LW, Olson GR und Wang SR: 90-Day toxicity study of dichloroacetate in dogs. Fundam Appl Toxicol. 17:376-389. 1991.
22 Maisenbacher HW III, Shroads AL III, Zhong G, Daigle AD, Abdelmalak MM, Samper IS, Mincey BD, James MO und Stacpoole PW: Pharmacokinetics of oral dichloroacetate in dogs. J Biochem Mol Toxicol. 27:522-525. 2013.
23 Lukas G, Vyas KH, Brindle SD, Le Sher AR und Wagner WE Jr: Biological disposition of sodium dichloroacetate in animals and humans after intravenous administration. J Pharm Sci. 69:419-421. 1980.
24 Park R, Arieff AI, Leach W und Lazarowitz VC: Treatment of lactic acidosis with dichloroacetate in dogs. J Clin Invest. 70:853-862. 1982.
25 Racker E: Geschichte des Pasteur-Effekts und seine Pathobiologie. Mol Cell Biochem. 5:17-23. 1974.
26 Warburg O, Wind F und Negelein E: Über den Stoffwechsel von Tumoren im Körper. Klin Wochenschr. 5:829-832. 1926.
27 Kim JW, Tchernyshyov I, Semenza GL und Dang CV: HIF-1-vermittelte Expression der Pyruvat-Dehydrogenase-Kinase: Ein metabolischer Schalter, der für die zelluläre Anpassung an Hypoxie erforderlich ist. Cell Metab. 3:177-185. 2006.
28 Lum JJ, Bui T, Gruber M, Gordan JD, DeBerardinis RJ, Covello KL, Simon MC und Thompson CB: The transcription factor HIF-1alpha plays a critical role in the growth factor-dependent regulation of both aerobic and anaerobic glycolysis. Genes Dev. 21:1037-1049. 2007.
29 Zhao Y, Butler EB und Tan M: Targeting cellular metabolism to improve cancer therapeutics. Cell Death Dis. 4:e5322013.
30 Plas DR und Thompson CB: Cell metabolism in the regulation of programmed cell death. Trends Endocrinol Metab. 13:75-78. 2002.
31 Simon D, Knebel JW, Baumgartner W, Aufderheide M, Meyer-Lindenberg A und Nolte I: In vitro efficacy of chemotherapeutics as determined by 50% inhibitory concentrations in cell cultures of mammary gland tumors obtained from dogs. Am J Vet Res. 62:1825-1830. 2001.
32 Knapp DW, Chan TC, Kuczek T, Reagan WJ und Park B: Evaluation of in vitro cytotoxicity of nonsteroidal anti-inflammatory drugs against canine tumor cells. Am J Vet Res. 56:801-805. 1995.
33 Sartin EA, Barnes S, Toivio-Kinnucan M, Wright JC und Wolfe LG: Heterogenic properties of clonal cell lines derived from canine mammary carcinomas and sensitivity to tamoxifen and doxorubicin. Anticancer Res. 13:229-236. 1993.
34 Winkler S, Murua Escobar H, Eberle N, Reimann-Berg N, Nolte I und Bullerdiek J: Establishment of a cell line derived from a canine prostate carcinoma with a highly rearranged karyotype. J Hered. 96:782-785. 2005.
35 Bonnet S, Archer SL, Allalunis-Turner J, Haromy A, Beaulieu C, Thompson R, Lee CT, Lopaschuk GD, Puttagunta L, Bonnet S, et al: A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Krebszelle. 11:37-51. 2007.
36 Cao W, Yacoub S, Shiverick KT, Namiki K, Sakai Y, Porvasnik S, Urbanek C und Rosser CJ: Dichloracetat (DCA) sensibilisiert sowohl Wildtyp- als auch überexprimierende Bcl-2-Prostatakrebszellen in vitro für Strahlung. Prostate. 68:1223-1231. 2008.
37 Ho N und Coomber BL: Pyruvate dehydrogenase kinase expression and metabolic changes following dichloroacetate exposure in anoxic human colorectal cancer cells. Exp Cell Res. 331:73-81. 2015.
38 Stockwin LH, Yu SX, Borgel S, Hancock C, Wolfe TL, Phillips LR, Hollingshead MG und Newton DL: Natriumdichloracetat wirkt selektiv auf Zellen mit Defekten im mitochondrialen ETC. Int J Cancer. 127:2510-2519. 2010.
39 Xie J, Wang BS, Yu DH, Lu Q, Ma J, Qi H, Fang C und Chen HZ: Dichloracetat verlagert den Stoffwechsel von der Glykolyse zur Glukoseoxidation und zeigt eine synergistische Wachstumshemmung mit Cisplatin in HeLa-Zellen. Int J Oncol. 38:409-417. 2011.
40 Feuerecker B, Seidl C, Pirsig S, Bruchelt G und Senekowitsch-Schmidtke R: DCA fördert das Wachstum von Neuroblastom-Tumoren in Nacktmäusen. Am J Cancer Res. 5:812-820. 2015.
41 Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC und Altieri DC: Kontrolle der Apoptose und des mitotischen Spindelkontrollpunkts durch Survivin. Nature. 396:580-584. 1998.
42 Ambrosini G, Adida C und Altieri DC: Ein neues Anti-Apoptose-Gen, Survivin, das bei Krebs und Lymphomen exprimiert wird. Nat Med. 3:917-921. 1997.
43 Abemayor E, Kovachich GB und Haugaard N: Effects of dichloroacetate on brain pyruvate dehydrogenase. J Neurochem. 42:38-42. 1984.
44 McPherson NO, Zander-Fox D und Lane M: Stimulation des mitochondrialen Embryo-Stoffwechsels durch Dichloressigsäure in einem gealterten Mausmodell verbessert die Embryoentwicklung und -lebensfähigkeit. Fertil Steril. 101:1458-1466. 2014.
45 Zhou N, Qu Y, Xu C und Tang Y: Upregulation of microRNA-375 increases the cisplatin-sensitivity of human gastric cancer cells by regulating ERBB2. Exp Ther Med. 11:625-630. 2016.
46 Zhou J, Song S, He S, Zhu X, Zhang Y, Yi B, Zhang B, Qin G und Li D: MicroRNA-375 zielt auf PDK1 im Pankreaskarzinom und unterdrückt das Zellwachstum durch den Akt-Signalweg. Int J Mol Med. 33:950-956. 2014.
47 Wang L, Song G, Liu M, Chen B, Chen Y, Shen Y, Zhu J und Zhou X: Die Überexpression von MicroRNA-375 beeinflusst die Proliferation, Apoptose und Differenzierung von P19-Zellen über den Notch-Signalweg. Int J Mol Med. 37:47-55. 2016.
48 Zaharie F, Muresan MS, Petrushev B, Berce C, Gafencu GA, Selicean S, Jurj A, Cojocneanu-Petric R, Lisencu CI, Pop LA, et al: Exosome-carried microRNA-375 inhibits cell progression and dissemination via Bcl-2 blocking in colon cancer. J Gastrointestin Liver Dis. 24:435-443. 2015.
49 Costa-Pinheiro P, Ramalho-Carvalho J, Vieira FQ, Torres-Ferreira J, Oliveira J, Gonçalves CS, Costa BM, Henrique R and Jerónimo C: MicroRNA-375 plays a dual role in prostate carcinogenesis. Clin Epigenetics. 7:422015.
50 Wang Z, Lei H and Sun Q: MicroRNA-141 and its associated gene FUS modulate proliferation, migration and cisplatin chemosensitivity in neuroblastoma cell lines. Oncol Rep. 35:2943-2951. 2016.
51 Mahdavinezhad A, Mousavi-Bahar SH, Poorolajal J, Yadegarazari R, Jafari M, Shabab N und Saidijam M: Evaluation of miR-141, miR-200c, miR-30b Expression and Clinicopathological features of bladder cancer. Int J Mol Cell Med. 4:32-39. 2015.
52 Brase JC, Johannes M, Schlomm T, Fälth M, Haese A, Steuber T, Beissbarth T, Kuner R und Sültmann H: Circulating miRNAs are correlated with tumor progression in prostate cancer. Int J Cancer. 128:608-616. 2011.
53 Xue X, You S, Zhang Q, Wu Y, Zou GZ, Wang PC, Zhao YL, Xu Y, Jia L, Zhang X, et al: Mitaplatin erhöht die Empfindlichkeit von Tumorzellen gegenüber Cisplatin durch Induktion mitochondrialer Dysfunktion. Mol Pharm. 9:634-644. 2012.
54 Porten SP, Leapman MS und Greene KL: Intravesikale Chemotherapie bei nicht-muskelinvasivem Blasenkrebs. Indian J Urol. 31:297-303. 2015.
55 Song D, Wientjes MG, Gan Y und Au JL: Bladder tissue pharmacokinetics and antitumor effect of intravesical 5-fluorouridine. Clin Cancer Res. 3:901-909. 1997.
56 Abbo AH, Jones DR, Masters AR, Stewart JC, Fourez L und Knapp DW: Klinische Studie der Phase I und Pharmakokinetik von intravesikalem Mitomycin C bei Hunden mit lokalisiertem Übergangszellkarzinom der Harnblase. J Vet Intern Med. 24:1124-1130. 2010.