Jason Y.Y. Wong1, Gordon S. Huggins2, Marcella Debidda4, Nikhil C. Munshi4, und Immaculata De Vivo1,3
1 Channing Laboratory, Abteilung für Medizin, Brigham and Women’s Hospital und Harvard Medical School, Boston, Massachusetts.
2 Forschungsinstitut für molekulare Kardiologie, Tufts-New England Medical Center, Boston, Massachusetts.
3 Programm für molekulare und genetische Epidemiologie, Harvard School of Public Health, Boston, Massachusetts.
4 Das Jerome Lipper Multiple Myeloma Center, Abteilung für medizinische Onkologie, Dana-Farber Cancer Institute, Harvard Medical School, Boston Massachusetts.
Korrespondenz: Immaculata De Vivo, Brigham and Women’s Hospital, Abteilung für Medizin, Channing Laboratory, 181 Longwood Ave, Boston, MA, 02115, USA. Telefon: 617-525-2094. Fax: 617-525-2008. [email protected].
Eingereicht: 14 September 2020Accepted
: 4. Dezember 2020Veröffentlicht
: 9. Dezember 2020
Zusammenfassung
Hintergrund: Eine kürzlich durchgeführte bahnbrechende Studie hat gezeigt, dass die Behandlung mit Dichloracetat (DCA) die Apoptose in Lungen-, Brust- und Glioblastomzelllinien fördert, indem der Stoffwechsel von aerober Glykolyse auf Glukoseoxidation umgestellt wird, verbunden mit einer Umgestaltung der NFAT-Kv1.5-Achse. Ziel dieser Studie war es, festzustellen, ob DCA die Apoptose in Endometriumkrebszellen auslöst und den apoptotischen Mechanismus zu bewerten.
Methoden: Eine Gruppe von Endometriumkrebs-Zelllinien mit unterschiedlichem Differenzierungsgrad wurde mit DCA behandelt und mittels Durchflusszytometrie auf Apoptose untersucht. Biologische Korrelate wie Genexpression, intrazelluläres Ca2+ und mitochondriales Membranpotenzial wurden untersucht, um den apoptotischen Mechanismus zu bewerten.
Ergebnisse: Die Einleitung der Apoptose wurde bei fünf schwach bis mäßig invasiven Krebszelllinien beobachtet, darunter Ishikawa, RL95-2, KLE, AN3CA und SKUT1B, während die Behandlung keine Auswirkungen auf nicht krebsartige 293T-Zellen hatte. Zwei stark invasive Endometriumadenokarzinom-Zelllinien, HEC1A und HEC1B, erwiesen sich als resistent gegen DCA-induzierte Apoptose. Apoptotisch reagierende Zelllinien wiesen einen signifikanten Anstieg der frühen und späten Apoptose, eine Abnahme des mitochondrialen Membranpotenzials und eine verringerte Survivin-Transkriptionshäufigkeit auf, was auf einen mitochondrial regulierten Mechanismus hindeutet. Die DCA-Behandlung verringerte den intrazellulären Kalziumspiegel in den meisten apoptotisch reagierenden Zelllinien, was auf einen Beitrag des NFAT-Kv1.5-vermittelten Weges hindeutet. Die DCA-Behandlung erhöhte die Transkripte des hochregulierten Apoptosemodulators p53 (PUMA) in Zelllinien mit apoptotischer Reaktion, was auf einen p53-PUMA-vermittelten Mechanismus hindeutet.
Schlüsselwörter: Dichloroacetat; Endometrium; Krebs; Apoptose; Mitochondrien
Erklärung zu Interessenkonflikten: Die Autoren erklären, dass es keine Interessenkonflikte gibt.
Schlussfolgerungen: Dichloracetat sensibilisiert die meisten Endometriumkarzinom-Zelllinien über mitochondriale, NFAT-Kv1.5 und PUMA-vermittelte Mechanismen wirksam für Apoptose. Eine weitere Untersuchung des krebstherapeutischen Potenzials von DCA ist gerechtfertigt.
MMP wird durch TMRM-Fluoreszenzfärbung in einem DCA-Dosis-Wirkungs-Experiment weiter bestätigt. Die Fehlerbalken stellen Standardfehler von 2 unabhängigen Experimenten dar, die in dreifachen Vertiefungen durchgeführt wurden.
EINFÜHRUNG
Endometriumkarzinom (EC) ist eine Neoplasie der epithelialen Auskleidung des Uteruskorpus. Es ist die häufigste gynäkologische Malignität in den Vereinigten Staaten und die vierthäufigste Krebstodesursache bei Frauen in diesem Land [1]. Für Patientinnen mit rezidivierendem oder metastasierendem Endometriumkarzinom gibt es nur wenige therapeutische Optionen ohne schwerwiegende Nachteile. Die Chemotherapie bei metastasierten Erkrankungen weist eine hohe Rate an Toxizität, Neuralgien und kardialen Komplikationen auf[2, 3]. Bei der Entwicklung künftiger Krebstherapien wird es darauf ankommen, schwerwiegende unerwünschte Wirkungen zu verringern und gleichzeitig eine vergleichbare oder bessere Wirksamkeit als bei bestehenden Behandlungen zu zeigen.
Die aerobe Glykolyse, auch als „Warburg-Effekt“ bekannt, ist eine einzigartige Eigenschaft der meisten Krebsarten. Dieses Phänomen ist gekennzeichnet durch eine erhöhte Glukoseaufnahme und die Abhängigkeit von der Glykolyse zur ATP-Produktion trotz einer verfügbaren Sauerstoffquelle [5]. Man geht davon aus, dass die aerobe Glykolyse eine Folge der mitochondrialen Dysfunktion ist, die Krebszellen eine apoptotische Resistenz verleiht [6]. Diese apoptotische Resistenz ist auf eine Hyperpolarisierung der Mitochondrienmembran zurückzuführen, die die Freisetzung von pro-apoptotischen Mediatoren aus den Mitochondrien in das Zytoplasma verhindert [4]. Hyperpolarisierte Mitochondrienmembranen sind für die meisten Karzinome charakteristisch, und ihre Umkehrung ist mit der Einleitung der Apoptose verbunden [7,8].
Die gezielte therapeutische Beeinflussung der aeroben Glykolyse ist ein neues Mittel, um Krebszellen zu bekämpfen. Der wichtigste Regulator des zellulären Stoffwechsels ist die Pyruvatdehydrogenase (PDH), die ihrerseits durch die Pyruvatdehydrogenase-Kinase (PDK) gehemmt wird. Eine kürzlich durchgeführte Studie zeigte, dass die PDK-Aktivität in Krebszelllinien durch DCA herunterreguliert werden kann [4]. Die gezielte Beeinflussung des Stoffwechsels durch DCA beinhaltet zwei synergistische Mechanismen, den proximalen und den distalen Weg [4]. Im proximalen (mitochondrial-regulierten) Weg bindet DCA an PDK und schwächt die Hemmung der PDH-Aktivität ab. Die erhöhte PDH-Aktivität verlagert den Stoffwechsel von der Glykolyse zur Glukoseoxidation und verringert die Hyperpolarisation des mitochondrialen Membranpotenzials (MMP), wodurch mitochondriale Übergangsporen (MTPs) geöffnet werden. Dies ermöglicht die Verlagerung von reaktiven Sauerstoffspezies (ROS) und Cytochrom c aus den Mitochondrien in das Zytoplasma, wodurch die Apoptose durch die Aktivierung von Caspasen ausgelöst wird [4]. Im distalen Weg (NFAT-Kv1.5) erweitern die translozierten ROS die Kv1.5-Kalium-Ionenkanäle an der Plasmamembran. Durch den Ausstoß von Kaliumionen wird die Zelle hyperpolarisiert und der spannungsabhängige Ca2+-Eintrag verhindert. Der verringerte intrazelluläre Ca2+-Spiegel hemmt die Aktivierung von NFAT, was die Kv1.5-Expression weiter steigert; so entsteht eine positive Rückkopplungsschleife, die letztlich zu einer verringerten tonischen Hemmung der Caspasen führt [4].
Zwischen den mitochondrialen und den p53-vermittelten Apoptosewegen gibt es erhebliche Wechselwirkungen. PUMA ( p53-upregulatedmodulator of apoptosis) ist ein solches pro-apoptotisches Protein, das die Interaktion zwischen mitochondrialen und p53-vermittelten Tumorsuppressor-Mechanismen überbrückt. PUMA gehört zur BH3-Familie von Proteinen, deren Expression durch p53 transkriptionell reguliert wird [9-11]. Nach Aktivierung durch verschiedene apoptotische Stimuli transloziert PUMA zur mitochondrialen Membran, wo es durch Bindung an seine BH3-Domäne die überlebensfördernden Bcl-2-Proteine antagonisiert, die Freisetzung von Cytochrom c induziert und die Apoptose fördert [10,12]. In jüngsten Knock-out-Studien wurde PUMA als kritischer Vermittler der p53-abhängigen Apoptose in Thymozyten der Maus und in menschlichen Darmkrebszellen nachgewiesen [13,14].
Dichloracetat hat in zahlreichen Studien gezeigt, dass es die Glukoseoxidation bei verschiedenen mitochondrialen Störungen fördert [15,16]. Darüber hinaus wurde festgestellt, dass die DCA-Behandlung in klinischen Studien zu mitochondrialen Enzephalomyopathien mildere Nebenwirkungen hat als die derzeitigen Therapien gegen Gebärmutterhalskrebs [17]. Bislang wurde die Wirkung von DCA nur an einer begrenzten Anzahl von Krebszelllinien untersucht, und unser Verständnis der alternativen apoptotischen Mechanismen, die durch DCA reguliert werden, ist unzureichend. Ziel unserer Studie war es, festzustellen, ob DCA eine Reihe von Endometriumkarzinom-Zelllinien für die Apoptose sensibilisiert, und den Beitrag der durch die Mitochondrien regulierten Mechanismen NFAT-Kv1.5 und PUMA zum apoptotischen Prozess zu bewerten, indem biologische Korrelate untersucht werden.
Materialien und Methoden
Zellkultur
Die Zelllinien AN3CA, SKUT1B, RL95-2, KLE, HEC1A und HEC1B wurden von American Type Culture Collection (Manassas, VA) und die Ishikawa-Zelllinie von Sigma-Aldrich (St. Louis, MO) erworben. Die 293T-Nierenepithelzellen, die als gesunde, nicht an Krebs erkrankte Kontrollen dienten, wurden von Nikhil Munshi zur Verfügung gestellt. MCF7 Brustepithel-Adenokarzinom war ein Geschenk von Ramon Parsons (Columbia University). Die Zelllinien wurden gemäß den vom Hersteller angegebenen Bedingungen vermehrt. Die Zelllinien wurden in einem 37°C, 5%CO2 befeuchteten Inkubator gehalten. Die Wachstumsmedien DMEM, McCoy’s 5A, MEM und DMEM-F12 sowie Penicillin-Streptomycin und Insulin wurden von Gibco-Invitrogen (Carlsbad, CA) bezogen. Dichloracetat (Alfa Aesar, Ward Hill, MA) wurde zu einer 1M-Arbeitslösung aufgelöst, filtriert und anschließend in den Wachstumsmedien zu Behandlungskonzentrationen verdünnt.
Zellviabilitätstest
Die Zellviabilität wurde mit dem CellTiter-Blue-Reagenz (Promega) gemessen, das die Fähigkeit gesunder, lebensfähiger Zellen misst, ein Resazurin-Substrat zu einem fluoreszierenden Resorufin-Produkt zu metabolisieren. Kurz gesagt wurden 3×104 Zellen jeder Zelllinie in undurchsichtige 96-Well-Gewebekulturplatten plattiert und über Nacht unter Standardwachstumsbedingungen bis zu einer Konfluenz von 60-70 % bebrütet. Das Medium in jeder Vertiefung wurde dann durch frisches Wachstumsmedium mit steigenden DCA-Konzentrationen (0 mM, 1 mM, 5 mM, 10 mM) ersetzt. Jede Vertiefung wurde in dreifacher Ausführung in zwei oder mehr unabhängigen Experimenten für jede Zelllinie durchgeführt. Nach der Behandlung wurden die Platten 40 Stunden lang bei 37 °C bebrütet. Danach wurden 20 µL Resazurin-Substrat direkt in jede Vertiefung gegeben und weitere 3 Stunden lang bebrütet. Die Platten wurden dann mit einem Molecular Devices Gemini XPS-Plattenlesegerät (Sunnyvale, CA) bei 560/590 nm abgelesen.
Apoptose-Assays
Mit Hilfe der Durchflusszytometrie mit Annexin-V-FITC (BD Bioscience, San Jose, CA) und 7-Amino-Actinomycin D (7-AAD) wurde ermittelt, ob die Behandlung spezifisch eine frühe Apoptose auslöst. Kurz gesagt wurden für jede Zelllinie 5×105 Zellen in 6-Well-Gewebekulturplatten ausgesät und über Nacht unter Standardwachstumsbedingungen bis zu einer Konfluenz von 60-70 % inkubiert. Anschließend wurde das Medium für jede Zelllinie durch frisches Wachstumsmedium mit und ohne eine 10 mM-Dosis DCA ersetzt. Die Behandlungsgruppen wurden für jede Zelllinie dreimal wiederholt. Die Zellen wurden dann 40 Stunden lang bei 37 °C inkubiert und mit 0,25 % Trypsin-EDTA (Invitrogen, Carlsbad, CA) geerntet. Die Zellen wurden mit 1X PBS gewaschen und anschließend gemäß dem Protokoll des Herstellers gefärbt. Die Durchflusszytometrie wurde mit einem BD FACSCanto II (BD Bioscience) durchgeführt und die Daten wurden mit FlowJo 7.2.2 (Tree Star, Ashland, OR) und BD FACSDiva 6.0 Software (BD Bioscience) analysiert.
Das Apoptag Peroxidase Terminal dUTP Nick-end Labeling (TUNEL)-Assay-Kit (Millipore, Billerica, MA) wurde verwendet, um apoptotische Zellen, die eine Caspase-abhängige Genomfragmentierung durchlaufen hatten, sichtbar zu machen. Kurz gesagt, wurden 5×104 Zellen verschiedener repräsentativer Endometriumkrebs-Zelllinien ausgesät und über Nacht auf 4-Well-Kammer-Objektträgern (Nunc, Rochester, NY) vermehrt. Die Medien in jeder Vertiefung wurden dann durch frische Wachstumsmedien mit oder ohne 10 mM DCA ersetzt. Nach 48 Stunden wurden die Zellen mit 1 % Paraformaldehyd fixiert und gemäß dem Herstellerprotokoll gefärbt. Die Färbung wurde von der Dana Farber – Harvard Cancer Center Pathology Core Facility durchgeführt. Die Bilder wurden mit einem 40X Objektiv auf einem Zeiss Axioskop 2 Plus Mikroskop (Thornwood, NY) unter Verwendung der AxioVs40 v.4.4.1.0 Software bei 24-bit RGB aufgenommen.
Zellproliferationstest
Zur Messung der Zellproliferation wurde die Durchflusszytometrie mit Bromdesoxyuridin (BrdU) (BD Bioscience) und 7-AAD-Färbung eingesetzt. Kurz gesagt wurden mehrere repräsentative Endometriumkarzinom-Zelllinien wie oben für den Annexin-V-Assay beschrieben vermehrt. Die Zellen wurden dann 8 Stunden lang in einem Wachstumsmedium mit 0,5 % FBS serumfrei gehalten, um den Zellzyklus in die G0-Phase zurückzusetzen. Anschließend wurde das Medium durch normales Wachstumsmedium mit und ohne 10 mM DCA-Behandlung ersetzt. Nach 24 Stunden wurden die Zellen 2 Stunden lang mit 10 µM BrdU in Wachstumsmedium gepulst. Anschließend wurden die Zellen geerntet, angefärbt und gemäß dem Protokoll des Herstellers analysiert.
Assays zum mitochondrialen Membranpotenzial
Das mitochondriale Membranpotenzial wurde mit dem Mitocapture Apoptosis Detection Kit (Calbiochem) nachgewiesen. Wachstum, Behandlung und Versuchsaufbau der Zelllinien waren identisch mit dem oben beschriebenen Annexin-V-Assay. Nach einer 24-stündigen Inkubationszeit im Anschluss an die Behandlung mit und ohne 10 mM DCA wurden die Zellen geerntet, mit 1X PBS gewaschen und mit dem Mitocapture-Reagenz gemäß dem Herstellerprotokoll gefärbt und mittels Durchflusszytometrie analysiert. Eine modifizierte Version eines Protokolls, bei dem Mitochondrien mit Tetramethylrhodaminmethylester (TMRM) (Invitrogen, Carlsbad, CA) angefärbt wurden, wie an anderer Stelle beschrieben, wurde ebenfalls zur Bewertung der MMP [18]. Kurz gesagt, die Zellen wurden vermehrt und genauso behandelt wie bei dem oben beschriebenen Zelllebensfähigkeitstest. Nach einer 24-stündigen Inkubationszeit wurden 5×104 Zellen isoliert, in 1X PBS gewaschen und in Hanks gepufferter Salzlösung (HBSS) (Sigma-Aldrich, St. Louis, MA) mit 50 nM TMRM resuspendiert und 30 Minuten lang bei 37 °C inkubiert. Die Zellen wurden in eine undurchsichtige 96-Well-Platte überführt, und die Fluoreszenz wurde bei 530/620 nm bei 37°C mit einem Plattenlesegerät gemessen.
Intrazelluläre Kalziumspiegel
Intrazelluläre Kalziumspiegel wurden mit dem FLUO-4 NW Kalzium Assay (Invitrogen) gemessen. Kurz gesagt, wurden 3×104 Zellen für jede Zelllinie auf einzelne undurchsichtige 96-Well-Gewebekulturplatten plattiert und 8 Stunden lang unter Standard-Wachstumsbedingungen bebrütet. Anschließend wurde das Medium in jeder Vertiefung durch frisches Wachstumsmedium mit steigenden DCA-Konzentrationen ersetzt. Jede Behandlungsgruppe wurde in 4 Vertiefungen in mindestens 2 unabhängigen Experimenten repliziert. Nach der 8-stündigen Inkubation wurden die Zellen in jeder Vertiefung mit dem FLUO-4-Reagenz gemäß dem Protokoll des Herstellers behandelt. Die Platten wurden dann mit einem Fluoreszenz-Plattenlesegerät bei 494/516 nm abgelesen.
Real Time PCR
Mit Hilfe der quantitativen Echtzeit-PCR wurde die Abundanz der endogenen Survivin- und PUMA-Transkripte ermittelt. Für jede Zelllinie wurden insgesamt 1×106 Zellen ausgesät und über Nacht in 10 cm großen Gewebekulturplatten gezüchtet. Das Medium wurde dann durch frisches Wachstumsmedium mit oder ohne 10 mM DCA-Behandlung ersetzt. Nach einer Inkubationszeit von 40 Stunden wurden 3×106 Zellen pro Platte geerntet und die gesamte RNA wurde mit dem RNeasy Plus Mini Kit (Qiagen, Valencia, CA) gemäß dem Herstellerprotokoll extrahiert. Die Erststrang-cDNA wurde mit 1000 ng Gesamt-RNA und Oligo dT-Primern unter Verwendung von Superscript III Reverse Transcriptase (Invitrogen) gemäß dem Herstellerprotokoll synthetisiert. Das cDNA-Produkt wurde dann 20 Minuten lang bei 37 °C mit RNase H behandelt und auf 100 ng/µl verdünnt. Die Konzentrationen von RNA und cDNA wurden mit einem Nanodrop ND-1000 Spektralphotometer (Wilmington, DE) genau bestimmt.
Die Primersequenzen für Survivin waren vorwärts 5′-AAGAACTGGCCCTTCTTGGA-3′ und rückwärts 5′- CAACCGGACGAATGCTTT-3′ (Primerbank). Die Primersequenzen für PUMA und das RPLP0-Hauskeeping-Gen wurden in früheren Studien beschrieben [19, 20]. Die Reaktionsmischungen bestanden aus 1X Applied Biosystems SYBR Green PCR-Mix (Foster City, CA), 1,5 mM MgCl2, 0,42 mM dNTPs, 5U ABI Amplitaq Gold, 200 ng cDNA-Vorlage und 333 nM Vorwärts- und Rückwärtsprimer. Die Reaktionen wurden in dreifacher Ausführung in zwei Replikatversuchen durchgeführt. Die Zyklusbedingungen waren 1 Zyklus bei 95C für 10:00, 33x Zyklen von 95C für 0:30, 55C für 0:30 und 72C bei 0:30. Eine Fünf-Punkte-Standardkurve für die Reaktionen hatte lineare Steigungen von -3,2 +/- 0,1 mit Korrelationskoeffizienten(r2) über 0,985. Der Assay wurde mit einem ABI 7300 Real-Time PCR System (Foster City, CA) durchgeführt. Die relative Quantifizierung der Ziel-Transkripte, normalisiert auf RPLP0, wurde mit der ABI 7300 Real-Time PCR Systems RQ Study Software unter Verwendung der vergleichenden Ct-Methode bewertet.
Statistische Analyse
Student’s t-test und One-way ANOVA wurden verwendet, um die Unterschiede zwischen den Behandlungsarmen zu bewerten. Ein p-Wert unter 0,05 wurde als signifikant angesehen. Die Analyse wurde mit Microsoft Excel 2007 (Redmond, WA) durchgeführt. Die Diagramme wurden mit GraphPad Prism 5 (San Diego, CA) erstellt.
Ergebnisse
DCA reduziert die Lebensfähigkeit von Endometriumkarzinomzellen in einer dosisabhängigen Weise
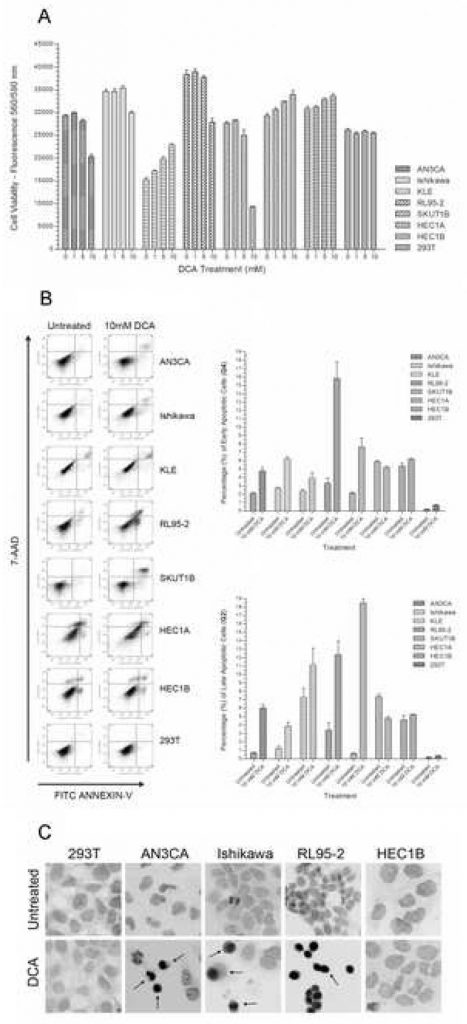
Um die Wirkung von DCA auf die Lebensfähigkeit von Endometriumkarzinomzellen zu bestimmen, wurde jede Zelllinie mit steigenden DCA-Dosen in Kultur gehalten. In einer Gruppe von sieben Endometriumkarzinom-Zelllinien sank die Lebensfähigkeit von AN3CA, Ishikawa, RL95-2 und SKUT1B mit zunehmender DCA-Konzentration um 15 bis 75 % (Abbildung 1A). Die Verringerung der Lebensfähigkeit der meisten reagierenden Zelllinien erreichte bei der 10 mM-Dosis einen signifikanten Wert. Ein Vergleich zwischen der unbehandelten Gruppe und der mit 10 mM DCA behandelten Gruppe ergab p-Werte < 0,01 für AN3CA, Ishikawa, RL95-2 und SKUT1B. Eine geringfügig signifikante Abnahme der Lebensfähigkeit wurde bei der 5-mM-Dosis für AN3CA und RL95-2 festgestellt. Daher wurde eine ungefähre wirksame Minimaldosis von DCA für diese Endometriumzelllinien für den Behandlungszeitraum zwischen 5 und 10 mM bestimmt. Diese DCA-Dosis-Konzentration und Behandlungsdauer liegt innerhalb des effektiven Bereichs früher veröffentlichter In-vitro-Experimente [21]. Bei HEC1A, HEC1B und KLE wurde ein statistisch signifikanter Anstieg der Lebensfähigkeit mit steigender DCA-Konzentration beobachtet (p < 0,02). Bei den 293T-Epithelzellen wurde erwartungsgemäß kein statistisch signifikanter Unterschied in der Lebensfähigkeit bei dem gegebenen DCA-Dosisbereich und Behandlungszeitraum festgestellt (p = 0,27).
Die Wirkung von DCA auf die Zellproliferation von Endometriumkarzinomen ist zelllinienabhängig
Um festzustellen, ob die beobachtete Abnahme der Zelllebensfähigkeit bei DCA-Behandlung auf einen Zellproliferationseffekt zurückzuführen ist, wurde eine BrdU/7-AAD-Färbung an mehreren repräsentativen Zelllinien durchgeführt und mittels Durchflusszytometrie analysiert. Bei Ishikawa-, HEC1B- und 293T-Epithelzellen wurde bei der Behandlung mit DCA kein signifikanter Unterschied in der Zellzyklusdynamik oder Proliferation festgestellt (Tabelle 1). Bei AN3CA steigerte die Behandlung mit DCA die Proliferation, was sich in einer signifikanten Zunahme der Anzahl der Zellen in den Phasen S und G2/M und einer geringeren Anzahl von Zellen in G0/G1 zeigte. Bei RL95-2-Zellen führte die Behandlung mit DCA zu einer signifikanten Verringerung des Anteils der Zellen in der S- und G2/M-Phase und zu einem Anstieg der Zellen in der G0/G1-Phase; dies deutet auf eine verringerte Proliferation und einen Zellzyklus-Stillstand entweder in einem seneszenten oder ruhenden Zustand hin.
| Zelllinie / Behandlung | % S-Phase | Stdev S-Phase | % G0 / G1 Phase | Stdev G0/G1 | % G2 / M Phase | Stdev G2 / M Phase |
|---|---|---|---|---|---|---|
| 293T Unbehandelt | 60.6 | 0.6 | 33.2 | 1.7 | 6.2 | 1.25 |
| 293T DCA | 58.1 | 2.2 | 31.7 | 2.2 | 10.2 | 0.34 |
| p-wert | 0.15 | 0.14 | 0.03 | |||
| Ishikawa Unbehandelt | 61.3 | 0.4 | 27.4 | 1.8 | 11.3 | 0.96 |
| Ishikawa DCA | 65.9 | 4.5 | 22.9 | 4.9 | 11.2 | 0.68 |
| p-wert | 0.21 | 0.25 | 0.96 | |||
| HEC1B Unbehandelt | 37.4 | 2.7 | 41.5 | 0.8 | 21.2 | 1.93 |
| HEC1B DCA | 42.4 | 1.5 | 34.8 | 3.6 | 22.8 | 2.15 |
| p-wert | 0.19 | 0.08 | 0.47 | |||
| AN3CA Unbehandelt | 43.5 | 0.6 | 50.6 | 2.0 | 5.9 | 1.80 |
DCA fördert die Apoptose in Endometriumkrebszellen
Um festzustellen, ob die Verringerung der Lebensfähigkeit der Zellen durch die DCA-Behandlung auf Apoptose und nicht auf Nekrose zurückzuführen ist, wurde eine Annexin-V-FITC- und 7-AAD-Zellfärbung durchgeführt und mittels Durchflusszytometrie analysiert. Bei AN3CA, Ishikawa, KLE, RL95-2 und SKUT1B wurde ein signifikanter Anstieg der frühen apoptotischen Zellen um 50 % bis 325 % festgestellt (Abbildung 1B). Ein signifikanter Anstieg wurde auch bei den spät apoptotischen Zellen dieser Zelllinien beobachtet (Abbildung 1B). RL95-2 wies den größten Anstieg der frühen apoptotischen Zellen auf, während KLE den geringsten signifikanten Anstieg verzeichnete. Der erhöhte Anteil an späten apoptotischen Zellen in KLE war statistisch nicht signifikant. Bei der Behandlung von HEC1B-Zellen wurde kein Unterschied im Prozentsatz der frühen und späten apoptotischen Zellen festgestellt, während bei HEC1A-Zellen ein leicht signifikanter Rückgang der apoptotischen Zellen zu verzeichnen war. Bei der Zelllinie 293T wurde durch die DCA-Behandlung keine Apoptose ausgelöst, und der leichte Anstieg des Anteils apoptotischer Zellen war nicht signifikant (p=0,08).
Da der Annexin-V-Assay in erster Linie zum Nachweis der frühen Apoptose verwendet wird, wurde an mehreren repräsentativen Endometriumkrebs-Zelllinien ein TUNEL-Assay durchgeführt, um das Fortschreiten der späten Apoptose qualitativ zu bestätigen, indem die Caspase-abhängige DNA-Fragmentierung sichtbar gemacht wurde. In Übereinstimmung mit dem quantitativen Annexin-V-Assay wurde ein Anstieg der TUNEL-positiven apoptotischen Zellen bei AN3CA, Ishikawa und RL95-2 beobachtet (Abbildung 1C). Bei HEC1B- und 293T-Zellen wurde bei einer Behandlung mit 10 mM DCA kein sichtbarer Unterschied bei den TUNEL-positiven Zellen festgestellt.
Um festzustellen, ob die Wachstumsrate die Empfindlichkeit der Endometriumkarzinom-Zelllinien gegenüber der DCA-Behandlung beeinflusst, wurden ein Apoptose-Responder und ein Non-Responder (Ishikawa bzw. HEC1A) unter Serumentzug mit 0,5 % FBS gezüchtet, was die Zellen in die G0-Phase zurücksetzt und die Proliferation behindert. Der Serumentzug hatte keinen Einfluss auf den Anteil der frühen apoptotischen Zellen in den behandelten Ishikawa-Zellen im Vergleich zu normalen Wachstumsbedingungen. Der Prozentsatz der frühen apoptotischen Zellen stieg von 3,17 % +/- 0,21 % SD in unbehandelten auf 6,20 % +/- 1,04 % SD p=0,05 in behandelten Ishikawa-Zellen, was den Ergebnissen unter normalen Wachstumsbedingungen entsprach. Der Prozentsatz der spät apoptotischen Ishikawa-Zellen stieg von 1,07% +/- 0,15% SD in den unbehandelten auf 3,57% +/- 0,49% SD p=0,02 in den behandelten Zellen. Bei der HEC1A-Zelllinie gab es keinen signifikanten Unterschied zwischen frühen und späten apoptotischen Zellen. Der Prozentsatz der frühen apoptotischen HEC1A-Zellen betrug 3,73 % +/- 0,51 % SD für unbehandelte und 1,93 % +/- 0,60 SD p=0,07 für behandelte Zellen. Der Prozentsatz der späten apoptotischen HEC1A-Zellen lag bei 3,60% +/- 0,69% SD für unbehandelte und 4,90% +/- 1,37 SD p=0,25 für behandelte Zellen.
Apoptose wird durch verringerte intrazelluläre Kalziumspiegel vermittelt
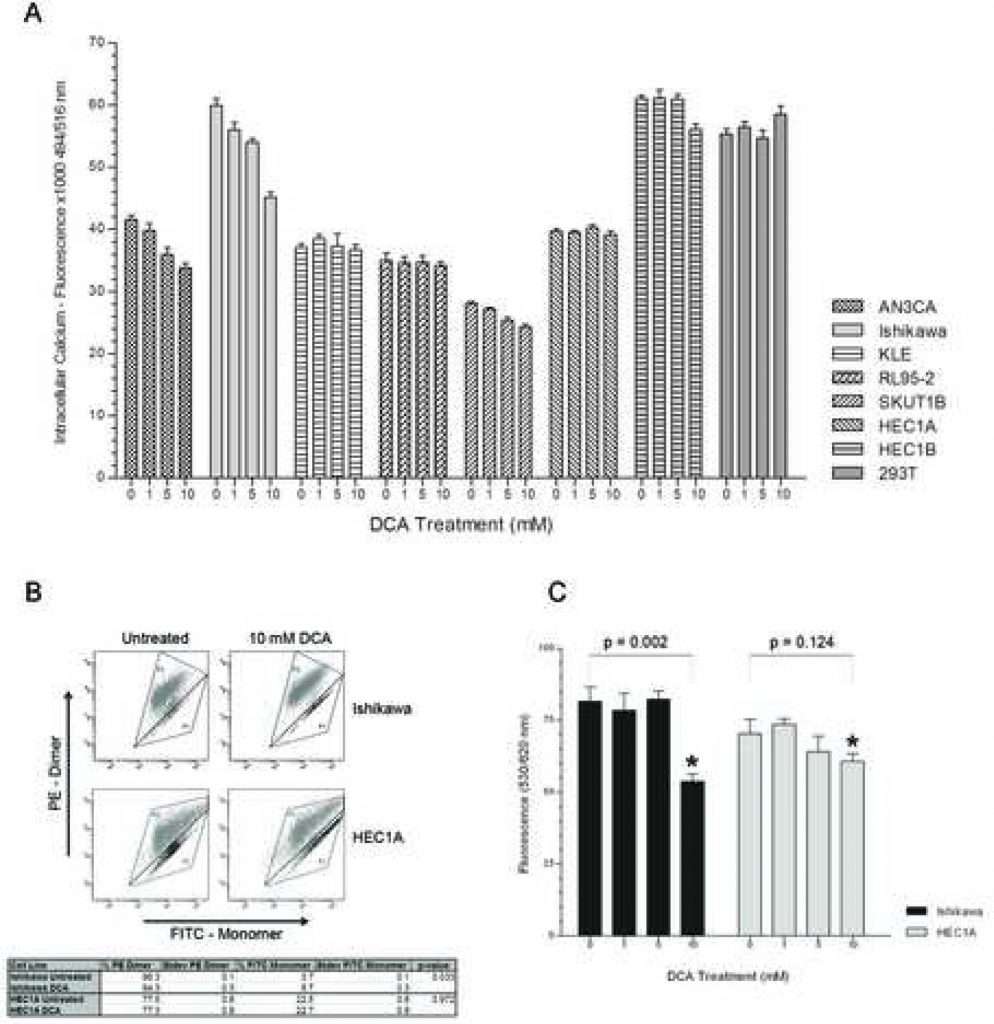
Um festzustellen, ob der distale NFAT-Kv1.5-Signalweg zur Förderung der Apoptose durch DCA beiträgt, wurde ein Dosis-Wirkungs-Experiment durchgeführt, um die intrazellulären Ca2+-Spiegel zu ermitteln. Bei AN3CA, Ishikawa und SKUTB sank der intrazelluläre Kalziumspiegel mit steigender DCA-Dosis (Abbildung 2A). Der Rückgang des intrazellulären Kalziums in diesen Zelllinien erreichte ein signifikantes Niveau bei einer Konzentration von 5 mM DCA mit p < 0,03 für AN3CA, Ishikawa und SKUT1B. Bei der KLE-Zelllinie, die die mildeste apoptotische Reaktion zeigte, sank der Kalziumspiegel mit zunehmender DCA-Konzentration nur geringfügig. Interessanterweise wurde bei RL95-2, das die stärkste apoptotische Reaktion zeigte, kein Unterschied in den intrazellulären Kalziumspiegeln zwischen den Dosen festgestellt. HEC1A, das zuvor keine apoptotische Reaktion zeigte, wies in der Tat bei keiner Behandlungskonzentration einen Unterschied im intrazellulären Kalziumspiegel auf. Bei HEC1B gab es ebenfalls keinen Unterschied in den Kalziumspiegeln zwischen den Behandlungsgruppen mit 0, 1 und 5 mM DCA, und bei der Behandlung mit 10 mM wurde nur ein leichter Rückgang beobachtet. Bei 293T gab es keinen Unterschied im intrazellulären Kalziumspiegel mit steigender DCA-Konzentration.
DCA-Behandlung reduziert die Hyperpolarisierung der mitochondrialen Membran in Endometriumkrebszellen, die Apoptose erleiden
Um zu beurteilen, ob DCA über einen mitochondrial regulierten Mechanismus zur Auslösung der Apoptose beiträgt, wurden die MMP eines Apoptose-Responders und eines Non-Responders (Ishikawa bzw. HEC1A) mit und ohne Behandlung mittels FACS-Analyse gemessen. Das MitoCapture-Reagenz ist ein kationischer Farbstoff, der sich je nach Ausmaß des elektrischen Transmembranpotenzials der Mitochondrien als grün emittierendes Monomer im Zytoplasma oder als rot emittierendes Dimer in hyperpolarisierten Mitochondrien von Krebszellen anreichert [22, 23]. Die DCA-Behandlung der Ishikawa-Zelllinie verringerte den Anteil der bei 575 nm rot gefärbten Zellen und erhöhte den Anteil der bei 525 nm grün gefärbten Zellen, was mit der apoptotischen Reaktion auf die Behandlung übereinstimmt (Abbildung 2B). Die DCA-Behandlung der HEC1A-Zelllinie hatte keinen Einfluss auf den Anteil der rot und grün gefärbten Zellen. Darüber hinaus wiesen unbehandelte HEC1A-Zellen einen geringeren Anteil an rot gefärbten Zellen mit hyperpolarisierten Mitochondrienmembranen auf als Ishikawa-Zellen (77,5 % +/- 0,6 % SD vs. 96,3 % +/- 0,1 % SD, p < 0,01). Es gab keinen Unterschied in der MMP der 293T-Kontrolle ohne Krebs bei der Behandlung (Daten nicht gezeigt). Die DCA-Modulation der MMP wurde durch TMRM-Färbung in einem Dosis-Wirkungs-Experiment bestätigt. Die MMP von Ishikawa-Zellen nahm bei einer DCA-Dosis von 10 mM signifikant ab (Abbildung 2C). Bei der MMP von HEC1A-Zellen gab es bei keiner Behandlungskonzentration einen signifikanten Unterschied.
DCA verringert die Survivin-Expression
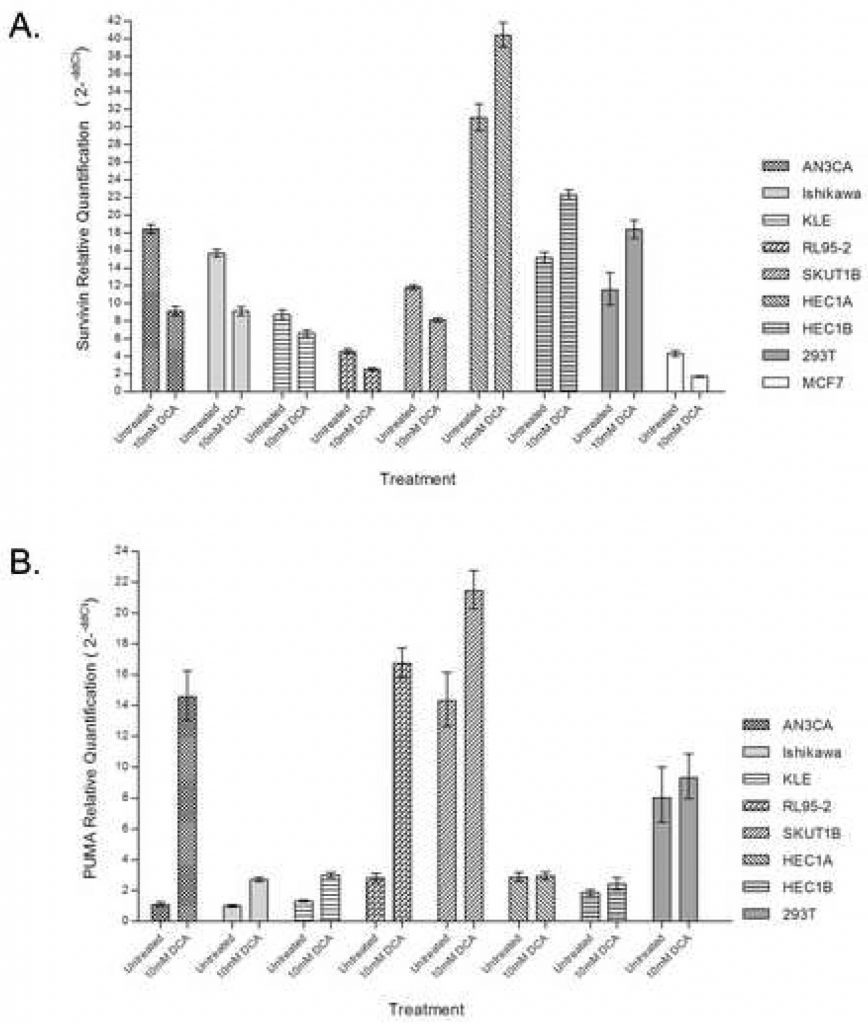
Um den Beitrag des proximalen, durch die Mitochondrien regulierten Weges zur apoptotischen Reaktion weiter zu bestätigen, wurde die quantitative Echtzeit-PCR zur Bewertung der Survivin-Expression mit und ohne DCA-Verabreichung verwendet. Die Behandlung von Endometriumkarzinom-Zelllinien mit DCA führte zu einer 25- bis 50-prozentigen Abnahme der Survivin-mRNA-Häufigkeit in Zellen, die eine apoptotische Reaktion zeigten, darunter AN3CA, Ishikawa, KLE, RL95-2 und SKUT1B (Abbildung 3A). RL95-2, das den größten Anstieg früh apoptotischer Zellen bei der Behandlung aufwies, hatte auch die geringste endogene Survivin-Transkriptmenge. HEC1A und HEC1B, die zuvor keine apoptotische Reaktion auf DCA zeigten, wiesen bei der Behandlung einen Anstieg der Survivin-Transkripte um 20-30 % auf. HEC1A wies die größte endogene Survivin-Transkriptabundanz auf. Die 293T-Kontrolle zeigte ebenfalls eine erhöhte Transkriptabundanz bei DCA-Behandlung.
DCA erhöht die PUMA-Expression
Um den Beitrag des PUMA-Signalwegs zur DCA-induzierten Apoptose zu bestimmen, wurde die PUMA-Transkriptionshäufigkeit mit und ohne DCA-Verabreichung mittels quantitativer Echtzeit-PCR untersucht. Die Behandlung von Endometriumkarzinom-Zelllinien mit DCA führte zu einem dramatischen Anstieg der PUMA-mRNA-Häufigkeit in Zelllinien, die eine apoptotische Reaktion zeigten, darunter AN3CA, Ishikawa, KLE, RL95-2 und SKUT1B (Abbildung 3B). Das größte Ausmaß der PUMA-Induktion wurde in AN3CA- und RL95-2-Zellen beobachtet, die einen 14- bzw. 6-fachen Anstieg aufwiesen. HEC1A und HEC1B, die zuvor keine apoptotische Reaktion auf DCA gezeigt hatten, zeigten keinen Unterschied in der Menge des PUMA-Transkripts bei der Behandlung. In 293T-Zellen wurde bei der Behandlung kein Unterschied in der Menge des PUMA-Transkripts festgestellt.
Diskussion
In dieser Studie konnten wir zeigen, dass der durch DCA induzierte Tod von Endometriumkrebszellen durch zwei Hauptmechanismen reguliert wird: den durch Mitochondrien regulierten und den NFAT-Kv1.5-Weg. Darüber hinaus haben wir gezeigt, dass DCA die Lebensfähigkeit von Endometriumkrebszellen dosisabhängig durch die Förderung der Apoptose reduziert, während es auf nicht krebsartige 293T-Zellen keine Wirkung hat. Schließlich zeigen wir, dass die DCA-Behandlung das Überleben von Endometriumkrebszellen durch mehrere molekulare Mechanismen beeinflusst, einschließlich der Regulierung des mitochondrialen Membranpotenzials, des intrazellulären Ca2+-Spiegels, des Verlusts der Survivin-Expression und der PUMA-Induktion.
Die pro-apoptotische Reaktion von AN3CA, Ishikawa und SKUT1B auf DCA korrelierte mit einer dosisabhängigen Abnahme des intrazellulären Ca2+-Spiegels, was auf die Beteiligung des NFAT-Kv1.5-Mechanismus hinweist. Im Vergleich dazu zeigten RL95-2 (mit der stärksten apoptotischen Reaktion auf DCA) und KLE (mit der geringsten apoptotischen Reaktion) bei keiner Behandlungskonzentration einen Unterschied im intrazellulären Ca2+-Spiegel, was darauf hindeutet, dass der NFAT-Kv1.5-Mechanismus nicht am apoptotischen Mechanismus dieser Zelllinien beteiligt ist. Stattdessen brachte die DCA-Behandlung die RL95-2-Zellen in der G0/G1-Phase des Zellzyklus zum Stillstand, einem Kennzeichen der p53-Aktivierung, induzierte stark die RL95-2-PUMA-Expression und verringerte die Expression von Survivin, einem Protein, das eine entscheidende Rolle bei der Regulierung des Zellzyklus spielt. [29].
Survivin ist ein transkriptionsgesteuerter Apoptose-Inhibitor, der als Reaktion auf gestörte MMP aus den Mitochondrien ins Zytoplasma entlassen wird, wo er die Caspase-Aktivierung verhindert, die Apoptose hemmt und die Tumorprogression fördert [26, 27]. Frühere Studien haben eine positive Korrelation zwischen einer erhöhten Survivin-Expression und dem Tumorgrad von Endometriumkarzinomen gezeigt [27,28]. Wir fanden heraus, dass die Survivin-Transkriptionshäufigkeit in allen Endometriumkarzinom-Zelllinien, die eine apoptotische Reaktion auf DCA zeigten, signifikant abnahm. Unsere Ergebnisse deuten darauf hin, dass der von den Mitochondrien regulierte Signalweg zur apoptotischen Reaktion in DCA-sensibilisierten Endometriumkarzinom-Zelllinien beiträgt.
Das PUMA-Transkript war in allen Endometriumkrebs-Zelllinien, die eine apoptotische Reaktion auf DCA zeigten, signifikant erhöht. Das Ergebnis könnte auf einen Beitrag des p53-PUMA-Signalwegs mit den mitochondrialen und Ionenkanalmechanismen zur DCA-induzierten Apoptose hinweisen. Die verstärkte PUMA-Expression würde der überlebensfördernden Wirkung von Bcl-2 auf die Mitochondrienmembran in den reagierenden Zelllinien entgegenwirken und eine verstärkte Verlagerung apoptotischer Mediatoren aus den Mitochondrien in das Zytoplasma ermöglichen, wodurch eine stärkere Caspase-Aktivierung und Apoptose gefördert würde.
Zwei Zelllinien, HEC1A und HEC1B, die beide stark invasiv sind, eine erhöhte Arzneimittelresistenz aufweisen und einen höheren Tumorgrad [24] im Vergleich zu den anderen Endometriumzelllinien, waren resistent gegen DCA. Tatsächlich zeigten beide Zelllinien eine erhöhte Survivin-Expression, eine PUMA-Expression, die durch die DCA-Behandlung nicht beeinflusst wurde, und einen geringeren Anteil von Zellen mit hyperpolarisierten Mitochondrienmembranen. Diese Ergebnisse deuten auf eine geringere Abhängigkeit von der aeroben Glykolyse hin. Wir überlegten, ob Mutationen in der DCA-Bindungsdomäne des menschlichen PDK2-Proteins die Unterschiede in der Reaktion auf die Behandlung mit HEC1A und HEC1B erklären könnten. Bei der Sequenzanalyse aller Zelllinien wurden jedoch keine Mutationen in den beiden Exons gefunden, die für die mutmaßliche DCA-Bindungsdomäne kodieren (Daten nicht gezeigt).
Zusammenfassend zeigt unsere Studie, dass Dichloracetat die meisten schwach bis mittelmäßig invasiven Endometriumkarzinomzellen wirksam für die Apoptose sensibilisiert. Unsere kollektiven Daten deuten darauf hin, dass die Apoptose auf mitochondriale und NFAT-Kv1.5-vermittelte Wege zurückzuführen ist. Außerdem deuten unsere Daten darauf hin, dass der PUMA-Signalweg an der Förderung der Apoptose durch DCA beteiligt sein könnte. Künftige Untersuchungen sollten sich darauf konzentrieren, ein breiteres Spektrum von Krebszelltypen zu untersuchen und die Mechanismen zu bestimmen, die eine apoptotische Resistenz gegen DCA bewirken. Der potentiell informativste Weg, der in Betracht gezogen werden sollte, ist die funktionelle Charakterisierung der Rolle des PUMA-Signalwegs bei der DCA-induzierten Apoptose.
Ergänzendes Material
| Endometriumkarzinom-Zelllinie | Tumor-Typ | Grad der Differenzierung | Invasivität | p53-Status |
| AN3CA | Epitheliales Adenokarzinom | Undifferenziert (30, 31) | Mäßig (25, 32) | Mutiert (33) |
| KLE | Adenokarzinom | Schlecht differenziert (31, 34, 35) | Mäßig (36) | Mutiert (33) |
| Ishikawa | Epitheliales Adenokarzinom | Gut differenziert (25, 37) | Gering (25) | Mutiert (33) |
| RL95-2 | Epitheliales Karzinom | Mäßig differenziert (31, 35, 38) | Abhängig von der Passagezahl (39) | Mutante (Codon-Deletion) (33) |
| SKUT1B | Mesodermales Leiomyosarkom | Gut differenziert | Mäßig-hoch (40) | k.A |
| HEC1A | Epitheliales Adenokarzinom | Mäßig differenziert (31, 41) | Hoch (25, 42) | Mutiert (33) |
| HEC1B | Epitheliales Adenokarzinom | Mäßig differenziert (31, 41) | Hoch (25, 42) | Mutiert (33) |
Danksagung
Wir danken Dr. John Daley von der Dana Farber HemNeo Flow Cytometry Core Facility für die technische Schulung und Dr. Sabina Signoretti von der Dana Farber – Harvard Cancer Center Pathology Core Facility für die immunhistochemische Unterstützung.
Finanzielle Unterstützung: Dieses Projekt wurde durch die Zuschussnummern CA082838 und CA101501 der National Institutes of Health unterstützt.
REFERENZEN
1 Rose P. Endometriumkarzinom. New England Journal of Medicine. 1996;335(9):640-649. [PubMed] br>2 Ingram SS, Rosenman J, Heath R, Morgan TM, Moore D, Varia M. The predictive value of progesterone receptor levels in endometrial cancer. Int J Radiat Oncol Biol Phys. 1989;17(1):21-27. [PubMed] br>3 Randall ME, Filiaci VL, Muss H, et al. Randomisierte Phase-III-Studie zur Ganzkörperbestrahlung im Vergleich zu Doxorubicin- und Cisplatin-Chemotherapie bei fortgeschrittenem Endometriumkarzinom: eine Studie der Gynecologic Oncology Group. J Clin Oncol. 2006;24(1):36-44. [PubMed] br>4 Bonnet S, Archer SL, Allalunis-Turner J, et al. Eine Mitochondrien-K+-Kanal-Achse ist bei Krebs unterdrückt und ihre Normalisierung fördert die Apoptose und hemmt das Krebswachstum. Krebszelle. 2007;11(1):37-51. [PubMed] br>5 Chen Z, Lu W, Garcia-Prieto C, Huang P. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr. 2007 [PubMed] br>6 Kim JW, Dang CV. Die molekulare Vorliebe von Krebs und der Warburg-Effekt. Cancer Res. 2006;66(18):8927-8930. [PubMed] br>7 Chen LB. Mitochondriales Membranpotential in lebenden Zellen. Annu Rev Cell Biol. 1988;4:155-181. [PubMed] br>8 Heerdt BG, Houston MA, Augenlicht LH. Das intrinsische mitochondriale Membranpotential von Kolonkarzinomzellen ist mit der Wahrscheinlichkeit der Tumorprogression verbunden. Cancer Res. 2005;65(21):9861-9867. [PubMed] br>9 Han J, Flemington C, Houghton AB, et al. Expression von bbc3, einem pro-apoptotischen BH3-only-Gen, wird durch verschiedene Zelltod- und Überlebenssignale reguliert. Proc Natl Acad Sci U S A. 2001;98(20):11318-11323. [PMC freier Artikel] [PubMed] br>10 Nakano K, Vousden KH. PUMA, ein neues proapoptotisches Gen, wird durch p53 induziert. Mol Cell. 2001;7(3):683-694. [PubMed] br>11 Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA induziert die schnelle Apoptose von Dickdarmkrebszellen. Mol Cell. 2001;7(3):673-682. [PubMed] br>12 Willis SN, Adams JM. Das Leben im Gleichgewicht: Wie BH3-only-Proteine die Apoptose auslösen. Curr Opin Cell Biol. 2005;17(6):617-625. [PMC freier Artikel] [PubMed] br>13 Jeffers JR, Parganas E, Lee Y, et al. Puma ist ein wesentlicher Vermittler von p53-abhängigen und -unabhängigen Apoptosewegen. Krebs Zelle. 2003;4(4):321-328. [PubMed] br>14 Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA vermittelt die apoptotische Antwort auf p53 in kolorektalen Krebszellen. Proc Natl Acad Sci U S A. 2003;100(4):1931-1936. [PMC freier Artikel] [PubMed] br>15 Abemayor E, Kovachich GB, Haugaard N. Effects of dichloroacetate on brain pyruvate dehydrogenase. J Neurochem. 1984;42(1):38-42. [PubMed] br>16 Lopaschuk GD, Saddik M. The relative contribution of glucose and fatty acids to ATP production in hearts reperfused following ischemia. Mol Cell Biochem. 1992;116(1–2):111–116. [PubMed] br>17 Stacpoole PW. Die Pharmakologie von Dichloracetat. Metabolism. 1989;38(11):1124–1144. [PubMed] br>18 Wong A, Cortopassi GA. High-throughput measurement of mitochondrial membrane potential in a neural cell line using a fluorescence plate reader. Biochem Biophys Res Commun. 2002;298(5):750-754. [PubMed] br>19 Yan J, Jiang J, Lim CA, Wu Q, Ng HH, Chin KC. BLIMP1 reguliert das Zellwachstum durch Unterdrückung der p53-Transkription. Proc Natl Acad Sci U S A. 2007;104(6):1841-1846. [PMC freier Artikel] [PubMed] br>20 Bieche I, Parfait B, Tozlu S, Lidereau R, Vidaud M. Quantitation of androgen receptor gene expression in sporadic breast tumors by real-time RT-PCR: evidence that MYC is an AR-regulated gene. Karzinogenese. 2001;22(9):1521–1526. [PubMed] br>21 Hassoun EA, Ray S. The induction of oxidative stress and cellular death by the drinking water disinfection by-products, dichloroacetate and trichloroacetate in J774.A1 cells. Vergleichende Biochemie und Physiologie Toxikologie und Pharmakologie. 2003;135(2):119-128. [PubMed] br>22 Di Lisa F, Silverman HS, Hansford RG. Mitochondriale Funktion und Zellschädigung in einzelnen Herzmyozyten, die Anoxie und Reoxygenierung ausgesetzt sind. Transplant Proc. 1995;27(5):2829-2830. [PubMed] br>23 Piccoli C, Scrima R, Boffoli D, Capitanio N. Die Kontrolle des zellulären oxidativen Phosphorylierungssystems durch die Cytochrom-c-Oxidase hängt vom mitochondrialen Energiezustand ab. Biochem J. 2006;396(3):573-583. [PMC freier Artikel] [PubMed] br>24 Liang Y, O’Driscoll L, McDonnell S, et al. Erhöhte Invasivität und Medikamentenresistenz mit veränderten Genexpressionsmustern in einer menschlichen Lungenkarzinom-Zelllinie nach Impulsselektion mit Krebsmedikamenten. Int J Cancer. 2004;111(4):484-493. [PubMed] br>25 Sillem M, Prifti S, Koumouridis A, et al. Invasivität entspricht eher der Differenzierung als der Proteinase-Sekretion in Endometriumkrebs-Zelllinien. Europäische Zeitschrift für Gynäkologische Onkologie. 1999;20(5–6):367–370. [PubMed] br>26 Dohi T, Okada K, Xia F, et al. Ein IAP-IAP-Komplex hemmt die Apoptose. J Biol Chem. 2004;279(33):34087–34090. [PubMed] br>27 Ambrosini G, Adida C, Altieri DC. Ein neues Anti-Apoptose-Gen, Survivin, das bei Krebs und Lymphomen exprimiert wird. Nat Med. 1997;3(8):917-921. [PubMed] br>28 Erkanli S, Bolat F, Kayaselcuk F, Demirhan B, Kuscu E. COX-2 und Survivin sind bei Endometriumkarzinomen überexprimiert und positiv korreliert. Gynecol Oncol. 2007;104(2):320-325. [PubMed] br>29 Li F, Ambrosini G, Chu EY, et al. Kontrolle der Apoptose und des mitotischen Spindel-Checkpoints durch Survivin. Nature. 1998;396(6711):580–584. [PubMed] br>30 Rice LW, Stone RL, Xu M, et al. Biologic targets for therapeutic intervention in endometrioid endometrial adenocarcinoma and malignant mixed mullerian tumors. Am J Obstet Gynecol. 2006;194(4):1119-1126. Diskussion 26-28. [PubMed] br>31 Nagamani M, Stuart CA. Spezifische Bindung und wachstumsfördernde Aktivität von Insulin in Endometriumkrebszellen in Kultur. Am J Obstet Gynecol. 1998;179(1):6-12. [PubMed] br>32 Zhao Y, Yamashita T, Ishikawa M. Regulation der Tumorinvasion durch das bei menschlichem Endometriumkrebs überexprimierte HOXB13-Gen. Oncol Rep. 2005;13(4):721-726. [PubMed] br>33 Yaginuma Y, Westphal H. Analysis of the p53 gene in human uterine carcinoma cell lines. Cancer Res. 1991;51(24):6506-6509. [PubMed] br>34 Richardson GS, Dickersin GR, Atkins L, et al. KLE: eine Zelllinie mit defektem Östrogenrezeptor, abgeleitet von undifferenziertem Endometriumkrebs. Gynecol Oncol. 1984;17(2):213-230. [PubMed] br>35 Carter CA, Parham GP. Der Zustand der Differenzierung beeinflusst die Reaktion von Adenokarzinomzellen des Endometriums auf Retinolsäure. Anticancer Research. 1997;17(3C):1973–1983. [PubMed] br>36 Yabushita H, Narumiya H, Hiratake K, et al. The association of transforming growth factor-beta 1 with myometrial invasion of endometrial carcinomas through effects on matrix metalloproteinase. J Obstet Gynaecol Res. 2000;26(3):163-170. [PubMed] br>37 Holinka CF, Hata H, Kuramoto H, et al. Reaktionen auf Östradiol in einer menschlichen endometrialen Adenokarzinom-Zelllinie (Ishikawa) Journal of Steroid Biochemistry. 1986;24(1):85-89. [PubMed] br>38 Way DL, Grosso DS, Davis JR, et al. Characterization of a new human endometrial carcinoma (RL95-2) established in tissue culture. In Vitro. 1983;19(3 part 1):147-158. [PubMed] br>39 Sundareshan P, Hendrix MJ. Wachstum, morphologische und invasive Eigenschaften von frühen und späten Passagen einer menschlichen Endometriumkarzinom-Zelllinie (RL95-2) In Vitro Cell Dev Biol. 1992;28A(7-8):544-552. [PubMed] br>40 Colombatti A, Russo P, Cervi M, et al. Differential Expression of IRS-1 and IRS-2 in Uterine Leiomyosarcomas with Distinct Oncogenic Phenotypes: Fehlende Korrelation mit nachgeschalteten Signalereignissen. Sarcoma. 2002;6(3):89-96. br>41 Kuramoto H, Tamura S, Notake Y. Establishment of a cell line of human endometrial adenocarcinoma in vitro. Am J Obstet Gynecol. 1972;114(8):1012–1019. br>42 Sieuwerts AM, Klijn JG, Foekens JA. Bewertung des invasiven Potenzials menschlicher gynäkologischer Tumorzelllinien mit dem in vitro Boyden-Kammer-Assay: Einflüsse der Fähigkeit der Zellen, durch die Filtermembran zu wandern. Clin Exp Metastasis. 1997;15(1):53-62.
Verwandter Inhalt: