Tiziana Tataranni 1, Francesca Agriesti 1, Consiglia Pacelli 2, Vitalba Ruggieri 1, Ilaria Laurenzana 1, Carmela Mazzoccoli 1 , Gerardo Della Sala 1, Concetta Panebianco 3, Valerio Pazienza 3, Nazzareno Capitanio 2 und Claudia Piccoli 1,2,*
1 Labor für präklinische und translationale Forschung, IRCCS-CROB, Referral Cancer Center of Basilicata, 85028 Rionero in Vulture (Pz), Italien; [email protected] (T.T.); [email protected] (F.A.); [email protected] (V.R.); [email protected] (I.L.); [email protected] (C.M.); [email protected] (G.D.S.))
2 Abteilung für klinische und experimentelle Medizin, Universität Foggia, 71100 Foggia, Italien; [email protected] (C.P.); [email protected] (N.C.)
3 Abteilung für Gastroenterologie, IRCCS „Casa Sollievo della Sofferenza“ Krankenhaus, 71013 San Giovanni Rotondo, Italien; [email protected] (C.P.); [email protected] (V.P.
)
* Korrespondenz: [email protected]; Tel.:
+39-0881-588-060Received: 21. Februar 2019Accepted
: 15. Mai 2019Veröffentlicht
: 18. Mai 2019
Zusammenfassung
Die gezielte Beeinflussung des Stoffwechsels ist ein möglicher erfolgreicher Ansatz zur Behandlung von Krebs. Dichloracetat (DCA) ist ein Medikament, von dem bekannt ist, dass es den Stoffwechsel von der anaeroben Glykolyse zur mitochondrialen oxidativen Phosphorylierung durch Stimulation der PDH umleitet. In dieser Studie untersuchten wir die Reaktion von zwei Bauchspeicheldrüsenkrebs-Zelllinien auf DCA, sowohl in zwei- und dreidimensionalen Zellkulturen als auch in einem Mausmodell. PANC-1 und BXPC-3, die mit DCA behandelt wurden, zeigten einen deutlichen Rückgang der Zellproliferation und -migration, der nicht mit einer erhöhten Apoptose korrelierte, was eher auf eine zytostatische als auf eine zytotoxische Wirkung hinweist. Trotz der PDH-Aktivierung führte die DCA-Behandlung zu einer Verringerung des mitochondrialen Sauerstoffverbrauchs, ohne die Glykolyse zu beeinträchtigen. Darüber hinaus führte DCA in beiden Zelllinien zu einer Erhöhung der ROS-Produktion, der mtDNA und des Mitophagie-Markers LC3B-II, reduzierte aber nur in BXPC-3 die mitochondrialen Fusionsmarker. Bemerkenswert ist, dass DCA die Expression der Krebsstammzellmarker CD24/CD44/EPCAM nur in PANC-1 herunterregulierte, aber die Sphäroidbildung/Lebensfähigkeit in beiden Zelllinien hemmte. In einem Xenograft-Pankreaskrebs-Mausmodell führte die DCA-Behandlung zu einer Verzögerung der Krebsprogression. Insgesamt zeigen unsere Ergebnisse deutlich, dass die Wirksamkeit von DCA bei der Hemmung des Krebswachstums mechanistisch vom Zellphänotyp und von mehreren Off-Target-Signalwegen abhängt. In diesem Zusammenhang ist die Neuheit, dass DCA das Krebsstammzellkompartiment beeinflussen könnte, therapeutisch relevant.
Schlüsselwörter: Stoffwechsel; Mitochondrien; Krebsstammzellen
© 2019 by the authors. Lizenznehmer MDPI, Basel, Schweiz. Dieser Artikel ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution (CC BY)-Lizenz verbreitet wird (http://creativecommons.org/licenses/by/4.0/).
EINLEITUNG
Das duktale Adenokarzinom der Bauchspeicheldrüse (Pankreas-Adenokarzinom, PDAC) ist eine sehr aggressive Krebserkrankung, bei der nur ein geringer Prozentsatz der betroffenen Patienten für eine chirurgische Resektion in Frage kommt und die gegenüber konventionellen Therapien sehr refraktär ist [1,2]. Daher wird dringend nach wirksameren Medikamenten gesucht, um die derzeitigen Behandlungsmethoden zu verbessern. Neben Zellwachstum, DNA-Reparatur, Invasivität und Angiogenese zeichnen sich PDAC-Zellen auch durch Mutationen in Genen aus, die am Stoffwechsel beteiligt sind [1,3]. Neue therapeutische Strategien, die auf den Metabolismus abzielen, sind vielversprechende Ansätze zur Überwindung der Chemoresistenz [4]. Die Heterogenität zwischen und innerhalb des Tumors führt jedoch häufig zu unterschiedlichen Stoffwechselphänotypen, auch als Folge vielfältiger Interaktionen mit der Mikroumgebung des Tumors [5]. Dies bringt therapeutische Einschränkungen mit sich und unterstreicht die Bedeutung einer vorläufigen metabolischen Charakterisierung der Tumorlinien, die der Verabreichung wirksamer Medikamente vorausgeht. Wir haben vor kurzem gezeigt, dass zwei Bauchspeicheldrüsenkrebs-Zelllinien, die sich durch ein unterschiedliches Stoffwechselprofil auszeichnen, unterschiedlich auf Glukose-Entzug/Galaktose-Substitution reagieren, ein Ansatz, der den Energiestoffwechsel umstellen kann [6]. Darüber hinaus hatte unsere Gruppe bereits die Wirksamkeit von Dichloracetat (DCA), einem Inhibitor der Pyruvat-Dehydrogenase-Kinase (PDK), bei der Abtötung von kultivierten Zellen aus menschlichen Mundhöhlenkarzinomen nachgewiesen, eine Wirkung, die umgekehrt mit der mitochondrialen Atmungskapazität der Tumorzellen korreliert [7]. Mehrere In-vivo- und In-vitro-Studien beschreiben die Fähigkeit von DCA, die mitochondriale oxidative Phosphorylierung (OxPhos) zu erhöhen, den Warburg-Effekt umzukehren und Tumorzellen selektiv zu bekämpfen [8,9]. Darüber hinaus gibt es eine umfangreiche Literatur, die die Wirksamkeit von DCA zur Verbesserung der Chemosensitivität bei verschiedenen Krebsarten belegt [10,11]. Die DCA-Behandlung wurde sowohl für In-vitro- als auch für In-vivo-Studien auch bei Bauchspeicheldrüsenkrebs eingesetzt [8,12,13,14]. Dennoch sind weitere Untersuchungen erforderlich, um die Wirksamkeit des Medikaments bei dieser Krebsart besser zu definieren, mögliche zusätzliche Mechanismen, die zum Zelltod führen, zu klären und mögliche weitere Wege zur Begrenzung der auftretenden Nebenwirkungen zu erkunden. In dieser Studie analysierten wir die Auswirkungen von DCA auf die beiden PDAC-Zelllinien PANC-1 und BXPC-3, die unter anderem wegen ihrer ähnlichen Wachstumsbedingungen und ihres gut charakterisierten Geno-/Phänotyps ausgewählt wurden [6,15,16]. Eine breit angelegte Metabolit- und Transkriptom-Profilierung von PDAC-Zelllinien identifizierte drei Tumor-Subtypen, wobei PANC-1 und BXPC-3 zu einem lipogenen Cluster gehören, der sich durch eine ausgeprägte Abhängigkeit von der Glukoseoxidation und dem mitochondrienbezogenen Stoffwechsel auszeichnet [17]. Indem wir DCA an 2D- und 3D-Kulturen der PDAC-Zelllinien testeten, konnten wir zeigen, dass sich das Medikament negativ auf lebenswichtige Parameter auswirkt, indem es die mitochondriale Atmungsaktivität und vor allem das Krebsstammzellkompartiment reduziert. Darüber hinaus haben wir gezeigt, dass DCA auch in der Lage ist, das In-vivo-Tumorwachstum in einem Modell mit PDAC-xenografted Mäusen abzuschwächen.
Materialien und Methoden
Zellkultur
PANC-1- und BXPC-3-Zellen wurden von der American Type Culture Collection (ATCC, Manassas, VA, USA) erworben und bei 37 °C in einer mit 5 %CO2 befeuchteten Atmosphäre in komplettem RPMI-Medium kultiviert, das mit 10 % fötalem Rinderserum, Penicillin-Streptomycin (100 U/mL) und 2 mM Glutamin angereichert war; die Glukosekonzentration betrug typischerweise 10 mM oder 1 mM, wenn angegeben. Dichloroacetat (DCA) wurde von Sigma-Aldrich (St. Louis, MO, USA) bezogen. Für jeden In-vitro-Versuch wurden die Zellen zu den angegebenen Zeiten mit 4 mM und 10 mM DCA behandelt.
Zellwachstumskurven
Die Zellwachstumskurven wurden wie zuvor beschrieben [18] erstellt.
Überwachung der Zellproliferation in Echtzeit mit dem xCELLigence-System
Die xCELLigence-Experimente wurden mit dem RTCA-Instrument (Real-Time Cell Analyzer) gemäß den Anweisungen des Herstellers (ACEA Biosciences, San Diego, CA, USA) durchgeführt. Die optimale Aussaatmenge wurde zuvor durch Zelltitration und Wachstumsexperimente bestimmt (Daten nicht gezeigt). Anschließend wurden 2500 Zellen pro Vertiefung ausgesät und ihre Proliferation automatisch alle 30 Minuten überwacht. 24 Stunden nach der Aussaat wurden die Zellen mit DCA behandelt. Der Zellindex wurde bis zu 90 Stunden nach der Aussaat überwacht. Die Daten wurden mit der xCELLigence-Software (Version 2.0, Acea biosciences, San Diego, CA, USA) analysiert und als Mittelwert ± SD des Zellindexes, normalisiert auf den letzten Zellindex vor der DCA-Zugabe, ausgedrückt.
Apoptose-Assay
Nach der Inkubation mit DCA wurden die Zellen mit Annexin-V-FITC und PI (BD Biosciences) gefärbt. Lebende, apoptotische und nekrotische Zellen wurden mittels Durchflusszitometrie (Navios, Beckman Coulter, Brea, CA, USA) nachgewiesen. Es wurden drei unabhängige Experimente durchgeführt. Insgesamt wurden104 Ereignisse für jede Probe erfasst.
Migrationstest
Die Auswirkungen von DCA auf die Migrationskapazitäten von PANC-1 und BXPC-3 wurden mit Hilfe eines Kratzwunden-Tests untersucht. Dazu wurden die Zellen in Kulturplatten mit sechs Vertiefungen ausgesät und bis zur vollständigen Konfluenz kultiviert. Anschließend wurden in jeder Schale mit einer 200-μl-Plastikpipettenspitze drei parallele, lineare Wunden erzeugt. Die Zellen wurden dann mit DCA behandelt, und die Wundheilungsfähigkeit, die zu verschiedenen Zeitpunkten beobachtet wurde, wurde nach 48 Stunden quantifiziert. Drei repräsentative Bilder von zerkratzten Bereichen aus jeder Schale wurden fotografiert, um die Migration der Zellen abzuschätzen. Die Zellmigrationsrate wurde anhand der folgenden Formel berechnet: [1 – (48 h Kratzbreite/0 h Kratzbreite)] × 100%.
Laktatmessungen
Einkolorimetrisches Laktat-Assay-Kit (Abcam, Cambridge, MA, USA) wurde nach dem Protokoll des Herstellers verwendet, und die festgestellte Laktatkonzentration (intrazellulär oder freigesetzt) wurde auf die Zellzahl normiert.
Analyse des metabolischen Flusses und der Enzymaktivität des mitochondrialen Atmungskomplexes
Die Sauerstoffverbrauchsrate (OCR) und die extrazelluläre Versauerungsrate (ECAR) wurden in adhärenten PANC-1- und BXPC-3-Zellen mit einem XF96 Extracellular Flux Analyzer (Seahorse Bioscience, Billerica, MA, USA) gemessen, wie zuvor beschrieben [19]. Kurz gesagt wurden für die OCR-Analyse nach der Messung der Basalatmung Oligomycin (1 μM), FCCP (1 μM) und Rotenon + Antimycin A (1 μM + 1 μM) nacheinander in jede Vertiefung injiziert, um die Kopplung der Atmungskette bzw. den maximalen und nicht-mitochondrialen Sauerstoffverbrauch zu bewerten. Für die ECAR-Analyse wurde der glykolytische Fluss (basale Glykolyse, glykolytische Kapazität und glykolytische Reserve) durch die sequentielle Zugabe von 10 mM Glukose, 1 μM Oligomycin und 100 mM 2-Desoxyglukose analysiert. Die OCR- und ECAR-Werte wurden auf den Proteingehalt in jeder Vertiefung normiert, der mit dem BCA-Assay (Thermo Scientific, Waltham, MA, USA) bestimmt wurde.
Quantifizierung der mitochondrialen DNA
Die Messung der mtDNA-Kopienzahl im Verhältnis zur Kern-DNA-Kopienzahl wurde wie zuvor beschrieben [6] bestimmt.
Live Cell Imaging von mtΔΨ und ROS
Zellen, die in geringer Dichte auf Fibronektin-beschichteten 35-mm-Glasbodenschalen (Eppendorf, Amburgo, Deutschland) kultiviert wurden, wurden 20 Minuten lang bei 37 °C mit 2 μM TMRE und 10 μM DCF (Molecular Probes, Eugene, OR, USA) inkubiert, um mtΔΨ bzw. ROS zu überwachen. Die gefärbten Zellen wurden mit PBS gewaschen und mit einem konfokalen Laser-Scanning-Mikroskop Leica TCS SP8 untersucht. Erfassung, Speicherung und Analyse der Daten wurden mit einer speziellen Software von Leica (LAS-X, Wetzlar, Deutschland) durchgeführt.
Western-Blotting-Analyse
Aliquots mit 40 μg Proteinen aus jedem Zelllysat wurden einer SDS-Polyacrylamid-Gelelektrophorese unterzogen und mit einem Trans Blot Turbo Transfer System auf eine Polyvinylidendifluorid-Membran übertragen. Die Membranen (Bio-Rad Laboratories, Hercules, CA, USA) wurden mit den folgenden primären Antikörpern sondiert: Pyruvatdehydrogenase E1-alpha (PDH) und pPDHSer293 (1:500, Abcam, Cambridge, UK), LC3B (1:1000 Cell Signaling Technology), TOM20 (1:1000, Santa Cruz Biotechnology, Santa Cruz, CA, USA), DRP1 (1:1000, BD Bioscences), OPA-1 (1:1000, BD Bioscences), MFN1 (1:1000, Santa Cruz), MFN2 (1:1000, Abnova, Tapei, Taiwan), und CASPASE 3 (1:1000, Cell Signaling Technology, Danvers, MA, USA). Nach Inkubation mit einem entsprechend geeigneten Meerrettichperoxidase-konjugierten Sekundärantikörper (1:2500; Cell Signaling Technology) wurden die Signale mit dem Enhanced Chemiluminescence Kit (ClarityTM Western ECL Substrate, Bio-Rad) und dem ChemiDoc Imaging System XRS + (BioRad) entwickelt und anschließend mit der Image Lab Software (Version 4.1, Bio-Rad, Hercules, CA, USA) analysiert. Die Intensität der LC3B-II (entsprechend der gespaltenen Fraktion), TOM20, DRP1, OPA-1, MFN1 und MFN2 Banden wurden auf das β-Actin-Signal normalisiert, während die PDH-Phosphorylierung auf die Gesamtproteine normalisiert wurde.
Durchflusszytometrischer Nachweis von Oberflächenmarkern
Die Expression der Oberflächenmarker CD44, CD24 und EPCAM wurde in PANC-1 und BXPC-3, die 24 Stunden lang mit DCA behandelt wurden, mittels zytofluorimetrischer Analyse bewertet. Kurz gesagt, nach der Trypsinisierung wurden die Zellen im Dunkeln bei Raumtemperatur 15 Minuten lang mit direkt konjugierten monoklonalen Antikörpern (BDB) CD44-APC, EPCAM-FITC und CD24-PE inkubiert. Die zytofluorimetrische Analyse wurde mit Navios (Beckman Coulter) durchgeführt. Das emittierte Fluoreszenzsignal von 10.000 Ereignissen für jede Probe wurde erfasst und mit der Kaluza Analysis Software (Version 1.3, Beckman Coulter, Brea, CA, USA) analysiert.
Reverse Transkription und Echtzeit-PCR-Analyse
Ein Mikrogramm Gesamt-RNA, isoliert mit Trizol-Reagenz (Life Technologies, Paisley, UK) gemäß den Anweisungen des Herstellers und quantifiziert mit einem Nanodrop-Spektrophotometer (Thermo Fisher Scientific, Waltham, MA, USA), wurde in einer reversen Transkriptionsreaktion (RT) unter Verwendung des Transcriptor cDNA-Erststrang-Synthese-Kits (Roche Diagnostic, Penzberg, Deutschland) gemäß den Anweisungen des Herstellers verwendet. Die quantitative Echtzeit-Polymerase-Kettenreaktion (PCR) wurde in zwei Durchgängen mit dem QuantiTect Primer Assay (Qiagen, Basel, Schweiz) zum Nachweis von Lin28 mRNA durchgeführt. Die Quantifizierung der mRNA-Spiegel wurde mit einem LightCycler® 480 Echtzeit-PCR-Gerät durchgeführt. Die relativen Mengen von Lin28 wurden mit Hilfe der Light Cycler® 480 Software Version 1.5 (ROCHE) unter Verwendung der 2ΔΔCt-Methode mit der GAPDH-Expression normalisiert.
3D-Kultur
PANC-1- und BXPC-3-Zellen wurden mit Trypsin-EDTA abgelöst und gezählt. Anschließend wurden 1000 Zellen/Well in 96-Well-Rundbodenplatten mit sehr geringem Anhaftungsgrad ausgesät und in RPMI kultiviert. Um die DCA-Wirkung der vorgeformten Sphäroide zu untersuchen, wurden die 3D-Kulturen 7 Tage lang aufrechterhalten, um Sphäroide zu erhalten. Dann wurde das Medium durch frisches Medium ersetzt und die Sphäroide wurden 72 Stunden lang mit DCA 4 mM und 10 mM behandelt. Um die Wirkung von DCA auf die Sphäroidbildung zu untersuchen, wurde DCA der Zellsuspension zugesetzt, als diese in Platten mit sehr geringer Anhaftung ausgesät wurde, und die Kultur wurde 7 Tage lang beibehalten. Die Sphäroide wurden mit einem inversen optischen Mikroskop (Axio Vert A1, Zeiss, Oberkochen, Deutschland) fotografiert, und ihr Durchmesser wurde mit der ZEISS ZEN Imaging Software gemessen. Die Lebensfähigkeit der Sphäroide wurde mit einem MTS-Assay bestimmt. Eine Lösung von cellTiter 96® Aqueous MTS Reagent Powder (Promega, Madison, WI, USA) und PMS (Sigma Aldrich, Saint Louis, MO, USA) wurde in jede Vertiefung der 3D-Sphäroidkultur gegeben. Nach 2 Stunden Inkubation bei 37 °C wurde die Absorption bei 490 nm gemessen und der Prozentsatz der Lebensfähigkeit in jeder Vertiefung unter Verwendung der unbehandelten Sphäroide als 100 % berechnet.
Tierversuche
Die Tierversuche wurden in einer von der AAALAC (Association for Assessment and Accreditation of Laboratory Animal Care International, Frederick, MD USA) akkreditierten Versuchseinrichtung unter der Zulassungsnummer ANM14_002/468862 durchgeführt. Insgesamt 5 ×106 BxPC-3-luc-Krebszellen wurden kultiviert, in 0,1 ml PBS/Matrigel-Gemisch (1:1) resuspendiert und dann s.c. in die rechte Flanke von 5-6 Wochen alten Nu/Nu-Nacktmäusen injiziert. Wenn der Tumor ein durchschnittliches Volumen von 100 mm3 erreicht hatte, wurden die BxPC-3-luc-Tumor-tragenden Nacktmäuse nach dem Zufallsprinzip in 2 Gruppen eingeteilt (6 Mäuse/Gruppe). Gruppe 1 (normale Kochsalzlösung, i.p, qw), Gruppe 2 (DCA, mg/kg, i.p, qw). Die Tiere hatten freien Zugang zu Wasser. DCA wurde aufgelöst, um eine Endkonzentration von 100 mg/kg/Tag zu erreichen (s.c.: subkutan; i.p.: intraperitoneal; qw: einmal pro Woche).
Statistische Analyse
Die Versuchsdaten werden als Mittelwert ± Standardfehler (SEM) oder Mittelwert ± Standardabweichung (SD) angegeben. Die Daten wurden mit dem ungepaarten Student’s t-Test oder der einseitigen Anova, gefolgt vom Bonferroni-Test, verglichen. Ein p-Wert < 0,05 wurde als statistisch signifikant akzeptiert.
Ergebnisse
DCA wirkt sich negativ auf die Zellproliferation, das Überleben und die Migration in den Zelllinien PANC-1 und BXPC-3 aus
Die beiden für diese Studie ausgewählten PDAC-Zelllinien waren PANC-1 und BXPC-3. PANC-1 ist eine von einem Pankreaskarzinom abgeleitete Zelllinie mit duktalem Ursprung. Sie kann metastasieren, hat aber eine schlechte Differenzierungsfähigkeit und weist Mutationen in KRAS und TP53 sowie eine homozygote Deletion in CDKN2A/p16 auf [16]. BxPC-3 ist eine primäre, von einem Adenokarzinom abgeleitete Zelllinie mit mäßiger Differenzierung und epithelialer Morphologie. Sie exprimiert Muzin und hohe Mengen an angiogenen Faktoren und Krebsstammzellmarkern [16,20] und weist keine KRAS-Mutationen auf, aber Mutationen in TP53 und homozygote Deletionen in CDKN2A/p16 und SMAD4/DPC4 [16]. Die Wirkung von DCA auf die Lebensfähigkeitsparameter der PANC-1- und BXPC-3-Zelllinien wurde in den Konzentrationen von 4 mM und 10 mM untersucht, die bereits in unserer früheren Studie getestet wurden und sich als wirksam erwiesen haben [7]. Zunächst führten wir einen Zellwachstumstest über 72 Stunden durch, der eine signifikante dosis- und zeitabhängige Empfindlichkeit beider Zelllinien gegenüber der DCA-Behandlung zeigte (Abbildung 1A,B). Insbesondere zeigten PANC-1 und BXPC-3 eine ähnliche Blockade des Zellwachstums, wenn sie ab dem ersten Tag der Inkubation mit 10 mM DCA behandelt wurden, und umgekehrt erschien die PANC-1-Zelllinie bei der niedrigeren getesteten Dosis von 4 mM deutlich empfindlicher gegenüber dem Medikament.
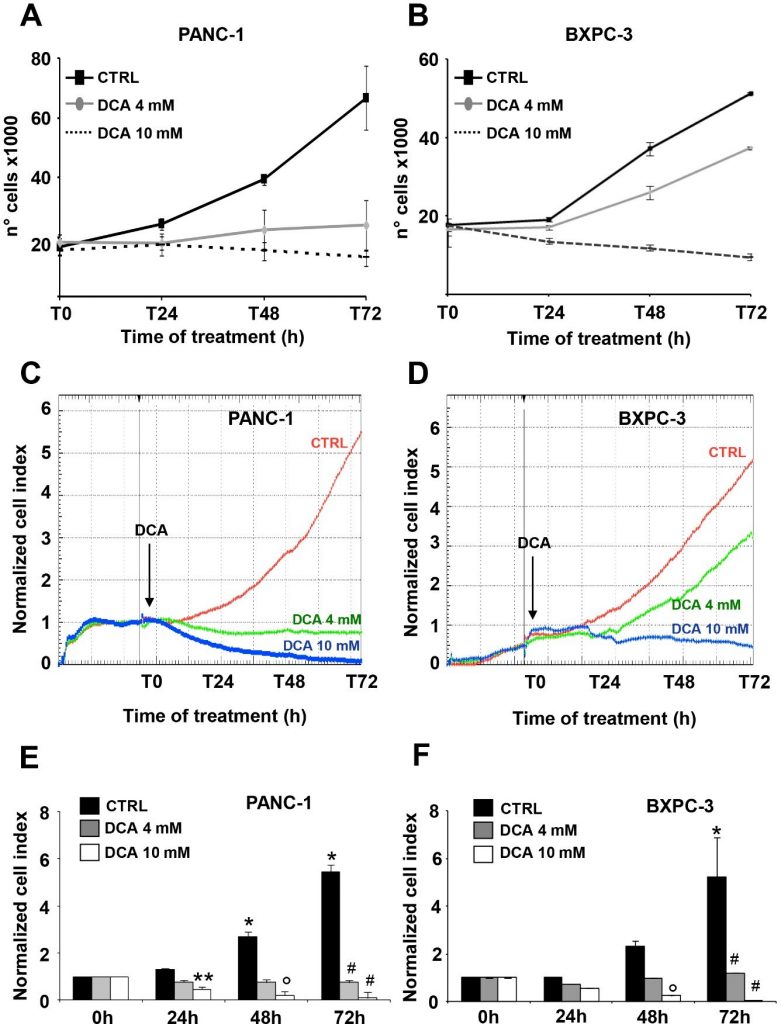
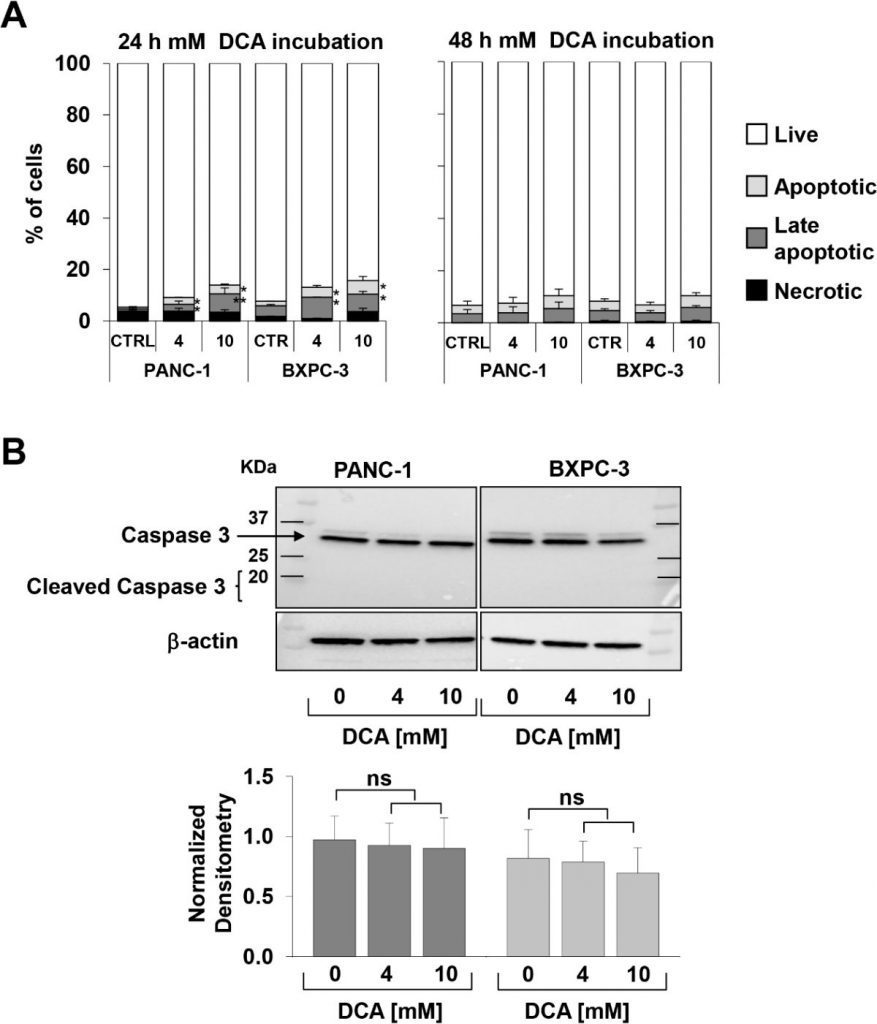
Die oben beschriebene Beobachtung, die vor allem wegen der bekannten Chemoresistenz der PANC-1-Zelllinie [21,22] interessant ist, veranlasste uns, die DCA-vermittelte Hemmung des Zellwachstums mit einem anderen Ansatz zu verifizieren. Zu diesem Zweck haben wir die dynamischen Veränderungen der Zellproliferation und der Lebensfähigkeit mit Hilfe der Impedanztechnologie in Echtzeit überwacht. Wie in Abbildung 1C-F zu sehen ist, führte eine Behandlung mit 10 mM DCA zu einer drastischen Verringerung der Zellproliferation in beiden Zelllinien, während eine Behandlung mit 4 mM DCA eine viel stärkere Hemmwirkung in PANC-1 im Vergleich zu den BXPC-3-Zelllinien bewirkte. Die Auswirkungen von DCA waren bereits nach 24 Stunden Inkubation mit dem Medikament deutlich sichtbar. Die Analyse des Zellwachstums in Echtzeit wurde auch bei niedrigem Glukosegehalt des Kulturmediums (d. h. 1 mM in RPMI) durchgeführt. Wie erwartet, wurde die Wachstumsrate beider PDAC-Zelllinien aufgrund ihrer metabolischen Abhängigkeit von der Glukoseoxidation stark gedämpft [17]. Die unterschiedliche Empfindlichkeit bei der Behandlung mit 4 mM DCA bestätigte sich jedoch auch bei der Behandlung mit niedriger Glukose (ergänzende Abbildung S1). Zur Bewertung der Vitalparameter verwendeten wir den Annexin V-FITC/PI-Assay und untersuchten mittels Durchflusszytometrie die relative Menge nekrotischer, später und früher apoptotischer Zellen. Die Ergebnisse zeigten, dass nach 24-stündiger Inkubation mit DCA sowohl die PANC-1- als auch die BXPC-3-Zelllinien einen leichten, aber signifikanten dosisabhängigen Anstieg der Apoptose im Vergleich zu unbehandelten Zellen zeigten. Die Menge der apoptotischen Zellen war jedoch relativ gering (d. h. < 10 % bei der höheren getesteten DCA-Konzentration) und stieg nach 48 Stunden DCA-Behandlung nicht weiter an (Abbildung 2A). Dementsprechend änderte sich die Expression der ungespaltenen Caspase 3 nach der DCA-Behandlung nicht, und es war keine nennenswerte Menge ihrer gespaltenen Form nachweisbar (Abbildung 2B). Dieses Ergebnis deutet eher auf eine zytostatische als auf eine zytotoxische Aktivität des Medikaments in beiden Zelllinien hin und erklärt die in Abbildung 1A-D gezeigte deutliche Dämpfung der Wachstumsrate.
Als Nächstes untersuchten wir die Wirkung von DCA auf die Zellmotilität, indem wir den Test zur Wundheilung durch Kratzen durchführten. Die Migrationsfähigkeit, die zu verschiedenen Zeitpunkten beobachtet wurde, wurde nach 48 Stunden bei einer Behandlung mit 4 mM und 10 mM DCA gemessen. Sowohl die PANC-1- als auch die BXPC-3-Zellen verringerten ihre Beweglichkeit, wenn sie mit der höheren DCA-Dosis behandelt wurden, während die Migrationsfähigkeit von BXPC-3 durch die Behandlung mit 4 mM DCA nicht beeinträchtigt wurde, was stattdessen eine Verzögerung des Wundverschlusses bei den PANC-1-Zellen bewirkte, was ihre größere Empfindlichkeit gegenüber dem Medikament bestätigt, das bei einer niedrigeren Konzentration nachweisbar ist (ergänzende Abbildung S2).
DCA verändert den energetischen Zellstoffwechsel in PDAC-Zelllinien
Um den Zusammenhang zwischen der DCA-induzierten antiproliferativen Wirkung und den Veränderungen im Stoffwechsel der PDAC-Zelllinien zu untersuchen, haben wir die Wirksamkeit des Wirkstoffs bei der Hemmung seines anerkannten Ziels, der Pyruvat-Dehydrogenase-Kinase (PDK), bewertet, indem wir den Phosphorylierungszustand der E1α-Untereinheit (Rest S293) des Pyruvat-Dehydrogenase-Komplexes (PDC) durch Western Blotting in PANC-1 und BXPC-3 untersuchten. Wie in Abbildung 3A und B dargestellt, war die normalisierte Konzentration von P-PDH-E1 in beiden Zelllinien signifikant verringert, während die Expressionskonzentration der Gesamt-PDH vergleichbar war und erwartungsgemäß nicht durch die medikamentöse Behandlung verändert wurde. Unerwarteterweise war sowohl die extra- als auch die intrazelluläre Laktatproduktion in beiden DCA-behandelten PDAC-Zelllinien offenbar unbeeinflusst (ergänzende Abbildung S3).
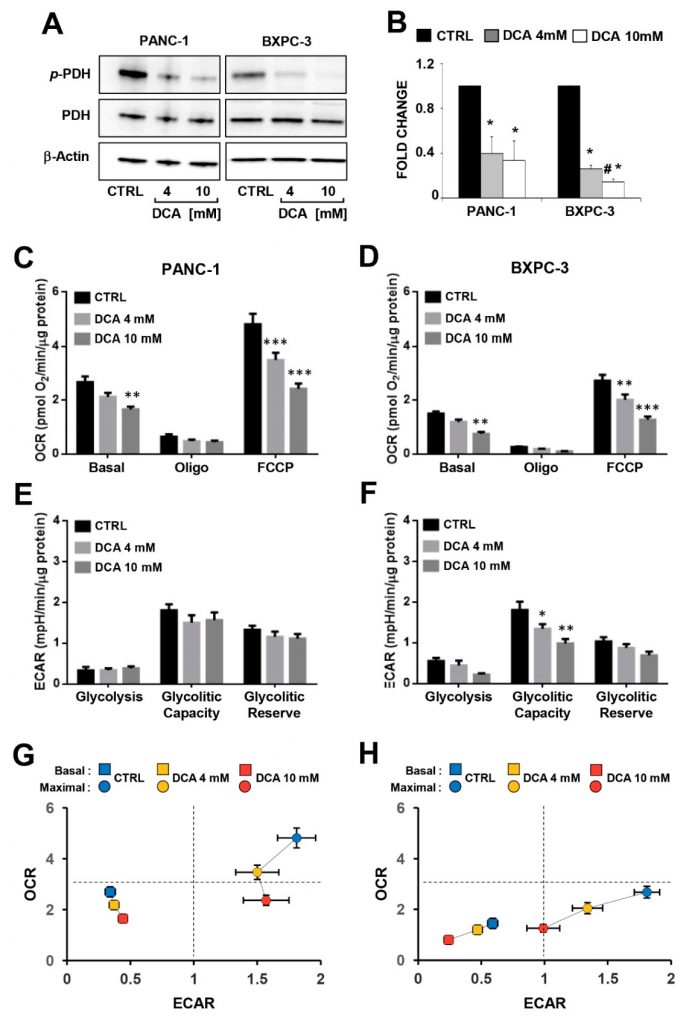
Anschließend analysierten wir die wichtigsten Stoffflüsse durch Messung der extrazellulären Versauerung und des Sauerstoffverbrauchs mit der SeaHorse-Technologie. Bei der Bewertung der Stoffwechselflüsse nach 24-stündiger DCA-Inkubation wurden in beiden PDAC-Zelllinien keine signifikanten Veränderungen festgestellt (ergänzende Abbildung S4). Eine längere (d. h. 48-stündige) DCA-Exposition verursachte eine dosisabhängige Abnahme der mitochondrialen Sauerstoffverbrauchsraten (OCRs) sowohl in den PANC-1- als auch in den BXPC-3-Zelllinien unter Basalbedingungen sowie in Gegenwart des ATP-Synthase-Inhibitors Oligomycin oder des Entkopplers FCCP (d. h. der maximalen Atmungskapazität) (Abbildung 3C,D). Es ist anzumerken, dass die mitochondriale Atmungsaktivität in PANC-1 signifikant höher war als in BXPC-3, was auf einen eher OxPhos-abhängigen Stoffwechselphänotyp hinweist. Die extrazellulären Ansäuerungsraten (ECARs), die mit dem glykolytischen Fluss verbunden sind, führten nach der DCA-Behandlung von PANC-1 zu keinen signifikanten Veränderungen, während bei BXPC-3 eine Hemmung der basalen ECAR bei der höheren DCA-Konzentration und eine Dosisabhängigkeit der glykolytischen Kapazität beobachtet wurde (Abbildung 3E,F). Folglich wurde das gesamte bioenergetische Profil der basalen und stimulierten Flusskapazitäten beider PDAC-Zellen durch DCA beeinträchtigt, wobei PANC-1 eine Abnahme der OxPhos-Kapazität und BXPC-3 eine stärkere Beeinträchtigung beider Stoffwechselflüsse zeigte (Abbildung 3G,H). Die Messung der Stoffwechselflüsse unter Wachstumsbedingungen mit niedrigem Glukosegehalt ergab eine verringerte OCR in beiden Zelllinien (konsistenter in BXPC-3) und eine erhöhte ECAR in BXPC-3. Die DCA-Behandlung (48 h) führte bei beiden Zelllinien zu einer signifikant geringeren hemmenden Wirkung auf die OCR (insbesondere bei 4 mM) bei niedriger Glukose im Vergleich zur Behandlung mit hoher Glukose. Die DCA-Behandlung bewirkte keine signifikante Veränderung der ECAR in PANC-1, während in BxPC-3 eine 40-50%ige Hemmung beobachtet wurde, die jedoch unabhängig von der Verfügbarkeit von Glukose war (Abbildung S5). Stattdessen verursachte die DCA-Behandlung eine bioenergetische Krise, die zu einer Dämpfung des Zellwachstums durch einen überwältigenden Off-Target-Mechanismus führte.
DCA induziert die ROS-Produktion in PDAC-Zelllinien und beeinflusst in unterschiedlicher Weise die mitochondriale Biogenese und Dynamik
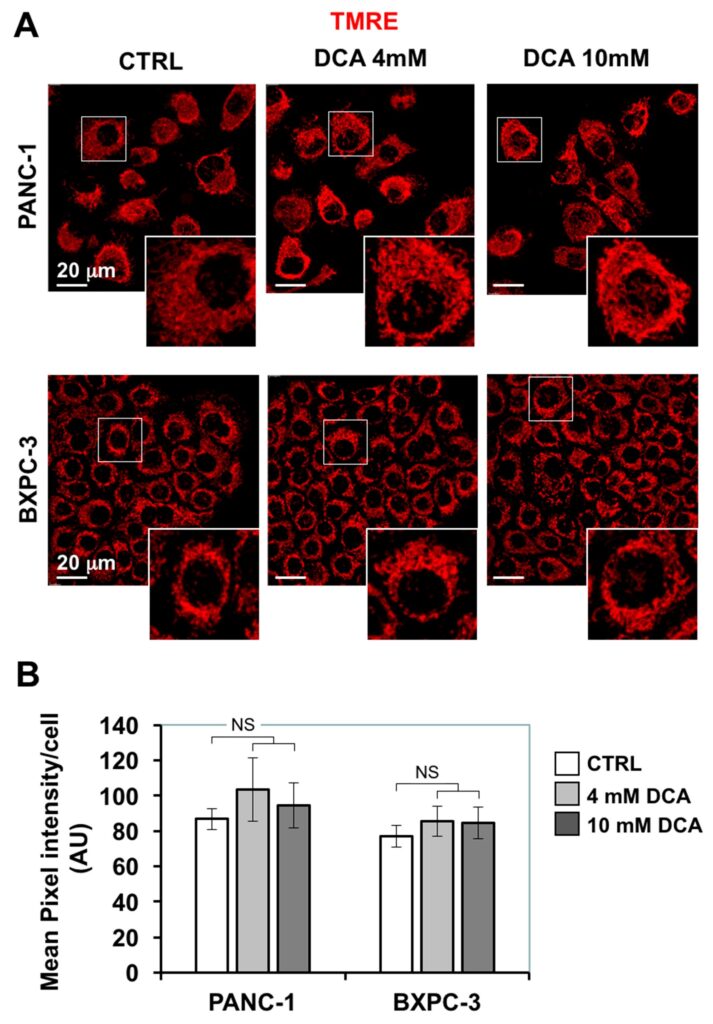
Die durch DCA verursachte verminderte mitochondriale Atmung veranlasste uns, weitere mitochondriale Funktionen zu untersuchen. Zunächst untersuchten wir die morphofunktionelle Architektur des mitochondrialen Kompartiments mit Hilfe der konfokalen Mikroskopie unter Verwendung der fluoreszierenden ΔΨ-Sonde TMRE, die sich in atmenden Mitochondrien anreichert. Abbildung 4A zeigt, dass das TMRE-bezogene Signal in PANC-1 ein diffuses, partikuläres Erscheinungsbild aufweist, das weitgehend im Zytoplasma verteilt ist, was auf eine eher fragmentierte als zusammenhängende Struktur hindeutet. Ein ähnliches Merkmal ergab sich auch bei den kleineren BXPC-3-Zellen, die jedoch eine ringförmige peri-nukleäre Kompartimentierung aufwiesen. Die 24-stündige Behandlung mit DCA führte weder zu größeren Veränderungen in der Intensität des TMRE-Fluoreszenzsignals noch in dessen morphologischem Erscheinungsbild.
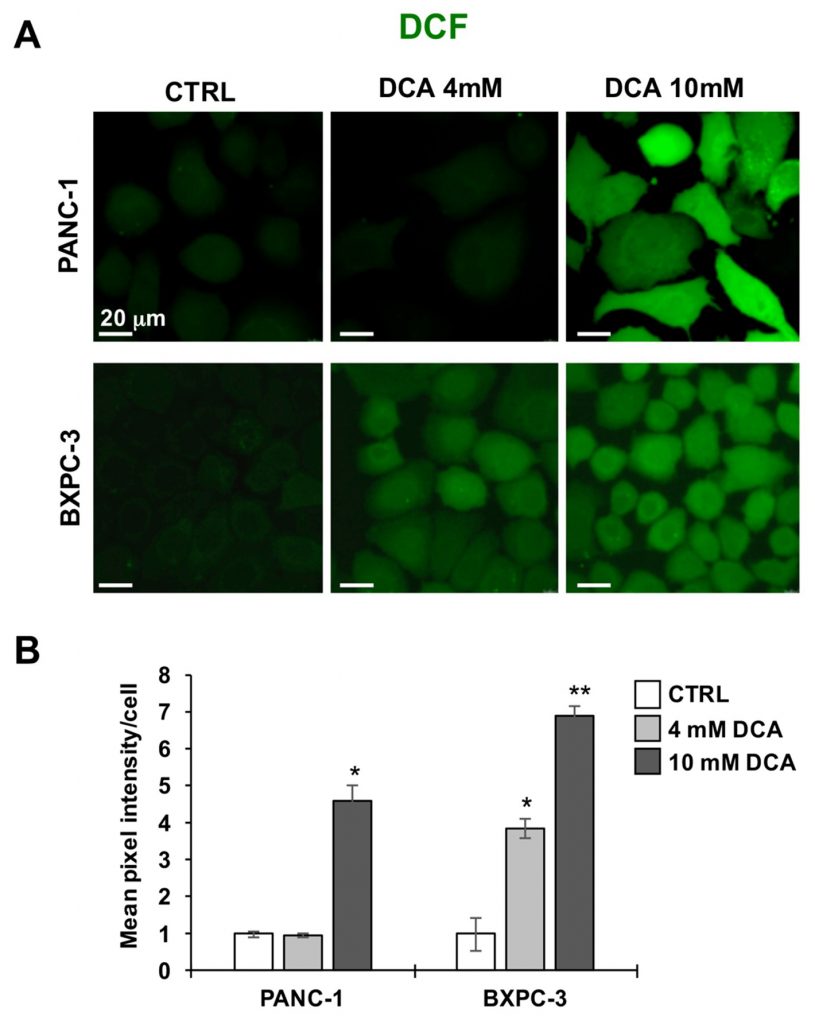
Als Nächstes untersuchten wir die beiden PDAC-Zelllinien auf ihren Redoxtonus mit der Peroxidsonde DCF. Abbildung 5A und B zeigen, dass die 10 mM DCA-Behandlung über 24 Stunden sowohl bei PANC-1 als auch bei BXPC-3 einen signifikanten Anstieg des DCF-Signals im Vergleich zum unbehandelten Ausgangswert verursacht. Dieses Ergebnis deutet auf ein pro-oxidatives Ungleichgewicht oder einen durch DCA-Exposition verursachten Redox-Zustand hin.
Die oben beschriebene Analyse wurde durch die Messung der mitochondrialen DNA (mtDNA) ergänzt. Wie in Abbildung 6A dargestellt, war die mtDNA-Kopienzahl/Zelle in PANC-1 deutlich höher als in BXPC-3, was mit der aktiveren Atmungsaktivität übereinstimmt. Nach der DCA-Behandlung wurde in beiden PDAC-Zelllinien ein progressiver, dosisabhängiger Anstieg der mtDNA beobachtet. Dies war wahrscheinlich auf eine kompensatorische Reaktion auf die durch DCA verursachte OxPhos-Dysfunktion zurückzuführen.
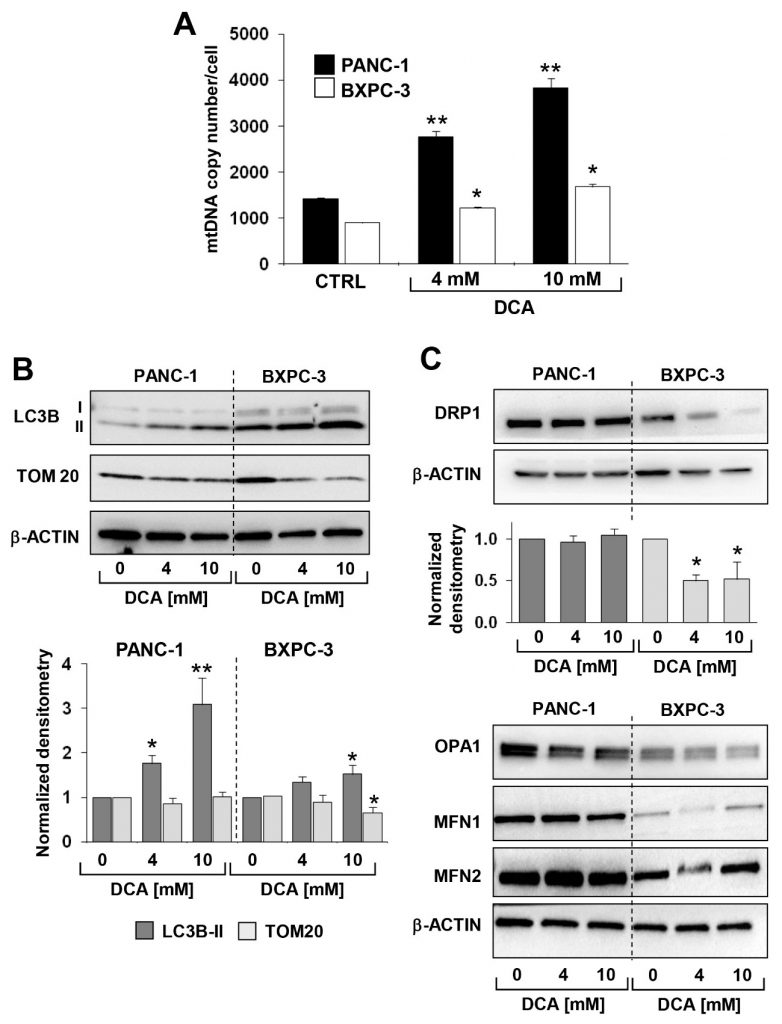
Als nächstes untersuchten wir mittels Immunoblotting die Expression von Proteinen, von denen bekannt ist, dass sie an der mitochondrialen Clearance (d.h. Mitophagie) und Dynamik beteiligt sind. Abbildung 6B und C zeigen, dass die Expression des Autophagosomen-Markers LC3B-II in BXPC-3 signifikant höher war als in PANC-1, und dass DCA in beiden Zelllinien einen dosisabhängigen, progressiven Anstieg des Markers verursachte. Die Analyse der Faktoren, die an der Fusion/Spaltung von Mitochondrien beteiligt sind, ergab, dass alle Faktoren in PANC-1 in höherem Maße exprimiert wurden als in BXPC-3, aber dass die DCA-Behandlung eine unterschiedliche Wirkung auf sie hatte (Abbildung 6C). Insbesondere nahm nur DRP1, ein an der mitochondrialen Spaltung beteiligter Faktor, nach der DCA-Behandlung in BXPC-3 ab. In PANC-1 wurde keine signifikante Veränderung der DRP1-Expression festgestellt, ebenso wenig wie bei den mitochondrialen fusionsinduzierenden Faktoren OPA1, MFN1 und MFN2 in beiden Zelllinien nach der DCA-Behandlung (ergänzende Abbildung S6) Zusammengenommen deuten diese Beobachtungen auf ein dynamischeres Profil des mitochondrialen Kompartiments in PANC-1 hin, das eine aktive mitochondriale Fusion und Spaltung durchläuft, wobei die Mitophagie offenbar nur in geringem Maße verarbeitet wird. Im Gegensatz dazu scheinen BXPC-3-Zellen phänotypisch eher dazu neigen, die Qualitätskontrolle der Organellen zu verfolgen. Dies könnte mit dem fragmentierteren Erscheinungsbild des mitochondrialen Netzwerks in BXPC-3-Zellen zusammenhängen. Die DCA-Behandlung führte in beiden Zelllinien zu einem deutlichen Anstieg des mitophagischen Markers LC3B, der jedoch in BXPC-3 deutlich größer war.
DCA beeinflusst die Krebsstammzellfraktion in PDAC-Zelllinien in unterschiedlicher Weise
Um mögliche zusätzliche Mechanismen der zytostatischen Wirkung von DCA zu untersuchen, beschlossen wir, seine Auswirkungen auf die Krebsstammzellfraktion (CSC) der PDAC-Zelllinien zu testen. Zu diesem Zweck untersuchten wir die Expression des embryonalen Stammzellfaktors Lin28, der nachweislich in den Zellstoffwechsel involviert ist [23] und als Biomarker für eine schlechte Prognose des Krebsfortschritts bekannt ist [24,25]. Abbildung 7A zeigt, dass eine 48-stündige DCA-Behandlung zu einer signifikanten Verringerung der Lin28-Expression in beiden Zelllinien führte, wobei BXPC-3 empfindlicher zu sein scheint als PANC-1. Ein ähnliches Ergebnis wurde in 3D-Kulturen aus beiden Zelllinien erzielt (Abbildung 7B).
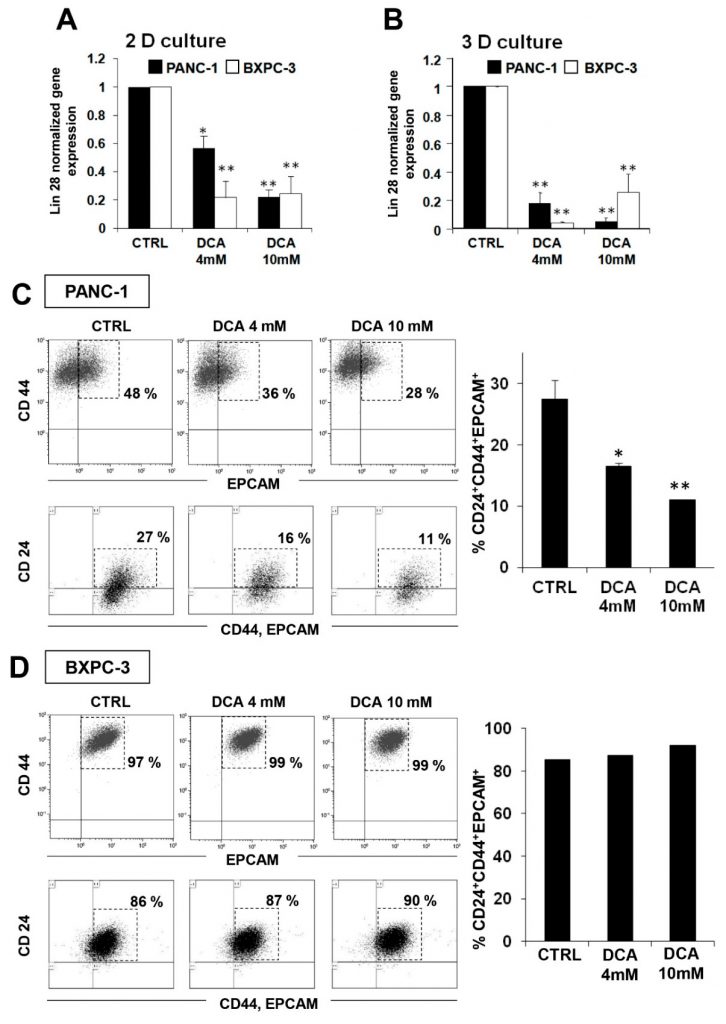
Diese Beobachtung veranlasste uns, die Wirkung von DCA auf CSCs durch eine FACS-Analyse der spezifischen Oberflächenmarker für CSCs in der Bauchspeicheldrüse, CD24, CD44 und EPCAM, zu vertiefen [26,27]. Abbildung 7C zeigt eine signifikante dosisabhängige Verringerung der CD24+/CD44+/EPCAM+-Zellen in PANC-1-Zellen, die 48 Stunden lang mit DCA behandelt wurden. Bemerkenswert ist, dass die Fluoreszenzintensität bei PANC-1-Zellen nach einer Behandlung mit 4 mM DCA um fast 50 % reduziert war, während bei 10 mM bereits nach 24 Stunden eine stärkere Reduktion der Fluoreszenzintensität zu beobachten war und sich nach 48 Stunden Behandlung nicht veränderte (Daten nicht gezeigt). Im Gegenteil, obwohl CSC-Marker in etwa 90 % der BXPC-3-Zellen exprimiert wurden, schien ihre Expression durch die DCA-Behandlung nicht beeinflusst zu werden (Abbildung 7D). Kürzlich wurde berichtet, dass nicht so sehr die absolute Expressionsstärke bestimmter Marker, sondern vielmehr ihr Verhältnis zur Identifizierung der Subpopulation mit echten Stammzellmerkmalen entscheidend ist. Insbesondere das CD44/CD24-Verhältnis scheint der zuverlässigere Marker für zelluläre Stammzellen in der Tumorentstehung und Metastasierung zu sein [28]. In diesem Zusammenhang ist es von Bedeutung, dass das CD44/CD24-Expressionsverhältnis in PANC-1 um das 8-fache höher war als in BXPC-3 (ergänzende Abbildung S7), was darauf hindeutet, dass das CSC-Kompartiment, obwohl es weniger besiedelt ist, qualitativ eher stammzellähnlich ist. Umgekehrt würde das niedrige Expressionsniveau der CSC-Marker, die in der BXPC-3-Population weit verbreitet sind, diese als frühe Vorläuferzellen phänotypisieren.
Wirkung von DCA auf 3D-Kulturen
Um die antitumoralen Eigenschaften von DCA weiter zu untersuchen, analysierten wir seine biologischen Wirkungen auf einem alternativen Prüfstand, der aus 3D-Kulturen von PANC-1 und BXPC-3 besteht. Es gibt immer mehr Belege dafür, dass von Krebszellen abgeleitete Sphäroide mit CSCs oder Zellen mit stammzellähnlichen Eigenschaften angereichert sind [29,30]. Abbildung 8A zeigt mikroskopische Aufnahmen der Sphäroide, die nach 7-tägiger Kultur gewonnen wurden. Es ist deutlich ein Unterschied in der Größe und Kompaktheit der Grenzschicht zwischen den Zelllinien PANC-1 und BXPC-3 zu erkennen. Insbesondere die aus den PANC-1-Zellen gewonnenen Sphäroide erschienen größer und mit unregelmäßigen Rändern im Vergleich zu den aus den BXPC-3-Zellen gewonnenen Sphäroiden. Eine 72-stündige Behandlung mit DCA veränderte die Morphologie der Sphäroide, die zunehmend undefinierter wurden. Besonders deutlich wurde dies bei den PANC-1-Sphäroiden bei einer Behandlung mit 10 mM DCA. In Übereinstimmung mit dieser Beobachtung war eine fortschreitende dosisabhängige Verringerung der Lebensfähigkeit der Zellen in den Sphäroiden von PANC-1 und BXPC-3 deutlich zu erkennen.
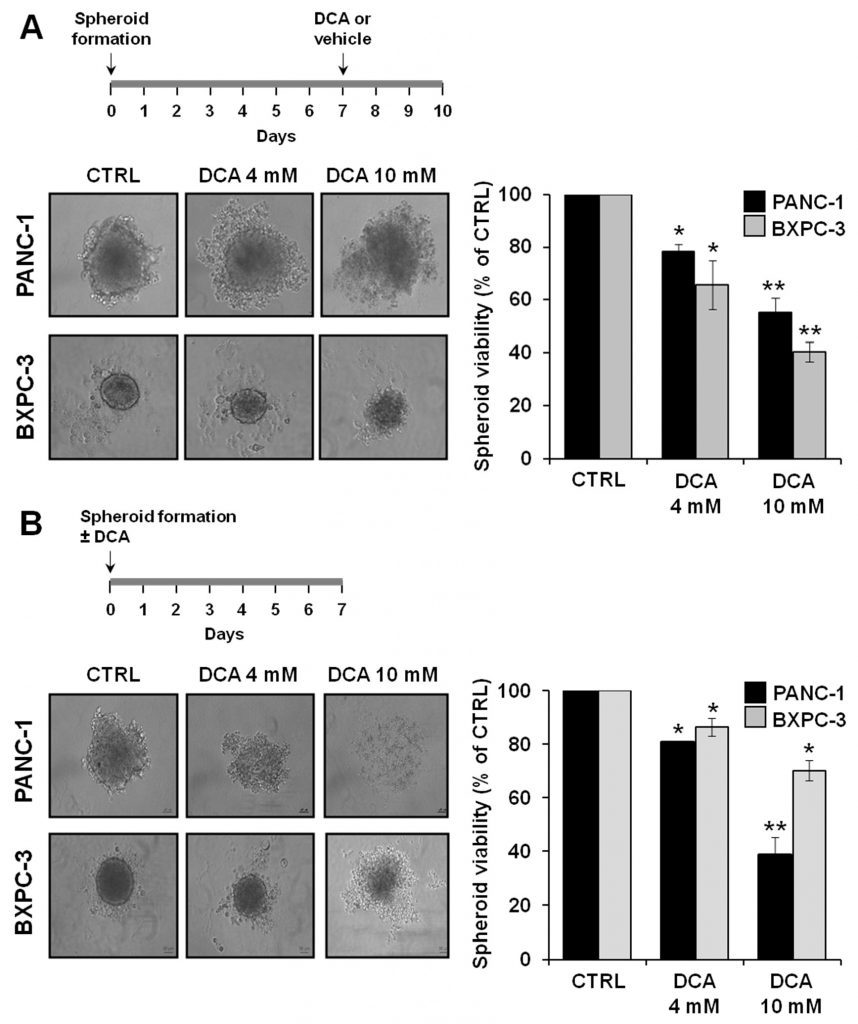
Wir untersuchten auch die Fähigkeit von DCA, die Sphäroidbildung zu beeinflussen, indem wir die Zellsuspension bei der Aussaat behandelten. Wie in Abbildung 8B gezeigt, beeinträchtigte DCA die Sphäroidbildung in beiden PDAC-Zelllinien stark, wobei PANC-1 empfindlicher auf das Medikament reagierte. Dementsprechend war die Zellviabilität der PANC-1-Sphäroide deutlich stärker beeinträchtigt als die der BXPC-3-Sphäroide.
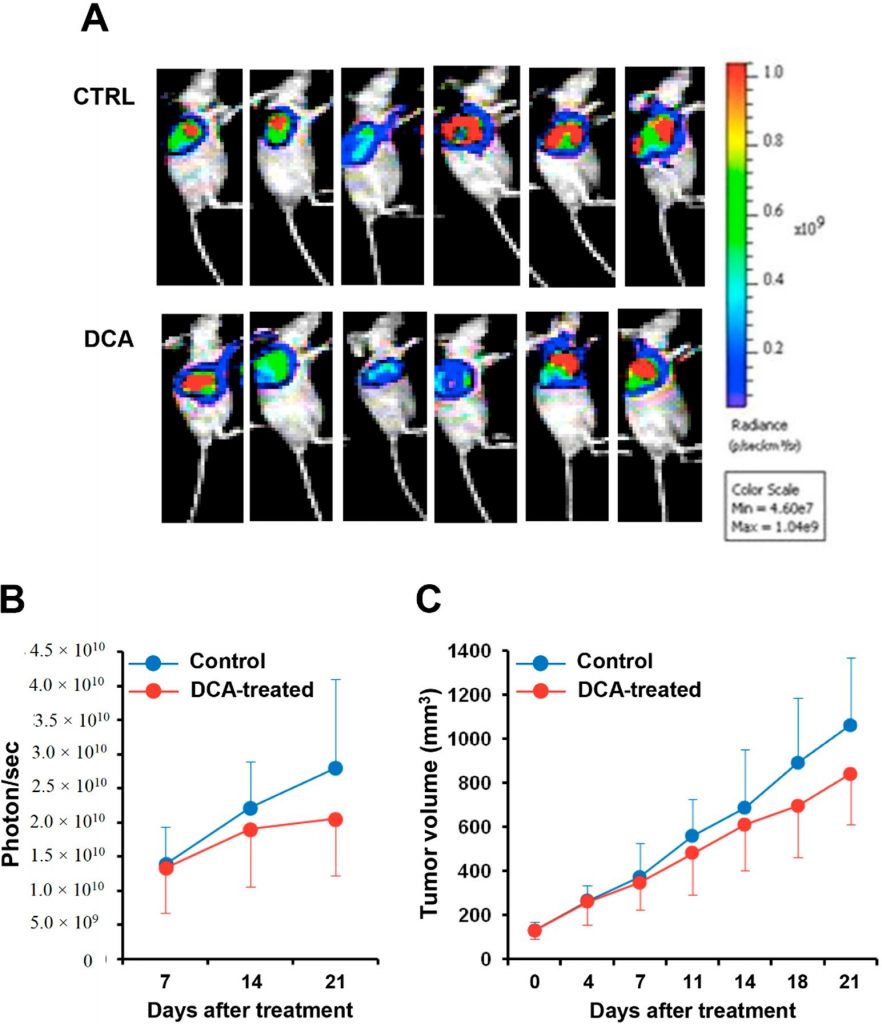
DCA mildert das Fortschreiten des Krebses in einem PC-Xenograft-Mausmodell
Schließlich untersuchten wir die Wirkung der DCA-Verabreichung in einem Xenograft-Pankreaskrebs-Mausmodell. Die Luziferase-exprimierende BXPC-3-Zelllinie wurde in Nacktmäuse injiziert und, nachdem sie ein Volumen von 100 mm3 erreicht hatte, drei Wochen lang mit DCA oder einem Vehikel behandelt. Abbildung 9A zeigt die Biolumineszenz-Bildgebung der Tumormasse in DCA-behandelten und Kontrollmäusen. Die Quantifizierung des Biolumineszenzsignals zeigte ein verzögertes Fortschreiten des Pankreastumors in den DCA-behandelten Mäusen, was durch eine 25-30%ige Verringerung sowohl der Intensität des Biolumineszenzsignals der Tumormasse als auch ihres Volumens im Vergleich zu den Vehikel-behandelten Mäusen dokumentiert wurde (Abbildung 9B,C). Aufgrund der großen interindividuellen Variabilität erreichten die Unterschiede jedoch keine statistische Signifikanz.
4. Diskussion
In Krebszellen kommt es in der Regel zu abnormen Stoffwechselvorgängen, weshalb die gezielte Beeinflussung des Stoffwechsels eine neue Strategie zur Behandlung von Tumoren, einschließlich Bauchspeicheldrüsenkrebs, darstellt [31,32,33]. Die Heterogenität von Tumoren kann dazu führen, dass bösartige Zellen einen unterschiedlichen Stoffwechselphänotyp aufweisen und folglich unterschiedlich empfindlich auf Stoffwechselmedikamente reagieren, wie im Fall von Gemcitabin, gegen das die meisten Patienten mit Bauchspeicheldrüsenkrebs eine Resistenz entwickeln [17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34].
In der vorliegenden Studie haben wir die Wirksamkeit des Stoffwechselmedikaments DCA in 2D- und 3D-Kulturen von zwei verschiedenen, gut charakterisierten Bauchspeicheldrüsenkrebs-Zelllinien (PANC-1 und BXPC-3) sowie in einem Xenotransplantationsmodell für Bauchspeicheldrüsenkrebs getestet. Beide Zelllinien, die in Monolayern gezüchtet wurden, zeigten eine ausgeprägte Empfindlichkeit gegenüber DCA in der höchsten getesteten Konzentration (d. h. 10 mM), die die Zellproliferation stoppte und ihre Migrationsfähigkeit stark beeinträchtigte. Beim Testen des Medikaments in einer niedrigeren Konzentration (d. h. 4 mM DCA) zeigte sich eine höhere Empfindlichkeit der PANC-1-Zelllinie. Diese Beobachtung ist von Interesse, da PANC-1 als aggressive und chemoresistente Zelllinie bekannt ist [21,22,35].
Die Analyse der Lebensfähigkeitsparameter in beiden DCA-behandelten PDAC-Zelllinien ergab einen begrenzten Prozentsatz apoptotischer/nekrotischer Zellen, was eher auf eine zytostatische als auf eine zytotoxische Wirkung des Medikaments hindeutet und frühere Berichte bestätigt [36,37].
Eine Hauptwirkung von DCA wird im Allgemeinen auf seine Fähigkeit zurückgeführt, eine Umstellung des Stoffwechsels von der Glykolyse auf die mitochondriale Glukoseoxidation zu bewirken. Dies wird durch die Hemmung der PDH-Kinase PDK erreicht, wodurch die PDH in ihren aktiveren, nicht phosphorylierten Zustand versetzt wird [38,39]. Folglich wird Pyruvat in Acetyl-CoA umgewandelt, das in den Tricarbonsäurezyklus eintritt und die mitochondriale oxidative Phosphorylierung antreibt.
In dieser Studie stellten wir jedoch fest, dass trotz einer erheblichen DCA-induzierten Dephosphorylierung von PDH keine Aktivierung der mitochondrialen Atmungsaktivität in den beiden medikamentös behandelten PDAC-Zelllinien beobachtet wurde. Im Gegenteil, DCA verursachte eine dosisabhängige Verringerung des mitochondrialen OxPhos, die mit einer Hemmung der glykolytischen Kapazität in BXPC-3 verbunden war.
Dieses Ergebnis war auch etwas überraschend, wenn man bedenkt, dass wir in einer früheren Studie mit oralen Krebszelllinien gezeigt haben, dass PE15-Zellen, die sich durch ein anhaltendes OxPhos auszeichnen, gegen die DCA-Behandlung resistent waren, während HSC2/3-Zellen, die ein glykolytisches Profil aufweisen, medikamentenempfindlicher zu sein schienen, mit einer deutlichen Auswirkung auch auf die mitochondrialen morpho-funktionellen Parameter [7]. Darüber hinaus haben wir in einer anderen Studie mit PANC-1- und BXPC-3-Zelllinien eine unterschiedliche Empfindlichkeit gegenüber Glukose-Entzug/Galaktose-Substitution gezeigt, eine Bedingung, die auch den oxidativen Stoffwechsel fördert, wobei die stärker glykolytischen BXPC-3-Zellen anfälliger waren [6]. Dies veranlasste uns zu der Hypothese, dass die unterschiedliche Empfindlichkeit der verschiedenen Zelllinien gegenüber Medikamenten oder Bedingungen, die eine pro-oxidative Stoffwechselverschiebung fördern, von ihrem grundlegenden Stoffwechselprofil abhängt, wobei die Zellen, die mehr auf Glykolyse angewiesen sind und/oder eine geringe Atmungskapazität aufweisen, anfälliger sind.
Die dämpfende Wirkung von DCA auf die mitochondriale Atmung führte offenbar nicht zu Veränderungen der mitochondrialen Morphologie, obwohl in DCA-behandelten BXPC-3-Zellen eine signifikante Verringerung des die Spaltung fördernden Faktors Drp1 beobachtet wurde. Wahrscheinlich verbirgt sich der basale fragmentierte Phänotyp des mitochondrialen Netzwerks in BXPC-3, um eine weitere mitochondriale Fragmentierung zu erkennen. Die mtDNA-Kopienzahl/Zelle war jedoch in beiden PDAC-Zelllinien signifikant erhöht, was wahrscheinlich auf einen kompensatorischen Mechanismus als Folge der mitochondrialen Dysfunktion zurückzuführen ist, der zur Aktivierung der Mitophagie führt, wie die erhöhte gespaltene Form von LC3B-II zeigt. Die beobachtete verstärkte Produktion von ROS in DCA-behandelten PDAC-Zelllinien könnte die organelle Qualitätskontrolle auslösen, um geschädigte Mitochondrien zu entfernen. Ein Ungleichgewicht der ROS-Homöostase wird häufig mit einer Störung der mitochondrialen Atmungskette in Verbindung gebracht, obwohl der Zusammenhang oft nicht klar ist (d. h. Ursache, Wirkung, Teufelskreis). Im Allgemeinen wurde die Mitophagie als überlebensfördernder Mechanismus angesehen, der die Zellen unter Stressbedingungen schützt (onkogene Funktion) [40]. In jüngerer Zeit wurde jedoch nachgewiesen, dass eine Dysregulation der Mitophagie zur Arzneimittelresistenz beiträgt (tumorsuppressive Funktion) [41]. Wie auch immer, die Induktion und Hemmung der Mitophagie bei der Krebsentstehung ist immer noch umstritten.
Alles in allem erlauben uns die oben genannten Beobachtungen nicht, die zytostatische Wirkung von DCA einfach mit einer metabolischen Umstellung der PDAC-Zellen zu erklären. Es muss berücksichtigt werden, dass DCA neben PDK auch auf andere zelluläre Signalwege wirken kann. In der Tat wurde berichtet, dass DCA den CoA-Biosyntheseweg beeinflusst [42], den AMPK-Signalweg aktiviert [43], mit Acetat antagonisiert [44] und den Tyrosinkatabolismus stört [45]. Darüber hinaus ergab ein Vergleich der Metabolitenprofile in Zellen, die mit DCA oder selektiveren neuen PDK-Inhibitoren behandelt wurden, unterschiedliche Ergebnisse [46]. Dies veranlasste uns, weitere potenzielle Off-Target-Effekte von DCA zu untersuchen, um seine Wirksamkeit bei der Bekämpfung von Tumorzellen zu erklären.
Krebsstammzellen (CSCs) machen einen Teil der gesamten Tumormasse aus und sind für die Therapieresistenz, die Metastasierung und das Wiederauftreten des Tumors verantwortlich [47]. Sie gewinnen daher zunehmend an Interesse als Zielstrukturen für die Entwicklung neuer Krebstherapien [48]. Soweit wir wissen, gibt es keinen Bericht über die Wirkung von DCA auf Stammzellen von Bauchspeicheldrüsenkrebs. Um diesen faszinierenden Aspekt zu untersuchen, haben wir zunächst die Wirkung der DCA-Behandlung auf die Lin28-Expression untersucht und dabei eine signifikante dosisabhängige Herabregulierung in beiden Zelllinien festgestellt. Die Expression von Lin28 ist eng mit dem Stoffwechsel verbunden, da es in der Lage ist, das Fortschreiten von Krebszellen über PDK1 zu regulieren und einen energetischen Wechsel zu bewirken [49]. Lin28 ist an der Bildung von CSCs beteiligt [50], und seine abweichende Expression wird mit vielen menschlichen neoplastischen Erkrankungen in Verbindung gebracht, darunter auch Bauchspeicheldrüsenkrebs [51,52]. Die FACS-Analyse der Expression der Oberflächenantigene CD44, CD24 und EPCAM, die typischerweise für CSCs in der Bauchspeicheldrüse charakteristisch sind [53], ergab, dass die DCA-Behandlung den Anteil der dreifach positiven Fraktion in PANC-1 reduzierte. Im Gegensatz dazu konnten wir bei BXPC-3, die hauptsächlich aus dreifach positiven Zellen bestanden, keine DCA-induzierte Modulation feststellen. Dabei ist zu berücksichtigen, dass, obwohl mehr als 90 % der BXPC-3 positiv für Stammzellmarker waren, ihr Expressionsniveau relativ niedrig war. Umgekehrt exprimierte PANC-1 mehr Stammzellmarker, wenn auch nur in weniger als 30 % der Zellpopulation, was auf einen jüngeren CSC-Phänotyp hinweist, der diese Zelluntergruppe charakterisiert. Diese Beobachtung deckt sich mit der Vorstellung, dass nicht die absolute Expression der CSC-Marker, sondern ihr Verhältnis die Stammzelleneigenschaft von Krebszellen „qualifiziert“ [28]. In Anbetracht der Tatsache, dass das CD44/CD24-Expressionsverhältnis in PANC-1 viel höher ist als in BXPC-3, würde dies darauf hindeuten, dass das CSC-Kompartiment in PANC-1, obwohl es weniger besiedelt ist, qualitativ eher stammzellähnlich ist. Umgekehrt würde das niedrige Expressionsniveau der CSC-Marker, die in der BXPC-3-Zellpopulation weit verbreitet sind, diese als frühe Vorläuferzellen phänotypisieren. Dieser Unterschied zwischen den beiden Bauchspeicheldrüsenkrebs-Zelllinien könnte der Grund für ihre unterschiedlichen Stoffwechselphänotypen und ihre Empfindlichkeit gegenüber Chemotherapeutika sowie gegenüber DCA sein.
Die dreidimensionale (3D) Zellkulturtechnologie ist zu einem Schwerpunkt der Forschung in der Tumorzellbiologie geworden. Im Vergleich zu 2D-Zelllinien sind 3D-Kulturen mit CSCs angereichert [30,54] und ermöglichen durch die Nachahmung der metabolischen und proliferativen Gradienten von In-vivo-Tumoren eine zuverlässigere Vorhersage der Reaktion auf eine mögliche Behandlung [55,56]. Vor diesem Hintergrund haben wir die Wirksamkeit von DCA auf 3D-Kulturen von PANC-1 und BXPC-3 getestet und gezeigt, dass eine DCA-Behandlung die Struktur und Lebensfähigkeit der bereits gebildeten Sphäroide beeinträchtigt und die Sphäroidbildung beider Zelllinien beeinträchtigt. Insbesondere konnte DCA in der höheren Dosis die Sphäroidbildung von PANC-1 fast vollständig hemmen. In Übereinstimmung mit unseren Beobachtungen in 2D-Kulturen reagierten die BXPC-3-Sphäroide weniger empfindlich auf die DCA-Behandlung als die PANC-1-Sphäroide. Ebenso wurde in 2D-Kulturen eine signifikante Herabregulierung von Lin28 in Sphäroiden aus beiden Zelllinien beobachtet. Obwohl die oben berichteten Veränderungen in der Expression allgemein anerkannter CSC-Marker sowohl in 2D- als auch in 3D-Kulturen keinen schlüssigen Beweis für die Wirkung von DCA auf das Stammzellkompartiment von PDAC darstellen, liefern sie doch bisher nicht beachtete Hinweise, die weitere Untersuchungen verdienen. In vivo bewirkte die DCA-Behandlung ein langsameres, wenn auch nicht signifikantes Krebswachstum bei BxPC-3-luc-Tumormäusen im Vergleich zu Kontrollmäusen, was sich in einer geringeren Photonenzählung und einem geringeren Tumorvolumen zeigte.
Um die rätselhaften Wirkungen von DCA auf die PDAC-Zelllinien zu erklären, die in unserer Studie berichtet wurden, schlagen wir die folgende hypothetische Abfolge von Ereignissen vor, die zu weiteren Untersuchungen anregen soll (Abbildung 10). Wir vermuten, dass infolge einer verstärkten Oxidation von Pyruvat mehr reduzierende Äquivalente auf die mitochondriale Atmungskette übertragen werden, was zur Bildung von ROS führt. Die Atmungskomplexe sind sowohl Produzenten als auch Ziel von ROS [57], wodurch ein Teufelskreis entsteht, der zu einer fortschreitenden Hemmung des funktionellen Elektronentransfers in der gesamten Atmungskette führt und eine weitere ROS-bedingte Umleitung von Elektronen zuO2 fördert. Darüber hinaus kann die Dämpfung der Atmungsaktivität zu einer Akkumulation von Zwischenprodukten des Tricarbonsäurezyklus sowie von Acetyl-CoA führen. Die Anhäufung von Acetyl-CoA führt bekanntermaßen zur Lysin-Acetylierung und zur Hemmung der Funktion einer Reihe von mitochondrialen Proteinen, einschließlich der Komplexe der Atmungskette [58,59]. Der daraus resultierenden fortschreitenden mitochondrialen Schädigung/Dysfunktion wird durch eine Hochregulierung der Mitophagie entgegengewirkt. Wie und ob diese DCA-vermittelten mitochondrialen Veränderungen zu einem Wachstumsstopp und einer Neuverdrahtung des Zellphänotyps, insbesondere des Krebsstammzellkompartiments, führen, ist noch nicht geklärt. Eine Reihe von Berichten deutet jedoch darauf hin, dass ein pro-oxidativer Zustand dazu führt, dass die Stammzellen ihren undifferenzierten Zustand verlassen und eine Bindung induzieren/begünstigen [60,61]. Darüber hinaus regulieren epigenetische Modifikationen, wie z. B. solche, die eine Umgestaltung des Chromatins bewirken, das Gleichgewicht zwischen Pluripotenz und Differenzierung von Stammzellen [62,63]. Möglicherweise führt der gestoppte TCA-Zyklus zu einem Ausfluss von Citrat in das Zytosol, wo es Acetyl-CoA freisetzt und damit dessen Verfügbarkeit für die Histon-Acetylierung erhöht. Offensichtlich können auch andere, noch nicht charakterisierte DCA-Ziele zu den beobachteten Wirkungen beitragen oder diese sogar dominieren.
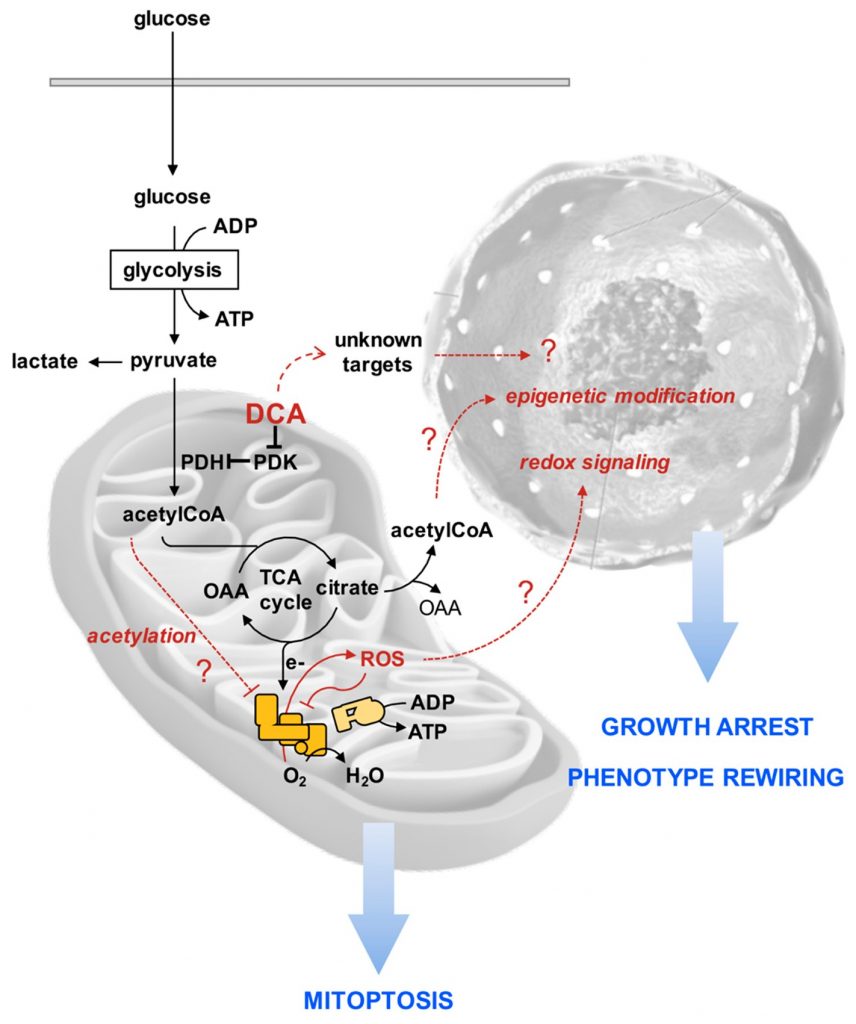
Zusammenfassend zeigen unsere Ergebnisse deutlich, dass die Wirksamkeit von DCA bei der Hemmung des Krebszellwachstums nicht immer in kausalem Zusammenhang mit seiner nachgewiesenen stimulierenden Wirkung auf die PDH-Aktivität und folglich dem umgekehrten Warburg-Effekt steht. Je nach dem Phänotyp der Zelle müssen auch andere Off-Targets in Betracht gezogen werden. In diesem Zusammenhang ist der in dieser Studie erbrachte Nachweis, dass das CSC-Kompartiment in PDAC-Zelllinien durch DCA-Behandlung beeinflusst werden könnte, von Bedeutung. Es wäre interessant zu überprüfen, ob dies auch bei anderen Krebszelltypen der Fall ist, und in unserem Labor wird in dieser Richtung gearbeitet. Jüngste Forschungsprojekte zur Entwicklung von oberflächenfunktionalisierten, mit Dichloracetat beladenen Nanopartikeln [64] und multifunktionalen Arzneimitteln, die aus chemotherapeutischen Wirkstoffen mit DCA als Ligand gewonnen werden [65 ], könnten dazu beitragen, die richtige gezielte pharmakologische Formulierung für die Entwicklung neuer wirksamer therapeutischer Strategien zur Bekämpfung von Bauchspeicheldrüsenkrebs und anderen Krebsarten zu entwerfen.
Ergänzende Materialien
Das folgende Material ist online verfügbar unter https://www.mdpi.com/2073-4409/8/5/478/s1: Abbildung S1: Wirkung von DCA auf die Zellproliferation, gemessen mit XCELLigence in einem Medium mit niedrigem Glukosegehalt; Abbildung S2: Kratzheilung; Abbildung S3: Wirkung von DCA auf die Laktatproduktion; Abbildung S4: Wirkung einer 24-stündigen DCA-Behandlung auf die Stoffwechselflüsse; Abbildung S5: Vergleichende Wirkung von DCA auf die Stoffwechselflüsse in PDAC-Zelllinien unter den Bedingungen einer Kultivierung mit niedriger Glukose (LG) und hoher Glukose (HG); Abbildung S6: Proteinexpression von Faktoren, die an der Mitochondrien-Fusions-Spaltung beteiligt sind (OPA1, MFN1/2); Abbildung S7: Bewertung der Stammzellen in PDAC-Zelllinien.
Beiträge der Autoren
T.T. Planung, Untersuchung und Schreiben; F.A., C.P. (Consiglia Pacelli) und C.M. Untersuchung; V.R. und I.L. Datenkuratierung; G.D.S. Visualisierung; C.P. (Concetta Panebianco) und V.P. Tiermodell; N.C. Durchsicht und Redaktion und C.P. (Claudia Piccoli) Konzeption, Überwachung.
Finanzierung
Diese Forschung wurde durch laufende Forschungsmittel des italienischen Gesundheitsministeriums für das IRCCS CROB und durch Zuschüsse des italienischen Gesundheitsministeriums durch die Abteilung für Gastroenterologie (RC1703GA31 und RC1803GA30) des IRCCS „Casa Sollievo della Sofferenza“ Krankenhauses finanziert.
Interessenkonflikte
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
REFERENZEN
1 Ying, H.; Dey, P.; Yao, W.; Kimmelman, A.C.; Draetta, G.F.; Maitra, A.; DePinho, R.A. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2016, 30, 355-385. [CrossRef]2 Hidalgo, M. Pancreatic cancer. N. Engl. J. Med. 2010, 362, 1605-1617. [CrossRef] [PubMed]
3 Camelo, F.; Le, A. The Intricate Metabolism of Pancreatic Cancers. Adv. Exp. Med. Biol. 2018, 1063, 73-81. [PubMed]
4 Adamska, A.; Domenichini, A.; Falasca, M. Pancreatic Ductal Adenocarcinoma: Current and Evolving Therapies. Int. J. Mol. Sci. 2017, 18, E1338. [CrossRef] [PubMed]
5 Gentric, G.; Mieulet, V.; Mechta-Grigoriou, F. Heterogeneity in Cancer Metabolism: New Concepts in an Old Field. Antioxid. Redox Signal. 2017, 26, 462-485. [CrossRef]
6 Tataranni, T.; Agriesti, F.; Ruggieri, V.; Mazzoccoli, C.; Simeon, V.; Laurenzana, I.; Scrima, R.; Pazienza, V.; Capitanio, N.; Piccoli, C. Rewiring carbohydrate catabolism differentially affects survival of pancreatic cancer cell lines with diverse metabolic profiles. Oncotarget 2017, 8, 41265-41281. [CrossRef]
7 Ruggieri, V.; Agriesti, F.; Scrima, R.; Laurenzana, I.; Perrone, D.; Tataranni, T.; Mazzoccoli, C.; Lo Muzio, L.; Capitanio, N.; Piccoli, C. Dichloroacetate, a selective mitochondria-targeting drug for oral squamous cell carcinoma: A metabolic perspective of treatment. Oncotarget 2015, 6, 1217-1230. [CrossRef]
8 Anderson, K.M.; Jajeh, J.; Guinan, P.; Rubenstein, M. In vitro effects of dichloroacetate and CO2 on hypoxic HeLa cells. Anticancer Res. 2009, 29, 4579-4588.
9 Chen, Y.; Cairns, R.; Papandreou, I.; Koong, A.; Denko, N.C. Oxygen consumption can regulate the growth of tumors, a new perspective on the Warburg effect. PLoS ONE 2009, 4, e7033. [CrossRef]
10 Lu, X.; Zhou, D.; Hou, B.; Liu, Q.X.; Chen, Q.; Deng, X.F.; Yu, Z.B.; Dai, J.G.; Zheng, H. Dichloracetat verstärkt die Antitumor-Wirksamkeit von Chemotherapeutika durch Hemmung der Autophagie bei nicht-kleinzelligem Lungenkrebs. Cancer Manag. Res. 2018, 10, 1231-1241. [CrossRef]
11 Yang, C.; Wu, T.; Qin, Y.; Qi, Y.; Sun, Y.; Kong, M.; Jiang, X.; Qin, X.; Shen, Y.; Zhang, Z. A facile doxorubicin-dichloroacetate conjugate nanomedicine with high drug loading for safe drug delivery. Int. J. Nanomed. 2018, 13, 1281-1293. [CrossRef]
12 Rajeshkumar, N.V.; Yabuuchi, S.; Pai, S.G.; De Oliveira, E.; Kamphorst, J.J.; Rabinowitz, J.D.; Tejero, H.; Al-Shahrour, F.; Hidalgo, M.; Maitra, A.; et al. Treatment of Pancreatic Cancer Patient-Derived Xenograft Panel with Metabolic Inhibitors Reveals Efficacy of Phenformin. Clin. Cancer Res. 2017, 23, 5639-5647. [CrossRef]
13 Khan, A.; Marier, D.; Marsden, E.; Andrews, D.; Eliaz, I. A novel form of dichloroacetate therapy for patients with advanced cancer: Ein Bericht über 3 Fälle. Altern. Ther. Health Med. 2014, 20 (Suppl. 2), 21-28.
14 Hanberry, B.S.; Berger, R.; Zastre, J.A. High-dose vitamin B1 reduces proliferation in cancer cell lines analog to dichloroacetate. Cancer Chemother. Pharm. 2014, 73, 585-594. [CrossRef]
15 Lowe, A.W.; Olsen, M.; Hao, Y.; Lee, S.P.; Taek Lee, K.; Chen, X.; van de Rijn, M.; Brown, P.O. Gene expression patterns in pancreatic tumors, cells and tissues. PLoS ONE 2007, 2, e323. [CrossRef]
16 Deer, E.L.; González-Hernández, J.; Coursen, J.D.; Shea, J.E.; Ngatia, J.; Scaife, C.L.; Firpo, M.A.; Mulvihill, S.J. Phenotype and genotype of pancreatic cancer cell lines. Pankreas 2010, 39, 425-435. [CrossRef]
17 Daemen, A.; Peterson, D.; Sahu, N.; McCord, R.; Du, X.; Liu, B.; Kowanetz, K.; Hong, R.; Moffat, J.; Gao, M.; et al. Metabolite profiling stratifies pancreatic ductal adenocarcinomas into subtypes with distinct sensitivities to metabolic inhibitors. Proc. Natl. Acad. Sci. USA 2015, 112, E4410-E4417. [CrossRef]
18 Mazzoccoli, C.; Ruggieri, V.; Tataranni, T.; Agriesti, F.; Laurenzana, I.; Fratello, A.; Capitanio, N.; Piccoli, C. N-Acetylaspartat (NAA) induziert die neuronale Differenzierung der SH-SY5Y Neuroblastom-Zelllinie und sensibilisiert sie für Chemotherapeutika. Oncotarget 2016, 7, 26235-26246. [CrossRef]
19 Scrima, R.; Menga, M.; Pacelli, C.; Agriesti, F.; Cela, O.; Piccoli, C.; Cotoia, A.; De Gregorio, A.; Gefter, J.V.; Cinnella, G.; et al. Para-hydroxyphenylpyruvate inhibits the pro-inflammatory stimulation of macrophage preventing LPS-mediated nitro-oxidative unbalance and immunometabolic shift. PLoS ONE 2017, 12, e0188683. [CrossRef]
20 Fredebohm, J.; Boettcher, M.; Eisen, C.; Gaida, M.M.; Heller, A.; Keleg, S.; Tost, J.; Greulich-Bode, K.M.; Hotz-Wagenblatt, A.; Lathrop, M.; et al. Establishment and characterization of a highly tumourigenic and cancer stem cell enriched pancreatic cancer cell line as a well defined model system. PLoS ONE 2012, 7, e48503. [CrossRef]
21 Fryer, R.A.; Barlett, B.; Galustian, C.; Dalgleish, A.G. Mechanisms underlying gemcitabine resistance in pancreatic cancer and sensitisation by the iMiD™ lenalidomide. Anticancer Res. 2011, 31, 3747-3756.
22 Yin, T.; Wei, H.; Gou, S.; Shi, P.; Yang, Z.; Zhao, G.; Wang, C. Cancer stem-like cells enriched in Panc-1 spheres possess increased migration ability and resistance to gemcitabine. Int. J. Mol. Sci. 2011, 12, 1595-23
Jun-Hao, E.T.; Gupta, R.R.; Shyh-Chang, N. Lin28 and let-7 in the Metabolic Physiology of Aging. Trends Endocrinol. Metab. 2016, 27, 132-141. [CrossRef] [PubMed]
24 Zhang, J.; Ratanasirintrawoot, S.; Chandrasekaran, S.; Wu, Z.; Ficarro, S.B.; Yu, C.; Ross, C.A.; Cacchiarelli, D.; Xia, Q.; Seligson, M.; et al. LIN28 Regulates Stem Cell Metabolism and Conversion to Primed Pluripotency. Cell Stem Cell 2016, 19, 66-80. [CrossRef] [PubMed]
25 Wang, X.; Weng, M.; Jin, Y.; Yang, W.; Wu, D.; Wang, T.; Li, X. Beyond an oncogene, Lin28 is a master regulator of cancer progression. Histol. Histopathol. 2018, 33, 327-334. [PubMed]
26 Li, C.; Heidt, D.G.; Dalerba, P.; Burant, C.F.; Zhang, L.; Adsay, V.; Wicha, M.; Clarke, M.F.; Simeone, D.M. Identification of pancreatic cancer stem cells. Cancer Res. 2007, 67, 1030-1037. [CrossRef]
27 Ohara, Y.; Oda, T.; Sugano, M.; Hashimoto, S.; Enomoto, T.; Yamada, K.; Akashi, Y.; Miyamoto, R.; Kobayashi, A.; Fukunaga, K.; et al. Histological and prognostic importance of CD44(+)/CD24(+)/EpCAM(+) expression in clinical pancreatic cancer. Cancer Sci. 2013, 104, 1127-1134. [CrossRef]
28 Li, W.; Ma, H.; Zhang, J.; Zhu, L.; Wang, C.; Yang, Y. Author Correction: Unraveling the roles of CD44/CD24 and ALDH1 as cancer stem cell markers in tumorigenesis and metastasis. Sci. Rep. 2018, 8, 4276. [CrossRef] [PubMed]
29 Melissaridou, S.; Wiechec, E.; Magan, M.; Jain, M.V.; Chung, M.K.; Farnebo, L.; Roberg, K. The effect of 2D and 3D cell cultures on treatment response, EMT profile and stem cell features in head and neck cancer. Cancer Cell Int. 2019, 19, 16. [CrossRef] [PubMed]
30 Ishiguro, T.; Ohata, H.; Sato, A.; Yamawaki, K.; Enomoto, T.; Okamoto, K. Tumor-derived spheroids: Relevanz für Krebsstammzellen und klinische Anwendungen. Cancer Sci. 2017, 108, 283-289. [CrossRef]
31 Luo, J.; Solimini, N.L.; Elledge, S.J. Principles of cancer therapy: Onkogene und nicht-onkogene Abhängigkeit. Cell 2009, 136, 823-837. [CrossRef]
32 Vivanco, I. Targeting molecular addictions in cancer. Br. J. Cancer 2014, 111, 2033-2038. [CrossRef]
33 Belizário, J.E.; Sangiuliano, B.A.; Perez-Sosa, M.; Neyra, J.M.; Moreira, D.F. Using Pharmacogenomic Databases for Discovering Patient-Target Genes and Small Molecule Candidates to Cancer Therapy. Front. Pharmacol. 2016, 7, 312. [CrossRef]
34 Grasso, C.; Jansen, G.; Giovannetti, E. Drug resistance in pancreatic cancer:Impact of altered energy metabolism. Crit. Rev. Oncol. Hematol. 2017, 114, 139-152. [CrossRef]
35 Huanwen, W.; Zhiyong, L.; Xiaohua, S.; Xinyu, R.; Kai, W.; Tonghua, L. Intrinsic chemoresistance to gemcitabine is associated with constitutive and laminin-induced phosphorylation of FAK in pancreatic cancer cell lines. Mol. Cancer 2009, 8, 125. [CrossRef]
36 Fedorchuk, A.G.; Pyaskovskaya, O.N.; Gorbik, G.V.; Prokhorova, I.V.; Kolesnik, D.L.; Solyanik, G.I. Effectiveness of sodium dichloroacetate against glioma C6 depends on administration schedule and dosage. Exp. Oncol. 2016, 38, 80-83. [CrossRef]
37 Ma, W.; Zhao, X.; Wang, K.; Liu, J.; Huang, G. Dichloressigsäure (DCA) synergiert mit dem SIRT2-Inhibitor Sirtinol und AGK2, um die Anti-Tumor-Wirksamkeit bei nicht-kleinzelligem Lungenkrebs zu erhöhen. Cancer Biol. Ther. 2018, 19, 835-846. [CrossRef]
38 Michelakis, E.D.; Sutendra, G.; Dromparis, P.; Webster, L.; Haromy, A.; Niven, E.; Maguire, C.; Gammer, T.L.; Mackey, J.R.; Fulton, D.; et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci. Transl. Med. 2010, 2, 31ra34. [CrossRef]
39 Papandreou, I.; Goliasova, T.; Denko, N.C. Anticancer drugs that target metabolism: Is dichloroacetate the new paradigm? Int. J. Cancer 2011, 128, 1001-1008. [CrossRef]
40 Yan, C.; Li, T.S. Dual Role of Mitophagy in Cancer Drug Resistance. Anticancer Res. 2018, 38, 617-621.
41 Praharaj, P.P.; Naik, P.P.; Panigrahi, D.P.; Bhol, C.S.; Mahapatra, K.K.; Patra, S.; Sethi, G.; Bhutia, S.K. Intricate role of mitochondrial lipid in mitophagy and mitochondrial apoptosis: Its implication in cancer therapeutics. Cell Mol. Life Sci. 2018. [CrossRef]
42 Dubuis, S.; Ortmayr, K.; Zampieri, M. A framework for large-scale metabolome drug profiling links coenzyme A metabolism to the toxicity of anti-cancer drug dichloroacetate. Commun. Biol. 2018, 1, 101. [CrossRef]
43 Li, X.; Liu, J.; Hu, H.; Lu, S.; Lu, Q.; Quan, N.; Rousselle, T.; Patel, M.S.; Li, J. Dichloroacetate Ameliorates Cardiac Dysfunction Caused by Ischemic Insults Through AMPK Signal Pathway-Not Only Shifts Metabolism. Toxicol. Sci. 2019, 167, 604-617. [CrossRef]
44 El Sayed, S.M.; Baghdadi, H.; Ahmed, N.S.; Almaramhy, H.H.; Mahmoud, A.A.; El-Sawy, S.A.; Ayat, M.; Elshazley, M.; Abdel-Aziz, W.; Abdel-Latif, H.M.; et al. Dichloroacetate is an antimetabolite that antagonizes acetate and deprived cancer cells from its benefits: Eine neue evidenzbasierte medizinische Hypothese. Med. Hypotheses 2019, 122, 206-209. [CrossRef] [PubMed]
45 Guo, X.; Dixit, V.; Liu, H.; Shroads, A.L.; Henderson, G.N.; James, M.O.; Stacpoole, P.W. Inhibition and recovery of rat hepatic glutathione S-transferase zeta and alteration of tyrosine metabolism following dichloroacetate exposure and withdrawal. Drug Metab. Dispos. 2006, 34, 36-42. [CrossRef]
46 Zhang, W.; Hu, X.; Zhou, W.; Tam, K.Y. Liquid Chromatography-Tandem Mass Spectrometry Method Revealed that Lung Cancer Cells Exhibited Distinct Metabolite Profiles upon the Treatment with Different Pyruvate Dehydrogenase Kinase Inhibitors. J. Proteome Res. 2018, 17, 3012-3021. [CrossRef]
47 Prasetyanti, P.R.; Medema, J.P. Intra-tumor heterogeneity from a cancer stem cell perspective. Mol. Cancer 2017, 16, 41. [CrossRef] [PubMed]
48 Chen, L.S.; Wang, A.X.; Dong, B.; Pu, K.F.; Yuan, L.H.; Zhu, Y.M. A new prospect in cancer therapy: Bekämpfung von Krebsstammzellen zur Ausrottung von Krebs. Chin. J. Cancer 2012, 31, 564-572. [CrossRef]
49 Ma, X.; Li, C.; Sun, L.; Huang, D.; Li, T.; He, X.; Wu, G.; Yang, Z.; Zhong, X.; Song, L.; et al. Lin28/let-7 axis regulates aerobic glycolysis and cancer progression via PDK1. Nat. Commun. 2014, 5, 5212. [CrossRef]
50 Zhou, J.; Ng, S.B.; Chng, W.J. LIN28/LIN28B: An emerging oncogenic driver in cancer stem cells. Int. J. Biochem. Cell Biol. 2013, 45, 973-978. [CrossRef] [PubMed]
51 Wang, Y.; Li, J.; Guo, S.; Ouyang, Y.; Yin, L.; Liu, S.; Zhao, Z.; Yang, J.; Huang, W.; Qin, H.; et al. Lin28B facilitates the progression and metastasis of pancreatic ductal adenocarcinoma. Oncotarget 2017, 8, 60414-60428. [CrossRef] [PubMed]
52 Balzeau, J.; Menezes, M.R.; Cao, S.; Hagan, J.P. The LIN28/let-7 Pathway in Cancer. Front. Genet. 2017, 8, 31. [CrossRef] [PubMed]
53 Ishiwata, T.; Matsuda, Y.; Yoshimura, H.; Sasaki, N.; Ishiwata, S.; Ishikawa, N.; Takubo, K.; Arai, T.; Aida, J. Pancreatic cancer stem cells: Merkmale und Nachweisverfahren. Pathol. Oncol. Res. 2018, 24, 797-805. [CrossRef]
54 Ravi, M.; Ramesh, A.; Pattabhi, A. Contributions of 3D Cell Cultures for Cancer Research. J. Cell Physiol. 2017, 232, 2679-2697. [CrossRef]
55 Friedrich, J.; Seidel, C.; Ebner, R.; Kunz-Schughart, L.A. Spheroid-based drug screen: Überlegungen und praktischer Ansatz. Nat. Protoc. 2009, 4, 309-324. [CrossRef]
56 Gutierrez-Barrera, A.M.; Menter, D.G.; Abruzzese, J.L.; Reddy, S.A. Etablierung von dreidimensionalen Kulturen menschlicher Pankreasgang-Epithelzellen. Biochem. Biophys. Res. Commun. 2007, 358, 698-703. [CrossRef]
57 Dröse, S.; Brandt, U.; Wittig, I. Mitochondrial respiratory chain complexes as sources and targets of thiol-based redox-regulation. Biochim. Biophys. Acta 2014, 1844, 1344-1354. [CrossRef]
58 Carrico, C.; Meyer, J.G.; He, W.; Gibson, B.W.; Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metab. 2018, 27, 497-512. [CrossRef]
59Cela, O.; Scrima, R.; Pazienza, V.; Merla, G.; Benegiamo, G.; Augello, B.; Fugetto, S.; Menga, M.; Rubino, R.; Fuhr, L.; et al. Clock genes-dependent acetylation of complex I sets rhythmic activity of mitochondrial OxPhos. Biochim. Biophys. Acta 2016, 1863, 596-606. [CrossRef]
60 Chaudhari, P.; Ye, Z.; Jang, Y.Y. Roles of reactive oxygen species in the fate of stem cells. Antioxid. Redox Signal. 2014, 20, 1881-1890. [CrossRef]
61 Ding, S.; Li, C.; Cheng, N.; Cui, X.; Xu, X.; Zhou, G. Redox Regulation in Cancer Stem Cells. Oxid. Med. Zelle. Longev. 2015. [CrossRef] [PubMed]
62 Trisciuoglio, D.; Di Martile, M.; Del Bufalo, D. Emerging Role of Histone Acetyltransferase in Stem Cells and Cancer. Stem Cells Int. 2018, 2018, 8908751. [CrossRef]
63 Yadav, T.; Quivy, J.P.; Almouzni, G. Chromatin plasticity: Eine vielseitige Landschaft, die dem Zellschicksal und der Identität zugrunde liegt. Science 2018, 361, 1332-1336. [CrossRef]
64 Abánades Lázaro, I.; Haddad, S.; Rodrigo-Muñoz, J.M.; Orellana-Tavra, C.; Del Pozo, V.; Fairen-Jimenez, D.; Forgan, R.S. Mechanistic Investigation into the Selective Anticancer Cytotoxicity and Immune System Response of Surface-Functionalized, Dichloroacetate-Loaded, UiO-66 Nanoparticles. ACS Appl. Mater Interfaces 2018, 10, 5255-5268. [CrossRef] [PubMed]
65 Petruzzella, E.; Sirota, R.; Solazzo, I.; Gandin, V.; Gibson, D. Triple action Pt(iv) derivatives of cisplatin: A new class of potent anticancer agents that overcome resistance. Chem. Sci. 2018, 9, 4299-4307. [CrossRef]
Verwandte Inhalte: